É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Incubação do medo usando um protocolo estendido de condicionamento do medo para ratos
Neste Artigo
Resumo
Descrevemos um protocolo estendido de condicionamento do medo que produz overtraining e incubação do medo em ratos. Este protocolo envolve uma única sessão de treinamento com pares de choque de tom de 25 tons (ou seja, overtraining) e uma comparação de respostas de congelamento condicionadas durante testes de contexto e sinalização 48 h (curto prazo) e 6 semanas (longo prazo) após o treinamento.
Resumo
A memória emocional tem sido estudada principalmente com paradigmas de condicionamento do medo. O condicionamento do medo é uma forma de aprendizado através da qual os indivíduos aprendem as relações entre eventos aversivos e estímulos neutros. Os procedimentos mais amplamente utilizados para estudar memórias emocionais implicam o condicionamento do medo em ratos. Nessas tarefas, o estímulo incondicionado (EUA) é um choque de pé apresentado uma ou várias vezes em sessões únicas ou várias, e a resposta condicionada (CR) está congelando. Em uma versão desses procedimentos, chamada de condicionamento do medo cued, um tom (estímulo condicionado, CS) é emparelhado com choques de pés (EUA) durante a fase de treinamento. Durante o primeiro teste, os animais são expostos ao mesmo contexto em que o treinamento ocorreu, e as respostas de congelamento são testadas na ausência de choques e tons de pés (ou seja, um teste de contexto). Durante o segundo teste, o congelamento é medido quando o contexto é alterado (por exemplo, manipulando o cheiro e as paredes da câmara experimental) e o tom é apresentado na ausência de choques de pé (ou seja, um teste de sinalização). A maioria dos procedimentos de condicionamento do medo cued implicam poucos pares de choque de tom (por exemplo, 1-3 ensaios em uma única sessão). Há um crescente interesse por versões menos comuns envolvendo um grande número de pares (ou seja, overtraining) relacionados ao efeito duradouro chamado incubação do medo (ou seja, as respostas ao medo aumentam ao longo do tempo sem maior exposição a eventos aversivos ou estímulos condicionados). Tarefas prolongadas de condicionamento do medo têm sido fundamentais para a compreensão dos aspectos comportamentais e neurobiológicos da incubação do medo, incluindo sua relação com outros fenômenos psicológicos (por exemplo, transtorno de estresse pós-traumático). Aqui, descrevemos um protocolo estendido de condicionamento do medo que produz overtraining e incubação do medo em ratos. Este protocolo envolve uma única sessão de treinamento com pares de choque de tom de 25 tons (ou seja, overtraining) e uma comparação de respostas de congelamento condicionadas durante testes de contexto e sinalização 48 h (curto prazo) e 6 semanas (longo prazo) após o treinamento.
Introdução
A memória é um processo psicológico que abrange diferentes fases: aquisição de informações, consolidação (permite a estabilidade das informações adquiridas) e recuperação (evidência para o processo de consolidação)1. Durante a fase de consolidação, ocorrem o estabelecimento de novas conexões sinápticas e a modificação das conexões pré-existentes. Isso sugere a necessidade de um período de tempo durante o qual ocorrem eventos moleculares e fisiológicos responsáveis por essas alterações1,,2. Essas alterações fisiológicas ou moleculares variam se os eventos recuperados são emocionalmente carregados ou não (ou seja, memória emocional). Por exemplo, pesquisas mostraram que o núcleo lateral e o complexo de amígdala basolateral são particularmente relevantes para a memória emocional3,,4,,5.
Fenômenos de memória emocional têm sido estudados principalmente com paradigmas de condicionamento do medo5,,6. O condicionamento do medo é uma forma de aprendizado através da qual os indivíduos aprendem as relações entre eventos aversivos e estímulos neutros7. Paradigmas de condicionamento do medo produzem mudanças moleculares, celulares e estruturais na amígdala. Além disso, o condicionamento do medo modifica a conectividade do hipocampo durante os processos de consolidação e recuperação da memória emocional.
Um dos procedimentos mais utilizados para estudar memórias de medo é o condicionamento clássico (pavloviano) em ratos. Este procedimento normalmente usa o footshock (EUA) como o estímulo aversivo, que é entregue uma ou várias vezes em uma ou várias sessões. A resposta condicionada (CR) dos ratos expostos a este procedimento é o congelamento (ou seja, "imobilidade generalizada causada por uma resposta tônica generalizada da musculatura esquelética dos animais, exceto os músculos utilizados na respiração"7 ). Essa resposta poderia ser avaliada em dois tipos de testes: testes de contexto e sinalização. Para o teste de contexto, o sujeito sofre um determinado número de choques durante a sessão de treinamento e, em seguida, é removido da câmara experimental por um tempo definido. Durante o teste, o sujeito é devolvido ao mesmo contexto em que o treinamento ocorreu e diferentes medidas de congelamento são coletadas na ausência de choques de pé (por exemplo, duração, percentual ou frequência de episódios de congelamento), e comparado com os níveis de base estabelecidos durante a fase de treinamento. Para o segundo tipo de teste, teste de sugestão, um estímulo (tipicamente um tom) é emparelhado com os choques dos pés durante a fase de treinamento (ou seja, estímulo condicional, CS). Após o treinamento ser concluído, o animal é removido do contexto de treinamento por um tempo definido e posteriormente é colocado em um contexto modificado (por exemplo, uma câmara experimental diferente que tem diferentes formas de paredes e cheiro diferente). A sugestão é então apresentada um determinado número de vezes, e as respostas de congelamento à sugestão são medidas e comparadas com os níveis de linha de base coletados durante o treinamento. A versão mais comum deste paradigma usa pares de 1 a 3 pares de choque de tom durante uma única sessão de treinamento, seguido de testes de contexto e sinalização realizados várias horas ou alguns dias depois.
Outros procedimentos de condicionamento de medo menos frequentemente implementados envolvem um grande número de pares de sinais de choque (ou seja, ensaios), que muitas vezes têm sido chamados de procedimentos de overtraining8. Um interesse crescente por essas tarefas está relacionado aos seus efeitos de memória duradouros e aumentados chamados incubação do medo (ou seja, as respostas de medo condicionadas aumentam ao longo do tempo na ausência de mais exposição a eventos aversivos ou estímulos condicionados)9,,10,11. Um exemplo desses procedimentos de overtraining envolve uma fase de treinamento de 100 pares de choque de tom distribuídos em 10 sessões, seguidos de testes de contexto e sinalização realizados 48h e 30 dias depois11,12. Para evitar treinamentos extensos espalhados por vários dias, Maren (1998) relatou que o overtraining poderia ser estabelecido e otimizado em uma única sessão com 25 pares8. O efeito de incubação é evidenciado em níveis significativamente mais elevados de medo condicionado em ratos testados 31 dias após o treinamento, em comparação com ratos testados 48 h depois. Tarefas prolongadas de condicionamento do medo têm sido fundamentais para a compreensão dos aspectos comportamentais e neurobiológicos subjacentes à incubação do medo, incluindo sua relação com outros fenômenos psicológicos (por exemplo, transtorno de estresse pós-traumático de início retardado)11,,12,13.
Aqui, descrevemos um protocolo estendido de condicionamento do medo que induz o overtraining e a incubação do medo em ratos. Diferente de outros paradigmas que requerem vários dias de treinamento11,o protocolo atual é focado em uma única sessão de treinamento8. Utilizamos 25 pares de choque de tom para produzir respostas de congelamento mais condicionadas durante o contexto e testes de sinalização realizados 6 semanas após o treinamento, em comparação com os testes realizados 48 horas depois.
Protocolo
O protocolo a seguir foi aprovado pelo Comitê Institucional de Cuidados e Uso de Animais da Fundación Universitaria Konrad Lorenz (IACUC-KL). A declaração universal dos direitos dos animais emitida pela Liga Internacional dos Direitos dos Animais, Genebra, Suíça (1989), e os princípios éticos de experimentação com animais emitidos pelo ICLAS foram respeitados.
1. Preparação do assunto
- Selecione ratos Wistar adultos masculinos (n = 12). Abriga-os em grupos de quatro por gaiola durante três dias de aclimatação, antes do início do protocolo de treinamento e teste. Forneça aos ratos acesso gratuito à água durante todo o experimento. Controle a temperatura ambiente entre 20 °C e 25 °C, sob um ciclo claro-escuro de 12 horas (luzes acesas às 07:00 h).
NOTA: As cepas de ratos mostraram desempenho diferencial durante o condicionamento do medo. Por exemplo, Schaap et al. (2013) relataram que as cepas de Wistar e Lewis mostraram durações mais longas de comportamento de congelamento em comparação com os ratos Fawn Hooded e Brown Norway12. Assim, devem ser avaliadas diferenças na dor e no limiar térmico para ajustar a intensidade e duração dos choques. - Mantenha os ratos em 85% de seus pesos de alimentação livre (peso normal entre 350-400 g) dando acesso restrito aos alimentos na mesma hora todos os dias. Pesar ratos todos os dias na mesma hora durante o ciclo de luz. Calcule o peso do anúncio lib (100% de peso) por três dias antes do início do treinamento prolongado de condicionamento do medo.
NOTA: Os animais utilizados no presente experimento foram testados em testes instrumentais adicionais que não são relatados aqui. A privação de alimentos era necessária para esses testes adicionais. Essa variação processual é assumida como provável para expandir o escopo do presente procedimento, pois sugere o potencial para testes combinados de medo instrumental. No entanto, estudos que utilizam apenas testes de condicionamento do medo não exigirão privação de alimentos. - Atribuir aleatoriamente indivíduos a um dos seguintes grupos: teste emocional 6 semanas após o treinamento (n = 6); teste emocional 48 h após o treinamento (n = 6).
- Realize treinamentos e testes em horas semelhantes, durante a fase leve do ciclo da luz escura. Atribua os animais à mesma câmara experimental e mantenha a mesma ordem dos animais durante o treinamento e teste.
NOTA: Um controle adicional que poderia ser implementado é contrabalaçar a ordem dos animais durante as fases de treinamento e teste. Recomendamos o uso dessa técnica quando grupos múltiplos são avaliados, ou diferentes tarefas são aplicadas em experimentos, para reduzir um possível efeito da ordem de tarefas sobre o comportamento.
2. Configuração do aparelho e calibração de choque
- Limpe todas as superfícies internas da câmara experimental e do piso da rede de aço inoxidável com 10% de etanol. Repita antes de testar cada animal.
- Conecte o equipamento a um computador usando um cabo USB e inicie o equipamento do sistema de detecção de congelamento: a CPU, o gabinete de controle, a luz infravermelha, o estimulador/embaralhador aversivo e o calibrador de intensidade de choque.
NOTA: Embora este protocolo tenha sido executado utilizando instrumentos disponíveis comercialmente(Tabela de Materiais),equipamentos e softwares de diferentes marcas podem ser utilizados. O aparelho consiste em uma câmara quadrada de acrílico interno (29,53 cm x 23,5 cm x 20,96 cm, chamada de câmara experimental) embutida em uma caixa de madeira coberta com plástico formímico. As portas externas permitem o isolamento do som, ruído ou luz (atenuando as portas da caixa). A câmera está localizada lateralmente na parte interna da porta externa. A caixa de acrílico interno com grades metálicas de piso (36 hastes de aço inoxidável, cada uma de 3 mm de diâmetro e espaçada 8 mm, centro a centro) permite a entrega de choque de pé. Em uma das paredes internas-laterais, um alto-falante está localizado a 6 cm do chão para apresentar uma sugestão auditiva. - Conecte os clipes vermelho e preto do calibrador de intensidade de choque (ou seja, conectores positivos e negativos) a duas hastes diferentes no piso da grade. Conecte o cabo USB à porta correspondente do computador. Certifique-se de conectar os clipes vermelho e preto a barras separadas por outra barra.
NOTA: Esta seção descreve o processo de calibração da intensidade de choque utilizando uma marca específica de equipamentos mencionadas na Tabela de Materiais. No entanto, o processo de calibração pode ser realizado utilizando diferentes marcas de equipamentos. Recomenda-se calibrar a intensidade do choque em três setores do piso da rede para verificar se ele é consistente. Além disso, remova sempre resíduos fecais e de urina do piso da rede para evitar interferências durante a entrega do choque. - Inicie o software calibrador de intensidade de choque(Tabela de Materiais). Escolha uma intensidade de 1,0 mA no aplicativo clicando na seta de alcance. Em seguida, mude o switch Run/Stop para Executar.
NOTA: Propomos 1,0 mA com base em nossos estudos com modelos de roedores em nosso laboratório e literatura que relata uma faixa de 0,75 mA a 1,5 mA como adequada para estudos de condicionamento do medo33,,34,,35. - Ligue o estimulador aversivo ou o equipamento usado para entregar os choques dos pés e olhe para a intensidade de choque exibida no painel da aplicação. Se necessário, ajuste a intensidade para 1,0 mA usando o botão no estimulador aversivo.
NOTA: O estimulador aversivo deve ser definido como "OUT" para testar, calibrar e executar adequadamente o experimento.
3. Calibração do sistema de detecção de congelamento
- Feche a câmara experimental e as portas da caixa de atenuante de som. Não introduza o animal neste momento, pois ele será colocado na câmara após a calibração do sistema de detecção de congelamento ter sido concluída. Verifique se a intensidade da luz dentro da caixa está entre 20 e 30 lux.
- Inicie o software do sistema de detecção de congelamento e abra a janela de diálogo de configuração do Experimento. Digite os detalhes de cada assunto (como número de identificação do assunto, data e grupo) e carregue o arquivo intitulado "Protocolo de treinamento VFC.pro" (disponível em http://doi.org/10.17605/OSF.IO/4NKFQ).
NOTA: Os testes de contexto e sinalização utilizam uma configuração de programa diferente; assim, certifique-se de usar o arquivo correto em cada teste. Neste ponto, o arquivo correto corresponde ao "protocolo de treinamento VFC.pro". Lembre-se que durante as fases de teste o arquivo correspondente será diferente da sessão de treinamento. - Escolha as câmeras correspondentes e verifique a opção Salvar vídeo (se necessário). Defina o limiar de movimento para 100 e a duração do congelamento min para 30 quadros.
NOTA: Este valor do limiar de movimento é baseado no tamanho da espécie utilizada (com base no número de pixels). O valor mínimo de duração do congelamento é recomendado pelo fabricante. Esses valores são utilizados para garantir o reconhecimento adequado do animal na câmara. - Verifique se a transmissão ao vivo das câmeras escolhidas aparece na tela, juntamente com o gráfico do limiar de movimento e a linha do tempo dos diferentes estímulos que são apresentados durante o treinamento (por exemplo, som e choque).
NOTA: Utilizando uma marca diferente, a configuração do equipamento deve oferecer a possibilidade de medir os movimentos do animal para detectar um "índice" de movimento que deve permitir comparações sobre a quantidade de tempo que o animal está se movendo ou congelando. Outra possibilidade é o uso de um software que apenas com a fonte de vídeo (durante ou após o experimento) pode detectar a quantidade de tempo que o animal está em movimento ou congelando, como o software livre ImageFZ13, caixa de ferramentas de código aberto no Matlab14, ou um classificador gratuito de comportamento animal como JAABA15. - Clique na opção Calibrar três vezes, enquanto verifica se o Índice de Movimento permanece abaixo de 100 (limiar). Em seguida, defina o equipamento para travar clicando no botão correspondente na tela.
NOTA: Esta seção descreve um processo de calibração do sistema de detecção de congelamento usando uma marca específica de equipamentos listados na Tabela de Materiais. Como foi mencionado anteriormente, o processo de calibração pode ser conduzido utilizando diferentes marcas de equipamentos (para uma revisão de diferentes opções em equipamentos e software ver Anagnostaras et al. 2010)16.
4. Treinamento prolongado de condicionamento do medo
- Transporte os ratos em suas gaiolas de origem, cobertos com um pano, desde o centro de cuidados com animais até a sala de treinamento comportamental no laboratório. Evite exposição a ruídos ou condições geradoras de estresse durante o transporte de animais para a sala de treinamento comportamental. Se vários animais forem transportados ao mesmo tempo, apenas tragam os animais para serem testados e mantenham outros ratos em uma sala de espera para melhorar o controle experimental. Manuseie suavemente os animais por 2 minutos antes de iniciar o treinamento.
NOTA: No protocolo, os animais foram manuseados todos os dias durante 2 minutos antes do treinamento comportamental. Após o manuseio, os animais foram introduzidos na câmara experimental. Recomendamos manipular animais para fazer ratos habituados ao pesquisador. - Apresente o rato à câmara experimental. Manuseie-o suavemente pela base de sua cauda e coloque-o no meio da câmara. Feche a câmara experimental e as portas da caixa de atenuante de som.
- Inicie a sessão clicando no botão Gravar. Deixe o rato se aclimatar na câmara por 3 minutos. Este período de 3 minutos é o padrão recomendado pelo fabricante do equipamento e serve como linha de base e tempo de habitação para a câmara.
- Ofereça 25 pares de choque de tom (ensaios) com um Intervalo Inter-Trial (ITI) de 60 s, começando no minuto 3 da sessão. Apresentar o tom (estímulo condicionado – CS; 90 dB SPL, 2000 Hz, 50 ms Rise Time) durante os últimos 10 s de cada ITI, e o choque (estímulo incondicionado – EUA) durante os últimos 2 s de cada ITI.
NOTA: A ativação do botão Gravar está condicionada à calibração e bloqueio das câmeras corretamente calibradas e bloqueadas. - Remova o rato da câmara experimental quando a sessão de 28 minutos acabar. Devolva animais para a respectiva gaiola. Transporte os ratos em suas gaiolas de casa cobertos com um pano da sala de treinamento comportamental para o centro de cuidados com animais.
- Repita a calibração do sistema de detecção de congelamento (etapas 3.1-3.5) e o condicionamento do medo (etapas 4.1 e 4.3) para treinar todos os sujeitos.
NOTA: Recomendamos fortemente a recalibração do sistema de detecção de cada animal para garantir que o software mantenha os mesmos parâmetros quando processa informações para detecção de congelamento. - Período de descanso: Durante esse período, que os animais descansem individualmente em suas gaiolas domésticas. Monitore o peso dos animais duas vezes por semana durante as 6 semanas do período de incubação. Manipule suavemente cada animal por dois minutos enquanto eles são ponderados.
5. Teste de contexto – sessão única de 10 minutos
- Após a fase de treinamento, exponha os animais ao primeiro teste de memória chamado teste de contexto. Durante esta fase de 10 minutos, exponha os ratos ao mesmo contexto em que o treinamento ocorreu, mas não apresentam pistas ou choques. Transporte os ratos em suas gaiolas domésticas cobertas (por exemplo, com um pano) do centro de cuidados com animais para a sala de treinamento comportamental. Tenha em mente que os animais foram divididos em grupos, assim um grupo é testado 48h após a fase de treinamento e o outro grupo é testado 6 semanas após o treinamento (ver Figura 1).
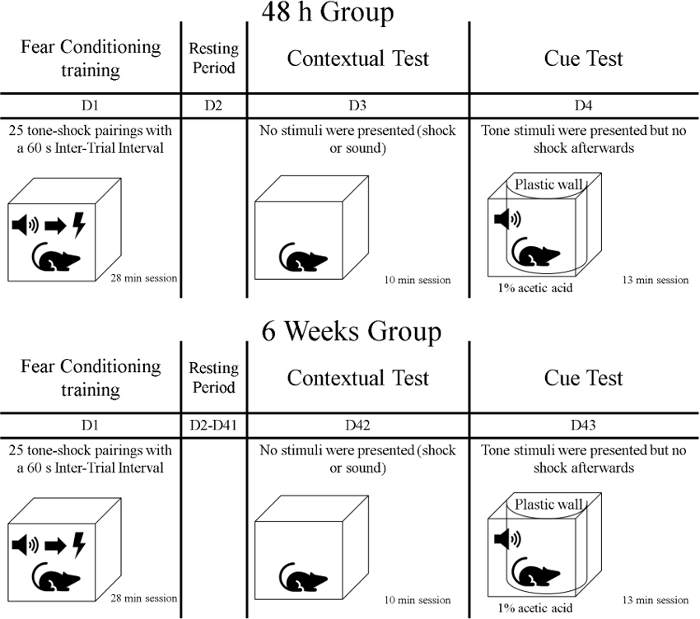
Figura 1: Linha do tempo do experimento. Clique aqui para ver uma versão maior desta figura.
- Limpe todas as superfícies internas da câmara experimental e do piso da rede de aço inoxidável com 10% de etanol. Repita antes de testar cada animal.
- Calibração do sistema de detecção de congelamento repetida (etapas 3.1 a 3.5). Abra a janela de diálogo de configuração do Experimento e carregue o arquivo chamado "Teste de contexto protocol.pro", disponível a partir de http://doi.org/10.17605/OSF.IO/4NKFQ.
NOTA: Este arquivo contém a configuração para esta fase experimental que consiste em nenhum choque ou tons. - Apresente o animal à câmara experimental. Manuseie-o suavemente pela base de sua cauda e coloque-o no meio da câmara. Feche a câmara experimental e as portas da caixa de atenuante de som.
- Inicie a sessão clicando no botão Gravar. Durante esta única sessão de teste de contexto de 10 minutos, nenhum estímulo é apresentado (choque nem som).
- Remova o assunto da câmara experimental quando a sessão de 10 minutos acabar. Devolva os animais para suas respectivas gaiolas e transporte os ratos em suas gaiolas cobertas da sala de treinamento comportamental para o centro de cuidados com animais. Repita as etapas 5.2-5.5 para testar todos os sujeitos.
6. Teste de sugestão – sessão única de 13 min
- Um dia após o teste de contexto, os animais passam pelo segundo teste de memória chamado teste de sinalização. Durante esta fase, os ratos estarão em um contexto diferente de treinamento durante 13 min.; pistas (tons) são apresentadas, mas nenhum choque é entregue. Transporte os ratos em suas gaiolas de casa cobertos com uma cobertura do centro de cuidados com animais para a sala de treinamento comportamental. Teste um grupo 72 h após o treinamento de condicionamento do medo, e teste outro grupo 6 semanas e um dia após o treinamento(Figura 1).
NOTA: Um sistema diferente de transporte (da unidade de cuidados com animais até a sala experimental) poderia ser implementado para diferenciar mais o contexto e os testes de sinalização. Uma vez que os animais foram transportados para a sessão de treinamento e sessão de teste de contexto em suas gaiolas de origem, uma gaiola de transporte diferente, roupa de cama e/ou cobertura poderia ser usada durante o transporte para a sessão de teste de sinalização. - Limpe todas as superfícies internas da câmara experimental e do piso da rede de aço inoxidável com 10% de etanol. Repita antes de testar cada animal.
- Para mudar o contexto visual, insira a parede ao redor de plástico na câmara experimental.
- Para alterar o contexto olfativo, aplique 1% de ácido acético em um cotonete com ponta de algodão e coloque-o na bandeja de metal abaixo do piso da grade17,,18,,19.
- Repita a calibração do sistema de detecção de congelamento (etapas 3.1-3.5). Carregue o arquivo chamado arquivo "Cue test protocol.pro", que está disponível a partir de http://doi.org/10.17605/OSF.IO/4NKFQ.
NOTA: Este arquivo contém a configuração para esta fase experimental, que consiste na entrega dos mesmos tons apresentados durante a fase de treinamento (SC), mas na ausência de choques (EUA). - Apresente o animal à câmara experimental. Manuseie-o suavemente pela base de sua cauda e coloque-o no meio da câmara. Feche a câmara experimental e as portas da caixa de atenuante de som.
- Inicie a sessão clicando no botão Gravar. Durante a única sessão de teste de 13 minutos, o estímulo CS (tom) é apresentado 10 vezes, começando no minuto 3 da sessão.
NOTA: Os primeiros 3 minutos correspondem à linha de base desta sessão, seguidos de 10 ensaios de teste de sinalização (ou seja, 10 s cada) entregues com ITIs de 50 s na ausência de choques. A entrega de tons é automática, através do uso do arquivo previamente carregado. - Remova o animal da câmara experimental quando a sessão de 13 minutos acabar. Devolva os animais para a respectiva gaiola e transporte-os cobertos para o centro de cuidados com animais. Repita as etapas 6.2 a 6.5 para testar todos os sujeitos.
7. Análise de dados
- Obtenha o índice geral de atividade (ou seja, índice de movimento) derivado do fluxo de vídeo usando o software do sistema de detecção de congelamento. Este software transforma automaticamente o índice de movimento para fornecer a porcentagem de tempo de congelamento por sessão e o número de episódios de congelamento. Defina o limiar de congelamento à configuração padrão de duração do congelamento mínimo do sistema (1 s = 30 quadros).
- Use o programa personalizado adicional (arquivo disponível a partir de http://doi.org/10.17605/OSF.IO/4NKFQ) para obter:
- Use o programa para determinar a porcentagem de congelamento durante os primeiros três minutos da sessão de treinamento (ou seja, congelamento da linha de base, uma vez que não foram apresentados choques ou tons antes ou durante esse período de 3 minutos) e durante os primeiros três minutos da sessão de teste de sinalização.
- Use o programa para determinar a porcentagem de congelamento para cada uma das oito caixas de 3 minutos da sessão de treinamento.
- Use o programa para determinar a porcentagem de congelamento durante as apresentações de sinalização (ou seja, congelamento durante os tons) e períodos sem sinalização (intervalos intertriais; ITIs), tanto para treinamento quanto para sessões de teste de sugestão.
- Para obter esses dados, abra o software do sistema de detecção de congelamento.
- Selecionar arquivo | Relatórios | Resumo do componente do lote.
- Selecione o arquivo com extensão . CMP disponível a partir de http://doi.org/10.17605/OSF.IO/4NKFQ.
- Nomeie o arquivo de saída e altere o Limiar de movimento para um 100. Em seguida, clique em OK.
- Selecione os arquivos a serem analisados (extensão . RAW). Esses arquivos são gerados automaticamente a partir do software do sistema de detecção de congelamento quando a sessão acaba e correspondem aos dados brutos de cada sessão. Inicialmente, os arquivos são salvos na área de trabalho do computador, mas podem ser armazenados em uma pasta personalizada (por exemplo, condicionante documentos-medo) para facilitar sua identificação e abertura subsequentes quando eles precisam ser analisados.
- Abra os arquivos de saída (extensão . CSV). Eles podem ser editados em um software de planilha para análise posterior. Este arquivo contém os resultados do congelamento durante a sessão experimental.
NOTA: Para obter a porcentagem total de congelamento, divida o tempo que o sujeito passou imóvel ao longo do tempo total da sessão. O número de episódios de congelamento pode ser calculado contando o número de eventos de congelamento durante a sessão. Em ambos os casos, é necessário definir um limiar de movimento com base em uma duração mínima de congelamento. Este é o critério temporal que define se um Episódio de Congelamento é gravado. Sistemas automatizados de gravação podem usar determinada quantidade de quadros por segundo (fps) como medida de duração mínima de congelamento. Por exemplo, com uma taxa amostral de 30 fps, uma duração mínima de congelamento de 15 quadros será registrada como congelamento de uma instância de imobilidade que dura 30 s.
- Calcule a duração média de cada episódio de congelamento para cada sessão (treinamento e ambos os testes, contexto e sugestão) dividindo a duração total de congelamento (em segundos) sobre o número total de episódios de congelamento.
Resultados
Foram analisadas variações no percentual de tempo de congelamento durante diferentes estágios da sessão de treinamento para todos os sujeitos (n = 12) utilizando-se um teste t dependente(Tabela 1). Os animais foram ativos e exploraram a câmara experimental durante os primeiros três minutos da sessão de treinamento (primeiro dia do protocolo), tempo durante o qual não foram entregues tons ou choques (ou seja, linha de base-BL). Conforme mostrado na
Discussão
O presente protocolo estendido de condicionamento do medo é uma abordagem eficiente e válida para avaliar a memória emocional em períodos curtos (48 h) e longo prazo (6 semanas). Assim, o protocolo permite estudar o overtraining e temer fenômenos de incubação em ratos. Entre as diferentes vantagens deste protocolo estão as seguintes. Oferece dois tipos de testes de memória, ou seja, contexto e sugestão, que permitem identificar o efeito diferencial de dois atrasos (48h e 6 semanas) em meio a manipulações de c...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
O apoio financeiro para esta pesquisa foi fornecido pela Fundación Universitaria Konrad Lorenz - número de subvenção 9IN15151. Os autores gostariam de agradecer ao Departamento de Comunicações da Universidade Konrad Lorenz por sua ajuda na gravação e edição do vídeo, em particular Natalia Rivera e Andrés Serrano (Produtores). Além disso, Nicole Pfaller-Sadovsky e Lucia Medina por seus comentários sobre o manuscrito, e Johanna Barrero, reitora da Corporacion Universitaria Iberoamericana, para colaboração institucional. Os autores não têm conflitos de interesse.
Materiais
| Name | Company | Catalog Number | Comments |
| Acetic acid (ethanoic acid) | https://pubchem.ncbi.nlm.nih.gov/compound/acetic_acid | ||
| Aversive Stimulation Current Package | MED Associates Inc | ENV-420 | https://www.med-associates.com/product-category/video-fear-packages-for-rat/ |
| Contextual test protocol.pro | http://doi.org/10.17605/OSF.IO/4NKFQ | ||
| Cue test protocol.pro | http://doi.org/10.17605/OSF.IO/4NKFQ | ||
| Curved Wall Insert | MED Associates Inc | VFC-008-CWI | https://www.med-associates.com/product-category/video-fear-packages-for-rat/ |
| Data processing.zip | http://doi.org/10.17605/OSF.IO/4NKFQ | ||
| NIR/White Light Control Box | MED Associates Inc | NIR-100 | |
| Quick Change Floor/Pan Unit for Mouse | MED Associates Inc | ENV-005FPU-M | https://www.med-associates.com/product-category/video-fear-packages-for-rat/ |
| Small Tabletop Cabinet and Power Supply | MED Associates Inc | SG-6080D | https://www.med-associates.com/product-category/video-fear-packages-for-rat/ |
| Standalone Aversive Stimulator/Scrambler (115 V / 60 Hz) | MED Associates Inc | ENV-414S | https://www.med-associates.com/product-category/video-fear-packages-for-rat/ |
| Standard Fear Conditioning Chamber | MED Associates Inc | VFC-008 | https://www.med-associates.com/product-category/video-fear-packages-for-rat/ |
| Training protocol VFC.pro | http://doi.org/10.17605/OSF.IO/4NKFQ | ||
| Video Fear Conditioning Package for Rat | MED Associates Inc | MED-VFC-SCT-R | https://www.med-associates.com/product-category/video-fear-packages-for-rat/ |
Referências
- Frankland, P. W., Bontempi, B. The organization of recent and remote memories. Nature Reviews Neuroscience. 6 (2), 119-130 (2005).
- Suzuki, A., Mukawa, T., Tsukagoshi, A., Frankland, P. W., Kida, S. Activation of LVGCCs and CB1 receptors required for destabilization of reactivated contextual fear memories. Learning & Memory. 15 (6), 426-433 (2008).
- Hermans, E. J., et al. How the amygdala affects emotional memory by altering brain network properties. Neurobiology of Learning and Memory. 112, 2-16 (2014).
- Moryś, J., Berdel, B., Jagalska-Majewska, H., ŁUczyńSka, A. The basolateral amygdaloid complex -its development, morphology and functions. Folia Morphologica. 58 (3), 29-46 (1998).
- LeDoux, J. E. Emotional memory systems in the brain. Behavioural Brain Research. 58 (1-2), 69-79 (1993).
- Labar, K. S. Beyond fear: Emotional memory mechanisms in the human brain. Current Directions in Psychological Science. 16 (4), 173-177 (2007).
- Izquierdo, I., Furini, C. R. G., Myskiw, J. C. Fear Memory. Physiological Reviews. 96 (2), 695-750 (2016).
- Maren, S. Overtraining Does Not Mitigate Contextual Fear Conditioning Deficits Produced by Neurotoxic Lesions of the Basolateral Amygdala. The Journal of Neuroscience. 18 (8), 3097-3097 (1998).
- Pickens, C. L., Golden, S. A., Nair, S. G. Incubation of fear. Current Protocols in Neuroscience. 64, (2013).
- Morrow, J. D., Saunders, B. T., Maren, S., Robinson, T. E. Sign-tracking to an appetitive cue predicts incubation of conditioned fear in rats. Behavioural Brain Research. 276, 59-66 (2015).
- Pickens, C. L., Golden, S. A., Adams-Deutsch, T., Nair, S. G., Shaham, Y. Long-lasting incubation of conditioned fear in rats. Biological Psychiatry. 65 (10), 881-886 (2009).
- Schaap, M. W. H., et al. Nociception and Conditioned Fear in Rats: Strains Matter. PLoS ONE. 8 (12), 83339 (2013).
- Shoji, H., Takao, K., Hattori, S., Miyakawa, T. Contextual and Cued Fear Conditioning Test Using a Video Analyzing System in Mice. Journal of Visualized Experiments. (85), e50871 (2014).
- Patel, T. P., et al. An open-source toolbox for automated phenotyping of mice in behavioral tasks. Frontiers in Behavioral Neuroscience. 8, 349 (2014).
- Kabra, M., Robie, A. A., Rivera-Alba, M., Branson, S., Branson, K. JAABA: Interactive machine learning for automatic annotation of animal behavior. Nature Methods. 10 (1), 64-67 (2013).
- Anagnostaras, S. G. Automated assessment of Pavlovian conditioned freezing and shock reactivity in mice using the VideoFreeze system. Frontiers in Behavioral Neuroscience. 4 (58), (2010).
- Moyer, J. R., Brown, T. H. Impaired Trace and Contextual Fear Conditioning in Aged Rats. Behavioral Neuroscience. 120 (3), 612-624 (2006).
- Schuette, S. R., Hobson, S. Conditioned contextual fear memory to assess natural forgetting and cognitive enhancement in rats. Journal of Biological Methods. 5 (3), 99 (2018).
- Chang, C. H., et al. Fear extinction in rodents. Current Protocols in Neuroscience. , (2009).
- Pickens, C. L., Golden, S. A., Nair, S. G. Incubation of fear. Current Protocols in Neuroscience. 64, 1-18 (2013).
- Izquierdo, I., Furini, C. R. G., Myskiw, J. C. Fear Memory. Physiological Reviews. 96 (2), 695-750 (2016).
- Vetere, G., et al. Chemogenetic Interrogation of a Brain-wide Fear Memory Network in Mice Article Chemogenetic Interrogation of a Brain-wide Fear Memory Network in Mice. Neuron. 94 (2), 363-374 (2017).
- Koob, G. F., Zimmer, A. Chapter 9 - Animal models of psychiatric disorders. Neurobiology of Psychiatric Disorders. 106, 137-166 (2012).
- Bourin, M. Animal models for screening anxiolytic-like drugs: a perspective. Dialogues in clinical neuroscience. 17 (3), 295-303 (2015).
- Murray, S. B., et al. Fear as a translational mechanism in the psychopathology of anorexia nervosa. Neuroscience & Biobehavioral Reviews. 95, 383-395 (2018).
- Pamplona, F. A., et al. Prolonged fear incubation leads to generalized avoidance behavior in mice. Journal of Psychiatric Research. 45 (3), 354-360 (2011).
- Török, B., Sipos, E., Pivac, N., Zelena, D. Modelling posttraumatic stress disorders in animals. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 90, 117-133 (2019).
- Bhakta, A., Gavini, K., Yang, E., Lyman-Henley, L., Parameshwaran, K. Chronic traumatic stress impairs memory in mice: Potential roles of acetylcholine, neuroinflammation and corticotropin releasing factor expression in the hippocampus. Behavioural Brain Research. 335, 32-40 (2017).
- Uniyal, A., et al. Pharmacological rewriting of fear memories: A beacon for post-traumatic stress disorder. European Journal of Pharmacology. , 172824 (2019).
- Barad, M. Fear extinction in rodents: basic insight to clinical promise. Current Opinion in Neurobiology. 15 (6), 710-715 (2005).
- Haaker, J., et al. Making translation work: Harmonizing cross-species methodology in the behavioural neuroscience of Pavlovian fear conditioning. Neuroscience & Biobehavioral Reviews. 107, 329-345 (2019).
- Heroux, N. A., Horgan, C. J., Pinizzotto, C. C., Rosen, J. B., Stanton, M. E. Medial prefrontal and ventral hippocampal contributions to incidental context learning and memory in adolescent rats. Neurobiology of Learning and Memory. 166, 107091 (2019).
- Rossi, M. A., Yin, H. H. Methods for Studying Habitual Behavior in Mice. Current Protocols in Neuroscience. 60 (1), 8-29 (2012).
- Brady, A. M., Floresco, S. B. Operant Procedures for Assessing Behavioral Flexibility in Rats. Journal of Visualized Experiments. (96), (2015).
- Zoccolan, D., Di Filippo, A. Methodological Approaches to the Behavioural Investigation of Visual Perception in Rodents. Handbook of Behavioral Neuroscience. , (2018).
- Lguensat, A., Bentefour, Y., Bennis, M., Ba-M'hamed, S., Garcia, R. Susceptibility and Resilience to PTSD-Like Symptoms in Mice Are Associated with Opposite Dendritic Changes in the Prelimbic and Infralimbic Cortices Following Trauma. Neuroscience. 418, 166-176 (2019).
- Li, Q., et al. N-Acetyl Serotonin Protects Neural Progenitor Cells Against Oxidative Stress-Induced Apoptosis and Improves Neurogenesis in Adult Mouse Hippocampus Following Traumatic Brain Injury. Journal of Molecular Neuroscience. 67 (4), 574-588 (2019).
- Pantoni, M. M., Carmack, S. A., Hammam, L., Anagnostaras, S. G. Dopamine and norepinephrine transporter inhibition for long-term fear memory enhancement. Behavioural Brain Research. 378 (112266), 112266 (2020).
- Smith, K. L., et al. Microglial cell hyper-ramification and neuronal dendritic spine loss in the hippocampus and medial prefrontal cortex in a mouse model of PTSD. Brain, Behavior, and Immunity. 80, 889-899 (2019).
- Liu, X., Zheng, X., Liu, Y., Du, X., Chen, Z. Effects of adaptation to handling on the circadian rhythmicity of blood solutes in Mongolian gerbils. Animal Models and Experimental. 2 (2), 127-131 (2019).
- Landgraf, D., McCarthy, M. J., Welsh, D. K. The role of the circadian clock in animal models of mood disorders. Behavioral Neuroscience. 128 (3), 344-359 (2014).
- Refinetti, R., Kenagy, G. J. Diurnally active rodents for laboratory research. Laboratory annimals. 52 (6), 577-587 (2018).
- Hurtado-Parrado, C., et al. Assessing Mongolian gerbil emotional behavior: effects of two shock intensities and response-independent shocks during an extended inhibitory-avoidance task. PeerJ. 5, (2017).
- Frey, P., Eng, S., Gavinf, W. Conditioned suppression in the gerbil. Behavior Research Methods & Instrumentation. 4 (5), 245-249 (1972).
- Woolley, M. L., Haman, M., Higgins, G. A., Ballard, T. M. Investigating the effect of bilateral amygdala lesions on fear conditioning and social interaction in the male Mongolian gerbil. Brain Research. 1078 (1), 151-158 (2006).
- Ballard, T. M., Sänger, S., Higgins, G. a Inhibition of shock-induced foot tapping behaviour in the gerbil by a tachykinin NK1 receptor antagonist. European Journal of Pharmacology. 412 (3), 255-264 (2001).
- Luyten, L., Schroyens, N., Hermans, D., Beckers, T. Parameter optimization for automated behavior assessment: plug-and-play or trial-and-error. Frontiers in Behavioral Neuroscience. 8 (28), (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados