A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
דגירה פחד באמצעות פרוטוקול מיזוג פחד מורחב לחולדות
In This Article
Summary
אנו מתארים פרוטוקול מורחב של מיזוג פחד המייצר אי-ניסיון יתר ופחד מחשירה בחולדות. פרוטוקול זה כרוך באימון יחיד עם 25 זיווגים של הלם טון (כלומר, אימון יתר) והשוואה של תגובות הקפאה מותנות במהלך בדיקות הקשר וסימן 48 שעות (לטווח קצר) ו-6 שבועות (לטווח ארוך) לאחר האימון.
Abstract
זיכרון רגשי נחקר בעיקר עם פרדיגמיות של מיזוג פחד. התניה פחד היא סוג של למידה שדרכה אנשים לומדים את היחסים בין אירועים aversive וגירויים ניטרליים אחרת. ההליכים הנפוצים ביותר לחקר זיכרונות רגשיים כרוכים בהתניה של פחד בחולדות. במשימות אלה, הגירוי ללא תנאי (ארה"ב) הוא הלם רגל שהוצג פעם או מספר פעמים על-פני מפגשים בודדים או מספר מפגשים, והתגובה המותנה (CR) מקפיאה. בגרסה של הליכים אלה, הנקראת "מיזוג פחד cued", טון (גירוי מותנה, CS) מזווג עם רעידות רגל (ארה"ב) במהלך שלב האימון. במהלך הבדיקה הראשונה, בעלי חיים נחשפים לאותו הקשר שבו התקיימה ההכשרה, ותגובות הקפאה נבדקות בהיעדר רעידות רגליים וגוונים (כלומר, מבחן הקשר). במהלך הבדיקה השנייה נמדדת ההקפאה כאשר ההקשר משתנה (לדוגמה, על ידי מניפולציה של הריח והקירות של התא הניסיוני) והטון מוצג בהיעדר רעידות רגליים (כלומר, מבחן רמז). רוב הליכי מיזוג הפחד cued כרוכים כמה זיווגים הלם טון (למשל, 1-3 ניסויים בפגישה אחת). יש עניין הולך וגדל בגרסאות פחות נפוצות הכוללות מספר רב של זיווגים (כלומר, עודף ניסיון) הקשורים לאפקט ארוך טווח הנקרא דגירה של פחד (כלומר, תגובות הפחד גדלות עם הזמן ללא חשיפה נוספת לאירועים או גירויים מותנים). משימות מורחבות של מיזוג פחד היו המפתח להבנת ההיבטים ההתנהגותיים והנוירוביולוגיים של הדגירה של הפחד, כולל הקשר שלה עם תופעות פסיכולוגיות אחרות (למשל, הפרעת דחק פוסט-טראומטית). כאן, אנו מתארים פרוטוקול מורחב של מיזוג פחד המייצר אי-ניסיון יתר ופחד דגירה בחולדות. פרוטוקול זה כרוך באימון יחיד עם 25 זיווגים של הלם טון (כלומר, אימון יתר) והשוואה של תגובות הקפאה מותנות במהלך בדיקות הקשר וסימן 48 שעות (לטווח קצר) ו-6 שבועות (לטווח ארוך) לאחר האימון.
Introduction
זיכרון הוא תהליך פסיכולוגי המקיף שלבים שונים: רכישת מידע, איחוד (מאפשר יציבות של מידע שנרכש) ואחזור (ראיות לתהליך האיחוד)1. במהלך שלב האיחוד, מתרחשים הקמה של חיבורים סינפטיים חדשים ושינוי של חיבורים קיימים מראש. הדבר מצביע על הצורך לתקופה של זמן שבמהלכה אירועים מולקולריים ופיזיולוגיים האחראים לשינויים אלהמתרחשים 1,2. שינויים פיזיולוגיים או מולקולריים אלה משתנים בין אם האירועים שאוחזרו טעונים רגשית או לא (כלומר, זיכרון רגשי). לדוגמה, מחקרים הראו כי גרעין הים הניצי ותסביך האמיגדלה הבסקית רלוונטיים במיוחד לזיכרון הרגשי3,,4,,5.
תופעות זיכרון רגשי נחקרו בעיקר עם פרדיגמים מיזוג פחד5,6. מיזוג פחד הוא סוג של למידה שדרכה אנשים לומדים את היחסים בין אירועים aversive וגירויים ניטרליים אחרת7. פרדיגמות מיזוג פחד לייצר מולקולרי, תאי, ושינויים מבניים האמיגדלה. בנוסף, מיזוג הפחד משנה את הקישוריות של ההיפוקמפוס במהלך תהליכי הקונסולידציה ואחזור של זיכרון רגשי.
אחד ההליכים הנפוצים ביותר לחקר זיכרונות פחד הוא קלאסי (פבלובי) מיזוג בחולדות. הליך זה משתמש בדרך כלל בהלם רגל (ארה"ב) כגירוי aversive, אשר מועבר פעם או מספר פעמים על פני אחד או מספר מפגשים. התגובה מותנית (CR) של חולדות שנחשפו להליך זה היא הקפאה (כלומר, "חוסר תנועה כללי הנגרמת על ידי תגובת טוניק כללית של שרירי השלד של בעלי החיים למעט השרירים המשמשיםבנשימה" 7). ניתן להעריך תגובה זו בשני סוגים של בדיקות: בדיקות הקשר וסימן. למבחן ההקשר, הנבדק עובר מספר נתון של רעידות רגליים במהלך האימון, ולאחר מכן מוסר מהתא הניסיוני למשך זמן מוגדר. במהלך הבדיקה, הנושא מוחזר לאותו הקשר שבו האימונים התקיימו ומדדים שונים של הקפאה נאספים בהיעדר רעידות רגליים (למשל, משך, אחוז או תדירות של פרקי הקפאה), ובהשוואה לרמות הבסיס שנקבעו בשלב האימון. עבור הסוג השני של הבדיקה, מבחן cue, גירוי (בדרך כלל טון) מזווג עם רעידות הרגל במהלך שלב האימון (כלומר, גירוי מותנה, CS). לאחר השלמת האימון, החיה מוסרת מהקשר האימון לזמן מוגדר ולאחר מכן ממוקמת בהקשר שונה (לדוגמה, תא ניסיוני שונה בעל צורות שונות של קירות וריח שונה). לאחר מכן הסימן מוצג מספר נתון של פעמים, ותגובות הקפאה לסימן נמדדות בהשוואה לרמות הבסיסיות שנאספו במהלך האימון. הגרסה הנפוצה ביותר של פרדיגמה זו משתמשת 1 עד 3 זיווגים הלם טון במהלך אימון יחיד, ואחריו בדיקות הקשר ו cue שנערך מספר שעות או כמה ימים לאחר מכן.
הליכי מיזוג פחד אחרים מיושמים בתדירות נמוכה יותר כרוכים במספר רב של זיווגים של מקלות הלם (כלומר, ניסויים), אשר נקראו לעתים קרובות הליכי אובר-און8. עניין הולך וגובר במשימות אלה קשור להשפעות הזיכרון הארוכות והגדלות שלהם הנקראות דגירה של פחד (כלומר, תגובות פחד מותנות גדלות עם הזמן בהיעדר חשיפה נוספת לאירועים או גירויים מותנים)9,,10,,11. דוגמה של נהלי אימון יתר כאלה כרוכה בשלב אימון של 100 זיווגים הלם טון מופץ על פני 10 הפעלות, ואחריו בדיקות הקשר ו cue שנערך 48 שעות ו 30 ימים מאוחריותר 11,12. כדי להימנע מהכשרה מקיפה הפרושה על פני מספר ימים, מרן (1998) דיווח כי אימון יתר יכול להיות מבוסס ואופטימיזציה בפגישה אחת עם 25זיווגים 8. אפקט הדגירה הוא עדות ברמות גבוהות יותר באופן משמעותי של פחד מותן בחולדות שנבדקו 31 ימים לאחר האימון, לעומת חולדות שנבדקו 48 שעות לאחר מכן. משימות מורחבות של מיזוג פחד היו המפתח להבנת היבטים התנהגותיים ונוירוביולוגיים הבסיסיים דגירה של פחד, כולל הקשר שלה עם תופעות פסיכולוגיות אחרות (למשל, הפרעת דחק פוסט-טראומטית מתעכבת)11,,12,,13.
כאן, אנו מתארים פרוטוקול מורחב של מיזוג פחדים שגורם לאורופן יתר ופחד מדגירה בחולדות. שונה פרדיגמים אחרים הדורשים מספר ימיאימון 11, הפרוטוקול הנוכחי מתמקד אימון יחיד8. השתמשנו ב-25 זיווגים של הלם טון כדי לייצר תגובות הקפאה מותנות גבוהות יותר במהלך בדיקות ההקשר והרמז שנערכו 6 שבועות לאחר האימון, בהשוואה לבדיקות שנערכו 48 שעות לאחר מכן.
Protocol
הפרוטוקול הבא אושר על ידי הוועדה המוסדית לטיפול בבעלי חיים ושימוש של אוניברסיטת Fundación Konrad Lorenz (IACUC-KL). ההכרזה האוניברסלית בדבר זכויות בעלי חיים שהונפקה על ידי הליגה הבינלאומית לזכויות בעלי חיים בז'נבה, שווייץ (1989) ועקרונות אתיים של ניסויים בבעלי חיים שהונפקו על ידי ICLAS היו מכובדים.
1. הכנת נושא
- בחר חולדות Wistar בוגר זכר (n = 12). להאוסן אותם בקבוצות של ארבעה לכלוב במשך שלושה ימים של התאקלמות, לפני תחילת פרוטוקול האימונים והבדיקה. לספק לחולדות גישה חופשית למים לאורך כל הניסוי. שלוט בטמפרטורת החדר בין 20°C ל-25°C, תחת מחזור בהיר של 12 שעה (אורות דולקים בשעה 07:00).
הערה: זנים חולדה הראו ביצועים דיפרנציאליים במהלך מיזוג פחד. לדוגמה, Schaap et al. (2013) דיווח כי זני Wistar ולואיס הראו משכי זמן ארוכים יותר של התנהגות הקפאה לעומת חולדות פון ברדסוחומים נורווגיה 12. לכן, יש להעריך הבדלים בכאב ותרמי סף כדי להתאים את העוצמה ואת משך הזעזועים. - לשמור על חולדות ב 85% של משקולות ההאכלה החופשית שלהם (משקל רגיל בין 350-400 גרם) על ידי מתן גישה מוגבלת למזון באותה שעה בכל יום. לשקול חולדות כל יום באותה שעה במהלך מחזור האור. חשב את משקל ה-ad lib (100% משקל) במשך שלושה ימים לפני תחילת אימון ממושך להתניית פחד.
הערה: בעלי חיים המשמשים בניסוי הנוכחי נבדקו בבדיקות אינסטרומנטליות נוספות שלא דווחו כאן. נדרש מחסור במזון לבדיקות נוספות אלה. וריאציה פרוצדורלית זו מניחה כי סביר להרחיב את היקף ההליך הנוכחי, כפי שהוא מרמז על הפוטנציאל של בדיקות משולבות פחד אינסטרומנטלי. עם זאת, מחקרים המשתמשים רק בבדיקות מיזוג פחד לא ידרשו מניעת מזון. - להקצות באופן אקראי נושאים לאחת מהקבוצות הבאות: בדיקות רגשיות 6 שבועות לאחר האימון (n = 6); בדיקה רגשית 48 שעות לאחר האימון (n = 6).
- בצע אימונים ובדיקות בשעות דומות, במהלך שלב האור של מחזור האור האפל. הקצה את בעלי החיים לאותו תא ניסיוני ולשמור על אותו סדר של בעלי חיים במהלך אימונים ובדיקות.
הערה: בקרה נוספת שיכולה להיות מיושמת היא איון נגד סדר בעלי החיים בשלבי אימון ובדיקה. מומלץ להשתמש בטכניקה זו כאשר קבוצות כפולות מוערכות, או משימות שונות מוחלות על-פני ניסויים, כדי להפחית השפעה אפשרית של סדר משימות על אופן הפעולה.
2. הגדרת ם לכיול והלם
- נקה את כל המשטחים הפנימיים של התא הניסיוני ואת רצפת הרשת מפלדת אל-חלד עם 10% אתנול. חזור על הפעולה לפני שתבדוק כל חיה.
- חבר את הציוד למחשב באמצעות כבל USB והתניע את ציוד מערכת זיהוי ההקפאה: המעבד המרכזי, ארון השליטה, אור האינפרא-אדום, הממריץ/מערבל הזעזועים והקליברטור בעוצמת ההלם.
הערה: למרות פרוטוקול זה בוצע באמצעות מכשירים מסחריים זמינים(טבלת חומרים),ציוד ותוכנה של מותגים שונים ניתן להשתמש. ההתקן מורכב מתא מרובע אקריליק פנימי (29.53 ס"מ על 23.5 ס"מ על 20.96 ס"מ, הנקרא תא הניסוי) המשובץ בקופסת עץ מכוסה בפלסטיק. הדלתות החיצוניות מאפשרות בידוד של קול, רעש או אור (דלתות תיבה מקלות). המצלמה ממוקמת לרוחב בחלק הפנימי של הדלת החיצונית. תיבת אקריליק פנימית עם רשתות מתכת הרצפה (36 מוטות נירוסטה, כל אחד של 3 מ"מ קוטר ומנומק 8 מ"מ, מרכז למרכז) מאפשר משלוח הלם רגל. באחד הקירות הפנימיים-לרוחב, רמקול ממוקם 6 ס"מ מהרצפה כדי להציג רמז שמיעתי. - חבר את הסרטונים האדומים והשחורים של קליברטור עוצמת ההלם (כלומר, מחברים חיוביים ושליליים) לשני מוטות שונים על רצפת הרשת. חבר את כבל ה-USB ליציאה המתאימה של המחשב. הקפד לחבר את הקליפים האדומים והשחורים לסורגים המופרדים באמצעות סרגל אחר.
הערה: סעיף זה מתאר את תהליך כיול עוצמת ההלם באמצעות מותג מסוים של ציוד המוזכר בטבלת החומרים. עם זאת, ניתן לבצע את תהליך הכיול באמצעות מותגים שונים של ציוד. מומלץ לכייל את עוצמת ההלם בשלושה מגזרים של רצפת הרשת כדי לוודא שהוא עקבי. בנוסף, תמיד להסיר שאריות צואה ושתן מרצפה הרשת כדי למנוע הפרעה במהלך המסירה של ההלם. - הפעל את תוכנת calibrator בעוצמת הלם (טבלת חומרים). בחר עוצמה של 1.0 mA ביישום על ידי לחיצה על חץ הטווח. לאחר מכן, שנה את המתג הפעלה/עצור להפעלה.
הערה: אנו מציעים 1.0 mA בהתבסס על המחקרים שלנו עם מודלים מכרסמים במעבדה שלנו וספרות המדווחת על טווח בין 0.75 mA ל 1.5 mA מתאים ללימודים של פחד מיזוג33,,34,35. - הפעל את הממריץ aversive או את הציוד המשמש כדי לספק את הזעזועים ברגל ולהסתכל על עוצמת ההלם המוצגת בלוח של היישום. במידת הצורך, התאימו את העוצמה ל-1.0 mA באמצעות הידית של הממריץ האוורסיבי.
הערה: יש להגדיר את ממריץ Aversive כ- "OUT" כדי לבדוק, לכייל ולהפעיל את הניסוי כראוי.
3. כיול מערכת זיהוי הקפאה
- סגור את התא הניסיוני ודלתות התיבה המיוחכות. אל תציגו את החיה בשלב זה, כפי שהוא יוצב לתוך התא לאחר כיול מערכת זיהוי הקפאה הושלמה. ודא שעוצמת האור בתוך התיבה היא בין 20 ל-30 לוקס.
- הפעל את תוכנת מערכת זיהוי ההקפאה ופתח את חלון הדיאלוג של הגדרת ניסוי. הזן את הפרטים של כל נושא (כגון מספר זיהוי נושא, תאריך וקבוצה) וטען את הקובץ שכותרתו "פרוטוקול הדרכה VFC.pro" (זמין http://doi.org/10.17605/OSF.IO/4NKFQ).
הערה: בדיקות הקשר וסימן משתמשות בתצורת תוכנית אחרת; לכן, הקפד להשתמש בקובץ הנכון בכל בדיקה. בשלב זה הקובץ הנכון מתאים ל"פרוטוקול הדרכה VFC.pro". זכור כי במהלך שלבי הבדיקה הקובץ המתאים יהיה שונה להפעלה אימונים. - בחר את המצלמות המתאימות ובדוק את האפשרות שמור וידאו (במידת הצורך). הגדר את סף התנועה ל- 100 ואת משך ההקפאה המינימלי ל- 30 מסגרות.
הערה: ערך סף תנועה זה מבוסס על גודל המינים המשמשים (בהתבסס על מספר הפיקסלים). היצרן ממליץ על ערך משך הקפאה מינימלי. ערכים אלה משמשים להבטחת הכרה נאותה של בעל החיים בתא. - ודא שההזנה החיה מהמצלמה שנבחרה מופיעה על המסך, יחד עם גרף סף התנועה וציר הזמן של הגירויים השונים המוצגים במהלך האימון (לדוגמה, קול והלם).
הערה: באמצעות מותג אחר, הגדרת הציוד צריכה להציע את האפשרות למדוד את התנועות של בעל החיים כדי לזהות "אינדקס" של תנועה שאמור לאפשר השוואות על משך הזמן שהחיה נעה או קופאת. אפשרות נוספת היא שימוש בתוכנה שעם מקור הווידאו בלבד (במהלך הניסוי או אחריו) יכולה לזהות את משך הזמן שבו בעל החיים נמצא בתנועה או הקפאה, כגון תוכנה חופשית ImageFZ13, ארגז כלים ב-Matlab14, או מסווג חינם של התנהגות בעלי חיים כמו JAABA15. - לחץ על האפשרות כיול שלוש פעמים, תוך כדי בדיקה שמדד התנועה נשאר מתחת ל- 100 (סף). לאחר מכן, הגדר את הציוד לנעילה על-ידי לחיצה על הלחצן המתאים על המסך.
הערה: סעיף זה מתאר תהליך כיול מערכת הקפאה באמצעות מותג מסוים של ציוד המפורט בטבלת החומרים. כפי שהוזכר קודם לכן, תהליך הכיול יכול לערך באמצעות מותגים שונים של ציוד (לסקירה של אפשרויות שונות בציוד ותוכנה ראה Anagnostaras ואח ' 2010)16.
4. אימון מורחב למיזוג פחד
- להעביר את החולדות בכלובים הביתיים שלהם, מכוסה במטלית, ממתקן טיפול בבעלי חיים לחדר האימונים ההתנהגותי במעבדה. הימנע מחשיפה לרעש או לתנאים ליצירת מתחים במהלך העברת בעלי חיים לחדר האימונים ההתנהגותי. אם מספר בעלי חיים מועברים בו זמנית, להביא את בעלי החיים רק להיבדק ולתחזק חולדות אחרות בחדר מעצר כדי לשפר את השליטה הניסיונית. לטפל בעדינות בבעלי החיים במשך 2 דקות לפני תחילת האימון.
הערה: בפרוטוקול, בעלי החיים טופלו כל יום במשך 2 דקות לפני אימון התנהגותי. לאחר הטיפול, בעלי חיים הוצגו בתא הניסוי. המלצנו לתמרן בעלי חיים כדי להפוך חולדות למגורים לחוקר. - הצג את העכברוש לתא הניסיוני. טפל בו בעדינות על ידי בסיס זנבו והישם אותו באמצע התא. סגור את התא הניסיוני ודלתות התיבה המיוחכות.
- התחל את ההפעלה על-ידי לחיצה על לחצן הקלט. תן לעכברוש להסתגל לתא למשך 3 דקות. תקופה זו של 3 דקות היא התקן המומלץ על ידי יצרן הציוד ומשמשת כזמן בסיסי וזמן מגורים לתא.
- ספק 25 זיווגים (ניסויים) עם מרווח זמן בין-ניסיון (ITI) של 60 שניות, החל מדקה 3 של ההפעלה. הצג את הטון (גירוי מותנה – CS; 90 dB SPL, 2000 הרץ, 50-ms זמן עלייה) במהלך 10 s האחרון של כל ITI, ואת ההלם (גירוי ללא תנאי – ארה"ב) במהלך 2 s האחרונות של כל ITI.
הערה: הפעלת לחצן הקלט מותנית בכך שמצלמות מכוילות ונעולות כראוי. - הסר את העכברוש מהתא הניסיוני כאשר הפגישה של 28 דקות הסתיימה. להחזיר בעלי חיים לכלוב הבית בהתאמה. להעביר את החולדות בכלובים הביתיים שלהם מכוסה במטלית מחדר האימונים ההתנהגותי למתקן לטיפול בבעלי חיים.
- חזור על כיול מערכת זיהוי הקפאה (שלבים 3.1-3.5) ועל מיזוג פחד (שלבים 4.1 ו- 4.3) כדי לאמן את כל הנושאים.
הערה: אנו ממליצים בחום כייל מחדש של מערכת הזיהוי עבור כל בעל חיים כדי להבטיח שהתוכנה תשמור על אותם פרמטרים כאשר היא מעבדת מידע לזיהוי הקפאה. - תקופת מנוחה: במהלך תקופה זו, בעלי החיים נחים בנפרד בכלובים הביתיים שלהם. לפקח על המשקל של בעלי החיים פעמיים בשבוע במהלך 6 השבועות של תקופת הדגירה. לתמרן בעדינות כל בעל חיים במשך שתי דקות בזמן שהם משוקללים.
5. מבחן הקשר – הפעלה אחת של 10 דקות
- לאחר שלב האימון, לחשוף את בעלי החיים למבחן הזיכרון הראשון שנקרא מבחן הקשר. במהלך שלב זה של 10 דקות, לחשוף את החולדות לאותו הקשר שבו האימונים התקיימו אך לא להציג רמזים או זעזועים. להעביר את החולדות בכלובים הביתיים המכוסים שלהם (למשל, עם מטלית) ממתקן הטיפול בבעלי חיים לחדר האימונים ההתנהגותי. יש לזכור כי בעלי חיים חולקו לקבוצות, ולכן קבוצה אחת נבדקת 48 שעות לאחר שלב האימון והקבוצה השנייה נבחנת 6 שבועות לאחר האימון (ראה איור 1).
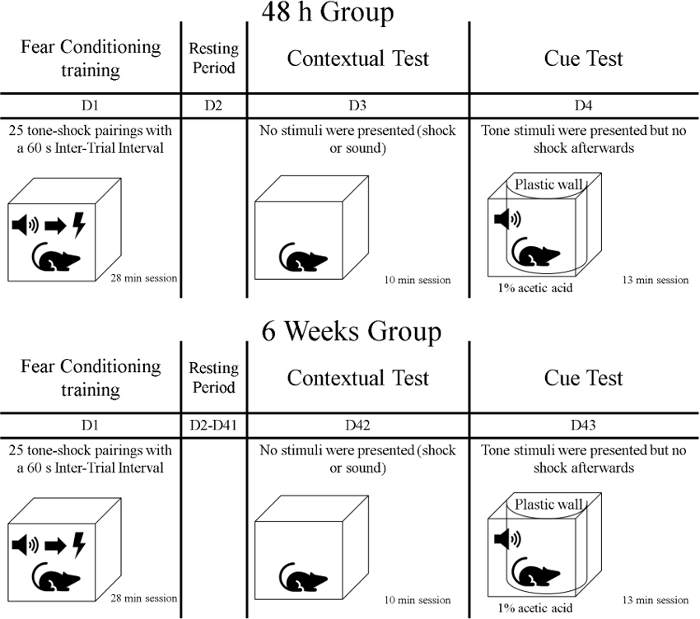
איור 1: ציר הזמן של הניסוי. לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.
- נקה את כל המשטחים הפנימיים של התא הניסיוני ואת רצפת הרשת מפלדת אל-חלד עם 10% אתנול. חזור על הפעולה לפני שתבדוק כל חיה.
- חזור על כיול מערכת זיהוי הקפאה (שלבים 3.1 עד 3.5). פתח את חלון הדו-שיח של הגדרת ניסוי וטען את הקובץ בשם "protocol.pro בדיקת הקשר", הזמין http://doi.org/10.17605/OSF.IO/4NKFQ.
הערה: קובץ זה מכיל את ההתקנה עבור שלב ניסיוני זה המורכב ללא זעזועים או גוונים. - הצג את החיה לתא הניסיוני. טפל בו בעדינות על ידי בסיס זנבו והישם אותו באמצע התא. סגור את התא הניסיוני ודלתות התיבה המיוחכות.
- התחל את ההפעלה על-ידי לחיצה על לחצן הקלט. במהלך אחד זה 10 דקות הקשר מבחן הפעלה, אין גירויים מוצגים (הלם אף קול).
- הסר את הנושא מהתא הניסיוני כאשר הפגישה של 10 דקות הסתיימה. החזירו את בעלי החיים לכלובים שלהם והעבירו את החולדות בכלובים הביתיים המכוסים שלהם מחדר האימונים ההתנהגותי למתקן לטיפול בבעלי חיים. חזור על שלבים 5.2-5.5 כדי לבדוק את כל הנבדקים.
6. מבחן Cue – יחיד 13 דקות מושב
- יום אחד לאחר בדיקת ההקשר, בעלי חיים לעבור את המבחן השני של זיכרון שנקרא מבחן cue. בשלב זה, החולדות יהיו בהקשר שונה של אימון במהלך 13 דקות; רמזים (גוונים) מוצגים, אך לא מועברים זעזועים. להעביר את החולדות בכלובים הביתיים שלהם מכוסה בכיסוי ממתקן טיפול בבעלי חיים לחדר האימונים ההתנהגותי. לבחון קבוצה 72 שעות לאחר אימון מיזוג הפחד, ולבדוק קבוצה אחרת 6 שבועות ויום אחד לאחר האימון(איור 1).
הערה: ניתן ליישם מערכת תחבורה שונה (ממתקן הטיפול בבעלי חיים לחדר הניסיוני) כדי להבדיל יותר את ההקשר ואת המבחנים. מאחר שבעלי החיים הועברו לאימון ולמבחן הקשר בכלובים הביתיים שלהם, ניתן להשתמש בכלוב תחבורה שונה, מצעים ו/או כיסוי במהלך ההסעות למפגש הבדיקה של הסימן. - נקה את כל המשטחים הפנימיים של התא הניסיוני ואת רצפת הרשת מפלדת אל-חלד עם 10% אתנול. חזור על הפעולה לפני שתבדוק כל חיה.
- כדי לשנות את ההקשר החזותי, הכנס את הקיר המקיף את הפלסטיק לתא הניסיוני.
- כדי לשנות הקשר חוש הריח, למרוח 1% חומצה אצטית על ספוגית כותנה קצה, ולמקם אותו במגש מתכת מתחת לרצפת הרשת17,18,19.
- חזור על כיול מערכת זיהוי ההקפאה (שלבים 3.1-3.5). טען את הקובץ בשם הקובץ "protocol.pro תותן" קובץ, הזמין http://doi.org/10.17605/OSF.IO/4NKFQ.
הערה: קובץ זה מכיל את ההתקנה עבור שלב ניסיוני זה, המורכב ממסירה של אותם גוונים המוצגים במהלך שלב האימון (CS), אך בהיעדר זעזועים (ארה"ב). - הצג את החיה לתא הניסיוני. טפל בו בעדינות על ידי בסיס זנבו והישם אותו באמצע התא. סגור את התא הניסיוני ודלתות התיבה המיוחכות.
- התחל את ההפעלה על-ידי לחיצה על לחצן הקלט. במהלך הבדיקה היחידה של 13 דקות, הגירוי של CS (טון) מוצג 10 פעמים, החל מדקה 3 של הפגישה.
הערה: 3 השעות הראשונות תואמות לקו הבסיס של הפעלה זו, ואחריהן 10 ניסויי בדיקת cue (כלשהם, 10 שניות כל אחד) שנמסרו עם ITIs של 50 s בהיעדר זעזועים. מסירת הגוונים היא אוטומטית, באמצעות הקובץ שנטען בעבר. - מוציאים את החיה מהתא הניסיוני כאשר הפגישה של 13 דקות נגמרת. החזר בעלי חיים לכלוב המתאימים והעביר אותם מכוסים למתקן לטיפול בבעלי חיים. חזור על שלבים 6.2 עד 6.5 כדי לבדוק את כל הנבדקים.
7. ניתוח נתונים
- השג את מדד הפעילות הכללית (כלומר, אינדקס תנועה) הנגזר מזרם הווידאו באמצעות תוכנת מערכת זיהוי ההקפאה. תוכנה זו משנה באופן אוטומטי את מדד התנועה כדי לספק את אחוז זמן ההקפאה בכל הפעלה ואת מספר פרקי ההקפאה. הגדר את סף ההקפאה להגדרת ברירת המחדל של משך ההקפאה המינימלי של המערכת (1 s = 30 מסגרות).
- השתמש בתוכנית הנוספת בהזמנה אישית (קובץ זמין http://doi.org/10.17605/OSF.IO/4NKFQ) כדי להשיג:
- השתמש בתוכנית כדי לקבוע את אחוז ההקפאה במהלך שלוש הדקות הראשונות של האימון (כלומר, הקפאה בסיסית, שכן לא הוצגו זעזועים או גוונים לפני או במהלך תקופה זו של 3 דקות) ובמהלך שלוש הדקות הראשונות של הבדיקה של הסימן.
- השתמש בתוכנית כדי לקבוע את אחוז ההקפאה עבור כל אחד משמונה 3 דקות פחים של האימון.
- השתמש בתוכנית כדי לקבוע את אחוז ההקפאה במהלך מצגות הסימן (כלומר, הקפאה במהלך הגוונים) ותקופות ללא תווים (מרווחי זמן בין-משפטיים; ITIs), הן לאימונים והן למבחנים.
- כדי להשיג נתונים אלה, פתח את תוכנת מערכת זיהוי ההקפאה.
- בחר קובץ | דוחות | סיכום רכיב אצווה.
- בחר את הקובץ עם סיומת . CMP זמין http://doi.org/10.17605/OSF.IO/4NKFQ.
- תן שם לקובץ הפלט ושנה את סף התנועה ל- 100. לאחר מכן, לחץ על אישור.
- בחר את הקבצים שיש לנתח (סיומת . RAW). קבצים אלה נוצרים באופן אוטומטי מהתוכנה של מערכת זיהוי הקפאה כאשר ההפעלה נגמרת ומתאימות לנתונים הגולמיים של כל הפעלה. בתחילה, הקבצים נשמרים בשולחן העבודה של המחשב, אך ניתן לאחסן אותם בתיקיה מותאמת אישית (לדוגמה, מיזוג מסמכים-פחד) כדי להקל על הזיהוי והפתיחה הבאים שלהם כאשר יש לנתח אותם.
- פתח את קבצי הפלט (סיומת . CSV). ניתן לערוך ם בתוכנה גיליון אלקטרוני לניתוח נוסף. קובץ זה מכיל את תוצאות ההקפאה במהלך ההפעלה הניסיונית.
הערה: כדי לקבל את האחוז הכולל של ההקפאה, חלק את הזמן שהנושא בילה ללא תנועה לאורך זמן ההפעלה הכולל. ניתן לחשב את מספר פרקי ההקפאה בספירה של מספר אירועי ההקפאה במהלך ההפעלה. בשני המקרים, יש להגדיר סף תנועה המבוסס על משך הקפאה מינימלי. זהו הקריטריון הזמני המגדיר אם פרק הקפאה נרשם. מערכות הקלטה אוטומטיות יכולות להשתמש בכמות מסוימת של מסגרות לשניה (fps) כמדד למשך הקפאה מינימלי. לדוגמה, עם קצב דגימה של 30 fps, משך הקפאה מינימלי של 15 מסגרות יתואם כהקפאה של מופע של חוסר ניידות להימשך 30 s.
- חשב את משך הזמן הממוצע של כל פרק הקפאה עבור כל הפעלה (אימון והן בדיקות, הקשר וסימן) על-ידי חלוקת משך ההקפאה הכולל (בשניות) על פני המספר הכולל של פרקי הקפאה.
תוצאות
וריאציות באחוז זמן ההקפאה בשלבים שונים של האימון נותחו עבור כל הנושאים (n = 12) באמצעות בדיקת t תלויה (טבלה 1). בעלי חיים היו פעילים וחקרו את התא הניסיוני במהלך שלוש הדקות הראשונות של האימון (היום הראשון של הפרוטוקול), זמן שבמהלכו לא נמסרו גוונים או זעזועים (כלומר, ק...
Discussion
פרוטוקול מיזוג הפחד המורחב הנוכחי הוא גישה יעילה ותקפה להערכת זיכרון רגשי בתקופות קצרות (48 שעות) ותקופות ארוכות טווח (6 שבועות). לפיכך, הפרוטוקול מאפשר ללמוד עודף על תופעות דגירה וחשש בחולדות. בין היתרונות השונים של פרוטוקול זה הם להלן. הוא מציע שני סוגים של בדיקות זיכרון, כלה הקשר וסימן, המא...
Disclosures
לסופרים אין מה לחשוף.
Acknowledgements
תמיכה כספית במחקר זה סופקה על ידי Fundación אוניברסיטת קונרד לורנץ - מענק מספר 9IN15151. המחברים רוצים להודות למחלקת התקשורת באוניברסיטת קונרד לורנץ על עזרתם בהקלטה ועריכה של הסרטון, במיוחד נטליה ריברה ואנדרס סראנו (מפיקים). כמו כן, ניקול פלר-סדובסקי ולוסיה מדינה על הערותיהם על כתב היד, וג'ואנה בררו, דיקן באוניברסיטת קורפורציה איבריאמריקנה, לשיתוף פעולה מוסדי. למחברים אין ניגודי עניינים.
Materials
| Name | Company | Catalog Number | Comments |
| Acetic acid (ethanoic acid) | https://pubchem.ncbi.nlm.nih.gov/compound/acetic_acid | ||
| Aversive Stimulation Current Package | MED Associates Inc | ENV-420 | https://www.med-associates.com/product-category/video-fear-packages-for-rat/ |
| Contextual test protocol.pro | http://doi.org/10.17605/OSF.IO/4NKFQ | ||
| Cue test protocol.pro | http://doi.org/10.17605/OSF.IO/4NKFQ | ||
| Curved Wall Insert | MED Associates Inc | VFC-008-CWI | https://www.med-associates.com/product-category/video-fear-packages-for-rat/ |
| Data processing.zip | http://doi.org/10.17605/OSF.IO/4NKFQ | ||
| NIR/White Light Control Box | MED Associates Inc | NIR-100 | |
| Quick Change Floor/Pan Unit for Mouse | MED Associates Inc | ENV-005FPU-M | https://www.med-associates.com/product-category/video-fear-packages-for-rat/ |
| Small Tabletop Cabinet and Power Supply | MED Associates Inc | SG-6080D | https://www.med-associates.com/product-category/video-fear-packages-for-rat/ |
| Standalone Aversive Stimulator/Scrambler (115 V / 60 Hz) | MED Associates Inc | ENV-414S | https://www.med-associates.com/product-category/video-fear-packages-for-rat/ |
| Standard Fear Conditioning Chamber | MED Associates Inc | VFC-008 | https://www.med-associates.com/product-category/video-fear-packages-for-rat/ |
| Training protocol VFC.pro | http://doi.org/10.17605/OSF.IO/4NKFQ | ||
| Video Fear Conditioning Package for Rat | MED Associates Inc | MED-VFC-SCT-R | https://www.med-associates.com/product-category/video-fear-packages-for-rat/ |
References
- Frankland, P. W., Bontempi, B. The organization of recent and remote memories. Nature Reviews Neuroscience. 6 (2), 119-130 (2005).
- Suzuki, A., Mukawa, T., Tsukagoshi, A., Frankland, P. W., Kida, S. Activation of LVGCCs and CB1 receptors required for destabilization of reactivated contextual fear memories. Learning & Memory. 15 (6), 426-433 (2008).
- Hermans, E. J., et al. How the amygdala affects emotional memory by altering brain network properties. Neurobiology of Learning and Memory. 112, 2-16 (2014).
- Moryś, J., Berdel, B., Jagalska-Majewska, H., ŁUczyńSka, A. The basolateral amygdaloid complex -its development, morphology and functions. Folia Morphologica. 58 (3), 29-46 (1998).
- LeDoux, J. E. Emotional memory systems in the brain. Behavioural Brain Research. 58 (1-2), 69-79 (1993).
- Labar, K. S. Beyond fear: Emotional memory mechanisms in the human brain. Current Directions in Psychological Science. 16 (4), 173-177 (2007).
- Izquierdo, I., Furini, C. R. G., Myskiw, J. C. Fear Memory. Physiological Reviews. 96 (2), 695-750 (2016).
- Maren, S. Overtraining Does Not Mitigate Contextual Fear Conditioning Deficits Produced by Neurotoxic Lesions of the Basolateral Amygdala. The Journal of Neuroscience. 18 (8), 3097-3097 (1998).
- Pickens, C. L., Golden, S. A., Nair, S. G. Incubation of fear. Current Protocols in Neuroscience. 64, (2013).
- Morrow, J. D., Saunders, B. T., Maren, S., Robinson, T. E. Sign-tracking to an appetitive cue predicts incubation of conditioned fear in rats. Behavioural Brain Research. 276, 59-66 (2015).
- Pickens, C. L., Golden, S. A., Adams-Deutsch, T., Nair, S. G., Shaham, Y. Long-lasting incubation of conditioned fear in rats. Biological Psychiatry. 65 (10), 881-886 (2009).
- Schaap, M. W. H., et al. Nociception and Conditioned Fear in Rats: Strains Matter. PLoS ONE. 8 (12), 83339 (2013).
- Shoji, H., Takao, K., Hattori, S., Miyakawa, T. Contextual and Cued Fear Conditioning Test Using a Video Analyzing System in Mice. Journal of Visualized Experiments. (85), e50871 (2014).
- Patel, T. P., et al. An open-source toolbox for automated phenotyping of mice in behavioral tasks. Frontiers in Behavioral Neuroscience. 8, 349 (2014).
- Kabra, M., Robie, A. A., Rivera-Alba, M., Branson, S., Branson, K. JAABA: Interactive machine learning for automatic annotation of animal behavior. Nature Methods. 10 (1), 64-67 (2013).
- Anagnostaras, S. G. Automated assessment of Pavlovian conditioned freezing and shock reactivity in mice using the VideoFreeze system. Frontiers in Behavioral Neuroscience. 4 (58), (2010).
- Moyer, J. R., Brown, T. H. Impaired Trace and Contextual Fear Conditioning in Aged Rats. Behavioral Neuroscience. 120 (3), 612-624 (2006).
- Schuette, S. R., Hobson, S. Conditioned contextual fear memory to assess natural forgetting and cognitive enhancement in rats. Journal of Biological Methods. 5 (3), 99 (2018).
- Chang, C. H., et al. Fear extinction in rodents. Current Protocols in Neuroscience. , (2009).
- Pickens, C. L., Golden, S. A., Nair, S. G. Incubation of fear. Current Protocols in Neuroscience. 64, 1-18 (2013).
- Izquierdo, I., Furini, C. R. G., Myskiw, J. C. Fear Memory. Physiological Reviews. 96 (2), 695-750 (2016).
- Vetere, G., et al. Chemogenetic Interrogation of a Brain-wide Fear Memory Network in Mice Article Chemogenetic Interrogation of a Brain-wide Fear Memory Network in Mice. Neuron. 94 (2), 363-374 (2017).
- Koob, G. F., Zimmer, A. Chapter 9 - Animal models of psychiatric disorders. Neurobiology of Psychiatric Disorders. 106, 137-166 (2012).
- Bourin, M. Animal models for screening anxiolytic-like drugs: a perspective. Dialogues in clinical neuroscience. 17 (3), 295-303 (2015).
- Murray, S. B., et al. Fear as a translational mechanism in the psychopathology of anorexia nervosa. Neuroscience & Biobehavioral Reviews. 95, 383-395 (2018).
- Pamplona, F. A., et al. Prolonged fear incubation leads to generalized avoidance behavior in mice. Journal of Psychiatric Research. 45 (3), 354-360 (2011).
- Török, B., Sipos, E., Pivac, N., Zelena, D. Modelling posttraumatic stress disorders in animals. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 90, 117-133 (2019).
- Bhakta, A., Gavini, K., Yang, E., Lyman-Henley, L., Parameshwaran, K. Chronic traumatic stress impairs memory in mice: Potential roles of acetylcholine, neuroinflammation and corticotropin releasing factor expression in the hippocampus. Behavioural Brain Research. 335, 32-40 (2017).
- Uniyal, A., et al. Pharmacological rewriting of fear memories: A beacon for post-traumatic stress disorder. European Journal of Pharmacology. , 172824 (2019).
- Barad, M. Fear extinction in rodents: basic insight to clinical promise. Current Opinion in Neurobiology. 15 (6), 710-715 (2005).
- Haaker, J., et al. Making translation work: Harmonizing cross-species methodology in the behavioural neuroscience of Pavlovian fear conditioning. Neuroscience & Biobehavioral Reviews. 107, 329-345 (2019).
- Heroux, N. A., Horgan, C. J., Pinizzotto, C. C., Rosen, J. B., Stanton, M. E. Medial prefrontal and ventral hippocampal contributions to incidental context learning and memory in adolescent rats. Neurobiology of Learning and Memory. 166, 107091 (2019).
- Rossi, M. A., Yin, H. H. Methods for Studying Habitual Behavior in Mice. Current Protocols in Neuroscience. 60 (1), 8-29 (2012).
- Brady, A. M., Floresco, S. B. Operant Procedures for Assessing Behavioral Flexibility in Rats. Journal of Visualized Experiments. (96), (2015).
- Zoccolan, D., Di Filippo, A. Methodological Approaches to the Behavioural Investigation of Visual Perception in Rodents. Handbook of Behavioral Neuroscience. , (2018).
- Lguensat, A., Bentefour, Y., Bennis, M., Ba-M'hamed, S., Garcia, R. Susceptibility and Resilience to PTSD-Like Symptoms in Mice Are Associated with Opposite Dendritic Changes in the Prelimbic and Infralimbic Cortices Following Trauma. Neuroscience. 418, 166-176 (2019).
- Li, Q., et al. N-Acetyl Serotonin Protects Neural Progenitor Cells Against Oxidative Stress-Induced Apoptosis and Improves Neurogenesis in Adult Mouse Hippocampus Following Traumatic Brain Injury. Journal of Molecular Neuroscience. 67 (4), 574-588 (2019).
- Pantoni, M. M., Carmack, S. A., Hammam, L., Anagnostaras, S. G. Dopamine and norepinephrine transporter inhibition for long-term fear memory enhancement. Behavioural Brain Research. 378 (112266), 112266 (2020).
- Smith, K. L., et al. Microglial cell hyper-ramification and neuronal dendritic spine loss in the hippocampus and medial prefrontal cortex in a mouse model of PTSD. Brain, Behavior, and Immunity. 80, 889-899 (2019).
- Liu, X., Zheng, X., Liu, Y., Du, X., Chen, Z. Effects of adaptation to handling on the circadian rhythmicity of blood solutes in Mongolian gerbils. Animal Models and Experimental. 2 (2), 127-131 (2019).
- Landgraf, D., McCarthy, M. J., Welsh, D. K. The role of the circadian clock in animal models of mood disorders. Behavioral Neuroscience. 128 (3), 344-359 (2014).
- Refinetti, R., Kenagy, G. J. Diurnally active rodents for laboratory research. Laboratory annimals. 52 (6), 577-587 (2018).
- Hurtado-Parrado, C., et al. Assessing Mongolian gerbil emotional behavior: effects of two shock intensities and response-independent shocks during an extended inhibitory-avoidance task. PeerJ. 5, (2017).
- Frey, P., Eng, S., Gavinf, W. Conditioned suppression in the gerbil. Behavior Research Methods & Instrumentation. 4 (5), 245-249 (1972).
- Woolley, M. L., Haman, M., Higgins, G. A., Ballard, T. M. Investigating the effect of bilateral amygdala lesions on fear conditioning and social interaction in the male Mongolian gerbil. Brain Research. 1078 (1), 151-158 (2006).
- Ballard, T. M., Sänger, S., Higgins, G. a Inhibition of shock-induced foot tapping behaviour in the gerbil by a tachykinin NK1 receptor antagonist. European Journal of Pharmacology. 412 (3), 255-264 (2001).
- Luyten, L., Schroyens, N., Hermans, D., Beckers, T. Parameter optimization for automated behavior assessment: plug-and-play or trial-and-error. Frontiers in Behavioral Neuroscience. 8 (28), (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved