A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الفحص الخاص بمثبطات بيروفوسفاتاسي الغشائية المربوطة بغشاء الثموغا
* These authors contributed equally
In This Article
Summary
هنا نقدم طريقه الفرز لبيروفوسفاتاسي الغشائية (من Thermotoga maritima) مثبطات استنادا إلى رد فعل الموليبدينوم الأزرق في شكل لوحه بشكل جيد 96.
Abstract
الاغشيه البركانية المرتبطة بالغشاء (mPPases) هي انزيمات ديميريكه تحدث في البكتيريا والنباتات والطفيليات. هذه البروتينات يلتصق بيروفوسفات في اثنين من جزيئات مقوم العظام, الذي يقترن مع البروتون و/أو أيون الصوديوم ضخ عبر الغشاء. منذ لا تحدث البروتينات المتماثلة في الكائنات والبشر ، mPPases هي المرشحين جيده في تصميم أهداف المخدرات المحتملة. هنا نقدم بروتوكول مفصل لفحص مثبطات mPPase باستخدام تفاعل الأزرق الموليبدينوم في 96 نظام لوحه جيدا. نحن نستخدم mPPase من بكتيريا thermophilic Thermotoga ماريتيما (tmppase) كانزيم نموذج. هذا البروتوكول بسيطه وغير مكلفه ، وتنتج نتيجة متسقة وقويه. يستغرق الأمر حوالي ساعة واحده فقط لإكمال بروتوكول فحص النشاط من بداية الفحص حتى قياس الامتصاص. وبما ان اللون الأزرق المنتج في هذا الفحص مستقر لفتره طويلة من الزمن ، يمكن اجراء المقايسة اللاحقة مباشره بعد الدفعة السابقة ، ويمكن قياس الامتصاص في وقت لاحق لجميع الدفعات دفعه واحده. العيب في هذا البروتوكول هو ان يتم ذلك يدويا ، التالي يمكن ان تكون مرهقه ، فضلا عن تتطلب مهارات جيده من التنضيد وحفظ الوقت. وعلاوة علي ذلك ، فان محلول ارسينيت سيترات المستخدم في هذا الفحص يحتوي علي ارسينيت الصوديوم ، وهو سام وينبغي التعامل معه بالاحتياطات اللازمة.
Introduction
ما يقرب من 25 ٪ من مجموع البروتينات الخلوية هي البروتينات غشاء وحوالي 60 ٪ منهم المخدرات الأهداف1،2. واحده من الأهداف المخدرات المحتملة3, الغشاء المتجهة بيروفوسفواسات (mppases), هي الانزيمات الديميريكه التي ضخ البروتون و/أو أيون الصوديوم عبر الغشاء عن طريق التحلل من بيروفوسفات في اثنين من تقويم العظام4. ويمكن العثور علي mPPases في الكائنات الحية المختلفة5 مثل البكتيريا ، والنباتات ، والطفيليات التقدمية ، باستثناء البشر والحيوانية4. في الطفيليات التقدمية ، علي سبيل المثال منجلي البلازما ، الغدد التناسلية الطفيلية والمكورات الفطرية، mppases ضرورية لطفيل الطفيليات6 والضربة القاضية لهذا التعبير في الطفيليات تؤدي إلى الفشل في الحفاظ علي درجه الحموضة داخل الخلايا عند التعرض لph الأساسي الخارجي7. نظرا لأهميتها وعدم وجود البروتين المتماثل الموجودة في الفقاريات ، ويمكن اعتبار mPPases كاهداف المخدرات المحتملة للامراض protistal3.
ويستند الفحص في المختبر من مثبطات mPPase في هذا العمل علي نظام نموذج TmPPase. TmPPase هو ضخ أيون الصوديوم وأيون البوتاسيوم تعتمد mPPase من t. maritima ولها النشاط الأمثل في 71 درجه مئوية8. فوائد هذا الانزيم هي علي سبيل المثال سهوله في الإنتاج والتنقية ، والاستقرار الحراري الجيد والنشاط النوعي العالي. ويظهر tmppase كلا من التشابه العالي بالاضافه إلى الحفظ الكامل للموقف ، فضلا عن هويه جميع البقايا الحفازه للبروست mppases3،9 والي هيكل محلوله من فيجنا رادياتا10 mppases. الهياكل المتاحة من TmPPase في التشكيلات المختلفة هي أيضا مفيده لتجربه تصميم المخدرات علي أساس الهيكل (كما الفحص الظاهري وتصميم دي نوفو).
هنا نقوم بالإبلاغ عن بروتوكول مفصل لفحص مثبطات TmPPase في شكل لوحه بشكل جيد 96 (الشكل 1). ويستند البروتوكول علي الأسلوب اللوني للتفاعل الأزرق الموليبدينوم ، الذي وضعت لأول مره من قبل فيش و Subbarow11. يتضمن هذا أسلوب التشكيل من [12-فوسموولبديك] حامض من [ثونوفوسفات] و موليبدات تحت شروط حامضيه, اي يكون بعد ذلك قللت ان يعطي مميزه [بلو-لون] فوسفوموليبدينوم نوع12.
Protocol
1. اعداد البروتين
ملاحظه: تم وصف التعبير وتنقيه TmPPase في مكان آخر13.
- اعداد 10 مل من حل أعاده التنشيط العازلة التي تحتوي علي 20 مم 2-(ن-مورتولينو) حمض اثانيسولفونيك (MES) pH 6.5 ، 3.5 ٪ (v/v) الجلسرين ، 2 مم ديثيوثريتول (dtt) ، و 0.05 ٪ دوديسيل مالتوسيدي (DDM).
- اعداد 10 مل من خليط التفاعل التي تحتوي علي 200 مم تريس-Cl الأس الهيدروجيني 8.0 ، 8.0 mM MgCl2، 333 Mm kcl ، و 67 Mm nacl.
ملاحظه: Mg2 + مطلوب لمخلب بيروفوسفات كما الركيزة من Mppase ،K + مطلوب لزيادة نشاط الانزيم كما Tmppase هو mppase تعتمد البوتاسيوم ، وهناك حاجه إلىNa + لنشاط الانزيم خلال نقل أيون الصوديوم من قبل tmppase. - اعداد 30 ملغ/مل الدهنية لأعاده تنشيط الانزيم.
- أضافه 10 مل من 20 مم تريس-HCl pH 8.0 مع 1 مم DTT إلى 0.3 غرام من L-α-فوسفاتيديلتشوليني من فول الصويا إلى 10 مل من 20 مم تريس-HCl pH 8.0 مع 1 مم DTT.
- وضع الشحمية علي الجليد ، والنسخ مع 1 الفاصل الزمني نبض ثانيه لمده 1 دقيقه ، وقفه لمده 1 دقيقه ، وكرر حتى يصبح الحل الأصفر الشفاف.
- Aliquot الدهنية ، وتجميد في النيتروجين السائل وتخزين في-80 درجه مئوية حتى تستخدم.
- أعاده تنشيط الانزيم.
- مزيج 40 μL من محلول الشحمية مع 22.5 μL من 20 ٪ DDM.
- سخني الخليط عند 55 درجه مئوية لمده 15 دقيقه واتركيه يبرد إلى درجه حرارة الغرفة.
- أضافه 36.5 μL من حل المخزن المؤقت أعاده التنشيط ، مزيج ، وأضافه 1 μL من البروتين المركز (13 ملغ/مل) لجعل تركيز إجمالي من 0.13 ملغ/مل.
ملاحظه: عاده ما يتم تجميد البروتين في 10 μL علي الارصفه بعد التنقية وأذابه علي الثلج قبل الاستخدام.
- خذ 20 μL من الانزيم المعاد تنشيطه وأضف إلى 1,480 μL من خليط التفاعل ، ثم اخلط برفق.
ملاحظه: يجب ان يتم أضافه الانزيم المعاد تنشيطه إلى خليط التفاعل قبل استخدامه مباشره.
2-التحضير المركب
- حل المركبات في سولفوكيد ثنائي الميثيل (DMSO) لجعل حلول الأسهم من 25 − 100 ملم في 50 − 200 μL ، استنادا إلى توافر المركبات.
ملاحظه: جميع المركبات المستخدمة هنا (الشكل 2ا) قد نشرت سابقا9. إذا كان الذوبان المركب منخفضا ، يمكن تعديل تركيز المخزون وفقا لذلك. - اعداد ثلاثه تركيزات مختلفه من كل مجمع في الماء.
ملاحظه: ستكون التركيزات النهائية في خليط التفاعل 1 و 5 و 50 ميكرومولار أو 1 و 5 و 20 ميكرومولار للمركبات القابلة للذوبان والقابلة للذوبان لماما ، علي التوالي.- تمييع حل الأسهم مع الماء إلى 1 مل في ميكروانبوبي لإعطاء 2 μM ، 10 μM و 100 μM للمركبات القابلة للذوبان ، أو بدلا من 2 μM ، 10 μM و 40 μM للمركبات القابلة للذوبان لماما.
- دوامه الحل المركب علي الفور بعد تخفيف الحل الأسهم لخلط السليم.
- تحقق من وجود تجميع مركب باستخدام مقياس الكلية.
ملاحظه: وقد درس هذا كما تريبليكاتيس في ثلاثه تركيزات (1 μm ، 5 μm و 20 μm) وتطبيعها إلى فارغه في لوحه 96 جيدا.- الاستغناء عن 75 μL من خليط التفاعل في كل بئر باستخدام ماصه متعددة القناات.
- أضافه 75 μL من كل مركب (للفارغة ، استخدم 75 μL من الماء بدلا من ذلك) وتخلط بواسطة الأنابيب صعودا وهبوطا 5 ×.
- قياس كل بئر في 300 V باستخدام مقياس الكلية ميكروبلايت.
3. الكواشف لاعداد الفحص
- اعداد الحل ارنيت سترات.
- تزن 5 غ من ارنيت الصوديوم و 5 غ من سترات ثلاثية الصوديوم ثنائي الهيدرات.
تحذير: ارسينيت الصوديوم سامه ، التالي استخدام معدات الحماية المناسبة والتعامل مع الرعاية الخاصة. كاجراء احترازي ، لا تعالج قبل ان يتم قراءه جميع احتياطات السلامة اللازمة وفهمها. التعامل فقط في غطاء الدخان من أجل عدم استنشاق الغبار/أبخره من المجمع أو حلها (ق). إذا استنشقت ، انتقل إلى الهواء النقي والحصول علي الرعاية الطبية. ارتداء نظارات السلامة الكيميائية المناسبة ، وقفازات واقيه والملابس لتجنب ابتلاع والعين/الجلد الاتصال. إذا ابتلع ، اتصل فورا مركز السموم أو الطبيب/الطبيب. إذا كان يحصل علي الجلد أو في العين (ق) ، يغسل مع الكثير من الماء والحصول علي الرعاية الطبية. - تذوب في 100 مل من الماء.
- أضافه 5 مل من حمض الخليك الجليدية ، ومزيج ، وأضافه الماء إلى 250 مل.
- يحفظ في درجه حرارة الغرفة المحمية من الضوء.
ملاحظه: الحل مستقر لأكثر من سنه.
- تزن 5 غ من ارنيت الصوديوم و 5 غ من سترات ثلاثية الصوديوم ثنائي الهيدرات.
- اعداد الحل الف والحل باء.
- للحل A ، أضافه 10 مل من الثلج البارد 0.5 M HCl إلى 0.3 غرام من حمض الاسكوربيك. حل حمض الاسكوربيك عن طريق vortexing.
- للحل ب ، أضف 1 مل من الماء البارد المثلج إلى 70 ملغ من الأمونيوم الرباعي الهيدرات والدوامة لأذابه.
ملاحظه: تخزين كلا الحلين علي الجليد حتى الاستخدام. لاتساق نتيجة الفحص ، يمكن تخزين كلا الحلين علي الجليد لمده أقصاها أسبوع واحد.
- اعداد الفوسفات (Pi) القياسية مع تركيز 0 μm ، 62.5 μm ، 250 μm و 500 μm للمعايرة.
- أضافه 0 μl ، 25 μl ، 50 μl ، و 100 μl من 5 مم Na2hpo4 هيدرات إلى أربعه ميكروانابيب تحتوي علي 370 μl من خليط التفاعل.
- اعلي إلى 1 مل مع الماء.
4. فحص النشاط للوحه جيدا 1 96
ملاحظه: انظر الشكل 1 لسير العمل التخطيطي لمقايسة.
- أضافه 1 مل من الحل B إلى 10 مل من الحل A ، مزيج من vortexing وتخزين الحل علي الجليد.
ملاحظه: يجب ان يكون هذا الحل شفافة والأصفر. الحفاظ علي الحل الف + ب علي الجليد لمده 30 دقيقه علي الأقل قبل الاستخدام. ومع ذلك ، استخدم الحل في غضون 3 ساعات لأنها سوف تذهب سيئه بعد التخزين علي المدى الطويل. - أضافه 40 μL من 0 μM ، 62.5 μM ، 250 μM و 500 μM Pi القياسية إلى شرائط أنبوب في ثلاث نسخ باستخدام ماصه متعددة القناات.
ملاحظه: سيتم استخدام خليط التفاعل معلا P المضافة كفارغه. - أضف 25 μL من المحلول المركب إلى شرائط الأنبوب باستخدام ماصه متعددة القناات.
ملاحظه: كل مركب لديه ثلاثه تركيزات مختلفه في ثلاثي النسخ الذي يكفي للتقدير الاولي للتركيز المثبطة القصوى نصف (IC50). لتحديد50 IC أكثر دقه ، يمكن استخدام ثمانيه تركيزات مركبه مختلفه. يستعاض عن الانزيم غير المثبط بالمحلول المركب بكميه متساوية من الماء. واستخدمت الضوابط الايجابيه 2.5 μM ، 25 μM ، و 250 μM من الصوديوم ايميدديفوسفات (المشردين داخليا) الملح. - أضافه 15 μL من مزيج محلول mPPase إلى شرائط أنبوب (باستثناء الأنابيب التي تحتوي علي Pi القياسية) باستخدام ماصه متعددة القناات.
- ختم شرائط أنبوب مع ورقه ختم لاصقه. قطع ورقه الختم لفصل كل شريط أنبوب.
- قبل احتضان عينات لمده 5 دقائق في 71 درجه مئوية. وضع العينات علي كتله التدفئة مع الفاصل الزمني 20 s بين كل قطاع من أجل تقليل استهلاك الوقت خلال الخطوات اللاحقة.
- لكل قطاع ، وفتح الختم لاصقه. أضافه 10 μl من 2 ملليمتر بيروفوسفات الصوديوم ثنائي فوسفات باستخدام ماصه متعددة القناات وتخلط بالأنابيب صعودا وهبوطا ل 5 ×. ختم شريط أنبوب مره أخرى باستخدام نفس الختم.
ملاحظه: قد تكون هذه الخطوة في البداية من الصعب إنجاز في 20 ثانيه; ومع ذلك ، فانه سيصبح أسهل بعد بعض المقايسات. - احتضان في 71 درجه مئوية لمده 5 دقائق.
- وضع العينات علي جهاز التبريد مع الفاصل الزمني 20 s بين كل قطاع. السماح لهم بارد لمده 10 دقيقه ولكن الطرد المركزي كل قطاع لفتره وجيزة بعد 5 دقائق من التبريد ، لقطرات الماء صب تحت ورقه الختم ، ثم وضعها مره أخرى إلى جهاز التبريد وأزاله الختم.
ملاحظه: يمكن ببساطه ان يتم جهاز التبريد عن طريق وضع لوحه PCR جيدا 96 علي طبق بيتري بتري (حجم 150 مم × 15 ملم) مليئه بالماء والمجمدة لمده 1 ساعة علي الأقل. يجب إخراج الجهاز من الفريزر حوالي 5 دقائق قبل بداية الفحص. لا تاخذ خارج جهاز التبريد الحق قبل التبريد عينه لأنها سوف تجمد خليط التفاعل وتعيق تطوير اللون. - بعد 10 دقيقه من التبريد ، أضافه 60 μL من الحل ا + ب ، ومزيج من الأنابيب صعودا وهبوطا ل 5 × والحفاظ علي شرائط أنبوب علي جهاز التبريد لمده 10 دقيقه.
- أضافه 90 μL من المحلول ارسينيت سيترات والحفاظ علي درجه حرارة الغرفة لمده لا تقل عن 30 دقيقه لإنتاج اللون الأزرق مستقره.
تحذير: نظرا لسميه يجب التعامل مع جميع الحلول التي تحتوي علي ارنيت الصوديوم مع رعاية اضافيه في كل وقت. التالي ، ينبغي ان يتم أضافه محلول ارسينيت سترات في غطاء الدخان. - الاستغناء عن 180 μL من كل خليط التفاعل في واضحة 96 البوليسترين ميكروبلايت.
- قياس الامتصاص من كل بئر في 860 nm باستخدام مقياس طيفي ميكروبلايت.
5-تحليل النتائج
- متوسط الثلاثيات من كل عينه ومعايير Pi . ثم طرح مع فارغه للقضاء علي اشاره الخلفية.
- جعل منحني المعايرة عن طريق رسم الامتصاص (A860) القيم مقابل مقدار Pi القياسية (nmol) واجراء انحدار خطي للحصول علي داله خط الاتجاه باستخدام الصيغة التالية:
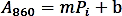
- احسب كميه الفوسفات (nmol) التي تم إطلاقها من التفاعل الانزيمي استنادا إلى صيغه الانحدار الخطي أعلاه.
- حساب النشاط المحدد باستخدام الصيغة التالية:

حيث nPانا هو كميه من الفوسفات المفرج عنه من رد الفعل (nmol) ، t هو وقت رد الفعل (دقيقه) ، و mtmppase هو كميه من tmppase النقي المستخدمة في الفحص (مغ). - احسب نشاط النسبة المئوية لكل تركيز مثبط باستخدام الصيغة التالية:

حيث saالأولsالنشاط محدده من عينه مع المثبط و saun هو النشاط المحدد للعينه غير ماهول. - حساب منطق50 (تقدير) و IC50 (تقدير) مع الانحدار غير الخطية تناسب من منحني الجرعة الاربعه المعلمة باستخدام الصيغة التالية:
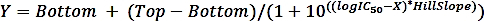
حيث X هو سجل التركيز (μM) ، Y هو النشاط (٪) ، اعلي وأسفل هي الهضاب في نفس الوحدة كما Y (100 ٪ و 0 ٪ ، علي التوالي) ، المنطق50 لديه نفس وحدات السجل كما x ، و هيلميل = عامل الانحدار أو منحدر التل ، والذي هو unitless.
ملاحظه: يتم استخدام البرنامج (جدول المواد) لتركيب. استخدام تركيز 0.01 μM (بدلا من 0.00 μM) للعينه دون مثبطات كما لم يتم تعريف لوغاريتم الصفر.
النتائج
وفي هذا البروتوكول ، تم اختبار ثماني مركبات (1 − 8) (الشكل 2 ا) مع المشردين داخليا ، وهو مثبط شائع للفوسفازات البركانية ، كعنصر تحكم إيجابي. تم اختبار كل مجمع في ثلاثه تركيزات مختلفه (1 μM ، 5 μM و 20 μM) في ثلاثي النسخ. ويصور سير العمل في الفحص في الشكل 1، بدءا من اعدا...
Discussion
هنا نحن الإبلاغ عن بروتوكول مفصل لفحص بسيط من مثبطات لبيروفوسفاتاسي الغشاء المرتبطة من t. maritima في شكل لوحه جيدا 96 استنادا إلى Vidilaseris وآخرون14. هذا البروتوكول غير مكلفه واستنادا إلى حمض 12 فوسفوميوليبديك ، الذي يتكون من الفوسفات والموليبدات في ظل الظروف الحمضية وخفضت إلى فو?...
Disclosures
وليس لدي المؤلفين ما يفصحون عنه.
Acknowledgements
وكان هذا العمل مدعوما بالمنح المقدمة من مؤسسه جين واياتوس ايركو و BBSRC (BB/M021610) إلى أدريان غولدمان ، اكاديميه فنلندا (رقم 308105) إلى كيني فيدياسريس ، (رقم 310297) إلى هنري اكسارد ، و (رقم 265481) إلى جاري لي-كاوهالوما ، واليي جامعه هلسنكي للبحوث المالية إلى غوستاف بويجي اف جينناس (). ويشكر المؤلفون برناديت جهل علي مساعدتها الفنية خلال المشروع.
Materials
| Name | Company | Catalog Number | Comments |
| Adhesive sealing sheet | Thermo Scientific | AB0558 | |
| Ammonium heptamolybdate tetrahydrate | Merck | F1412481 636 | |
| Ascorbic acid | Sigma-Aldrich | 95212-250G | |
| BioLite 96Well Multidish | Thermo Scientific | 130188 | |
| Dimethyl sulfoxide (DMSO) | Merck | 1167431000 | |
| 8-well PCR Tube Strips 0.2 ml without caps (120) | Nippon genetics | FG-028 | |
| Dodecyl maltoside (DDM) | Melford | B2010-100G | |
| Ethanol | Merck | 1009901001 | |
| Glacial acetic acid | Merck | 1000631011 | |
| Hydrochloric acid | Sigma-Aldrich | 258148-500ML | |
| Imidodiphosphate sodium salt | Sigma-Aldrich | I0631-1G | |
| L-α-Phosphatidyl choline from soybean lecithin | Sigma | 429415-100GM | |
| Magnesium chloride | Sigma-Aldrich | 8147330500 | |
| Multiplate 96-Well PCR Plates | Bio-Rad | MLL9651 | |
| MultiSkan Go | Thermo Scientific | 10680879 | |
| Nepheloskan Ascent (Type 750) | Labsystems | ||
| Polystyrene Petri dish (size 150 mm x 15 mm) | Sigma-Aldrich | P5981-100EA | |
| Potassium chloride | Merck | 104936 | |
| Prism 6 software | GraphPad | ||
| QBT2 Heating block | Grant Instruments | ||
| Sodium meta-arsenite | Fisher Chemical | 12897692 | |
| Sodium phosphate dibasic (Pi) | Sigma | S0876-1KG | |
| Sodium pyrophosphate dibasic | Fluka | 71501-100G | |
| Trisodium citrate dihydrate | Fluka | 71404-1KG |
References
- Terstappen, G. C., Reggiani, A. In silico research in drug discovery. Trends in Pharmacological Sciences. 22 (1), 23-26 (2001).
- Rask-Andersen, M., Almen, M. S., Schioth, H. B. Trends in the exploitation of novel drug targets. Nature Reviews Drug Discovery. 10 (8), 579-590 (2011).
- Shah, N. R., Vidilaseris, K., Xhaard, H., Goldman, A. Integral membrane pyrophosphatases: a novel drug target for human pathogens. AIMS Biophysics. 3 (1), 171-194 (2016).
- Baykov, A. A., Malinen, A. M., Luoto, H. H., Lahti, R. Pyrophosphate-Fueled Na+ and H+ Transport in Prokaryotes. Microbiology and Molecular Biology Reviews. 77 (2), 267-276 (2013).
- Serrano, A., Perez-Castineira, J. R., Baltscheffsky, M., Baltscheffsky, H. H+-PPases: yesterday, today and tomorrow. IUBMB Life. 59 (2), 76-83 (2007).
- Liu, J., et al. A vacuolar-H+-pyrophosphatase (TgVP1) is required for microneme secretion, host cell invasion, and extracellular survival of Toxoplasma gondii. Molecular Microbiology. 93 (4), 698-712 (2014).
- Lemercier, G., et al. A pyrophosphatase regulating polyphosphate metabolism in acidocalcisomes is essential for Trypanosoma brucei virulence in mice. Journal of Biological Chemistry. 279 (5), 3420-3425 (2004).
- Belogurov, G. A., et al. Membrane-bound pyrophosphatase of Thermotoga maritima requires sodium for activity. Biochemistry. 44 (6), 2088-2096 (2005).
- Vidilaseris, K., et al. Asymmetry in catalysis by Thermotoga maritima membrane-bound pyrophosphatase demonstrated by a nonphosphorus allosteric inhibitor. Science Advances. 5 (5), (2019).
- Lin, S. M., et al. Crystal structure of a membrane-embedded H+-translocating pyrophosphatase. Nature. 484 (7394), 399-403 (2012).
- Fiske, C. H., Subbarow, Y. The colorimetric determination of phosphorus. Journal of Biological Chemistry. 66 (2), 375-400 (1925).
- Nagul, E. A., McKelvie, I. D., Worsfold, P., Kolev, S. D. The molybdenum blue reaction for the determination of orthophosphate revisited: Opening the black box. Analytica Chimica Acta. 890, 60-82 (2015).
- Kellosalo, J., Kajander, T., Palmgren, M. G., Lopez-Marques, R. L., Goldman, A. Heterologous expression and purification of membrane-bound pyrophosphatases. Protein Expression and Purification. 79 (1), 25-34 (2011).
- Vidilaseris, K., Kellosalo, J., Goldman, A. A high-throughput method for orthophosphate determination of thermostable membrane-bound pyrophosphatase activity. Analytical Methods. 10 (6), 646-651 (2018).
- He, Z. Q., Honeycutt, C. W. A modified molybdenum blue method for orthophosphate determination suitable for investigating enzymatic hydrolysis of organic phosphates. Communications in Soil Science and Plant Analysis. 36 (9-10), 1373-1383 (2005).
- Martin, B., Pallen, C. J., Wang, J. H., Graves, D. J. Use of fluorinated tyrosine phosphates to probe the substrate specificity of the low molecular weight phosphatase activity of calcineurin. Journal of Biological Chemistry. 260 (28), 14932-14937 (1985).
- Strauss, J., Wilkinson, C., Vidilaseris, K., Harborne, S. P. D., Goldman, A. A simple strategy to determine the dependence of membrane-bound pyrophosphatases on K+ as a cofactor. Methods in Enzymology. 607, 131-156 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved