Method Article
رواية سترومال ليفيبليوم-تعديل 3D نموذج الورم كرويويد لدراسة الورم ستروما التفاعل واكتشاف المخدرات
In This Article
Summary
يتم تأسيس نموذج كروي ثلاثي الأبعاد جديد يستند إلى التفاعل الهيتيريبيك من الخلايا السرطانية والخلايا الليفية المترالية. هنا ، نقدم الاستزراع المشترك للخلايا السرطانية والخلايا الليفية المترفية ، والتصوير الفاصل الزمني ، والمجهر المعالبؤر لتصور تشكيل الكرويدات. هذا النموذج ثلاثي الأبعاد يوفر منصة ذات الصلة لدراسة التفاعلات الورم ستروما واختبار علاجات السرطان.
Abstract
تلعب تفاعلات الورم وستروما دورًا مهمًا في تطور السرطان. نماذج الورم ثلاثيالأبعاد (3D) الكروية هي النموذج الأكثر استخداما في المختبر في دراسة سرطان الجذعية / الخلايا البادئة، وبحوث السرطان قبل السريرية، وفحص المخدرات. النماذج الكروية ثلاثية الأبعاد متفوقة على ثقافة خلايا الورم التقليدية وتتكاثر بعض الشخصيات الهامة للأورام الصلبة الحقيقية. ومع ذلك ، تتكون كرويدات الورم ثلاثية الأبعاد التقليدية حصريًا من الخلايا السرطانية. أنها تفتقر إلى مشاركة الخلايا الترمفية ولديها ما يكفي من المصفوفة خارج الخلية (ECM) ترسب, وبالتالي تحاكي جزئيا فقط في ظروف الجسم الحي من أنسجة الورم. أنشأنا نموذج جديد متعدد الخلايا كروية 3D تتألف من الخلايا السرطانية والخلايا الليفية سترومال الذي يحاكي أفضل في البيئة الدقيقة الورم غير المتجانسة وdesmoplasia الأصلي. يتم تنظيم تشكيل الكرويدات بشكل صارم من قبل الخلايا الليفية المترفية الورم ية ويتم تحديدها من خلال نشاط بعض مسارات الإشارات الحاسمة داخل الخلايا (على سبيل المثال ، إشارات الشق) في الخلايا الليفية المترالية. في هذه المقالة ، نقدم تقنيات الزراعة المشتركة للخلايا السرطانية الليفية المترفية ، والتصوير الفاصل الزمني لتصور تفاعلات الخلية ، والمجهر المعالبؤر لعرض الميزات المعمارية ثلاثية الأبعاد للكرويدات. نعرض أيضا مثالين للتطبيق العملي لهذا النموذج كروي 3D. هذا النموذج الجديد متعدد الخلايا كروية 3D يقدم منصة مفيدة لدراسة التفاعل الورم ستروما, توضيح كيفية الخلايا الليفية سترومال تنظيم سرطان الجذعية / الخلايا البادئة, التي تحدد تطور الورم والعدوانية, واستكشاف تورط رد فعل سترومال في حساسية المخدرات السرطان والمقاومة. ويمكن لهذه المنصة أيضا أن تكون نموذجا في المختبر لاكتشاف المخدرات.
Introduction
تمثل الأورام الصلبة الأنسجة المعقدة المكونة من خلايا الأورام وتشكيلة كبيرة من الخلايا المترالية1،2،3،4. الخلايا الليفية المترالية، أو الخلايا الليفية المرتبطة بالسرطان (CAF)، هي واحدة من مجموعات الخلايا المترالية البارزة في معظم أنواع الأورام الصلبة. وهم يشاركون بشكل حاسم في تنظيم نمو الورم، الجذعية، الانبثاث، تولد الأوعية، ومقاومة الأدوية من خلال إنتاج عوامل النمو، السيتوكينات / chemokines، توليف ECM وإعادة عرض الإنزيمات (على سبيل المثال، الكولاجين، ليفينكتين، ومصفوفة metalloproteases)، والإفراج عن exosomes، والتفاعل المباشر خلية heterotypic5،6،7،8،9،10،11 . CAF أيضا المشاركة في تحديد الانبثاث الجهاز السرطان يُحدد عن طريق التحديد المسبق مجموعة فرعية من المستنسخين الورم من مجموعات خلايا الورم غير متجانسة في الآفة الأولية وتعزيز هذه المستنسخات المختارة لتكون مهيأة للانبثاث إلى جهاز بعيد محدد بيئة دقيقة هو الأمثل لإعادة استعمار استنساخ مختارة12. وعلاوة على ذلك، الخلايا الليفية والعوامل القابلة للذوبان يفرز وECM المشاركة في تعديل تولد الأوعية الورم13،14،المضادة للورم الاستجابة المناعية15،وتشارك حتى في مقاومة المخدرات وتكرار الورم16،17.
في المختبر 3D نماذج الورم كرويتم تطويرها واستخدامها في أبحاث السرطان كنموذج وسيط بين الخلايا السرطانية في المختبر وفي نماذج الورم في الجسم الحي18،19،20،21. اكتسبت نماذج الورم ثلاثي الأبعاد شعبية في أبحاث الخلايا الجذعية السرطانية ، وأبحاث السرطان قبل السريرية ، وفحص الأدوية لأن هذه النماذج تستنسخ بعض الميزات الهامة للأورام الحقيقية التي لا توجد في الطبقات الأحادية التقليدية2D 22. العديد من النماذج الموجودة 3D الورم كرويتشكل فقط من الخلايا السرطانية وتفتقر إلى مشاركة الخلايا السرطانية. وهذا غالبا ما يؤدي إلى ورم كرويات وجود ترسب ECM غير كافية وعدم وجود تفاعلات الخلايا الهيتيريبيك. قد تكون الكرويدات ثلاثية الأبعاد التقليدية التي تشكلها الخلايا السرطانية والتصاق الخلايا المتجانسة جزئيًا فقط في ظروف أنسجة الورم في الجسم الحي. للتغلب على بعض هذه القيود، اقترح المحققون دمج أنواع متعددة من الخلايا السترومال في الثقافات المشتركة 3D وطوروا العديد من نماذج الورم ثلاثي الأبعاد ثلاثي ة الأبعاد23،24،25،26. وبالإضافة إلى ذلك، استخدم المحققون مصفوفات ثلاثية الأبعاد خارجية، بما في ذلك الهيدروجيلات الطبيعية أوالبوليمرات الاصطناعية مثل غليكول البولي إيثيلين، والبولي (لاكتيد- كو-جليكوليد)، وبولي (N-isopropylacrylamide)، لتضمين نماذج كروية أحادية الخلية ومتعددةالخلايا،وخلق بيئة داعمة للخلايا وإعادة إنتاج التفاعلات الخلية مصفوفة28،29،مما يجعل هذه النظم أكثر أهمية بيولوجيا. ومع ذلك ، فإن دمج أنواع معينة من الخلايا السترومال ، مثل الخلايا البطانية ، في الثقافات المشتركة ثلاثية الأبعاد يجلب تعقيدًا إضافيًا لنظام المختبر ويجعل من الصعب دراسة تفاعلات الخلايا الهيتيرية بين نوعين محددين من الخلايا ، مثل تفاعلات الخلايا الليفية السرطانية. وعلاوة على ذلك، الخلايا البطانة في الأنسجة الحقيقية لا تتفاعل دائما مباشرة مع الخلايا السرطانية وغيرها من الخلايا سترومال لأن هناك طبقة من غشاء الطابق السفلي ملفوفة خارج الشعيرات الدموية التي تمنع الخلايا البطانة من التفاعل مباشرة مع الخلايا السرطانية وغيرها من الخلايا السترومال. في تلك النماذج الكروية ثلاثية الأبعاد ، لا تشكل الخلايا البُنالتية المدمجة في الواقع أوعية دموية ، ولكنها تتفاعل مباشرة مع الخلايا السرطانية والخلايا السترومالية الأخرى ، وهو أمر نادر الحدوث في الجسم الحي. وبالمثل، فإن المصفوفات الخارجية المستخدمة في بعض النماذج الكروية ثلاثية الأبعاد ليست مطابقة لـ ECM في أنسجة الورم الحقيقية من حيث الهيكل والتكوين. كل هذه الشروط الاصطناعية قد تؤدي إلى بيانات مضللة.
لقد أنشأنا مؤخرًا نموذجًا كرويًا ثلاثي الخلايا متعدد الخلايا يتكون من الخلايا السرطانية وCAF. في نموذجنا ، يتم تحديد تكوين كرويدات الورم ثلاثية الأبعاد تمامًا من قبل CAF. CAF حث وتنظيم النمط الظاهري للورم الجذعية / الخلايا البادئة. وECM التي تنتجها CAF أمر طبيعي ويسمح للهيكل desmoplastic لمحاكاة أفضل في البيئة الدقيقة الورم الحي. هذا النموذج 3D الرواية يمكن أن تكون أداة مفيدة لفحص المخدرات السرطان ويقدم منصة فريدة من نوعها لدراسة التفاعل الورم ستروما، وتوضيح كيفية CAF تنظيم السرطان الجذعية / الخلايا البادئة، واستكشاف المشاركة في التفاعلات سترومال في حساسية المخدرات السرطان والمقاومة.
Protocol
1. زراعة خلايا الورم الميلانيني والخلايا الليفية الجلدية
- زراعة خلايا الورم الميلانيني البشري
- خلايا سرطان الجلد البشري الثقافة، C816131 تحت ظروف ثقافة الخلايا التقليدية المنضمة في المتوسط W489 كاملة (انظر الخطوة 1.2) في حاضنة 37 درجة مئوية الموردة مع 5٪ CO2 كما هو موضح سابقا32. تقسيم الخلايا بنسبة 1:5 عندما تصل إلى ~ 90٪ التقاء.
- الميلانوما خلية ثقافة متوسطة (W489)
- للحصول على متوسط W489 كامل، استخدم 80٪ MCDB153 المتوسطة، 20٪ L-15 المتوسطة (انظر جدول المواد)،2٪ مصل الأبقار الجنين (FBS)، 5 ميكروغرام / مل الأنسولين، 1.68 mM CaCl2،و 0.11٪ بيكربونات الصوديوم. للزراعة المشتركة، لا تضيف FBS، الأنسولين، وCaCl2.
- عزل الخلايا الليفية لبشرة الفأر
- قطع 1 سم × 1 سم جزء الجلد من الماوس وفقا للمبادئ التوجيهية ذات الصلة واللوائح من المؤسسة رعاية الحيوانات ولجنة الاستخدام (IACUC).
- هضم الجلد عن طريق dispase (انظر جدول المواد)في 4 درجة مئوية بين عشية وضحاها. تجريد الأدمة من البشرة ومزيد من هضم مع الكولاجين (1 ملغ / مل في DMEM، انظر جدول المواد)في درجة حرارة الغرفة (RT) بين عشية وضحاها.
- الفأر الجلد الليفي ة عبادة
- غسل الكريات الأنسجة مع برنامج تلفزيوني وثقافة لهم في DMEM مع FBS 10٪ و 1٪ البنسلين-ستريبتومسين في 37 درجة مئوية / 5٪ CO2. تقسيم الخلايا بنسبة 1:2 عندما تصل إلى ~ 90٪ التقاء.
- Transduce الخلايا الليفية الجلد مع GFP / lentivirus باستخدام الأساليب القياسية قبل المشاركة.
- توصيف الخلايا الليفية لبشرة الفأر عن طريق تلطيخ المناعة
- إعداد الخلية للتلطيخ
- بذور الخلايا الليفية الجلد في 24 لوحة جيدة بكثافة 2 × 104 خلايا / جيدا. في اليوم 2، وغسل الخلايا مع PBS 2x وإصلاحها في 2٪ محايدة الفورمالين المخزنة مؤقتا لمدة 10 دقيقة. إزالة الفورمالين وغسل الخلايا الثابتة مع برنامج تلفزيوني مرتين.
- تلطيخ المناعة
- إضافة 200 ميكرولتر من محلول الحجب إلى كل بئر واحتضان لوحة لمدة 30 دقيقة في RT، ثم إضافة الماوس المضادة α-SMA المخفف في 1:200 واحتضان في 37 درجة مئوية لمدة 1 ح. غسل مع PBS 3x، 5 دقيقة لكل منهما.
- إضافة اليكس فلور 488 الماعز المضادة للفأر IgG في 1:400 تخفيف واحتضان في RT لمدة 1 ح. غسل الأجسام المضادة 3x مع برنامج تلفزيوني، 5 دقيقة لكل منهما.
- إضافة 1 ميكروغرام / مل DAPI واحتضان في RT لمدة 2 دقيقة. إزالة محلول DAPI وإضافة 500 ميكرولتر من PBS في كل بئر.
- مراقبة الخلايا واتخاذ الصور باستخدام المجهر الفلوري المقلوب.
- إعداد الخلية للتلطيخ
- الخلايا الليفية والميلانوما السابقة للوسم
- الخلايا الليفية البذور في طبق 100 ملم في اليوم 1 بحيث التقاء الخلية تصل إلى ~ 60٪ في اليوم التالي. في اليوم 2، وإزالة الوسط الثقافة وإضافة GFP / lentivirus (~ 1:3-1:5 المخفف من المخزون) إلى وسط الثقافة العادية مع 4 ميكروغرام / مل من البوليبرين. الخلايا المحتضنة في حاضنة 37 درجة مئوية لمدة 6 ساعة، وإزالة المتوسطة واستبدالها مع متوسط الثقافة العادية الطازجة. بعد يومين، لاحظ إشارة GFP من الخلايا باستخدام مجهر مضان. Transduce C8161 الخلايا مع DsRed / lentivirus في ظل ظروف مماثلة. وقد وصفت بروتوكولات لإعداد GFP / lentivirus وDsRed / lentivirus سابقا14،34.
2. خلية الثقافة المشتركة
- البذور وC8161- الخلايا الليفية coculture.
- في اليوم 0 من اختبار تشكيل كروي، فصل كل من C8161 والخلايا الليفية الجلد باستخدام 0.25٪ التربسين-EDTA. تدور أسفل الخلايا في 250 ز لمدة 5 دقيقة في RT وغسل مرة واحدة مع برنامج تلفزيوني.
- إعادة تعليق الخلايا في خلية coculture المتوسطة (مصل مجانا، والأنسولين مجانا، والكالسيوم مجانا W489 متوسطة مختلطة مع DMEM المصل مجانا بنسبة 1:1). ضبط تركيز الخلية إلى 2 × 104 خلايا / مل.
- اخلط خلايا C8161 مع الخلايا الليفية بنسبة 1:1 وأضف 2 مل من خلائط الخلايا إلى كل بئر من صفيحة بئر 24. يجب أن يحتوي كل بئر على 2 × 104 من كل نوع من الخلايا. وينبغي أن يتم كل شرط في ثلاثة توائم.
ملاحظة: من المهم استخدام لوحة غير الأنسجة المعالجة ثقافة (انظر جدول المواد). خلاف ذلك، فإن الخلايا نعلق بقوة على لوحة وتكون غير قادرة على من تعليق كرويدات.
- تحضن الخلايا عند درجة حرارة 37 درجة مئوية لمدة 4 درجات مئوية حتى تعلق الخلايا على اللوحة، ثم تقوم بإجراء التصوير بالفاصل الزمني أو المسح الضوئي المعالبؤر في النقاط الزمنية المشار إليها لكل فحص.
3. يعيش خلية الفاصل الزمني التصوير
- قبل الاستزراع المشترك ، قم بتشغيل نظام التصوير الفاصل الزمني (انظر جدول المواد)باتباع تعليمات الشركة المصنعة والسماح للحاضنة بالوصول إلى 37 درجة مئوية و 5٪ CO2. وعادة ما يستغرق 1 ساعة للنظام للوصول إلى التوازن. ضع لوحة الثقافة بعناية على خشبة المجهر داخل الحاضنة وأغلق الباب بشكل آمن.
- افتح برنامج نظام التصوير الفاصل الزمني (انظر جدول المواد)واختر نوع اللوحة والشركة المصنعة حتى يتمكن المجهر من تحديد موقع منطقة المسح الضوئي بدقة. اختيار الآبار من الفائدة وعدسة 10x الهدف. اختر الإعدادات لمنطقة المسح الضوئي، ووقت الفاصل الزمني بين عمليات الفحص، ووقت البدء بالإضافة إلى وقت النهاية. في هذا البروتوكول، الحد الأقصى لعدد التنسيق لمنطقة المسح الضوئي لبئر 1 هو 36 ووقت الفاصل الزمني هو 1 ساعة.
- تسجيل التصوير الفاصل الزمني من 4 إلى 52 ساعة.
ملاحظة: يجب تحسين وقت البدء ووقت الانتهاء والمدة حسب نوع الخلية والغرض من التجربة. - عند إكمال تسجيل الصور، استخدم برنامج نظام التصوير الفاصل الزمني لاسترداد البيانات وتصدير مقاطع الفيديو أو مجموعات الصور.
4. كونستموب سمرة وأفلام ثلاثية الأبعاد
- ضع لوحة الثقافة المشتركة للخلية على خشبة مجهر الفلورسينال مقلوب (انظر جدول المواد)واستخدم أشعة الليزر الحمراء والخضراء. مراقبة الخلايا تحت عدسة موضوعية 5x أو 10x واختيار كروية لبدء المسح الضوئي.
- استخدام 1 μm z خطوة لمسح من أسفل إلى أعلى من كرويويد. معالجة البيانات باستخدام برنامج معالجة الصور (انظر جدول المواد)لإعادة بناء صورة ثلاثية الأبعاد يمكن تدويرها وحفظها كفيلم ثلاثي الأبعاد.
5. ثقافة سولو من خلايا سرطان الجلد وتشكيل 2D مجموعات / المجاميع
- البذور 2 × 104 خلايا سرطان الجلد C8161 في كل بئر من 24 لوحة جيدة كما هو موضح في القسم 2.1. زراعة الخلايا لمدة 7-10 أيام وتصويرها باستخدام مجهر الفلورسينال مقلوب.
6. التحقق مما إذا كانت 3D Spheroids و 2D مجموعات الخلية / المجاميع علقت في المتوسط أو تعلق على لوحات
- للزراعة المشتركة للخلية، تحقق من الكرويدات ثلاثية الأبعاد التي تشكلت في اليوم 7. للحصول على ثقافة خلية واحدة، تحقق من المجموعات/المجاميع 2D التي تم تشكيلها في اليوم 10.
- تعيين لوحات ثقافة الخلية على منصة المجهر الفلوري المقلوب. وضع إبرة عازمة مع حقنة في بئر وبلطف تستنشق وسط الثقافة داخل وخارج لإزعاج الوسط الثقافة في الآبار. تسجيل هذه العملية باستخدام وضع الفيلم من برنامج الفيلم (انظر جدول المواد). سوف تكون كرويدات ثلاثية الأبعاد متحركة ، ولكن مجموعات الخلايا 2D / المجاميع ستظل ثابتة.
7. صورة كونتشال من السُبوات ثلاثية الأبعاد
ملاحظة: تبدأ الخلايا المختلطة في تشكيل كرويدات من 48-72 ساعة اعتمادًا على نوع الخلايا الليفية المستخدمة. عموما، تتضخم الكرويدات تدريجيا مع مرور الوقت. يمكن أن تندمج الكرويدات الصغيرة لتشكيل كرويدات أكبر حتى اليوم 7. بعد تثبيت الكرويدات في الحجم ، يمكن أن تستمر أكثر من 10 أيام. بعد ذلك ، غالباً ما تنفصل الكرويدات عن الجزء السفلي من لوحة الثقافة وتتجمع في وسط الآبار. أثناء توسيع الكرويدات ، تموت الخلايا في المركز عادة بسبب عدم كفاية التغذية و / أو البيئة الدقيقة السامة. وبالتالي ، ينبغي تحسين ذروة تشكيل كروي ثلاثي الأبعاد وتوقيت لتصوير الكرويدات الناضجة باستخدام التجارب التجريبية. لهذا البروتوكول، تم إجراء المجهر البؤري حول اليوم 7 عندما كانت كرويويدات ناضجة والخلايا في مركز كرويدات لا تزال على قيد الحياة وفقا لفلورسسولوجي ومورفولوجيا الخلايا في المركز.
- للقيام المجهر confocal، واستخدام الليزر الأخضر والأحمر لمسح كرويويدس. تحديد منطقة المسح تحت هدف 10x والانتقال من أسفل إلى أعلى كرويويد مع 1 μm z-الخطوة.
- قم بإنشاء مقاطع الفيديو ثلاثية الأبعاد للتشكيل والدوران باستخدام وظيفة الإسقاط ثلاثي الأبعاد لبرنامج معالجة الصور (على سبيل المثال، ImageJ).
8. داخل الخلايا Notch1 إشارة نشاط المسار في تحديد تنظيم سترومال من السرطان الجذعية / الخلايا البادئة
- عزل وتوصيف الخلايا الليفية الجلدية من الكسب وفقدان الوظيفة Notch1 الفئران
- عزل الخلايا الليفية الجلدية من زوجين من الفئران المعدلة وراثيا: كسب من وظيفة نوتش1 (GOFNotch1: Fsp1.Cre+/-; روزاLSL-N1IC +/+)الفئران مقابل التحكم نظيرتها (GOFctrl : FSP1. كري-/-; روزاLSL-N1IC+/+)الفئران وفقدان الوظيفة نوتش1 (LOFNotch1: Fsp1.Cre+/-; Notch1LoxP / LoxP+/+) الفئران مقابل السيطرة نظيرتها (LOFctrl : FSP1. كري-/-; Notch1LoxP / LoxP+/+الفئران31، على التوالي. عزل وتوصيف الخلايا الليفية الجلدية باستخدام البروتوكول الموصوف في الأقسام 1.3-1.5.
- Transduce الخلايا الليفية جلد الفأر مع GFP / lentivirus.
- انظر القسم 1 لطريقة نقل الخلايا مع ناقلات لينتيفية.
- الاستزراع المشترك للخلايا الليفية والميلانوما
- إجراء تجربة الثقافة المشتركة للخلية كما هو موضح في القسم 2.
- تقييم تأثير نشاط مسار Notch1 داخل الخلايا في الخلايا الليفية على تحديد تنظيم سترومال من سرطان الجذعية / الخلايا البادئة عن طريق قياس أحجام كرويدات 3D
- تنفيذ القياس الكمي لتشكيل كرويفيد تحت كل حالة عن طريق تصوير الكرويدات في الوقت الذي تكون فيه الكرويدات ناضجة (يشار إليها بتوقف النمو حول اليوم 5-7 اعتمادًا على أنواع الخلايا الليفية). قياس أحجام كرويات 3D باستخدام برنامج معالجة الصور.
9. اختبار استجابة الدواء من السرطان الجذعية / الخلايا البادئة باستخدام فحص كروي 3D
ملاحظة: يمكن CAF تنظيم الهيترجينية السرطان ية والحث على النمط الظاهري للخلايا الجذعية السرطانية / البادئة. CAF أيضا دعم السرطان الجذعية / الخلايا البادئة لتحمل العلاجات السريرية. وقد ثبت أن الخلايا الجذعية السرطانية مسؤولة عن مقاومة الأدوية. لذلك ، استخدمنا هذا النموذج الكروي ثلاثي الأبعاد لتقييم استجابة الدواء لخلايا السرطان الجذعية / البادئة. يمكن للنتيجة تقييم الفعالية السريرية المحتملة للأدوية المضادة للسرطان بشكل جيد.
- إدارة الأدوية
- مباشرة بعد coculturing الخلايا في لوحة بئر 24، وإعداد الأدوية في تخفيف المسلسل في الوسط الثقافة للوصول إلى 5x من مجموعة المطلوب من التركيزات على أساس التجارب التجريبية (أي 1 nM، 2.5 nM، 5 nM، 10 nM، و 25 nM).
إضافة 0.5 مل من حلول المخدرات المقابلة لكل بئر من الخلايا المشتركة. تعامل مع مجموعة التحكم باستخدام وسائط الثقافة المشتركة العادية كما ذكر أعلاه. - ملاحظة: مثبط MEK قابل للذوبان في وسائط ثقافة الخلية. لذلك، عناصر التحكم الفارغة هي 2.5 مل من وسط ثقافة الخلية. ومع ذلك ، إذا كان الدواء غير قابل للذوبان في محلول مائي ويتطلب مذيبات مثل DMSO ، فيجب تطبيق وسائط ثقافة الخلايا بنفس تركيز DMSO على مجموعة التحكم.
- مباشرة بعد coculturing الخلايا في لوحة بئر 24، وإعداد الأدوية في تخفيف المسلسل في الوسط الثقافة للوصول إلى 5x من مجموعة المطلوب من التركيزات على أساس التجارب التجريبية (أي 1 nM، 2.5 nM، 5 nM، 10 nM، و 25 nM).
- القياس الكمي للاستجابة للمخدرات عن طريق عد الكرويدات
- مراقبة الخلايا المعالجة والخلايا غير المعالجة باستخدام المجهر الفلوري وتصوير الخلايا كل يوم. قم بتحديد تكوين كروي في المجموعات التجريبية المختلفة وقارن قدرة تشكيل الخلايا في ظل تركيزات مختلفة من الأدوية.
ملاحظة: تميل الكرويدات إلى الظهور ~ 5-7 أيام بعد الثقافة المشتركة. سوف تصبح آثار المخدرات ملحوظة في تلك النقطة الزمنية. - استخدام المجهر الفلوري لتصوير / تصوير كرويدات والخلايا في الآبار ومن ثم استخدام برنامج الصورة لحساب متوسط حجم الكرويدات وأرقام الكرويدات التي تشكلت لكل حقل طاقة منخفضة (LPF x 4) في كل مجموعة علاج مع مرور الوقت.
ملاحظة: يجب أن تشكل الخلايا التي تتلقى علاجًا فعالًا من المخدرات أقل أو لا كرويات مقارنة بمجموعة التحكم. هذا هو مؤشر على فعالية الدواء الذي تم اختباره على قمع الخلايا الجذعية السرطانية.
- مراقبة الخلايا المعالجة والخلايا غير المعالجة باستخدام المجهر الفلوري وتصوير الخلايا كل يوم. قم بتحديد تكوين كروي في المجموعات التجريبية المختلفة وقارن قدرة تشكيل الخلايا في ظل تركيزات مختلفة من الأدوية.
النتائج
لقد طورنا طريقة جديدة لتوليد كرويدات ثلاثية الأبعاد مع نظام زراعة الخلايا الهيستروية الهيستروية التي تحاكي البيئة الدقيقة للورم الحي. مشتقة من الخلايا الليفية الخلايا الليفية الماوس. تم إنشاء الخلايا الليفية الجلدية كما هو موضح أعلاه ووصفت بأنها α-SMA+/ Vimentin+/ FSP-1+ الخلايا. تم استزراع خلايا الورم الميلانيني النقيلي البشري (C8161) في وسط W489 كما هو موضح32. لتصور والتمييز بين الخلايا الليفية من الخلايا السرطانية، تم نقل الخلايا الليفية وخلايا الورم الميلانيني مسبقا مع GFP/lentivirus وDsRed/lentivirus، على التوالي34،36،قبل الزرع المشترك للخلايا.
يوضح الشكل 1 مثالًا على الخلايا ثلاثية الخلايا ثلاثية الأبعاد التي تشكلت من خلايا الورم الميلانيني والخلايا الليفية. لم خلايا سرطان الجلد المستزرعة في غياب الخلايا الليفية لا تشكل كرويدات ثلاثية الأبعاد نموذجية ، على الرغم من أن بعض خلايا الورم الميلانيني تشكل مجموعات / مجاميع 2D مع الثقافة الموسعة. كان متوسط حجم الكرويدات حوالي 170-360 ميكرومتر (المتوسط = 275، SD = 37) في اليوم ~ 5−7. باستخدام التصوير الفاصل الزمني ، لاحظنا أن الخلايا الليفية والخلايا السرطانية تفاعلت في الزراعة المشتركة وبدأت في تشكيل كرويدات ثلاثية الأبعاد في حوالي 36 ساعة من الثقافة المشتركة كما هو موضح في الفيديو 1. سجل التصوير الفاصل بين الوقت العملية الديناميكية للتفاعل بين الخلايا والمرحلة الأولية من تكوين كرويفيحوالي 4-52 ساعة من الثقافة المشتركة. حدثت ذروة تشكيل كروي ثلاثي الأبعاد حول اليوم ~ 5−7. وتتكون كرويدات ثلاثية الأبعاد المشكّلة من الخلايا الليفية والميلانوما، حيث تتكون الغالبية (~ 80%) كانت خلايا ورم. فيديو 2 يظهر العملية الديناميكية لخلايا سرطان الجلد المستزرعة واحدة (DsRed+/ C8161) في تشكيل الكتلة الخلايا / المجاميع بدءا من ~ 4-52 ح في ثقافة واحدة. بلغ تشكيل المجموعات/المجاميع 2D ذروته احول اليوم ~ 7-10. فيديو 3 والفيديو 4 تظهر هياكل كروية 3D و2D كتلة الخلايا السرطانية تصور بواسطة المجهر confocal، على التوالي. تم فحص كروية ثلاثية الأبعاد ومجموعات الخلايا السرطانية 2D عن طريق المجهر المعالبؤر في اليوم 7 من الثقافة المشتركة للخلية. فيديو 5 يظهر أن تم تعليق كرويدات 3D في الوسط والثقافة والمحمول، في حين يظهر الفيديو 6 أن الكتلة 2D ورم الخلية تعلق على لوحة الثقافة وغير متحركة. التعليق في الوسط هو سمة من سمات كرويدات ثلاثية الأبعاد تميزها عن المجموعات ثنائي الأبعاد. عندما يكون اضطراب المتوسطة في طبق ثقافة الخلية أو جيدا إما عن طريق إسقاط أو pipetting بلطف وسط الثقافة، وتتحرك كرويدات 3D معلقة، في حين أن مجموعات الخلايا 2D غير متحركة. فقط عدد قليل من الخلايا الميتة المتنقلة.
يوضح الشكل 2A مثالًا على هذا النموذج ثلاثي الأبعاد الذي يعمل كمنصة فريدة لدراسة تفاعلات الورم ستروما وتوضيح كيفية تنظيم نشاط مسار الإشارة داخل الخلايا Notch1 في CAF للخلايا الجذعية / البادئة والخلايا الكروية. زوجان من الخلايا الليفية (FB) معزولة عن الجلد من كسب من وظيفة نوتش1 (GOFNotch1: Fsp1.Cre+/-; روزاLSL-N1IC +/+)الفئران مقابل التحكم نظيرتها (GOFctrl : FSP1. كري-/-; روزاLSL-N1IC+/+)الفئران وفقدان الوظيفة نوتش1 (LOFNotch1: Fsp1.Cre+/-; Notch1LoxP / LoxP+/+) الفئران مقابل السيطرة نظيرتها (LOFctrl : FSP1. كري-/-; Notch1LoxP / LoxP+/+الفئران35، على التوالي. تم نقل جميع الخلايا الليفية بواسطة GFP / lentivirus وcocultureed مع خلايا الورم الميلانيني C8161 pretransduced مع DsRed / lentivirus. يظهر التصوير الفاصل الزمني أن Fb-GOFNotch1 أوقف خلايا C8161 الميلانوما من تشكيل كرويدات ثلاثية الأبعاد مقارنة بـ Fb-GOFctrl خلال أول ~ 4-52 ساعة من الثقافة المشتركة للخلية. في المقابل، شجع Fb-LOFNotch1 تشكيل الكرويدات ثلاثية الأبعاد بواسطة خلايا الورم الميلانيني C8161 مقارنة بـ Fb-LOFctrl. الشكل 2B، أعلى ، ويظهر صورا تمثيلية من كرويدات 3D شكلت في اليوم 7 من الخلايا المشتركة مع الخلايا الخلايا المختلفة التي تنفذ أنشطة مسار الشق متنوعة. الشكل 2B، أسفل ، ويبين البيانات الكمية على متوسط حجم كرويدات 3D شكلت في اليوم 7 من الخلايا المشتركة مع الخلايا الخلايا المختلفة التي تحمل أنشطة مسار الشق متنوعة.
يوضح الشكل 3 مثالًا على هذا النموذج ثلاثي الأبعاد المستخدم لاختبار استجابة الدواء لخلايا السرطان الجذعية/البادئة. وقد ثبت أن الخلايا الجذعية السرطانية / البادئة لتكون مسؤولة عن مقاومة الأدوية وتكرار السرطان. لذلك ، يمكن تقييم الاستجابة للدواء باستخدام هذا النموذج ثلاثي الأبعاد أن يكشف بشكل أفضل عن الفعالية السريرية للدواء المحتمل لعلاج السرطان. تعتمد خلايا C8161 الميلانوما على إشارات MAPK النشطة لنمو الخلايا وغزوها. كما أنها تعبر عن مستويات عالية من CDK4/Kit، ولكنها لا تحمل طفرة BRAF. لاختبار استجابة المخدرات من السرطان الجذعية / الخلايا البادئة نحو مثبط MAPK باستخدام هذا النموذج 3D، ونحن شارك في زراعة خلايا الورم الميلانيني C8161 والخلايا الليفية في 24 لوحات بئر. تم إعداد PD0325901 (انظر جدول المواد)، وهو مثبط MAPK ، في تخفيف متسلسل بمجموعة من التركيزات من 1 نانومتر ، 2.5 نانومتر ، 5 نانومتر ، 10 نانومتر ، و 25 نانومتر. تمت إضافة PD0325901 إلى الثقافات المشتركة للخلية عندما تم مطلي خلائط الخلايا. واستخدمت الخلايا المستزرعة المشتركة غير المعالجة كسيطرة. قمنا بتقييم قدرة تشكيل الخلايا في الخلايا تحت تركيزات مختلفة من الأدوية وقارناها بالتحكم غير المعالج. ويبين الشكل 3A صوراً تمثيلية لكرويدات ثلاثية الأبعاد تشكلت في اليوم الخامس من الاستزراع المشترك للخلايا تحت تركيزات مختلفة من الأدوية. الشكل 3B هو البيانات الكمية لمتوسط الحجم لكل كروية وأرقام الكرويدات ثلاثية الأبعاد التي تشكلت لكل حقل منخفض الطاقة (LPF x 4) في اليوم 5 من الاستزراع المشترك للخلايا تحت تركيزات مختلفة من الأدوية.
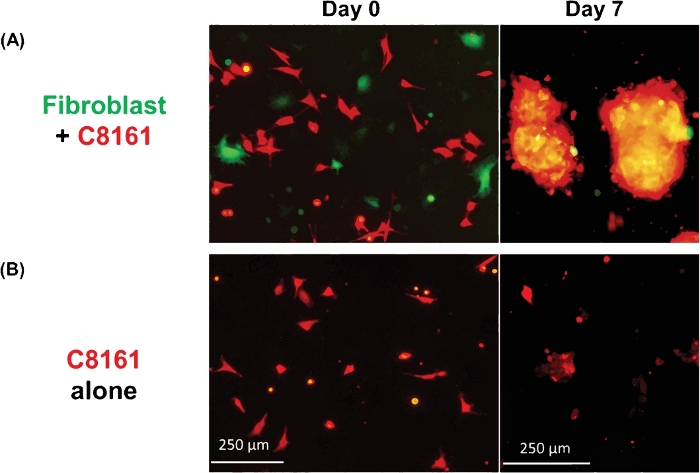
الشكل 1: تشكيل كرويدات ثلاثية الأبعاد ومجموعات 2D. (أ)صورة تمثيلية من كرويدات 3D التي شكلتها الثقافة المشتركة لخلايا الورم الميلانيني الإنسان C8161 والخلايا الليفية جلد الفأر. تم تصوير الكرويدات ثلاثية الأبعاد في اليوم 7 من الاستزراع المشترك لخلايا الورم الميلانيني والخلايا الليفية. كان متوسط أحجام الكرويدات حوالي 170-360 ميكرومتر (المتوسط = 275، SD = 37) في اليوم ~ 5−7. كان متوسط عدد الكرويدات 18-26 (20.5 ± 3.6) لكل حقل طاقة منخفض (LPF x4). (ب)صورة تمثيلية لمجموعات الخلايا السرطانية 2D التي شكلتها ثقافة واحدة من خلايا الورم الميلانيني C8161. تم تصوير مجموعات خلايا الميلانوما 2D في اليوم 7 من ثقافة واحدة من خلايا سرطان الجلد. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
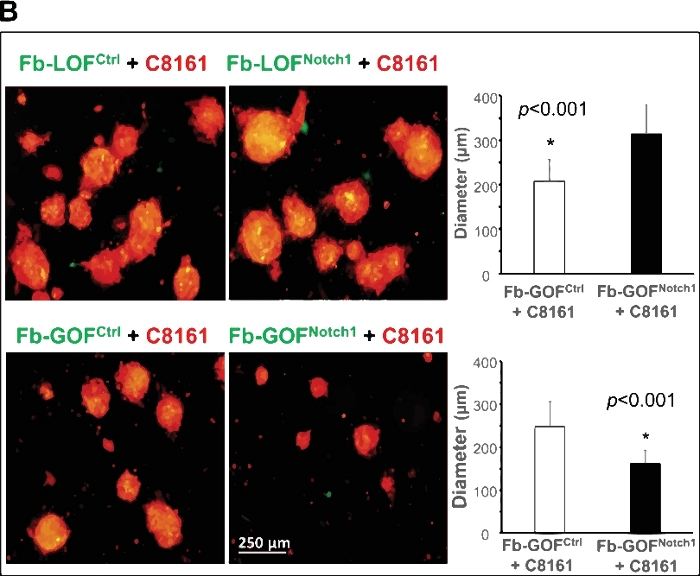
الشكل 2: توضيح دور النشاط مسار إشارة نوتش1 داخل الخلايا في CAF في تنظيم خلايا السرطان الجذعية / بدء باستخدام نموذج كروي 3D. (أ)داخل الخلايا Notch1 نشاط مسار الإشارة في CAF تحديد تشكيل كرويدات بواسطة خلايا سرطان الجلد في الخلايا المشتركة. فيديو الفاصل الزمني يظهر أن FB-GOFNotch1 توقف تشكيل كرويدات ثلاثية الأبعاد من قبل خلايا C8161 الميلانوما، في حين شجع Fb-LOFNotch1 على تكوين المزيد من الكريات ثلاثية الأبعاد من قبل خلايا الورم الميلانيني C8161 خلال أول 4-52 ساعة من الاستزراع المشترك للخلايا. (ب)أعلى: صور تمثيلية من كرويدات ثلاثية الأبعاد تشكلت في اليوم 7 من الخلايا المشتركة مع الخلايا الليفية المختلفة التي تحمل وظائف مسار الشق المتنوعة. أسفل: البيانات الكمية من متوسط حجم (قطر [μm]/كروية) من كرويدات 3D شكلت في اليوم 7 من الخلايا المشتركة مع الخلايا الخلايا المختلفة التي تحمل أنشطة مسار الشق متنوعة. تم استخدام اختبار t للطالب ذي الذيلا للتحليل الإحصائي. يتم التعبير عن البيانات كمتوسط ± الانحراف المعياري (SD). يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
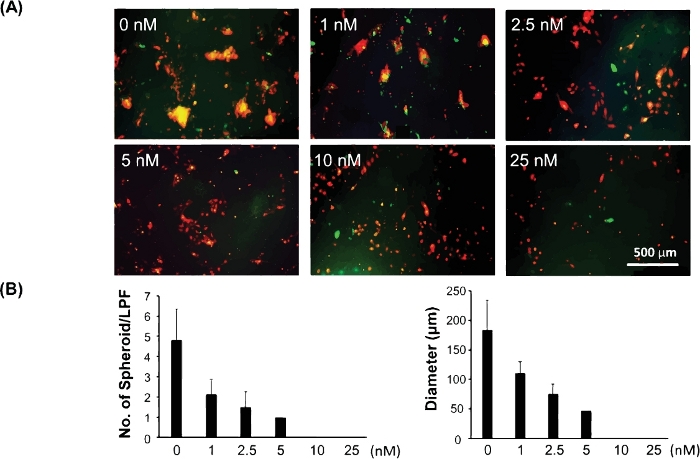
الشكل 3: تقييم استجابة الدواء للخلايا الجذعية السرطانية / البادئة باستخدام نموذج كروي ثلاثي الأبعاد. (أ)صور تمثيلية من كرويدات ثلاثية الأبعاد تشكلت في اليوم 5 من الخلايا المشتركة تحت تركيزات المخدرات المختلفة. (ب)البيانات الكمية لمتوسط الحجم (القطر [μm]/spheroid) وعدد الكرويدات ثلاثية الأبعاد لكل حقل منخفض الطاقة (LPF x 4) التي تشكلت في اليوم 5 من الاستزراع المشترك للخلايا تحت تركيزات مختلفة للأدوية. يتم التعبير عن البيانات الكمية كمتوسط ± الانحراف المعياري (SD). يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
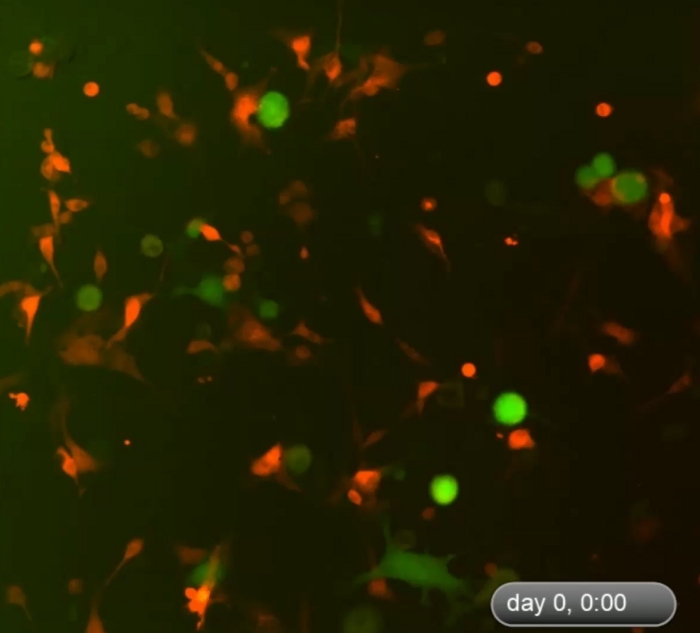
فيديو 1: عملية ديناميكية لتشكيل كرويدات ثلاثية الأبعاد في المرحلة المبكرة من الاستزراع المشترك للخلية. يظهر التصوير الفاصل بين الوقت تفاعلات ديناميكية بين الخلايا الليفية والخلايا السرطانية في الزراعة المشتركة وتشكيل الكرويدات ثلاثية الأبعاد خلال الاستزراع المشترك للخلية ~ 4-52. بدأت الخلايا لتشكيل كرويدات ثلاثية الأبعاد حوالي 48 ساعة بعد بداية الاستزراع المشترك. حدثت ذروة تشكيل كروي ثلاثي الأبعاد في اليوم ~ 5−7 (غير معروض هنا). وتتكون الخلايا الكروية ثلاثية الأبعاد من الخلايا الليفية والميلانوما، حيث غالبية (~ 80٪) من الخلايا الليفية والميلانوما، حيث تتكون الغالبية (~ 80٪). كانت خلايا ورم. يرجى الضغط هنا لتحميل هذا الفيديو.

فيديو 2: عملية ديناميكية لتشكيل مجموعات 2D في المرحلة المبكرة من الثقافة المشتركة الخلية. يُظهر التصوير بالفاصل الزمني العملية الديناميكية للمجموعات 2D التي شكلتها خلايا الورم الميلانية C8161 في ثقافة واحدة. تشكيل مجموعات 2D وقعت حول اليوم ~ 7-10. يسجل التصوير الفاصل الزمني فترة ~ 4-52 ساعة في ثقافة واحدة من خلايا DsRed+/ C8161 الميلانوما. يرجى الضغط هنا لتحميل هذا الفيديو.
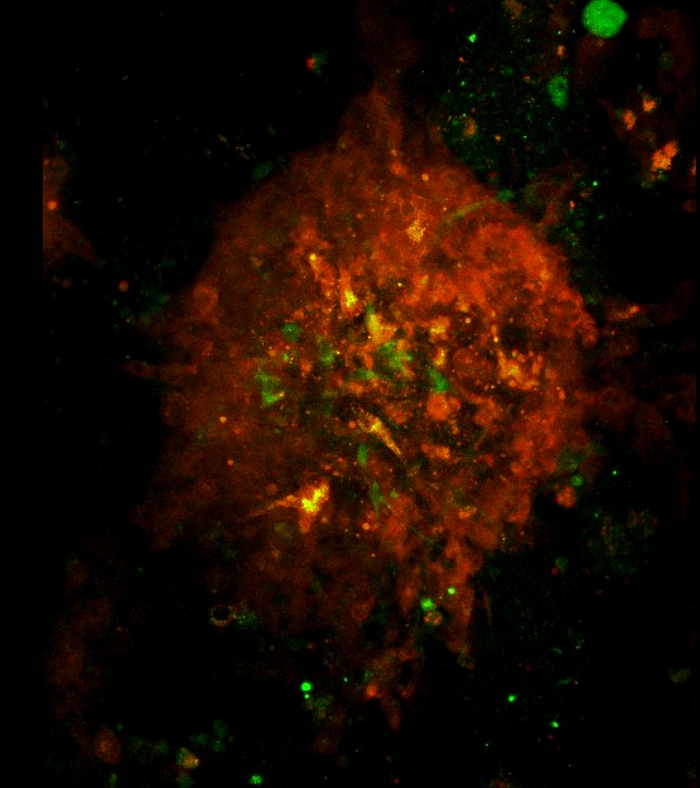
فيديو 3: الهندسة المعمارية ودوران كروية ثلاثية الأبعاد كما هو متصور بواسطة المجهر المعالبؤر. الهندسة المعمارية والتناوب من كروية 3D. تم استخدام الليزر الأخضر والأحمر لمسح الكرويدات التي تشكلت في اليوم 7 في الثقافة المشتركة للخلايا. تم تحديد منطقة المسح تحت هدف 10x. يبدأ المسح الضوئي من أسفل إلى أعلى كروية في خطوة z 1 ميكرومتر. تم إنشاء فيلم دوران كروي ثلاثي الأبعاد باستخدام برنامج فيجي. يرجى الضغط هنا لتحميل هذا الفيديو.
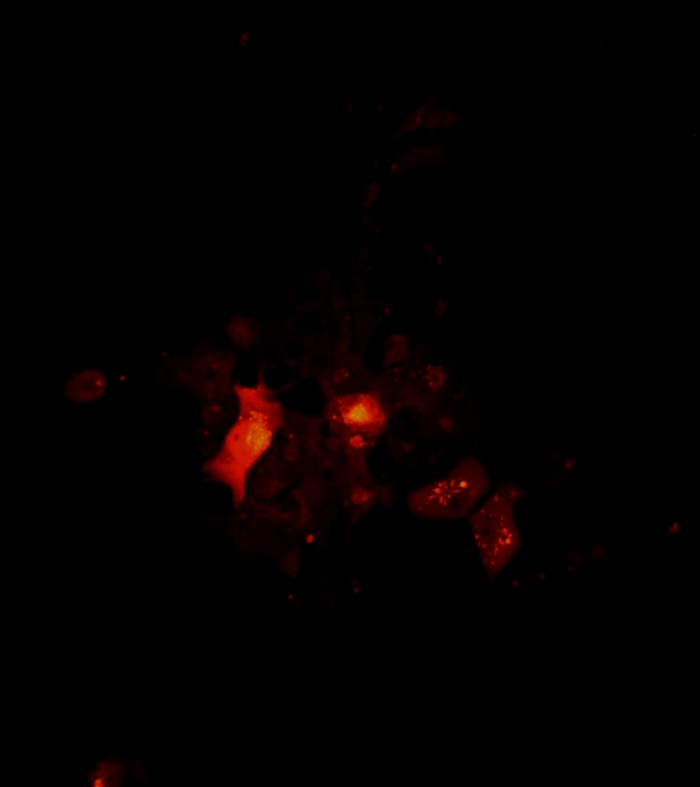
فيديو 4: الهندسة المعمارية والتناوب كتلة الخلايا السرطانية 2D كما هو تصور من قبل المجهر confocal. الهندسة المعمارية ودوران مجموعة 2D. تم التقاط صور كونكولمن مجموعات الخلايا في اليوم 7 من الثقافة الواحدة لخلايا سرطان الجلد. تم تحديد منطقة المسح تحت هدف 10x. يبدأ المسح الضوئي من أسفل إلى أعلى كروية في خطوة z 1 ميكرومتر. تم إنشاء فيلم دوران الكتلة 2D باستخدام برامج فيجي. يرجى الضغط هنا لتحميل هذا الفيديو.
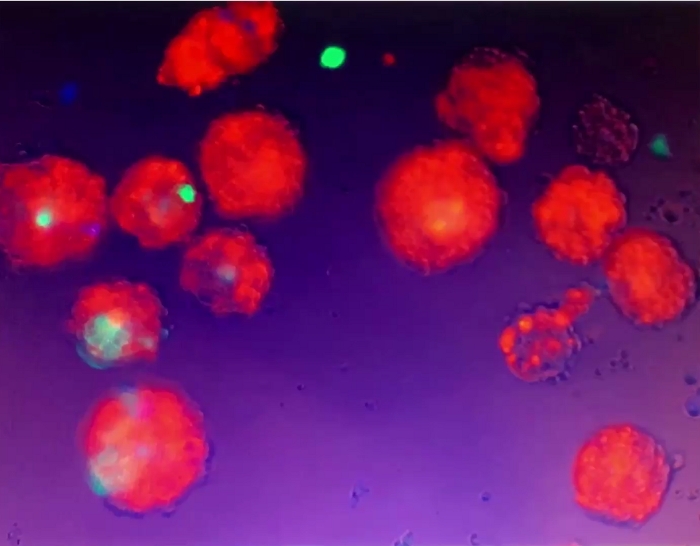
فيديو 5: حركة كرويدات ثلاثية الأبعاد. علقت ال [3د] [كرويدات] كان في الثقافة وسط ولم يلتصق إلى الثقافة طبق/جيّدا. عندما لا يزال المتوسطة في ثقافة الخلية بشكل جيد كان منزعج من الأنابيب لطيف، انتقلت كرويدات 3D معلقة. يرجى الضغط هنا لتحميل هذا الفيديو.
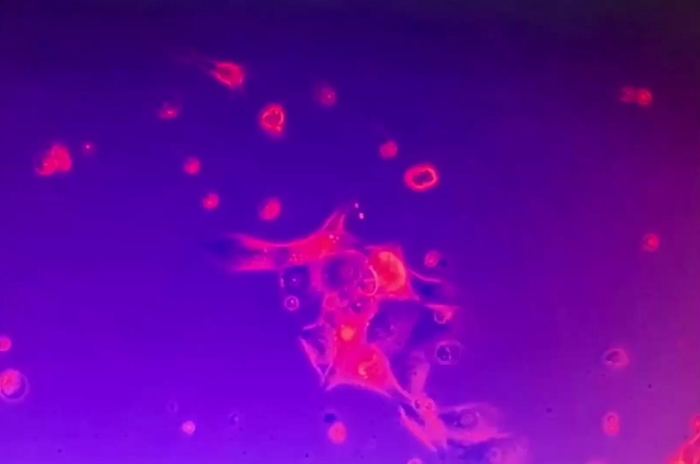
فيديو 6: صمود مجموعات الخلايا السرطانية 2D. ورست الكتلة 2D الخلايا السرطانية إلى لوحة الثقافة وغير متحركة على الرغم من اضطراب وسط الثقافة. بعض الخلايا الميتة المنفردة كانت متنقلة يرجى الضغط هنا لتحميل هذا الفيديو.
Discussion
في المختبر 3D تقنيات زراعة الخلايا وقد استخدمت على نطاق واسع لعقود في أبحاث السرطان. بالمقارنة مع أنظمة زراعة الخلايا 2D التقليدية ، فإن البيئة الدقيقة ثلاثية الأبعاد تُلخص التفاعلات بين الخلية و / أو مصفوفة الخلية وتمكن من محاكاة الحالات الحقيقية التي لوحظت في أنسجة الورم. ومع ذلك ، فإن نظام 3D التي شكلتها فقط من الخلايا السرطانية والتفاعلات الخلايا المتجانسة الخلايا لا تأخذ في الاعتبار أهمية الكلام عبر heterotypic ويمكن أن توفر نتائج غير دقيقة في البحوث. لقد قمنا مؤخرًا بتطوير نظام جديد ثلاثي الأبعاد يجمع بين الخلايا السرطانية وCAF لمحاكاة أفضل في البيئة الدقيقة للورم غير المتجانسة ورد فعله الأصلي والقاسي.
الخلايا الليفية هي المكونات الرئيسية للورم ستروما. وتشارك CAF في تنظيم تطور الورم عن طريق إثارة العوامل القابلة للذوبان، ECM / إعادة عرض الإنزيمات10،11،وexosomes. بالإضافة إلى ذلك، يلعب CAF دورا في مقاومة الأدوية وتكرار الورم16،17. يمكن استخدام نظامنا ثلاثي الأبعاد ثلاثي الخلايا لاستكشاف الآليات الجزيئية للتفاعلات بين الورم والورم ومعالجة مقاومة الأدوية وتكرار الورم. وتستمد في المقام الأول CAF من الخلايا الليفية المحلية تنشيط هادئة وتجنيد تعميم نخاع العظام MSC، والتي تخضع في الموقع التمايز إلى CAF في أنسجة الورم37،38،39. في الدراسة الحالية، استخدمنا الخلايا الليفية الجلدية لإنشاء نموذج كروي ثلاثي الأبعاد متعدد الخلايا. ومع ذلك ، فإن نوعًا آخر من الخلايا الليفية (على سبيل المثال ، MSC-DF) ، يعمل أيضًا بطريقة مشابهة جدًا للخلايا الليفية الجلدية لتنظيم تكوين الخلية السرطانية ثلاثية الأبعاد34. يمكن أن تولد MSC-DF من نخاع العظم المورين MSC، الذي يتم تخصيبه عن طريق زراعة نخاع العظم الخلايا أحادية النواة في وسط ثقافة الخلايا MSC لمدة 10 أيام مع تغييرات متوسطة دورية كل 3 أيام. وتتميز هذه MSC كما CD73+/ CD105+/ لين-. للتمييز MSC إلى الخلايا الليفية، يتم استزراع MSC لاحقًا مع DMEM كاملة لمدة أسبوعين إضافيين. تتميز MSC-DF بأنها α-SMA+/ Vimentin+/FSP-1+ الخلايا36. يمكن أن يكون MSC-DF منظم الأورام المهم. لأن يتم تمييز جزء صغير من CAF في العديد من أنواع الأورام الصلبة من المعينين تعميم MSC صدر من نخاع العظام36، MSC-DF يمكن أن تكون أهدافا العلاج واعدة. كما أنها أكثر سهولة من حيث التلاعب أو المستهدفة علاجيا قبل أن يتم تجنيدهم لأنسجة الورم وتمييزها في CAF. وهكذا، لدينا نموذج 3D يقدم نظام مثالي لدراسة واختبار ليس فقط الخلايا السرطانية، ولكن أيضا كسور مختلفة أو مجموعات فرعية من CAF. طريقة تشكيل كروية ثلاثية الأبعاد واضحة. وتشمل الخطوات الحاسمة استخدام وسيط مصل حر للاستزراع المشترك، وتطبيق النسبة الصحيحة من الخلايا الليفية إلى الخلايا السرطانية، واستخدام لوحات الثقافة الصحيحة للاستزراع المشترك. القيد المحتمل لطريقتنا هو أن تشكيل كرويدات ثلاثية الأبعاد يعتمد إلى حد كبير على خط الخلايا السرطانية. قد يتطلب بروتوكول تشكيل كروي ة لدينا تحسين النسبة بين الخلايا الليفية والخلايا السرطانية إذا تم استخدام خطوط خلايا سرطانية مختلفة. تجدر الإشارة إلى أننا استخدمنا خلية الميلانوما البشرية ونموذج الاستزراع المشترك للخلايا الليفية للفأر لتشكيل كرويدات ثلاثية الأبعاد ، لأنه من الأسهل بكثير إنشاء خلايا GOF أو LOF في الخلايا الليفية للفأر لدراسة دور جزيء أو مسار إشارة في تنظيم تكوين الورم الكروي. تشير قدرة خلايا الورم الميلانيني البشري والخلايا الليفية للفئران على تشكيل الخلايا الكروية إلى أن الجزيئات المطلوبة للاتصالات بين الخلايا تعمل عبر الأنواع. لقد اختبرنا مؤخرا الاستزراع المشترك للانفجارات الليفية البشرية مع خلايا الورم الميلانيني البشري ووجدنا أن الخلايا الليفية البشرية يمكن أن تنظم أيضًا خلايا الورم الميلانيني البشري لتشكيل كرويدات ثلاثية الأبعاد.
لقد وظفنا خلايا الورم الميلانيني النقيلي البشري، C8161، في نموذجنا ثلاثي الأبعاد متعدد الخلايا. كما اختبرنا خلايا سرطان الجلد البشرية الأخرى، على سبيل المثال، 1205Lu32، الذي يحمل طفرة BRAFV600E، وMeWo، الذي يعبر عن مستويات عالية من CDK4/Kit (ATCC HTB-65)، ووجدت أنها قادرة أيضا على تشكيل كرويدات ثلاثية الأبعاد في الثقافة المشتركة. وهذا يشير إلى أن تشكيل كرويدات ثلاثية الأبعاد بواسطة الخلايا السرطانية مستقلة عن أنواع الطفرات الأورامية. على الرغم من أننا لم نختبر ما إذا كانت الأنواع الأخرى من الخلايا السرطانية غير الميلانوما قادرة على تشكيل كرويدات ثلاثية الأبعاد مع الخلايا الليفية ، تشير النتائج التي توصلنا إليها إلى أن تكوين كرويدات ثلاثية الأبعاد لا يقتصر على خط خلايا سرطانية وقد لا يعتمد على خط خلايا سرطاني محدد.
أظهرنا مثالين من التطبيقات العملية لنموذجنا كروي 3D. كان أحد الأمثلة على توضيح نشاط مسار الإشارة داخل الخلايا Notch في تنظيم النمط الظاهري للخلايا الجذعية / البادئة السرطان وتشكيل كروي ثلاثي الأبعاد. لقد أثبتنا أن مسار الإشارات داخل الخلايا Notch في CAF هو مفتاح جزيئي يتحكم في النمط الظاهري للخلايا الجذعية / البادئة بالسرطان باستخدام هذا النموذج الكروي ثلاثي الأبعاد. النتائج التي توصلنا إليها ليس فقط الكشف عن آلية الجزيئية الكامنة وراء تنظيم سترومال من السرطان الجذعية / الخلايا البادئة وheterogenicity السرطان، ولكن أيضا تسليط الضوء على أن مسار نوتش في CAF هو هدف حاسم لعلاجات سرطان الجلد. يشير هذا المثال إلى أن نموذجنا الكروي ثلاثي الأبعاد مفيد جدًا لدراسة آليات تفاعلات الخلايا الليفية التليفائية التليفائية السرطانية وتحديد الأهداف العلاجية المحتملة. مثال آخر هو اختبار استجابة الدواء من السرطان الجذعية / الخلايا البادئة في وجود CAF. ومن المعروف جيدا أن استجابة المخدرات من الخلايا السرطانية، بما في ذلك سرطان الجذعية / الخلايا البادئة، يختلف في وجود وعدم وجود CAF. وجود CAF في هذا النظام المختبري يجعل هذا النموذج أكثر ملاءمة سريريا ونتائج الاختبار ولدت أكثر موثوقية. وعلاوة على ذلك، لدينا نظام كروي ثلاثي الأبعاد هو تنوعا. ويمكن استخدامه لأغراض مختلفة. على سبيل المثال، إذا تم استخدام الخلايا السرطانية المقاومة للأدوية في هذا النموذج ثلاثي الأبعاد، يمكن تغييره لمعالجة مقاومة الأدوية وربما تكرار الورم. ويمكن أيضا أن يتم تعديلها لاختبار أو فحص الأدوية التي تستهدف في المقام الأول CAF لعلاج السرطان. وقد أصبحت الكاف مؤخرا أهدافا علاجية واعدة. هناك مزايا لاستهداف CAF. أولاً، بالمقارنة مع الخلايا السرطانية غير الطبيعية (غالباً مع التعديلات الوراثية) والذكية (بسهولة كسب مقاومة للعلاج الكيميائي والإشعاعي)، CAF في الأنسجة السرطانية هي خلايا طبيعية وأكثر استقراراً وراثياً، لذلك هم أقل عرضة لتطوير مقاومة للعلاجات. ثانياً، لا يعتمد استهداف CAF على نوع الطفرات الأورامية في الخلايا السرطانية. ثالثاً، قد يحقق استهداف CAF تأثيرات إصابة متعددة من خلال مضادات الورم التي تعتمد على الخلايا الليفية، والتكوين المضاد للأنجيوعية، و/أو الاستجابة المناعية للسرطان المغيرة. نموذجنا الكروي ثلاثي الأبعاد هو أداة قوية لاكتشاف مجموعات متنوعة من الاستراتيجيات العلاجية للسرطان.
Disclosures
ويعلن صاحبا البلاغ أنه ليس لديهما مصالح مالية متنافسة.
Acknowledgements
نشكر الدكتورة أوميدا سي فيلاسكيز (جامعة ميامي) على التعاون والمشاورات والمناقشة المفيدة؛ الدكتور جي لي (جامعة ميامي) لتوفير خلايا MeWo؛ والدكتور ميهادر هيرلين (معهد ويستار) لتوفير جميع خلايا الورم الميلانيني الأخرى. كما نشكر الدكتورة مارسيا بولينا، مديرة مرفق التصوير التحليلي الأساسي، جامعة ميامي، على تحليل التصوير. تم دعم تشاو جون ليو بمنح من برنامج أبحاث السرطان Bankhead-Coley (جائزة 09BN-11) وجمعية سرطان المرأة (المنحة السنوية53) والأموال الداخلية من جامعة ميامي.
Materials
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA | Corning | 25-253-CI | |
| 24-well plate | Corning | 351147 | Non-tissue culture treated plate, 24-well, flat bottom with low evaporation lid |
| Alex Fluor 488 goat anti-mouse IgG | Life Technology | A21202 | |
| CaCl2 1.5 M | Sigma-Aldrich | C5670-500G | |
| Collagenase, Type 1A | Sigma-Aldrich | C-2674 | 500 mg, 1 mg/mL concentration in DMEM. |
| DakoCytomation | Dako | x0909 | |
| DAPI | |||
| Dispase Grade II | Roche Diagnostics | 165859 | |
| Dulbecco's Modified Eagle's Medium(DMEM) | Corning | 10-013-CV | |
| Fetal Bovine Serum | VMR | 97068-085 | Premium Grade |
| Fiji (ImageJ) | NIH | Free for downloading, no license needed. | |
| IncuCyte Zoom 2016A | Essen Bioscience | ||
| IncuCyte Zoom System | Essen Bioscience | ||
| Insulin | Sigma-Aldrich | I1882 | |
| L-15 Medium (Leibovitz) | Sigma-Aldrich | L1518 | |
| Leica SP5 Inverted Confocal Microscope | Leica | ||
| MCDB 153 Medium | Sigma-Aldrich | M7403-10X1L | |
| Mouse anti α-SMA (smooth muscle actin), monoclone | Abcam | ab18640 | |
| Olympus IX51 Inverted Fluorescence Microscope | Olympus | IX51 | |
| Olymupus CellSens | Olympus | ||
| PD0325901 | Selleckchem Chemicals | S1036 | |
| Penicillin Streptomycin Solution | Corning | 30-002- CI | 100 X |
| Sodium Bicarbonate 7.5% | Corning | 25-035-CI |
References
- Lorusso, G., Ruegg, C. The tumor microenvironment and its contribution to tumor evolution toward metastasis. Histochemistry and Cell Biology. 130, 1091-1103 (2008).
- Anton, K., Glod, J. Targeting the tumor stroma in cancer therapy. Current Pharmaceutical Biotechnology. 10, 185-191 (2009).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144, 646-674 (2011).
- Junttila, M. R., de Sauvage, F. J. Influence of tumour micro-environment heterogeneity on therapeutic response. Nature. 501, 346-354 (2013).
- Allinen, M., et al. Molecular characterization of the tumor microenvironment in breast cancer. Cancer Cell. 6, 17-32 (2004).
- Bhowmick, N. A., Neilson, E. G., Moses, H. L. Stromal fibroblasts in cancer initiation and progression. Nature. 432, 332-337 (2004).
- Lynch, C. C., Matrisian, L. M. Matrix metalloproteinases in tumor-host cell communication. Differentiation. 70, 561-573 (2002).
- Midwood, K. S., Williams, L. V., Schwarzbauer, J. E. Tissue repair and the dynamics of the extracellular matrix. The International Journal of Biochemistry & Cell Biology. 36, 1031-1037 (2004).
- Olumi, A. F., et al. Carcinoma-associated fibroblasts direct tumor progression of initiated human prostatic epithelium. Cancer Research. 59, 5002-5011 (1999).
- Orimo, A., Weinberg, R. A. Stromal fibroblasts in cancer: a novel tumor-promoting cell type. Cell Cycle. 5, 1597-1601 (2006).
- Luga, V., et al. Exosomes mediate stromal mobilization of autocrine Wnt-PCP signaling in breast cancer cell migration. Cell. 151, 1542-1556 (2012).
- Zhang, X. H., et al. Selection of bone metastasis seeds by mesenchymal signals in the primary tumor stroma. Cell. 154, 1060-1073 (2013).
- Orimo, A., et al. Stromal fibroblasts present in invasive human breast carcinomas promote tumor growth and angiogenesis through elevated SDF-1/CXCL12 secretion. Cell. 121, 335-348 (2005).
- Shao, H., et al. Activation of Notch1 signaling in stromal fibroblasts inhibits melanoma growth by upregulating WISP-1. Oncogene. 30, 4316(2011).
- Ziani, L., Chouaib, S., Thiery, J. Alteration of the Antitumor Immune Response by Cancer-Associated Fibroblasts. Frontier in Immunology. 9, 414(2018).
- Kraman, M., et al. Suppression of antitumor immunity by stromal cells expressing fibroblast activation protein-alpha. Science. 330, 827-830 (2010).
- Straussman, R., et al. Tumour micro-environment elicits innate resistance to RAF inhibitors through HGF secretion. Nature. 487, 500-504 (2012).
- Smalley, K. S., Lioni, M., Noma, K., Haass, N. K., Herlyn, M. In vitro three-dimensional tumor microenvironment models for anticancer drug discovery. Expert Opinion on Drug Discovery. 3 (1), 1-10 (2007).
- Santiago-Walker, A., Li, L., Haass, N. K., Herlyn, M. Melanocytes: from morphology to application. Skin Pharmacology and Physiology. 22, 114-121 (2009).
- Beaumont, K. A., Mohana-Kumaran, N., Haass, N. K. Modeling melanoma in vitro and in vivo. Healthcare (basel). 2, 27-46 (2013).
- Beaumont, K. A., Anfosso, A., Ahmed, F., Weninger, W., Haass, N. K. Imaging- and flow cytometry-based analysis of cell position and the cell cycle in 3D melanoma spheroids. Journal of Visualized Experiments. (106), e53486(2015).
- Weiswald, L. B., Bellet, D., Dangles-Marie, V. Spherical cancer models in tumor biology. Neoplasia. 17, 1-15 (2015).
- Cui, X., Hartanto, Y., Zhang, H. Advances in multicellular spheroids formation. Journal of the Royal Society Interface. 14, (2017).
- Fennema, E., Rivron, N., Rouwkema, J., van Blitterswijk, C., de Boer, J. Spheroid culture as a tool for creating 3D complex tissues. Trends in Biotechnology. 31, 108-115 (2013).
- Thoma, C. R., Zimmermann, M., Agarkova, I., Kelm, J. M., Krek, W. 3D cell culture systems modeling tumor growth determinants in cancer target discovery. Advanced Drug Delivery Review. 69-70, 29-41 (2014).
- Bulin, A. L., Broekgaarden, M., Hasan, T. Comprehensive high-throughput image analysis for therapeutic efficacy of architecturally complex heterotypic organoids. Scientific Reports. 7, 16645(2017).
- Lazzari, G., et al. Multicellular spheroid based on a triple coculture: A novel 3D model to mimic pancreatic tumor complexity. Acta Biomaterialia. 78, 296-307 (2018).
- Fong, E. L., Harrington, D. A., Farach-Carson, M. C., Yu, H. Heralding a new paradigm in 3D tumor modeling. Biomaterials. 108, 197-213 (2016).
- Gu, L., Mooney, D. J. Biomaterials and emerging anticancer therapeutics: engineering the microenvironment. Nature Reviews Cancer. 16, 56-66 (2016).
- Tevis, K. M., Colson, Y. L., Grinstaff, M. W. Embedded Spheroids as Models of the Cancer Microenvironment. Advanced Biosystems. 1, (2017).
- Welch, D. R., et al. Characterization of a highly invasive and spontaneously metastatic human malignant melanoma cell line. International Journal of Cancer. 47, 227-237 (1991).
- Balint, K., et al. Activation of Notch1 signaling is required for beta-catenin-mediated human primary melanoma progression. Journal of Clinical Investigation. 115, 3166-3176 (2005).
- Meier, F., et al. Human melanoma progression in skin reconstructs : biological significance of bFGF. the American Journal of Pathology. 156, 193-200 (2000).
- Du, Y., et al. Intracellular Notch1 Signaling in Cancer-Associated Fibroblasts Dictates the Plasticity and Stemness of Melanoma Stem/Initiating Cells. Stem Cells. 37, 865-875 (2019).
- Shao, H., et al. Notch1 Pathway Activity Determines the Regulatory Role of Cancer-Associated Fibroblasts in Melanoma Growth and Invasion. PLoS One. 10, 0142815(2015).
- Shao, H., et al. Notch1-WISP-1 axis determines the regulatory role of mesenchymal stem cell-derived stromal fibroblasts in melanoma metastasis. Oncotarget. 7, 79262-79273 (2016).
- Kalluri, R., Neilson, E. G. Epithelial-mesenchymal transition and its implications for fibrosis. Journal of Clinical Investigation. 112, 1776-1784 (2003).
- Price, J. E. Xenograft models in immunodeficient animals : I. Nude mice: spontaneous and experimental metastasis models. Methods in Molecular Medicine. 58, 205-213 (2001).
- Spaeth, E. L., et al. Mesenchymal stem cell transition to tumor-associated fibroblasts contributes to fibrovascular network expansion and tumor progression. PLoS One. 4, 4992(2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved