Method Article
Um novo modelo esferoide de tumor 3D modulado por fibrosa estromal para estudar a interação tumoral-stroma e a descoberta de drogas
Neste Artigo
Resumo
Um novo modelo esferoide tridimensional baseado na interação heteroplípica das células tumorais e fibroblastos estrômios é estabelecido. Aqui, apresentamos cocultura de células tumorais e fibroblastos estrômicos, imagens de lapso de tempo e microscopia confocal para visualizar a formação de esferoides. Este modelo tridimensional oferece uma plataforma pertinente para estudar interações tumor-stroma e testar a terapêutica do câncer.
Resumo
As interações tumorais-stroma desempenham um papel importante na progressão do câncer. Modelos de esferoide tumorais tridimensionais (3D) são os modelos in vitro mais utilizados no estudo de células cancerígenas/inatidas, pesquisa de câncer pré-clínico e rastreamento de medicamentos. Os modelos esferoides 3D são superiores à cultura convencional das células tumorais e reproduzem alguns personagens importantes de tumores sólidos reais. No entanto, os esferoides tumorais 3D convencionais são compostos exclusivamente por células tumorais. Faltam a participação de células estrumárias tumorais e possuem deposição insuficiente de matriz extracelular (ECM), imitando parcialmente as condições in vivo dos tecidos tumorais. Estabelecemos um novo modelo esferoide 3D multicelular composto por células tumorais e fibroblastos estrômicos que imita melhor o microambiente tumoral heterogêneo in vivo e sua desmoplasia nativa. A formação de esferoides é estritamente regulada pelos fibroblastos estrômios tumorais e é determinada pela atividade de certas vias de sinalização intracelular cruciais (por exemplo, sinalização de entalhe) em fibroblastos estrômios. Neste artigo, apresentamos as técnicas de cocultura de fibroblastos tumorais-estrônomo, imagens de lapso de tempo para visualizar interações células-células e microscopia confocal para exibir as características arquitetônicas 3D dos esferoides. Também mostramos dois exemplos da aplicação prática deste modelo esferoide 3D. Este novo modelo esferoide 3D multicelular oferece uma plataforma útil para estudar a interação tumoral-stroma, elucidando como fibroblastos estrômios regulam células cancerígenas/iniciantes, que determinam a progressão e a agressividade do tumor, e exploram o envolvimento da reação estrária na sensibilidade e resistência dos medicamentos cancerosos. Esta plataforma também pode ser um modelo in vitro pertinente para a descoberta de drogas.
Introdução
Tumores sólidos representam tecidos complexos compostos por células neoplásticas e uma grande variedade de células estrumárias1,2,3,4. Os fibroblastos estrumes, ou fibroblastos associados ao câncer (CAF), são uma das populações de células estrume proeminentes na maioria dos tipos de tumores sólidos. Estão criticamente envolvidos na regulação do crescimento tumoral, caule, metástase, angiogênese e resistência medicamentosa através da produção de fatores de crescimento, citocinas/quimokinas, síntese de ECM e enzimas remodeladoras (por exemplo, colágeno, fibronectina e metaloproteases matriciais), liberação de exosóis e interação direta heteroptípica celular-célula5,6,7,8,9,10, 101 , 101 , 101 , 101 . A CAF também participa na determinação da metástase específica do órgão cancero, pré-selecionando um subconjunto de clones tumorais de populações de células tumorais heterogêneas na lesão primária e fomentando esses clones selecionados para serem preparados para metástase a um órgão distante específico cujo microambiente é ideal para a recolonização de clones selecionados12. Além disso, os fibroblastos e seus fatores solúveis secretos e o ECM participam da modulação da angiogênese tumoral13,14, resposta imune antitumoral15, e estão até envolvidos na resistência a medicamentos e recidiva do tumor16,17.
Modelos de esferoide sheróide suofóide sufóis in vitro foram desenvolvidos e utilizados na pesquisa do câncer como modelo intermediário entre culturas celulares in vitro cancerosas e modelos in vivo tumoristo 18,19,20,21. Os modelos de esferoide tumoral 3D ganharam popularidade na pesquisa de células-tronco do câncer, pesquisa de câncer pré-clínico e rastreamento de medicamentos porque esses modelos reproduzem algumas características importantes de tumores reais que estão ausentes em monocamadas 2D tradicionais22. Muitos modelos esferoides tumorais 3D existentes são constituídos exclusivamente por células tumorais e não têm a participação de células estróides tumorais. Isso muitas vezes resulta em esferoides tumorais com deposição insuficiente de ECM e ausência de interações células-células heterotépicas. Esferoides 3D convencionais formados exclusivamente por células cancerosas e adesão homoppicacelular célula-célula só podem imitar parcialmente as condições in vivo dos tecidos tumorais. Para superar algumas dessas limitações, os pesquisadores propuseram incorporar vários tipos de células estrumárias em coculturas 3D e desenvolveram vários modelos de esferoide tumoral heterotipo 3D23,24,25,26,27. Além disso, os investigadores empregaram matrizes 3D exógenas, incluindo hidrogéis naturais ou polímeros sintéticos como polietileno glicol, poli (lactide- co-glicolide) e poli (N-isopropylacrilamida), para incorporar modelos de esferoide monocelular e multicelular, criando um ambiente de suporte celular e reproduzindo interações matrizes celulares28,29,tornando esses sistemas mais biologicamente relevantes30. No entanto, a incorporação de certos tipos de células estrôteras, como células endoteliais, em coculturas 3D traz complexidade adicional para um sistema in vitro e dificulta o estudo de interações heteroptípicas células celulares entre dois tipos específicos de células, como interações células-fibroblasto cancerosas. Além disso, as células endoteliais em tecidos reais nem sempre interagem diretamente com células cancerosas e outras células estrônes porque há uma camada de membrana do porão envolta fora dos capilares que impede que as células endoteliais interajam diretamente com células cancerosas e outras células estrônes. Nesses modelos esferoides 3D, as células endoteliais incorporadas não formam vasos sanguíneos, mas interagem diretamente com células cancerígenas e outras células estrôteras, algo que raramente ocorre no vivo. Da mesma forma, matrizes exógenas empregadas em alguns dos modelos esferoides 3D não são idênticas ao ECM em tecidos tumorais reais em termos de estrutura e composição. Todas essas condições artificiais podem resultar em dados enganosos.
Recentemente criamos um novo modelo esferoide 3D multicelular composto por células tumorais e CAF. No nosso modelo, a formação de esferoides tumorais 3D é inteiramente determinada pela CAF. O CAF induz e regula o fenótipo das células de tronco/início do tumor. O ECM produzido pela CAF é natural e permite que a estrutura desmoplástica imite melhor o microambiente tumoral in vivo. Este novo modelo 3D pode ser uma ferramenta útil para o rastreamento de medicamentos contra o câncer e oferece uma plataforma única para estudar a interação tumoral-stroma, elucidar como a CAF regula o câncer/instituir células, e explorar o envolvimento de interações estrumárias na sensibilidade e resistência de medicamentos cancerígenos.
Protocolo
1. Células de Melanoma culintura e fibroblastos da pele
- Culturing células de melanoma humano
- Células de melanoma humano cultura, C816131 condições convencionais de cultura celular aderente em meio W489 completo (ver passo 1.2) em uma incubadora de 37 °C fornecida com 5% de CO2 como descrito anteriormente32. Divida as células a uma proporção de 1:5 quando atingem ~90% de confluência.
- Meio de cultura celular melanoma (W489)
- Para médio W489 completo, utilize 80% de mcdb153 médio, 20% L-15 médio (ver Tabela de Materiais),2% soro bovino fetal (FBS), 5 μg/mL insulina, 1,68 mM CaCl2e 0,11% bicarbonato de sódio. Para cocultura, não adicione FBS, insulina e CaCl2.
- Isolamento do fibroblasto da pele do rato
- Corte um fragmento de pele de 1 cm x 1 cm de um camundongo de acordo com as diretrizes e regulamentos relevantes do Comitê de Cuidados e Uso de Animais (IACUC) da instituição.
- Digerir a pele por dispase (ver Tabela de Materiais) a 4 °C durante a noite. Retire a derme da epiderme e digerir com colagenase (1 mg/mL em DMEM, consulte Tabela de Materiais) à temperatura ambiente (RT) durante a noite.
- Culturing do fibroblasto da pele do rato
- Lave as pelotas de tecido com PBS e as cultura em DMEM com 10% de FBS e 1% de penicilina-estreptomicina em 37 °C/5% CO2. Divida as células a uma proporção de 1:2 quando atingem ~90% de confluência.
- Transdutore os fibroblastos da pele com GFP/lentivírus usando métodos padrão antes da cocultura.
- Caracterização de fibroblastos da pele do rato por imunocoloração
- Preparação celular para coloração
- Sementes os fibroblastos de pele em 24 pratos de poço em uma densidade de 2 x 104 células/poço. No dia 2, lave as células com PBS 2x e fixe-as em formalina tampão neutro de 2% por 10 min. Remova a formalina e lave as células fixas com PBS duas vezes.
- Imunocoloração
- Adicione 200 μL de solução de bloqueio a cada poço e incuba a placa por 30 min na RT, em seguida, adicione mouse anti-α-SMA diluído em 1:200 e incubar a 37 °C para 1 h. Lave com PBS 3x, 5 min cada.
- Adicione Alex Fluor 488 cabra anti-mouse IgG a 1:400 diluição e incubar na RT por 1h. Lave os anticorpos 3x com PBS, 5 min cada.
- Adicione 1 μg/mL DAPI e incuba na RT por 2 min. Remova a solução DAPI e adicione 500 μL de PBS em cada poço.
- Observe as células e tire imagens usando um microscópio de fluorescência invertido.
- Preparação celular para coloração
- Fibroblastos pré-rotulados e células de melanoma
- Fibroblastos de sementes em um prato de 100 mm no primeiro dia para que a confluência celular atinja ~60% no dia seguinte. No dia 2, remova o meio de cultura e adicione GFP/lentivírus (~1:3-1:5 diluído do estoque) em meio de cultura regular com 4 μg/mL de polibrene. Incubar células em uma incubadora de 37 °C por 6h, remova o meio e substitua por meio de cultura regular fresca. Após 2 dias, observe o sinal GFP das células usando um microscópio de fluorescência. Transduce células C8161 com DsRed/lentivírus em condições semelhantes. Protocolos para a preparação do GFP/lentivirus e DsRed/lentivirus foram descritos anteriormente14,34.
2. Cocultura celular
- Semente semed a cocultura C8161-fibroblasto.
- No dia 0 do ensaio de formação esferoide, desative tanto o C8161 quanto os fibroblastos da pele usando 0,25% de trypsin-EDTA. Gire as células a 250 g por 5 min na RT e lave uma vez com PBS.
- Resuspenda as células em meio de cocultura celular (livre de soro, livre de insulina e meio W489 livre de cálcio misturado com DMEM livre de soro a uma proporção 1:1). Ajuste a concentração celular para 2 x 104 células/mL.
- Misture as células C8161 com os fibroblastos a uma proporção 1:1 e adicione 2 mL das misturas celulares a cada poço de uma placa de 24 poços. Cada poço deve conter 2 x 104 de cada tipo de células. Cada condição deve ser feita em triplicado.
NOTA: É importante usar uma placa tratada de cultura não-tecidual (ver Tabela de Materiais). Caso contrário, as células se prenderão fortemente a uma placa e não poderão suspender esferoides.
- Incubar as células a 37 °C por 4 h até que as células se conectem à placa e, em seguida, realizem imagens de lapso de tempo ou varredura confocal nos pontos de tempo indicados para cada ensaio.
3. Imagem de lapso de tempo do tempo do celular ao vivo
- Antes da cocultura, ligue o sistema de imagem de lapso de tempo (ver Tabela de Materiais) seguindo as instruções do fabricante e deixe a incubadora atingir 37 °C e 5% de CO2. Normalmente leva 1h para o sistema atingir o equilíbrio. Coloque cuidadosamente a placa de cultura no palco do microscópio dentro da incubadora e tranque com segurança a porta.
- Abra o software do sistema de imagem de lapso de tempo (ver Tabela de Materiais)e escolha o tipo de placa e o fabricante para que o microscópio possa localizar a área de digitalização com precisão. Escolha os poços de interesse e uma lente objetiva de 10x. Escolha as configurações para a área de digitalização, o intervalo entre os exames e uma partida, bem como um tempo final. Neste protocolo, o número máximo de formato para a área de digitalização para 1 poço é de 36 e o intervalo é de 1 h.
- Recorde de imagem de lapso de tempo de 4 a 52 h.
NOTA: O tempo de partida, o tempo de término e a duração devem ser otimizados pelo tipo de célula e o propósito do experimento. - Ao concluir a gravação de imagens, use o software do sistema de imagem de lapso de tempo para recuperar os dados e exportar vídeos ou conjuntos de imagens.
4. Microscopia Confocal e Filmes 3D
- Coloque a placa de cocultura celular no palco de um microscópio de fluorescência invertido (ver Tabela de Materiais)e use raios laser vermelhos e verdes. Observe as células uma lente objetiva de 5x ou 10x e escolha um esferoide para começar a digitalizar.
- Use um passo de 1 μm z para escanear de baixo para cima do esferoide. Processe os dados usando software de processamento de imagens (ver Tabela de Materiais) para reconstruir uma imagem 3D que pode ser ainda mais girada e salva como um filme 3D.
5. Cultura Solo de Células de Melanoma e Formação de Clusters/Agregados 2D
- Sementes 2 x 104 Células de melanoma C8161 em cada poço de uma placa de 24 poços conforme descrito na seção 2.1. Cultura as células por 7 a 10 dias e fotografe-as usando um microscópio de fluorescência invertido.
6. Verificar se spheróides 3D e clusters/agregados de células 2D estão suspensos no Médio ou anexados às placas
- Para cocultura celular, verifique os esferoides 3D formados no dia 7. Para obter cultura celular única, verifique os clusters/agregados 2D formados no dia 10.
- Coloque placas de cultura celular na plataforma de um microscópio de fluorescência invertido. Coloque uma agulha dobrada com uma seringa em um poço e gentilmente aspirar o meio cultural dentro e fora para perturbar o meio cultural nos poços. Grave esse processo usando o modo de filme do software de filme (ver Tabela de Materiais). Os esferoides 3D serão móveis, mas os clusters/agregados de células 2D permanecerão firmes.
7. Imagem confocal de Spheróides 3D
NOTA: As células cocultivadas começam a formar esferoides de 48 a 72 h, dependendo do tipo de fibroblastos usados. Geralmente, os esferoides aumentam gradualmente com o tempo. Pequenos esferoides podem se fundir para formar esferoides maiores até o dia 7. Depois que os esferoides são estabilizados em tamanho, eles podem durar mais de 10 dias. Depois disso, os esferoides muitas vezes se desprendem do fundo da placa de cultura e se reúnem no centro dos poços. Durante o alargamento dos esferoides, as células do centro geralmente morrem devido à nutrição insuficiente e/ou um microambiente tóxico. Assim, o pico de formação e tempo de esferoide 3D para visualizar os esferoides maduros deve ser otimizado usando experimentos piloto. Para este protocolo, a microscopia confocal foi realizada por volta do dia 7, quando os esferoides eram maduros e as células no centro dos esferoides ainda estavam vivas de acordo com a fluorescência e morfologia das células no centro.
- Para fazer microscopia confocal, use um laser verde e vermelho para escanear os esferoides. Determine a área de digitalização um objetivo de 10x e mova-se da parte inferior para o topo do esferoide com um passo de 1 μm z.
- Gere os vídeos de formação e rotação de esferoides 3D usando a função de projeção 3D do software de processamento de imagem (por exemplo, ImageJ).
8. Atividade intracelular notch1 sinalização caminho na determinação da regulação estrária de células cancerígenas/inicialização
- Isolamento e caracterização de fibroblastos da pele a partir de camundongos Notch1 de ganho e perda de função
- Isolar fibroblastos da pele de dois pares de camundongos geneticamente modificados: Entalhe de Ganho de Função1 (GOFNotch1: Fsp1.Cre+/-; ROSALSL-N1IC+/+) mouses versus seu controle de contraparte (GOFctrl : FSP1. Cre-/-; ROSALSL-N1IC+/+) ratos e entalhe de perda de função1 (LOFNotch1: Fsp1.Cre+/-; Notch1LoxP/LoxP+/+) mouses versus seu controle de contraparte (LOFctrl : FSP1. Cre-/-; Notch1LoxP/LoxP+/+) mouses31,respectivamente. Isolar e caracterizar fibroblastos da pele usando o protocolo descrito nas seções 1.3-1.5.
- Transdutore os fibroblastos da pele do rato com GFP/lentivírus.
- Consulte a seção 1 para que o método transdutor as células com o vetor lentiviral.
- Cocultura de fibroblastos e células de melanoma
- Conduza o experimento de cocultura celular como descrito na seção 2.
- Avaliar o efeito da atividade intracelular da via Notch1 nos fibroblastos na determinação da regulação estrumária de células de câncer/início, medindo os tamanhos dos esferoides 3D
- Realize a quantificação da formação de esferoides cada condição fotografando os esferoides no momento em que os esferoides são maduros (indicados pela parada do crescimento por volta do dia 5-7, dependendo dos tipos de fibroblastos). Meça os tamanhos dos esferoides 3D usando o software de processamento de imagens.
9. Testando a resposta medicamentosa de células cancerígenas/initiadores usando o ensaio spheróide 3D
NOTA: O CAF pode regular a heterogenicidade do câncer e induzir fenótipo de células cancerígenas/de início. A CAF também apoia células cancerígenas/de início para suportar tratamentos clínicos. Células-tronco cancerígenas têm sido responsáveis pela resistência a medicamentos. Por isso, usamos esse modelo esferoide 3D para avaliar a resposta medicamentosa de células cancerígenas/intitantes. O resultado pode avaliar bem a eficácia clínica potencial da medicação anticâncer.
- Administração de drogas
- Logo após a coculação das células em uma placa de poço de 24, prepare as drogas em uma diluição serial em meio cultural para atingir 5x de uma gama desejada de concentrações baseadaem em experimentos piloto (ou seja, 1 nM, 2,5 nM, 5 nM, 10 nM e 25 nM).
Adicione 0,5 mL de soluções de medicamentos correspondentes a cada poço das células coculturadas. Trate o grupo controle com mídia de cocultura regular como mencionado acima. - NOTA: O inibidor MEK é solúvel na mídia da cultura celular. Portanto, os controles em branco são de 2,5 mL de meio de cultura celular. No entanto, se a droga não é solúvel em solução aquosa e requer solventes como o DMSO, então a mídia de cultura celular com a mesma concentração de DMSO deve ser aplicada ao grupo controle.
- Logo após a coculação das células em uma placa de poço de 24, prepare as drogas em uma diluição serial em meio cultural para atingir 5x de uma gama desejada de concentrações baseadaem em experimentos piloto (ou seja, 1 nM, 2,5 nM, 5 nM, 10 nM e 25 nM).
- Quantificação da resposta a medicamentos contando esferoides
- Observe as células tratadas e células não tratadas usando um microscópio de fluorescência e fotografe as células todos os dias. Quantifique a formação esferoide nos diferentes grupos experimentais e compare a capacidade de formação de esferoides das culturas celulares diferentes concentrações de drogas.
NOTA: Os esferoides tendem a aparecer ~5-7 dias após a cocultura. Os efeitos das drogas se tornarão perceptíveis nesse momento. - Use microscópio de fluorescência para fotografar/fotografar os esferoides e células nos poços e, em seguida, use o software de imagem para calcular o tamanho médio dos esferoides e o número de esferoides formados por campo de baixa potência (LPF x 4) em cada grupo de tratamento ao longo do tempo.
NOTA: As células que recebem tratamento medicamentoso eficaz devem formar menos ou nenhum esferoide em comparação com o grupo controle. Isso é uma indicação da eficácia da droga testada na supressão de células-tronco cancerígenas.
- Observe as células tratadas e células não tratadas usando um microscópio de fluorescência e fotografe as células todos os dias. Quantifique a formação esferoide nos diferentes grupos experimentais e compare a capacidade de formação de esferoides das culturas celulares diferentes concentrações de drogas.
Resultados
Desenvolvemos um novo método para gerar esferoides 3D com um sistema de cocultura celular heteroptorípica in vitro que imita o microambiente tumoral in vivo. Os fibroblastos são derivados de fibroblastos da pele do rato. Os fibroblastos da pele foram gerados como descritoacima e caracterizados como α-SMA+/Vimentin+/FSP-1+ células. As células de melanoma metastático humano (C8161) foram cultivadas em meio W489, conforme descrito32. Para visualizar e distinguir fibroblastos de células tumorais, fibroblastos e células de melanoma foram pré-transecíveis com GFP/lentivírus e DsRed/lentivirus, respectivamente34,36, antes da cocultura celular.
A Figura 1 mostra um exemplo de esferoides 3D multicelulares formados por células de melanoma e fibroblastos. As células de melanoma cultivadas na ausência de fibroblastos não formavam esferoides 3D típicos, embora algumas células de melanoma formem clusters/agregados 2D com a cultura estendida. O tamanho médio dos esferoides foi de aproximadamente 170-360 μm de diâmetro (média = 275, SD = 37) no dia ~5-7. Usando imagens de lapso de tempo, observamos que fibroblastos e células tumorais interagiram na cocultura e começaram a formar esferoides 3D a cerca de 36 h de cocultura, como mostrado no Vídeo 1. A imagem de lapso de tempo registrou o processo dinâmico de interação celular-célula e a fase inicial da formação esferoide em ~4-52 h de cocultura. O pico de formação esferoide 3D ocorreu por volta do dia ~5-7. Os esferoides 3D formados eram compostos por fibroblastos e células de melanoma, onde a maioria (~80%) eram células tumorais. O vídeo 2 mostra o processo dinâmico de células de melanoma cultivadas únicas (DsRed+/C8161) na formação de aglomerados/agregados celulares a partir de ~4-52 h na cultura única. A formação de clusters/agregados 2D atingiu o pico por volta do dia ~7-10. O vídeo 3 e o Vídeo 4 mostram as estruturas de um esferoide 3D e um aglomerado de células tumorais 2D visualizados por microscopia confocal, respectivamente. O esferoide 3D e os aglomerados de células tumorais 2D foram examinados por microscopia confocal no dia 7 de cocultura celular. O vídeo 5 mostra que os esferoides 3D foram suspensos no meio cultural e no celular, enquanto o Vídeo 6 mostra que o aglomerado de células tumorais 2D estava ligado à placa de cultura e imóvel. A suspensão no meio é uma característica dos esferoides 3D que os distingue de clusters 2D. Quando o meio no prato de cultura celular ou bem é perturbado por cair ou encanar suavemente o meio cultural, os esferoides 3D suspensos se movem, enquanto os aglomerados de células 2D são imóveis. Apenas algumas células mortas são móveis.
A Figura 2A mostra um exemplo desse modelo 3D servindo como uma plataforma única para estudar interações tumor-stroma e elucidar como a atividade intracelular notch1 sinalizando a atividade da via no CAF regula células com tronco/início do câncer e formação esferoide. Dois pares de fibroblastos (Fb) isolados da pele do Entalhe De Ganho de Função1 (GOFNotch1: Fsp1.Cre+/-; ROSALSL-N1IC+/+) mouses versus seu controle de contraparte (GOFctrl : FSP1. Cre-/-; ROSALSL-N1IC+/+) ratos e entalhe de perda de função1 (LOFNotch1: Fsp1.Cre+/-; Notch1LoxP/LoxP+/+) mouses versus seu controle de contraparte (LOFctrl : FSP1. Cre-/-; Notch1LoxP/LoxP+/+) mouses35,respectivamente. Todos os fibroblastos foram transduceds pelo GFP/lentivírus e cocultivados com células de melanoma C8161 pré-transinduzidas com DsRed/lentivírus. Imagens de lapso de tempo mostram que fb-GOFNotch1 impediu que as células de melanoma C8161 formassem esferoides 3D em comparação com oCTRL fb-GOF durante os primeiros ~4-52 h de cocultura celular. Em contrapartida, fb-LOFNotch1 promoveu a formação de esferoides 3D por células de melanoma C8161 em comparação com oCTRLFB-LOF . Figura 2B, topo, mostra imagens representativas de esferoides 3D formados no 7º dia de cocultura celular com diferentes fibroblastos realizando variadas atividades de caminho de Notch. Figura 2B, inferior, mostra os dados quantitativos sobre o tamanho médio dos esferoides 3D formados no 7º dia de cocultura celular com diferentes fibroblastos carregando variadas atividades de caminho de Notch.
A Figura 3 mostra um exemplo desse modelo 3D sendo usado para testar a resposta medicamentosa de células cancerígenas/intitantes. Células cancerígenas/de início têm se mostrado responsáveis pela resistência a medicamentos e recidiva do câncer. Portanto, avaliar a resposta medicamentosa usando este modelo 3D pode revelar melhor a eficácia clínica de um medicamento potencial para o tratamento do câncer. As células de melanoma C8161 dependem da sinalização ATIVA MAPK para crescimento celular e invasão. Eles também expressam altos níveis de CDK4/Kit, mas não carregam uma mutação BRAF. Para testar a resposta medicamentosa de células cancerígenas/de início de células em direção ao inibidor MAPK usando este modelo 3D, coculturamos células de melanoma C8161 e fibroblastos em 24 placas de poço. PD0325901 (ver Tabela de Materiais),um inibidor MAPK, foi preparado em uma diluição serial a uma gama de concentrações de 1 nM, 2,5 nM, 5 nM, 10 nM e 25 nM. O PD0325901 foi adicionado às coculturas celulares quando as misturas celulares foram banhadas. Células coculturadas não tratadas foram usadas como controle. Avaliamos a capacidade de formação de esferoides das coculturas celulares diferentes concentrações de drogas e comparamos com o controle não tratado. Figura 3A mostra imagens representativas de esferoides 3D formados no 5º dia de cocultura celular diferentes concentrações de drogas. A Figura 3B é o dado quantitativo do tamanho médio por esferoide e números de esferoides 3D formados por campo de baixa potência (LPF x 4) no 5º dia da cocultura celular diferentes concentrações de medicamentos.
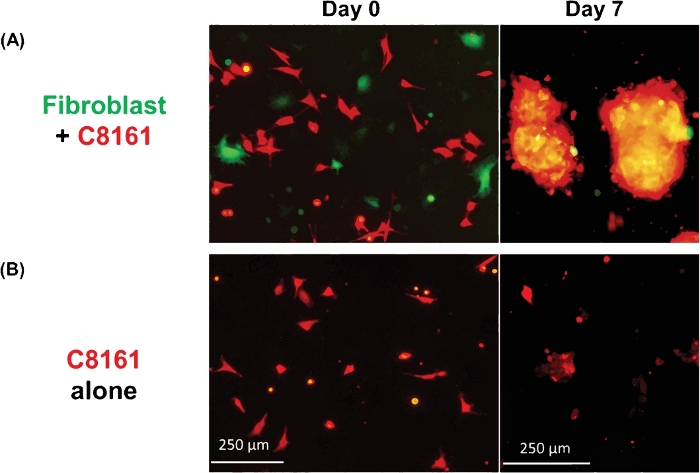
Figura 1: Formação de esferoides 3D e clusters 2D. (A) Imagem representativa de esferoides 3D formados pela cocultura de células de melanoma C8161 humanas e fibroblastos da pele do rato. Os esferoides 3D foram fotografados no 7º dia da cocultura de células de melanoma e fibroblastos. Os tamanhos médios dos esferoides foram de ~170-360 μm de diâmetro (média = 275, SD = 37) no dia ~5-7. O número médio de esferoides foi de 18 a 26 (20,5 ± 3,6) por campo de baixa potência (LPF x4). (B) Imagem representativa de aglomerados de células tumorais 2D formados pela cultura única das células de melanoma C8161. Os aglomerados de células de melanoma 2D foram fotografados no 7º dia de uma única cultura de células de melanoma. Clique aqui para ver uma versão maior deste valor.
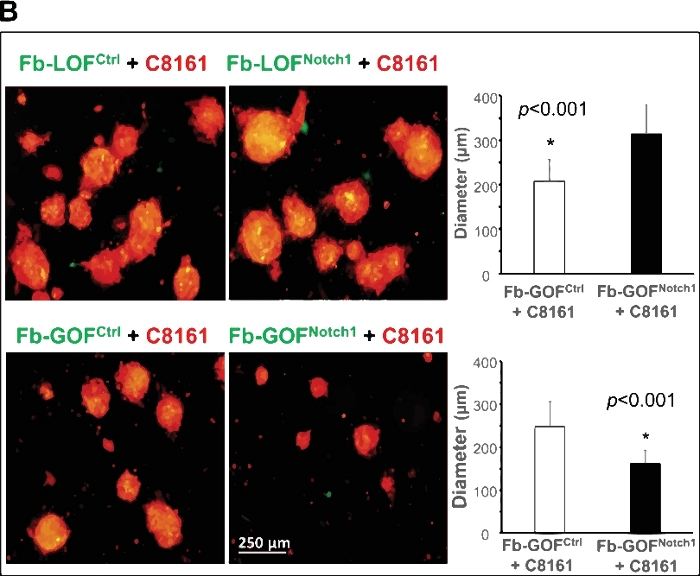
Figura 2: Elucidação do papel do Entalhe 1 intracelular sinalizando a atividade da via no CAF na regulação de células cancerígenas/inicialização usando o modelo esferoide 3D. (A)A atividade intracelular de sinalização notch1 no CAF determinou a formação de esferoides por células de melanoma na cocultura celular. O vídeo de lapso de tempo mostra que o Fb-GOFNotch1 parou a formação de esferoides 3D pelas células de melanoma C8161, enquanto fb-LOFNotch1 promoveu a formação de mais esferoides 3D pelas células de melanoma C8161 durante as primeiras 4-52 h de cocultura celular. (B) Topo: Imagens representativas de esferoides 3D formaram-se no 7º dia de cocultura celular com diferentes fibroblastos carregando variadas funções de caminho notch. Fundo: Os dados quantitativos do tamanho médio (diâmetro [μm]/esferoide) dos esferoides 3D formados no 7º dia de cocultura celular com diferentes fibroblastos carregando variadas atividades de caminho de notch. O teste t do aluno de duas caudas foi usado para análise estatística. Os dados são expressos como média ± desvio padrão (DP). Clique aqui para ver uma versão maior deste valor.
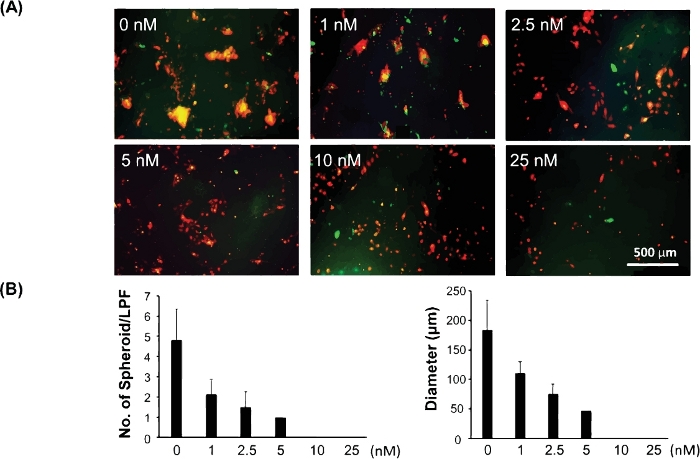
Figura 3: Avaliação da resposta medicamentosa de células cancerígenas/de início usando o modelo esferoide 3D. (A)Imagens representativas de esferoides 3D formaram-se no 5º dia de cocultura celular diferentes concentrações de drogas. (B) Os dados quantitativos do tamanho médio (diâmetro [μm]/esferoide) e o número de esferoides 3D por campo de baixa potência (LPF x 4) formaram-se no 5º dia de cocultura celular diferentes concentrações de medicamentos. Os dados quantitativos são expressos como média ± desvio padrão (DP). Clique aqui para ver uma versão maior deste valor.
Vídeo 1: Processo dinâmico de formação de esferoides 3D na fase inicial da cocultura celular. Imagens de lapso de tempo mostram interações dinâmicas de células celulares entre fibroblastos e células tumorais na cocultura e formação de esferoides 3D durante os primeiros ~4-52 h de cocultura celular. As células começaram a formar esferoides 3D por volta de 48 h após o início da cocultura. O pico de formação esferoide 3D ocorreu no dia ~5-7 (não exibido aqui). Os esferoides 3D eram compostos por fibroblastos e células de melanoma, onde a maioria (~80%) eram células tumorais. Clique aqui para baixar este vídeo.

Vídeo 2: Processo dinâmico de formação de clusters 2D na fase inicial da cocultura celular. A imagem em lapso de tempo mostra o processo dinâmico de clusters 2D formados por células C8161 melanoma em cultura única. A formação de clusters 2D ocorreu por volta do dia ~7-10. A imagem em lapso de tempo registra o período de ~4-52 h na cultura única das células de melanoma DsRed+/C8161. Clique aqui para baixar este vídeo.
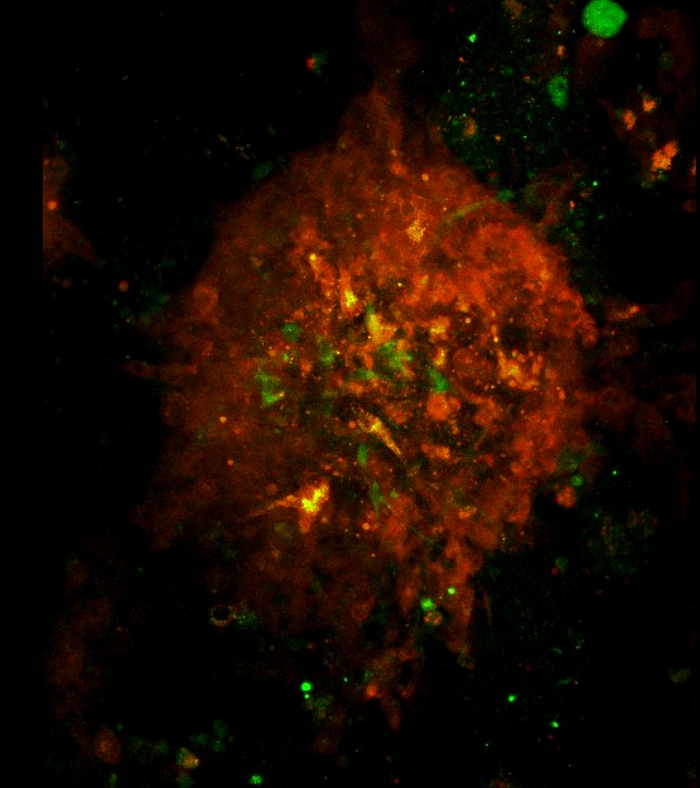
Vídeo 3: Arquitetura e rotação de um esferoide 3D como visualizado por microscopia confocal. Arquitetura e rotação de um esferoide 3D. Lasers verdes e vermelhos foram usados para escanear os esferoides formados no dia 7 na cocultura celular. A área de varredura foi determinada um objetivo de 10x. A varredura começa da parte inferior ao topo do esferoide a 1 μm z-step. O filme de rotação esferoide 3D foi criado usando o software Fiji. Clique aqui para baixar este vídeo.
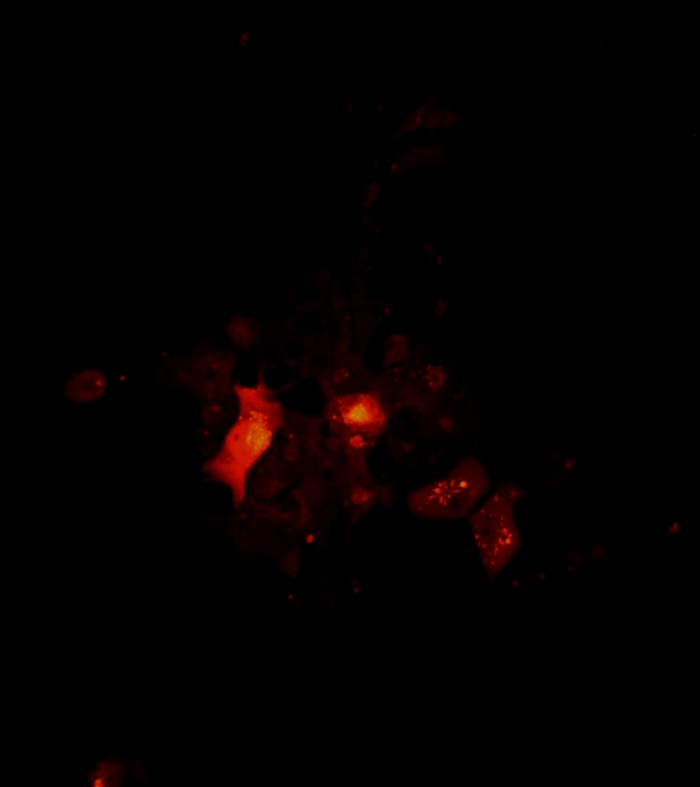
Vídeo 4: Arquitetura e rotação um cluster de células tumorais 2D como visualizado por microscopia confocal. Arquitetura e rotação de um cluster 2D. Imagens confocais de aglomerados celulares foram tiradas no 7º dia da cultura única das células de melanoma. A área de varredura foi determinada um objetivo de 10x. A varredura começa da parte inferior ao topo do esferoide a 1 μm z-step. O filme de rotação de cluster 2D foi criado usando o software Fiji. Clique aqui para baixar este vídeo.
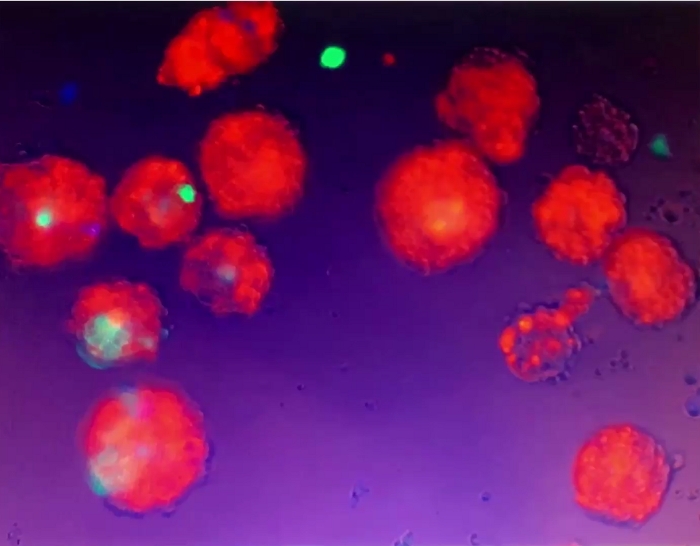
Vídeo 5: Movimento de esferoides 3D. Os esferoides 3D foram suspensos no meio cultural e não aderiram ao prato de cultura/bem. Quando ainda médium na cultura celular bem foi perturbado por canobramento suave, os esferoides 3D suspensos se moveram. Clique aqui para baixar este vídeo.
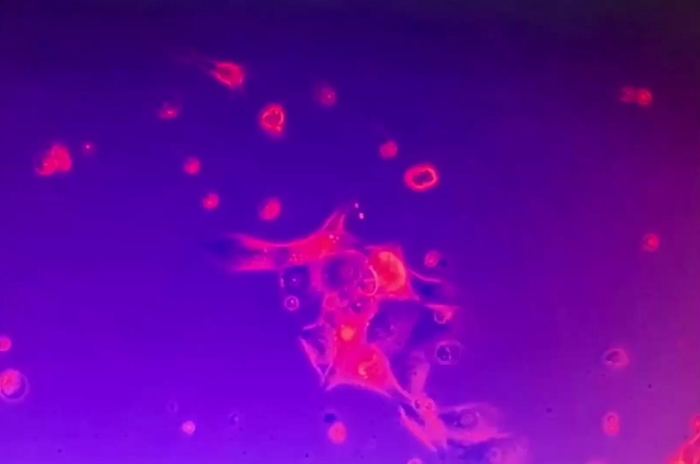
Vídeo 6: Firmeza de aglomerados de células tumorais 2D. O aglomerado de células tumorais 2D foi ancorado na placa de cultura e imóvel apesar da perturbação do meio cultural. Algumas células mortas eram móveis. Clique aqui para baixar este vídeo.
Discussão
As técnicas de cultura celular 3D in vitro têm sido amplamente empregadas há décadas em pesquisa sobre câncer. Em comparação com os sistemas convencionais de cultura celular 2D, o microambiente 3D recapitula as interações celular-célula e/ou matriz celular e permite imitar as condições genuínas observadas nos tecidos tumorais. No entanto, um sistema 3D formado apenas por células cancerígenas e interações homopípicas celulares não leva em conta a importância da conversa cruzada heterotípica e pode fornecer resultados imprecisos na pesquisa. Recentemente desenvolvemos um novo sistema 3D que combina células cancerígenas e CAF para melhor imitar no microambiente tumoral heterogêneo vivo e sua reação desmoplástica nativa e dura.
Fibroblastos são componentes principais do estroma tumoral. A CAF está envolvida na regulação da progressão tumoral, provocando fatores solúveis, enzimas ECM/remodelação10,11e exosóis. Além disso, a CAF desempenha um papel na resistência a medicamentos e recidiva do tumor16,17. Nosso sistema multicelular de esferoide 3D pode ser utilizado para explorar mecanismos moleculares de interações tumorais-estrôqueis e para lidar com a resistência medicamentosa e recidiva do tumor. O CAF é derivado principalmente de fibroblastos quiescentes locais ativados e recrutados circulando msc de medula óssea, que se submetem em diferenciação in situ para CAF no tecido tumoral37,38,39. No presente estudo, usamos fibroblastos de pele para criar um modelo esferoide 3D multicelular. No entanto, outro tipo de fibroblastos (por exemplo, MSC-DF), também funcionam de forma muito semelhante aos fibroblastos da pele para regular a formação esferoide 3D da célula tumoral3D. O MSC-DF pode ser gerado a partir da medula óssea murina MSC, que é enriquecida por cultivar células mononucleares de medula óssea em meio smsc cultura celular por cerca de 10 dias com mudanças médias periódicas a cada 3 dias. Estes MSC são caracterizados como CD73+/CD105+/Lin-. Para diferenciar o MSC em fibroblastos, o MSC é posteriormente cultivado com DMEM completo por mais 2 semanas. MSC-DF são caracterizados como α-SMA+/Vimentin+/FSP-1+ células36. O MSC-DF pode ser importantes reguladores tumorais. Como uma fração de CAF em muitos tipos de tumores sólidos são diferenciadas do MSC circulante recrutado liberado da medula óssea36, o MSC-DF pode ser promissor a metas de tratamento. Eles também são muito mais facilmente manipulados ou direcionados terapêuticamente antes de serem recrutados para tecidos tumorais e diferenciados para o CAF. Assim, nosso modelo 3D oferece um sistema ideal para estudar e testar não apenas células cancerosas, mas também diferentes frações ou subpopulações de CAF. O método para formação esferoide 3D é simples. Os passos críticos incluem o uso de meio livre de soro para cocultura, aplicação da razão certa de fibroblastos às células tumorais e o uso das placas culturais certas para cocultura. A limitação potencial do nosso método é que a formação de esferoides 3D é em grande parte dependente da linha celular cancerosa. Nosso protocolo de formação esferoide pode exigir otimização da razão entre fibroblastos e células cancerosas se diferentes linhas de células cancerígenas forem empregadas. Deve-se notar que usamos um modelo de cocultura celular de melanoma humano e célula de fibroblasto rato para a formação de esferoides 3D, pois é muito mais fácil criar células GOF ou LOF em fibroblastos de camundongos para o estudo do papel de uma molécula ou sinalização de caminho na regulação da formação de esferoides tumorais. A capacidade das células de melanoma humano e fibroblastos de camundongos para formar esferoides indica que as moléculas necessárias para as comunicações celulares funcionam entre espécies. Recentemente testamos a cocultura de fibroblastos humanos com células de melanoma humano e descobrimos que os fibroblastos humanos também podem regular as células de melanoma humano para formar esferoides 3D.
Empregamos células de melanoma metastático humano, C8161, em nosso modelo multicelular de esferoide 3D. Também testamos outras células de melanoma humano, por exemplo, 1205Lu32, que carrega a mutação BRAFV600E, e meWo, que expressa altos níveis de CDK4/Kit (ATCC HTB-65), e descobriu que elas também são capazes de formar esferoides 3D na cocultura. Isso indica que a formação de esferoides 3D por células tumorais é independente dos tipos de mutações oncogênicas. Embora não tenhamos testado se outros tipos de células tumorais não melanoma são capazes de formar esferoides 3D com fibroblastos, nossos achados indicam que a formação de esferoides 3D não se limita a uma linha celular de melanoma e pode não depender de uma linha específica de células cancerosas.
Mostramos dois exemplos de aplicações práticas do nosso modelo esferoide 3D. Um exemplo foi elucidar a atividade intracelular de sinalização de entalhe na regulação do fenótipo celular de câncer/início e formação de esferoides 3D. Demonstramos que a via intracelular de sinalização notch no CAF é um interruptor molecular que controla o fenótipo das células de câncer/início usando este modelo esferoide 3D. Nossos achados não só descobrem um mecanismo molecular subjacente à regulação estrumária de células com tronco/início do câncer e heterogenicidade do câncer, mas também destacam que o caminho notch no CAF é um alvo crítico para a terapêutica do melanoma. Este exemplo indica que nosso modelo esferoide 3D é muito útil para estudar os mecanismos para interações de fibroblasto celular-estromal de células cancerígenas e identificar potenciais alvos terapêuticos. Outro exemplo foi testar a resposta medicamentosa de células cancerígenas/intitantes na presença de CAF. É sabido que a resposta medicamentosa das células cancerígenas, incluindo células cancerígenas/de início, varia na presença e ausência de CAF. A presença de CAF neste sistema in vitro torna esse modelo mais relevante clinicamente e gerou resultados de testes mais confiáveis. Além disso, nosso sistema de esferoide 3D é versátil. Pode ser usado para vários propósitos. Por exemplo, se as células cancerígenas resistentes a medicamentos forem empregadas neste modelo 3D, ela pode ser alterada para enfrentar a resistência medicamentosa e talvez a recidiva do tumor. Também pode ser modificado para testar ou testar medicamentos que visam principalmente o CAF para o tratamento do câncer. A CAF tornou-se recentemente alvos terapêuticos promissores. Há vantagens em mirar caf. Primeiro, em comparação com células tumorais que são anormais (muitas vezes com alterações genéticas) e inteligentes (facilmente ganham resistência a quimioterapia e radioterapia), o CAF no tecido tumoral são células normais e geneticamente mais estáveis, por isso são menos propensos a desenvolver resistência aos tratamentos. Em segundo lugar, o direcionamento do CAF não depende do tipo de mutações oncogênicas nas células tumorais. Em terceiro lugar, a segmentação da CAF pode atingir múltiplos efeitos de impacto através do antitumoragenado dependente de fibroblastos, anti-angiogênese e/ou da resposta imune ao câncer modulador. Nosso modelo esferoide 3D é uma poderosa ferramenta para a descoberta de diversos conjuntos de estratégias terapêuticas contra o câncer.
Divulgações
Os autores declaram que não têm interesses financeiros concorrentes.
Agradecimentos
Agradecemos à Dra. Dr. Jie Li (Universidade de Miami) para fornecer células MeWo; e dr. Meenhard Herlyn (Instituto Wistar) para fornecer todas as outras células de melanoma. Agradecemos também à Dra. Zhao-Jun Liu foi apoiado por subsídios do Bankhead-Coley Cancer Research Program (Award# 09BN-11), Women's Cancer Association (a53ª bolsa anual) e fundos internos da Universidade de Miami.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA | Corning | 25-253-CI | |
| 24-well plate | Corning | 351147 | Non-tissue culture treated plate, 24-well, flat bottom with low evaporation lid |
| Alex Fluor 488 goat anti-mouse IgG | Life Technology | A21202 | |
| CaCl2 1.5 M | Sigma-Aldrich | C5670-500G | |
| Collagenase, Type 1A | Sigma-Aldrich | C-2674 | 500 mg, 1 mg/mL concentration in DMEM. |
| DakoCytomation | Dako | x0909 | |
| DAPI | |||
| Dispase Grade II | Roche Diagnostics | 165859 | |
| Dulbecco's Modified Eagle's Medium(DMEM) | Corning | 10-013-CV | |
| Fetal Bovine Serum | VMR | 97068-085 | Premium Grade |
| Fiji (ImageJ) | NIH | Free for downloading, no license needed. | |
| IncuCyte Zoom 2016A | Essen Bioscience | ||
| IncuCyte Zoom System | Essen Bioscience | ||
| Insulin | Sigma-Aldrich | I1882 | |
| L-15 Medium (Leibovitz) | Sigma-Aldrich | L1518 | |
| Leica SP5 Inverted Confocal Microscope | Leica | ||
| MCDB 153 Medium | Sigma-Aldrich | M7403-10X1L | |
| Mouse anti α-SMA (smooth muscle actin), monoclone | Abcam | ab18640 | |
| Olympus IX51 Inverted Fluorescence Microscope | Olympus | IX51 | |
| Olymupus CellSens | Olympus | ||
| PD0325901 | Selleckchem Chemicals | S1036 | |
| Penicillin Streptomycin Solution | Corning | 30-002- CI | 100 X |
| Sodium Bicarbonate 7.5% | Corning | 25-035-CI |
Referências
- Lorusso, G., Ruegg, C. The tumor microenvironment and its contribution to tumor evolution toward metastasis. Histochemistry and Cell Biology. 130, 1091-1103 (2008).
- Anton, K., Glod, J. Targeting the tumor stroma in cancer therapy. Current Pharmaceutical Biotechnology. 10, 185-191 (2009).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144, 646-674 (2011).
- Junttila, M. R., de Sauvage, F. J. Influence of tumour micro-environment heterogeneity on therapeutic response. Nature. 501, 346-354 (2013).
- Allinen, M., et al. Molecular characterization of the tumor microenvironment in breast cancer. Cancer Cell. 6, 17-32 (2004).
- Bhowmick, N. A., Neilson, E. G., Moses, H. L. Stromal fibroblasts in cancer initiation and progression. Nature. 432, 332-337 (2004).
- Lynch, C. C., Matrisian, L. M. Matrix metalloproteinases in tumor-host cell communication. Differentiation. 70, 561-573 (2002).
- Midwood, K. S., Williams, L. V., Schwarzbauer, J. E. Tissue repair and the dynamics of the extracellular matrix. The International Journal of Biochemistry & Cell Biology. 36, 1031-1037 (2004).
- Olumi, A. F., et al. Carcinoma-associated fibroblasts direct tumor progression of initiated human prostatic epithelium. Cancer Research. 59, 5002-5011 (1999).
- Orimo, A., Weinberg, R. A. Stromal fibroblasts in cancer: a novel tumor-promoting cell type. Cell Cycle. 5, 1597-1601 (2006).
- Luga, V., et al. Exosomes mediate stromal mobilization of autocrine Wnt-PCP signaling in breast cancer cell migration. Cell. 151, 1542-1556 (2012).
- Zhang, X. H., et al. Selection of bone metastasis seeds by mesenchymal signals in the primary tumor stroma. Cell. 154, 1060-1073 (2013).
- Orimo, A., et al. Stromal fibroblasts present in invasive human breast carcinomas promote tumor growth and angiogenesis through elevated SDF-1/CXCL12 secretion. Cell. 121, 335-348 (2005).
- Shao, H., et al. Activation of Notch1 signaling in stromal fibroblasts inhibits melanoma growth by upregulating WISP-1. Oncogene. 30, 4316(2011).
- Ziani, L., Chouaib, S., Thiery, J. Alteration of the Antitumor Immune Response by Cancer-Associated Fibroblasts. Frontier in Immunology. 9, 414(2018).
- Kraman, M., et al. Suppression of antitumor immunity by stromal cells expressing fibroblast activation protein-alpha. Science. 330, 827-830 (2010).
- Straussman, R., et al. Tumour micro-environment elicits innate resistance to RAF inhibitors through HGF secretion. Nature. 487, 500-504 (2012).
- Smalley, K. S., Lioni, M., Noma, K., Haass, N. K., Herlyn, M. In vitro three-dimensional tumor microenvironment models for anticancer drug discovery. Expert Opinion on Drug Discovery. 3 (1), 1-10 (2007).
- Santiago-Walker, A., Li, L., Haass, N. K., Herlyn, M. Melanocytes: from morphology to application. Skin Pharmacology and Physiology. 22, 114-121 (2009).
- Beaumont, K. A., Mohana-Kumaran, N., Haass, N. K. Modeling melanoma in vitro and in vivo. Healthcare (basel). 2, 27-46 (2013).
- Beaumont, K. A., Anfosso, A., Ahmed, F., Weninger, W., Haass, N. K. Imaging- and flow cytometry-based analysis of cell position and the cell cycle in 3D melanoma spheroids. Journal of Visualized Experiments. (106), e53486(2015).
- Weiswald, L. B., Bellet, D., Dangles-Marie, V. Spherical cancer models in tumor biology. Neoplasia. 17, 1-15 (2015).
- Cui, X., Hartanto, Y., Zhang, H. Advances in multicellular spheroids formation. Journal of the Royal Society Interface. 14, (2017).
- Fennema, E., Rivron, N., Rouwkema, J., van Blitterswijk, C., de Boer, J. Spheroid culture as a tool for creating 3D complex tissues. Trends in Biotechnology. 31, 108-115 (2013).
- Thoma, C. R., Zimmermann, M., Agarkova, I., Kelm, J. M., Krek, W. 3D cell culture systems modeling tumor growth determinants in cancer target discovery. Advanced Drug Delivery Review. 69-70, 29-41 (2014).
- Bulin, A. L., Broekgaarden, M., Hasan, T. Comprehensive high-throughput image analysis for therapeutic efficacy of architecturally complex heterotypic organoids. Scientific Reports. 7, 16645(2017).
- Lazzari, G., et al. Multicellular spheroid based on a triple coculture: A novel 3D model to mimic pancreatic tumor complexity. Acta Biomaterialia. 78, 296-307 (2018).
- Fong, E. L., Harrington, D. A., Farach-Carson, M. C., Yu, H. Heralding a new paradigm in 3D tumor modeling. Biomaterials. 108, 197-213 (2016).
- Gu, L., Mooney, D. J. Biomaterials and emerging anticancer therapeutics: engineering the microenvironment. Nature Reviews Cancer. 16, 56-66 (2016).
- Tevis, K. M., Colson, Y. L., Grinstaff, M. W. Embedded Spheroids as Models of the Cancer Microenvironment. Advanced Biosystems. 1, (2017).
- Welch, D. R., et al. Characterization of a highly invasive and spontaneously metastatic human malignant melanoma cell line. International Journal of Cancer. 47, 227-237 (1991).
- Balint, K., et al. Activation of Notch1 signaling is required for beta-catenin-mediated human primary melanoma progression. Journal of Clinical Investigation. 115, 3166-3176 (2005).
- Meier, F., et al. Human melanoma progression in skin reconstructs : biological significance of bFGF. the American Journal of Pathology. 156, 193-200 (2000).
- Du, Y., et al. Intracellular Notch1 Signaling in Cancer-Associated Fibroblasts Dictates the Plasticity and Stemness of Melanoma Stem/Initiating Cells. Stem Cells. 37, 865-875 (2019).
- Shao, H., et al. Notch1 Pathway Activity Determines the Regulatory Role of Cancer-Associated Fibroblasts in Melanoma Growth and Invasion. PLoS One. 10, 0142815(2015).
- Shao, H., et al. Notch1-WISP-1 axis determines the regulatory role of mesenchymal stem cell-derived stromal fibroblasts in melanoma metastasis. Oncotarget. 7, 79262-79273 (2016).
- Kalluri, R., Neilson, E. G. Epithelial-mesenchymal transition and its implications for fibrosis. Journal of Clinical Investigation. 112, 1776-1784 (2003).
- Price, J. E. Xenograft models in immunodeficient animals : I. Nude mice: spontaneous and experimental metastasis models. Methods in Molecular Medicine. 58, 205-213 (2001).
- Spaeth, E. L., et al. Mesenchymal stem cell transition to tumor-associated fibroblasts contributes to fibrovascular network expansion and tumor progression. PLoS One. 4, 4992(2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados