Method Article
用于研究肿瘤-斯特罗马相互作用和药物发现的新型斯特罗姆纤维细胞-模组3D肿瘤球体模型
摘要
建立了基于肿瘤细胞和基质成纤维细胞异质相互作用的新型三维球体模型。在这里,我们介绍肿瘤细胞和基质成纤维细胞的共培养,延时成像和共聚焦显微镜,以可视化球形的形成。该三维模型为研究肿瘤-频闪相互作用和测试癌症治疗提供了一个相关的平台。
摘要
肿瘤-频闪相互作用在癌症进展中起着重要的作用。三维(3D)肿瘤球体模型是癌症干细胞/启动细胞研究、临床前癌症研究和药物筛选中应用最广泛的体外模型。三维球形模型优于传统的肿瘤细胞培养,再现了真实实体肿瘤的一些重要特征。然而,传统的3D肿瘤球体完全由肿瘤细胞组成。它们缺乏肿瘤基质细胞的参与,且细胞外基质(ECM)沉积不足,因此只能部分模拟肿瘤组织的体内条件。我们建立了一个新的多细胞3D球体模型,由肿瘤细胞和基质成纤维细胞组成,更好地模仿体内异质肿瘤微环境及其原生脱模。球体的形成由肿瘤基质成纤维细胞严格调节,由基质成纤维细胞中某些关键的细胞内信号通路(例如Notch信号)的活性决定。在本文中,我们将介绍肿瘤细胞-基质成纤维细胞共培养技术,用于可视化细胞-细胞相互作用的延时成像技术,以及用于显示球形的3D结构特征的共聚焦显微镜技术。我们还展示了该 3D 球形模型的实际应用的两个示例。这种新颖的多细胞3D球形模型为研究肿瘤-频闪相互作用提供了一个有用的平台,阐明基质成纤维细胞如何调节癌症干细胞/起始细胞,从而决定肿瘤进展和攻击性,并探索基质反应在癌症药物敏感性和抗药性中的参与。该平台也可以是药物发现的相关体外模型。
引言
实体肿瘤代表由肿瘤细胞和多种基质细胞1、2、3、4组成的复杂组织。位中成纤维细胞,或癌症相关的成纤维细胞(CAF),是大多数类型实体肿瘤中突出的基质细胞群之一。它们通过生成生长因子、细胞因子/化学因子、ECM 合成和重塑酶(例如胶原蛋白、纤维素和基质金属蛋白酶)、外体释放和直接异质细胞-细胞相互作用5、6、7、8、11、11、11、11、调节肿瘤生长、干细胞、转移、血管生成和耐药性等关键性。.CAF还参与确定癌症器官特异性转移,从原发病变的异质肿瘤细胞群中预先选择一部分肿瘤克隆,并培育这些选定的克隆,以进行转移到特定的遥远器官,其微环境最适合对选定的克隆体进行再殖民12。此外,纤维细胞及其分泌可溶性因子和ECM参与肿瘤血管生成调节13、14、抗肿瘤免疫反应15,甚至参与耐药性和肿瘤复发16、17。
体外3D肿瘤球体模型已被开发,并用于癌症研究,作为体外癌细胞培养和体内肿瘤模型18、19、20、21之间的中间模型。3D肿瘤球形模型在癌症干细胞研究、临床前癌症研究、药物筛选中已广受欢迎,因为这些模型再现了传统2D单层22中不存在的一些重要肿瘤特征。许多现有的3D肿瘤球形模型完全由肿瘤细胞组成,缺乏肿瘤基质细胞的参与。这通常导致肿瘤球体具有足够的ECM沉积和不存在异质细胞细胞相互作用。传统的3D球体完全由癌细胞和同质细胞粘附形成,只能部分模仿肿瘤组织的体内状况。为了克服其中的一些限制,研究人员建议在3D共培养中加入多种类型的基质细胞,并开发了几种异型3D肿瘤球体模型23,24,25,26,27。此外,研究人员还利用外源性3D基质,包括天然水凝胶或合成聚合物,如聚乙烯乙二醇、聚(乳酸-共甘油)和聚(N-异丙丙烯酰胺),嵌入单细胞和多细胞球形模型,创建细胞支持环境并繁殖细胞-基质相互作用28,29,从而使这些系统在生物学上更加相关。然而,将某些类型的基质细胞(如内皮细胞)结合在3D共培养中,为体外系统带来了额外的复杂性,使得研究两种特定类型细胞(如癌细胞-成纤维细胞相互作用)之间的异质细胞-细胞相互作用变得困难。此外,真实组织中的内皮细胞并不总是与癌细胞和其他基质细胞直接相互作用,因为毛细血管外有一层基底膜,可防止内皮细胞与癌细胞和其他基质细胞直接相互作用。在这些3D球形模型中,内皮细胞实际上并不形成血管,而是与癌细胞和其他基质细胞直接相互作用,这在体内很少发生。同样,某些3D球形模型中使用的外源性基质在结构和组成方面与真实肿瘤组织中的ECM不同。所有这些人为条件都可能导致误导性数据。
我们最近创建了一个由肿瘤细胞和CAF组成的新的多细胞3D球体模型。在我们的模型中,3D肿瘤球体的形成完全由CAF决定。CAF诱导和调节肿瘤干细胞的表型。CAF 产生的 ECM 是天然的,允许脱塑性结构更好地模仿体内肿瘤微环境。这一新颖的3D模型是癌症药物筛选的有用工具,为研究肿瘤-频闪相互作用提供了一个独特的平台,阐明CAF如何调节癌症干细胞/起始细胞,并探索基质相互作用在癌症药物敏感性和抗药性中的参与。
研究方案
1. 培养黑色素瘤细胞和皮肤纤维细胞
- 培养人类黑色素瘤细胞
- 培养人类黑色素瘤细胞,C816131在常规粘附细胞培养条件下,在完整的W489培养基(见步骤1.2)中,在37°C培养箱中提供5%CO2,如前32所述。当细胞达到+90%的汇合时,以1:5的比例分裂细胞。
- 黑色素瘤细胞培养基(W489)
- 对于完整的W489介质,使用80%MCDB153介质、20%L-15介质(见材料表)、2%胎儿牛血清(FBS)、5μg/mL胰岛素、1.68 mM CaCl2和0.11%碳酸氢钠。对于共栽,不要添加FBS、胰岛素和CaCl2。
- 小鼠皮肤成纤维细胞隔离
- 根据该机构动物护理和使用委员会 (IACUC) 的相关准则和规定,从鼠标上切下 1 厘米 x 1 厘米的皮肤碎片。
- 在4°C过夜时,通过消瘦(见材料表)消化皮肤。在室温(RT)下,从表皮中剥离真皮,并在室温(RT)过夜时用胶原酶进一步消化(DMEM中1mg/mL,见材料表)。
- 小鼠皮肤成纤维细胞培养
- 用PBS清洗组织颗粒,并在DMEM中培养它们,在37°C/5%CO2中用10%的FBS和1%的青霉素-链霉素培养它们。当细胞达到+90%的汇合时,以1:2的比例分割细胞。
- 在共栽培之前,使用标准方法用GFP/乳毒病毒转导皮肤成纤维细胞。
- 通过免疫染色对小鼠皮肤成纤维细胞的表征
- 用于染色的细胞制备
- 以2 x 104细胞/孔的密度在24孔板中播种皮肤成纤维细胞。在第2天,用PBS2x清洗细胞,并将其固定在2%中性缓冲形式10分钟。去除形式素,用PBS洗涤固定细胞两次。
- 免疫染色
- 向每口井加入200μL的阻滞溶液,在RT处孵育板30分钟,然后在1:200时加入小鼠抗β-SMA稀释剂,在37°C孵育1小时,用PBS3x,每次5分钟。
- 在1:400稀释时加入Alex Fluor 488山羊抗小鼠IgG,并在RT孵育1小时。用PBS将抗体3x洗出,每次5分钟。
- 加入1μg/mL DAPI,在RT孵育2分钟。 去除DAPI溶液,并在每口井中加入500μL的PBS。
- 使用倒置荧光显微镜观察细胞并拍摄图像。
- 用于染色的细胞制备
- 预标记成纤维细胞和黑色素瘤细胞
- 种子成纤维细胞在第1天进入100毫米的碟,使细胞汇合达到+60%。在第2天,取出培养基,将GFP/联比病毒(从库存中稀释的±1:3+1:5)加入常规培养基中,含有4微克/mL的聚二苯乙烯。在37°C培养箱中孵育细胞6小时,去除培养基,用新的常规培养基体替代。2天后,使用荧光显微镜观察来自细胞的GFP信号。在类似条件下用DsRed/lenti病毒转导C8161细胞。GFP/lenti病毒和DsRed/lenti病毒的制备协议已经描述之前14,34。
2. 细胞共栽培
- 种子C8161-成纤维细胞共栽培。
- 在球形形成测定的第0天,使用0.25%胰蛋白酶-EDTA分离C8161和皮肤成纤维细胞。在RT下,在250克下旋转细胞5分钟,用PBS洗涤一次。
- 在细胞共培养培养基中重新悬浮细胞(无血清、无胰岛素和无钙W489介质与无血清DMEM混合,比例为1:1)。将细胞浓度调整到 2 x 104细胞/mL。
- 以 1:1 的比例将 C8161 细胞与成纤维细胞混合,并将 2 mL 的细胞混合物添加到 24 孔板的每个孔中。每口井应包含每种类型的细胞的2 x 104。每个条件应分三次执行。
注:使用非组织培养处理板(参见材料表)非常重要。否则,细胞将强烈附着在板上,并且无法从悬浮球体。
- 在37°C孵育细胞4小时,直到细胞附着在板中,然后在每个测定的指定时间点进行延时成像或共聚焦扫描。
3. 活细胞延时成像
- 在共栽培之前,按照制造商的说明打开延时成像系统(参见材料表),让培养箱达到37°C和5%CO2。系统通常需要 1 小时才能达到平衡。小心地将培养板放在培养箱内的显微镜上,并牢固地锁上门。
- 打开延时成像系统软件(见材料表),选择板材类型和制造商,使显微镜能够准确定位扫描区域。选择感兴趣的井和 10 倍物镜。选择扫描区域的设置、扫描之间的间隔时间以及开始时间和结束时间。在此协议中,1 口井扫描区域的最大格式编号为 36,间隔时间为 1 小时。
- 从 4-52 小时记录延时成像。
注:开始时间、结束时间和持续时间应按单元格类型和实验目的进行优化。 - 完成图像录制后,使用延时成像系统软件检索数据并导出视频或图像集。
4. 共聚焦显微镜和 3D 电影
- 将细胞共培养板放在倒荧光显微镜的舞台上(见材料表),并使用红色和绿色激光束。观察5x或10x物镜下的细胞,并选择球体开始扫描。
- 使用 1 μm z 步长从球体的底部到顶部进行扫描。使用图像处理软件(参见材料表)处理数据,以重建可进一步旋转并保存为 3D 影片的 3D 图像。
5. 黑色素瘤细胞的单独培养和二维簇/聚合的形成
- 种子 2 x 104 C8161 黑色素瘤细胞进入 24 孔板的每个孔,如第 2.1 节所述。培养细胞7~10天,并用倒荧光显微镜拍摄。
6. 检查 3D 球形和 2D 细胞簇/聚合是否悬浮在介质中或附加到板中
- 对于细胞共培养,检查第7天形成的3D球体。对于单细胞培养,检查第 10 天形成的 2D 聚类/聚合。
- 在倒置荧光显微镜的平台上设置细胞培养板。将用注射器的弯曲针头放入井中,轻轻吸进和吸出培养基,以干扰井中的培养基。使用电影软件的电影模式记录此过程(参见材料表)。3D 球体将是移动的,但 2D 细胞簇/聚合将保持坚定。
7. 3D 球体的共聚焦图像
注:共培养细胞从48-72小时开始形成球形,这取决于所使用的成纤维细胞的类型。一般来说,球形会随着时间而逐渐增大。小球体可以融合形成更大的球体,直到第7天。球体在大小稳定后,可以持续10天以上。之后,球体经常从培养板的底部分离,并聚集在井的中心。在球体增大期间,中心细胞通常因营养不足和/或有毒的微环境而死亡。因此,应采用试验实验对成熟球体形成和成像的3D球形形成和计时峰进行优化。对于该协议,在球体成熟、球体中心细胞依中心细胞的荧光和形态进行共聚焦显微镜的第7天左右。
- 要进行共聚焦显微镜,请使用绿色和红色的激光扫描球形。确定 10 倍目标的扫描区域,然后使用 1 μm z 步长从球体的底部移动到顶部。
- 使用图像处理软件的 3D 投影功能(例如 ImageJ)生成 3D 球形形成和旋转视频。
8. 细胞内槽1 信号通路活性,以确定癌症干细胞/起始细胞的动位调节
- 皮肤成纤维细胞的分离和表征,从增益和功能丧失Notch1小鼠
- 从两对转基因小鼠中分离出皮肤成纤维细胞:功能增益Notch1(GOF Notch1:Fsp1.Cre+/-;ROSALSL-N1IC+/ *小鼠与它们的对应控制 (GOFctrl : FSP1.Cre-/-;ROSALSL-N1IC[/]) 小鼠和功能丧失的 Notch1 (LOF凹槽 1: Fsp1.Cre+/-;诺奇1LoxP/LoxP[/]) 小鼠与其对应控制 (LOFctrl : FSP1.Cre-/-;诺奇1LoxP/LoxP[/])小鼠31,分别。使用第 1.3-1.5 节中描述的协议分离和表征皮肤成纤维细胞。
- 用GFP/拉比病毒转导小鼠皮肤成纤维细胞。
- 有关用慢病毒载体转导细胞的方法,请参阅第 1 节。
- 成纤维细胞和黑色素瘤细胞的共培养
- 如第 2 节所述,进行细胞共培实验。
- 通过测量3D球形的大小,评估成纤维细胞中细胞内Notch1通路活性对确定癌症干细胞/起始细胞的基质调节的影响
- 在球形成熟时拍摄球形体,在每种条件下对球形形成进行量化(根据第5-7天左右的生长停止,取决于成纤维细胞的类型)。使用图像处理软件测量 3D 球体的大小。
9. 使用3D球形测定测试癌症干细胞/启动细胞的药物反应
注:CAF可以调节癌症异质性,并诱导癌症干细胞/起始细胞的表型。CAF还支持癌症干细胞/启动细胞,以经受临床治疗。癌症干细胞已被证明是导致耐药性的罪魁祸首。因此,我们使用这种3D球形模型来评估癌症干细胞/起始细胞的药物反应。研究结果可以很好地评估抗癌药物的潜在临床疗效。
- 药物管理
- 在24孔板中共同培养细胞后,在培养基培养基中连续稀释药物,根据试验实验(即1 nM、2.5 nM、5 nM、10 nM和25 nM)达到所需浓度范围的5倍。
向共培细胞的每个井中加入0.5 mL的相应药物溶液。如上所述,使用常规共培养介质处理对照组。 - 注:MEK抑制剂可溶于细胞培养基。因此,空白对照是2.5 mL的细胞培养基。然而,如果药物不溶于水溶液,并且需要DMSO等溶剂,则应将具有相同浓度DMSO的细胞培养基应用于对照组。
- 在24孔板中共同培养细胞后,在培养基培养基中连续稀释药物,根据试验实验(即1 nM、2.5 nM、5 nM、10 nM和25 nM)达到所需浓度范围的5倍。
- 通过计数球体对药物反应的量化
- 使用荧光显微镜观察经过处理的细胞和未经处理的细胞,每天对细胞进行拍照。量化不同实验组中的球形形成,比较不同药物浓度下细胞培养物的球形形成能力。
注:球体往往在共栽培后5~7天出现。药物作用在那个时候会变得明显。 - 使用荧光显微镜对井中的球体和细胞进行成像/成像,然后使用图像软件计算球体的平均大小以及每个处理组中每个低功率场 (LPF x 4) 中形成球体的数量。
注:与对照组相比,接受有效药物治疗的细胞应形成较少或没有球体。这表明被测试的药物在抑制癌症干细胞方面的有效性。
- 使用荧光显微镜观察经过处理的细胞和未经处理的细胞,每天对细胞进行拍照。量化不同实验组中的球形形成,比较不同药物浓度下细胞培养物的球形形成能力。
结果
我们开发了一种新方法,用于使用模仿体内肿瘤微环境的体外异质细胞共培系统生成3D球体。成纤维细胞来自小鼠皮肤成纤维细胞。皮肤成纤维细胞如上所述生成,其特征是β-SMA+/维门丁=/FSP-1=细胞。人类转移性黑色素瘤细胞(C8161)在W489培养中培养,如描述32所述。为了可视化和区分与肿瘤细胞的成纤维细胞,成纤维细胞和黑色素瘤细胞在细胞共培养前分别用GFP/lenti病毒和DsRed/lenti病毒预转导。
图1显示了通过共培黑色素瘤细胞和成纤维细胞而形成的多细胞3D球体的例子。在没有成纤维细胞的情况下培养的黑色素瘤细胞没有形成典型的3D球形,尽管一些黑色素瘤细胞与扩展培养形成2D簇/聚集体。球体的平均尺寸约为直径170~360微米(平均=275,SD = 37)。第5-7天。使用延时成像,我们观察到成纤维细胞和肿瘤细胞在共培养中相互作用,并开始在大约36小时的共栽培时形成3D球形,如视频1所示。延时成像记录细胞-细胞相互作用的动态过程和球形形成的初始阶段在+4~52h的共性。3D球形形成的峰值发生在第5~7天左右。形成3D球体由成纤维细胞和黑色素瘤细胞组成,其中多数(+80%)是肿瘤细胞视频 2显示了单培养黑色素瘤细胞 (DsRed+/C8161) 在单个培养基中从 +4-52 h 开始的细胞簇/聚合体形成的动态过程。2D 集群/聚合的形成在 #7~10 日左右达到顶峰。视频 3和视频 4分别显示了由共聚焦显微镜可视化的 3D 球形和 2D 肿瘤细胞簇的结构。在细胞共培的第7天,通过共聚焦显微镜对3D球体和2D肿瘤细胞簇进行了研究。视频5显示,3D球体悬浮在培养基和移动中,而视频6显示2D肿瘤细胞团附着在培养板上且不可移动。介质中的悬浮物是 3D 球体的一个特征,可将它们与 2D 聚类区分开来。当细胞培养皿或孔中的介质因滴入或轻轻移液培养基培养物而受到干扰时,悬浮的3D球形体移动,而2D细胞簇则无法移动。只有几个单一的死细胞是移动的。
图 2A显示了此 3D 模型的示例,该模型作为研究肿瘤-频闪相互作用和阐明 CAF 中细胞内 Notch1 信号通路活性如何调节癌症干细胞/起始细胞和球形形成的独特平台。从功能增益槽1(GOF Notch1:Fsp1.Cre+/-;ROSALSL-N1IC+/ *小鼠与它们的对应控制 (GOFctrl : FSP1.Cre-/-;ROSALSL-N1IC[/]) 小鼠和功能丧失的 Notch1 (LOF凹槽 1: Fsp1.Cre+/-;诺奇1LoxP/LoxP[/]) 小鼠与其对应控制 (LOFctrl : FSP1.Cre-/-;诺奇1LoxP/LoxP[/])小鼠35,分别。所有成纤维细胞均由GFP/lenti病毒转导,并与C8161黑色素瘤细胞共同培养,预转用DsRed/lenti病毒。延时成像显示,Fb-GOF Notch1 在第一个 +4-52 h 细胞共培养期间,与 Fb-GOFctrl相比,Fb-GOFNotch1阻止了 C8161 黑色素瘤细胞形成 3D 球形。相比之下,与Fb-LOFctrl相比,Fb-LOFNotch1通过C8161黑色素瘤细胞促进3D球体的形成。图2B,上图,显示了细胞共培第7天形成的3D球体的代表性图像,不同的成纤维细胞进行不同的Notch通路活动。图2B,底部,显示了在细胞共培的第7天形成的3D球体平均大小的定量数据,不同的成纤维细胞携带不同的Notch通路活动。
图 3显示了用于测试癌症干细胞/起始细胞的药物反应的 3D 模型示例。癌症干细胞/起始细胞已被证明是导致耐药性和癌症复发的原因。因此,利用这种3D模型评估药物反应可以更好地揭示一种潜在的药物对癌症治疗的临床疗效。C8161黑色素瘤细胞依靠活性MAPK信号来促进细胞生长和入侵。它们也表达高水平的CDK4/Kit,但不携带BRAF突变。为了测试癌症干细胞/起始细胞对MAPK抑制剂的药物反应,使用这个3D模型,我们在24个孔板中共同培养C8161黑色素瘤细胞和成纤维细胞。PD0325901(见材料表),一种MAPK抑制剂,在1 nM、2.5 nM、5 nM、10 nM和25 nM的浓度范围内进行连续稀释。当细胞混合物被镀层时,PD0325901被添加到细胞共培养中。未经治疗的共培细胞被用作对照细胞。评价了不同药物浓度下细胞共培养的球体形成能力,并将其与未经治疗的对照进行比较。图3A显示了不同药物浓度下细胞共培的第5天形成的3D球体的代表性图像。图3B是不同药物浓度下细胞共培的第5天,每个球体的平均大小和每个低功率场(LPF x 4)形成3D球体的定量数据。
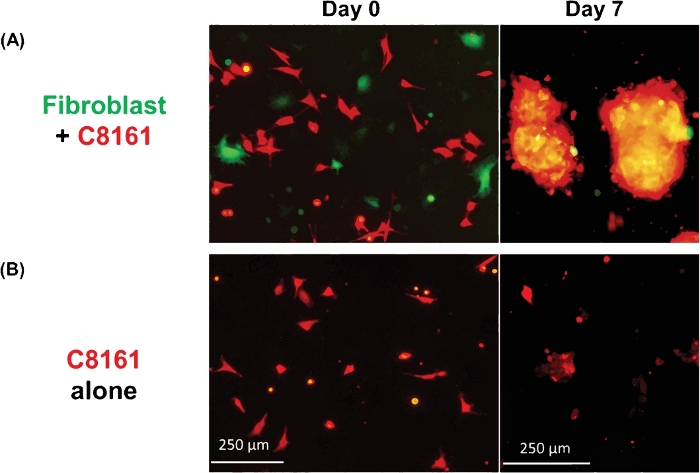
图1:3D球体和2D聚类的形成。(A) 由人类C8161黑色素瘤细胞和小鼠皮肤成纤维细胞共同培养形成的3D球体的代表性图像。3D球体在黑色素瘤细胞和成纤维细胞共同培养的第7天被拍摄。球体的平均尺寸为直径为±170~360 μm(平均值= 275,SD = 37),第5天至7日。每个低功耗场(LPF x4)的平均球体数为18~26(20.5 ± 3.6)。(B) 由C8161黑色素瘤细胞单一培养形成2D肿瘤细胞簇的代表性图像。2D黑色素瘤细胞簇在黑色素瘤细胞单一培养的第7天被拍摄。请点击此处查看此图的较大版本。
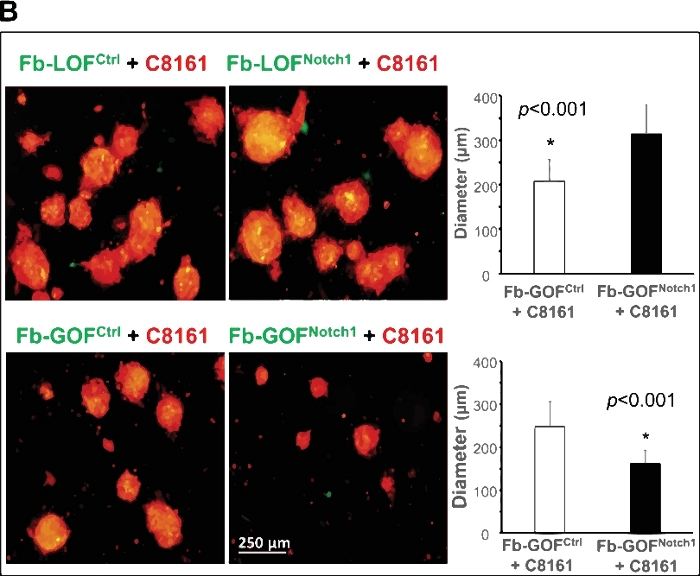
图2:利用3D球形模型阐明CAF细胞内Notch1信号通路活性在调节癌症干细胞/起始细胞中的作用。(A) CAF的细胞内Notch1信号通路活性决定了细胞共培养中黑色素瘤细胞的球体形成。延时视频显示,Fb-GOFNotch1阻止了 C8161 黑色素瘤细胞形成 3D 球体,而 Fb-LOFNotch1在细胞共培养的前 4-52 小时期间,B8161 黑色素瘤细胞促进了更多 3D 球体的形成。(B) 顶部:在细胞共培的第7天形成的3D球体的代表性图像,具有不同的细胞细胞,具有不同的Notch通路功能。底部:在细胞共培的第7天形成的3D球体的平均大小(直径[m]/球体)的定量数据,具有不同的Notch通路活性的不同成纤维细胞。双尾学生的t-测试用于统计分析。数据以均值 = 标准差 (SD) 表示。请点击此处查看此图的较大版本。
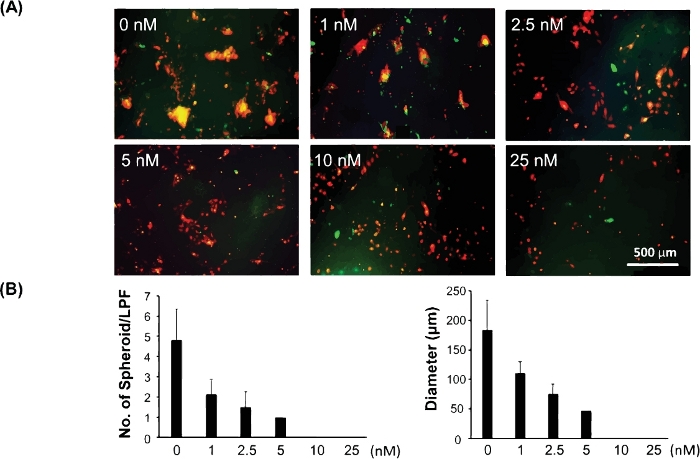
图3:使用3D球形模型评估癌症干细胞/起始细胞的药物反应。(A) 不同药物浓度下细胞共培的第5天形成的3D球体的代表性图像。(B) 不同药物浓度下细胞共培的第5天形成的平均大小(直径[m]/球体)和每个低功率场(LPF x 4)的3D球体数量。定量数据表示为均值 = 标准差 (SD)。请点击此处查看此图的较大版本。
视频1:细胞共培养早期3D球体形成的动态过程。延时成像显示成纤维细胞和肿瘤细胞在第一次[4~52小时细胞共培养]期间在共培养和形成3D球体之间的动态细胞-细胞相互作用。细胞开始形成3D球体约48小时后,开始共同培养。3D球形形成的峰值发生在第 5~7 天(此处未显示)。3D球体由成纤维细胞和黑色素瘤细胞组成,其中多数(+80%)是肿瘤细胞请点击此处下载此视频。

视频2:细胞共培养早期2D簇形成的动态过程。延时成像显示由C8161黑色素瘤细胞在单一培养中形成的2D簇的动态过程。2D集群的形成发生在第7天~10日左右。延时成像记录DsRed +/C8161黑色素瘤细胞单一培养的周期[4~52小时]。请点击此处下载此视频。
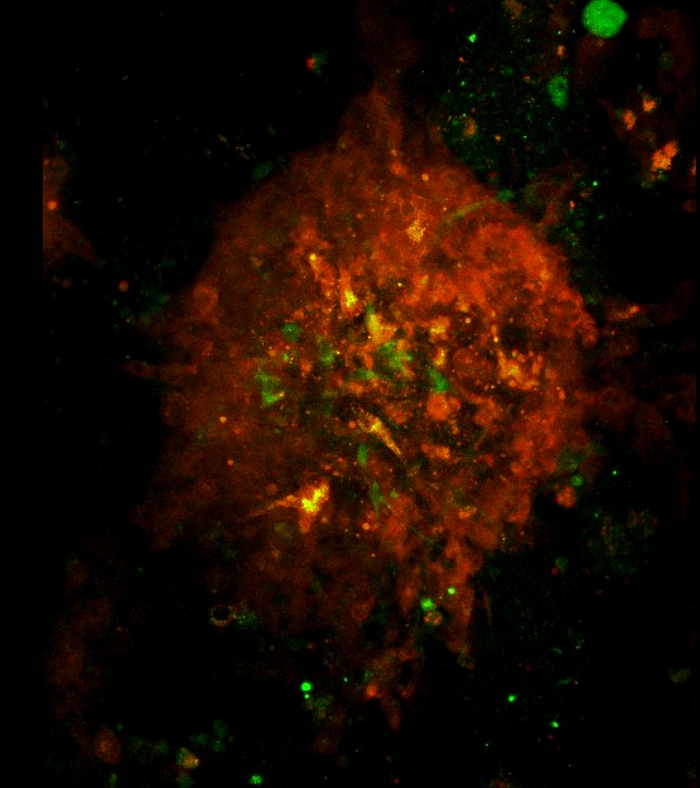
视频 3:由共聚焦显微镜可视化的 3D 球体的体系结构和旋转。3D球体的架构和旋转。绿色和红色的激光器用于扫描细胞共培养中第7天形成的球体。扫描区域在 10 倍目标下确定。扫描从球形的底部到顶部以 1 μm z 步长开始。3D 球形旋转影片是使用斐济软件创建的。请点击此处下载此视频。
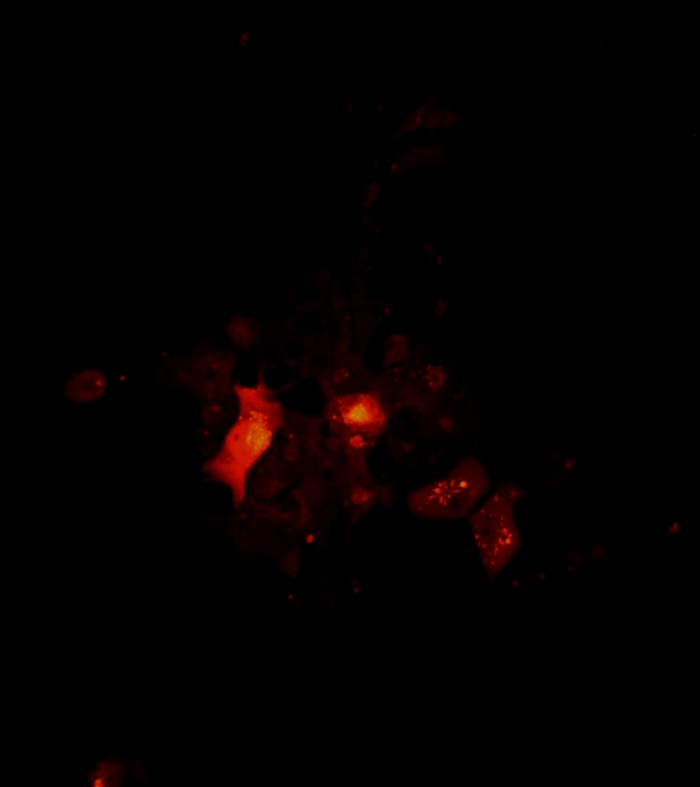
视频4:通过共聚焦显微镜可视化的2D肿瘤细胞簇的架构和旋转。2D 群集的体系结构和旋转。在黑色素瘤细胞单一培养的第7天拍摄了细胞簇的共聚焦图像。扫描区域在 10 倍目标下确定。扫描从球形的底部到顶部以 1 μm z 步长开始。2D 群集旋转影片是使用斐济软件创建的。请点击此处下载此视频。
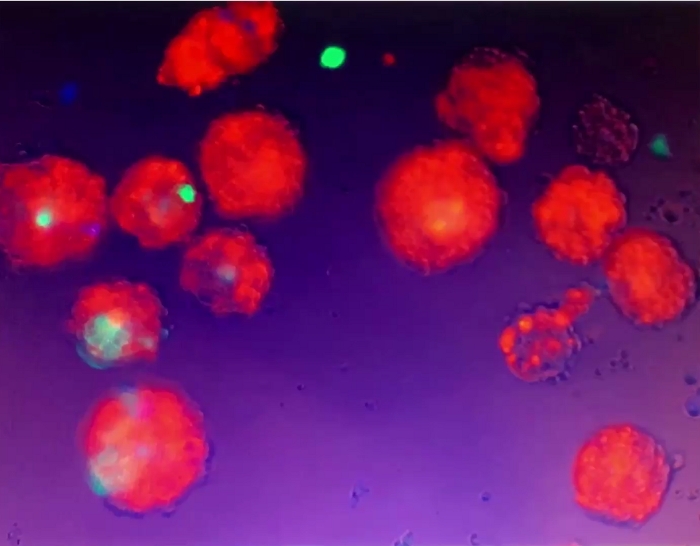
视频 5:3D 球体的移动。3D球体被悬浮在培养基中,没有坚持文化菜/井。当细胞培养液中仍然中等被柔和的移液干扰时,悬浮的3D球体移动。请点击此处下载此视频。
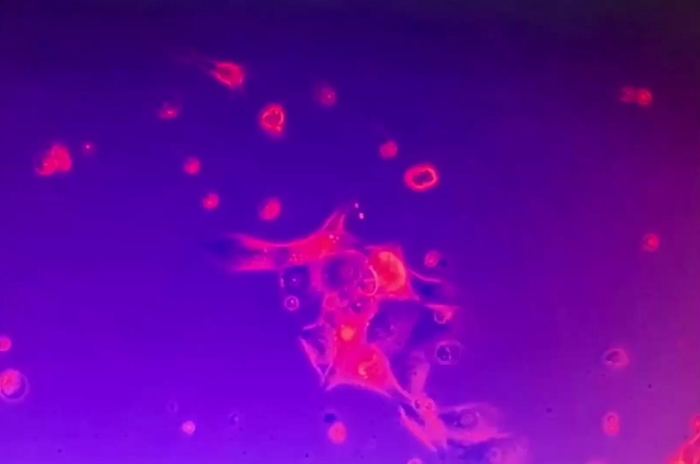
视频6:2D肿瘤细胞群的稳健性。2D肿瘤细胞群固定在培养板上,在培养基受到干扰的情况下不动。几个单死细胞是流动的。请点击此处下载此视频。
讨论
几十年来,体外3D细胞培养技术在癌症研究中得到了广泛的应用。与传统的2D细胞培养系统相比,3D微环境可重新结合细胞和/或细胞基质相互作用,并能够模拟在肿瘤组织中观察到的真实状况。然而,只有癌细胞和同质细胞-细胞相互作用形成的3D系统没有考虑到异质性串扰的重要性,并且可能在研究中提供不准确的结果。我们最近开发出一种新型的3D系统,将癌细胞和CAF相结合,以更好地模拟体内异质肿瘤微环境及其原生和僵硬的脱塑性反应。
成纤维细胞是肿瘤频闪的主要成分。CAF通过诱导可溶性因子、ECM/重塑酶10、11和外体参与调节肿瘤进展。此外,CAF在耐药性和肿瘤复发16,17中发挥作用。我们的多细胞3D球形系统可用于探索肿瘤-基质相互作用的分子机制,并解决耐药性和肿瘤复发问题。CAF主要来源于激活的局部静成纤维细胞和招募的循环骨髓MSC,在肿瘤组织37、38、39中进行原位分化为CAF。在目前的研究中,我们使用皮肤成纤维细胞创建多细胞3D球形模型。然而,其他类型的成纤维细胞(例如,MSC-DF),也以非常类似的方式作用于皮肤纤维细胞,以调节肿瘤细胞3D球形形成34。MSC-DF可以从鼠骨髓MSC生成,通过在MSC细胞培养基培养中培养骨髓单核细胞来丰富,每3天定期改变一次介质。这些 MSC 被描述为 CD73+/CD105+/Lin-。为了将 MSC 区分为成纤维细胞,MSC 随后使用完整的 DMEM 进行额外 2 周的培养。MSC-DF 被描述为 +-SMA+/维门丁=/FSP-1=细胞36。MSC-DF 可能是重要的肿瘤调节器。由于许多类型实体肿瘤中的CAF的一小部分与从骨髓36中释放的循环MSC有区别,MSC-DF是有希望的治疗靶点。在将它们招募到肿瘤组织并分化成 CAF 之前,它们也更容易被治疗操纵或瞄准。因此,我们的 3D 模型不仅为癌细胞,而且为 CAF 的不同分数或亚群的研究和测试提供了理想的系统。3D球形形成的方法非常简单。关键步骤包括使用无血清培养基用于共性培养,将成纤维细胞的正确比例应用于肿瘤细胞,以及使用正确的培养板进行共性培养。我们方法的潜在局限性是,3D球体的形成在很大程度上依赖于癌细胞系。如果采用不同的癌细胞系,我们的球形形成方案可能需要优化成纤维细胞和癌细胞之间的比例。应该指出的是,我们使用人类黑色素瘤细胞和小鼠成纤维细胞共培养模型来形成3D球体,因为在小鼠成纤维细胞中创建GOF或LOF细胞对于研究分子或信号通路在调节肿瘤球形形成中的作用要容易得多。人类黑色素瘤细胞和小鼠成纤维细胞形成球体的能力表明,细胞-细胞通信所需的分子工作是跨物种的。我们最近测试了人类成纤维细胞与人类黑色素瘤细胞的共性培养,发现人类成纤维细胞也可以调节人类黑色素瘤细胞,形成3D球形。
我们在多细胞3D球形模型中采用了人类转移性黑色素瘤细胞C8161。我们还测试了其他人类黑色素瘤细胞,例如携带BRAFV600E突变的1205Lu32和MeWo,后者表示高水平的CDK4/Kit(ATCC HTB-65),并发现它们也能在共栽培中形成3D球体。这表明肿瘤细胞形成3D球体与致癌突变的类型无关。尽管我们还没有测试其他类型的非黑色素瘤肿瘤细胞是否能够形成具有成纤维细胞的3D球形,但我们的发现表明,3D球形体的形成并不限于黑色素瘤细胞系,可能并不依赖于特定的癌细胞系。
我们展示了三维球形模型的两个实际应用示例。一个例子是阐明细胞内Notch信号通路活性,以调节癌症干细胞/起始细胞表型和3D球形形成。证明CAF的细胞内Notch信号通路是一种分子开关,利用该3D球形模型控制癌症干细胞/起始细胞的表型。我们的发现不仅揭示了癌症干细胞/起始细胞和癌症异质性基础的基质调控的分子机制,而且突出表明CAF中的Notch通路是黑色素瘤治疗的关键靶点。本示例表明,我们的 3D 球形模型对于研究癌细胞-基质成纤维细胞相互作用的机制和确定潜在的治疗靶点非常有用。另一个例子是在CAF的存在下测试癌症干细胞/起始细胞的药物反应。众所周知,癌细胞(包括癌症干细胞/起始细胞)的药物反应在CAF的存在和不存在时各不相同。这种体外系统中存在CAF,使该模型在临床上更相关,生成测试结果更可靠。此外,我们的 3D 球形系统是多功能的。它可用于各种目的。例如,如果在这个3D模型中使用了耐药癌细胞,它可以被改变以解决耐药性,也许肿瘤复发。它也可以修改,以测试或筛选药物,主要针对CAF的癌症治疗。CAF最近成为有前途的治疗目标。以 CAF 为目标有其优点。首先,与异常(通常具有基因改变)和智能(容易获得对化疗和放射治疗的抵抗力)的肿瘤细胞相比,肿瘤组织中的CAF是正常细胞,遗传更稳定,因此它们不太可能产生对治疗的抗药性。其次,针对CAF并不取决于肿瘤细胞的致癌突变的类型。第三,针对CAF可能通过成纤维细胞依赖性抗肿瘤、抗血管生成和/或调节癌症免疫反应实现多重打击效果。我们的 3D 球形模型是发现各种癌症治疗策略的有力工具。
披露声明
作者宣称他们没有相互竞争的经济利益。
致谢
我们感谢Omaida C. Velazquez博士(迈阿密大学)的有益合作、协商和讨论;李杰博士(迈阿密大学)提供MeWo细胞;和米恩哈德·赫林博士(威斯塔研究所)提供所有其他黑色素瘤细胞。我们还感谢迈阿密大学分析成像核心设施主任Marcia Boulina博士的成像分析。刘兆军得到了银行头-科利癌症研究计划(第09BN-11奖)、妇女癌症协会(第53届年度赠款)和迈阿密大学内部基金的资助。
材料
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA | Corning | 25-253-CI | |
| 24-well plate | Corning | 351147 | Non-tissue culture treated plate, 24-well, flat bottom with low evaporation lid |
| Alex Fluor 488 goat anti-mouse IgG | Life Technology | A21202 | |
| CaCl2 1.5 M | Sigma-Aldrich | C5670-500G | |
| Collagenase, Type 1A | Sigma-Aldrich | C-2674 | 500 mg, 1 mg/mL concentration in DMEM. |
| DakoCytomation | Dako | x0909 | |
| DAPI | |||
| Dispase Grade II | Roche Diagnostics | 165859 | |
| Dulbecco's Modified Eagle's Medium(DMEM) | Corning | 10-013-CV | |
| Fetal Bovine Serum | VMR | 97068-085 | Premium Grade |
| Fiji (ImageJ) | NIH | Free for downloading, no license needed. | |
| IncuCyte Zoom 2016A | Essen Bioscience | ||
| IncuCyte Zoom System | Essen Bioscience | ||
| Insulin | Sigma-Aldrich | I1882 | |
| L-15 Medium (Leibovitz) | Sigma-Aldrich | L1518 | |
| Leica SP5 Inverted Confocal Microscope | Leica | ||
| MCDB 153 Medium | Sigma-Aldrich | M7403-10X1L | |
| Mouse anti α-SMA (smooth muscle actin), monoclone | Abcam | ab18640 | |
| Olympus IX51 Inverted Fluorescence Microscope | Olympus | IX51 | |
| Olymupus CellSens | Olympus | ||
| PD0325901 | Selleckchem Chemicals | S1036 | |
| Penicillin Streptomycin Solution | Corning | 30-002- CI | 100 X |
| Sodium Bicarbonate 7.5% | Corning | 25-035-CI |
参考文献
- Lorusso, G., Ruegg, C. The tumor microenvironment and its contribution to tumor evolution toward metastasis. Histochemistry and Cell Biology. 130, 1091-1103 (2008).
- Anton, K., Glod, J. Targeting the tumor stroma in cancer therapy. Current Pharmaceutical Biotechnology. 10, 185-191 (2009).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144, 646-674 (2011).
- Junttila, M. R., de Sauvage, F. J. Influence of tumour micro-environment heterogeneity on therapeutic response. Nature. 501, 346-354 (2013).
- Allinen, M., et al. Molecular characterization of the tumor microenvironment in breast cancer. Cancer Cell. 6, 17-32 (2004).
- Bhowmick, N. A., Neilson, E. G., Moses, H. L. Stromal fibroblasts in cancer initiation and progression. Nature. 432, 332-337 (2004).
- Lynch, C. C., Matrisian, L. M. Matrix metalloproteinases in tumor-host cell communication. Differentiation. 70, 561-573 (2002).
- Midwood, K. S., Williams, L. V., Schwarzbauer, J. E. Tissue repair and the dynamics of the extracellular matrix. The International Journal of Biochemistry & Cell Biology. 36, 1031-1037 (2004).
- Olumi, A. F., et al. Carcinoma-associated fibroblasts direct tumor progression of initiated human prostatic epithelium. Cancer Research. 59, 5002-5011 (1999).
- Orimo, A., Weinberg, R. A. Stromal fibroblasts in cancer: a novel tumor-promoting cell type. Cell Cycle. 5, 1597-1601 (2006).
- Luga, V., et al. Exosomes mediate stromal mobilization of autocrine Wnt-PCP signaling in breast cancer cell migration. Cell. 151, 1542-1556 (2012).
- Zhang, X. H., et al. Selection of bone metastasis seeds by mesenchymal signals in the primary tumor stroma. Cell. 154, 1060-1073 (2013).
- Orimo, A., et al. Stromal fibroblasts present in invasive human breast carcinomas promote tumor growth and angiogenesis through elevated SDF-1/CXCL12 secretion. Cell. 121, 335-348 (2005).
- Shao, H., et al. Activation of Notch1 signaling in stromal fibroblasts inhibits melanoma growth by upregulating WISP-1. Oncogene. 30, 4316(2011).
- Ziani, L., Chouaib, S., Thiery, J. Alteration of the Antitumor Immune Response by Cancer-Associated Fibroblasts. Frontier in Immunology. 9, 414(2018).
- Kraman, M., et al. Suppression of antitumor immunity by stromal cells expressing fibroblast activation protein-alpha. Science. 330, 827-830 (2010).
- Straussman, R., et al. Tumour micro-environment elicits innate resistance to RAF inhibitors through HGF secretion. Nature. 487, 500-504 (2012).
- Smalley, K. S., Lioni, M., Noma, K., Haass, N. K., Herlyn, M. In vitro three-dimensional tumor microenvironment models for anticancer drug discovery. Expert Opinion on Drug Discovery. 3 (1), 1-10 (2007).
- Santiago-Walker, A., Li, L., Haass, N. K., Herlyn, M. Melanocytes: from morphology to application. Skin Pharmacology and Physiology. 22, 114-121 (2009).
- Beaumont, K. A., Mohana-Kumaran, N., Haass, N. K. Modeling melanoma in vitro and in vivo. Healthcare (basel). 2, 27-46 (2013).
- Beaumont, K. A., Anfosso, A., Ahmed, F., Weninger, W., Haass, N. K. Imaging- and flow cytometry-based analysis of cell position and the cell cycle in 3D melanoma spheroids. Journal of Visualized Experiments. (106), e53486(2015).
- Weiswald, L. B., Bellet, D., Dangles-Marie, V. Spherical cancer models in tumor biology. Neoplasia. 17, 1-15 (2015).
- Cui, X., Hartanto, Y., Zhang, H. Advances in multicellular spheroids formation. Journal of the Royal Society Interface. 14, (2017).
- Fennema, E., Rivron, N., Rouwkema, J., van Blitterswijk, C., de Boer, J. Spheroid culture as a tool for creating 3D complex tissues. Trends in Biotechnology. 31, 108-115 (2013).
- Thoma, C. R., Zimmermann, M., Agarkova, I., Kelm, J. M., Krek, W. 3D cell culture systems modeling tumor growth determinants in cancer target discovery. Advanced Drug Delivery Review. 69-70, 29-41 (2014).
- Bulin, A. L., Broekgaarden, M., Hasan, T. Comprehensive high-throughput image analysis for therapeutic efficacy of architecturally complex heterotypic organoids. Scientific Reports. 7, 16645(2017).
- Lazzari, G., et al. Multicellular spheroid based on a triple coculture: A novel 3D model to mimic pancreatic tumor complexity. Acta Biomaterialia. 78, 296-307 (2018).
- Fong, E. L., Harrington, D. A., Farach-Carson, M. C., Yu, H. Heralding a new paradigm in 3D tumor modeling. Biomaterials. 108, 197-213 (2016).
- Gu, L., Mooney, D. J. Biomaterials and emerging anticancer therapeutics: engineering the microenvironment. Nature Reviews Cancer. 16, 56-66 (2016).
- Tevis, K. M., Colson, Y. L., Grinstaff, M. W. Embedded Spheroids as Models of the Cancer Microenvironment. Advanced Biosystems. 1, (2017).
- Welch, D. R., et al. Characterization of a highly invasive and spontaneously metastatic human malignant melanoma cell line. International Journal of Cancer. 47, 227-237 (1991).
- Balint, K., et al. Activation of Notch1 signaling is required for beta-catenin-mediated human primary melanoma progression. Journal of Clinical Investigation. 115, 3166-3176 (2005).
- Meier, F., et al. Human melanoma progression in skin reconstructs : biological significance of bFGF. the American Journal of Pathology. 156, 193-200 (2000).
- Du, Y., et al. Intracellular Notch1 Signaling in Cancer-Associated Fibroblasts Dictates the Plasticity and Stemness of Melanoma Stem/Initiating Cells. Stem Cells. 37, 865-875 (2019).
- Shao, H., et al. Notch1 Pathway Activity Determines the Regulatory Role of Cancer-Associated Fibroblasts in Melanoma Growth and Invasion. PLoS One. 10, 0142815(2015).
- Shao, H., et al. Notch1-WISP-1 axis determines the regulatory role of mesenchymal stem cell-derived stromal fibroblasts in melanoma metastasis. Oncotarget. 7, 79262-79273 (2016).
- Kalluri, R., Neilson, E. G. Epithelial-mesenchymal transition and its implications for fibrosis. Journal of Clinical Investigation. 112, 1776-1784 (2003).
- Price, J. E. Xenograft models in immunodeficient animals : I. Nude mice: spontaneous and experimental metastasis models. Methods in Molecular Medicine. 58, 205-213 (2001).
- Spaeth, E. L., et al. Mesenchymal stem cell transition to tumor-associated fibroblasts contributes to fibrovascular network expansion and tumor progression. PLoS One. 4, 4992(2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。