Method Article
Un nuovo modello di spheroid del tumore strutturato in 3D modulato come fibromastro per studiare l'interazione tumora-stroma e la scoperta di farmaci
In questo articolo
Riepilogo
Viene stabilito un nuovo modello di sferoide tridimensionale basato sull'interazione eterotipica delle cellule tumorali e dei fibroblasti stromali. Qui, presentiamo la cocoltura di cellule tumorali e fibroblasti stromali, imaging time-lapse, e microscopia confocale per visualizzare la formazione di sferoidi. Questo modello tridimensionale offre una piattaforma pertinente per studiare le interazioni tumora-stroma e testare le terapie antitumorali.
Abstract
Le interazioni tumora-stroma svolgono un ruolo importante nella progressione del cancro. I modelli di sferoide tumorale tridimensionali (3D) sono il modello in vitro più utilizzato nello studio delle cellule staminali tumorali, della ricerca preclinica sul cancro e dello screening farmacologico. I modelli di sferoide 3D sono superiori alla coltura convenzionale delle cellule tumorali e riproducono alcuni personaggi importanti di veri tumori solidi. Tuttavia, gli sferoidi tumorali 3D convenzionali sono costituiti esclusivamente da cellule tumorali. Non hanno la partecipazione delle cellule stromali tumorali e hanno una deposizione insufficiente della matrice extracellulare (ECM), quindi solo parzialmente imitando le condizioni in vivo dei tessuti tumorali. Abbiamo creato un nuovo modello di sferoide 3D multicellulare composto da cellule tumorali e fibroblasti stromali che imitano meglio il microambiente tumorale eterogeneo in vivo e la sua desmoplasia nativa. La formazione di sferoidi è strettamente regolata dai fibroblasti stromali del tumore ed è determinata dall'attività di alcune vie di segnalazione intracellulari cruciali (ad esempio, segnalazione Notch) nei fibroblasti stromali. In questo articolo, presentiamo le tecniche per la cocultura delle cellule tumorali-fibroblasti stromali, l'imaging time-lapse per visualizzare le interazioni cellula-cellula e la microscopia confocale per visualizzare le caratteristiche architettoniche 3D degli sferoidi. Mostriamo anche due esempi dell'applicazione pratica di questo modello di sferoide 3D. Questo nuovo modello di sferoide 3D multicellulare offre una piattaforma utile per studiare l'interazione tumora-stroma, chiarire come i fibroblasti stromali regolano le cellule staminali/iniziatiche del cancro, che determinano la progressione e l'aggressività del tumore, ed esplorano il coinvolgimento della reazione stromatale nella sensibilità e resistenza del farmaco cancro. Questa piattaforma può anche essere un modello in vitro pertinente per la scoperta di farmaci.
Introduzione
I tumori solidi rappresentano tessuti complessi composti da cellule neoplastiche e da una grande varietà di cellule stromali1,2,3,4. I fibroblasti stromali, o fibroblasti associati al cancro (CAF), sono una delle popolazioni di cellule stromali prominenti nella maggior parte dei tipi di tumori solidi. Sono coinvolti in modo critico nella regolazione della crescita tumorale, sgambi, metastasi, angiogenesi e resistenza ai farmaci attraverso la produzione di fattori di crescita, citochine/chemiocinesi, sintesi di ECM ed enzimi rimodellati (ad esempio, collagene, fibronectina e matrice di metalloteasi), rilascio di esosomici e interazione diretta eterotipica-cellula5,6,7,8,9,10 . CAF partecipa anche alla determinazione della metastasi specifica dell'organo tumorale preselezionando un sottoinsieme di cloni tumorali provenienti da popolazioni di cellule tumorali eterogenee nella lesione primaria e favorendo questi cloni selezionati per essere innescati per la metastasi a uno specifico organo lontano il cui microambiente è ottimale per la ricolonizzazione di cloni selezionati12. Inoltre, i fibroblasti e i loro fattori solubili secreti e l'ECM partecipano alla modulazione dell'angiogenesi tumorale13,14, risposta immunitaria anti-tumorale15, e sono anche coinvolti nella resistenza ai farmaci e recidiva del tumore16,17.
I modelli in vitro 3D di sferoide tumorale sono stati sviluppati e utilizzati nella ricerca sul cancro come modello intermedio tra le colture cellulari tumorali in vitro e i modelli tumorali in vivo18,19,20,21. I modelli di sferoide del tumore 3D hanno guadagnato popolarità nella ricerca sulle cellule staminali tumorali, nella ricerca preclinica sul cancro e nello screening farmacologico perché questi modelli riproducono alcune caratteristiche importanti dei tumori reali che sono assenti nei tradizionali monostrati 2D22. Molti modelli di sferoidi tumorali 3D esistenti sono costituiti esclusivamente da cellule tumorali e mancano della partecipazione delle cellule stromali tumorali. Questo spesso si traduce in sferoidi tumorali avendo deposizione ECM insufficiente e assenza di interazioni eterotipiche cellula-cellula. Gli sferoidi 3D convenzionali formati esclusivamente da cellule tumorali e l'adesione omotipica delle cellule possono imitare solo parzialmente le condizioni in vivo dei tessuti tumorali. Per superare alcune di queste limitazioni, gli investigatori hanno proposto di incorporare più tipi di cellule stromali nelle coculture 3D e hanno sviluppato diversi modelli di sferoide tumorale 3D eterotipi23,24,25,26,27. Inoltre, gli investigatori hanno impiegato matrici 3D esogene, tra cui idrogel naturali o polimeri sintetici come il glicole di polietilene, poli(lactide- co-glicolide) e poli(N-isopropylacrylacrylamide), per incorporare modelli di sferoidi monocellulari e multicellulari, creando un ambiente di supporto cellulare e riproducendo interazioni tra matrici cellulari28,29, rendendo questi sistemi più biologicamente rilevanti30. Tuttavia, l'incorporazione di alcuni tipi di cellule stromali, come le cellule endoteliali, nelle coculture 3D comporta ulteriore complessità per un sistema in vitro e rende difficile studiare le interazioni eterotipiche cellule-cellule tra due tipi specifici di cellule, come le interazioni cellula-fibroblasto delle cellule tumorali. Inoltre, le cellule endoteliali nei tessuti reali non sempre interagiscono direttamente con le cellule tumorali e altre cellule stromali perché c'è uno strato di membrana seminterrato avvolto al di fuori dei capillari che impedisce alle cellule endoteliali di interagire direttamente con le cellule tumorali e altre cellule stromali. In questi modelli di sferoide 3D, le cellule endoteliali incorporate non formano effettivamente vasi sanguigni, ma interagiscono direttamente con le cellule tumorali e altre cellule stromali, cosa che raramente si verifica in vivo. Allo stesso modo, le matrici esogene impiegate in alcuni dei modelli di sferoide 3D non sono identiche all'ECM nei tessuti tumorali reali in termini di struttura e composizione. Tutte queste condizioni artificiali possono portare a dati fuorvianti.
Recentemente abbiamo creato un nuovo modello di sferoide 3D multicellulare composto da cellule tumorali e CAF. Nel nostro modello, la formazione di sferoidi tumorali 3D è interamente determinata dal CAF. CAF indurre e regolare il fenotipo delle cellule staminali tumorali/inititrici. L'ECM prodotto da CAF è naturale e permette alla struttura desmoplastica di imitare meglio il microambiente tumorale in vivo. Questo nuovo modello 3D può essere uno strumento utile per lo screening dei farmaci contro il cancro e offre una piattaforma unica per studiare l'interazione tumora-stroma, chiarire come CAF regola le cellule staminali/iniziative del cancro ed esplorare il coinvolgimento delle interazioni stromali nella sensibilità e resistenza dei farmaci tumorali.
Protocollo
1. Coltivare cellule di melanoma e fibroblasti cutanei
- Coltivare le cellule del melanoma umano
- Coltura cellule di melanoma umano, C816131 in condizioni convenzionali di coltura cellulare aderenti in completo W489 medio (vedi passo 1.2) in un incubatore 37 C fornito con 5% di CO2 come descritto in precedenza32. Dividere le celle con un rapporto 1:5 quando raggiungono il 90% di confluenza.
- Melanoma cell coltura media (W489)
- Per il supporto W489 completo, utilizzare il mezzo MCDB153 80%, il 20% il supporto L-15 (vedere Tabella dei materiali),il 2% del siero bovino fetale (FBS), l'insulina a 5 g/mL, il CaCl2di 1,68 mM e lo 0,11% bicarbonato di sodio. Per la cocultura, non aggiungere FBS, insulina e CaCl2.
- Isolamento fibroblasto della pelle di topo
- Tagliare un frammento di pelle di 1 cm x 1 cm da un topo in conformità con le linee guida e i regolamenti pertinenti del Comitato per la cura e l'uso degli animali dell'istituzione (IACUC).
- Digerire la pelle con dispasi (vedi Tabella dei Materiali)a 4 gradi durante la notte. Togliere il derma dall'epidermide e digerire ulteriormente con collagenase (1 mg/mL in DMEM, vedi Tabella dei materiali) a temperatura ambiente (RT) durante la notte.
- Coltura fibroblasta della pelle del topo
- Lavare i pellet di tessuto con PBS e coltura in DMEM con 10% FBS e 1% penicillina-streptomiacina in 37 C/5% CO2. Dividere le celle con un rapporto 1:2 quando raggiungono il 90% di confluenza.
- Traduci i fibroblasti cutanei con GFP/lentivirus usando metodi standard prima della cocultura.
- Caratterizzazione dei fibroblasti della pelle di topo mediante immunostaining
- Preparazione cellulare per la colorazione
- Semina i fibroblasti della pelle in 24 piastra ben ad una densità di 2 x 104 cellule / bene. Il giorno 2, lavare le celle con PBS 2x e fissarle in formalina tampone neutra 2% per 10 min. Rimuovere la formalina e lavare le celle fisse con PBS due volte.
- Immunostaining
- Aggiungere 200 l di soluzione di blocco ad ogni pozzo e incubare la piastra per 30 min a RT, quindi aggiungere il topo anti-z-SMA diluito a 1:200 e incubare a 37 s per 1 h. Lavare con PBS 3x, 5 min ciascuno.
- Aggiungere Alex Fluor 488 capra anti-tono IgG a 1:400 diluizione e incubare a RT per 1 h. Lavare gli anticorpi 3x con PBS, 5 min ciascuno.
- Aggiungete 1 DAPI e incubate a RT per 2 min.
- Osservare le cellule e scattare immagini utilizzando un microscopio a fluorescenza invertita.
- Preparazione cellulare per la colorazione
- Fibroblasti preetichettanti e cellule melanoma
- I fibroblasti di semi in un piatto da 100 mm il giorno 1 in modo che la confluenza cellulare raggiunga il 60% il giorno successivo. Il secondo giorno, togliere il mezzo di coltura e aggiungere gFP/lentivirus (1:3-1:5 diluito dal magazzino) in un normale supporto di coltura con 4 g/mL di polibrene. Incubare le cellule in un'incubatrice a 37 gradi centigradi per 6 h, rimuovere il mezzo e sostituirlo con un nuovo mezzo di coltura regolare. Dopo 2 giorni, osservare il segnale GFP dalle cellule utilizzando un microscopio a fluorescenza. Trasduci le cellule C8161 con DsRed/lentivirus in condizioni simili. I protocolli per la preparazione di GFP/lentivirus e DsRed/lentivirus sono stati descritti in precedenza14,34.
2. Cocultura cellulare
- Seme la cocultura c8161-fibroblast.
- Il giorno 0 del saggio di formazione degli sferoidi, staccano sia il C8161 che i fibroblasti cutanei utilizzando 0,25% trypsin-EDTA. Abbassare le celle a 250 g per 5 min a RT e lavare una volta con PBS.
- Risospendere le cellule nel mezzo di cocoltura cellulare (siero libero, privo di insulina e mezzo W489 privo di calcio mescolato con DMEM senza siero con un rapporto 1:1). Regolare la concentrazione cellulare a 2 x 104 cellule/mL.
- Mescolare le cellule C8161 con i fibroblasti ad un rapporto 1:1 e aggiungere 2 mL delle miscele cellulari ad ogni pozzetto di un pozzo 24 bene. Ogni pozzo dovrebbe contenere 2 x 104 di ogni tipo di cellule. Ogni condizione deve essere fatta in triplice copia.
NOTA: È importante utilizzare una piastra trattata con coltura non di tessuto (vedere Tabella dei materiali). In caso contrario, le cellule si attaccheranno fortemente a una piastra e non saranno in grado di sospendere gli sferoidi.
- Incubare le cellule a 37 gradi centigradi per 4 h fino a quando le cellule si attaccano alla piastra, quindi eseguire l'imaging time-lapse o la scansione confocale ai punti temporali indicati per ogni saggio.
3. Imaging Time-lapse di Live Cell
- Prima della cocultura, accendere il sistema di imaging time-lapse (vedi Tabella dei materiali)seguendo le istruzioni del produttore e lasciare che l'incubatore raggiunga i 37 e il 5% di CO2. Di solito ci vuole 1 h per il sistema per raggiungere l'equilibrio. Posizionare con cura la piastra di coltura sul palco del microscopio all'interno dell'incubatrice e chiudere saldamente la porta.
- Aprire il software del sistema di imaging time-lapse (vedere Tabella dei materiali) e scegliere il tipo di lastra e il produttore in modo che il microscopio possa individuare con precisione l'area di scansione. Scegli i pozze di interesse e una lente obiettivo 10x. Scegliere le impostazioni per l'area di scansione, l'intervallo di tempo tra le scansioni e un'ora di inizio e di fine. In questo protocollo, il numero di formato massimo per l'area di scansione per 1 po '36 e l'intervallo di tempo è 1 h.
- Registrare l'imaging time-lapse da 4 a 52 h.
NOTA: l'ora di inizio, l'ora di fine e la durata devono essere ottimizzate in base al tipo di cella e allo scopo dell'esperimento. - Quando si completa la registrazione delle immagini, utilizzare il software del sistema di imaging time-lapse per recuperare i dati ed esportare video o set di immagini.
4. Microscopia confocale e filmati 3D
- Posizionare la piastra di cocoltura cellulare sullo stadio di un microscopio a fluorescenza invertita (vedere Tabella dei materiali)e utilizzare fasci laser rossi e verdi. Osservare le cellule sotto un obiettivo 5x o 10x e scegliere uno sferoide per avviare la scansione.
- Utilizzare un passo z da 1 m per eseguire la scansione dal basso verso l'alto dello sferoide. Elaborare i dati utilizzando il software di elaborazione delle immagini (vedere Tabella dei materiali) per ricostruire un'immagine 3D che può essere ulteriormente ruotata e salvata come filmato 3D.
5. Cultura solista delle cellule di melanoma e formazione di cluster/aggregati 2D
- Seme 2 x 104 cellule di melanoma C8161 in ogni pozzo di un 24 piastra di benessere come descritto nella sezione 2.1. Coltivano le cellule per 7-10 giorni e fotografate usando un microscopio a fluorescenza invertito.
6. Controllare se gli Spheroid 3D e i cluster/aggregati di cellule 2D sono sospesi nel mezzo o attaccati alle piastre
- Per la cocoltura cellulare, controllare gli sferoidi 3D formati il giorno 7. Per le impostazioni cultura a cella singola, controllare i cluster/aggregati 2D formatisi il giorno 10.
- Impostare piastre di coltura cellulare sulla piattaforma di un microscopio a fluorescenza invertito. Mettere un ago piegato con una siringa in un pozzo e aspirare delicatamente il mezzo di coltura dentro e fuori per disturbare il mezzo di coltura nei pozzi. Registrare questo processo utilizzando la modalità filmato del software filmato (vedere Tabella dei materiali). Gli sferoidi 3D saranno mobili, ma gli ammassi/aggregati di cellule 2D rimarranno fermi.
7. Immagine confocale di Spheroids 3D
NOTA: Le cellule coculture iniziano a formare sferoidi da 48 a 72 h a seconda del tipo di fibroblasti utilizzati. Generalmente, gli sferoidi si ingrandiscono gradualmente con il tempo. Piccoli sferoidi possono fondersi per formare sferoidi più grandi fino al giorno 7. Dopo che gli sferoidi sono stabilizzati di dimensioni, possono durare più di 10 giorni. Dopo di che, gli sferoidi spesso si staccano dal fondo della piastra di coltura e si riuniscono al centro dei pozzi. Durante l'allargamento degli sferoidi, le cellule al centro di solito muoiono a causa di insufficiente nutrizione e/o di un microambiente tossico. Di conseguenza, il picco della formazione di sferoidi 3D e la tempistica per l'immagine degli sferoidi maturati dovrebbero essere ottimizzati utilizzando esperimenti pilota. Per questo protocollo, la microscopia confocale è stata eseguita intorno al giorno 7 quando gli sferoidi erano maturi e le cellule al centro degli sferoidi erano ancora vive secondo la fluorescenza e la morfologia delle cellule al centro.
- Per fare la microscopia confocale, utilizzare un laser verde e rosso per eseguire la scansione degli sferoidi. Determinare l'area di scansione sotto un obiettivo 10x e spostarsi dal basso verso l'alto dello sferoide con un passaggio di 1 x.
- Genera i video di formazione e rotazione degli sferoidi 3D utilizzando la funzione di proiezione 3D del software di elaborazione delle immagini (ad esempio, ImageJ).
8. Attività del percorso di segnalazione intracellulare Notch1 nella determinazione della regolazione stroposta delle cellule staminali tumorali/di inattività
- Isolamento e caratterizzazione dei fibroblasti cutanei da topi Notch1 a basso e perdita di funzione
- Isolare i fibroblasti cutanei da due coppie di topi geneticamente modificati: Gain-Of-Function Notch1 (GOFNotch1: Fsp1.Cre Itopi ROSALSL-N1IC/z)rispetto al loro controllo controparti (GOFctrl : FSP1. Cre-/-; ROSALSL-N1IC)e Notch1 Loss-Of-Function (LOFNotch1: Fsp1.Cre Topinotch1 LoxP/LoxPs/z)rispetto al loro controllo controparti (LOFctrl : FSP1. Cre-/-; Notch1LoxP/LoxP)topi31, rispettivamente. Isolare e caratterizzare i fibroblasti cutanei utilizzando il protocollo descritto nelle sezioni 1.3-1.5.
- Traduci i fibroblasti della pelle di topo con GFP/lentivirus.
- Vedere la sezione 1 per il metodo per trasdurre le cellule con il vettore lentivirale.
- Cocultura di fibroblasti e cellule del melanoma
- Condurre l'esperimento di cocoltura cellulare come descritto nella sezione 2.
- Valutare l'effetto dell'attività della via Intracellular Notch1 nei fibroblasti sulla determinazione della regolazione stroposta delle cellule staminali/iniziatrici del cancro misurando le dimensioni degli sferoidi 3D
- Eseguire la quantificazione della formazione di sferoidi sotto ogni condizione fotografando gli sferoidi nel momento in cui gli sferoidi sono maturi (indicato dallo stop della crescita intorno al giorno 5-7 a seconda dei tipi di fibroblasti). Misurare le dimensioni degli sferoidi 3D utilizzando il software di elaborazione delle immagini.
9. Test della risposta farmacologica delle cellule staminali/tiofonanti del cancro utilizzando il saggio 3D Spheroid
NOTA: CAF può regolare l'eterogenicità del cancro e indurre il fenotipo delle cellule staminali/iniettive tumorali. CAF supporta anche il cancro delle cellule staminali/ini-inizializzanti per sopportare trattamenti clinici. Le cellule staminali tumorali hanno dimostrato di essere responsabili della resistenza ai farmaci. Pertanto, abbiamo usato questo modello di sferoide 3D per valutare la risposta ai farmaci delle cellule staminali/ini-loro tumorali. Il risultato può valutare la potenziale efficacia clinica dei farmaci anti-cancro bene.
- Somministrazione di farmaci
- Subito dopo aver coculturato le cellule in una piastra di 24 pozze, preparare i farmaci in un mezzo di diluizione seriale in mezzo di coltura per raggiungere 5 volte di una gamma desiderata di concentrazioni basate su esperimenti pilota (cioè, 1 nM, 2,5 nM, 5 nM, 10 nM e 25 nM).
Aggiungere 0,5 mL di soluzioni farmacologiche corrispondenti a ogni pozzo delle cellule coculture. Trattare il gruppo di controllo con supporti coculture regolari come accennato in precedenza. - NOTA: l'inibitore meK è solubile nei mezzi di coltura cellulare. Pertanto, i controlli vuoti sono 2,5 mL di supporto di coltura cellulare. Tuttavia, se il farmaco non è solubile in soluzione acquosa e richiede solventi come DMSO, allora i supporti di coltura cellulare con la stessa concentrazione di DMSO dovrebbero essere applicati al gruppo di controllo.
- Subito dopo aver coculturato le cellule in una piastra di 24 pozze, preparare i farmaci in un mezzo di diluizione seriale in mezzo di coltura per raggiungere 5 volte di una gamma desiderata di concentrazioni basate su esperimenti pilota (cioè, 1 nM, 2,5 nM, 5 nM, 10 nM e 25 nM).
- Quantificazione della risposta ai farmaci contando gli sferoidi
- Osservare le cellule trattate e le cellule non trattate utilizzando un microscopio a fluorescenza e fotografare le cellule ogni giorno. Quantificare la formazione di sferoidi nei diversi gruppi sperimentali e confrontare la capacità di formare sferoidi delle colture cellulari sotto diverse concentrazioni di droga.
NOTA: Gli sferoidi tendono ad apparire 5-7 giorni dopo la cocultura. Gli effetti del farmaco diventeranno evidenti in quel punto di tempo. - Utilizzare il microscopio a fluorescenza per immaginare/fotografare gli sferoidi e le cellule nei pozzetti e quindi utilizzare il software di immagine per calcolare la dimensione media degli sferoidi e il numero di sferoidi formati per campo a bassa potenza (LPF x 4) in ogni gruppo di trattamento nel tempo.
NOTA: Le cellule che ricevono un trattamento farmacologico efficace devono formare meno o nessun sferoide rispetto al gruppo di controllo. Questa è un'indicazione dell'efficacia del farmaco testato sulla soppressione delle cellule staminali tumorali.
- Osservare le cellule trattate e le cellule non trattate utilizzando un microscopio a fluorescenza e fotografare le cellule ogni giorno. Quantificare la formazione di sferoidi nei diversi gruppi sperimentali e confrontare la capacità di formare sferoidi delle colture cellulari sotto diverse concentrazioni di droga.
Risultati
Abbiamo sviluppato un nuovo metodo per generare sferoidi 3D con un sistema di cocoltura cellulare eterotipica in vitro che imita il microambiente tumorale in vivo. I fibroblasti sono derivati dai fibroblasti della pelle di topo. I fibroblasti cutanei sono stati generati come descritto sopra e sono stati caratterizzati comecellule di z-SMA- /Vimentin /FSP-1. Le cellule del melanoma metastatico umano (C8161) sono state coltivate nel mezzo W489 come descritto32. Per visualizzare e distinguere i fibroblasti dalle cellule tumorali, i fibroblasti e le cellule melanoma sono stati pretradotti con GFP/lentivirus e DsRed/lentivirus, rispettivamente34,36, prima della cocultura cellulare.
La figura 1 mostra un esempio di sferoidi 3D multicellulari formati dalla coculturazione delle cellule del melanoma e dei fibroblasti. Le cellule del melanoma coltivate in assenza di fibroblasti non hanno formato sferoidi 3D tipici, anche se alcune cellule di melanoma formano cluster/aggregati 2D con la coltura estesa. La dimensione media degli sferoidi era di circa 170-360 m di diametro (media: 275, SD - 37) il giorno 5/7. Utilizzando l'imaging time-lapse, abbiamo osservato che i fibroblasti e le cellule tumorali interagivano nella cocultura e iniziavano a formare sferoidi 3D a circa 36 h di cocultura come mostrato nel Video 1. L'imaging time-lapse ha registrato il processo dinamico dell'interazione cellula-cellula e la fase iniziale della formazione di sferoidi a 4-52 h di cocultura. Il picco della formazione di sferoidi 3D si è verificato intorno al giorno 5-7. Gli sferoidi 3D formati erano composti da fibroblasti e cellule di melanoma, dove la maggior parte erano cellule tumorali. Il video 2 illustra il processo dinamico delle singole cellule di melanoma coltivate (DsRed//C8161) nella formazione di gruppi di cellule/aggregati a partire da 4-52 h in singola coltura. La formazione di ammassi/aggregati 2D ha raggiunto il picco intorno al giorno 7-10. Video 3 e Video 4 mostrano le strutture di uno sferoide 3D e di un cluster di cellule tumorali 2D visualizzate rispettivamente dalla microscopia confocale. Lo sferoide 3D e gli ammassi di cellule tumorali 2D sono stati esaminati mediante microscopia confocale il giorno 7 della cocultura cellulare. Il video 5 mostra che gli sferoidi 3D sono stati sospesi nel mezzo di coltura e nel mobile, mentre il video 6 mostra che l'ammasso di cellule tumorali 2D è stato attaccato alla piastra di coltura e immobile. La sospensione nel mezzo è una caratteristica degli sferoidi 3D che li distingue dai cluster 2D. Quando il mezzo nel piatto di coltura cellulare o bene è disturbato da cadere o pipettare delicatamente il mezzo di coltura, gli sferoidi 3D sospesi si muovono, mentre gli ammassi di cellule 2D sono immobili. Solo poche singole cellule morte sono mobili.
La figura 2A mostra un esempio di questo modello 3D che funge da piattaforma unica per studiare le interazioni tumora-stroma e per chiarire come l'attività del percorso di segnalazione intracellulare Notch1 in CAF regola le cellule staminali tumorali e la formazione di sferoidi. Due coppie di fibroblasti (Fb) isolati dalla pelle di Gain-Of-Function Notch1 (GOFNotch1: Fsp1.Cre Itopi ROSALSL-N1IC/z)rispetto al loro controllo controparti (GOFctrl : FSP1. Cre-/-; ROSALSL-N1IC)e Notch1 Loss-Of-Function (LOFNotch1: Fsp1.Cre Topinotch1 LoxP/LoxPs/z)rispetto al loro controllo controparti (LOFctrl : FSP1. Cre-/-; Notch1LoxP/LoxP-mouse35, rispettivamente. Tutti i fibroblasti sono stati trasdotti da GFP/lentivirus e cocoltivati con cellule melanoma C8161 pretradusse con DsRed/lentivirus. L'imaging time-lapse mostra che L'imaging Time-GOFNotch1 ha impedito alle cellule di melanoma C8161 di formare sferoidi 3D rispetto a Fb-GOFctrl durante i primi 4-52 h di cocoltura cellulare. Al contrario, Fb-LOFNotch1 ha promosso la formazione di sferoidi 3D da cellule melanoma C8161 rispetto a Fb-LOFctrl. Figura 2B, in alto, mostra immagini rappresentative di sferoidi 3D formati il giorno 7 della cocultura cellulare con diversi fibroblasti che svolgono varie attività di percorso di Notch. La figura 2B,in basso, mostra i dati quantitativi sulla dimensione media degli sferoidi 3D formati il giorno 7 della cocultura cellulare con diversi fibroblasti che trasportano varie attività di percorso di Notch.
La figura 3 mostra un esempio di questo modello 3D utilizzato per testare la risposta farmacologica delle cellule staminali/di inirti del cancro. È stato dimostrato che le cellule staminali/tiofili che si stanno adoperando per la resistenza ai farmaci e la recidiva del cancro. Pertanto, valutare la risposta ai farmaci utilizzando questo modello 3D può rivelare meglio l'efficacia clinica di un potenziale farmaco per il trattamento del cancro. Le cellule del melanoma C8161 si basano sulla segnalazione MAPK attiva per la crescita e l'invasione delle cellule. Esprimono anche alti livelli di CDK4/Kit, ma non portano una mutazione BRAF. Per testare la risposta farmacologica delle cellule staminali/iniziatrici del cancro verso l'inibitore MAPK utilizzando questo modello 3D, abbiamo costati cellule melanoma C8161 e fibroblasti in 24 piastre di pozzo. PD0325901 (vedere Tabella dei materiali),un inibitore della MAPK, è stato preparato in una diluizione seriale a una gamma di concentrazioni da 1 nM, 2,5 nM, 5 nM, 10 nM e 25 nM. Il PD0325901 è stato aggiunto alle coculture cellulari quando le miscele cellulari sono state placcate. Le cellule coculture non trattate sono state usate come controllo. Abbiamo valutato la capacità di formare sferoidi delle coculture cellulari a diverse concentrazioni di farmaci e l'abbiamo confrontata con il controllo non trattato. La figura 3A mostra immagini rappresentative di sferoidi 3D formati il giorno 5 di cocultura cellulare a diverse concentrazioni di droga. La figura 3B è il dato quantitativo della dimensione media per sferoide e il numero di sferoidi 3D formati per campo a bassa potenza (LPF x 4) nel giorno 5 della cocultura cellulare in diverse concentrazioni di farmaci.
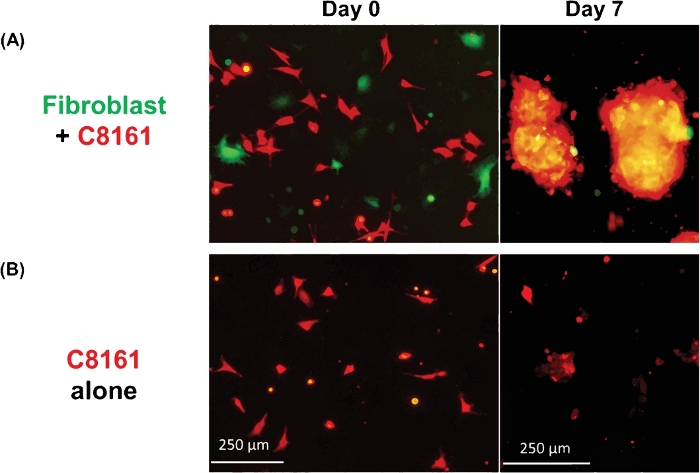
Figura 1: Formazione di sferoidi 3D e cluster 2D. (A) Immagine rappresentativa degli sferoidi 3D formati dalla cocultura delle cellule del melanoma C8161 umano e dei fibroblasti della pelle di topo. Gli sferoidi 3D sono stati fotografati il giorno 7 della cocultura delle cellule melanoma e dei fibroblasti. Le dimensioni medie degli sferoidi erano di 170-360 m di diametro (media : 275, SD - 37) il giorno 5/7. Il numero medio di sferoidi era di 18–26 (20,5 x 3,6) per campo a bassa potenza (LPF x4). (B) Immagine rappresentativa degli ammassi di cellule tumorali 2D formate da un'unica coltura di cellule del melanoma C8161. Gli ammassi di cellule melanoma 2D sono stati fotografati il giorno 7 di singola coltura di cellule melanoma. Fare clic qui per visualizzare una versione più grande di questa figura.
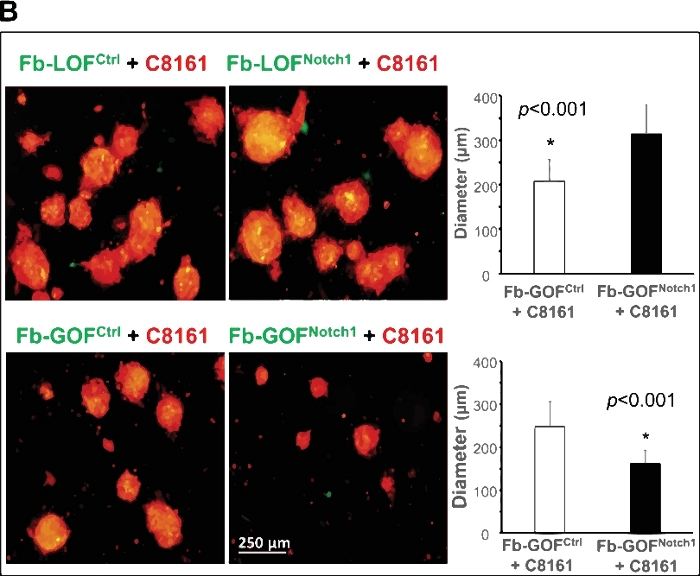
Figura 2: Spiegazione del ruolo dell'attività del percorso di segnalazione intracellulare Notch1 in CAF nella regolazione delle cellule staminali/avvio del cancro utilizzando il modello sferoide 3D. (A) L'attività del percorso di segnalazione intracellulare di Notch1 in CAF ha determinato la formazione di sferoidi da parte di cellule di melanoma nella cocultura cellulare. Il video time-lapse mostra che Fb-GOFNotch1 ha interrotto la formazione di sferoidi 3D da parte delle cellule del melanoma C8161, mentre Fb-LOFNotch1 ha promosso la formazione di più sferoidi 3D da parte delle cellule di melanoma C8161 durante i primi 4-52 h di cocultura cellulare. (B) Top: Immagini rappresentative di sferoidi 3D formati il giorno 7 della cocultura cellulare con diversi fibroblasti che trasportano varie funzioni di percorso notch. In basso: i dati quantitativi della dimensione media (diametro [m]/spheroid) degli sferoidi 3D formatisi il giorno 7 della cocultura cellulare con diversi fibroblasti che trasportano varie attività di percorso di Notch. Il test t dello studente a due code è stato utilizzato per l'analisi statistica. I dati sono espressi come media : deviazione standard (SD). Fare clic qui per visualizzare una versione più grande di questa figura.
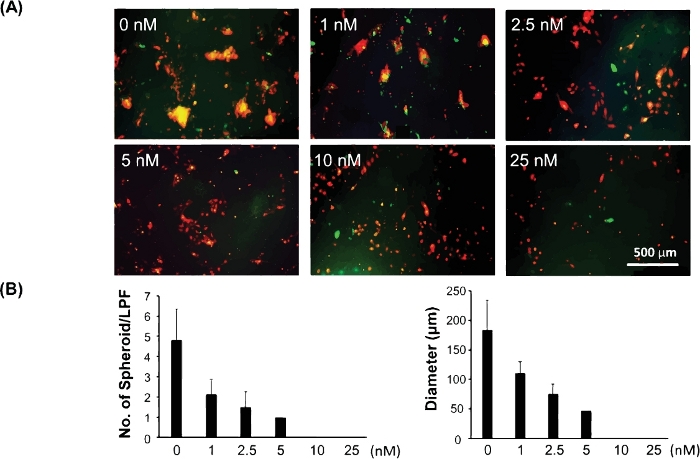
Figura 3: Valutazione della risposta ai farmaci delle cellule staminali/iniziali del cancro utilizzando il modello sferoide 3D. (A) Immagini rappresentative di sferoidi 3D formati il giorno 5 della cocultura cellulare a diverse concentrazioni di droga. (B) I dati quantitativi della dimensione media (diametro [m]/spheroid) e del numero di sferoidi 3D per campo a bassa potenza (LPF x 4) si sono formati il giorno 5 della cocultura cellulare con diverse concentrazioni di farmaci. I dati quantitativi sono espressi come media e deviazione standard (SD). Fare clic qui per visualizzare una versione più grande di questa figura.
Video 1: Processo dinamico di formazione di sferoidi 3D nella fase iniziale della cocoltura cellulare. L'imaging time-lapse mostra interazioni dinamiche cellule-cellule tra fibroblasti e cellule tumorali nella cocultura e formazione di sferoidi 3D durante i primi 4-52 h di cocultura cellulare. Le cellule hanno iniziato a formare sferoidi 3D circa 48 h dopo l'inizio della cocultura. Il picco della formazione di sferoidi 3D si è verificato il giorno 5-7 (non mostrato qui). Gli sferoidi 3D erano composti da fibroblasti e cellule di melanoma, dove la maggior parte erano cellule tumorali. Clicca qui per scaricare questo video.

Video 2: Processo dinamico di formazione di cluster 2D nella fase iniziale della cocultura cellulare. L'imaging time-lapse mostra il processo dinamico degli ammassi 2D formati da cellule C8161melanoma in singola coltura. La formazione di ammassi 2D si è verificata intorno al giorno da 7 a 10. L'imaging time-lapse registra il periodo di 4-52h in una singola coltura di cellule melanoma /C8161. Clicca qui per scaricare questo video.
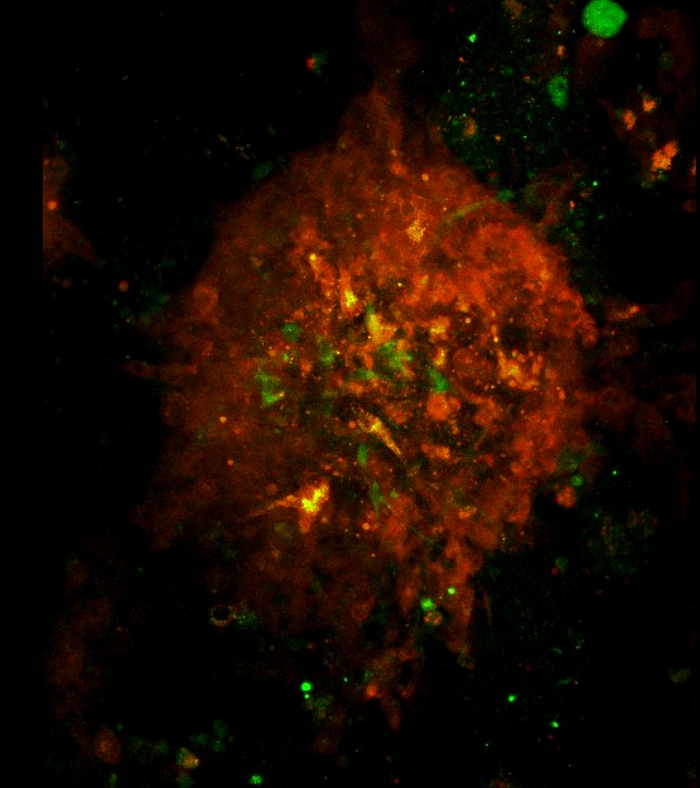
Video 3: Architettura e rotazione di uno sferoide 3D visualizzato dalla microscopia confocale. Architettura e rotazione di uno sferoide 3D. I laser verdi e rossi sono stati utilizzati per scansionare gli sferoidi formatisi il giorno 7 nella cocoltura cellulare. L'area di scansione è stata determinata in base a un obiettivo 10x. La scansione inizia dal basso verso la parte superiore dello sferoide in un passo di 1 m. Il film di rotazione dello sferoide 3D è stato creato utilizzando il software Fiji. Clicca qui per scaricare questo video.
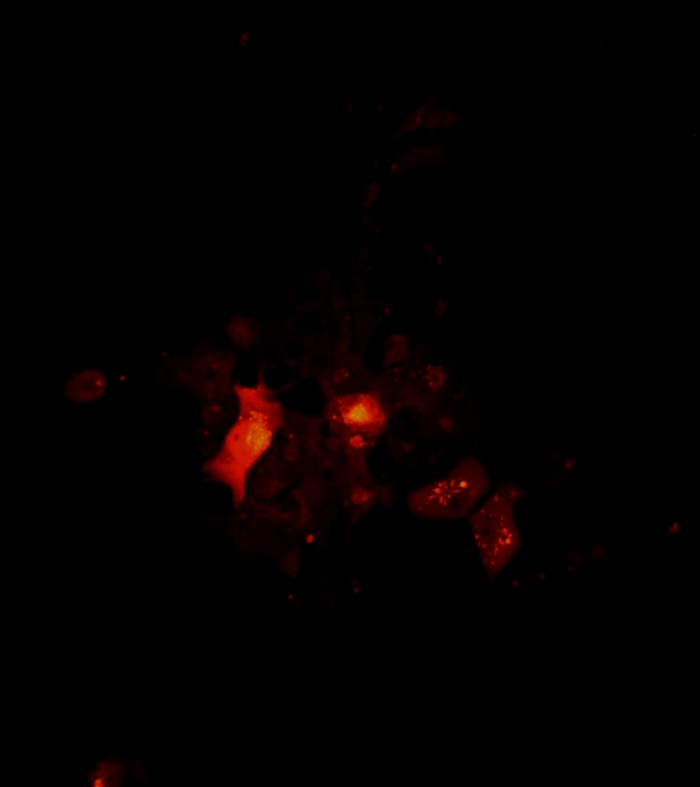
Video 4: Architettura e rotazione di un cluster di cellule tumorali 2D, come visualizzato dalla microscopia confocale. Architettura e rotazione di un cluster 2D. Le immagini confocali di cluster cellulari sono state scattate il giorno 7 della coltura singola delle cellule del melanoma. L'area di scansione è stata determinata in base a un obiettivo 10x. La scansione inizia dal basso verso la parte superiore dello sferoide in un passo di 1 m. Il filmato di rotazione cluster 2D è stato creato utilizzando il software Fiji. Clicca qui per scaricare questo video.
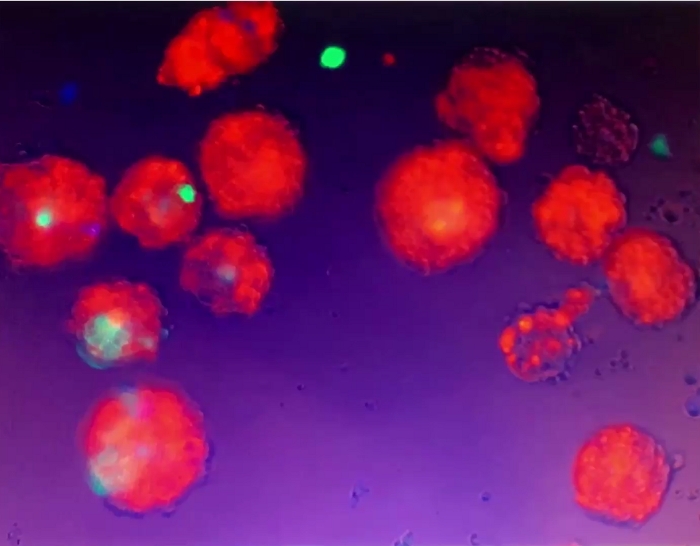
Video 5: Movimento di sferoidi 3D. Gli sferoidi 3D sono stati sospesi nel mezzo culturale e non hanno aderito al piatto di coltura /bene. Quando ancora medio nella coltura cellulare ben è stato disturbato da pipettaggio delicato, gli sferoidi 3D sospesi spostato. Clicca qui per scaricare questo video.
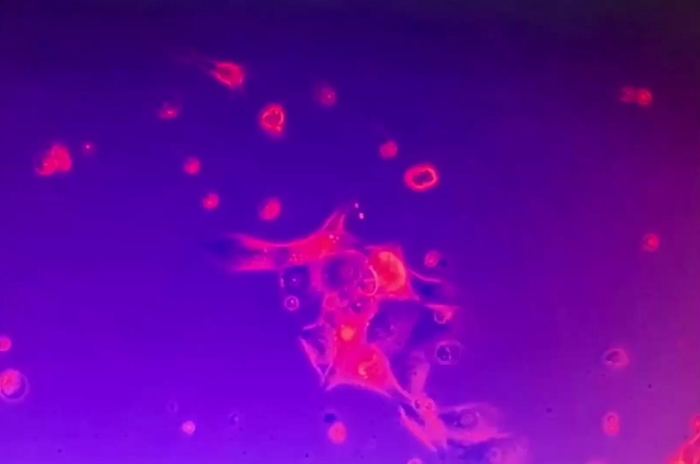
Video 6: Stabilità dei cluster di cellule tumorali 2D. L'ammasso di cellule tumorali 2D era ancorato alla piastra di coltura e immobile nonostante il disturbo del mezzo di coltura. Alcune singole cellule morte erano mobili. Clicca qui per scaricare questo video.
Discussione
Le tecniche di coltura cellulare 3D in vitro sono state ampiamente impiegate per decenni nella ricerca sul cancro. Rispetto ai tradizionali sistemi di coltura cellulare 2D, il microambiente 3D riassume le interazioni cellula-cellula e/o cellula-matrice e consente di imitare le condizioni reali osservate nei tessuti tumorali. Tuttavia, un sistema 3D formato solo da cellule tumorali e interazioni omotipiche cellule-cellule non tiene conto dell'importanza del dialogo incrociato eterotipico e può fornire risultati imprecisi nella ricerca. Recentemente abbiamo sviluppato un nuovo sistema 3D che combina cellule tumorali e CAF per imitare meglio il microambiente tumorale eterogeneo in vivo e la sua reazione desmoplastica nativa e rigida.
I fibroblasti sono componenti principali dello stroma tumorale. CAF sono coinvolti nella regolazione della progressione del tumore suscitando fattori solubili, ECM / remodellando enzimi10,11, e esosomi. Inoltre, CAF svolgono un ruolo nella resistenza ai farmaci e la recidiva del tumore16,17. Il nostro sistema multicellulare di sferoidi 3D può essere utilizzato per esplorare meccanismi molecolari di interazioni tumorale-stromali e per affrontare la resistenza ai farmaci e la recidiva del tumore. CAF sono principalmente derivati da attivato fibroblasti quiescenti locali e reclutato circolante midollo osseo MSC, che subiscono in situ differenziazione in CAF nel tessuto tumorale37,38,39. Nello studio attuale, abbiamo usato i fibroblasti della pelle per creare un modello di sferoide 3D multicellulare. Tuttavia, anche altri tipi di fibroblasti (ad esempio, MSC-DF), funzionano in modo molto simile ai fibroblasti cutanei per regolare la formazione di sferoidi 3D delle cellule tumorali34. MSC-DF può essere generato dal midollo osseo murino MSC, che viene arricchito coltivo coltivano le cellule mononucleari del midollo osseo nel mezzo di coltura delle cellule MSC per circa 10 giorni con cambiamenti medi periodici ogni 3 giorni. Questi MSC sono caratterizzati come CD73-/CD105-/Lin-. Per differenziare MSC in fibroblasti, MSC sono successivamente coltivati con DMEM completo per altre 2 settimane. MSC-DF è caratterizzato come sMA-/Vimentin,/FSP-1e celle36. MSC-DF può essere importanti regolatori tumorali. Poiché una frazione di CAF in molti tipi di tumori solidi è differenziata dal MSC circolante reclutato rilasciato dal midollo osseo36, MSC-DF può essere promettenti obiettivi di trattamento. Essi sono anche molto più facilmente manipolati terapeuticamente o mirati prima di essere reclutati ai tessuti tumorali e differenziati in CAF. Così, il nostro modello 3D offre un sistema ideale per studiare e testare non solo le cellule tumorali, ma anche diverse frazioni o sottopopolazioni di CAF. Il metodo per la formazione di sferoidi 3D è semplice. I passaggi critici includono l'utilizzo di un mezzo senza siero per la cocultura, l'applicazione del giusto rapporto di fibroblasti alle cellule tumorali e l'utilizzo delle piastre di coltura giuste per la cocultura. La limitazione potenziale del nostro metodo è che la formazione di sferoidi 3D è in gran parte cancerosa dipendente dalla linea. Il nostro protocollo di formazione degli sferoidi può richiedere l'ottimizzazione del rapporto tra fibroblasti e cellule tumorali se vengono impiegate diverse linee cellulari tumorali. Va notato che abbiamo usato un modello di cocultura delle cellule fibroblaste del melanoma umano e del topo per la formazione di sferoidi 3D, perché è molto più facile creare cellule GOF o LOF nei fibroblasti murini per lo studio del ruolo di una molecola o del percorso di segnalazione nella regolazione della formazione di sferoidi tumorali. La capacità delle cellule del melanoma umano e dei fibroblasti murini di formare sferoidi indica che le molecole necessarie per le comunicazioni cellulari funzionano tra le specie. Recentemente abbiamo testato la cocoltura di fibroblasti umani con cellule melanoma umano e abbiamo scoperto che i fibroblasti umani possono anche regolare le cellule del melanoma umano per formare sferoidi 3D.
Abbiamo impiegato cellule melanoma metastatiche umane, C8161, nel nostro modello di sferoide 3D multicellulare. Abbiamo anche testato altre cellule di melanoma umano, per esempio, 1205Lu32, che porta la mutazione BRAFV600E, e MeWo, che esprime alti livelli di CDK4/Kit (ATCC HTB-65), e ha scoperto che sono anche in grado di formare sferoidi 3D in cocultura. Ciò indica che la formazione di sferoidi 3D da parte delle cellule tumorali è indipendente dai tipi di mutazioni oncogene. Anche se non abbiamo testato se altri tipi di cellule tumorali non melanoma sono in grado di formare sferoidi 3D con fibroblasti, i nostri risultati indicano che la formazione di sferoidi 3D non è limitata a una linea cellulare di melanoma e non può dipendere da una linea cellulare del cancro specifica.
Abbiamo mostrato due esempi di applicazioni pratiche del nostro modello di sferoide 3D. Un esempio è stato quello di chiarire l'attività della via di segnalazione intracellulare Notch nella regolazione del fenotipo cellulare del tronco canceroso/inititante e della formazione di sferoidi 3D. Abbiamo dimostrato che la via di segnalazione intracellulare di Notch in CAF è un interruttore molecolare che controlla il fenotipo delle cellule staminali/inicontrolling del cancro utilizzando questo modello sferoide 3D. I nostri risultati non solo scoprono un meccanismo molecolare alla base della regolazione strostrazionale delle cellule staminali tumorali e dell'eterogenicità del cancro, ma evidenziano anche che la via Notch nel CAF è un obiettivo critico per la terapia del melanoma. Questo esempio indica che il nostro modello di sferoide 3D è molto utile per studiare i meccanismi per le interazioni del fibroblasto cellula-stromal cancro e identificare potenziali bersagli terapeutici. Un altro esempio è stato quello di testare la risposta farmacologica delle cellule staminali/di inirti tumorali in presenza di CAF. È ben noto che la risposta farmacologica delle cellule tumorali, comprese le cellule staminali tumorali, varia in presenza e assenza di CAF. La presenza di CAF in questo sistema in vitro rende questo modello più clinicamente rilevante e i risultati dei test generati più affidabili. Inoltre, il nostro sistema sferoide 3D è versatile. Può essere utilizzato per vari scopi. Ad esempio, se in questo modello 3D vengono impiegate cellule tumorali resistenti ai farmaci, queste possono essere modificate per affrontare la resistenza ai farmaci e forse la ricorrenza del tumore. Può anche essere modificato per testare o screening farmaci che si rivolgono principalmente CAF per il trattamento del cancro. CAF sono recentemente diventati promettenti obiettivi terapeutici. Il targeting di CAF presenta dei vantaggi. In primo luogo, rispetto alle cellule tumorali che sono anormali (spesso con alterazioni genetiche) e intelligenti (facilmente guadagnano resistenza alle chemio e radioterapie), CAF nel tessuto tumorale sono cellule normali e geneticamente più stabili, quindi hanno meno probabilità di sviluppare resistenza ai trattamenti. In secondo luogo, il targeting CAF non dipende dal tipo di mutazioni oncogeniche nelle cellule tumorali. In terzo luogo, il targeting CAF può ottenere più effetti di successo attraverso fibroblasti-dipendenti anti-tumore, anti-angiogenesi, e/o la risposta immunitaria del cancro modulante. Il nostro modello di sferoide 3D è un potente strumento per la scoperta di diverse serie di strategie terapeutiche contro il cancro.
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari concorrenti.
Riconoscimenti
Ringraziamo la Dott.ssa Omaida C. Velazquez (Università di Miami) per una collaborazione, una consulenza e una discussione utili; Dr. Jie Li (Università di Miami) per la fornitura di cellule MeWo; e il Dr. Meenhard Herlyn (The Wistar Institute) per la fornitura di tutte le altre cellule di melanoma. Ringraziamo inoltre la Dott.ssa Marcia Boulina, Direttrice dell'Analytical Imaging Core Facility dell'Università di Miami, per l'analisi delle immagini. È stato sostenuto da sovvenzioni del Bankhead-Coley Cancer Research Program (Award 09BN-11), Women's Cancer Association (la 53rd annual grant) e di fondi interni dell'Università di Miami.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA | Corning | 25-253-CI | |
| 24-well plate | Corning | 351147 | Non-tissue culture treated plate, 24-well, flat bottom with low evaporation lid |
| Alex Fluor 488 goat anti-mouse IgG | Life Technology | A21202 | |
| CaCl2 1.5 M | Sigma-Aldrich | C5670-500G | |
| Collagenase, Type 1A | Sigma-Aldrich | C-2674 | 500 mg, 1 mg/mL concentration in DMEM. |
| DakoCytomation | Dako | x0909 | |
| DAPI | |||
| Dispase Grade II | Roche Diagnostics | 165859 | |
| Dulbecco's Modified Eagle's Medium(DMEM) | Corning | 10-013-CV | |
| Fetal Bovine Serum | VMR | 97068-085 | Premium Grade |
| Fiji (ImageJ) | NIH | Free for downloading, no license needed. | |
| IncuCyte Zoom 2016A | Essen Bioscience | ||
| IncuCyte Zoom System | Essen Bioscience | ||
| Insulin | Sigma-Aldrich | I1882 | |
| L-15 Medium (Leibovitz) | Sigma-Aldrich | L1518 | |
| Leica SP5 Inverted Confocal Microscope | Leica | ||
| MCDB 153 Medium | Sigma-Aldrich | M7403-10X1L | |
| Mouse anti α-SMA (smooth muscle actin), monoclone | Abcam | ab18640 | |
| Olympus IX51 Inverted Fluorescence Microscope | Olympus | IX51 | |
| Olymupus CellSens | Olympus | ||
| PD0325901 | Selleckchem Chemicals | S1036 | |
| Penicillin Streptomycin Solution | Corning | 30-002- CI | 100 X |
| Sodium Bicarbonate 7.5% | Corning | 25-035-CI |
Riferimenti
- Lorusso, G., Ruegg, C. The tumor microenvironment and its contribution to tumor evolution toward metastasis. Histochemistry and Cell Biology. 130, 1091-1103 (2008).
- Anton, K., Glod, J. Targeting the tumor stroma in cancer therapy. Current Pharmaceutical Biotechnology. 10, 185-191 (2009).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144, 646-674 (2011).
- Junttila, M. R., de Sauvage, F. J. Influence of tumour micro-environment heterogeneity on therapeutic response. Nature. 501, 346-354 (2013).
- Allinen, M., et al. Molecular characterization of the tumor microenvironment in breast cancer. Cancer Cell. 6, 17-32 (2004).
- Bhowmick, N. A., Neilson, E. G., Moses, H. L. Stromal fibroblasts in cancer initiation and progression. Nature. 432, 332-337 (2004).
- Lynch, C. C., Matrisian, L. M. Matrix metalloproteinases in tumor-host cell communication. Differentiation. 70, 561-573 (2002).
- Midwood, K. S., Williams, L. V., Schwarzbauer, J. E. Tissue repair and the dynamics of the extracellular matrix. The International Journal of Biochemistry & Cell Biology. 36, 1031-1037 (2004).
- Olumi, A. F., et al. Carcinoma-associated fibroblasts direct tumor progression of initiated human prostatic epithelium. Cancer Research. 59, 5002-5011 (1999).
- Orimo, A., Weinberg, R. A. Stromal fibroblasts in cancer: a novel tumor-promoting cell type. Cell Cycle. 5, 1597-1601 (2006).
- Luga, V., et al. Exosomes mediate stromal mobilization of autocrine Wnt-PCP signaling in breast cancer cell migration. Cell. 151, 1542-1556 (2012).
- Zhang, X. H., et al. Selection of bone metastasis seeds by mesenchymal signals in the primary tumor stroma. Cell. 154, 1060-1073 (2013).
- Orimo, A., et al. Stromal fibroblasts present in invasive human breast carcinomas promote tumor growth and angiogenesis through elevated SDF-1/CXCL12 secretion. Cell. 121, 335-348 (2005).
- Shao, H., et al. Activation of Notch1 signaling in stromal fibroblasts inhibits melanoma growth by upregulating WISP-1. Oncogene. 30, 4316(2011).
- Ziani, L., Chouaib, S., Thiery, J. Alteration of the Antitumor Immune Response by Cancer-Associated Fibroblasts. Frontier in Immunology. 9, 414(2018).
- Kraman, M., et al. Suppression of antitumor immunity by stromal cells expressing fibroblast activation protein-alpha. Science. 330, 827-830 (2010).
- Straussman, R., et al. Tumour micro-environment elicits innate resistance to RAF inhibitors through HGF secretion. Nature. 487, 500-504 (2012).
- Smalley, K. S., Lioni, M., Noma, K., Haass, N. K., Herlyn, M. In vitro three-dimensional tumor microenvironment models for anticancer drug discovery. Expert Opinion on Drug Discovery. 3 (1), 1-10 (2007).
- Santiago-Walker, A., Li, L., Haass, N. K., Herlyn, M. Melanocytes: from morphology to application. Skin Pharmacology and Physiology. 22, 114-121 (2009).
- Beaumont, K. A., Mohana-Kumaran, N., Haass, N. K. Modeling melanoma in vitro and in vivo. Healthcare (basel). 2, 27-46 (2013).
- Beaumont, K. A., Anfosso, A., Ahmed, F., Weninger, W., Haass, N. K. Imaging- and flow cytometry-based analysis of cell position and the cell cycle in 3D melanoma spheroids. Journal of Visualized Experiments. (106), e53486(2015).
- Weiswald, L. B., Bellet, D., Dangles-Marie, V. Spherical cancer models in tumor biology. Neoplasia. 17, 1-15 (2015).
- Cui, X., Hartanto, Y., Zhang, H. Advances in multicellular spheroids formation. Journal of the Royal Society Interface. 14, (2017).
- Fennema, E., Rivron, N., Rouwkema, J., van Blitterswijk, C., de Boer, J. Spheroid culture as a tool for creating 3D complex tissues. Trends in Biotechnology. 31, 108-115 (2013).
- Thoma, C. R., Zimmermann, M., Agarkova, I., Kelm, J. M., Krek, W. 3D cell culture systems modeling tumor growth determinants in cancer target discovery. Advanced Drug Delivery Review. 69-70, 29-41 (2014).
- Bulin, A. L., Broekgaarden, M., Hasan, T. Comprehensive high-throughput image analysis for therapeutic efficacy of architecturally complex heterotypic organoids. Scientific Reports. 7, 16645(2017).
- Lazzari, G., et al. Multicellular spheroid based on a triple coculture: A novel 3D model to mimic pancreatic tumor complexity. Acta Biomaterialia. 78, 296-307 (2018).
- Fong, E. L., Harrington, D. A., Farach-Carson, M. C., Yu, H. Heralding a new paradigm in 3D tumor modeling. Biomaterials. 108, 197-213 (2016).
- Gu, L., Mooney, D. J. Biomaterials and emerging anticancer therapeutics: engineering the microenvironment. Nature Reviews Cancer. 16, 56-66 (2016).
- Tevis, K. M., Colson, Y. L., Grinstaff, M. W. Embedded Spheroids as Models of the Cancer Microenvironment. Advanced Biosystems. 1, (2017).
- Welch, D. R., et al. Characterization of a highly invasive and spontaneously metastatic human malignant melanoma cell line. International Journal of Cancer. 47, 227-237 (1991).
- Balint, K., et al. Activation of Notch1 signaling is required for beta-catenin-mediated human primary melanoma progression. Journal of Clinical Investigation. 115, 3166-3176 (2005).
- Meier, F., et al. Human melanoma progression in skin reconstructs : biological significance of bFGF. the American Journal of Pathology. 156, 193-200 (2000).
- Du, Y., et al. Intracellular Notch1 Signaling in Cancer-Associated Fibroblasts Dictates the Plasticity and Stemness of Melanoma Stem/Initiating Cells. Stem Cells. 37, 865-875 (2019).
- Shao, H., et al. Notch1 Pathway Activity Determines the Regulatory Role of Cancer-Associated Fibroblasts in Melanoma Growth and Invasion. PLoS One. 10, 0142815(2015).
- Shao, H., et al. Notch1-WISP-1 axis determines the regulatory role of mesenchymal stem cell-derived stromal fibroblasts in melanoma metastasis. Oncotarget. 7, 79262-79273 (2016).
- Kalluri, R., Neilson, E. G. Epithelial-mesenchymal transition and its implications for fibrosis. Journal of Clinical Investigation. 112, 1776-1784 (2003).
- Price, J. E. Xenograft models in immunodeficient animals : I. Nude mice: spontaneous and experimental metastasis models. Methods in Molecular Medicine. 58, 205-213 (2001).
- Spaeth, E. L., et al. Mesenchymal stem cell transition to tumor-associated fibroblasts contributes to fibrovascular network expansion and tumor progression. PLoS One. 4, 4992(2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon