Method Article
إعداد شرائح فرس النهر البشري الحادة للتسجيلات الكهربية
In This Article
Erratum Notice
Summary
ويصف البروتوكول المقدم نقل وإعداد أنسجة فرس النهر البشرية التي تم استئصالها بهدف نهائي هو استخدام شرائح الدماغ الحيوية كأداة تقييم قبل الظهر للمواد المضادة للصرع المحتملة.
Abstract
ويصيب الصرع حوالي 1% من سكان العالم ويؤدي إلى انخفاض حاد في نوعية الحياة بسبب النوبات المستمرة وكذلك ارتفاع خطر الوفاة المفاجئة. على الرغم من وفرة من خيارات العلاج المتاحة، حوالي 30٪ من المرضى مقاومة للأدوية. وقد تم تطوير العديد من العلاجات الجديدة باستخدام نماذج حيوانية، على الرغم من أن معدل المرضى المقاومين للأدوية لا يزال دون تغيير. أحد الأسباب المحتملة هو عدم وجود ترجمة بين نماذج القوارض والبشر ، مثل ضعف تمثيل المقاومة الدوائية البشرية في النماذج الحيوانية. أنسجة الدماغ البشرية المُجَرَّدة كأداة تقييم قبل الإكلينيكية لديها ميزة سد هذه الفجوة الترجمية. هو موضح هنا هو وسيلة لإعداد عالية الجودة لشرائح الدماغ فرس النهر الإنسان والحث مستقرة لاحقة من نشاط الصرع. البروتوكول يصف تحريض نشاط انفجار أثناء تطبيق 8 م م KCl و 4-aminopyridin. هذا النشاط حساس لاكوساميد AED المنشأة أو المرشحين رواية لمكافحة البيبيل، مثل dimethylethanolamine (DMEA). بالإضافة إلى ذلك, الأسلوب يصف التعريفي من الأحداث مثل المضبوطات في CA1 من شرائح الدماغ فرس النهر الإنسان عن طريق الحد من خارج الخلية ملغ2 + وتطبيق bicuculline, مانع مستقبلات GABAA. يمكن استخدام الإعداد التجريبي لفحص المواد المضادة للصرع المحتملة لآثارها على نشاط الصرع. وعلاوة على ذلك، يمكن التحقق من صحة آليات العمل التي تُفترض بشأن مركبات معينة باستخدام هذا النهج في الأنسجة البشرية (على سبيل المثال، استخدام تسجيلات التحامل). في الختام، فإن التحقيق في الأنسجة الحيوية في الدماغ البشري السابقين في الدماغ (هنا، الحصين المُجَرَّح من المرضى الذين يعانون من صرع الفص الصدغي) سيحسن المعرفة الحالية للآليات الفسيولوجية والمرضية في الدماغ البشري.
Introduction
الصرع هو واحد من الاضطرابات العصبية الأكثر شيوعا، التي تؤثر على 1٪ من سكان العالم، ويرتبط مع زيادة معدلات الاعتلال والوفيات1،2. للأسف، ثلث المرضى الذين يعانون من الصرع مقاومة للأدوية، على الرغم من وفرة من خيارات العلاج المتاحة بما في ذلك أكثر من 20 الأدوية المضادة للصرع المعتمدة (AEDs)3. الفشل في ترجمة النتائج من البحوث الحيوانية قبل السريرية إلى التجارب السريرية هو أحد الأسباب التي تجعل استراتيجيات العلاج الواعدة ليست فعالة في العديد من المرضى4. في الآونة الأخيرة, وقد ثبت neuropeptide Y (NPY) و galanin أن يكون لها آثار مكافحة البُلَد في النماذج الحيوانية; على الرغم من, عندما اختبارها في أنسجة الدماغ البشري مُجَذَّب, فقط كان NPY فعالة5.
21- ومعظم المعارف القائمة المتعلقة بالآليات العصبية الأساسية ومناهج العلاج بالأمراض تنبع من نماذج حيوانية وتجارب استزراع الخلايا. على الرغم من أن المعلومات، وهذه النماذج تمثل جوانب واحدة فقط من الأمراض البشرية المعقدة وشبكة الدماغ البشري الكبار. بدلا من ذلك، أنسجة الدماغ البشرية لديها القدرة على سد الفجوة الترجمية ولكن نادرا ما تكون متاحة للدراسات الوظيفية. على سبيل المثال، أنسجة الدماغ بعد الوفاة كانت أداة قيمة في التحقيق في التعبير البروتيني، مورفولوجيا الدماغ، أو الاتصالات التشريحية، على الرغم من أن نشاط الخلايا العصبية غالبا ما يتعرض للخطر هو هذا النسيج6،,7،,8،,9،,10،,11.
في المقابل، تم التحقيق في الأنسجة المخية البشرية الحية المُجَرَّحَة فيما يتعلق بتقييم الأدوية قبل الكلينيكية، وظائف الخلايا العصبية الأساسية وأنماط التعبير الجيني12،13،14،15،16،17. ميزة كبيرة من شرائح الدماغ البشري مقارنة مع شرائح القوارض هو جدوى طويلة من الأنسجة العصبية بعد استئصال وإعداد. بالمقارنة مع شرائح الدماغ القوارض، والتي يمكن عادة أن تسجل لمدة تصل إلى 8 ساعة بعد إعداد، شرائح الدماغ البشري تظهر نشاط الخلايا العصبية مستقرة لمدة تصل إلى 72 ساعة، مما يتيح إجراء تحقيق شامل لهذه العينات النادرة وقيمة12،18.
وقد بحثت العديد من الدراسات خصائص نشاط الصرع في مناطق مختلفة من الأنسجة القشرية وهرون الدماغ الإنسان استئصالها واستخدمت أساليب مختلفة لالتحث على نشاط الصرع. في شرائح القوارض، يمكن أن يسبب نشاط الصرع عدة طرق: التحفيز الكهربائي لخلايا DG hilar، زيادة K+ خارج الخلية (8-12 mM KCl)، حظر مستقبلات GABAA بواسطة bicuculline (BIC)، منع قنوات البوتاسيوم من قبل 4-أمينوبيريدين (4-AP)، وإزالة أو تقليل Mg2+ في محلول خارج الخلية19. ومع ذلك ، فإن تحريض نشاط الصرع في الأنسجة البشرية يتطلب الجمع بين اثنين على الأقل من الطرق المذكورة أعلاه20،21،22.
هنا هو طريقة لإعداد شرائح الدماغ فرس النهر الإنسان, التي هي قابلة للحياة لمدة تصل إلى 20 ح وإظهار تحريض النشاط الصرع عند تطبيق عالية K+ (8 mM) و 4-AP أو منخفضة ملغ2 + و BIC.
Protocol
يجب على المرضى إعطاء موافقة خطية مستنيرة قبل العملية، ويجب أن تكون الاتفاقيات الأخلاقية اللازمة في مكانها قبل التجربة. وفيما يتعلق بالنتائج التمثيلية، استعرضت مؤسسة شاريتيه - يونيفرسيتسميدين ، برلين ،جميع الدراسات التي تشمل مشاركين من البشر وأقرتها (EA2/111/14).
1. إعداد حلول 10x
ملاحظة: بسبب الصعوبات في التخطيط للوصول إلى أنسجة الدماغ البشري، فمن المستحسن لإعداد حلول 10x كما هو موضح هنا. وبدلاً من ذلك، يمكن إعداد حلول 1x النهائية طازجة بإضافة مواد فردية في التركيز النهائي إلى الماء المقطر المزدوج (ddH2O).
- بالنسبة للحلول الفردية 10x، إضافة المواد إلى ddH2O وفقا للجدول 1 ويحرك حتى يذوب.
- استخدام 10x حلول تصل إلى 1 شهر بعد إعداد (تصل إلى 1 سنة لتجميد 10X الكولين aCSF).
- ل10x الكولين ACSF, إعداد 50 مل aliquots من 10x 1.1 الكولين ACSF(الجدول 1)وتجميد في -20 درجة مئوية أو -80 درجة مئوية حتى مزيد من الاستخدام.
ملاحظة: لا تضيف الجلوكوز وCaCl2 إلى 10x 1.1 الكولين aCSF لمنع التلوث بالبكتيريا وهطول كربونات الكالسيوم. - يمكن استخدام 10x الحل 2 لجميع الحلول النهائية 1x ، في حين أن حلول 10x 1.1-1.4 يتم تخصيصها وتسميا وفقا لذلك (الجدول 1).
2. إعداد 1x الحلول النهائية
ملاحظة: يجب إعداد حلول 1x النهائية طازجة أو أقرب وقت ممكن في اليوم السابق للاستخدام. يجب أن تكون جميع الحلول النهائية مُكَرْكَبَة بـ 5% CO2 و 95% O2 باستخدام مُشتَشِد غاز زجاجي لإثراء الحلول بالأكسجين، وضبط درجة الـ (7.4) (الحد الأقصى = 7.4 ± 0.2).
- الكولين ACSF للنقل والتحضير
- للحصول على الحل النهائي 500 مل, ذوبان 50 مل aliquot من 10x الحل 1.1 aliquot للكولين aCSF في 37 درجة مئوية حمام الماء.
- أضف 50 مل aliquot من 10x حل 1.1 و 50 مل من 10x حل 2 إلى ما يقرب من 300 مل من ddH2O.
- إضافة تركيزات النهائية من الجلوكوز وCaCl2، ثم يحرك حتى يذوب(الجدول 1، الحل 1.1).
- إضافة ddH2O إلى حجم النهائي من 500 مل وقياس osmolarity (300 mOsm ± 10 mOsm).
- اختياريا، استخدم مرشح لتعقيم الحل (انظر مناقشة طول مدة صلاحية شريحة تحت ظروف معقمة).
- ملء زجاجة منفصلة مع حوالي 100 مل من 1X الكولين ACSF للنقل من غرفة العمليات إلى المختبر.
- اختياري: اعتمادا على وقت النقل من غرفة العمليات إلى المختبر، والنظر في استخدام أغطية زجاجات الغاز ضيق لضمان درجة PH مستقرة من ACSF خلال فترات النقل أطول.
- تخزين الحل النهائي في 4-8 درجة مئوية حتى مزيد من الاستخدام.
- في يوم التشغيل, البرد 1X الكولين aCSF على الجليد وcarogenate لمدة 10-15 دقيقة على الأقل باستخدام مثرثر الغاز الزجاجي متصلة بغاز كاربوجين (5% CO2,95% O2).
ملاحظة: النظر في الحفاظ على زجاجة الغاز في متناول غرفة العمليات في حالة من أطول أوقات الانتظار، الأمر الذي سيتطلب إعادة كاربوجينيشن من حل النقل. ومع ذلك، نقلنا أنسجة فرس النهر دون إعادة كاربوجينيشن قبل أوقات النقل الطويلة والقصّر (15 دقيقة مقابل 60 دقيقة) ولم نلاحظ الاختلافات في تحريض نشاط الصرع.
- aCSF للتخزين والتسجيل
- للحصول على حل 2 L النهائي، إضافة 200 مل من 10x حل 1.2 (aCSF) و 200 مل من 10x الحل 2 والجلوكوز(الجدول 1) إلى ~ 1500 مل من ddH2O.
ملاحظة: تعتمد وحدات التخزين من الحلول النهائية على التجارب التطبيقية ونوع الغرفة المستخدمة في التخزين والتسجيل. - إضافة ddH2O إلى حجم النهائي من 2 L وقياس osmolarity (300 mOsm ± 10 mOsm).
- Prewarm الحل إلى 35 درجة مئوية وcarogenate لمدة 10-15 دقيقة على الأقل قبل الاستخدام.
- للحصول على حل 2 L النهائي، إضافة 200 مل من 10x حل 1.2 (aCSF) و 200 مل من 10x الحل 2 والجلوكوز(الجدول 1) إلى ~ 1500 مل من ddH2O.
- هايك++4-AP aCSF لاستقراء نشاط الانفجار
- للحصول على حل 1 L النهائي، إضافة 100 مل من 10x الحل 1.3 (هاي ك++4-AP ACSF) و 100 مل من 10x الحل 2 إلى ~ 700 مل من ddH2O.
- إضافة الجلوكوز و 4-AP (التركيز النهائي = 100 μM) وفقا للجدول 1.
- إضافة ddH2O إلى حجم النهائي من 1 L وقياس osmolarity (300 mOsm ± 10 mOsm).
- Prewarm الحل إلى 35 درجة مئوية وcarogenate لمدة 10-15 دقيقة على الأقل قبل الاستخدام.
- LowMg2 +BIC ACSF لالتدثارة من الأحداث مثل المضبوطات (SLEs)
- للحصول على حل 1 L النهائي، إضافة 100 مل من 10x الحل 1.4 (lowMg2 + +BIC ACSF) و 100 مل من 10x الحل 2 إلى ~ 700 مل من ddH2O.
- إضافة الجلوكوز و BIC (التركيز النهائي = 10 μM) وفقا للجدول 1.
- إضافة ddH2O إلى حجم النهائي من 1 L وقياس osmolarity (300 mOsm ± 10 mOsm).
- Prewarm الحل إلى 35 درجة مئوية وcarogenate لمدة 10-15 دقيقة على الأقل قبل الاستخدام.
3. إعداد غرفة واجهة
- في غرفة الواجهة، تقع الشرائح على ثلاث طبقات من ورق التصفية لضمان كمية كافية من الحل أسفل الشريحة. للقيام بذلك، وقطع اثنين ~ 4 سم × 2 سم قطعة من ورقة مرشح لكل شريحة عقد المقصورة (غرفة واجهة وصف يتكون من اثنين من المقصورات) ووضعها على رأس بعضها البعض.
- ضع سلاسل قطنية رقيقة حول أوراق التصفية 4 سم × 2 سم داخل المقصورات لكسر توتر الحل. ضمان تدفق حتى (هنا، أسود النايلون قطع إلى سلاسل رقيقة قطع ~ 10 سم في الطول وتستخدم؛ لوضع، انظر الشكل 1).
- ضع قطع صغيرة من ورق التصفية فوق أوراق التصفية الأكبر داخل المقصورات التي تحمل الشريحة. وينبغي أن تكون قطع الأنسجة تصفية صغيرة تقريبا في حجم شريحة واحدة في الدماغ (~ 1.5 سم × 1.0 سم) ، وسوف تمكن من مزيد من التعامل مع شرائح الفردية. ضع ثلاث إلى أربع قطع ورق تصفية صغيرة في كل حجرة.
- ضمان معدل تدفق aCSF من 1.8 مل / دقيقة مع مضخة ال peristaltic.
- Carbogenate وprewarm غرفة واجهة إلى ~ 35 درجة مئوية (يجب أن تكون درجة الحرارة النهائية للشريحة ~ 32 درجة مئوية).
4- إنشاء منطقة إعداد
ملاحظة: يمكن إجراء التحضير في ظروف معقمة لتجنب التلوث وإطالة بقاء الشريحة. ومع ذلك، لا تناسب جميع الهزات تحت غطاء معقمة، وهناك حاجة إلى تدابير أخرى للحد من التلوث أثناء التحضير. يصف هذا القسم بعض هذه التدابير.
- امسح منطقة التحضير بنسبة 70% EtOH ووضع إما رقائق الألومنيوم أو الأغطية المعقمة فوق المنطقة.
- إعداد الغراء السوبر، واثنين من ملاقط حادة، ملعقة، مشرط مع شفرات، وشفرة لقطع الخام من أنسجة الدماغ. يمكن تعقيم الأدوات قبل إجراء الحد من التلوث.
- امسح علبة العازلة ولوحة العينة من الاهتزاز مع EtOH 70٪. مرة واحدة في علبة العازلة جافة تماما، وتغطية مع رقائق الألومنيوم ووضع علبة في حمام الجليد. ملء حمام الجليد مع الثلج المسحوق والحفاظ على -20 درجة مئوية حتى التحضير.
- امسح شفرة الاهتزاز وشفرة الحلاقة بنسبة 70% من ماكينات قياس الاهتزازات، ثم قم بمعايرة الاهتزازات لتقليل الاهتزازات العمودية وتلف الأنسجة أثناء عملية التقطيع.
5. تقطيع الأنسجة وتخزينها
- مباشرة بعد استئصال, وضع الأنسجة فورا في البرد, كاربوجينيد الكولين aCSF ونقل بسرعة إلى المختبر.
تنبيه: ارتداء القفازات وقناع الوجه في جميع الأوقات أثناء التحضير، لأن أنسجة الدماغ البشرية يمكن أن تحتوي على مسببات الأمراض المحتملة. بالإضافة إلى ذلك، فإن ارتداء قناع الوجه عندما لا يعمل تحت غطاء معقمة يقلل إلى حد كبير من تلوث الحلول وأنسجة الدماغ. - إزالة الأنسجة من الكولين aCSF وقطع أي أجزاء محروقة من الأنسجة.
- قطع سطح حتى إلى قطعة الأنسجة الغراء على لوحة العينة، مع الأخذ في الاعتبار زاوية القطع وطبقات الأنسجة. من الناحية المثالية، تحتوي شريحة فرس النهر على DG و CA1-4 و (إذا كان ذلك ممكناً) subiculum.
- شريحة أنسجة الدماغ إلى شرائح سميكة 400 ميكرومتر وضبط السعة والسرعة أثناء القطع. بسبب احتمال ماطر بيا المتبقية, أنسجة الدماغ البشرية يظهر المزيد من المقاومة، وقد تتطلب قطع أبطأ.
ملاحظة: سمك شريحة يؤثر كثيرا على الشبكة المتاحة (المزيد من الخلايا العصبية في شرائح سمكا) أو قابلية البقاء من شريحة (اختراق الحل في شريحة). استخدمنا 500 ميكرون لشرائح لزيادة الشبكة الصغيرة المتاحة، ولم نتمكن من ملاحظة الاختلافات في تحريض نشاط الصرع. يشيع استخدام شرائح 300 ميكرومتر لإجراء تجارب المشبك، على الرغم من أن تحريض نشاط الصرع في هذه الشرائح لم يتم اختباره بعد هنا. نحن نستخدم 400 ميكرومتر كسمكة شريحة قياسية، على الرغم من أن 300-500 ميكرومتر قد تكون كافية. - قبل جمع، واستخدام مشرط للحد من أحجام شرائح الدماغ لتناسب غرفة تسجيل. لاستخدام غرفة الغشاء (انظر القسم 6)، يجب أن تكون الشرائح القصوى 1.5 سم × 1 سم. في حين الحد، والنظر في طبقات محددة والاتصالات اللازمة لتكون سليمة للتسجيل (على سبيل المثال، للتسجيل في CA1 وDG، وقطع بعيدا subiculum والأنسجة البيضاء المحيطة بها).
- باستخدام ملعقة وقطط صغيرة، ضع شرائح بعناية في غرفة واجهة على أوراق تصفية صغيرة والسماح لهم بقية ل ~ 1 ساعة في aCSF حتى تسجيل.
- يمكن تسجيل الشرائح لمدة تصل إلى 20 ساعة (حتى لفترة أطول عندما تكون في ظروف معقمة).
6- تسجيل نشاط الصرع
- في غرفة الغشاء (غرفة تسجيل نوع مغمورة)، ضع شريحة الدماغ على غشاء نصف نفاذ شفاف، وهو ملتصق بحلقة بلاستيكية24. لهذا، واستخدام الغراء السوبر لإرفاق حلقة من البلاستيك إلى غشاء إدراج ثقافة الخلية.
- استخدم مشرط لإزالة أي غشاء على السطح الخارجي للحلقة البلاستيكية. تأكد من أن الغشاء حتى وتعلق تماما على الحلبة قبل وضع الغشاء في الغرفة.
ملاحظة: يمكن تخزين الغشاء في ddH2O في 4-8 درجة مئوية وإعادة استخدامها لمدة تصل إلى 1 شهر. الحفاظ على الغشاء الرطب في جميع الأوقات. - يتم توصيل كل من تدفق وتدفق غرفة الغشاء إلى أنابيب لتوريد الحل. ضع الأنابيب في مضخة مُتعالة بحيث يتحرك التدفق والتدفق إلى الخارج في اتجاهين متعاكسين.
- وضع تدفق وتدفق أنبوب في كاربوجينيد، aCSF قبل اسخاء حتى تمتلئ جميع الأنابيب والغرفة مع الحل. ضبط سرعة المضخة ال peristaltic لتحقيق معدل تدفق حتى 10-13 مل / دقيقة.
ملاحظة: غرفة الغشاء المستخدمة هنا هو معدل تدفق عالية، غرفة تسجيل نوع المغمورة تمكين تدفق حل يصل إلى 14 مل / دقيقة24. في حالة استخدام غرفة تسجيل نوع مغمورة مختلفة، يجب تعديل معدلات التدفق. ومع ذلك ، للتحريض على نشاط الصرع ، ينصح بشدة باستخدام غرفة الغشاء. - استخدام عنصر التدفئة متصلة تدفق على مقربة من غرفة غشاء لضمان درجة حرارة مستقرة من 32 درجة مئوية.
- إعداد 1-2 MΩ الماصات الزجاجية باستخدام سحب عمودي. ملء المواص مع 154 mM NaCl الحل ووضعها في حامل القطب.
- باستخدام ملاقط وملعقة، وإزالة شريحة فرس النهر من غرفة واجهة عن طريق اتخاذ شريحة مع ورقة مرشح صغيرة ووضع على حد سواء في طبق بيتري مليئة aCSF carbogenated. إزالة ورقة مرشح صغير من شريحة فرس النهر، و (إذا لزم الأمر) تطبيق بعض القوة باستخدام ماصة لفصل شريحة من ورقة التصفية. يجب الحرص على عدم الوجه شريحة.
- ضع الشريحة في غرفة التسجيل واحملها في مكانها باستخدام شبكة الشريحة.
ملاحظة: بسبب مبدأ برنولي، في غرفة غشاء نوع المغمورة المستخدمة، وعادة ما تكون الشرائح مستقرة دون استخدام شبكة شريحة إضافية. - وضع الأقطاب الكهربائية في المنطقة وطبقة من الفائدة (هنا، CA1) والبدء في التسجيل.
- سجل النشاط الميداني المحتمل في وضع المشبك الحالي بمعدل أخذ العينات من 10 إلى 20 كيلو هرتز وتصفية تمريرة منخفضة عند 2 كيلو هرتز.
- سجل النشاط القاعدي في aCSF لمدة تصل إلى 5 دقائق.
- تبديل أنابيب تدفق من aCSF إلى ارتفاع+4AP أو lowMg2 +BIC aCSF وأنبوب تدفق إلى حاوية النفايات لمنع خلط الحلول. بعد 2 دقيقة، ووضع أنبوب تدفق في نفس الحل كما تدفق للحفاظ على الحل.
- يجب أن يكون نشاط الاندفاع الناجم عن ارتفاع درجةالـhighK + +4-AP مرئيًا بعد 2-5 دقيقة من الغسيل. ومع ذلك، يمكن أن التعريفي من SLEs من قبل lowMg2 ++ BIC يستغرق ما يصل إلى 30 دقيقة. إذا لزم الأمر، قم بتغيير مواضع الأقطاب الكهربائية بعناية للحصول على أفضل النتائج.
- مرة واحدة في الموقف النهائي، سجل النشاط الأساسي لمدة 20 دقيقة على الأقل. إذا قمت بتسجيل SLEs، ففكر في التسجيلات الأساسية الأطول بسبب التردد المنخفض لـ SLEs.
- في حالة أن النشاط الأساسي مستقر (هضبة من تواتر الحدث) ، وغسل في الدواء المطلوب. لاحظ أنه نظرا لارتفاع معدل تدفق الغسيل في المخدرات يستغرق سوى 2-5 دقيقة، مما يسمح لتبادل حل سريع.
- سجل النشاط أثناء تطبيق المخدرات على الأقل 20 دقيقة، بعد غسلها. يجب أن يكون النشاط مستقرًا لمدة 60-90 دقيقة على الأقل ، مما يسمح بتسجيلات أطول.
7- التحليل
- ويمكن إجراء تحليل التردد والسعة مع أي برنامج متاح. حتى الآن، لم نتمكن من إنشاء تحليل تلقائي موثوق به من SLEs أو نشاط الانفجار، وبدلا من ذلك استخدم تحليل شبه الآلي مع تأكيد بصري للنشاط المحدد.
- يتميز نشاط الاندفاع بانحراف ثنائي الطور، إيجابي، وسلبي، ومدة ≥100 مللي ثانية، وينبغي الإشارة يدويا إلى جميع الأحداث التي تم تحديدها بصريا على أنها نشاط انفجار (مثل، شبه تلقائيا بتحليل العتبة) لإجراء مزيد من التحليل لتواتر الحدث (الفاصل بين الأحداث، IEI)، السعة، والعدد الإجمالي للأحداث خلال الإطار الزمني الذي تم تحليله.
ملاحظة: نظراً لتردد عالية من نشاط انفجار، يتم تحليل آخر 5 دقيقة من كل مرحلة تطبيق عادة20. - يمكن تحليل SLEs كما هو موضح في Heuzeroth وآخرون. SLEs المحدد يمكن تحليلها كذلك لمدة، السعة، تردد الارتفاع، ومدة منشط (ارتفاع الترددات) مقابل كلوني (انخفاض التردد) مدة المرحلة. يجب استبعاد SLEs التي تكون <10 s في المدة من التحليل.
ملاحظة: بالنسبة للتقييم قبل الثانوي للمواد المضادة للصرع المحتملة، يجري التحقيق في الآثار على نشاط الانفجار (الناجم عن ارتفاعدرجة4AP) بسبب الحث على الأنسجة المُشطَرة في فرس النهر. وقد تم الإبلاغ عن النتائج الأولية على تحريض SLEs باستخدام lowMg2 ++ BIC(الشكل 2)، على الرغم من أن تحليل هذه البيانات لم تدرج هنا.
النتائج
وقد تم تسجيل نشاط الصرع بنجاح في أنسجة فرس النهر البشرية التي تم استئصالها والتي تنشأ من ما يصل إلى 15 مريضاً. إن وضع إجراءات نقل وإعداد مستقرة أمر بالغ الأهمية لنجاح الحث على نشاط الصرع في أنسجة الدماغ البشرية. وقد أظهرت النتائج التي نشرت مؤخرا 1) التعريفي مستقرة من النشاط الصرع في الأنسجة اصطياد من المرضى مختلفة وكذلك 2) استخدام أنسجة الدماغ البشري استئصال كأداة قبل اكلينيكي لتقييم آليات مكافحة رواية14,20.
تطبيق highK++4-AP النشاط الصرع المستحث في شكل نشاط انفجار في غضون بضع دقائق (الشكل 2A، B ، C ،D). بسبب انخفاض توزيع الخلايا العصبية في أنسجة فرس النهر البشرية أو فقدان الخلايا العصبية العالية بسبب صرع الفص الصدغي (TLE) ، يمكن تعديل موضع الأقطاب الكهربائية في بداية التسجيل. في الحالات التي يكون فيها نشاط الاندفاع من شرائح غير مرئية في منطقة CA1 بعد 10 دقيقة (مستقلة عن موضع القطب)، قد تكون عرضة للقابلية للقطعة، وسوف تحتاج إلى استبدال شريحة.
يمكن أن يسبب SLEs، مع مدة >10 ق، مع تطبيق lowMg2 ++ BIC(الشكل 2E،F). ويبين الشكل 2E التعريفي مستقرة من SLEs بعد بضع دقائق وتواتر مستقر في جميع أنحاء التسجيل. هنا ، تم إجراء نشاط SLE بنجاح في شريحتين من أربع شرائح من المريض الذي تم التحقيق فيه. وأظهرت شريحة واحدة نشاط انفجار فقط بعد 15 دقيقة من النشاط SLE، في حين أن شريحة أخرى لم تظهر SLEs حتى بعد 40 دقيقة.
وفيما يتعلق بالتقييم قبل التكيني لآثار المواد، تم التحقيق في تأثير محتمل مضاد للصرع على نشاط الانفجار الناجم عن ارتفاع درجة الانبعاثات++4-AP. تم اختبار المواد المضادة للصرع المعروفة والمحتملة (لاكوساميد ، DMEA ، dynorphine14) ، وتظهر أمثلة هنا لاكوساميد AED التقليدي (مانع قناة الصوديوم) وكذلك DMEA (مادة جديدة محتملة مانعة للصرع)20. انخفض عدد الأحداث والفاصل الزمني بين الأحداث (IEI) من أحداث الانفجار أثناء تطبيق اللاكوساميد و DMEA (الشكل 3C) ، على الرغم من أن السعات لم تتأثر في الغالب (الشكل 3D). في مجموعة فرعية من الشرائح، على الرغم من أن تم تحقيق تحريض أحداث الانفجار في الدقائق القليلة الأولى، لم يتعافى تواتر النشاط أثناء الغسل من AEDs التطبيقية (البيانات غير المبينة هنا، انظر Kraus et al.20). وهنا، اعتبرت العقاقير المطبقة من أجل إحداث آثار؛ ومع ذلك، قد تتأثر الانخفاضات في نشاط الاندفاع من قبل الاضمحلال التدريجي في النشاط أثناء التسجيلات الطويلة. وبالتالي، يجب تفسير النتائج بعناية.
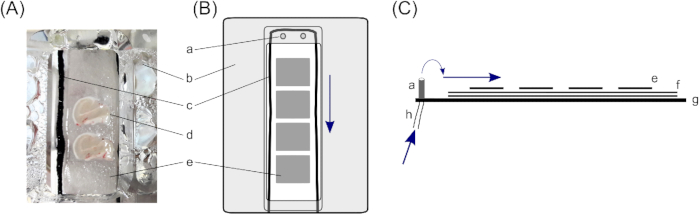
الشكل 1: غرفة الواجهة. لتخزين شرائح الدماغ قرن آمون الإنسان, يتم استخدام غرفة واجهة مع اثنين من أجزاء عقد شريحة الدماغ (A); على وجه التحديد، غرفة واجهة من نوع هاس23. هنا، شرائح الدماغ فرس النهر بقية على (d) ثلاث طبقات من ورقة التصفية، (ه) قطع أصغر لتمكين التعامل مع شرائح الدماغ الفردية، و (و) أكبر قطعة ورقة تصفية لضمان طبقة كافية من الحل تحت شريحة. (ج)سلسلة قطنية تحيط بشرائح الدماغ، أعلى أوراق التصفية، تضمن حتى تدفق الحل من المداخل فيالجزءالعلوي من المقصورة . (ب) غطاء الغلاف يوجه الأكسجين من أسفل المقصورة إلى شريحة. (ب) منظر علوي لحجرة واحدة ممسكة بالشرائح. (ج) عرض جانبي لتوضيح طبقات أوراق المرشح. (ز)أسفل الغرفة. (ح) أنبوب للتدفق الحل، الذي يرتبط مضخة ال peristaltic (الأسهم الزرقاء علامة اتجاه تدفق الحل). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
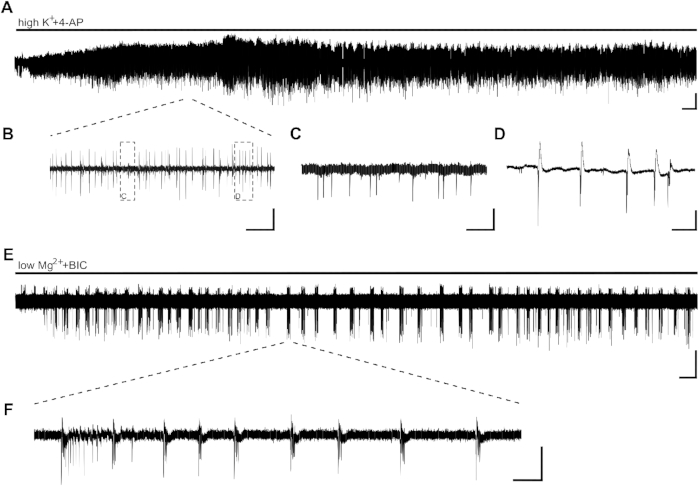
الشكل 2: نشاط الصرع في شرائح قرن آمون الإنسان الناجمة عن هايك++4-AP و lowMg2 ++BIC. CA1 أمثلة على تسجيلات ومقتطفات من تطبيق هايك+ (8 مل م) +4-ا ف ب (100 ميكرومتر) (A, B, C, D) و lowMg2 ++ BIC (10 μM) (E, F). (أ) تطبيق حمام من highK++4-AP يحفز نشاط الصرع في غضون بضع دقائق، والنشاط مستقر لمدة 60 دقيقة على الأقل. يتم حث نوعين مختلفين من النشاط في منطقة CA1 لشرائح قرن آمون الإنسان: المسامير الشبيهة بالتشابكات (C، تفاصيل [B]) ونشاط الانفجار (D، تفاصيل [B]) .) ) وقد تبين أن نشاط الانفجار حساس للأدوية المضادة للصرع وبالتالي تم تحليله لمعرفة تأثير المواد المضادة للصرع المحتملة(الشكل 3). (هاء، واو) تطبيق lowMg2 +BIC يحفز سليبس في مدة > 10 ق (F) في CA1 في غضون بضع دقائق. ومع ذلك، يمكن أن تصل إلى 30 دقيقة في شرائح أخرى تحريض من SLEs. أشرطة المقياس = 0.2 mV، 2 دقيقة (A، E)، 5 s (B)، 500 مللي ثانية (C، D)، 5 دقائق (E)، و 2 ثانية (F). وقد تم تكييف هذا الرقم من كراوس وآخرون20. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
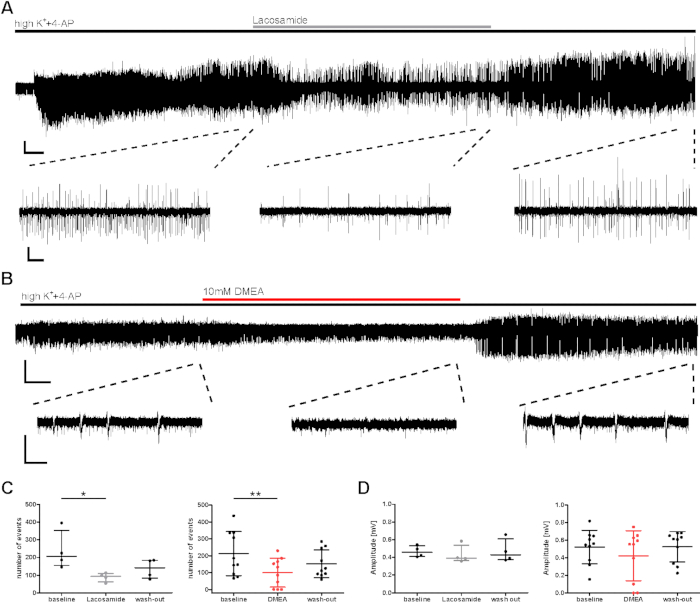
الشكل 3: انخفاض نشاط انفجار الصرع من شرائح الإنسان أثناء تطبيق اللاكوساميد أو DMEA. انخفض نشاط الاندفاع أثناء تطبيق (A) اللاكوساميد و (B) DMEA ، وهو جزيء جديد محتمل لمكافحة البيبيد. (أ) و (باء) تعرض تسجيلات نموذجية للمنطقة CA1 مع مقتطفات من المناطق المستخدمة للتحليل في (C) و (D). انخفض نشاط الاندفاع خلال لاكوساميد (100 ميكرومتر) وتطبيق DMEA (10 mM) ، كما يتضح من المقتطفات الوسطى ويزيد مرة أخرى أثناء الغسل. (جيم، دال) تم تحليل عدد و اتساع نشاط الانفجار لآخر 5 دقائق من كل مرحلة تطبيق (خط الأساس ، اللاكوساميد / DMEA ، قم بالاغتسال) ويظهران على النحو النتائج الموجزة لجميع المرضى (عدد الأحداث ، C ؛ السعة ، D) على أن متوسط ± SD. كل نقطة تشير إلى مريض واحد. علامة النجمة علامة اختلافات كبيرة كما تم تقييمها من قبل اختبار فريدمان و ما بعد مخصص مع مقارنة دونيت متعددة من المجموعات لتحليل تطبيق اللاكوساميد (* p < 0.05, n = 4) أو عن طريق القياس المتكرر ANOVA وما بعد hoc مع مقارنة توكي لتحليل تطبيق DMEA (**p20. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| الحل 1.1 الكولين ACSF | |||
| مضمون | تركيز 10x (mM) | 1x تركيز (mM) | ملاحظه |
| الكولين كل | 1100 | 110 | |
| (+)-نا L-أسكوربات | 116 | 11.6 | |
| MgCl2x6H2O | 70 | 7 | |
| نا بيروفات | 31 | 3.1 | |
| KCl | 25 | 2.5 | |
| NaH2PO4 | 12.5 | 1.25 | |
| NaHCO3 | 260 | 26 | |
| CaCl2 | - | 0.5 | إضافة إلى الحل النهائي |
| الجلوكوز | - | 10 | إضافة إلى الحل النهائي |
| الحل 1.2 aCSF | |||
| مضمون | تركيز 10x (mM) | 1x تركيز (mM) | ملاحظه |
| NaCl | 1290 | 129 | |
| NaH2PO4 | 12.5 | 1.25 | |
| CaCl2 | 16 | 1.6 | |
| KCl | 30 | 3 | |
| مغس 4 | 18 | 1.8 | |
| الجلوكوز | - | 10 | إضافة إلى الحل النهائي |
| الحل 1.3 هايك++4-AP aCSF | |||
| مضمون | تركيز 10x (mM) | 1x تركيز (mM) | ملاحظه |
| NaCl | 1240 | 124 | |
| NaH2PO4 | 12.5 | 1.25 | |
| CaCl2 | 16 | 1.6 | |
| KCl | 80 | 8 | |
| مغس 4 | 18 | 1.8 | |
| الجلوكوز | - | 10 | إضافة إلى الحل النهائي |
| 4-AP | - | 0.1 | إضافة إلى الحل النهائي |
| الحل 1.4 lowMg2++ BIC aCSF | |||
| مضمون | تركيز 10x (mM) | 1x تركيز (mM) | ملاحظه |
| NaCl | 1300 | 130 | |
| NaH2PO4 | 12.5 | 1.25 | |
| CaCl2 | 16 | 1.6 | |
| KCl | 30 | 3 | |
| الجلوكوز | - | 10 | إضافة إلى الحل النهائي |
| Bic | - | 0.01 | إضافة إلى الحل النهائي |
| الحل 2 | |||
| مضمون | تركيز 10x (mM) | 1x تركيز (mM) | ملاحظه |
| NaHCO3 | 210 | 21 | |
الجدول 1: إعداد حلول 10x و1x النهائية للنقل والإعداد والتسجيل.
Discussion
إن نسيج الدماغ البشري الذي يُعاد استئصاله هو أداة قيمة للغاية في التقييم قبل الكلينيكي لـ AEDs ، لأنه يمثل بشكل صحيح شبكة صغيرة للدماغ البشري سليمة. يصف البروتوكول المعروض طريقة لنقل الأنسجة وإعدادها، والتي تضمن شرائح فرس النهر عالية الجودة بالإضافة إلى طريقة تحريضية مستقرة لنشاط الصرع الحاسم لتقييم AED.
وقد سبق أن أظهرت التحقيق في نشاط الصرع وكذلك طرق الحث الكيميائية أو الكهربائية في شرائح الدماغ البشري من قبل مجموعات أخرى17,20,21,22. يصف هذا البروتوكول تحريض نشاط الاندفاع المستقر في شرائح من المرضى المختلفين عن طريق تطبيق K++4-AP العالي وكذلك تحريض SLEs في منطقة CA1 عن طريق تطبيق من انخفاض Mg2 +BIC. ووجد أن تحريض نشاط الاندفاع أكثر اتساقا (80٪ من شرائح اختبارها في 15 مريضا) من تحريض SLEs (50٪ من شرائح اختبارها في مريض واحد). ومع ذلك ، حتى الآن ، تم اختبار تحريض SLEs فقط في مريض واحد. ومع ذلك, ويوصى التعريفي من SLEs من قبل منخفضة Mg2 ++ BIC, كما SLEs لم تكن قادرة حتى الآن على أن تكون مستحثة باستخدام K عالية++4-AP.
وقد أدخلت العديد من الدراسات أساليب لنقل وإعداد أنسجة الدماغ البشري وغالبا ما تسلط الضوء على ثلاثة عوامل حاسمة لبقاء الخلايا العصبية: وقت النقل، وحلول النقل المستخدمة، وظروف التخزين.
للحصول على القدرة على البقاء على النحو الأمثل شريحة, بعض المجموعات تشير إلى أن نقل أنسجة الدماغ مُجَرَّح تكون قصيرة قدر الإمكان. ومع ذلك، نادراً ما تكون غرف العمليات والمختبرات على مقربة، مما يعني أن جودة الشريحة قد تتعرض للخطر بسبب وسائل النقل الطويلة. وقد تغلبت بعض المجموعات على هذه العقبة بتطبيق ثابت O2 على الحل أثناء النقل12. لقد نقلنا أنسجة المخ لفترة قصيرة (الحد الأقصى = 15 دقيقة) وطويلة (تصل إلى 1 ساعة) فترات من الزمن دون ثابت إضافية O2 العرض أثناء النقل، على غرار مجموعات أخرى18،,25. في هذه الحالات، لم تلاحظ الاختلافات في جودة الأنسجة أثناء التسجيلات الصرعية. في التواصل مع مجموعات أخرى في معهدنا ، لم تتغير جودة الشريحة للتجارب المشبك ، سواء. في المقابل، التباين في نوعية الأنسجة ينبع ربما من الضرر أثناء العمليات، والتشريح لفترات طويلة، و تشريح الإجراء.
فيما يتعلق النقل وقطع الحل، وجميع الأساليب المنشورة حذف NaCl من الحلول للحد من تورم الخلايا بسبب الضغط التناضحي، على غرار الإجراء القياسي لتجارب القوارض التصحيح المشبك. ومع ذلك، فقد تم إدخال العديد من البدائل حتى الآن (أي السكروز القائم على aCSF13،22، NMDG القائم على aCSF12،26، والكولين القائم على aCSF27). قدم تينغ وزملاؤه aCSF القائم على NMDG لإعداد شريحة في 201426 وأضاف في وقت لاحق بروتوكول الانتعاش، الذي يعيد ببطء NaCl إلى شرائح28. ومع ذلك، كما وصفها Ting وآخرون، الخلايا العصبية من أنسجة الدماغ أعدت في ACSF المستندة إلى NMDG إظهار مقاومة الغشاء أعلى، مما يؤثر على ختم الخلية الكاملة خلال التجارب التصحيح المشبك26. ولذلك, لقد انتقلنا من NMDG القائم على aCSF إلى استخدام aCSF20القائم على الكولين , الذي ينتج شرائح عالية الجودة لكل من إمكانات الحقل والتسجيلات المشبك التصحيح.
فيما يتعلق بتخزين شرائح، فمن المسلم به عموما أن ظروف واجهة توفير الأوكسجين الأمثل حاسمة لشريحة طويلة البقاء على قيد الحياة18. ومع ذلك، تظهر مجموعات أخرى شريحة البقاء على قيد الحياة لمدة تصل إلى 72 ساعة تحت ظروف مغمورة12. على عكس الفرضية السابقة ، يبدو أن شرائح الدماغ البشرية أكثر مقاومة لانخفاض الأكسجين أو الإجهاد التأكسي مقارنة بشرائح القوارض. في المقام الأول، تم استخدام غرف الواجهة سابقًا لتخزين شرائح فرس النهر البشرية، على الرغم من أنه يوصى بالظروف المغمورة للحفاظ على شرائح الدماغ البشرية في تجارب المشبك.
كما ناقشته مجموعات أخرى، خطوة إضافية حاسمة للبقاء على قيد الحياة شريحة طويلة (واجهة ل<48 ح18،المغمورة ل< 72 ح12) هو منع التلوث البكتيري. وعادة ما تستخدم شرائح الدماغ القوارض في التسجيلات الكهربائية الفيزيولوجية لمدة تصل إلى 8 ساعات، والتلوث البكتيري لا يعتبر يؤثر على صلاحية شريحة خلال هذه الفترة. ويبرز العدد الكبير من الشرائح المعدة من استئصال واحد والتوافر غير المألوف لأنسجة الدماغ البشري الحاجة إلى إطالة أمد صلاحية شرائح الدماغ البشري. هذه الطريقة تصف بنجاح إعداد الحية الإنسان شرائح الدماغ قرن آمون، والتي يمكن بسهولة تكييفها لظروف معقمة. ومع ذلك ، للتسجيلات التي أجريت هنا ، فإن بقاء الشريحة الممتد 20 ساعة لم يكن أولوية.
كما تبين أن التسجيل في غرف الواجهة ضروري لاستقراء نشاط الصرع مثل SLEs22. نادرا ما تستخدم الظروف المغمورة، بسبب انخفاض الأوكسجين، لتسجيل SLEs. على الرغم من ذلك، فهي ضرورية للدقة الضوئية عالية اللازمة للتجارب التصحيح المشبك. استخدام غرفة تسجيل نوع مغمورة الأمثل تمكن من تسجيل نشاط الصرع (خارج الخلية مجال أو خلية عصبية واحدة) في شرائح الدماغ البشري، وذلك بسبب ارتفاع الأوكسجين وتطبيق المخدراتالسريعة 29. هنا، يتم وصف أساليب ونتائج التسجيلات المحتملة الميدانية، ولكن ينبغي التأكيد على أن تسجيلات اللصقات تم تنفيذها بنجاح في شرائح الماوس والدماغ البشري باستخدام هذه الغرفة التسجيل المعدلة (البيانات غير مبينة).
أنسجة الدماغ البشرية المُجَرَّح لها قيمة تحويلية أعلى مقارنةً بنماذج القوارض. وهو يمثل الكبار, شبكة الخلايا العصبية المريضة التي لا يمكن استنساخها من قبل iPSCs. ومع ذلك ، كما هو الحال في أي نظام في المختبر ، شرائح الدماغ البشري لا تمثل الدماغ البشري سليمة. بالإضافة إلى ذلك، يمكن أن تخضع الشبكات العصبية المسجلة من أنسجة الدماغ المُجَرَّحَة لتغييرات جزيئية ووظيفية كبيرة بسبب التلف أثناء التشغيل أو الإعداد. وقد تبين أن إجراءات تشريح تؤثر على وظيفة GABAergic وقد تؤثر على تحريض النشاط الصرع30. وينبغي النظر في هذه القيود عند صياغة فرضية. عند اختبار الأدوية المضادة للصرع المحتملة ، ينبغي النظر في استخدام مناطق مختلفة من الدماغ ، حيث قد لا يتم التعبير عن أهداف المخدرات في جميع مناطق الدماغ البشري أو جميع المرضى. على وجه الخصوص، وفرس النهر من المرضى TLE غالبا ما تظهر علامات التصلب قرن آمون يرافقه فقدان الخلايا العصبية الشديدة. من المستحسن الحصول على معلومات المريض عن التغيرات المرضية وتاريخ المرض ، مثل الانكسار المحتمل تجاه الأدوية ، والنظر في ذلك أثناء تفسير البيانات.
في الختام، هذه الطريقة تصف بنجاح إعداد الحية الإنسان شرائح الدماغ قرن آمون وتقنيات الحث لتسجيل نوعين مختلفين من نشاط الصرع. وبما أن توافر أنسجة الدماغ البشرية الحية أمر نادر الحدوث، ينبغي استخدام ظروف النقل والتسجيل المثلى لضمان أقصى قدر من الناتج من التجارب باستخدام شرائح الدماغ البشري. ويقترح أن أنسجة الدماغ البشرية التي تم استئصالها يمكن استخدامها كأداة للتحقق قبل التثبت من صحة القوارض وتجارب زراعة الخلايا.
Disclosures
ويعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
نشكر ماندي ماربلر-بوتر (Charite-Unversitätsmedizin، برلين) على المساعدة التقنية الممتازة. تم تمويل P.F. من قبل مؤسسة الأبحاث الألمانية (DFG، دويتشه Forschungsgemeinschaft) في إطار استراتيجية التميز في ألمانيا-EXC-2049-390688087. وقد تم دعم هذا العمل من قبل مركز كويست لتحويل البحوث الطبية الحيوية في معهد برلين للصحة.
Materials
| Name | Company | Catalog Number | Comments |
| (+)-Na L-ascorbate | Sigma Aldrich | A4034 | |
| 4-AP | Sigma Aldrich | 275875-5G | |
| Blades | eliteSERVE GmbH | HW3 | used for the vibratome |
| CaCl2 | Merck | 102382 | |
| Choline Cl | Sigma Aldrich | C1879 | |
| Filter paper | Tiffen | EK1546027T | |
| Gas-tight bottle caps | Carl Roth GmbH+Co.KG | E694.1 | |
| Glass filaments | Science Products | GB150F-8P | for recording electrodes |
| Glass gas disperser | DWK Life Sciences GmbH | 258573309 | |
| Glucose | Sigma Aldrich | G7528 | |
| Interface Chamber | inhouse made | - | see Haas et al., 1979 |
| KCl | AppliChem | 131494.1210 | |
| Membrane (Cell culture inserts) | Merck | PICM030050 | |
| Membrane chamber | inhouse made | - | see Hill and Greenfield, 2011 |
| MgCl2?6H2O | Carl Roth | HNO3.2 | |
| MgSO4 | Sigma Aldrich | M7506 | |
| Na pyruvate | Sigma Aldrich | P8574 | |
| NaCl | Carl Roth | 3957.1 | |
| NaH2PO4 | Merck | 106346 | |
| NaHCO3 | Carl Roth | HNO1.2 | |
| Peristaltic pump | Gilson | Minipuls 3 | |
| Slice holder | Warner instruments | SHD-41/15 | |
| Vertical puller | Narishige | PC-10 | |
| Vibratome | Leica | VT1200S |
References
- Hirtz, D., et al. How common are the "common" neurologic disorders. Neurology. 68 (5), 326-337 (2007).
- Ngugi, A. K., Bottomley, C., Kleinschmidt, I., Sander, J. W., Newton, C. R. Estimation of the burden of active and life-time epilepsy: a meta-analytic approach. Epilepsia. 51 (5), 883-890 (2010).
- Kwan, P., Brodie, M. J. Early Identification of Refractory Epilepsy. New England Journal of Medicine. 342 (5), 314-319 (2000).
- Löscher, W. Critical review of current animal models of seizures and epilepsy used in the discovery and development of new antiepileptic drugs. Seizure. 20 (5), 359-368 (2011).
- Ledri, M., et al. Differential Effect of Neuropeptides on Excitatory Synaptic Transmission in Human Epileptic Hippocampus. The Journal of Neuroscience: the official journal of the Society for Neuroscience. 35 (26), 9622-9631 (2015).
- Qi, X. R., et al. Alterations in the steroid biosynthetic pathways in the human prefrontal cortex in mood disorders: A post-mortem study. Brain Pathology. 28 (4), 536-547 (2018).
- Verwer, R. W. H., et al. Post-mortem brain tissue cultures from elderly control subjects and patients with a neurodegenerative disease. Experimental Gerontology. 38 (1-2), 167-172 (2003).
- Verwer, R. W. H., et al. Cells in human postmortem brain tissue slices remain alive for several weeks in culture. FASEB journal official publication of the Federation of American Societies for Experimental Biology. 16 (1), 54-60 (2002).
- Le Maître, T. W., Dhanabalan, G., Bogdanovic, N., Alkass, K., Druid, H. Effects of Alcohol Abuse on Proliferating Cells, Stem/Progenitor Cells, and Immature Neurons in the Adult Human Hippocampus. Neuropsychopharmacology. 43 (4), 690-699 (2018).
- Dennis, C. V., Suh, L. S., Rodriguez, M. L., Kril, J. J., Sutherland, G. T. Human adult neurogenesis across the ages: An immunohistochemical study. Neuropathology and Applied Neurobiology. 42 (7), 621-638 (2016).
- Verwer, R. W. H., et al. Mature astrocytes in the adult human neocortex express the early neuronal marker doublecortin. Brain. 130 (12), 3321-3335 (2007).
- Ting, J. T., et al. A robust ex vivo experimental platform for molecular-genetic dissection of adult human neocortical cell types and circuits. Scientific Reports. 8 (1), 8407 (2018).
- Le Duigou, C., et al. Imaging pathological activities of human brain tissue in organotypic culture. Journal of Neuroscience Methods. 298, 33-44 (2018).
- Agostinho, A. S., et al. Dynorphin-based "release on demand" gene therapy for drug-resistant temporal lobe epilepsy. EMBO molecular medicine. 11 (10), 9963 (2019).
- Hodge, R. D., et al. Conserved cell types with divergent features in human versus mouse cortex. Nature. 573 (7772), 61-68 (2019).
- Beaulieu-Laroche, L., et al. Enhanced Dendritic Compartmentalization in Human Cortical Neurons. Cell. 175 (3), 643-651 (2018).
- Sandow, N., et al. Drug resistance in cortical and hippocampal slices from resected tissue of epilepsy patients: no significant impact of p-glycoprotein and multidrug resistance-associated proteins. Frontiers in Neurology. 6, 30 (2015).
- Wickham, J., et al. Prolonged life of human acute hippocampal slices from temporal lobe epilepsy surgery. Scientific Reports. 8 (1), (2018).
- Avoli, M., Jefferys, J. G. R. Models of drug-induced epileptiform synchronization in vitro. Journal of Neuroscience Methods. , (2015).
- Kraus, L., et al. Dimethylethanolamine Decreases Epileptiform Activity in Acute Human Hippocampal Slices in vitro. Frontiers in Molecular Neuroscience. 12, 209 (2019).
- Antonio, L. L., et al. In vitro seizure like events and changes in ionic concentration. Journal of Neuroscience Methods. , (2016).
- Gabriel, S., et al. Stimulus and Potassium-Induced Epileptiform Activity in the Human Dentate Gyrus from Patients with and without Hippocampal Sclerosis. Journal of Neuroscience. 24 (46), 10416-10430 (2004).
- Haas, H. L., Schaerer, B., Vosmansky, M. A simple perfusion chamber for the study of nervous tissue slices in vitro. Journal of Neuroscience Methods. 1 (4), 323-325 (1979).
- Hill, M. R. H., Greenfield, S. A. The membrane chamber: a new type of in vitro recording chamber. Journal of neuroscience methods. 195 (1), 15-23 (2011).
- Andersson, M., et al. Optogenetic control of human neurons in organotypic brain cultures. Scientific Reports. 6, 24818 (2016).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. Acute brain slice methods for adult and aging animals: application of targeted patch clamp analysis and optogenetics. Methods in molecular biology. 1183, 221-242 (2014).
- Testa-Silva, G., et al. Human synapses show a wide temporal window for spike-timing-dependent plasticity. Frontiers in Synaptic Neuroscience. 2, 12 (2010).
- Ting, J. T., et al. Preparation of Acute Brain Slices Using an Optimized N-Methyl-D-glucamine Protective Recovery Method. Journal of Visualized Experiments. (132), (2018).
- Morris, G., Jiruska, P., Jefferys, J. G. R., Powell, A. D. A New Approach of Modified Submerged Patch Clamp Recording Reveals Interneuronal Dynamics during Epileptiform Oscillations. Frontiers in Neuroscience. 10, 519 (2016).
- Valeeva, G., Valiullina, F., Khazipov, R. Excitatory actions of GABA in the intact neonatal rodent hippocampus in vitro. Frontiers in Cellular Neuroscience. , (2013).
Erratum
Formal Correction: Erratum: Preparation of Acute Human Hippocampal Slices for Electrophysiological Recordings
Posted by JoVE Editors on 7/13/2020. Citeable Link.
An erratum was issued for: Preparation of Acute Human Hippocampal Slices for Electrophysiological Recordings. Step 2.1.3 in the Protocol was corrected.
Step 2.1.3 in the Protocol was updated from:
Add final concentrations of glucose and MgCl, then stir until dissolved (Table 1, solution 1.1).
to:
Add final concentrations of glucose and CaCl2, then stir until dissolved (Table 1, solution 1.1).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved