Method Article
Vorbereitung von akuten menschlichen Hippocampusscheiben für elektrophysiologische Aufnahmen
In diesem Artikel
Erratum Notice
Zusammenfassung
Das vorgestellte Protokoll beschreibt den Transport und die Vorbereitung von resektiertem menschlichen Hippocampusgewebe mit dem ultimativen Ziel, lebenswichtige Hirnscheiben als präklinisches Bewertungsinstrument für potenzielle antiepileptikatische Substanzen zu verwenden.
Zusammenfassung
Epilepsie betrifft etwa 1% der Weltbevölkerung und führt zu einem starken Rückgang der Lebensqualität aufgrund anhaltender Anfälle sowie eines hohen Risikos für einen plötzlichen Tod. Trotz einer Fülle von verfügbaren Behandlungsmöglichkeiten sind etwa 30% der Patienten medikamentenresistent. Mehrere neuartige Therapeutika wurden mit Tiermodellen entwickelt, obwohl die Rate der medikamentenresistenten Patienten unverändert bleibt. Einer der wahrscheinlichen Gründe ist die fehlende Übersetzung zwischen Nagetiermodellen und Menschen, wie z. B. eine schwache Darstellung der menschlichen Pharmakoresistenz in Tiermodellen. Resected human brain tissue as a preclinical evaluation tool has the advantage to bridge this translational gap. Beschrieben hier ist eine Methode zur qualitativ hochwertigen Vorbereitung von menschlichen Hippocampus-Gehirnscheiben und anschließende stabile Induktion von epiptiformen Aktivität. Das Protokoll beschreibt die Induktion der Burstaktivität während der Anwendung von 8 mM KCl und 4-Aminopyridin. Diese Aktivität ist empfindlich gegenüber etablierten AED-Lacosamid oder neuartigen Antiepileptika-Kandidaten wie Dimethylethanolamin (DMEA). Darüber hinaus beschreibt die Methode die Induktion von anfallartigen Ereignissen in CA1 von menschlichen Hippocampus-Gehirnscheiben durch Reduktion von extrazellulären Mg2+ und Anwendung von Bicuculline, ein GABA-A-Rezeptor-Blocker.A Der Versuchsaufbau kann verwendet werden, um potenzielle antiepileptische Substanzen auf ihre Auswirkungen auf die epileptische Aktivität zu überprüfen. Darüber hinaus können wir, die für bestimmte Verbindungen postuliert sind, mit diesem Ansatz im menschlichen Gewebe (z. B. durch Patch-Clamp-Aufnahmen) postuliert werden. Abschließend möchte ich sagen, dass die Untersuchung des lebenswichtigen menschlichen Hirngewebes ex vivo (hier resezierte Hippocampus von Patienten mit zeitlicher Lappenepilepsie) das aktuelle Wissen über physiologische und pathologische Mechanismen im menschlichen Gehirn verbessern wird.
Einleitung
Epilepsie ist eine der häufigsten neurologischen Erkrankungen, von denen 1% der Weltbevölkerung betroffen sind, und ist mit erhöhter Morbidität und Mortalität1,2verbunden. Leider ist ein Drittel der Patienten, die an Epilepsie leiden, medikamentenresistent, trotz einer Fülle von verfügbaren Behandlungsmöglichkeiten, darunter mehr als 20 zugelassene Antiepileptika (AEDs)3. Die Nichtübersetzung von Ergebnissen aus der präklinischen Tierforschung in klinische Studien ist ein Grund, warum vielversprechende Behandlungsstrategien bei vielen Patienten nicht wirksam sind4. In jüngster Zeit haben Neuropeptid Y (NPY) und Galanin gezeigt, dass sie antiepileptikatische Wirkungen in Tiermodellen haben; jedoch, wenn in reseziertem menschlichen Gehirngewebe getestet, nur NPY war wirksam5.
Die meisten vorhandenen Kenntnisse über grundlegende neurologische Mechanismen und Krankheitstherapieansätze stammen aus Tiermodellen und Zellkulturexperimenten. Obwohl diese Modelle informativ sind, stellen sie nur einzelne Aspekte komplexer menschlicher Krankheiten und des Erwachsenennetzwerks des menschlichen Gehirns dar. Alternativ hat menschliches Hirngewebe das Potenzial, die Translationslücke zu überbrücken, steht aber nur selten für funktionelle Studien zur Verfügung. Zum Beispiel, post mortem Gehirngewebe war ein wertvolles Werkzeug bei der Untersuchung von Protein-Expression, Gehirnmorphologie, oder anatomische Verbindungen, obwohl neuronale Aktivität ist oft kompromittiert ist dieses Gewebe6,7,8,9,10,11.
Im Gegensatz dazu wurde das lebende resezierte menschliche Hirngewebe hinsichtlich der präklinischen Arzneimittelbewertung, der grundlegenden neuronalen Funktionen und der Genexpressionsmuster12,13,14,15,16,17untersucht. Ein großer Vorteil der menschlichen Gehirnscheiben im Vergleich zu Nagetierscheiben ist die lange Lebensfähigkeit des neuronalen Gewebes nach Resektion und Vorbereitung. Im Vergleich zu Nagetier-Gehirnscheiben, die in der Regel für bis zu 8 h nach der Vorbereitung aufgezeichnet werden können, zeigen menschliche Gehirnscheiben stabile neuronale Aktivität für bis zu 72 h, was eine gründliche Untersuchung dieser seltenen und wertvollen Proben12,18ermöglicht.
Mehrere Studien haben die Eigenschaften der epileppmischen Aktivität in verschiedenen Bereichen des resezierten kortikalen und hippocampalen menschlichen Gewebes untersucht und verschiedene Methoden zur Induktion der epileppmischen Aktivität verwendet. In Nagetierscheiben kann die epileptime Aktivität durch verschiedene Methoden induziert werden: elektrische Stimulation von DG-Hilarzellen, Erhöhung der extrazellulären K+ (8–12 mM KCl), Blockierung von GABA-A-Rezeptoren durch Bicukulin (BIC), Blockierung von Kaliumkanälen durch 4-Aminopyridin (4-AP) und Entfernung oder Reduzierung von Mg2+ in extrazellulärer LösungA 19. Die Induktion der epileppiformen Aktivität im menschlichen Gewebe erfordert jedoch die Kombination von mindestens zwei der oben genannten Methoden20,21,22.
Präsentiert wird hier eine Methode zur Herstellung von menschlichen Hippocampus-Gehirnscheiben, die für bis zu 20 h lebensfähig sind und die Induktion von epilepptiformen Aktivität bei Anwendung von hohen K+ (8 mM) und 4-AP oder low Mg2+ und BIC zeigen.
Protokoll
Die Patienten müssen vor der Operation eine schriftliche Einwilligung in Kenntnis der Sachlage erteilen, und die erforderlichen ethischen Vereinbarungen müssen vor dem Experiment getroffen werden. Hinsichtlich der repräsentativen Ergebnisse wurden alle Studien mit menschlichen Teilnehmern von der Charité-Universitätsmedizin Berlin überprüft und genehmigt (EA2/111/14).
1. Vorbereitung von 10x Lösungen
HINWEIS: Aufgrund von Schwierigkeiten bei der Planung des Zugangs zu menschlichem Hirngewebe wird empfohlen, 10x Lösungen vorzubereiten, wie hier beschrieben. Alternativ können endgültige 1x-Lösungen frisch zubereitet werden, indem einzelne Substanzen in Endkonzentration zu doppeldestilliertem Wasser (ddH2O) hinzugefügt werden.
- Bei einzelnen 10x Lösungen Stoffe zu ddH2O nach Tabelle 1 hinzufügen und rühren, bis sie gelöst sind.
- Verwenden Sie 10x Lösungen bis zu 1 Monat nach der Vorbereitung (bis zu 1 Jahr für gefrorenes 10x Cholin aCSF).
- Für 10x Cholin aCSF 50 ml Aliquots von 10x 1.1 Cholin aCSF (Tabelle 1) vorbereiten und bei -20 °C oder -80 °C bis zur weiteren Verwendung einfrieren.
HINWEIS: Fügen Sie Glukose und CaCl2 bis 10x 1.1 Cholin aCSF nicht hinzu, um eine Kontamination mit Bakterien und die Ausfällung von Calciumcarbonat zu verhindern. - 10x Lösung 2 kann für alle 1x verwendet werden, während 10x Lösungen 1.1–1.4 angepasst und entsprechend benannt werden (Tabelle 1).
2. Vorbereitung von 1x
HINWEIS: Die endgültigen 1x-Lösungen sollten am Tag vor der Anwendung frisch oder so früh wie möglich vorbereitet werden. Alle sollten mit 5%CO2 und 95%O2 mit einem Glasgasdispergierer verkargiert werden, um Lösungen mit Sauerstoff anzureichern, und den pH-Wert auf 7,4 einstellen (max = 7,4 x 0,2).
- Cholin aCSF für Transport und Zubereitung
- Für die endgültige 500 ml Lösung ein 50 ml Aliquot der 10x Lösung 1.1 aliquot für Cholin aCSF im 37 °C Wasserbad auftauen.
- Fügen Sie die aufgetauten 50 ml aliquot der 10x Lösung 1.1 und 50 ml von 10x Lösung 2 bis ca. 300 ml ddH2O hinzu.
- Die Endkonzentrationen von Glukose und CaCl2 hinzufügen, dann rühren, bis sie gelöst sind(Tabelle 1, Lösung 1.1).
- Fügen Sie ddH2O zu einem Endvolumen von 500 ml hinzu und messen Sie die Osmolarität (300 mOsm bei 10 mOsm).
- Optional verwenden Sie einen Filter, um die Lösung zu sterilisieren (siehe Diskussion über längere Scheibenlebensfähigkeit unter sterilen Bedingungen).
- Füllen Sie eine separate Flasche mit ca. 100 ml 1x Cholin aCSF für den Transport vom Operationssaal ins Labor.
- Optional: Je nach Transportzeit vom Operationssaal zum Labor sollten Sie gasdichte Flaschenverschlüsse verwenden, um einen stabilen pH-Wert von aCSF während längerer Transportzeiten zu gewährleisten.
- Bewahren Sie die bei 4–8°C bis zur weiteren Verwendung auf.
- Am Betriebstag 1x Cholin aCSF auf Eis und Carbogenat für mindestens 10-15 min mit einem Glasgasdispergierer, der mit Carbogen-Gas verbunden ist (5%CO2, 95% O2).
HINWEIS: Erwägen Sie, bei längeren Wartezeiten, die eine Umfahrung der Transportlösung erfordern, eine Gasflasche zum Operationssaal zugänglich zu halten. Wir haben jedoch Hippocampusgewebe ohne Rekarbogenation vor langen und kurzen Transportzeiten (15 min vs. 60 min) transportiert und keine Unterschiede in der Induktion der epilepptiformen Aktivität beobachtet.
- aCSF zur Speicherung und Aufzeichnung
- Für eine endgültige 2 L-Lösung 200 ml 10x Lösung 1.2 (aCSF) und 200 ml 10x Lösung 2 und Glukose (Tabelle 1) bis 1500 ml ddH2O hinzufügen.
HINWEIS: Die Volumen der endgültigen Lösungen hängen von angewandten Experimenten und der Art der Kammer ab, die für die Speicherung und Aufzeichnung verwendet wird. - Fügen Sie ddH2O zu einem Endvolumen von 2 L hinzu und messen Sie die Osmolarität (300 mOsm bei 10 mOsm).
- Die Lösung vor Gebrauch auf 35 °C vorwärmen und mindestens 10–15 min carbogenat.
- Für eine endgültige 2 L-Lösung 200 ml 10x Lösung 1.2 (aCSF) und 200 ml 10x Lösung 2 und Glukose (Tabelle 1) bis 1500 ml ddH2O hinzufügen.
- HighK++4-AP aCSF zur Induktion von Burst-Aktivität
- Für eine endgültige 1 L-Lösung 100 ml 10x Lösung 1.3 (highK++4-AP aCSF) und 100 ml 10x Lösung 2 bis 700 ml ddH2O hinzufügen.
- Glucose und 4-AP (Endkonzentration = 100 m) gemäß Tabelle 1hinzufügen.
- Fügen Sie ddH2O zum Endvolumen von 1 L hinzu und messen Sie die Osmolarität (300 mOsm bei 10 mOsm).
- Die Lösung vor Gebrauch auf 35 °C vorwärmen und mindestens 10–15 min carbogenat.
- LowMg2++BIC aCSF zur Induktion von anfallähnlichen Ereignissen (SLEs)
- Für eine endgültige 1 L-Lösung 100 ml 10x Lösung 1.4 (lowMg2++BIC aCSF) und 100 ml 10x Lösung 2 bis 700 ml ddH2O hinzufügen.
- Glucose und BIC (Endkonzentration = 10 m) gemäß Tabelle 1hinzufügen.
- Fügen Sie ddH2O zum Endvolumen von 1 L hinzu und messen Sie die Osmolarität (300 mOsm bei 10 mOsm).
- Die Lösung vor Gebrauch auf 35 °C vorwärmen und mindestens 10–15 min carbogenat.
3. Vorbereitung der Schnittstellenkammer
- In einer Schnittstellenkammer ruhen Die Scheiben auf drei Schichten Filterpapier, um eine ausreichende Lösungsmenge unter der Scheibe zu gewährleisten. Schneiden Sie dazu für jedes Scheibenhaltefach (die beschriebene Grenzflächenkammer besteht aus zwei Fächern) zwei x 4 cm x 2 cm Filterpapier und legen Sie sie übereinander.
- Legen Sie dünne Baumwollsaiten um die 4 cm x 2 cm Filterpapiere in die Fächer, um die Spannung der Lösung zu brechen. Sorgen Sie für einen gleichmäßigen Durchfluss (hier werden schwarze Nylonstrumpfhosen verwendet, die auf dünn geschnittene Saiten mit einer Länge von 10 cm geschnitten sind; zur Platzierung siehe Abbildung 1).
- Legen Sie kleine Teile Filterpapier auf die größeren Filterpapiere in die Scheibenhaltefächer. Kleine Filtergewebestücke sollten ungefähr die Größe einer Gehirnscheibe haben (ca. 1,5 cm x 1,0 cm) und ermöglichen eine weitere Handhabung einzelner Scheiben. Legen Sie drei bis vier kleine Filterpapierstücke in jedes Fach.
- Stellen Sie mit einer Peristaltikpumpe einen aCSF-Durchfluss von 1,8 ml/min sicher.
- Carbogenat und Vorwärmen der Grenzflächenkammer auf 35 °C (Endtemperatur der Scheibe sollte 32 °C betragen).
4. Aufbau des Vorbereitungsbereichs
HINWEIS: Die Zubereitung kann unter sterilen Bedingungen durchgeführt werden, um eine Kontamination zu vermeiden und das Überleben der Scheiben zu längen. Allerdings passen nicht alle Vibratome unter eine sterile Haube, und andere Maßnahmen sind erforderlich, um die Kontamination während der Vorbereitung zu reduzieren. In diesem Abschnitt werden einige dieser Maßnahmen beschrieben.
- Wischen Sie den Vorbereitungsbereich mit 70% EtOH ab und legen Sie entweder Aluminiumfolie oder sterile Abdeckungen auf die Fläche.
- Bereiten Sie Superkleber, zwei scharfe Pinzette, einen Spachtel, ein Skalpell mit Klingen und eine Klinge für grobes Schneiden des Gehirngewebes vor. Werkzeuge können vor dem Verfahren sterilisiert werden, um die Kontamination zu reduzieren.
- Wischen Sie die Pufferschale und die Probenplatte des Vibratom mit 70% EtOH ab. Sobald die Pufferschale vollständig trocken ist, bedecken Sie sie mit Aluminiumfolie und legen Sie das Tablett in das Eisbad. Das Eisbad mit zerkleinertem Eis füllen und bis zur Zubereitung bei -20 °C halten.
- Wischen Sie das Vibratom und die Rasierklinge mit 70% EtOH ab und kalibrieren Sie das Vibratom, um vertikale Vibrationen und Gewebeschäden während des Schneidvorgangs zu minimieren.
5. Gewebeschneiden und Lagern
- Direkt nach der Resektion das Gewebe sofort in kalte, kariertecholina aCSF und schnell ins Labor transportieren.
VORSICHT: Tragen Sie während der Vorbereitung jederzeit Handschuhe und eine Gesichtsmaske, da menschliches Hirngewebe potenzielle Krankheitserreger enthalten kann. Darüber hinaus wird das Tragen einer Gesichtsmaske, wenn es nicht unter einer sterilen Kapuze arbeitet, die Kontamination von Lösungen und Hirngewebe erheblich reduzieren. - Entfernen Sie Gewebe von Cholin aCSF und schneiden Sie alle verbrannten Teile des Gewebes.
- Schneiden Sie eine gleichmäßige Oberfläche, um Gewebestück auf die Probenplatte zu kleben, unter Berücksichtigung der Schnittwinkel und Gewebeschichten. Idealerweise enthält ein Hippocampus-Slice DG, CA1-4 und (wenn möglich) Subiculum.
- Schneiden Sie das Hirngewebe in 400 m dicke Scheiben und passen Sie die Amplitude und Geschwindigkeit beim Schneiden an. Aufgrund möglicher verbleibender Pia mater zeigt menschliches Hirngewebe mehr Resistenz und kann langsamer geschnitten werden müssen.
HINWEIS: Die Schnittdicke wirkt sich stark entweder auf das verfügbare Netzwerk (mehr Neuronen in dickeren Scheiben) oder die Lebensfähigkeit der Scheibe (Eindringen der Lösung in die Scheibe) aus. Wir haben 500-m-Slices verwendet, um das potenziell verfügbare Mikronetz zu erhöhen, und konnten keine Unterschiede in der Induktion der epilepptiformen Aktivität beobachten. 300 m Scheiben werden häufig für Patch-Clamp-Experimente verwendet, obwohl die Induktion der epilepptiformen Aktivität in diesen Scheiben hier noch nicht getestet wurde. Wir verwenden 400 m als Standard-Scheibendicke, obwohl 300–500 m Scheiben ausreichen können. - Verwenden Sie vor dem Sammeln ein Skalpell, um die Größe von Gehirnscheiben zu reduzieren, um in die Aufnahmekammer zu passen. Für die Verwendung der Membrankammer (siehe Abschnitt 6) sollten die Scheiben maximal 1,5 cm x 1 cm betragen. Berücksichtigen Sie bei der Reduzierung die spezifischen Schichten und Verbindungen, die für die Aufnahme intakt sein müssen (z. B. für die Aufnahme in CA1 und DG, schneiden Sie das Subikulum und das umgebende weiße Gewebe ab).
- Mit einem Spachtel und kleinen Zangen, legen Sie vorsichtig Scheiben in der Schnittstellenkammer auf kleine Filterpapiere und lassen Sie sie für 1 h in einemCSF bis zur Aufnahme ruhen.
- Scheiben können bis zu 20 h (auch länger unter sterilen Bedingungen) aufgezeichnet werden.
6. Aufzeichnung der epilepiformen Aktivität
- In der Membrankammer (untergetauchte Aufnahmekammer) legen Sie die Hirnscheibe auf eine transparente halbdurchlässige Membran, die auf einen Kunststoffring geklebt ist24. Verwenden Sie dazu Superkleber, um den Kunststoffring an der Membran eines Zellkultureinsatzes zu befestigen.
- Verwenden Sie ein Skalpell, um jede Membran an der Außenseite des Kunststoffrings zu entfernen. Stellen Sie sicher, dass die Membran gleichmäßig und vollständig am Ring befestigt ist, bevor Sie die Membran in die Kammer legen.
HINWEIS: Die Membran kann in ddH2O bei 4–8 °C gelagert und bis zu 1 Monat wiederverwendet werden. Halten Sie die Membran jederzeit nass. - Sowohl der Zu- als auch der Abfluss der Membrankammer sind mit Rohren zur Lösungsversorgung verbunden. Legen Sie die Rohre in eine peristaltische Pumpe, so dass sich Zu- und Abfluss in entgegengesetzte Richtungen bewegen.
- Das Zu- und Abflussrohr in karbogenierte, vorgewärmte aCSF legen, bis alle Rohre und die Kammer mit Lösung gefüllt sind. Passen Sie die Geschwindigkeit der peristaltischen Pumpe an, um eine gleichmäßige Durchflussmenge von 10–13 ml/min zu erreichen.
HINWEIS: Die hier verwendete Membrankammer ist eine hohe Durchflussrate, eingetauchter Aufnahmekammer, die einen Lösungsfluss von bis zu 14 ml/min24ermöglicht. Bei Verwendung einer anderen Aufnahmekammer vom Typ Untergetaucht müssen die Durchflussraten angepasst werden. Für die Induktion der epilepptiformen Aktivität wird jedoch dringend empfohlen, die Membrankammer zu verwenden. - Verwenden Sie ein Heizelement, das in unmittelbarer Nähe zur Membrankammer mit dem Zufluss verbunden ist, um eine stabile Temperatur von 32 °C zu gewährleisten.
- Bereiten Sie 1–2 M-Glaspipetten mit einem vertikalen Abzieher vor. Pipettes mit 154 mM NaCl-Lösung füllen und in einen Elektrodenhalter legen.
- Mit einer Pinzette und einem Spachtel, entfernen Sie eine Hippocampus-Scheibe aus der Grenzflächenkammer, indem Sie die Scheibe mit dem kleinen Filterpapier nehmen und beide in eine Petrischale mit kariertem aCSF gefüllt. Entfernen Sie das kleine Filterpapier aus der Hippocampusscheibe, und (falls erforderlich) wenden Sie etwas Kraft mit einer Pipette an, um die Scheibe vom Filterpapier zu trennen. Achten Sie darauf, die Scheibe nicht umzudrehen.
- Legen Sie das Segment in die Aufnahmekammer und halten Sie es mit Deminteilen netzein.
HINWEIS: Aufgrund des Bernoulli-Prinzips sind Scheiben in der verwendeten Unterwassermembrankammer in der Regel stabil, ohne dass ein zusätzliches Scheibennetz verwendet wird. - Legen Sie Elektroden in die Region und die Interessenschicht (hier CA1) und beginnen Sie mit der Aufnahme.
- Zeichnen Sie Feldpotentialaktivität im aktuellen Klemmmodus mit einer Abtastrate von 10–20 kHz und Tiefpassfiltern bei 2 kHz auf.
- Zeichnen Sie die Basalaktivität in aCSF für bis zu 5 min auf.
- Schalten Sie die Zuflussrohre von aCSF auf highK++4AP oder lowMg2++BIC aCSF und das Abflussrohr in einen Abfallbehälter, um das Mischen von Lösungen zu verhindern. Nach 2 min das Abflussrohr in die gleiche Lösung wie den Zufluss legen, um die Lösung zu erhalten.
- Burst-Aktivität durch HighK++4-AP induziert sollte 2-5 min nach dem Einwaschen sichtbar sein. Die Induktion von SLEs durch lowMg2++BIC kann jedoch bis zu 30 min dauern. Falls erforderlich, ändern Sie die Positionen der Elektroden sorgfältig, um optimale Ergebnisse zu erzielen.
- Sobald Sie sich in der endletzten Position befinden, zeichnen Sie die Ausgangsaktivität für mindestens 20 min auf. Wenn Sie SLEs aufzeichnen, sollten Sie längere Basisaufzeichnungen aufgrund der geringen Häufigkeit von SLEs in Betracht ziehen.
- Für den Fall, dass die Ausgangsaktivität stabil ist (Plateau der Ereignishäufigkeit), waschen Sie das gewünschte Medikament. Beachten Sie, dass aufgrund der hohen Durchflussrate das Einwaschen von Medikamenten nur 2-5 min dauert, was einen schnellen Lösungsaustausch ermöglicht.
- Aufzeichnung aktivität während der Anwendung von Drogen von mindestens 20 min, nach dem Auswaschen. Die Aktivität sollte mindestens 60–90 min stabil sein, was längere Aufnahmen ermöglicht.
7. Analyse
- Die Analyse von Frequenz und Amplitude kann mit jeder verfügbaren Software durchgeführt werden. Bisher konnten wir keine zuverlässige automatische Analyse von SLEs oder Burst-Aktivitäten durchführen und stattdessen eine halbautomatische Analyse mit visueller Bestätigung der identifizierten Aktivität verwenden.
- Die Burstaktivität ist durch eine biphasische, positive und negative Durchbiegung und eine Dauer von 100 ms gekennzeichnet. Alle Ereignisse, die visuell als Burstaktivität identifiziert werden (z. B. halbautomatisch durch Schwellenwertanalyse), sollten manuell für die weitere Analyse der Ereignishäufigkeit (Inter-Event-Intervall, IEI), amplitude und der Gesamtzahl der Ereignisse während des analysierten Zeitrahmens angegeben werden.
HINWEIS: Aufgrund der hohen Häufigkeit der Burstaktivität werden die letzten 5 min jeder Anwendungsphase in der Regel20analysiert. - SLEs können wie in Heuzeroth et al. beschrieben analysiert werden. Identifizierte SLEs können weiter auf Dauer, Amplitude, Spike-Frequenz und Dauer der Tonic (Hochfrequenz-Spiking) vs. konnische (niederfrequente Spiking) Phase Dauer analysiert werden. SLEs, die <10 s daueren, sollten von der Analyse ausgeschlossen werden.
HINWEIS: Zur präklinischen Bewertung möglicher antiepileptischer Substanzen werden Auswirkungen auf die Burstaktivität (induziert durch HighK++4AP) aufgrund der nachgewiesenen Induktion im resektierten Hippocampusgewebe untersucht. Vorläufige Ergebnisse zur Induktion von SLEs mit lowMg2++BIC wurden gemeldet (Abbildung 2), obwohl die Analyse dieser Daten hier nicht enthalten ist.
Ergebnisse
Die epiptiforme Aktivität wurde erfolgreich in resektiertem menschlichen Hippocampusgewebe von bis zu 15 Patienten aufgezeichnet. Die Etablierung stabiler Transport- und Vorbereitungsverfahren ist entscheidend für die erfolgreiche Induktion der epipapten Aktivität im menschlichen Hirngewebe. Kürzlich veröffentlichte Ergebnisse haben gezeigt, 1) stabile Induktion der epilepiformen Aktivität im resektierten Gewebe verschiedener Patienten sowie 2) die Verwendung von reseziertem menschlichen Hirngewebe als präklinisches Werkzeug für die Bewertung neuartiger antiepileptischer Mechanismen14,20.
Anwendung von HighK++4-AP induzierte epileptiforme Aktivität in Form von Burst-Aktivität innerhalb weniger Minuten (Abbildung 2A,B,C,D). Aufgrund der geringen neuronalen Verteilung im menschlichen Hippocampusgewebe oder des hohen neuronalen Zellverlustes durch temporale Lappenepilepsie (TLE) kann die Platzierung von Elektroden zu Beginn der Aufzeichnung angepasst werden. In Fällen, in denen die Burstaktivität von Slices im CA1-Bereich nach 10 min (unabhängig von der Platzierung der Elektroden) nicht sichtbar ist, kann die Slice-Lebensfähigkeit beeinträchtigt werden, und das Slice muss ersetzt werden.
SLEs, mit einer Dauer von >10 s, können mit Anwendung von lowMg2++BIC induziert werden (Abbildung 2E,F). Abbildung 2E zeigt eine stabile Induktion von SLEs nach einigen Minuten und eine stabile Frequenz während der gesamten Aufzeichnung. Hier wurde die SLE-Aktivität in zwei von vier Scheiben des untersuchten Patienten erfolgreich induziert. Eine Scheibe zeigte nur Burst-Aktivität nach 15 min SLE-Aktivität, während die andere Scheibe auch nach 40 min keine SLEs zeigte.
Für die präklinische Bewertung von Substanzeffekten wurde eine mögliche antiepileptische Wirkung auf die Burstaktivität untersucht, die durch HighK++4-AP induziert wurde. Getestet wurden bekannte und potentielle antiepileptische Substanzen (Lacoamin, DMEA, Dynorphin14), und hier werden Beispiele für das konventionelle AED-Lacoamin (ein Natriumkanalblocker) sowie DMEA (eine neuartige potentielle antiepileptische Substanz)20gezeigt. Die Anzahl der Ereignisse und das Ereignisintervall (IEI) von Burstereignissen ging sowohl während der Anwendung von Lacosamide als auch bei DMEA zurück (Abbildung 3C), obwohl Amplituden größtenteils nicht betroffen waren (Abbildung 3D). In einer Teilmenge von Slices, obwohl die Induktion von Burst-Ereignissen in den ersten Minuten erreicht wurde, erholte sich die Aktivitätshäufigkeit beim Auswaschen von angewendeten AEDs nicht (Daten, die hier nicht gezeigt werden, siehe Kraus et al.20). Hier bei den angewandten Medikamenten wurden Wirkungen induziert; Jedoch kann die Abnahme der Burst-Aktivität durch den allmählichen Verfall der Aktivität während langer Aufnahmen beeinflusst worden sein. Daher müssen die Ergebnisse sorgfältig interpretiert werden.
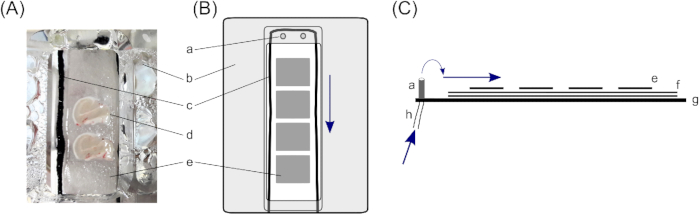
Abbildung 1: Schnittstellenkammer. Für die Speicherung von menschlichen Hippocampus Gehirn Scheiben, wird eine Schnittstellenkammer mit zwei GehirnScheibe halten Fächer verwendet (A); insbesondere eine Schnittstellekammer vom Typ Haas23. Hier ruhen Hippocampus-Gehirnscheiben auf (d) drei Schichten Filterpapier, (e) kleinere Stücke, um den Umgang mit einzelnen Gehirnscheiben zu ermöglichen, und (f) größere Filterpapierstücke, um eine ausreichende Lösungsschicht unter der Scheibe zu gewährleisten. (c) Eine Baumwollschnur, die die Gehirnscheiben umgibt, auf den Filterpapieren sorgt für einen gleichmäßigen Lösungsfluss aus den Einlässe an der (a) Oberseite des Fachs. (b) Ein Deckel leitet Sauerstoff von unterhalb des Fachs auf die Scheibe. (B) Obere Ansicht eines Scheibenhaltefachs. (C) Seitenansicht zur Veranschaulichung der Schichten von Filterpapieren. (g) Unterseite der Kammer. (h) Rohr für Lösungszufluss, der mit einer peristaltischen Pumpe verbunden ist (blaue Pfeile markieren die Richtung des Lösungsflusses). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
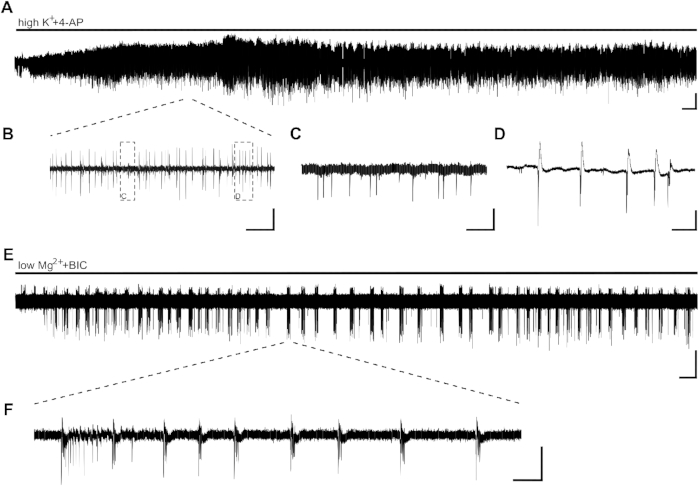
Abbildung 2: Epiptiforme Aktivität in menschlichen Hippocampusscheiben, die durch highK++4-AP und lowMg2++BIC induziert werden. CA1-Beispielaufzeichnungen und Auszüge der Anwendung von highK+ (8 mM)+4-AP (100 m) (A,B,C,D) und lowMg2++BIC (10 'M) (E,F). (A) Die Bathanwendung von HighK++4-AP induziert innerhalb weniger Minuten eine epileppische Aktivität, und die Aktivität ist mindestens 60 min stabil. Details von (A) sind in (B) zu sehen. Zwei verschiedene Arten von Aktivität werden im CA1-Bereich menschlicher Hippocampusscheiben induziert: interictalartige Spitzen (C, Details von [B]) und Burstaktivität (D, Details von [B]). Die Burst-Aktivität erwies sich als empfindlich gegenüber Antiepileptika und wurde daher auf die Wirkung potenzieller antiepileptischer Substanzen analysiert (Abbildung 3). (E,F) Die Anwendung von lowMg2++BIC induziert SLEs bei einer Dauer von >10 s (F) in CA1 innerhalb weniger Minuten. Die Induktion von SLEs kann jedoch bis zu 30 min in anderen Scheiben dauern. Skalenbalken = 0,2 mV, 2 min (A,E), 5 s (B), 500 ms (C,D), 5 min (E) und 2 s (F). Diese Figur wurde von Kraus et al.20adaptiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
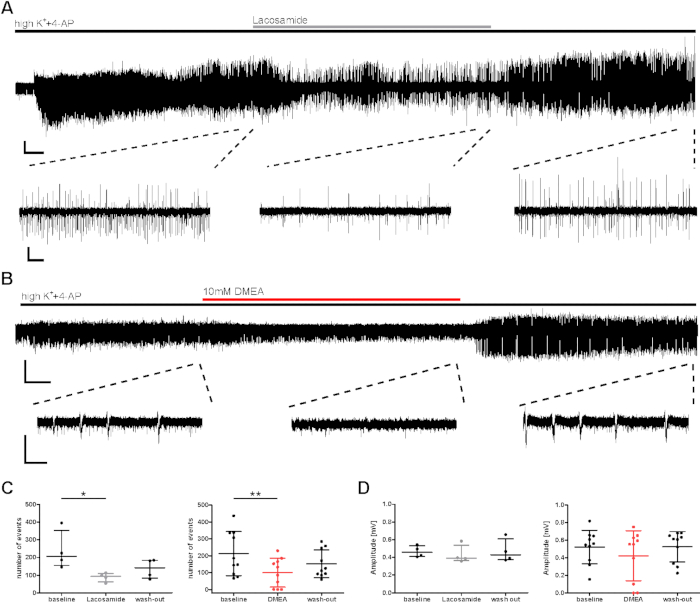
Abbildung 3: Abnahme der epileptischen Burstaktivität menschlicher Scheiben während der Anwendung von Lacosamide oder DMEA. Die Burstaktivität verringerte sich während der Anwendung von (A) Lacosamide und (B) DMEA, einem potenziellen neuen antiepileptischen Molekül. (A) und (B) zeigen beispielhafte Aufzeichnungen des CA1-Gebiets mit Auszügen von Regionen, die für die Analyse in (C) und (D) verwendet werden. Die Burstaktivität verringerte sich während der Anwendung von Lacosamide (100 m) und DMEA (10 mM), wie die mittleren Auszüge zeigen, und nimmt während des Auswaschens wieder zu. (C,D) Anzahl und Amplitude der Burstaktivität wurden für die letzten 5 min jeder Anwendungsphase (Baseline, Lacosamide/DMEA, Auswaschen) analysiert und als zusammengefasste Ergebnisse für alle Patienten (Anzahl der Ereignisse, C; Amplitude, D) als Mittelwert sD dargestellt. Jeder Punkt zeigt einen Patienten an. Sternchen markieren signifikante Unterschiede, die entweder vom Friedman-Test und nach dem Hoc-Test mit Dunnetts Mehrfachvergleich von Gruppen zur Analyse der Lacosamide-Anwendung (*p < 0,05, n = 4) oder durch wiederholte Messung ANOVA und Post-hoc mit Tukeys Vergleich zur Analyse der DMEA-Anwendung (**p < 0,01, n = 10) bewertet werden. Skalenbalken = 0,2 mV, 2 min (vollständige Aufnahme, A), 5 s (Auszüge, A), 3 min (vollständige Aufnahme, B) und 1 s (Auszüge, B). Diese Figur wurde von Kraus et al.20adaptiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Lösung 1.1 Cholin aCSF | |||
| Substanz | 10x Konzentration (mM) | 1x Konzentration (mM) | Hinweis |
| Cholin Cl | 1100 | 110 | |
| (+)-Na L-Ascorbat | 116 | 11.6 | |
| MgCl2x6H2O | 70 | 7 | |
| Na pyruvat | 31 | 3.1 | |
| Kcl | 25 | 2.5 | |
| NaH2PO4 | 12.5 | 1.25 | |
| NaHCO3 | 260 | 26 | |
| CaCl2 | - | 0.5 | zur endgültigen Lösung hinzufügen |
| Glukose | - | 10 | zur endgültigen Lösung hinzufügen |
| Lösung 1.2 aCSF | |||
| Substanz | 10x Konzentration (mM) | 1x Konzentration (mM) | Hinweis |
| Nacl | 1290 | 129 | |
| NaH2PO4 | 12.5 | 1.25 | |
| CaCl2 | 16 | 1.6 | |
| Kcl | 30 | 3 | |
| MgSO4 | 18 | 1.8 | |
| Glukose | - | 10 | zur endgültigen Lösung hinzufügen |
| Lösung 1.3 highK++4-AP aCSF | |||
| Substanz | 10x Konzentration (mM) | 1x Konzentration (mM) | Hinweis |
| Nacl | 1240 | 124 | |
| NaH2PO4 | 12.5 | 1.25 | |
| CaCl2 | 16 | 1.6 | |
| Kcl | 80 | 8 | |
| MgSO4 | 18 | 1.8 | |
| Glukose | - | 10 | zur endgültigen Lösung hinzufügen |
| 4-AP | - | 0.1 | zur endgültigen Lösung hinzufügen |
| Lösung 1.4 lowMg2++BIC aCSF | |||
| Substanz | 10x Konzentration (mM) | 1x Konzentration (mM) | Hinweis |
| Nacl | 1300 | 130 | |
| NaH2PO4 | 12.5 | 1.25 | |
| CaCl2 | 16 | 1.6 | |
| Kcl | 30 | 3 | |
| Glukose | - | 10 | zur endgültigen Lösung hinzufügen |
| Bic | - | 0.01 | zur endgültigen Lösung hinzufügen |
| Lösung 2 | |||
| Substanz | 10x Konzentration (mM) | 1x Konzentration (mM) | Hinweis |
| NaHCO3 | 210 | 21 | |
Tabelle 1: Vorbereitung von 10x- und Final-1x-Lösungen für Transport, Vorbereitung und Aufzeichnung.
Diskussion
Das Leben nach dem menschlichen Hirngewebe ist ein sehr wertvolles Werkzeug bei der präklinischen Bewertung von AEDs, da es ein intaktes menschliches Gehirnmikronetzwerk darstellt. Das vorgestellte Protokoll beschreibt eine Methode für den Gewebetransport und die Gewebeaufbereitung, die hochwertige Hippocampusscheiben sowie eine stabile Induktionsmethode für die für die AED-Bewertung entscheidende epileptiforme Aktivität sicherstellt.
Untersuchung der epilepporganischen Aktivität sowie Methoden zur chemischen oder elektrischen Induktion in menschlichen Gehirnscheiben wurden zuvor von anderen Gruppen17,20,21,22gezeigt. Dieses Protokoll beschreibt die Induktion einer stabilen Burstaktivität in Scheiben von verschiedenen Patienten durch Anwendung von hohem K++4-AP sowie die Induktion von SLEs im CA1-Bereich durch Anwendung von low Mg2++BIC. Es wurde festgestellt, dass die Induktion der Burst-Aktivität konsistenter ist (80% der getesteten Scheiben bei 15 Patienten) als die Induktion von SLEs (50% der getesteten Scheiben bei einem Patienten). Bisher wurde die Induktion von SLEs jedoch nur bei einem Patienten getestet. Dennoch wird die Induktion von SLEs durch niedrigemg2++BIC empfohlen, da SLEs noch nicht mit hohem K++4-AP induziert werden konnten.
Mehrere Studien haben Methoden für den Transport und die Vorbereitung von menschlichem Hirngewebe eingeführt und zeigen oft drei Faktoren hervor, die für das neuronale Überleben entscheidend sind: Transportzeit, verwendete Transportlösungen und Lagerbedingungen.
Für eine optimale Slice-Lebensfähigkeit schlagen einige Gruppen vor, dass der Transport von resektiertem Hirngewebe so kurz wie möglich sein sollte. Operationsräume und Labore befinden sich jedoch selten in unmittelbarer Nähe, was bedeutet, dass die Qualität der Scheiben durch den langen Transport beeinträchtigt werden kann. Einige Gruppen haben dieses Hindernis überwunden, indem sie während des Transports12konstantes O2 auf die Lösung angewendet haben. Wir haben Hirngewebe für kurze (max = 15 min) und lange (bis zu 1 h) Zeiträume ohne konstante zusätzlicheO2-Versorgung während des Transports transportiert, ähnlich wie andere Gruppen18,25. In diesen Fällen wurden bei epileptiformen Aufnahmen keine Unterschiede in der Gewebequalität beobachtet. Auch in der Kommunikation mit anderen Gruppen unseres Instituts änderte sich die Schnittqualität bei Patch-Clamp-Experimenten nicht. Im Gegensatz dazu kann die Varianz in der Gewebequalität möglicherweise auf Schäden während operationen, längere Resektion und Schneidverfahren zurückzuführen sein.
In Bezug auf Transport- und Schneidlösung lassen alle veröffentlichten Methoden NaCl von Lösungen weg, um die Zellschwellung durch osmotischen Druck zu reduzieren, ähnlich dem Standardverfahren für Nagetier-Patch-Clamp-Experimente. Bisher wurden jedoch mehrere Substitute eingeführt (d.h. Saccharose-basierte aCSF13,22, NMDG-basierte aCSF12,26und Cholin-basierte aCSF27). Ting und Kollegen führten 2014 2014das NMDG-basierte aCSF für die Slice-Vorbereitung ein und fügten später ein Wiederherstellungsprotokoll hinzu, das NaCl langsam wieder in die Slices28einführt. Wie von Ting et al. beschrieben, weisen jedoch Neuronen von Hirngewebe, die in NMDG-basiertem aCSF hergestellt wurden, eine höhere Membranresistenz auf und wirken sich somit auf die Ganzzellversiegelung bei Patch-Clamp-Experimentenaus 26. Daher haben wir von NMDG-basierte aCSF auf die Verwendung von Cholin-basierte aCSF20umgestellt, die qualitativ hochwertige Slices für Feldpotenzial und Patch-Clamp-Aufnahmen liefert.
Hinsichtlich der Lagerung von Scheiben ist allgemein anerkannt, dass Schnittstellenbedingungen eine optimale Sauerstoffversorgung bieten, die für das Überleben langer Scheiben entscheidend ist18. Andere Gruppen zeigen jedoch ein Scheibenüberleben von bis zu 72 h unter getauchten Bedingungen12. Im Gegensatz zu früheren Hypothesen scheinen menschliche Gehirnscheiben resistenter gegen niedrige Sauerstoffversorgung oder oxidativen Stress im Vergleich zu Nagetierscheiben zu sein. In erster Linie wurden Schnittstellenkammern früher für die Lagerung von menschlichen Hippocampus-Scheiben verwendet, obwohl untergetauchte Bedingungen für die Aufrechterhaltung von menschlichen Gehirnscheiben in Patch-Clamp-Experimenten empfohlen werden.
Wie von anderen Gruppen diskutiert, ist ein zusätzlicher kritischer Schritt für das Überleben langer Scheiben (Schnittstelle für <48 h18, untergetaucht für <72 h12) die Verhinderung einer bakteriellen Kontamination. Nagetier-Gehirnscheiben werden in der Regel in elektrophysiologischen Aufnahmen für bis zu 8 h verwendet, und bakterielle Kontamination wird nicht als Einfluss auf die Lebensfähigkeit der Scheibe während dieses Zeitraums betrachtet. Eine hohe Anzahl von Scheiben, die aus einer Resektion hergestellt werden, und die ungewöhnliche Verfügbarkeit von menschlichem Gehirngewebe unterstreichen die Notwendigkeit, die Lebensfähigkeit menschlicher Gehirnscheiben zu verlängern. Diese Methode beschreibt erfolgreich die Herstellung von lebenden menschlichen Hippocampus-Gehirnscheiben, die leicht an sterile Bedingungen angepasst werden können. Für die hier gezeigten Aufnahmen hatte das Scheibenüberleben von 20 h jedoch keine Priorität.
Die Aufnahme in Schnittstellenkammern hat sich auch als wesentlich für die Induktion von epileptiforme Aktivität wie SLEs22erwiesen. Untergetauchte Bedingungen aufgrund geringer Sauerstoffversorgung werden selten für die Aufzeichnung von SLEs verwendet; Sie sind jedoch für eine optische hohe Auflösung notwendig, die für Patch-Clamp-Experimente benötigt wird. Der Einsatz einer optimierten Aufnahmekammer vom Typ Untergetaucht ermöglicht die Aufzeichnung der epileppfigen Aktivität (extrazelluläres Feld oder einzelnes Neuron) in menschlichen Gehirnscheiben aufgrund hoher Sauerstoffversorgung und schneller Wirkstoffanwendung29. Hier werden Methoden und Ergebnisse für Feldpotentialaufnahmen beschrieben, aber es sollte betont werden, dass Patch-Clamp-Aufnahmen erfolgreich in Maus- und menschlichen Gehirnscheiben mit dieser modifizierten Aufnahmekammer durchgeführt wurden (Daten nicht dargestellt).
Resected human brain tissue hat einen höheren Translationswert im Vergleich zu Nagetiermodellen. Es stellt ein erwachsenes, krankes neuronales Netzwerk dar, das von iPSCs nicht reproduziert werden kann. Jedoch, wie in jedem In-vitro-System, menschliche Gehirnscheiben stellen kein intaktes menschliches Gehirn. Darüber hinaus können die aufgezeichneten neuronalen Netzwerke von reseziertem Hirngewebe erhebliche molekulare und funktionelle Veränderungen aufgrund von Schäden während der Operation oder Vorbereitung erfahren. Slicing-Verfahren haben gezeigt, dass GABAerge Funktion beeinflussen und kann die Induktion der epilepptiformen Aktivitätbeeinflussen 30. Diese Einschränkungen sollten bei der Formulierung einer Hypothese berücksichtigt werden. Bei der Prüfung potenzieller Antiepileptika sollte die Verwendung verschiedener Hirnbereiche in Betracht gezogen werden, da Arzneimittelziele möglicherweise nicht in allen menschlichen Hirnregionen oder allen Patienten ausgedrückt werden. Insbesondere die Hippocampi von TLE-Patienten zeigen oft Anzeichen von Hippocampus-Sklerose, begleitet von einem schweren neuronalen Zellverlust. Es wird empfohlen, Patienteninformationen über pathologische Veränderungen und Krankheitsverlauf, wie z. B. potenzielle Feuerfeststoffe gegenüber Medikamenten, zu erhalten und dies bei der Dateninterpretation zu berücksichtigen.
Zusammenfassend beschreibt diese Methode erfolgreich die Vorbereitung lebender menschlicher Hippocampus-Gehirnscheiben und Induktionstechniken zur Aufzeichnung von zwei verschiedenen Arten von epiptiformer Aktivität. Da die Verfügbarkeit von lebendem menschlichem Hirngewebe selten ist, sollten optimierte Transport- und Aufzeichnungsbedingungen verwendet werden, um eine maximale Leistung von Experimenten mit menschlichen Gehirnscheiben zu gewährleisten. Es wird vorgeschlagen, dass reseziertes menschliches Hirngewebe als präklinisches Validierungswerkzeug zusätzlich zu Nagetiermodellen und Zellkulturexperimenten verwendet werden kann.
Offenlegungen
Die Autoren erklären keinen Interessenkonflikt.
Danksagungen
Wir danken Mandy Marbler-Pötter (Charite-Unversitätsmedizin, Berlin) für die hervorragende technische Unterstützung. P.F. wurde von der Deutschen Forschungsgemeinschaft (DFG) im Rahmen der Exzellenzstrategie EXC-2049-390688087 gefördert. Diese Arbeit wurde vom QUEST Center for Transforming Biomedical Research am Berliner Institut für Gesundheit unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| (+)-Na L-ascorbate | Sigma Aldrich | A4034 | |
| 4-AP | Sigma Aldrich | 275875-5G | |
| Blades | eliteSERVE GmbH | HW3 | used for the vibratome |
| CaCl2 | Merck | 102382 | |
| Choline Cl | Sigma Aldrich | C1879 | |
| Filter paper | Tiffen | EK1546027T | |
| Gas-tight bottle caps | Carl Roth GmbH+Co.KG | E694.1 | |
| Glass filaments | Science Products | GB150F-8P | for recording electrodes |
| Glass gas disperser | DWK Life Sciences GmbH | 258573309 | |
| Glucose | Sigma Aldrich | G7528 | |
| Interface Chamber | inhouse made | - | see Haas et al., 1979 |
| KCl | AppliChem | 131494.1210 | |
| Membrane (Cell culture inserts) | Merck | PICM030050 | |
| Membrane chamber | inhouse made | - | see Hill and Greenfield, 2011 |
| MgCl2?6H2O | Carl Roth | HNO3.2 | |
| MgSO4 | Sigma Aldrich | M7506 | |
| Na pyruvate | Sigma Aldrich | P8574 | |
| NaCl | Carl Roth | 3957.1 | |
| NaH2PO4 | Merck | 106346 | |
| NaHCO3 | Carl Roth | HNO1.2 | |
| Peristaltic pump | Gilson | Minipuls 3 | |
| Slice holder | Warner instruments | SHD-41/15 | |
| Vertical puller | Narishige | PC-10 | |
| Vibratome | Leica | VT1200S |
Referenzen
- Hirtz, D., et al. How common are the "common" neurologic disorders. Neurology. 68 (5), 326-337 (2007).
- Ngugi, A. K., Bottomley, C., Kleinschmidt, I., Sander, J. W., Newton, C. R. Estimation of the burden of active and life-time epilepsy: a meta-analytic approach. Epilepsia. 51 (5), 883-890 (2010).
- Kwan, P., Brodie, M. J. Early Identification of Refractory Epilepsy. New England Journal of Medicine. 342 (5), 314-319 (2000).
- Löscher, W. Critical review of current animal models of seizures and epilepsy used in the discovery and development of new antiepileptic drugs. Seizure. 20 (5), 359-368 (2011).
- Ledri, M., et al. Differential Effect of Neuropeptides on Excitatory Synaptic Transmission in Human Epileptic Hippocampus. The Journal of Neuroscience: the official journal of the Society for Neuroscience. 35 (26), 9622-9631 (2015).
- Qi, X. R., et al. Alterations in the steroid biosynthetic pathways in the human prefrontal cortex in mood disorders: A post-mortem study. Brain Pathology. 28 (4), 536-547 (2018).
- Verwer, R. W. H., et al. Post-mortem brain tissue cultures from elderly control subjects and patients with a neurodegenerative disease. Experimental Gerontology. 38 (1-2), 167-172 (2003).
- Verwer, R. W. H., et al. Cells in human postmortem brain tissue slices remain alive for several weeks in culture. FASEB journal official publication of the Federation of American Societies for Experimental Biology. 16 (1), 54-60 (2002).
- Le Maître, T. W., Dhanabalan, G., Bogdanovic, N., Alkass, K., Druid, H. Effects of Alcohol Abuse on Proliferating Cells, Stem/Progenitor Cells, and Immature Neurons in the Adult Human Hippocampus. Neuropsychopharmacology. 43 (4), 690-699 (2018).
- Dennis, C. V., Suh, L. S., Rodriguez, M. L., Kril, J. J., Sutherland, G. T. Human adult neurogenesis across the ages: An immunohistochemical study. Neuropathology and Applied Neurobiology. 42 (7), 621-638 (2016).
- Verwer, R. W. H., et al. Mature astrocytes in the adult human neocortex express the early neuronal marker doublecortin. Brain. 130 (12), 3321-3335 (2007).
- Ting, J. T., et al. A robust ex vivo experimental platform for molecular-genetic dissection of adult human neocortical cell types and circuits. Scientific Reports. 8 (1), 8407 (2018).
- Le Duigou, C., et al. Imaging pathological activities of human brain tissue in organotypic culture. Journal of Neuroscience Methods. 298, 33-44 (2018).
- Agostinho, A. S., et al. Dynorphin-based "release on demand" gene therapy for drug-resistant temporal lobe epilepsy. EMBO molecular medicine. 11 (10), 9963 (2019).
- Hodge, R. D., et al. Conserved cell types with divergent features in human versus mouse cortex. Nature. 573 (7772), 61-68 (2019).
- Beaulieu-Laroche, L., et al. Enhanced Dendritic Compartmentalization in Human Cortical Neurons. Cell. 175 (3), 643-651 (2018).
- Sandow, N., et al. Drug resistance in cortical and hippocampal slices from resected tissue of epilepsy patients: no significant impact of p-glycoprotein and multidrug resistance-associated proteins. Frontiers in Neurology. 6, 30 (2015).
- Wickham, J., et al. Prolonged life of human acute hippocampal slices from temporal lobe epilepsy surgery. Scientific Reports. 8 (1), (2018).
- Avoli, M., Jefferys, J. G. R. Models of drug-induced epileptiform synchronization in vitro. Journal of Neuroscience Methods. , (2015).
- Kraus, L., et al. Dimethylethanolamine Decreases Epileptiform Activity in Acute Human Hippocampal Slices in vitro. Frontiers in Molecular Neuroscience. 12, 209 (2019).
- Antonio, L. L., et al. In vitro seizure like events and changes in ionic concentration. Journal of Neuroscience Methods. , (2016).
- Gabriel, S., et al. Stimulus and Potassium-Induced Epileptiform Activity in the Human Dentate Gyrus from Patients with and without Hippocampal Sclerosis. Journal of Neuroscience. 24 (46), 10416-10430 (2004).
- Haas, H. L., Schaerer, B., Vosmansky, M. A simple perfusion chamber for the study of nervous tissue slices in vitro. Journal of Neuroscience Methods. 1 (4), 323-325 (1979).
- Hill, M. R. H., Greenfield, S. A. The membrane chamber: a new type of in vitro recording chamber. Journal of neuroscience methods. 195 (1), 15-23 (2011).
- Andersson, M., et al. Optogenetic control of human neurons in organotypic brain cultures. Scientific Reports. 6, 24818 (2016).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. Acute brain slice methods for adult and aging animals: application of targeted patch clamp analysis and optogenetics. Methods in molecular biology. 1183, 221-242 (2014).
- Testa-Silva, G., et al. Human synapses show a wide temporal window for spike-timing-dependent plasticity. Frontiers in Synaptic Neuroscience. 2, 12 (2010).
- Ting, J. T., et al. Preparation of Acute Brain Slices Using an Optimized N-Methyl-D-glucamine Protective Recovery Method. Journal of Visualized Experiments. (132), (2018).
- Morris, G., Jiruska, P., Jefferys, J. G. R., Powell, A. D. A New Approach of Modified Submerged Patch Clamp Recording Reveals Interneuronal Dynamics during Epileptiform Oscillations. Frontiers in Neuroscience. 10, 519 (2016).
- Valeeva, G., Valiullina, F., Khazipov, R. Excitatory actions of GABA in the intact neonatal rodent hippocampus in vitro. Frontiers in Cellular Neuroscience. , (2013).
Erratum
Formal Correction: Erratum: Preparation of Acute Human Hippocampal Slices for Electrophysiological Recordings
Posted by JoVE Editors on 7/13/2020. Citeable Link.
An erratum was issued for: Preparation of Acute Human Hippocampal Slices for Electrophysiological Recordings. Step 2.1.3 in the Protocol was corrected.
Step 2.1.3 in the Protocol was updated from:
Add final concentrations of glucose and MgCl, then stir until dissolved (Table 1, solution 1.1).
to:
Add final concentrations of glucose and CaCl2, then stir until dissolved (Table 1, solution 1.1).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten