Method Article
Préparation de tranches d’hippocampe humaine aiguë pour les enregistrements électrophysiologiques
Dans cet article
Erratum Notice
Résumé
Le protocole présenté décrit le transport et la préparation du tissu hippocampal humain réséqué dans le but ultime d’utiliser des tranches vitales du cerveau comme outil d’évaluation préclinique pour les substances antiépileptiques potentielles.
Résumé
L’épilepsie touche environ 1 % de la population mondiale et entraîne une grave diminution de la qualité de vie due aux crises d’épilepsie en cours ainsi qu’au risque élevé de mort subite. Malgré une abondance d’options de traitement disponibles, environ 30% des patients sont résistants aux médicaments. Plusieurs nouvelles thérapies ont été développées à l’aide de modèles animaux, bien que le taux de patients pharmacorésistants reste inchangé. L’une des raisons probables est le manque de traduction entre les modèles de rongeurs et les humains, comme une faible représentation de la pharmacocœursistance humaine dans les modèles animaux. Le tissu cérébral humain réséqué comme outil d’évaluation préclinique a l’avantage de combler cet écart translationnel. Décrit ici est une méthode pour la préparation de haute qualité des tranches de cerveau hippocampal humaine et l’induction stable suivante de l’activité épileptiforme. Le protocole décrit l’induction de l’activité d’éclatement pendant l’application de 8 mM KCl et 4-aminopyridin. Cette activité est sensible aux candidats adécoides AED établis ou de nouveaux candidats antiépileptiques, tels que la diméthyléthanolamine (DMEA). En outre, la méthode décrit l’induction des événements de saisie-comme dans CA1 des tranches de cerveau hippocampal humaine par la réduction du Mg extracellulaire2+ et l’application de la bicuculline, un bloqueur de récepteur de GABAA. L’installation expérimentale peut être utilisée pour dépister les substances antiépileptiques potentielles pour leurs effets sur l’activité épileptiforme. En outre, les mécanismes d’action postulés pour des composés spécifiques peuvent être validés à l’aide de cette approche dans les tissus humains (p. ex., à l’aide d’enregistrements de pinces à patch). Pour conclure, l’étude de l’ex vivo vital de tissu cérébral humain (ici, hippocampe réséqué des patients souffrant de l’épilepsie de lobe temporel) améliorera la connaissance actuelle des mécanismes physiologiques et pathologiques dans le cerveau humain.
Introduction
L’épilepsie est l’un des troubles neurologiques les plus courants, affectant 1% de la population mondiale, et est associée à une augmentation de la morbidité et de la mortalité1,2. Malheureusement, un tiers des patients souffrant d’épilepsie sont résistants aux médicaments, malgré une abondance d’options de traitement disponibles, y compris plus de 20 médicaments antiépileptiques approuvés (DEA)3. L’incapacité à traduire les résultats de la recherche préclinique sur les animaux aux essais cliniques est l’une des raisons pour lesquelles les stratégies de traitement prometteuses ne sont pas efficaces chez de nombreux patients4. Récemment, neuropeptide Y (NPY) et galanin ont été montrés pour avoir des effets antiépileptiques dans les modèles animaux; cependant, lorsqu’il est testé dans le tissu cérébral humain réséqué, seul NPY était efficace5.
La plupart des connaissances existantes concernant les mécanismes neurologiques de base et les approches de thérapie de la maladie proviennent de modèles animaux et d’expériences de culture cellulaire. Bien qu’informatifs, ces modèles ne représentent que des aspects uniques des maladies humaines complexes et du réseau cérébral humain adulte. Alternativement, le tissu cérébral humain a le potentiel de combler l’écart translationnel mais est rarement disponible pour des études fonctionnelles. Par exemple, le tissu cérébral post mortem a été un outil précieux dans l’étude de l’expression des protéines, la morphologie du cerveau, ou des connexions anatomiques, bien que l’activité neuronale est souvent compromise est ce tissu6,7,8,9,10,11.
En revanche, la vie réséqué tissu cérébral humain a été étudié concernant l’évaluation des médicaments précliniques, les fonctions neuronales de base et les modèles d’expression des gènes12,13,14,15,16,17. Un grand avantage des tranches de cerveau humaines par rapport aux tranches de rongeur est la longue viabilité du tissu neuronal après la résection et la préparation. Par rapport aux tranches de cerveau de rongeur, qui peuvent généralement être enregistrées jusqu’à 8 h après la préparation, les tranches de cerveau humain montrent une activité neuronale stable pour un jusqu’à 72 h, permettant une étude approfondie de ces échantillons rares et précieux12,18.
Plusieurs études ont étudié les propriétés de l’activité épileptiforme dans divers domaines du tissu humain cortical et hippocampal réséqué et ont utilisé différentes méthodes pour l’induction de l’activité épileptiforme. Dans les tranches de rongeurs, l’activité épileptiforme peut être induite par plusieurs méthodes : stimulation électrique des cellules hilares DG, augmentation du K extracellulaire+ (8–12 mM KCl), blocage des récepteurs GABAA par bicuculline (BIC), blocage des canaux de potassium par 4-aminopyridine (4-AP), et suppression ou réduction de Mg2+ en solution extracellulaire19. Cependant, l’induction de l’activité épileptiforme dans les tissus humains nécessite la combinaison d’au moins deux des méthodes susmentionnées20,21,22.
Présenté ici est une méthode pour la préparation des tranches de cerveau hippocampal humain, qui sont viables pour jusqu’à 20 h et montrent l’induction de l’activité épileptiforme sur l’application de haut K+ (8 mM) et 4-AP ou faible Mg2 + et BIC.
Protocole
Les patients doivent donner un consentement écrit éclairé avant l’opération, et les accords éthiques nécessaires doivent être en place avant l’expérience. En ce qui concerne les résultats représentatifs, toutes les études impliquant des participants humains ont été examinées et approuvées par Charité-Universitätsmedizin, Berlin (EA2/111/14).
1. Préparation de solutions 10x
NOTE : En raison des difficultés dans la planification de l’accès aux tissus cérébraux humains, il est recommandé de préparer des solutions 10x comme décrit ici. Alternativement, les solutions finales 1x peuvent être préparées fraîchement en ajoutant des substances individuelles en concentration finale à l’eau double distillée (ddH2O).
- Pour les solutions individuelles 10x, ajouter des substances à ddH2O selon le tableau 1 et remuer jusqu’à dissolution.
- Utilisez des solutions 10x jusqu’à 1 mois après la préparation (jusqu’à 1 an pour l’aCSF de choline 10x congelé).
- Pour 10x choline aCSF, préparer 50 mL aliquots de 10x 1,1 choline aCSF (Tableau 1) et congeler à -20 °C ou -80 °C jusqu’à une utilisation ultérieure.
REMARQUE : N’ajoutez pas de glucose et de CaCl2 à 10 x 1,1 choline aCSF pour prévenir la contamination par les bactéries et les précipitations de carbonate de calcium. - La solution 10x 2 peut être utilisée pour toutes les solutions finales 1x, tandis que les solutions 10x 1.1–1.4 sont personnalisées et nommées en conséquence (Tableau 1).
2. Préparation de solutions finales 1x
REMARQUE : Les solutions finales 1x doivent être préparées fraîchement ou le plus tôt possible la veille de l’utilisation. Toutes les solutions finales doivent être carbogénées avec 5% de CO2 et 95% O2 à l’aide d’un disperseur de gaz en verre pour enrichir les solutions avec de l’oxygène, et ajuster le pH à 7,4 (max = 7,4 ± 0,2).
- Choline aCSF pour le transport et la préparation
- Pour la solution finale de 500 mL, décongeler un aliquot de 50 mL de la solution 10x 1.1 aliquot pour la choline aCSF dans un bain d’eau de 37 °C.
- Ajouter l’aliquot décongelé de 50 mL de la solution 10x 1,1 et 50 mL de solution 10x 2 à environ 300 mL de ddH2O.
- Ajouter les concentrations finales de glucose et de CaCl2, puis remuer jusqu’à dissolution (tableau 1, solution 1.1).
- Ajouter ddH2O à un volume final de 500 mL et mesurer l’osmolarité (300 mOsm ± 10 mOsm).
- En option, utilisez un filtre pour stériliser la solution (voir la discussion sur la viabilité prolongée des tranches dans des conditions stériles).
- Remplissez une bouteille séparée d’environ 100 ml de 1x choline aCSF pour le transport de la salle d’opération au laboratoire.
- Facultatif : selon le temps de transport de la salle d’opération au laboratoire, envisagez d’utiliser des bouchons de bouteilles étanches au gaz pour assurer un pH stable de l’ACSF pendant les périodes de transport plus longues.
- Conserver la solution finale à 4–8°C jusqu’à ce qu’elle soit utilisée ultérieurement.
- Le jour de l’opération, réfrigérez 1x choline aCSF sur glace et carbogénate pendant au moins 10 à 15 min à l’aide d’un disperseur de gaz en verre relié au gaz carbogénique (5 % de CO2,95 % O2).
REMARQUE : Envisagez de garder une bouteille de gaz accessible à la salle d’opération en cas de temps d’attente plus long, ce qui nécessitera une re-carbogénation de la solution de transport. Cependant, nous avons transporté le tissu hippocampal sans re-carbogénation avant de longs et courts temps de transport (15 min contre 60 min) et n’avons pas observé les différences dans l’induction de l’activité épileptiforme.
- aCSF pour le stockage et l’enregistrement
- Pour une solution finale de 2 L, ajoutez 200 mL de solution 1.2 (aCSF) et 200 mL de solution 10x 2 et glucose (tableau 1) à ~1500 mL de ddH2O.
REMARQUE : Les volumes des solutions finales dépendent d’expériences appliquées et du type de chambre utilisé pour le stockage et l’enregistrement. - Ajouter ddH2O à un volume final de 2 L et mesurer l’osmolarité (300 mOsm ±10 mOsm).
- Préwarmer la solution à 35 °C et le carbogénate pendant au moins 10–15 min avant utilisation.
- Pour une solution finale de 2 L, ajoutez 200 mL de solution 1.2 (aCSF) et 200 mL de solution 10x 2 et glucose (tableau 1) à ~1500 mL de ddH2O.
- HighK++4-AP aCSF pour l’induction de l’activité d’éclatement
- Pour une solution finale de 1 L, ajoutez 100 mL de solution 10x 1,3 (highK++4-AP aCSF) et 100 mL de solution 10x 2 à ~700 mL de ddH2O.
- Ajouter le glucose et le 4-AP (concentration finale = 100 μM) selon le tableau 1.
- Ajouter ddH2O au volume final de 1 L et mesurer l’osmolarité (300 mOsm ±10 mOsm).
- Préwarmer la solution à 35 °C et le carbogénate pendant au moins 10–15 min avant utilisation.
- LowMg2++BIC aCSF pour l’induction d’événements de type saisie (RES)
- Pour une solution finale de 1 L, ajoutez 100 mL de solution 10x 1,4 (lowMg2++BIC acsf) et 100 mL de solution 10x 2 à ~700 mL de ddH2O.
- Ajouter le glucose et le BIC (concentration finale = 10 μM) selon le tableau 1.
- Ajouter ddH2O au volume final de 1 L et mesurer l’osmolarité (300 mOsm ± 10 mOsm).
- Préwarmer la solution à 35 °C et le carbogénate pendant au moins 10–15 min avant utilisation.
3. Préparation de la chambre d’interface
- Dans une chambre d’interface, les tranches reposent sur trois couches de papier filtre pour assurer une quantité suffisante de solution sous la tranche. Pour ce faire, coupez deux morceaux de papier filtre de ~4 cm x ~2 cm pour chaque compartiment à tranches (la chambre d’interface décrite se compose de deux compartiments) et placez-les l’un sur l’autre.
- Placez de fines cordes de coton autour des papiers filtres de 4 cm x 2 cm à l’intérieur des compartiments pour briser la tension de la solution. Assurer un débit uniforme (ici, des collants en nylon noir coupés à des cordes minces ~10 cm de longueur sont utilisés; pour le placement, voir figure 1).
- Placez de petits morceaux de papier filtre sur les plus gros papiers filtrants à l’intérieur des compartiments à tranches. Les petits morceaux de tissu filtrant doivent être à peu près de la taille d’une tranche de cerveau (~1,5 cm x ~1,0 cm) et permettront une manipulation plus poussée des tranches individuelles. Placez trois à quatre petits morceaux de papier filtre dans chaque compartiment.
- Assurer un débit aCSF de 1,8 mL/min avec une pompe péristaltique.
- Carbogénate et préguerre la chambre d’interface à ~35 °C (la température finale de la tranche doit être ~32 °C).
4. Mise en place de la zone de préparation
REMARQUE : La préparation peut être effectuée dans des conditions stériles pour éviter la contamination et allonger la survie des tranches. Cependant, tous les vibromètres ne s’adaptent pas sous une hotte stérile, et d’autres mesures sont nécessaires pour réduire la contamination pendant la préparation. Cette section décrit certaines de ces mesures.
- Essuyez la zone de préparation avec 70% d’EtOH et placez soit du papier d’aluminium ou des couvercles stériles sur le dessus de la zone.
- Préparez de la colle super, deux pinces pointues, une spatule, un scalpel avec des lames, et une lame pour la coupe grossière du tissu cérébral. Les outils peuvent être stérilisés avant la procédure pour réduire la contamination.
- Essuyez le plateau tampon et la plaque de spécimen du vibratome avec 70% EtOH. Une fois que le plateau tampon est entièrement sec, couvrez-le de papier d’aluminium et placez le plateau dans le bain de glace. Remplir le bain de glace de glace et conserver à -20 °C jusqu’à la préparation.
- Essuyez le vibratome et la lame de rasoir avec 70% d’EtOH et calibrez le vibratome pour minimiser les vibrations verticales et les dommages tissulaires pendant la procédure de tranchage.
5. Découpage et stockage des tissus
- Directement après la résection, placer le tissu immédiatement dans l’aCSF froid et carbogené de choline et le transport rapidement au laboratoire.
ATTENTION : Portez des gants et un masque facial en tout temps pendant la préparation, puisque les tissus cérébraux humains peuvent contenir des agents pathogènes potentiels. En outre, le port d’un masque facial lorsqu’il ne travaille pas sous une hotte stérile réduira considérablement la contamination des solutions et des tissus cérébraux. - Retirer le tissu de la choline aCSF et couper toutes les parties brûlées de tissu.
- Couper une surface uniforme pour coller le morceau de tissu sur la plaque de spécimen, tout en considérant l’angle de coupe et les couches de tissu. Idéalement, une tranche hippocampale contient DG, CA1-4, et (si possible) subiculum.
- Couper le tissu cérébral en tranches de 400 μm d’épaisseur et ajuster l’amplitude et la vitesse pendant la coupe. En raison de pia mater restant possible, le tissu cérébral humain montre plus de résistance et peut exiger une coupe plus lente.
REMARQUE : L’épaisseur des tranches affecte grandement soit le réseau disponible (plus de neurones en tranches plus épaisses) soit la viabilité de la tranche (pénétration de la solution dans la tranche). Nous avons utilisé 500 tranches de μm pour augmenter le micro-réseau potentiellement disponible, et nous n’avons pas pu observer les différences dans l’induction de l’activité épileptiforme. 300 tranches de μm sont couramment utilisées pour des expériences de pince à patch, bien que l’induction de l’activité épileptiforme dans ces tranches n’ait pas encore été testée ici. Nous utilisons 400 μm comme épaisseur standard de tranche, bien que des tranches de 300 à 500 μm puissent être suffisantes. - Avant de la collecte, utilisez un scalpel pour réduire la taille des tranches de cerveau pour s’insérer dans la chambre d’enregistrement. Pour l’utilisation de la chambre membranante (voir la section 6), les tranches doivent être au maximum 1,5 cm x 1 cm. Tout en réduisant, considérez les couches et les connexions spécifiques nécessaires pour être enregistrées (p. ex., pour l’enregistrement dans le CA1 et le DG, coupez le subiculum et les tissus blancs environnants).
- À l’aide d’une spatule et de petits forceps, placez soigneusement les tranches dans la chambre d’interface sur de petits papiers de filtre et laissez-les reposer pendant ~1 h dans l’ACSF jusqu’à l’enregistrement.
- Les tranches peuvent être enregistrées jusqu’à 20 h (encore plus longtemps dans des conditions stériles).
6. Enregistrement de l’activité épileptiforme
- Dans la chambre membranaire (chambre d’enregistrement de type submergé), placez la tranche de cerveau sur une membrane transparente semi-perméable, qui est collée à un anneau en plastique24. Pour cela, utilisez de la colle super pour attacher l’anneau en plastique à la membrane d’un insert de culture cellulaire.
- Utilisez un scalpel pour enlever toute membrane à l’extérieur de l’anneau en plastique. Assurez-vous que la membrane est uniforme et entièrement attachée à l’anneau avant de placer la membrane dans la chambre.
REMARQUE : La membrane peut être stockée en ddH2O à 4–8 °C et réutilisée jusqu’à 1 mois. Gardez la membrane humide en tout temps. - L’entrée et la sortie de la chambre membranaire sont reliées à des tubes pour l’alimentation des solutions. Placez les tubes dans une pompe péristaltique de sorte que l’afflux et la sortie se déplacent dans des directions opposées.
- Placez le tube d’entrée et de sortie dans l’aCSF carbogéné et préguerre jusqu’à ce que tous les tubes et la chambre soient remplis de solution. Ajuster la vitesse de la pompe péristaltique pour obtenir un débit uniforme de 10–13 mL/min.
REMARQUE : La chambre membranaire utilisée ici est une chambre d’enregistrement de type submergé à débit élevé permettant un flux de solution allant jusqu’à 14 mL/min24. Dans le cas de l’utilisation d’une autre chambre d’enregistrement de type submergé, les débits doivent être ajustés. Cependant, pour l’induction de l’activité épileptiforme, il est fortement recommandé d’utiliser la chambre membranaire. - Utiliser un élément chauffant relié à l’entrée à proximité de la chambre membranaire pour assurer une température stable de 32 °C.
- Préparer des pipettes en verre 1 à 2 MΩ à l’aide d’un puller vertical. Remplissez les pipettes avec une solution NaCl de 154 mM et placez-les dans un support d’électrodes.
- À l’aide d’une pince à épiler et d’une spatule, retirer une tranche d’hippocampe de la chambre d’interface en prenant la tranche avec le petit papier filtre et en plaçant les deux dans une boîte de Pétri remplie d’aCSF carbogené. Retirez le petit papier filtre de la tranche hippocampale et (si nécessaire) appliquez une certaine force à l’aide d’une pipette pour séparer la tranche du papier filtre. Veillez à ne pas retourner la tranche.
- Placez la tranche dans la chambre d’enregistrement et maintenez-la en place à l’aide d’un filet de coupe.
REMARQUE : En raison du principe de Bernoulli, dans la chambre à membrane de type submergé utilisée, les tranches sont généralement stables sans avoir recours à une maille de tranche supplémentaire. - Placez les électrodes dans la région et la couche d’intérêt (ici, CA1) et commencez à enregistrer.
- Enregistrement de l’activité potentielle sur le terrain en mode de serrage actuel avec un taux d’échantillonnage de 10 à 20 kHz et un passage bas filtré à 2 kHz.
- Enregistrer l’activité basale dans l’ACSF jusqu’à 5 min.
- Passez les tubes d’entrée de l’ACSF à highK++4AP ou lowMg2++BIC aCSF et le tube de sortie vers un conteneur à déchets pour éviter le mélange des solutions. Après 2 min, placez le tube de sortie dans la même solution que l’entrée pour conserver la solution.
- L’activité de rafale induite par highK++4-AP doit être visible 2–5 min après le lavage. Toutefois, l’induction des SLEs par lowMg2++BIC peut prendre jusqu’à 30 min. Si nécessaire, changez soigneusement la position des électrodes pour obtenir des résultats optimaux.
- Une fois dans la position finale, enregistrez l’activité de base pendant au moins 20 min. Si vous enregistrez des SLE, envisagez des enregistrements de base plus longs en raison de la faible fréquence des SLE.
- Dans le cas où l’activité de base est stable (plateau de fréquence des événements), laver dans le médicament désiré. Notez qu’en raison du débit élevé de lavage des médicaments ne prend que 2 à 5 min, ce qui permet un échange rapide de solutions.
- Enregistrer l’activité pendant l’application de drogue d’au moins 20 min, après lavage. L’activité doit être stable pendant au moins 60 à 90 min, ce qui permet des enregistrements plus longs.
7. Analyse
- L’analyse de la fréquence et de l’amplitude peut être effectuée avec n’importe quel logiciel disponible. Jusqu’à présent, nous n’avons pas été en mesure d’établir une analyse automatique fiable des SLE ou de l’activité de rafales, et nous avons plutôt utilisé une analyse semi-automatisée avec la confirmation visuelle de l’activité identifiée.
- L’activité de rafale est caractérisée par une déviation biphasique, positive et négative et une durée de ≥100 ms. Tous les événements visuellement identifiés comme une activité d’éclatement (p. ex., semi-automatique par analyse de seuil) doivent être indiqués manuellement pour une analyse plus poussée de la fréquence des événements (intervalle interévéniel, IEI), de l’amplitude et du nombre total d’événements au cours de la période analysée.
REMARQUE : En raison de la fréquence élevée de l’activité d’éclatement, les 5 dernières minutes de chaque phase d’application sont généralement analysées20. - Les ELS peuvent être analysés comme décrit dans Heuzeroth et coll. Identified SLEs peuvent être analysés plus en détail pour la durée, l’amplitude, la fréquence des pointes et la durée de la durée de phase tonique (pic à haute fréquence) par rapport à la durée de phase clonique (picage à faible fréquence). Les SLE de durée de l’an 10 doivent être exclus de l’analyse.
NOTE : Pour l’évaluation préclinique des substances antiépileptiques possibles, les effets sur l’activité d’éclatement (induite par highK++4AP) sont à l’étude, en raison de l’induction établie dans le tissu hippocampal réséqué. Des résultats préliminaires sur l’induction d’ESL utilisant lowMg2++BIC ont été rapportés (Figure 2), bien que l’analyse de ces données ne soit pas incluse ici.
Résultats
L’activité épileptiforme a été enregistrée avec succès dans le tissu hippocampal humain réséqué provenant d’un jusqu’à 15 patients. L’établissement de procédures stables de transport et de préparation est essentiel pour l’induction réussie de l’activité épileptiforme dans le tissu cérébral humain. Les résultats récemment publiés ont montré 1) induction stable de l’activité épileptiforme dans le tissu réséqué de différents patients ainsi que 2) l’utilisation du tissu cérébral humain réséqué comme outil préclinique pour l’évaluation des nouveaux mécanismes antiépileptiques14,20.
Application de l’activité épileptiforme induite par highK++4-AP sous forme d’activité d’éclatement en quelques minutes (Figure 2A,B,C,D). En raison d’une faible distribution neuronale dans le tissu hippocampal humain ou d’une perte élevée de cellules neuronales due à l’épilepsie du lobe temporal (TLE), le placement des électrodes peut être ajusté au début de l’enregistrement. Dans les cas où l’activité de rafales de tranches n’est pas visible dans la zone CA1 après 10 min (indépendamment du placement d’électrodes), la viabilité des tranches peut être compromise et la tranche devra être remplacée.
Les SLE, d’une durée de >10 s, peuvent être induites avec l’application de lowMg2++BIC (Figure 2E,F). La figure 2E montre l’induction stable des SLE après quelques minutes et une fréquence stable tout au long de l’enregistrement. Ici, l’activité de SLE a été avec succès induite dans deux des quatre tranches du patient étudié. Une tranche n’a montré qu’une poussée d’activité après 15 min d’activité des SE, tandis que l’autre tranche ne présentait pas de SLE même après 40 min.
Pour l’évaluation préclinique des effets de substance, un effet antiépileptique potentiel sur l’activité d’éclatement induite par highK++4-AP a été étudié. Des substances antiépileptiques connues et potentielles (lacosamide, DMEA, dynorphine14)ont été testées, et des exemples sont montrés ici pour le lacosamide AED conventionnel (un bloqueur de canal de sodium) ainsi que DMEA (une nouvelle substance antiépileptique potentielle)20. Le nombre d’événements et l’intervalle interévéniel (IEI) des événements d’éclatement ont diminué à la fois lors de l’application du lacosamide et de la DMEA (figure 3C), bien que les amplitudes n’aient pas été affectées (figure 3D). Dans un sous-ensemble de tranches, même si l’induction d’événements éclatés a été réalisée dans les premières minutes, la fréquence de l’activité ne s’est pas rétablie pendant le lavage des DEA appliqués (données non indiquées ici, voir Kraus et al.20). En l’espèce, les médicaments appliqués ont été considérés comme induisent des effets; cependant, des diminutions de l’activité en rafale peuvent avoir été affectées par la dégradation progressive de l’activité pendant les enregistrements longs. Ainsi, les résultats doivent être interprétés avec soin.
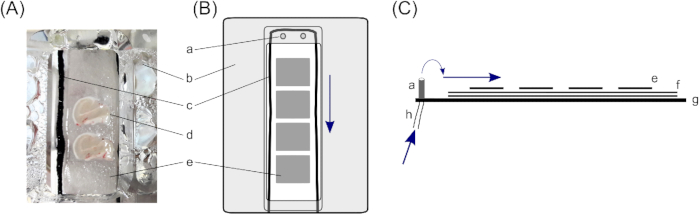
Figure 1 : Chambre d’interface. Pour le stockage des tranches de cerveau hippocampal humaines, une chambre d’interface avec deux compartiments de fixation de tranche de cerveau est employée (A); spécifiquement, une chambre d’interface de type Haas23. Ici, les tranches de cerveau hippocampal reposent sur (d) trois couches de papier filtre, (e) de plus petits morceaux pour permettre la manipulation des tranches de cerveau individuelles, et (f) plus grandes pièces de papier filtre pour assurer une couche suffisante de solution sous la tranche. (c) Une chaîne de coton entourant les tranches de cerveau, sur le dessus des papiers de filtre, assure le flux même de solution des entrées au (a) dessus du compartiment. bb) Un couvercle de couverture dirige l’oxygène du dessous du compartiment sur la tranche. (B) Vue supérieure d’un compartiment à tranches. (C) Vue latérale pour illustrer les couches de papiers filtre. g) Bas de la chambre. hh) Tube pour l’entrée de solution, qui est relié à une pompe péristaltique (les flèches bleues marquent la direction du flux de solution). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
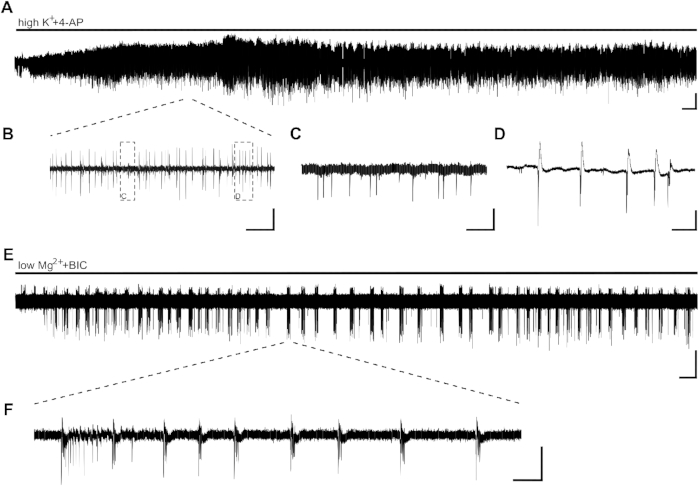
Figure 2 : Activité épileptiforme dans les tranches hippocampales humaines induites par highK++4-AP et lowMg2++BIC. Exemple d’enregistrements et d’extraits d’application de highK+ (8 mM)+4-AP (100 μM) (A,B,C,D) et lowMg2++BIC (10 μM) (E,F). (A) L’application de bain de highK++4-AP induit l’activité épileptiforme en quelques minutes, et l’activité est stable pendant au moins 60 min. Détails de (A) peut être vu dans (B). Deux types d’activité différents sont induits dans la zone CA1 des tranches hippocampales humaines : les pointes interictales (C, détails de [B]) et l’activité de rafale (D, détails de [B]). Il a été démontré que l’activité de l’éclatement était sensible aux médicaments antiépileptiques et qu’elle était donc analysée pour déterminer l’effet des substances antiépileptiques potentielles (figure 3). (E,F) L’application de lowMg2++BIC induit des RE À UNE D’une durée de >10 s (F) en CA1 en quelques minutes. Cependant, l’induction des SLEs peut prendre jusqu’à 30 min dans d’autres tranches. Barres d’échelle = 0,2 mV, 2 min (A,E), 5 s (B), 500 ms (C,D), 5 min (E) et 2 s (F). Ce chiffre a été adapté de Kraus et coll.20. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
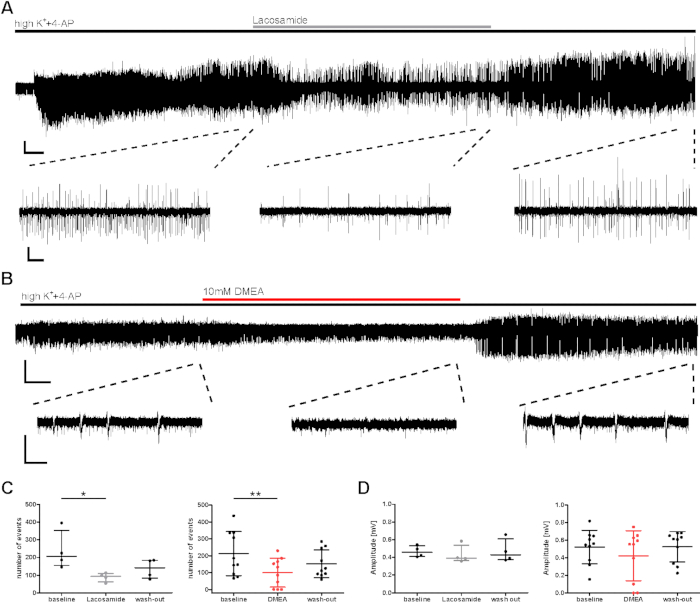
Figure 3 : Diminution de l’activité épileptique des tranches humaines pendant l’application du lacosamide ou de la DMEA. L’activité de rafale a diminué pendant l’application de (A) lacosamide et (B) DMEA, une nouvelle molécule antiépileptique potentielle. (A) et B) présentent des enregistrements exemplaires de la zone CA1 avec des extraits de régions utilisées pour l’analyse dans les points C et (D). L’activité de l’éclatement a diminué pendant l’application de lactosamide (100 μM) et de DMEA (10 mM), comme en témoignent les extraits du milieu et augmente à nouveau pendant le lavage. (C,D) Le nombre et l’amplitude de l’activité de rafale ont été analysés pendant les 5 dernières minutes de chaque phase d’application (ligne de base, lacosamide/DMEA, lavage) et montrés comme résultats résumés pour tous les patients (nombre d’événements, C; amplitude, D) comme moyenne ± DD. Chaque point indique un patient. Les astérisques marquent des différences significatives telles qu’évaluées par l’essai Friedman et post-hoc avec la comparaison multiple par Dunnett des groupes pour l’analyse de l’application de lactosamide (*p < 0,05, n = 4) ou par mesure répétée ANOVA et post-hoc avec la comparaison de Tukey pour l’analyse de l’application DMEA (**p < 0,01, n = 10). Barres d’échelle = 0,2 mV, 2 min (enregistrement complet, A), 5 s (extraits, A), 3 min (enregistrement complet, B) et 1 s (extraits, B). Ce chiffre a été adapté de Kraus et coll.20. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
| Solution 1.1 choline aCSF | |||
| Substance | Concentration de 10x (mM) | Concentration de 1x (mM) | Note |
| choline Cl | 1100 | 110 | |
| (+)-Na L-ascorbate | 116 | 11.6 | |
| MgCl2x6H2O | 70 | 7 | |
| Na pyruvate | 31 | 3.1 | |
| Kcl | 25 | 2.5 | |
| NaH2PO4 | 12.5 | 1.25 | |
| NaHCO3 | 260 | 26 | |
| CaCl2 | - | 0.5 | ajouter à la solution finale |
| Glucose | - | 10 | ajouter à la solution finale |
| Solution 1.2 aCSF | |||
| Substance | Concentration de 10x (mM) | Concentration de 1x (mM) | Note |
| Nacl | 1290 | 129 | |
| NaH2PO4 | 12.5 | 1.25 | |
| CaCl2 | 16 | 1.6 | |
| Kcl | 30 | 3 | |
| MgSO4 | 18 | 1.8 | |
| Glucose | - | 10 | ajouter à la solution finale |
| Solution 1.3 highK++4-AP aCSF | |||
| Substance | Concentration de 10x (mM) | Concentration de 1x (mM) | Note |
| Nacl | 1240 | 124 | |
| NaH2PO4 | 12.5 | 1.25 | |
| CaCl2 | 16 | 1.6 | |
| Kcl | 80 | 8 | |
| MgSO4 | 18 | 1.8 | |
| Glucose | - | 10 | ajouter à la solution finale |
| 4-AP | - | 0.1 | ajouter à la solution finale |
| Solution 1.4 lowMg2++BIC acsf | |||
| Substance | Concentration de 10x (mM) | Concentration de 1x (mM) | Note |
| Nacl | 1300 | 130 | |
| NaH2PO4 | 12.5 | 1.25 | |
| CaCl2 | 16 | 1.6 | |
| Kcl | 30 | 3 | |
| Glucose | - | 10 | ajouter à la solution finale |
| Bic | - | 0.01 | ajouter à la solution finale |
| Solution 2 | |||
| Substance | Concentration de 10x (mM) | Concentration de 1x (mM) | Note |
| NaHCO3 | 210 | 21 | |
Tableau 1 : Préparation de solutions 10x et 1x finales pour le transport, la préparation et l’enregistrement.
Discussion
Vivre réséqué tissu cérébral humain est un outil très précieux dans l’évaluation préclinique des DEA, car il représente correctement un micro-réseau cérébral humain intact. Le protocole présenté décrit une méthode pour le transport et la préparation des tissus, qui assure des tranches hippocampales de haute qualité ainsi qu’une méthode d’induction stable pour l’activité épileptiforme critique pour l’évaluation du DEA.
L’étude de l’activité épileptiforme ainsi que les méthodes d’induction chimique ou électrique dans les tranches du cerveau humain ont été précédemment montrés par d’autres groupes17,20,21,22. Ce protocole décrit l’induction de l’activité d’éclatement stable en tranches de différents patients via l’application de K élevé++4-AP ainsi que l’induction de SLE dans la zone CA1 via l’application de faible Mg2 ++BIC. Il a été constaté que l’induction de l’activité de rafale est plus cohérente (80% des tranches testées dans 15 patients) que l’induction des SLE (50% des tranches testées dans un patient). Cependant, jusqu’ici, l’induction des SLE n’a été testé que chez un patient. Néanmoins, l’induction des SLE par mgbas 2++BIC est recommandée, car les RES n’ont pas encore pu être induites à l’aide de K++4-AP élevé.
Plusieurs études ont introduit des méthodes de transport et de préparation des tissus cérébraux humains et mettent souvent en évidence trois facteurs essentiels à la survie neuronale : le temps de transport, les solutions de transport utilisées et les conditions de stockage.
Pour une viabilité optimale des tranches, certains groupes suggèrent que le transport du tissu cérébral réséqué soit aussi court que possible. Cependant, les salles d’opération et les laboratoires sont rarement à proximité, ce qui signifie que la qualité des tranches peut être compromise en raison du long transport. Certains groupes ont surmonté cet obstacle en appliquant la constante O2 à la solution pendant le transport12. Nous avons transporté des tissus cérébraux pour de courtes (max = 15 min) et de longues (jusqu’à 1 h) périodes de temps sans constante supplémentaire O2 approvisionnement pendant le transport, similaire à d’autres groupes18,25. Dans ces cas, des différences dans la qualité de tissu n’ont pas été observées pendant les enregistrements épileptiformes. En communication avec d’autres groupes de notre institut, la qualité des tranches n’a pas changé non plus pour les expériences de pince à patch. En revanche, la variance de la qualité des tissus provient peut-être de dommages pendant les opérations, la résection prolongée et la procédure de tranchage.
En ce qui concerne le transport et la solution de coupe, toutes les méthodes publiées omettent le NaCl des solutions visant à réduire l’enflure cellulaire due à la pression osmotique, similaire à la procédure standard pour les expériences de pince à taches de rongeurs. Cependant, plusieurs substituts ont été introduits jusqu’à présent (c.-à-d. aCSF13,22,NMDG-based aCSF12,26, et choline-based aCSF27). Ting et ses collègues ont introduit l’ACSF basé sur le NMDG pour la préparation des tranches en2014 26 et ont par la suite ajouté un protocole de récupération, qui réintroduit lentement nacl aux tranches28. Cependant, comme décrit par Ting et coll., les neurones du tissu cérébral préparés dans l’ACSF à base de NMDG montrent une résistance plus élevée à la membrane, affectant ainsi le joint des cellules entières au cours des expériences de correction-clamp26. Par conséquent, nous sommes passés de l’ACSF basé sur NMDG à l’utilisation d’aCSF20basé sur la choline , qui produit des tranches de haute qualité pour le potentiel de champ et les enregistrements de correction-clamp.
En ce qui concerne le stockage des tranches, il est généralement admis que les conditions d’interface fournissent une oxygénation optimale critique pour la survie à longue tranche18. Cependant, d’autres groupes montrent la survie des tranches jusqu’à 72 h dans des conditions submergées12. Contrairement à l’hypothèse précédente, les tranches de cerveau humain semblent être plus résistantes à une faible oxygénation ou à un stress oxydatif par rapport aux tranches de rongeurs. Principalement, les chambres d’interface ont été précédemment employées pour stocker des tranches d’hippocampe humaines, bien que les conditions submergées soient recommandées pour le maintien des tranches de cerveau humaines dans des expériences de correction-clamp.
Comme d’autres groupes l’ont vu, une étape critique supplémentaire pour la survie des tranches longues (interface pour <48 h18, submergée pour <72 h12) est la prévention de la contamination bactérienne. Les tranches cérébrales des rongeurs sont généralement utilisées dans les enregistrements électrophysiologiques jusqu’à 8 h, et la contamination bactérienne n’est pas considérée comme ayant une incidence sur la viabilité des tranches pendant cette période. Un grand nombre de tranches préparées à partir d’une résection et la disponibilité rare de tissus cérébraux humains souligne la nécessité de prolonger la viabilité des tranches de cerveau humain. Cette méthode décrit avec succès la préparation de tranches vivantes du cerveau hippocampal humain, qui peuvent facilement être adaptés à des conditions stériles. Cependant, pour les enregistrements effectués ici, la survie en tranches s’étendant sur 20 h n’était pas une priorité.
L’enregistrement dans les chambres d’interface s’est également avéré essentiel pour l’induction de l’activité épileptiforme telle que les SLE22. Les conditions submergées, dues à une faible oxygénation, sont rarement utilisées pour l’enregistrement des ETL; cependant, ils sont nécessaires pour la haute résolution optique nécessaire pour les expériences de correction-clamp. L’utilisation d’une chambre d’enregistrement de type immergé optimisée permet d’enregistrer l’activité épileptiforme (champ extracellulaire ou neurone unique) dans les tranches du cerveau humain, en raison d’une forte oxygénation et d’une application rapide des médicaments29. Ici, les méthodes et les résultats pour les enregistrements potentiels sur le terrain sont décrits, mais il convient de souligner que les enregistrements patch-clamp ont été exécutés avec succès dans les tranches de souris et de cerveau humain à l’aide de cette chambre d’enregistrement modifiée (données non montrées).
Le tissu cérébral humain réséqué a une valeur translationnelle plus élevée que les modèles de rongeurs. Il représente un réseau neuronal adulte et malade qui ne peut pas être reproduit par les iPSC. Cependant, comme dans n’importe quel système in vitro, les tranches de cerveau humain ne représentent pas un cerveau humain intact. En outre, les réseaux neuronaux enregistrés de tissu cérébral réséqué peuvent subir des changements moléculaires et fonctionnels substantiels dus aux dommages pendant l’opération ou la préparation. Il a été démontré que les procédures de tranchage affectent la fonction GABAergic et peuvent affecter l’induction de l’activité épileptiforme30. Ces limitations doivent être envisagées lors de la formulation d’une hypothèse. Lors de l’essai de médicaments antiépileptiques potentiels, l’utilisation de différentes zones du cerveau devrait être envisagée, car les cibles médicamenteuses pourraient ne pas être exprimées dans toutes les régions du cerveau humain ou tous les patients. En particulier, l’hippocampe des patients de TLE montrent souvent des signes de sclérose hippocampal accompagnée de perte grave de cellules neuronales. Il est recommandé d’obtenir des informations sur les changements pathologiques et les antécédents de la maladie, tels que les réfractaires potentiels à l’égard des médicaments, et d’envisager cela lors de l’interprétation des données.
En conclusion, cette méthode décrit avec succès la préparation des tranches vivantes du cerveau hippocampal humain et des techniques d’induction pour enregistrer deux types différents d’activité épileptiforme. Étant donné que la disponibilité de tissus cérébraux humains vivants est rare, des conditions de transport et d’enregistrement optimisées devraient être utilisées pour assurer une production maximale d’expériences utilisant des tranches de cerveau humains. Il est suggéré que le tissu cérébral humain réséqué peut être employé comme outil de validation préclinique en plus des modèles de rongeur et des expériences de culture cellulaire.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Nous remercions Mandy Marbler-Pötter (Charite-Unversitätsmedizin, Berlin) pour son excellente assistance technique. P.F. a été financé par la Fondation allemande de recherche (DFG, Deutsche Forschungsgemeinschaft) dans le cadre de la stratégie d’excellence de l’Allemagne-EXC-2049-390688087. Ce travail a été soutenu par le QUEST Center for Transforming Biomedical Research de l’Institut de santé de Berlin.
matériels
| Name | Company | Catalog Number | Comments |
| (+)-Na L-ascorbate | Sigma Aldrich | A4034 | |
| 4-AP | Sigma Aldrich | 275875-5G | |
| Blades | eliteSERVE GmbH | HW3 | used for the vibratome |
| CaCl2 | Merck | 102382 | |
| Choline Cl | Sigma Aldrich | C1879 | |
| Filter paper | Tiffen | EK1546027T | |
| Gas-tight bottle caps | Carl Roth GmbH+Co.KG | E694.1 | |
| Glass filaments | Science Products | GB150F-8P | for recording electrodes |
| Glass gas disperser | DWK Life Sciences GmbH | 258573309 | |
| Glucose | Sigma Aldrich | G7528 | |
| Interface Chamber | inhouse made | - | see Haas et al., 1979 |
| KCl | AppliChem | 131494.1210 | |
| Membrane (Cell culture inserts) | Merck | PICM030050 | |
| Membrane chamber | inhouse made | - | see Hill and Greenfield, 2011 |
| MgCl2?6H2O | Carl Roth | HNO3.2 | |
| MgSO4 | Sigma Aldrich | M7506 | |
| Na pyruvate | Sigma Aldrich | P8574 | |
| NaCl | Carl Roth | 3957.1 | |
| NaH2PO4 | Merck | 106346 | |
| NaHCO3 | Carl Roth | HNO1.2 | |
| Peristaltic pump | Gilson | Minipuls 3 | |
| Slice holder | Warner instruments | SHD-41/15 | |
| Vertical puller | Narishige | PC-10 | |
| Vibratome | Leica | VT1200S |
Références
- Hirtz, D., et al. How common are the "common" neurologic disorders. Neurology. 68 (5), 326-337 (2007).
- Ngugi, A. K., Bottomley, C., Kleinschmidt, I., Sander, J. W., Newton, C. R. Estimation of the burden of active and life-time epilepsy: a meta-analytic approach. Epilepsia. 51 (5), 883-890 (2010).
- Kwan, P., Brodie, M. J. Early Identification of Refractory Epilepsy. New England Journal of Medicine. 342 (5), 314-319 (2000).
- Löscher, W. Critical review of current animal models of seizures and epilepsy used in the discovery and development of new antiepileptic drugs. Seizure. 20 (5), 359-368 (2011).
- Ledri, M., et al. Differential Effect of Neuropeptides on Excitatory Synaptic Transmission in Human Epileptic Hippocampus. The Journal of Neuroscience: the official journal of the Society for Neuroscience. 35 (26), 9622-9631 (2015).
- Qi, X. R., et al. Alterations in the steroid biosynthetic pathways in the human prefrontal cortex in mood disorders: A post-mortem study. Brain Pathology. 28 (4), 536-547 (2018).
- Verwer, R. W. H., et al. Post-mortem brain tissue cultures from elderly control subjects and patients with a neurodegenerative disease. Experimental Gerontology. 38 (1-2), 167-172 (2003).
- Verwer, R. W. H., et al. Cells in human postmortem brain tissue slices remain alive for several weeks in culture. FASEB journal official publication of the Federation of American Societies for Experimental Biology. 16 (1), 54-60 (2002).
- Le Maître, T. W., Dhanabalan, G., Bogdanovic, N., Alkass, K., Druid, H. Effects of Alcohol Abuse on Proliferating Cells, Stem/Progenitor Cells, and Immature Neurons in the Adult Human Hippocampus. Neuropsychopharmacology. 43 (4), 690-699 (2018).
- Dennis, C. V., Suh, L. S., Rodriguez, M. L., Kril, J. J., Sutherland, G. T. Human adult neurogenesis across the ages: An immunohistochemical study. Neuropathology and Applied Neurobiology. 42 (7), 621-638 (2016).
- Verwer, R. W. H., et al. Mature astrocytes in the adult human neocortex express the early neuronal marker doublecortin. Brain. 130 (12), 3321-3335 (2007).
- Ting, J. T., et al. A robust ex vivo experimental platform for molecular-genetic dissection of adult human neocortical cell types and circuits. Scientific Reports. 8 (1), 8407 (2018).
- Le Duigou, C., et al. Imaging pathological activities of human brain tissue in organotypic culture. Journal of Neuroscience Methods. 298, 33-44 (2018).
- Agostinho, A. S., et al. Dynorphin-based "release on demand" gene therapy for drug-resistant temporal lobe epilepsy. EMBO molecular medicine. 11 (10), 9963 (2019).
- Hodge, R. D., et al. Conserved cell types with divergent features in human versus mouse cortex. Nature. 573 (7772), 61-68 (2019).
- Beaulieu-Laroche, L., et al. Enhanced Dendritic Compartmentalization in Human Cortical Neurons. Cell. 175 (3), 643-651 (2018).
- Sandow, N., et al. Drug resistance in cortical and hippocampal slices from resected tissue of epilepsy patients: no significant impact of p-glycoprotein and multidrug resistance-associated proteins. Frontiers in Neurology. 6, 30 (2015).
- Wickham, J., et al. Prolonged life of human acute hippocampal slices from temporal lobe epilepsy surgery. Scientific Reports. 8 (1), (2018).
- Avoli, M., Jefferys, J. G. R. Models of drug-induced epileptiform synchronization in vitro. Journal of Neuroscience Methods. , (2015).
- Kraus, L., et al. Dimethylethanolamine Decreases Epileptiform Activity in Acute Human Hippocampal Slices in vitro. Frontiers in Molecular Neuroscience. 12, 209 (2019).
- Antonio, L. L., et al. In vitro seizure like events and changes in ionic concentration. Journal of Neuroscience Methods. , (2016).
- Gabriel, S., et al. Stimulus and Potassium-Induced Epileptiform Activity in the Human Dentate Gyrus from Patients with and without Hippocampal Sclerosis. Journal of Neuroscience. 24 (46), 10416-10430 (2004).
- Haas, H. L., Schaerer, B., Vosmansky, M. A simple perfusion chamber for the study of nervous tissue slices in vitro. Journal of Neuroscience Methods. 1 (4), 323-325 (1979).
- Hill, M. R. H., Greenfield, S. A. The membrane chamber: a new type of in vitro recording chamber. Journal of neuroscience methods. 195 (1), 15-23 (2011).
- Andersson, M., et al. Optogenetic control of human neurons in organotypic brain cultures. Scientific Reports. 6, 24818 (2016).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. Acute brain slice methods for adult and aging animals: application of targeted patch clamp analysis and optogenetics. Methods in molecular biology. 1183, 221-242 (2014).
- Testa-Silva, G., et al. Human synapses show a wide temporal window for spike-timing-dependent plasticity. Frontiers in Synaptic Neuroscience. 2, 12 (2010).
- Ting, J. T., et al. Preparation of Acute Brain Slices Using an Optimized N-Methyl-D-glucamine Protective Recovery Method. Journal of Visualized Experiments. (132), (2018).
- Morris, G., Jiruska, P., Jefferys, J. G. R., Powell, A. D. A New Approach of Modified Submerged Patch Clamp Recording Reveals Interneuronal Dynamics during Epileptiform Oscillations. Frontiers in Neuroscience. 10, 519 (2016).
- Valeeva, G., Valiullina, F., Khazipov, R. Excitatory actions of GABA in the intact neonatal rodent hippocampus in vitro. Frontiers in Cellular Neuroscience. , (2013).
Erratum
Formal Correction: Erratum: Preparation of Acute Human Hippocampal Slices for Electrophysiological Recordings
Posted by JoVE Editors on 7/13/2020. Citeable Link.
An erratum was issued for: Preparation of Acute Human Hippocampal Slices for Electrophysiological Recordings. Step 2.1.3 in the Protocol was corrected.
Step 2.1.3 in the Protocol was updated from:
Add final concentrations of glucose and MgCl, then stir until dissolved (Table 1, solution 1.1).
to:
Add final concentrations of glucose and CaCl2, then stir until dissolved (Table 1, solution 1.1).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon