Method Article
Preparazione di fette acute di ippocampale umano per registrazioni elettrofisiologiche
In questo articolo
Erratum Notice
Riepilogo
Il protocollo presentato descrive il trasporto e la preparazione del tessuto ippocampale umano resected con l'obiettivo finale di utilizzare fette cerebrali vitali come strumento di valutazione preclinica per potenziali sostanze antietiche.
Abstract
L'epilessia colpisce circa l'1% della popolazione mondiale e porta a una grave diminuzione della qualità della vita a causa di convulsioni in corso e ad alto rischio di morte improvvisa. Nonostante l'abbondanza di opzioni di trattamento disponibili, circa il 30% dei pazienti è resistente ai farmaci. Diverse nuove terapie sono state sviluppate utilizzando modelli animali, anche se il tasso di pazienti farmacoresisteriati rimane inalterato. Uno dei motivi probabili è la mancanza di traduzione tra i modelli di roditori e gli esseri umani, come una debole rappresentazione della farmacosistenza umana nei modelli animali. Il tessuto cerebrale umano resected come strumento di valutazione preclinica ha il vantaggio di colmare questo divario tras translationale. Descritto qui è un metodo per la preparazione di alta qualità delle fette di cervello ippocampale umano e la successiva induzione stabile dell'attività epileptiforme. Il protocollo descrive l'induzione dell'attività di burst durante l'applicazione di 8 mM KCl e 4-aminopiridin. Questa attività è sensibile ai candidati lacosamide AED stabiliti o nuovi candidati antiepiletici, come la dimetelethanolamina (DMEA). Inoltre, il metodo descrive l'induzione di eventi simili a crisi epilettiche in CA1 di fette cerebrali dell'ippocampo umano mediante la riduzione di Mg2 e l'applicazione della bicucullina, un bloccantedel recettore GABA A. L'impostazione sperimentale può essere utilizzata per screening di potenziali sostanze antietiche per i loro effetti sull'attività epileptiforme. Inoltre, i meccanismi di azione postulati per composti specifici possono essere convalidati utilizzando questo approccio nel tessuto umano (ad esempio, utilizzando registrazioni patch-clamp). Per concludere, lo esame del tessuto cerebrale umano vitale ex vivo (qui, l'ippocampo risected da pazienti affetti da epilessia del lobo temporale) migliorerà l'attuale conoscenza dei meccanismi fisiologici e patologici nel cervello umano.
Introduzione
L'epilessia è uno dei disturbi neurologici più comuni, che colpisce l'1% della popolazione mondiale, ed è associata ad una maggiore morbilità emortalità 1,2. Purtroppo, un terzo dei pazienti affetti da epilessia sono resistenti ai farmaci, nonostante l'abbondanza di opzioni di trattamento disponibili tra cui più di 20 farmaci antiepilettici approvati (AED)3. La mancata traduzione dei risultati della ricerca sugli animali preclinici negli studi clinici è uno dei motivi per cui promettenti strategie di trattamento non sono efficaci in molti pazienti4. Recentemente, neuropeptide Y (NPY) e galanin hanno dimostrato di avere effetti antieettici nei modelli animali; anche se, quando testato nel tessuto cerebrale umano resected, solo NPY era efficace5.
La maggior parte delle conoscenze esistenti riguardanti i meccanismi neurologici di base e gli approcci di terapia della malattia derivano da modelli animali ed esperimenti di coltura cellulare. Anche se informativi, questi modelli rappresentano solo singoli aspetti delle malattie umane complesse e della rete cerebrale umana adulta. In alternativa, il tessuto cerebrale umano ha il potenziale per colmare il divario trasscolare, ma è raramente disponibile per studi funzionali. Per esempio, il tessuto cerebrale post mortem è stato uno strumento prezioso nello studio dell'espressione delle proteine, della morfologia del cervello o delle connessioni anatomiche, anche se l'attività neuronale è spesso compromessa èquesto tessuto 6,7,8,9,10,11.
Al contrario, il tessuto cerebrale umano resito vivente è stato studiato per quanto riguarda la valutazione preclinica dei farmaci, le funzioni neuronali di base e i modelli di espressionegenica 12,13,14,15,16,17. Un grande vantaggio delle fette di cervello umano rispetto alle fette di roditore è la lunga vitalità del tessuto neuronale dopo la resezione e la preparazione. Rispetto alle fette cerebrali dei roditori, che in genere possono essere registrate fino a 8 h dopo la preparazione, le fette del cervello umano mostrano un'attività neuronale stabile fino a 72 h, consentendo un'indagine approfondita di questi campioni rarie preziosi 12,18.
Diversi studi hanno studiato le proprietà dell'attività epileptiforme in varie aree del tessuto umano corticale e ippocampale risentito e hanno utilizzato diversi metodi per l'induzione dell'attività epileptiforme. Nelle fette di roditore, l'attività epileptiforme può essere indotta da diversi metodi: stimolazione elettrica delle cellule di Llar DG, aumento diK extracellulare (8-12 mM KCl), blocco dei recettori GABAA da bicucullina (BIC), blocco dei canali di potassio da 4-aminopiridina (4-AP) e rimozione o riduzione di Mg2 in soluzione extracellulare19. Tuttavia, l'induzione dell'attività epileptiforme nel tessuto umano richiede la combinazione di almeno due dei suddatimetodi 20,21,22.
Presentato qui è un metodo per la preparazione di fette di cervello ippocampale umano, che sono vitali per fino a 20 h e mostrano l'induzione di attività epileptiforme su applicazione dialta K (8 mM) e 4-AP o basso Mg2 e BIC.
Protocollo
I pazienti devono dare il consenso scritto informato prima del funzionamento e gli accordi etici necessari devono essere in vigore prima dell'esperimento. Per quanto riguarda i risultati rappresentativi, tutti gli studi che hanno coinvolto partecipanti all'uomo sono stati esaminati e approvati da Charité-Universit-ttsmedizin, Berlino (EA2/111/14).
1. Preparazione di soluzioni 10x
NOTA: A causa di difficoltà nella pianificazione dell'accesso al tessuto cerebrale umano, si consiglia di preparare soluzioni 10x come descritto qui. In alternativa, le soluzioni 1x finali possono essere preparate fresco aggiungendo singole sostanze in concentrazione finale all'acqua a doppia distillazione (ddH2O).
- Per le singole soluzioni 10x, aggiungere sostanze a ddH2O secondo la tabella 1 e mescolare fino a dissoluzione.
- Utilizzare 10x soluzioni fino a 1 mese dopo la preparazione (fino a 1 anno per congelato 10x colina aCSF).
- Per 10x colina aCSF, preparare 50 mL aliquots di 10x 1.1 colina aCSF (Tabella 1) e congelare a -20 gradi centigradi o -80 gradi centigradi fino a nuovo uso.
NOTA: Non aggiungere glucosio e CaClda 2 a 10x 1.1 colina aCSF per prevenire la contaminazione con batteri e la precipitazione del carbonato di calcio. - La soluzione 10x 2 può essere utilizzata per tutte le soluzioni finali 1x, mentre le soluzioni 10x 1.1–1.4 sono personalizzate e denominate di conseguenza (Tabella 1).
2. Preparazione di 1x soluzioni finali
NOTA: Le soluzioni 1x finali devono essere preparate il più presto possibile il giorno prima dell'uso. Tutte le soluzioni finali devono essere carbogenate con il 5% di CO2 e 95% O2 utilizzando un dispersore di gas di vetro per arricchire le soluzioni con ossigeno e regolare il pH a 7,4 (max - 7,4 x 0,2).
- Colina aCSF per il trasporto e la preparazione
- Per la soluzione finale da 500 mL, scongelare un aliquot da 50 mL della soluzione 10x 1.1 aliquot per la colina aCSF in bagno d'acqua da 37 gradi centigradi.
- Aggiungere l'aliquot scongelato da 50 mL della soluzione 10x 1.1 e 50 mL di soluzione 10x 2 a circa 300 mL di ddH2O.
- Aggiungere le concentrazioni finali di glucosio e CaCl2, quindi mescolare fino a dissoluzione(Tabella 1, soluzione 1.1).
- Aggiungere ddH2O ad un volume finale di 500 mL e misurare l'osmolarità (300 mOsm - 10 mOsm).
- Facoltativamente, utilizzare un filtro per sterilizzare la soluzione (vedere discussione sulla redditività prolungata delle sezioni in condizioni sterili).
- Riempire una bottiglia separata con circa 100 mL di 1x colina aCSF per il trasporto dalla sala operatoria al laboratorio.
- Facoltativo: a seconda del tempo di trasporto dalla sala operatoria al laboratorio, prendere in considerazione l'utilizzo di tappi di bottiglia a tenuta di gas per garantire un pH stabile di aCSF durante i periodi di trasporto più lunghi.
- Conservare la soluzione finale a 4-8 gradi centigradi fino a un ulteriore utilizzo.
- Il giorno dell'operazione, raffreddare 1x colina aCSF su ghiaccio e carbogenato per almeno 10-15 min utilizzando un dispersore di gas di vetro collegato al gas carbogeno (5% CO2, 95% O2).
NOTA: Considerare la possibilità di mantenere una bombola di gas accessibile alla sala operatoria in caso di tempi di attesa più lunghi, che richiederanno la ri-carbogenazione della soluzione di trasporto. Tuttavia, abbiamo trasportato il tessuto ippocampale senza ri-carbogenazione in tempi di trasporto lunghi e brevi (15 min contro 60 min) e non abbiamo osservato differenze nell'induzione dell'attività epileptiforme.
- aCSF per l'archiviazione e la registrazione
- Per una soluzione finale da 2 L, aggiungere 200 mL di soluzione 10x 1.2 (aCSF) e 200 mL di soluzione 10x 2 e glucosio (Tabella 1) a 1500 mL di ddH2O.
NOTA: I volumi delle soluzioni finali dipendono dagli esperimenti applicati e dal tipo di camera utilizzata per la memorizzazione e la registrazione. - Aggiungere ddH2O ad un volume finale di 2 L e misurare l'osmolarità (300 mOsm 10 mOsm).
- Preriwarm la soluzione a 35 gradi centigradi e carbogenato per almeno 10-15 minuti prima dell'uso.
- Per una soluzione finale da 2 L, aggiungere 200 mL di soluzione 10x 1.2 (aCSF) e 200 mL di soluzione 10x 2 e glucosio (Tabella 1) a 1500 mL di ddH2O.
- HighK-4-AP aCSF per l'induzione dell'attività di scoppio
- Per una soluzione finale da 1 L, aggiungere 100 mL di soluzione+1.3 (highK e 4-AP aCSF) e 100 mL di soluzione 10x 2 a 700 mL di ddH2O.
- Aggiungere il glucosio e 4-AP (concentrazione finale - 100 M) secondo la tabella 1.
- Aggiungere ddH2O al volume finale di 1 L e misurare l'osmolarità (300 mOsm 10 mOsm).
- Preriwarm la soluzione a 35 gradi centigradi e carbogenato per almeno 10-15 minuti prima dell'uso.
- LowMg2 scBaCSF per l'induzione di eventi simili a sequestri (SLE)
- Per una soluzione finale da 1 L, aggiungere 100 mL di soluzione 10x 1.4 (lowMg2, BIC aCSF) e 100 mL di soluzione 10x 2 a 700 mL di ddH2O.
- Aggiungere il glucosio e il BIC (concentrazione finale : 10 M) secondo la tabella 1.
- Aggiungere ddH2O al volume finale di 1 L e misurare l'osmolarità (300 mOsm - 10 mOsm).
- Preriwarm la soluzione a 35 gradi centigradi e carbogenato per almeno 10-15 minuti prima dell'uso.
3. Preparazione della camera di interfaccia
- In una camera di interfaccia, le fette poggiano su tre strati di carta da filtro per garantire una quantità sufficiente di soluzione sotto la fetta. Per fare questo, tagliare due pezzi di carta da filtro da 4 cm x 2 cm per ogni compartimento a fette (la camera di interfaccia descritta è costituita da due scomparti) e posizionarli uno sopra l'altro.
- Posizionare sottili corde di cotone intorno alle carte da filtro 4 cm x 2 cm all'interno dei compartimenti per rompere la tensione della soluzione. Garantire il flusso uniforme (qui, vengono utilizzati collant in nylon nero tagliati a corde tagliate a taglio sottile di 10 cm; per il posizionamento, vedere la Figura 1).
- Posizionare piccoli pezzi di carta da filtro sopra le carte filtro più grandi all'interno dei compartimenti a fette. I piccoli pezzi di tessuto filtranti devono avere all'incirca le dimensioni di una fetta del cervello (1,5 cm x 1,0 cm) e consentiranno un'ulteriore manipolazione delle singole fette. Posizionare da tre a quattro piccoli pezzi di carta da filtro in ogni vano.
- Assicurarsi una velocità di flusso aCSF di 1,8 mL/min con una pompa peristaltica.
- Carbogenate e prebellici la camera di interfaccia a 35 gradi centigradi (la temperatura finale della fetta deve essere di 32 gradi centigradi).
4. Configurazione dell'area di preparazione
NOTA: La preparazione può essere eseguita in condizioni sterili per evitare contaminazioni e allungare la sopravvivenza delle fette. Tuttavia, non tutti i vibratomi si adattano sotto un cappuccio sterile, e sono necessarie altre misure per ridurre la contaminazione durante la preparazione. In questa sezione vengono descritte alcune di queste misure.
- Pulire l'area di preparazione con 70% EtOH e posizionare sia la lamina di alluminio o coperture sterili sulla parte superiore della zona.
- Preparare super colla, due pinzette affilate, una spatola, un bisturi con lame e una lama per il taglio ruvido del tessuto cerebrale. Gli utensili possono essere sterilizzati prima della procedura per ridurre la contaminazione.
- Pulire il vassoio tampone e la piastra campione del vibratome con 70% EtOH. Una volta che il vassoio tampone è completamente asciutto, coprirlo con un foglio di alluminio e posizionare il vassoio nel bagno di ghiaccio. Riempire il bagno di ghiaccio con ghiaccio tritato e tenere a -20 gradi centigradi fino alla preparazione.
- Pulire il vibratome e la lama del rasoio con 70% EtOH e calibrare il vibrato per ridurre al minimo le vibrazioni verticali e i danni ai tessuti durante la procedura di affettatura.
5. Affettare e conservare i tessuti
- Direttamente dopo la resezione, posizionare immediatamente il tessuto in freddo, carbogenato colina aCSF e il trasporto rapidamente al laboratorio.
CAUTION: Indossare guanti e una maschera per il viso in ogni momento durante la preparazione, poiché il tessuto cerebrale umano può contenere potenziali agenti patogeni. Inoltre, indossare una maschera per il viso quando non si lavora sotto una cappa sterile ridurrà notevolmente la contaminazione delle soluzioni e del tessuto cerebrale. - Rimuovere il tessuto dalla colina aCSF e tagliare via eventuali porzioni bruciate di tessuto.
- Tagliare una superficie uniforme per incollare il pezzo di tessuto sulla piastra del campione, considerando l'angolo di taglio e gli strati di tessuto. Idealmente, una fetta di ippocampo contiene DG, CA1-4 e (se possibile) subiculum.
- Affettare il tessuto cerebrale in fette spesse 400 m e regolare l'ampiezza e la velocità durante il taglio. A causa di possibile pia mater rimanente, tessuto cerebrale umano mostra più resistenza e può richiedere un taglio più lento.
NOTA: Lo spessore delle sezioni influisce notevolmente sulla rete disponibile (più neuroni nelle fette più spesse) o sulla vitalità della sezione (penetrazione della soluzione nella sezione). Abbiamo usato fette di 500 m per aumentare la micro-rete potenzialmente disponibile e non abbiamo potuto osservare differenze nell'induzione dell'attività epileptiforme. Le fette di 300 m sono comunemente utilizzate per esperimenti di morsetto a patch, anche se l'induzione dell'attività epileptiforme in queste fette non è ancora stata testata qui. Usiamo 400 m come spessore standard della fetta, anche se possono essere sufficienti fette da 300 a 500 m. - Prima di raccogliere, utilizzare un bisturi per ridurre le dimensioni delle fette cerebrali per adattarsi alla camera di registrazione. Per l'uso della camera a membrana (vedi sezione 6), le fette devono essere al massimo 1,5 cm x 1 cm. Durante la riduzione, considerare i livelli e le connessioni specifici che dovevano essere intatti per la registrazione (ad esempio, per la registrazione nel CA1 e nella DG, tagliare il subiculum e il tessuto bianco circostante).
- Utilizzando una spatola e piccole forpe, posizionare con attenzione le fette nella camera di interfaccia su piccole carte da filtro e lasciarle riposare per 1 h in aCSF fino alla registrazione.
- Le fette possono essere registrate fino a 20 h (anche più lunghe quando sono in condizioni sterili).
6. Registrazione dell'attività epileptiforme
- Nella camera a membrana (camera di registrazione di tipo sommerso), posizionare la fetta di cervello su una membrana semipermeabile trasparente, che viene incollata ad un anello diplastica 24. Per questo, utilizzare super colla per attaccare l'anello di plastica alla membrana di un inserto di coltura cellulare.
- Utilizzare un bisturi per rimuovere qualsiasi membrana all'esterno dell'anello di plastica. Assicurarsi che la membrana sia uniforme e completamente attaccata all'anello prima di posizionare la membrana nella camera.
NOTA: La membrana può essere conservata in ddH2O a 4-8 gradi centigradi e riutilizzata per un massimo di 1 mese. Mantenere la membrana umida in ogni momento. - Sia l'afflusso che il deflusso della camera a membrana sono collegati ai tubi per la fornitura della soluzione. Posizionare i tubi in una pompa peristaltica in modo che l'afflusso e il deflusso si muova in direzioni opposte.
- Posizionare il tubo di afflusso e deflusso in carbogenato, preriscaldato aCSF fino a quando tutti i tubi e la camera sono pieni di soluzione. Regolare la velocità della pompa peristaltica per ottenere una velocità di flusso uniforme di 10-13 mL/min.
NOTA: La camera a membrana utilizzata qui è un'elevata frequenza di flusso, camera di registrazione di tipo sommerso che consente un flusso di soluzione fino a 14 mL/min24. Nel caso di utilizzo di una camera di registrazione di tipo sommerso diversa, le velocità di flusso devono essere regolate. Tuttavia, per l'induzione dell'attività epileptiforme, si consiglia vivamente di utilizzare la camera a membrana. - Utilizzare un elemento riscaldante collegato all'afflusso in prossimità della camera di membrana per garantire una temperatura stabile di 32 gradi centigradi.
- Preparare 1-2 MΩ di vetro con un puller verticale. Riempire le pipette con una soluzione NaCl da 154 mM e posizionarle in un supporto per elettrodi.
- Utilizzando una pinzetta e una spatola, rimuovere una fetta di ippocampo dalla camera di interfaccia prendendo la fetta con la piccola carta da filtro e mettendo entrambe in un piatto Petri riempito con aCSF carbogenato. Togliere la piccola carta da filtro dalla fetta dell'ippocampo e (se necessario) applicare una forza utilizzando una pipetta per separare la fetta dalla carta da filtro. Fare attenzione a non capovolgere la fetta.
- Posizionare la sezione nella camera di registrazione e tenerla in posizione utilizzando la mesh a sezione.
NOTA: A causa del principio di Bernoulli, nella camera di membrana di tipo sommersa utilizzata, le fette sono di solito stabili senza l'uso di una maglia a sezione aggiuntiva. - Posizionare gli elettrodi nella regione e nello strato di interesse (qui, CA1) e iniziare la registrazione.
- Registrare l'attività potenziale del campo in modalità morsetto corrente con una frequenza di campionamento di 10-20 kHz e a passaggio basso filtrata a 2 kHz.
- Registrare l'attività basale in aCSF per un massimo di 5 min.
- Passare i tubi di afflusso da aCSF ad highK,4AP o lowMg2,e il tubo di deflusso in un contenitore di scarto per evitare la miscelazione di soluzioni. Dopo 2 minuti, posizionare il tubo di deflusso nella stessa soluzione dell'afflusso per conservare la soluzione.
- L'attività di scoppioindottada highK - 4-AP dovrebbe essere visibile 2-5 minuti dopo il lavaggio. Tuttavia, l'induzione di SLE da bassoMg2 eBIC può richiedere fino a 30 min. Se necessario, modificare attentamente le posizioni degli elettrodi per ottenere risultati ottimali.
- Una volta nella posizione finale, registrare l'attività di base per almeno 20 min. Se si registrano SLE, prendere in considerazione registrazioni di base più lunghe a causa della bassa frequenza delle SLE.
- Nel caso in cui l'attività di base sia stabile (plateau della frequenza degli eventi), lavare il farmaco desiderato. Si noti che a causa del lavaggio ad alto flusso in farmaci richiede solo 2-5 min, consentendo uno scambio rapido della soluzione.
- Registrare l'attività durante l'applicazione del farmaco di almeno 20 min, dopo il lavaggio. L'attività deve essere stabile per almeno 60-90 min, consentendo registrazioni più lunghe.
7. Analisi
- L'analisi della frequenza e dell'ampiezza può essere eseguita con qualsiasi software disponibile. Finora, non siamo stati in grado di stabilire un'analisi automatica affidabile delle SLE o dell'attività di scoppio, e abbiamo invece utilizzato un'analisi semi-automatica con conferma visiva dell'attività identificata.
- L'attività burst è caratterizzata da deflessione bifasica, positiva e negativa e da una durata di 100 ms. Tutti gli eventi identificati visivamente come attività di burst (ad esempio, semi-automaticamente per analisi di soglia) devono essere indicati manualmente per un'ulteriore analisi della frequenza dell'evento (intervallo tra eventi, IEI), dell'ampiezza e del numero totale di eventi durante l'intervallo di tempo analizzato.
NOTA: a causa dell'alta frequenza di attività burst, gli ultimi 5 minuti di ogni fase dell'applicazione vengono in genere analizzati20. - Le SLE possono essere analizzate come descritto in Heuzeroth et al. Le SLE identificate possono essere ulteriormente analizzate per durata, ampiezza, frequenza dei picchi e durata della fase tonica (high frequency spiking) e clonica (low frequency spiking). Le SLE di durata <10 s devono essere escluse dall'analisi.
NOTA: Per la valutazione preclinica di possibili sostanze antietiche, si stanno indagando gli effetti sull'attività di scoppio (indotto dahighK- 4AP), a causa dell'induzione stabilita nel tessuto ippocampale resetto. Sono stati riportati i risultati preliminari sull'induzione di SLE utilizzando lowMg2, BIC (Figura 2), anche se l'analisi di questi dati non è inclusa qui.
Risultati
L'attività epileptiforme è stata registrata con successo nel tessuto ippocampale umano resected proveniente da un massimo di 15 pazienti. Stabilire procedure stabili di trasporto e preparazione è fondamentale per l'induzione di successo dell'attività epileptiforme nel tessuto cerebrale umano. I risultati pubblicati di recente hanno mostrato 1) l'induzione stabile dell'attività epilettica nel tessuto resected di diversi pazienti e 2) l'uso del tessuto cerebrale umano resected come strumento preclinico per la valutazione di nuovi meccanismi antietigrafici14,20.
Applicazionedell'attivitàepileptiforme indotta da highK a 4 punti in forma di burst in pochi minuti ( Figura2A,B,C,D). A causa della bassa distribuzione neuronale nel tessuto ippocampale umano o dell'elevata perdita di cellule neuronali a causa dell'epilessia del lobo temporale (TLE), il posizionamento degli elettrodi può essere regolato all'inizio della registrazione. Nei casi in cui l'attività di scoppio delle sezioni non è visibile nell'area CA1 dopo 10 min (indipendente dal posizionamento degli elettrodi), la vitalità della sezione potrebbe essere compromessa e la fetta dovrà essere sostituita.
Le SLE, con una durata di >10 s, possono essere indotte con l'applicazione di lowMg2, BIC (Figura 2E,F). La figura 2E mostra l'induzione stabile delle SLE dopo pochi minuti e la frequenza stabile durante tutta la registrazione. Qui, l'attività SLE è stata indotta con successo in due delle quattro fette del paziente indagato. Una fetta ha mostrato solo l'attività di scoppio dopo 15 minuti di attività SLE, mentre l'altra fetta non ha mostrato SLE anche dopo 40 min.
Per la valutazione preclinica degli effetti della sostanza, è stato studiato un potenziale effetto antieepettattico sull'attività discoppioindotta da highK - 4-AP. Sono state testate sostanze antietiche note e potenziali (lacosamide, DMEA, dynorphine14), ed esempi sono mostrati qui per il lacosamide AED convenzionale (un bloccante del canale di sodio) e DMEA (una nuova potenziale sostanza antieepepepepepepepeptica)20. Il numero di eventi e l'intervallo tra eventi (IEI) di eventi burst è diminuito sia durante l'applicazione di lacosamide che di DMEA (Figura 3C), anche se le ampiezze sono state per lo più inalterate (Figura 3D). In un sottoinsieme di sezioni, anche se l'induzione di eventi burst è stata raggiunta nei primi minuti, la frequenza di attività non è stata recuperata durante il lavaggio degli AED applicati (dati non mostrati qui, vedere Kraus et al.20). Qui, i farmaci applicati sono stati considerati per indurre effetti; tuttavia, le diminuzioni dell'attività di burst potrebbero essere state influenzate dal graduale decadimento dell'attività durante le registrazioni lunghe. Pertanto, i risultati devono essere interpretati con attenzione.
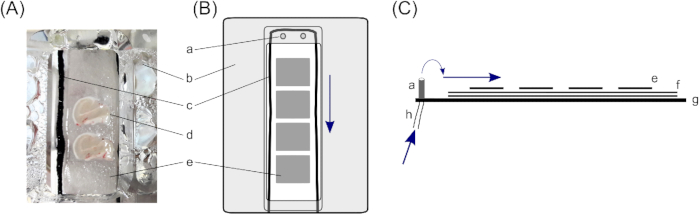
Figura 1: Camera di interfaccia. Per la conservazione di fette cerebrali dell'ippocampo umano, viene utilizzata una camera di interfaccia con due scomparti di tenuta a fette cerebrali (A); in particolare, una camera di interfaccia di tipo Haas23. Qui, le fette cerebrali dell'ippocampo poggiano su (d) tre strati di carta da filtro, ( e )pezzi piùpiccoli per consentire la gestione di singole fette cerebrali e ( f )pezzidi carta da filtro più grandi per garantire uno strato sufficiente di soluzione sotto la fetta. (c) Una stringa di cotone che circonda le fette cerebrali, sopra le carte filtranti, assicura anche il flusso della soluzione dalle insenature nella parte superiore (a) del vano. (b) Un coperchio di copertura dirige l'ossigeno da sotto il compartimento sulla fetta. (B) Vista superiore di un vano affettamento. (C) Vista laterale per illustrare i livelli di carte filtro. (g) Parte inferiore della camera. (h) Tubo per l'afflusso di soluzione, che è collegato a una pompa peristaltica (frecce blu segnano la direzione del flusso della soluzione). Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
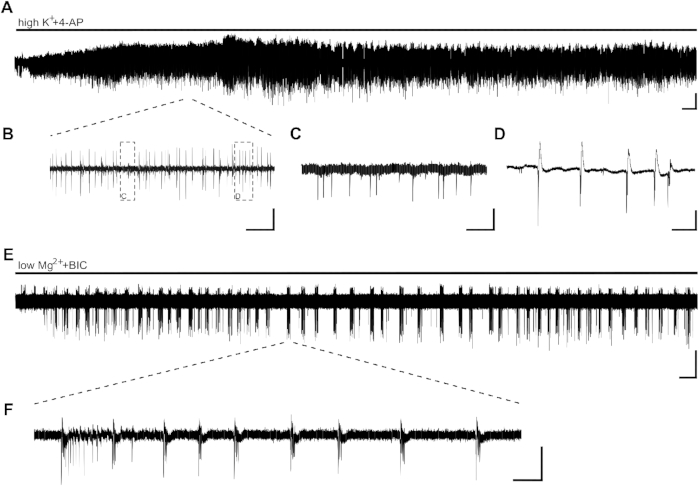
Figura 2: Attività epilettiforme nelle fette dell'ippocampo umano indotta dahighK- 4-AP e lowMg2. Registrazioni di esempio CA1 ed estratti dell'applicazione dihighK (8 mM) - 4-AP (100 M) (A,B,C,D) e lowMg2, BIC (10 M) (E,F). (A) L'applicazione del bagno dihighK- 4-AP induce l'attività epileptiforme in pochi minuti, e l'attività è stabile per almeno 60 min. I dettagli di (A) possono essere visti in (B). Due diversi tipi di attività sono indotti nell'area CA1 delle fette dell'ippocampo umano: picchi interictal-like (C, dettagli di [B]) e attività di scoppio (D, dettagli di [B]). L'attività di burst è stata dimostrata sensibile ai farmaci antielettici e quindi analizzata per l'effetto di potenziali sostanze antietiche (Figura 3). (E,F) L'applicazione di lowMg2e BIC induce le SLE a una durata di >10 s (F) in CA1 in pochi minuti. Tuttavia, l'induzione di SLE può richiedere fino a 30 min in altre fette. Barre di ridimensionabile: 0,2 mV, 2 min (A,E), 5 s (B), 500 ms (C,D), 5 min (E) e 2 s (F). Questa cifra è stata adattata da Kraus et al.20. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
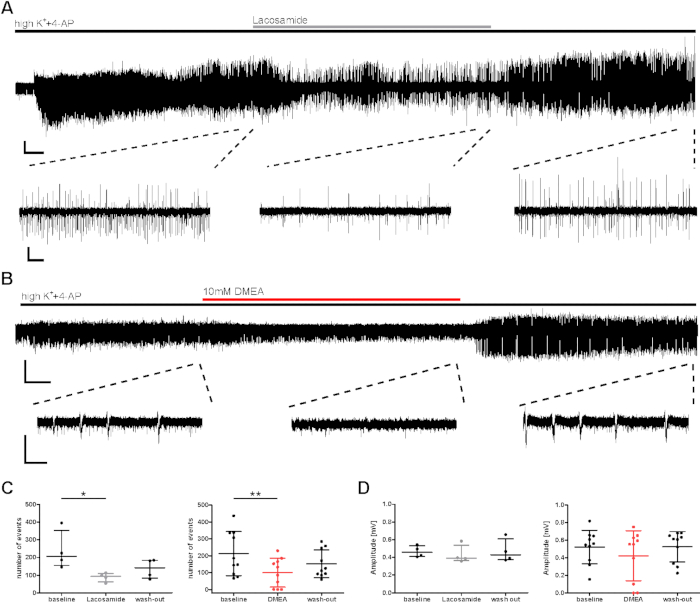
Figura 3: Diminuzione dell'attività di scoppio epilettico delle fette umane durante l'applicazione di lacosamide o DMEA. L'attività di scoppio è diminuita durantel'applicazionedi ( A ) lacosamide e (B) DMEA, una potenziale nuova molecola antieeplettica. (A) e (B) mostrano registrazioni esemplari dell'area CA1 con estratti di regioni utilizzate per l'analisi in (C) e (D). L'attività di scoppio è diminuita durante l'applicazione lacosamide (100 M) e DMEA (10 mM), come visto dagli estratti intermedi e aumenta di nuovo durante il lavaggio. (C,D) Numero e ampiezza dell'attività di scoppio sono stati analizzati per gli ultimi 5 minuti di ogni fase di applicazione (base, lacosamide/DMEA, lavaggio) e mostrati come risultati riepilogati per tutti i pazienti (numero di eventi, C; ampiezza, D) come media . Ogni punto indica un paziente. Gli asterischi segnano differenze significative come valutate dal test Friedman e post-hoc con il confronto multiplo di Dunnett dei gruppi per l'analisi dell'applicazione lacosamide ('p < 0.05, n ' 4) o per la misurazione ripetuta ANOVA e post-hoc con il confronto di Tukey per l'analisi dell'applicazione DMEA ('p < 0.01, n ' 10). Barre di scala: 0,2 mV, 2 min (registrazione completa, A), 5 s (estratti, A), 3 min (registrazione completa, B) e 1 s (estratti, B). Questa cifra è stata adattata da Kraus et al.20. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
| Soluzione 1.1 colina aCSF | |||
| Sostanza | Concentrazione 10x (mM) | Concentrazione 1x (mM) | Nota |
| colina Cl | 1100 | 110 | |
| Na L-Ascorbate | 116 | 11.6 | |
| MgCl2x6H2O | 70 | 7 | |
| Na pyruvate | 31 | 3.1 | |
| Kcl | 25 | 2.5 | |
| NaH2PO4 | 12.5 | 1.25 | |
| NaHCO3 | 260 | 26 | |
| CaCl2 | - | 0.5 | aggiungere alla soluzione finale |
| Glucosio | - | 10 | aggiungere alla soluzione finale |
| Soluzione 1.2 aCSF | |||
| Sostanza | Concentrazione 10x (mM) | Concentrazione 1x (mM) | Nota |
| Nacl | 1290 | 129 | |
| NaH2PO4 | 12.5 | 1.25 | |
| CaCl2 | 16 | 1.6 | |
| Kcl | 30 | 3 | |
| MgSO4 | 18 | 1.8 | |
| Glucosio | - | 10 | aggiungere alla soluzione finale |
| Soluzione 1.3 highK-4-AP aCSF | |||
| Sostanza | Concentrazione 10x (mM) | Concentrazione 1x (mM) | Nota |
| Nacl | 1240 | 124 | |
| NaH2PO4 | 12.5 | 1.25 | |
| CaCl2 | 16 | 1.6 | |
| Kcl | 80 | 8 | |
| MgSO4 | 18 | 1.8 | |
| Glucosio | - | 10 | aggiungere alla soluzione finale |
| 4-AP | - | 0.1 | aggiungere alla soluzione finale |
| Soluzione 1.4 lowMg2-aCSF BIC | |||
| Sostanza | Concentrazione 10x (mM) | Concentrazione 1x (mM) | Nota |
| Nacl | 1300 | 130 | |
| NaH2PO4 | 12.5 | 1.25 | |
| CaCl2 | 16 | 1.6 | |
| Kcl | 30 | 3 | |
| Glucosio | - | 10 | aggiungere alla soluzione finale |
| Bic | - | 0.01 | aggiungere alla soluzione finale |
| Soluzione 2 | |||
| Sostanza | Concentrazione 10x (mM) | Concentrazione 1x (mM) | Nota |
| NaHCO3 | 210 | 21 | |
Tabella 1: Preparazione delle soluzioni 10x e 1x finali per il trasporto, la preparazione e la registrazione.
Discussione
Vivere il tessuto cerebrale umano risentito è uno strumento di grande valore nella valutazione preclinica degli EED, in quanto rappresenta correttamente una micro-rete cerebrale umana intatta. Il protocollo presentato descrive un metodo per il trasporto e la preparazione dei tessuti, che garantisce fette di ippocampo di alta qualità, nonché un metodo di induzione stabile per l'attività epilettaforme critica per la valutazione AED.
Lo esame dell'attività epileptiforme e dei metodi per l'induzione chimica o elettrica nelle fette del cervello umano sono stati precedentemente mostratida altri gruppi 17,20,21,22. Questo protocollo descrive l'induzione di un'attività di scoppio stabile nelle fette di diversipazientitramite l'applicazione di un'elevata K - 4-AP e l'induzione di SLE nell'area CA1 tramite l'applicazione di un basso Mg2. Si è scoperto che l'induzione dell'attività di scoppio è più coerente (80% delle fette testate in 15 pazienti) rispetto all'induzione di SLE (50% delle fette testate in un paziente). Tuttavia, finora, l'induzione delle SLE è stata testata solo in un paziente. Tuttavia, si raccomanda l'induzione di SLE da parte di un basso Mg2,poiché le SLE non sono ancora state in grado di essere indotteutilizzandol'elevato K e il 4-AP.
Diversi studi hanno introdotto metodi per il trasporto e la preparazione del tessuto cerebrale umano e spesso evidenziano tre fattori critici per la sopravvivenza neuronale: il tempo di trasporto, le soluzioni di trasporto usate e le condizioni di memorizzazione.
Per una vitalità ottimale della sezione, alcuni gruppi suggeriscono che il trasporto del tessuto cerebrale resected sia il più breve possibile. Tuttavia, le sale operatorie e i laboratori sono raramente nelle immediate vicinanze, il che significa che la qualità delle fette può essere compromessa a causa del trasporto lungo. Alcuni gruppi hanno superato questo ostacolo applicando costante O2 alla soluzione durante il trasporto12. Abbiamo trasportato il tessuto cerebrale per brevi (max 15 min) e lunghi (fino a 1 h) periodi di tempo senza costante ulteriore O2 fornitura durante il trasporto, simile ad altri gruppi18,25. In questi casi, le differenze nella qualità dei tessuti non sono state osservate durante le registrazioni epileptiformi. In comunicazione con altri gruppi del nostro istituto, la qualità delle fette non è stata modificate neanche per gli esperimenti di patch-clamp. Al contrario, la varianza nella qualità dei tessuti deriva probabilmente da danni durante le operazioni, resezione prolungata e procedura di affettatura.
Per quanto riguarda il trasporto e la soluzione di taglio, tutti i metodi pubblicati omettono NaCl dalle soluzioni per ridurre il gonfiore cellulare a causa della pressione osmotica, simile alla procedura standard per gli esperimenti di patch-clamp dei roditori. Tuttavia, finora sono stati introdotti diversi sostituti (ad esempio, aCSF13,22,NMDG-based aCSF12,26e aCSF27a base di colina ). Ting e colleghi hanno introdotto l'aCSF basato su NMDG per la preparazione delle fette nel 201426 e in seguito hanno aggiunto un protocollo di recupero, che lentamente reintroduce NaCl nelle fette28. Tuttavia, come descritto da Ting et al., i neuroni del tessuto cerebrale preparati in aCSF a base di NMDG mostrano una maggiore resistenza alla membrana, influenzando così la tenuta a cellule intere durante gli esperimenti di patch-clamp26. Pertanto, siamo passato da aCSF basato su NMDG all'uso di aCSF20basato sulla colina , che produce fette di alta qualità sia per le registrazioni potenziali sul campo che per le registrazioni patch-clamp.
Per quanto riguarda lo stoccaggio delle fette, è generalmente accettato che le condizioni di interfaccia forniscono un'ossigenazione ottimale critica per la sopravvivenza afettine lunghe 18. Tuttavia, altri gruppi mostrano la sopravvivenza delle fette fino a 72 h in condizioni sommerse12. Contrariamente alle ipotesi precedenti, le fette di cervello umano sembrano essere più resistenti alla bassa ossigenazione o allo stress ossidativo rispetto alle fette di roditore. Principalmente, le camere di interfaccia sono state precedentemente utilizzate per la conservazione di fette di ippocampo umano, anche se le condizioni sommerse sono raccomandate per il mantenimento delle fette del cervello umano negli esperimenti patch-clamp.
Come discusso da altri gruppi, un ulteriore passo critico per la sopravvivenza a fettine lunghe (interfaccia per <48 h18, sommersa per <72 h12) è la prevenzione della contaminazione batterica. Le fette di cervello dei roditori sono tipicamente utilizzate nelle registrazioni elettrofisiologiche fino a 8 h, e la contaminazione batterica non è considerata per influenzare la vitalità della sezione durante questo periodo. Alto numero di fette preparate da una resezione e la disponibilità non comune di tessuto cerebrale umano evidenzia la necessità di prolungare la vitalità delle fette del cervello umano. Questo metodo descrive con successo la preparazione di fette di cervello ippocampale umano vivente, che possono essere facilmente adattate a condizioni sterili. Tuttavia, per le registrazioni eseguite qui, la sopravvivenza delle fette che si estende per 20 h non era una priorità.
La registrazione nelle camere di interfaccia ha anche dimostrato di essere essenziale per l'induzione dell'attività epileptiforme come le SLE22. Le condizioni sommerse, a causa della bassa ossigenazione, sono raramente utilizzate per la registrazione delle SLE; tuttavia, sono necessari per l'alta risoluzione ottica necessaria per gli esperimenti patch-clamp. L'uso di una camera di registrazione di tipo sommersa ottimizzata consente la registrazione dell'attività epileptiforme (campo extracellulare o singolo neurone) nelle fette del cervello umano, a causa dell'alta ossigenazione e dell'applicazionerapida di farmaci 29. Qui, vengono descritti metodi e risultati per le registrazioni potenziali sul campo, ma va sottolineato che le registrazioni patch-clamp sono state eseguite con successo in sezioni di topo e cervello umano utilizzando questa camera di registrazione modificata (dati non mostrati).
Il tessuto cerebrale umano resected ha un valore traslazione più elevato rispetto ai modelli di roditori. Rappresenta una rete neuronale adulta e maesa che non può essere riprodotta da iPSC. Tuttavia, come in qualsiasi sistema in vitro, le fette di cervello umano non rappresentano un cervello umano intatto. Inoltre, le reti neuronali registrate di tessuto cerebrale resected possono subire sostanziali cambiamenti molecolari e funzionali a causa di danni durante il funzionamento o la preparazione. Le procedure di affettatura hanno dimostrato di influenzare la funzione GABAergic e possono influenzare l'induzione dell'attività epileptiforme30. Queste limitazioni devono essere considerate durante la formulazione di un'ipotesi. Quando si testano potenziali farmaci antielettici, l'uso di diverse aree cerebrali dovrebbe essere considerato, come bersagli farmacologici potrebbero non essere espressi in tutte le regioni del cervello umano o tutti i pazienti. In particolare, l'ippocampo dei pazienti affetti da TLE mostra spesso segni di sclerosi ippocampale accompagnata da una grave perdita di cellule neuronali. Si raccomanda di ottenere informazioni sui pazienti sui cambiamenti patologici e sulla storia della malattia, come il potenziale refrattario verso i farmaci, e considerare questo durante l'interpretazione dei dati.
In conclusione, questo metodo descrive con successo la preparazione di fette di cervello ippocampale umano vivente e tecniche di induzione per la registrazione di due diversi tipi di attività epileptiforme. Poiché la disponibilità di tessuto cerebrale umano vivente è rara, le condizioni di trasporto e registrazione ottimizzate dovrebbero essere utilizzate per garantire la massima produzione da esperimenti che utilizzano fette di cervello umano. Si suggerisce che il tessuto cerebrale umano resected può essere utilizzato come strumento di convalida preclinica oltre a modelli di roditori ed esperimenti di coltura cellulare.
Divulgazioni
Gli autori non dichiarano alcun conflitto di interessi.
Riconoscimenti
Ringraziamo Mandy Marbler-Pàtter (Charite-Unversit-tmedizin, Berlino) per un'eccellente assistenza tecnica. P.F. è stato finanziato dalla German Research Foundation (DFG, Deutsche Forschungsgemeinschaft) nell'ambito della strategia di eccellenza tedesca-EXC-2049-390688087. Questo lavoro è stato sostenuto dal CENTRO QUEST per la trasformazione della ricerca biomedica presso l'Istituto di Sanità di Berlino.
Materiali
| Name | Company | Catalog Number | Comments |
| (+)-Na L-ascorbate | Sigma Aldrich | A4034 | |
| 4-AP | Sigma Aldrich | 275875-5G | |
| Blades | eliteSERVE GmbH | HW3 | used for the vibratome |
| CaCl2 | Merck | 102382 | |
| Choline Cl | Sigma Aldrich | C1879 | |
| Filter paper | Tiffen | EK1546027T | |
| Gas-tight bottle caps | Carl Roth GmbH+Co.KG | E694.1 | |
| Glass filaments | Science Products | GB150F-8P | for recording electrodes |
| Glass gas disperser | DWK Life Sciences GmbH | 258573309 | |
| Glucose | Sigma Aldrich | G7528 | |
| Interface Chamber | inhouse made | - | see Haas et al., 1979 |
| KCl | AppliChem | 131494.1210 | |
| Membrane (Cell culture inserts) | Merck | PICM030050 | |
| Membrane chamber | inhouse made | - | see Hill and Greenfield, 2011 |
| MgCl2?6H2O | Carl Roth | HNO3.2 | |
| MgSO4 | Sigma Aldrich | M7506 | |
| Na pyruvate | Sigma Aldrich | P8574 | |
| NaCl | Carl Roth | 3957.1 | |
| NaH2PO4 | Merck | 106346 | |
| NaHCO3 | Carl Roth | HNO1.2 | |
| Peristaltic pump | Gilson | Minipuls 3 | |
| Slice holder | Warner instruments | SHD-41/15 | |
| Vertical puller | Narishige | PC-10 | |
| Vibratome | Leica | VT1200S |
Riferimenti
- Hirtz, D., et al. How common are the "common" neurologic disorders. Neurology. 68 (5), 326-337 (2007).
- Ngugi, A. K., Bottomley, C., Kleinschmidt, I., Sander, J. W., Newton, C. R. Estimation of the burden of active and life-time epilepsy: a meta-analytic approach. Epilepsia. 51 (5), 883-890 (2010).
- Kwan, P., Brodie, M. J. Early Identification of Refractory Epilepsy. New England Journal of Medicine. 342 (5), 314-319 (2000).
- Löscher, W. Critical review of current animal models of seizures and epilepsy used in the discovery and development of new antiepileptic drugs. Seizure. 20 (5), 359-368 (2011).
- Ledri, M., et al. Differential Effect of Neuropeptides on Excitatory Synaptic Transmission in Human Epileptic Hippocampus. The Journal of Neuroscience: the official journal of the Society for Neuroscience. 35 (26), 9622-9631 (2015).
- Qi, X. R., et al. Alterations in the steroid biosynthetic pathways in the human prefrontal cortex in mood disorders: A post-mortem study. Brain Pathology. 28 (4), 536-547 (2018).
- Verwer, R. W. H., et al. Post-mortem brain tissue cultures from elderly control subjects and patients with a neurodegenerative disease. Experimental Gerontology. 38 (1-2), 167-172 (2003).
- Verwer, R. W. H., et al. Cells in human postmortem brain tissue slices remain alive for several weeks in culture. FASEB journal official publication of the Federation of American Societies for Experimental Biology. 16 (1), 54-60 (2002).
- Le Maître, T. W., Dhanabalan, G., Bogdanovic, N., Alkass, K., Druid, H. Effects of Alcohol Abuse on Proliferating Cells, Stem/Progenitor Cells, and Immature Neurons in the Adult Human Hippocampus. Neuropsychopharmacology. 43 (4), 690-699 (2018).
- Dennis, C. V., Suh, L. S., Rodriguez, M. L., Kril, J. J., Sutherland, G. T. Human adult neurogenesis across the ages: An immunohistochemical study. Neuropathology and Applied Neurobiology. 42 (7), 621-638 (2016).
- Verwer, R. W. H., et al. Mature astrocytes in the adult human neocortex express the early neuronal marker doublecortin. Brain. 130 (12), 3321-3335 (2007).
- Ting, J. T., et al. A robust ex vivo experimental platform for molecular-genetic dissection of adult human neocortical cell types and circuits. Scientific Reports. 8 (1), 8407 (2018).
- Le Duigou, C., et al. Imaging pathological activities of human brain tissue in organotypic culture. Journal of Neuroscience Methods. 298, 33-44 (2018).
- Agostinho, A. S., et al. Dynorphin-based "release on demand" gene therapy for drug-resistant temporal lobe epilepsy. EMBO molecular medicine. 11 (10), 9963 (2019).
- Hodge, R. D., et al. Conserved cell types with divergent features in human versus mouse cortex. Nature. 573 (7772), 61-68 (2019).
- Beaulieu-Laroche, L., et al. Enhanced Dendritic Compartmentalization in Human Cortical Neurons. Cell. 175 (3), 643-651 (2018).
- Sandow, N., et al. Drug resistance in cortical and hippocampal slices from resected tissue of epilepsy patients: no significant impact of p-glycoprotein and multidrug resistance-associated proteins. Frontiers in Neurology. 6, 30 (2015).
- Wickham, J., et al. Prolonged life of human acute hippocampal slices from temporal lobe epilepsy surgery. Scientific Reports. 8 (1), (2018).
- Avoli, M., Jefferys, J. G. R. Models of drug-induced epileptiform synchronization in vitro. Journal of Neuroscience Methods. , (2015).
- Kraus, L., et al. Dimethylethanolamine Decreases Epileptiform Activity in Acute Human Hippocampal Slices in vitro. Frontiers in Molecular Neuroscience. 12, 209 (2019).
- Antonio, L. L., et al. In vitro seizure like events and changes in ionic concentration. Journal of Neuroscience Methods. , (2016).
- Gabriel, S., et al. Stimulus and Potassium-Induced Epileptiform Activity in the Human Dentate Gyrus from Patients with and without Hippocampal Sclerosis. Journal of Neuroscience. 24 (46), 10416-10430 (2004).
- Haas, H. L., Schaerer, B., Vosmansky, M. A simple perfusion chamber for the study of nervous tissue slices in vitro. Journal of Neuroscience Methods. 1 (4), 323-325 (1979).
- Hill, M. R. H., Greenfield, S. A. The membrane chamber: a new type of in vitro recording chamber. Journal of neuroscience methods. 195 (1), 15-23 (2011).
- Andersson, M., et al. Optogenetic control of human neurons in organotypic brain cultures. Scientific Reports. 6, 24818 (2016).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. Acute brain slice methods for adult and aging animals: application of targeted patch clamp analysis and optogenetics. Methods in molecular biology. 1183, 221-242 (2014).
- Testa-Silva, G., et al. Human synapses show a wide temporal window for spike-timing-dependent plasticity. Frontiers in Synaptic Neuroscience. 2, 12 (2010).
- Ting, J. T., et al. Preparation of Acute Brain Slices Using an Optimized N-Methyl-D-glucamine Protective Recovery Method. Journal of Visualized Experiments. (132), (2018).
- Morris, G., Jiruska, P., Jefferys, J. G. R., Powell, A. D. A New Approach of Modified Submerged Patch Clamp Recording Reveals Interneuronal Dynamics during Epileptiform Oscillations. Frontiers in Neuroscience. 10, 519 (2016).
- Valeeva, G., Valiullina, F., Khazipov, R. Excitatory actions of GABA in the intact neonatal rodent hippocampus in vitro. Frontiers in Cellular Neuroscience. , (2013).
Erratum
Formal Correction: Erratum: Preparation of Acute Human Hippocampal Slices for Electrophysiological Recordings
Posted by JoVE Editors on 7/13/2020. Citeable Link.
An erratum was issued for: Preparation of Acute Human Hippocampal Slices for Electrophysiological Recordings. Step 2.1.3 in the Protocol was corrected.
Step 2.1.3 in the Protocol was updated from:
Add final concentrations of glucose and MgCl, then stir until dissolved (Table 1, solution 1.1).
to:
Add final concentrations of glucose and CaCl2, then stir until dissolved (Table 1, solution 1.1).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon