Method Article
電気生理学的記録のための急性ヒト海馬スライスの調製
Erratum Notice
要約
提示されたプロトコルは、潜在的な抗てんかん物質の前臨床評価ツールとして重要な脳スライスを使用するという究極の目標を持つ切除されたヒト海馬組織の輸送および調製について説明する。
要約
てんかんは世界人口の約1%に影響を及ぼし、発作が続き、突然死のリスクが高いため、生活の質が著しく低下する。利用可能な治療オプションの豊富さにもかかわらず、患者の約30%は薬剤耐性です。薬剤耐性患者の割合は変わらないが、いくつかの新しい治療法が動物モデルを用いて開発されている。考えられる理由の1つは、動物モデルにおけるヒト薬理抵抗性の弱い表現など、げっ歯類モデルと人間の間の翻訳の欠如である。前臨床評価ツールとして切除されたヒト脳組織は、この翻訳ギャップを埋める利点がある。ここで説明する、ヒト海馬脳スライスの高品質な調製と、てんかん活動のその後の安定な誘導のための方法を説明する。プロトコルは、8 mM KClおよび4-アミノピリジンの適用中のバースト活性の誘導を記述する。この活性は、確立されたAEDラコサミドまたはジメチルエタノールアミン(DMEA)のような新規の抗てんかん候補に敏感である。さらに、この方法は、細胞外Mg2+ の減少およびBICUcullineの適用によるヒト海馬脳スライスのCA1における発作様事象の誘導を記述する、GABAA 受容体遮断薬である。実験的なセットアップは、てんかんの活動に及ぼす影響について潜在的な抗てんかん物質をスクリーニングするために使用することができる。さらに、特定の化合物に対して仮定された作用機序は、ヒト組織においてこのアプローチを用いて検証することができる(例えば、パッチクランプ記録を使用して)。結論として、ヒト脳組織ex vivo(ここでは、側頭葉てんかんに罹患している患者から海馬を切除した)の研究は、ヒト脳における生理学的および病理学的メカニズムに関する現在の知識を改善する。
概要
てんかんは、世界人口の1%に影響を及ぼす最も一般的な神経疾患の1つであり、罹患率および死亡率11、22の増加に関連している。残念ながら、てんかんに罹患している患者の3分の1は薬剤耐性であり、20以上の承認された抗てんかん薬(AED)3を含む利用可能な治療オプションが豊富3にあるにもかかわらず。前臨床動物研究の結果を臨床試験に翻訳しないことは、有望な治療戦略が多くの患者に有効でない理由の1つである4.最近, 神経ペプチド Y (NPY) およびガラニンは、動物モデルで抗てんかん効果を有することが示されています;;しかし、切除されたヒト脳組織で試験を行った場合、NPYだけが有効であった。
基本的な神経学的メカニズムと疾患治療のアプローチに関する既存の知識のほとんどは、動物モデルと細胞培養実験に由来します。有益であるが、これらのモデルは、複雑な人間の病気と成人の人間の脳ネットワークの単一の側面を表すだけです。あるいは、ヒトの脳組織は、翻訳のギャップを埋める可能性を秘めているが、機能的研究のために利用できることはめったにありません。例えば、死後の脳組織は、タンパク質発現、脳形態、または解剖学的接続を調査する上で貴重なツールであったが、神経活動がしばしば損なわれるのはこの組織676、7、8、9、10、11,8,9,10,11である。,
これに対し、ヒト脳組織の生きた切除は、前臨床薬物評価、基礎神経機能および遺伝子発現パターン12、13、14、15、16、17に関して調査されている。12,13,14,15,16,17げっ歯類のスライスと比較して人間の脳スライスの大きな利点は、切除および調製後の神経組織の長い生存率です。調製後8時間まで記録できるげっ歯類の脳スライスと比較して、人間の脳スライスは最大72時間の安定した神経活動を示し、これらの希少かつ貴重なサンプル12、18,の徹底的な調査を可能にする。
いくつかの研究は、切除された皮質および海馬ヒト組織の様々な分野におけるてんかん活動の特性を調査し、てんかん活動の誘導に異なる方法を使用した。げっ歯類のスライスでは、てんかんの活性は、DGヒラー細胞の電気刺激、細胞外K+(8〜12 mM KCl)の増加、ビクキュリンによるGABAA受容体の遮断(BIC)、4-アミノピリジン(4-AP)によるカリウムチャネルの遮断、および細胞外溶液中のMg2+の除去または減少などのいくつかの方法によって誘発され得る。しかしながら、ヒト組織におけるてんかん活性の誘導は、上記の方法20、21、22,21の少なくとも2つの組み合わせを必要とする22。
ここで提示されるヒト海馬脳スライスの調製方法は、最大20時間生存可能であり、高K+(8 mM)および4-APまたは低Mg2+ およびBICの適用時にてんかん活動の誘導を示す。
プロトコル
患者は手術前に書面による同意を得る必要があり、実験の前に必要な倫理的合意を設ける必要があります。代表結果に関しては、人間の参加者を含むすべての研究がベルリンのシャリテ・ユニバーシテ・メディジン(EA2/111/14)によってレビューされ、承認されました。
1. 10xソリューションの調製
注:人間の脳組織へのアクセスを計画する際に困難のため、ここで説明するように10倍のソリューションを準備することをお勧めします。あるいは、最終1x溶液は、最終濃度の個々の物質を二重蒸留水(ddH2 O)に添加することによって2、新たに調製することができる。
- 個々の10x溶液については、表1に従ってddH2Oに物質を添加し、溶解するまで攪拌する。2
- 10x溶液を調製後1ヶ月まで使用してください(10xコリンaCSFを凍結する場合は1年まで)。
- 10xコリンaCSFの場合、10x 1.1コリンaCSF(表1)の50mLアリコートを調製し、さらに使用するまで-20°Cまたは-80°Cで凍結する。
注:細菌との汚染や炭酸カルシウムの2沈殿を防ぐために、グルコースとCaCl2〜10x 1.1コリンaCSFを追加しないでください。 - 10x ソリューション 2 は、すべての 1x 最終ソリューションに使用できますが、10x ソリューション 1.1 ~ 1.4 はカスタマイズされ、それに応じて名前が付けられます (表 1)。
2. 1x最終ソリューションの作成
注:最終1xソリューションは、使用する前日にできるだけ新鮮または最も早く準備する必要があります。すべての最終的な解決は、酸素と溶液を濃縮するためにガラスガス2分散機を使用して5%CO2と95%O2でカルボゲン化し、7.4(最大= 7.4 ±0.2)にpHを調整する必要があります。2
- 輸送および準備のためのコリンaCSF
- 最終的な500 mL溶液については、37°Cの水浴中のコリンaCSFに対する10x溶液1.1アリコートの50mLアリコートを解凍する。
- 解凍した50 mLの10x溶液1.1と50mLの10x溶液2をddH2Oの約300 mLに加えます。
- グルコースとCaCl2の最終的な濃度を加え、次に溶解するまで攪拌する(表1、溶液1.1)。
- 最終容積500mLにddH2Oを加え、浸透量(300mOsm±10 mOsm)を測定します。
- オプションで、溶液を殺菌するフィルターを使用してください(滅菌条件下でのスライスの生存率の延長に関する議論を参照)。
- 手術室から実験室への輸送のために約100 mLの1xコリンaCSFで別のボトルを充填してください。
- オプション:手術室から実験室への輸送時間に応じて、より長い輸送期間中にaCSFの安定したpHを確保するためにガスタイトボトルキャップを使用することを検討してください。
- 最終ソリューションは、さらに使用されるまで4~8°Cで保管してください。
- 作動日には、カルボーゲンガスに接続されたガラスガス分散機(5%CO2、95%O2)を使用して、氷上の1xコリンaCSFを冷やし、カルボゲ2ネートを少なくとも10〜15分間冷却する。2
注:輸送ソリューションの再カーボジネーションが必要になるより長い待ち時間の場合は、手術室にガスボトルをアクセス可能にしておくことを検討してください。しかし、長く短い輸送時間(15分対60分)の前に再カルボギンスなしで海馬組織を輸送し、てんかん活動の誘導の違いを観察しませんでした。
- ストレージおよび記録用の aCSF
- 最終的な2 L溶液の場合、10x溶液1.2(aCSF)の200mLと10x溶液2の200mLとグルコース(表1)をddH2Oの約1500 mLに加える。
注:最終的な解決の容積は適用された実験および貯蔵および記録に使用される部屋のタイプによって異なる。 - 2 L の最終容積に ddH2O を加え、浸透量(300 mOsm ±10 mOsm)を測定します。
- 使用前に35°C、カルボゲネートを少なくとも10〜15分間前温めください。
- 最終的な2 L溶液の場合、10x溶液1.2(aCSF)の200mLと10x溶液2の200mLとグルコース(表1)をddH2Oの約1500 mLに加える。
- バースト活動の誘導のための高K++4-AP aCSF
- 最終的な1 L溶液の場合、10x溶液1.3(highK+ +4-APaCSF)の100 mLと100 mLの10x溶液2~700mLのddH2Oを加えます。2
- 表1に従ってグルコースと4-AP(最終濃度= 100 μM)を加える。
- DDH2Oを1 Lの最終容積に加え、浸透量(300 mOsm ±10 mOsm)を測定します。
- 使用前に35°C、カルボゲネートを少なくとも10〜15分間前温めください。
- 発作様イベント(SL)の誘導のためのLowMg2 ++BIC aCSF
- 最終的な1 L溶液の場合、10x溶液1.4(lowMg2++BIC aCSF)の100 mLと100 mLの10x溶液2~700mLのddH2Oを加えます。2
- 表1に従ってグルコースとBIC(最終濃度= 10 μM)を加える。
- DDH2Oを1 Lの最終容積に加え、浸透量(300 mOsm ± 10 mOsm)を測定します。
- 使用前に35°C、カルボゲネートを少なくとも10〜15分間前温めください。
3. インターフェース室の準備
- インターフェースチャンバでは、スライスは3層の濾紙に置かれ、スライスの下に十分な量の溶液を確保します。これを行うには、各スライス保持コンパートメント(記載されたインターフェイスチャンバーは2つのコンパートメントで構成されています)ごとに2〜4cm x〜2cmのフィルターペーパーをカットし、それらを互いの上に置きます。
- 4 cm x 2 cm のフィルターペーパーの周りに薄い綿の弦を入れて、溶液の張力を壊します。均等な流れを確認します(ここでは、長さが約10cmの薄切り弦にカットされた黒いナイロンタイツが使用されます。
- スライス保持コンパートメント内の大きなフィルターペーパーの上に小さなフィルターペーパーを置きます。小さなフィルター組織片は、1つの脳スライス(〜1.5cm x〜1.0 cm)の大きさにする必要があり、個々のスライスのさらなる処理を可能にします。各区画に3~4個の小さな濾紙を入れます。
- 蠕動ポンプで1.8 mL/minのaCSF流量を確認してください。
- カルボゲネートおよび前温面チャンバ〜35°C(スライスの最終温度は〜32°Cでなければならない)。
4. 準備エリアの設定
注:調製は、汚染を避け、スライスの生存期間を伸張するために無菌条件下で行うことができます。しかし、すべての振動子が無菌フードの下に収まるわけではないし、他の措置は、準備中の汚染を減らすために必要とされる。ここでは、これらの対策の一部について説明します。
- 70%のEtOHで準備領域を拭き、領域の上にアルミホイルまたは滅菌カバーを置きます。
- スーパー接着剤、2つの鋭いピンセット、へら、刃付きのメス、脳組織の粗い切断のためのブレードを準備します。工具は、汚染を減らすために手順の前に滅菌することができます。
- ビブラートメのバッファートレイと試料プレートを70%のEtOHで拭きます。バッファートレイが完全に乾燥したら、アルミホイルで覆い、トレイを氷浴に入れます。砕いた氷で氷浴を満たし、準備するまで-20°Cに保ちます。
- 70%のEtOHでビブラートとカミソリの刃を拭き、スライス手順の間に垂直振動と組織の損傷を最小限に抑えるためにビブラートメを較正します。
5. 組織のスライスと保管
- 切除直後に、組織をすぐに冷たく、カルボゲン化したコリンaCSFに入れ、実験室に素早く輸送する。
注意:人間の脳組織は潜在的な病原体を含むことができるので、準備中に常に手袋とフェイスマスクを着用してください。さらに、無菌フードの下で作業していないときにフェイスマスクを着用すると、溶液や脳組織の汚染を大幅に低減します。 - コリン aCSF から組織を削除し、組織の燃焼部分を切り取る.
- 均一な表面を切断し、切断角度と組織層を考慮しながら、組織片を標本プレートに接着します。理想的には、海馬スライスにはDG、CA1-4、および(可能であれば)subiculumが含まれています。
- 脳組織を400μmの厚いスライスにスライスし、切削中に振幅と速度を調整します。可能な残留ピアの嵌合体, 人間の脳組織は、より多くの抵抗を示し、遅い切断を必要とするかもしれない.
注:スライスの厚さは、利用可能なネットワーク(より厚いスライスでより多くのニューロン)またはスライスの生存率(スライスへの溶液の浸透)に大きく影響します。500 μmのスライスを使用して、潜在的に利用可能なマイクロネットワークを増加させ、てんかん活動の誘導の違いを観察することができませんでした。300 μm のスライスはパッチクランプ実験に一般的に使用されていますが、これらのスライスにおけるてんかん活動の誘導はまだここでテストされていません。標準スライス厚は400μmですが、300~500μmのスライスで十分です。 - 収集する前に、メスを使用して、記録チャンバーに収まるように脳スライスのサイズを小さくします。膜室(セクション6を参照)の使用のために、スライスは最大1.5 cm x 1 cmでなければなりません。還元しながら、記録のために無傷である必要がある特定の層および接続を考慮してください(例えば、CA1およびDGで記録するために、subiculumおよび周囲の白い組織を切り取る)。
- スパチュラと小さな鉗子を使用して、慎重に小さなフィルターペーパーのインターフェイスチャンバーにスライスを置き、記録するまでaCSFで〜1時間休ませます。
- スライスは、最大20時間(無菌条件下でも長く)記録することができます。
6. てんかんの活動の記録
- 膜室(水没型記録室)に、透明半透膜上に脳スライスを置き、プラスチックリング24に接着する。このためには、スーパー接着剤を使用して、細胞培養インサートの膜にプラスチックリングを取り付けます。
- メスを使用して、プラスチックリングの外側の膜を取り除きます。膜をチャンバーに入れる前に、膜が均一かつ完全にリングに取り付けられていることを確認してください。
注:膜は4–8 °CのddH2Oで貯留し、1ヶ月まで再使用することができる。常に膜を濡らしてください。 - 膜室の流入と流出の両方が、溶液供給のためにチューブに接続されています。チューブを蠕動ポンプに入れ、流入と流出が逆方向に移動するようにします。
- すべてのチューブとチャンバーが溶液で満たされるまで、流入および流出管をカルボゲネートした、事前に温めたaCSFに入れます。蠕動ポンプの速度を調整して、10~13 mL/minの均等な流量を実現します。
注:ここで使用される膜チャンバーは、高流量、水没型記録室で、最大14 mL/min24の溶液フローを可能にします。別の水没型記録室を使用する場合、流量を調整する必要があります。しかし、てんかんの活性の誘導のために、膜室を使用することを強く推奨する。 - 32°Cの安定した温度を確保するために、膜室に近接して流入に接続された発熱体を使用してください。
- 垂直のプーラーを使用して1~2 MΩのガラスピペットを準備します。ピペットに154 mM NaCl溶液を充填し、電極ホルダーに入れて下ろします。
- ピンセットとヘラを使用して、小さなろ紙でスライスを取り、カルボゲン化されたaCSFで満たされたペトリ皿に両方を入れることによって、インターフェイスチャンバーから海馬スライスを取り除きます。海馬スライスから小さな濾紙を取り出し、(必要に応じて)ピペットを使用してスライスを濾紙から分離するためにある程度の力を加えます。スライスを反転しないように注意してください。
- 記録チャンバーにスライスを置き、スライスメッシュを使用して所定の位置に保持します。
注:ベルヌーイの原理により、使用水没型膜室では、スライスは通常、追加のスライスメッシュを使用せずに安定しています。 - 目的の領域と層(ここでは、CA1)に電極を配置し、記録を開始します。
- サンプリングレートが10~20kHz、ローパスが2kHzでフィルタリングされた現在のクランプモードで、フィールド電位のアクティビティを記録します。
- aCSFで最大5分間の基礎活動を記録します。
- aCSF から高++4AP または lowMg2++BIC aCSF および流出管に流入管を交換して、溶液の混合を防止します。2分後、流出管を流入液と同じ溶液に入れて、溶液を節約します。
- 高K++4-APによって誘導されたバースト活性は、洗浄後2〜5分目に見える必要があります。しかし、低Mg2 ++BICによるSLEの誘導は最大30分かかることがあります。必要に応じて電極の位置を慎重に変更し、最適な結果を得ます。
- 最終位置に入ると、ベースラインアクティビティを少なくとも 20 分間記録します。SL を録音する場合は、SL の頻度が低いため、ベースラインの記録を長くすることを検討してください。
- ベースライン活性が安定している場合(イベント頻度の高原)、所望の薬剤で洗浄する。高流量の洗浄により、2~5分しかかからないため、迅速な溶液交換が可能です。
- 洗い流しに続いて、少なくとも20分の薬物適用中に活性を記録する。活動は、少なくとも60〜90分の間安定して、より長い録音を可能にするべきである。
7. 分析
- 周波数と振幅の分析は、利用可能な任意のソフトウェアで行うことができます。これまでのところ、SESやバースト活動の信頼性の高い自動分析を確立できず、代わりに識別された活動を視覚的に確認する半自動分析を使用しました。
- バースト アクティビティは、二倍、正、負の偏向、および、バースト アクティビティとして視覚的に識別されるすべてのイベント (たとえば、しきい値分析によって半自動) を手動で示して、イベント頻度(イベント間間隔、IEI)、振幅、および分析された時間枠内のイベントの合計数を手動で示す必要があります。
注: バーストアクティビティの頻度が高いため、各アプリケーションフェーズの最後の 5 分は通常20. - SESは、Heuzerothらで説明されているように分析することができ、同定されたSLAは、持続時間、振幅、スパイク周波数、およびトニック(高周波スパイク)対クロニック(低周波スパイク)位相持続時間の持続時間についてさらに分析することができる。期間が 10 s の SLA は、分析から除外する必要があります。
注:抗てんかん物質の前臨床評価のために、切除された海馬組織における確立された誘導のために、バースト活性(highK+ +4APによって誘発される)への影響が調査されている。このデータの分析はここでは含まれていませんが、lowMg2++BICを用いたSLの誘導に関する予備的な結果が報告されています(図2)。
結果
てんかんの活動は、最大15人の患者から生じる切除されたヒト海馬組織に正常に記録されている。安定した輸送および準備手順の確立は、ヒト脳組織におけるてんかん活動の誘導を成功させるために重要である。最近発表された結果は、1)新しい抗てんかん機構14,20,20の評価のための前臨床ツールとして切除されたヒト脳組織を使用する、ならびに2)異なる患者の切除組織におけるてんかん活性の安定な誘導を示している。
数分以内にバースト+活性の形態で高K++4-AP誘導てんかん活性の適用(図2A、B、C、D)。,B,C,Dヒト海馬組織における神経細胞分布が低いか、側頭葉てんかん(TLE)による高い神経細胞損失のために、電極の配置は記録の開始時に調整することができる。10分後にCA1領域にスライスのバースト活性が見えない場合(電極の配置とは無関係)、スライスの生存率が損なわれ、スライスを交換する必要があります。
SLは、持続時間が10%の場合、lowMg2++BICの適用により誘導することができる(図2E、F)。F図2Eは、数分経過後のSLの安定した誘導と、記録全体を通して安定した周波数を示しています。ここで、SLE活性は、調査された患者からの4つのスライスのうちの2つにおいて正常に誘導された。一方のスライスはSLE活性の15分後にバースト活性のみを示し、もう一方のスライスは40分後でもSLEを示さなかった。
物質効果の前臨床評価のために、高K++4-APによって誘発されるバースト活性に対する+潜在的な抗てんかん効果を調査した。既知および潜在的な抗てんかん物質(ラコサミド、DMEA、ダイボルフィン14)が試験され、DMEA(新規潜在的抗てんかん物質)20と同様に従来のAEDラコサミド(ナトリウムチャネル遮断薬)についてここに例示されている。ラコサミドとDMEA(図3C)の適用中にバーストイベントのイベント数とイベント間間隔(IEI)の数は減少しましたが、振幅はほとんど影響を受けませんでした(図3D)。スライスのサブセットでは、バーストイベントの誘導が最初の数分で達成されたにもかかわらず、適用されたAETDの洗浄中に活動の頻度は回復しなかった(ここに示されていないデータは、Krausらら参照)。ここで、 適用された薬物は、効果を誘発すると考えられた;しかし、バースト活動の減少は、長い録音中の活動の徐々に減衰の影響を受けている可能性があります。したがって、結果は慎重に解釈する必要があります。
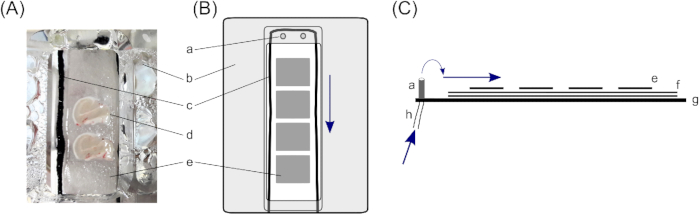
図1:インターフェース室ヒト海馬脳スライスの保存には、コンパートメントを保持する2つの脳スライスを備えたインターフェースチャンバーが使用されます(A);具体的には、ハース型インターフェース室23.ここでは、海馬の脳スライスは、(d)ろ紙の3層、個々のe脳スライスの取り扱いを可能にする小さな部分、および(f)スライスの下の溶液の十分な層を確保するために大きなフィルターペーパー片の上に置かれている。d(c) フィルターペーパーの上に、脳のスライスを囲む綿の弦は、コンパートメントの上の(a)の入口からの溶液の流れさえも保証する。(b)カバー蓋は、区画の下からスライスに酸素を導く。(B) 1つのスライス保持コンパートメントのトップビュー。(C)フィルターペーパーの層を図示するサイドビュー。(g)チャンバーの底部。(h) 蠕動ポンプに接続された溶液流入用チューブ(青色矢印は、溶液の流れの方向を示す)。この図の大きなバージョンを表示するには、ここをクリックしてください。
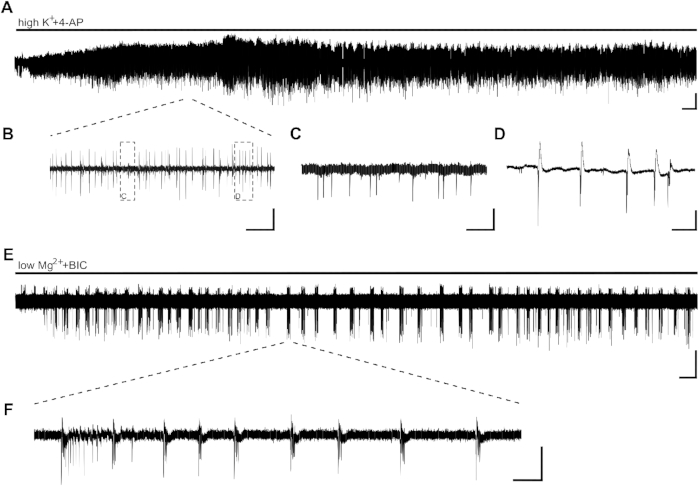
図2:高+4-APおよびlowMg2++BICによって誘導されるヒト+海馬スライスにおけるてんかん活性。CA1 の例の記録と高い+ (8 mM)+4-AP (100 μM) (A,B,C,D)および lowMg2++BIC (E,F) の適用の抜粋と.(A)高K++4-APの浴用途は、数分以内にてんかん活動を誘導し、活動は少なくとも60分間安定であり、(A)の詳細は(B)で見ることができる。ヒト海馬スライスのCA1領域では、2種類の活性が誘導される:頭蓋間状スパイク(C、[B]の詳細)およびバースト活性(D、Bの詳細)。バースト活性は抗てんかん薬に対して感受性であることが示され、したがって潜在的な抗てんかん物質の効果について分析された(図3)。(E,F)lowMg2++BICの適用は、数分以内にCA1で>10s(F)の持続時間でSLを誘導する。ただし、SLの誘導は、他のスライスで最大30分かかることがあります。スケールバー= 0.2 mV、2分(A,E)、5 s(B)、500ミリ秒(C,D)、5分(E)、2秒(F)。この図は、クラウスらから適応されています。この図の大きなバージョンを表示するには、ここをクリックしてください。
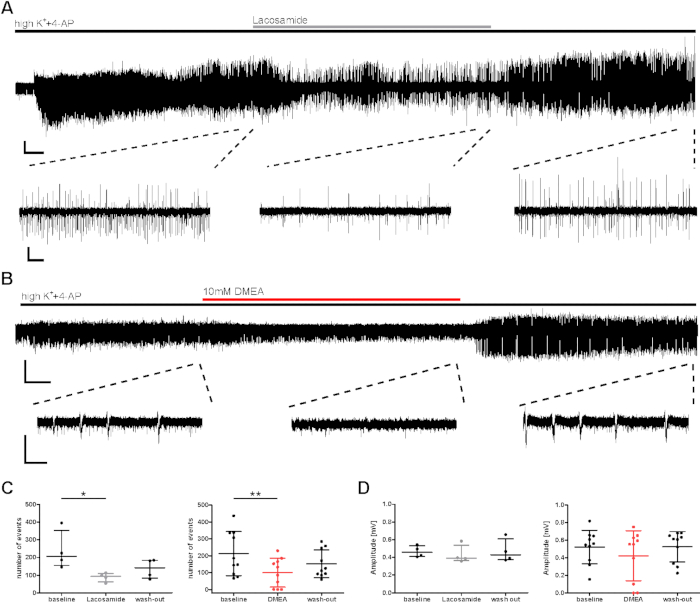
図3:ラコサミドまたはDMEAの適用中にヒトスライスのてんかんバースト活性の減少バースト活性は、(A)ラコサミドおよび(B)DMEA、潜在的な新しい抗てんかん分子の適用中に減少した。B(A)および(B)は、(C)および(D)における分析に使用される領域の抜粋を用いてCA1領域の例示的な記録を示す。ラコサミド(100 μM)およびDMEA(10 mM)アプリケーションの間にバースト活性が低下し、途中の抜粋で見られ、洗い流す際に再び増加しました。(C,D)バースト活性の数と振幅を各適用段階(ベースライン、ラコサミド/DMEA、洗浄)の最後の5分間分析し、平均値として全患者(事象数、C;振幅、D)の要約結果として示した。各ドットは1人の患者を示す。アスタリスクは、フリードマン試験とポストホック、ラコサミドアプリケーションの分析のためのダネットのグループの複数比較(*p<0.05、n = 4)、またはDMEAアプリケーションの分析のためのTukeyの比較(**p<0.01、n = 10)との反復測定ANOVAとポストホックのいずれかによって評価される大きな違いを示します。スケールバー= 0.2 mV、2分(フルレコーディング、A)、5 s(抜粋、A)、3分(フルレコーディング、B)、1 s(抜粋、B)。この図は、クラウスらから適応されています。この図の大きなバージョンを表示するには、ここをクリックしてください。
| ソリューション 1.1 コリン aCSF | |||
| 物質 | 10x濃度(mM) | 1x濃度(mM) | メモ |
| コリン Cl | 1100 | 110 | |
| (+)-ナL-アスコルビント | 116 | 11.6 | |
| MgCl2x6H2O | 70 | 7 | |
| ナピルビン酸 | 31 | 3.1 | |
| Kcl | 25 | 2.5 | |
| ナH2PO4 | 12.5 | 1.25 | |
| ナフコ3 | 260 | 26 | |
| CaCl2 | - | 0.5 | 最終ソリューションに追加 |
| グルコース | - | 10 | 最終ソリューションに追加 |
| ソリューション 1.2 aCSF | |||
| 物質 | 10x濃度(mM) | 1x濃度(mM) | メモ |
| 塩化 ナトリウム | 1290 | 129 | |
| ナH2PO4 | 12.5 | 1.25 | |
| CaCl2 | 16 | 1.6 | |
| Kcl | 30 | 3 | |
| MgSO4 | 18 | 1.8 | |
| グルコース | - | 10 | 最終ソリューションに追加 |
| ソリューション 1.3 highK++4-AP aCSF | |||
| 物質 | 10x濃度(mM) | 1x濃度(mM) | メモ |
| 塩化 ナトリウム | 1240 | 124 | |
| ナH2PO4 | 12.5 | 1.25 | |
| CaCl2 | 16 | 1.6 | |
| Kcl | 80 | 8 | |
| MgSO4 | 18 | 1.8 | |
| グルコース | - | 10 | 最終ソリューションに追加 |
| 4-AP | - | 0.1 | 最終ソリューションに追加 |
| ソリューション 1.4 lowMg2++BIC aCSF | |||
| 物質 | 10x濃度(mM) | 1x濃度(mM) | メモ |
| 塩化 ナトリウム | 1300 | 130 | |
| ナH2PO4 | 12.5 | 1.25 | |
| CaCl2 | 16 | 1.6 | |
| Kcl | 30 | 3 | |
| グルコース | - | 10 | 最終ソリューションに追加 |
| ビックカメラ | - | 0.01 | 最終ソリューションに追加 |
| 解決策 2 | |||
| 物質 | 10x濃度(mM) | 1x濃度(mM) | メモ |
| ナフコ3 | 210 | 21 | |
表1:輸送、準備、記録のための10xおよび最終的な1xソリューションの調製。
ディスカッション
生きたヒト脳組織は、無傷のヒト脳マイクロネットワークを適切に表すため、AEDの前臨床評価において非常に価値のあるツールである。提示されたプロトコルは、組織輸送および調製のための方法を記述し、これは高品質の海馬スライスならびにAED評価にとって重要なてんかん活動のための安定した誘導方法を保証する。
てんかんの活性の調査と、ヒト脳スライスにおける化学的または電気的誘導のための方法は、以前に他のグループ17、20、21、22,21,22によって示されている。17,このプロトコルは、高いK ++4-APの適用と低Mg2++BICの適用によるCA1領域でのSLの誘導を介して、異なる患者からのスライスにおける安定したバースト活性の誘導を記述する。+バースト活性の誘導は、SESの誘導(1人の患者における試験スライスの50%)よりも一貫していることがわかりました(15人の患者でテストされたスライスの80%)。しかし、これまでのところ、SESの誘導は1人の患者でのみテストされています。それにもかかわらず、SLは高いK +4-APを使用してまだ誘導することができないので、低Mg2+BICによるSLE+の誘導が推奨されます。
いくつかの研究は、人間の脳組織の輸送と準備のための方法を導入し、多くの場合、神経細胞生存に重要な3つの要因を強調している:輸送時間、使用輸送溶液、および保存条件。
最適なスライスの生存率のために、一部のグループは、切除された脳組織の輸送が可能な限り短いことを示唆している。しかし、手術室や研究所が近接することはほとんどなく、長い輸送のためにスライスの品質が損なわれる可能性があります。一部のグループは、輸送中に一定のO2を溶液に適用することによってこの障害を克服しました 12.我々は、他のグループ18、25,25と同様に、輸送中に一定の追加のO2供給なしで短い(最大= 15分)および長い(最大1時間)の時間の脳組織を輸送した。これらの場合、てんかんの記録中に組織の質の違いは認められなかった。私たちの研究所の他のグループとのコミュニケーションでは、パッチクランプ実験でもスライスの品質は変わりませんでした。対照的に、組織の質の差異は、手術中の損傷、長期の切除、およびスライス手順に起因する可能性がある。
輸送および切断溶液に関して、全ての公表された方法は、げっ歯類のパッチクランプ実験のための標準的な手順と同様に、浸透圧による細胞の膨潤を減らすための溶液からNaClを省略する。しかしながら、これまでにいくつかの代替物が導入されている(すなわち、ショ糖系aCSF13、22、NMDGベースのaCSF,2212、26、,26およびコリンベースのaCSF27)。Tingたちは、2014年26年にスライス調製用のNMDGベースのaCSFを導入し、後に回復プロトコルを追加し、スライス28にNaClをゆっくりと再導入する。しかし、Tingらによって説明されるように、NMDGベースのaCSFで調製された脳組織のニューロンは、より高い膜抵抗性を示し、従ってパッチクランプ実験26の間に全細胞シールに影響を与える。そこで、NMDGベースのaCSFから、フィールド電位とパッチクランプ記録の両方に高品質のスライスを生み出すコリンベースのaCSF20の使用に移行しました。
スライスの保存に関しては、インターフェース条件が長いスライス生存のために重要な最適酸素化を提供することが一般的に受け入れられている18.しかし、他のグループは、水没条件12の下で最大72時間のスライス生存を示す。以前の仮説とは対照的に、人間の脳スライスはげっ歯類のスライスに比べて低酸素化または酸化ストレスに対してより耐性があるようです。主に、インターフェース室は以前、ヒト海馬スライスの保存に使用されてきましたが、パッチクランプ実験で人間の脳スライスを維持するために水没した条件が推奨されています。
他のグループで議論されているように、長いスライス生存のための追加の重要なステップ(<48 h18のインタフェース、<72 h12のために水没)は細菌汚染の予防である。げっ歯類の脳スライスは、通常、最大8時間の電気生理学的記録に使用され、細菌汚染は、この期間中のスライスの生存率に影響を与えるとは考えられません。1つの切除から調製されたスライスの数が多く、人間の脳組織の珍しい可用性は、人間の脳スライスの生存率を延長する必要性を強調しています。この方法は、無菌状態に容易に適応することができる生きているヒト海馬脳スライスの調製を正常に記述する。しかしながら、ここで行う記録については、20時間延長するスライス生存率は優先事項ではなかった。
インターフェース室での記録は、SES22などのてんかん活動の誘導に不可欠であることが示されている。低酸素化のために水没条件は、SLの記録にはほとんど使用されません。ただし、パッチクランプ実験に必要な光学高解像度に必要です。最適化された水没型記録室の使用により、高酸素化および高速薬物用途29によるヒト脳スライスにおけるてんかんの活動(細胞外野または単一ニューロン)の記録が可能となる。ここでは、電界電位記録の方法と結果について説明するが、この修正記録チャンバーを用いてマウス及びヒト脳スライスでパッチクランプ記録が正常に行われていることを強調すべきである(データは示されていない)。
切除されたヒト脳組織は、げっ歯類モデルに比べて翻訳値が高い。これは、iPSCでは再現できない、成人の疾患を持つ神経ネットワークを表します。しかし、他の インビトロ システムと同様に、人間の脳スライスは無傷の人間の脳を表すものではありません。さらに、切除された脳組織の記録された神経ネットワークは、手術中または準備中の損傷による実質的な分子および機能的変化を受ける可能性がある。スライス手順は、GABAergic機能に影響を与える、てんかん活動30の誘導に影響を与える可能性が示されている。これらの制限は、仮説を策定する際に考慮する必要があります。潜在的な抗てんかん薬をテストする場合、薬物標的がすべてのヒト脳領域またはすべての患者で発現されない可能性があるため、異なる脳領域の使用を考慮する必要があります。特に、TLE患者の海馬はしばしば、重度の神経細胞喪失を伴う海馬性硬化症の徴候を示す。薬に対する難治性の可能性など、病理学的変化や疾患歴に関する患者情報を取得し、データ解釈中に検討することをお勧めします。
結論として、この方法は、2種類のてんかん活動を記録するためのヒト海馬脳スライスおよび誘導技術の調製を正常に記述する。生きている人間の脳組織の可用性はまれであるため、最適化された輸送および記録条件は、人間の脳スライスを使用した実験からの最大出力を確保するために使用されるべきです。切除されたヒト脳組織は、げっ歯類モデルや細胞培養実験に加えて、前臨床検証ツールとして使用できることが示唆されている。
開示事項
著者らは利益相反を宣言しない。
謝辞
マンディ・マーマー=ペッター(ベルリンのシャリテ・ウンヴァーシテテツメディジン)に、優れた技術支援を感謝します。P.F.はドイツ研究財団(DFG、ドイツ・フォルシュングスゲマイインシャフト)がドイツのエクセレンス戦略-EXC-2049-390688087の下で資金提供を受けています。この研究は、ベルリン保健研究所のQUEST生物医学研究センターによって支援されています。
資料
| Name | Company | Catalog Number | Comments |
| (+)-Na L-ascorbate | Sigma Aldrich | A4034 | |
| 4-AP | Sigma Aldrich | 275875-5G | |
| Blades | eliteSERVE GmbH | HW3 | used for the vibratome |
| CaCl2 | Merck | 102382 | |
| Choline Cl | Sigma Aldrich | C1879 | |
| Filter paper | Tiffen | EK1546027T | |
| Gas-tight bottle caps | Carl Roth GmbH+Co.KG | E694.1 | |
| Glass filaments | Science Products | GB150F-8P | for recording electrodes |
| Glass gas disperser | DWK Life Sciences GmbH | 258573309 | |
| Glucose | Sigma Aldrich | G7528 | |
| Interface Chamber | inhouse made | - | see Haas et al., 1979 |
| KCl | AppliChem | 131494.1210 | |
| Membrane (Cell culture inserts) | Merck | PICM030050 | |
| Membrane chamber | inhouse made | - | see Hill and Greenfield, 2011 |
| MgCl2?6H2O | Carl Roth | HNO3.2 | |
| MgSO4 | Sigma Aldrich | M7506 | |
| Na pyruvate | Sigma Aldrich | P8574 | |
| NaCl | Carl Roth | 3957.1 | |
| NaH2PO4 | Merck | 106346 | |
| NaHCO3 | Carl Roth | HNO1.2 | |
| Peristaltic pump | Gilson | Minipuls 3 | |
| Slice holder | Warner instruments | SHD-41/15 | |
| Vertical puller | Narishige | PC-10 | |
| Vibratome | Leica | VT1200S |
参考文献
- Hirtz, D., et al. How common are the "common" neurologic disorders. Neurology. 68 (5), 326-337 (2007).
- Ngugi, A. K., Bottomley, C., Kleinschmidt, I., Sander, J. W., Newton, C. R. Estimation of the burden of active and life-time epilepsy: a meta-analytic approach. Epilepsia. 51 (5), 883-890 (2010).
- Kwan, P., Brodie, M. J. Early Identification of Refractory Epilepsy. New England Journal of Medicine. 342 (5), 314-319 (2000).
- Löscher, W. Critical review of current animal models of seizures and epilepsy used in the discovery and development of new antiepileptic drugs. Seizure. 20 (5), 359-368 (2011).
- Ledri, M., et al. Differential Effect of Neuropeptides on Excitatory Synaptic Transmission in Human Epileptic Hippocampus. The Journal of Neuroscience: the official journal of the Society for Neuroscience. 35 (26), 9622-9631 (2015).
- Qi, X. R., et al. Alterations in the steroid biosynthetic pathways in the human prefrontal cortex in mood disorders: A post-mortem study. Brain Pathology. 28 (4), 536-547 (2018).
- Verwer, R. W. H., et al. Post-mortem brain tissue cultures from elderly control subjects and patients with a neurodegenerative disease. Experimental Gerontology. 38 (1-2), 167-172 (2003).
- Verwer, R. W. H., et al. Cells in human postmortem brain tissue slices remain alive for several weeks in culture. FASEB journal official publication of the Federation of American Societies for Experimental Biology. 16 (1), 54-60 (2002).
- Le Maître, T. W., Dhanabalan, G., Bogdanovic, N., Alkass, K., Druid, H. Effects of Alcohol Abuse on Proliferating Cells, Stem/Progenitor Cells, and Immature Neurons in the Adult Human Hippocampus. Neuropsychopharmacology. 43 (4), 690-699 (2018).
- Dennis, C. V., Suh, L. S., Rodriguez, M. L., Kril, J. J., Sutherland, G. T. Human adult neurogenesis across the ages: An immunohistochemical study. Neuropathology and Applied Neurobiology. 42 (7), 621-638 (2016).
- Verwer, R. W. H., et al. Mature astrocytes in the adult human neocortex express the early neuronal marker doublecortin. Brain. 130 (12), 3321-3335 (2007).
- Ting, J. T., et al. A robust ex vivo experimental platform for molecular-genetic dissection of adult human neocortical cell types and circuits. Scientific Reports. 8 (1), 8407 (2018).
- Le Duigou, C., et al. Imaging pathological activities of human brain tissue in organotypic culture. Journal of Neuroscience Methods. 298, 33-44 (2018).
- Agostinho, A. S., et al. Dynorphin-based "release on demand" gene therapy for drug-resistant temporal lobe epilepsy. EMBO molecular medicine. 11 (10), 9963 (2019).
- Hodge, R. D., et al. Conserved cell types with divergent features in human versus mouse cortex. Nature. 573 (7772), 61-68 (2019).
- Beaulieu-Laroche, L., et al. Enhanced Dendritic Compartmentalization in Human Cortical Neurons. Cell. 175 (3), 643-651 (2018).
- Sandow, N., et al. Drug resistance in cortical and hippocampal slices from resected tissue of epilepsy patients: no significant impact of p-glycoprotein and multidrug resistance-associated proteins. Frontiers in Neurology. 6, 30 (2015).
- Wickham, J., et al. Prolonged life of human acute hippocampal slices from temporal lobe epilepsy surgery. Scientific Reports. 8 (1), (2018).
- Avoli, M., Jefferys, J. G. R. Models of drug-induced epileptiform synchronization in vitro. Journal of Neuroscience Methods. , (2015).
- Kraus, L., et al. Dimethylethanolamine Decreases Epileptiform Activity in Acute Human Hippocampal Slices in vitro. Frontiers in Molecular Neuroscience. 12, 209 (2019).
- Antonio, L. L., et al. In vitro seizure like events and changes in ionic concentration. Journal of Neuroscience Methods. , (2016).
- Gabriel, S., et al. Stimulus and Potassium-Induced Epileptiform Activity in the Human Dentate Gyrus from Patients with and without Hippocampal Sclerosis. Journal of Neuroscience. 24 (46), 10416-10430 (2004).
- Haas, H. L., Schaerer, B., Vosmansky, M. A simple perfusion chamber for the study of nervous tissue slices in vitro. Journal of Neuroscience Methods. 1 (4), 323-325 (1979).
- Hill, M. R. H., Greenfield, S. A. The membrane chamber: a new type of in vitro recording chamber. Journal of neuroscience methods. 195 (1), 15-23 (2011).
- Andersson, M., et al. Optogenetic control of human neurons in organotypic brain cultures. Scientific Reports. 6, 24818 (2016).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. Acute brain slice methods for adult and aging animals: application of targeted patch clamp analysis and optogenetics. Methods in molecular biology. 1183, 221-242 (2014).
- Testa-Silva, G., et al. Human synapses show a wide temporal window for spike-timing-dependent plasticity. Frontiers in Synaptic Neuroscience. 2, 12 (2010).
- Ting, J. T., et al. Preparation of Acute Brain Slices Using an Optimized N-Methyl-D-glucamine Protective Recovery Method. Journal of Visualized Experiments. (132), (2018).
- Morris, G., Jiruska, P., Jefferys, J. G. R., Powell, A. D. A New Approach of Modified Submerged Patch Clamp Recording Reveals Interneuronal Dynamics during Epileptiform Oscillations. Frontiers in Neuroscience. 10, 519 (2016).
- Valeeva, G., Valiullina, F., Khazipov, R. Excitatory actions of GABA in the intact neonatal rodent hippocampus in vitro. Frontiers in Cellular Neuroscience. , (2013).
Erratum
Formal Correction: Erratum: Preparation of Acute Human Hippocampal Slices for Electrophysiological Recordings
Posted by JoVE Editors on 7/13/2020. Citeable Link.
An erratum was issued for: Preparation of Acute Human Hippocampal Slices for Electrophysiological Recordings. Step 2.1.3 in the Protocol was corrected.
Step 2.1.3 in the Protocol was updated from:
Add final concentrations of glucose and MgCl, then stir until dissolved (Table 1, solution 1.1).
to:
Add final concentrations of glucose and CaCl2, then stir until dissolved (Table 1, solution 1.1).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved