Method Article
为电子生理记录准备急性人类河马切片
Erratum Notice
摘要
提出的方案描述了被切除的人类海马组织的运输和制备,最终目标是使用重要的脑片作为潜在抗癫痫物质的临床前评估工具。
摘要
癫痫影响大约1%的世界人口,并导致生活质量的严重下降,由于持续的癫痫发作以及高风险的突然死亡。尽管有丰富的治疗方案,但约30%的患者具有耐药性。一些新的治疗方法已经开发使用动物模型,虽然耐药患者的速度保持不变。其中一个可能的原因是啮齿动物模型和人类之间缺乏翻译,例如动物模型中人类药理表现力的弱。被切除的人类脑组织作为临床前评估工具具有弥补这种转化差距的优势。这里描述的方法是人类海马脑切片的高质量制备,随后稳定地诱导表皮活动。该协议描述了在8mM KCl和4-氨基pyridin的应用过程中爆发活性的诱导。此活性对已建立的 AED 乳酰胺或新型抗癫痫候选物(如二甲苯二甲胺 (DMEA))敏感。此外,该方法还描述了通过减少细胞外Mg2+ 和应用双库线(GABAA 受体阻滞剂)来诱导人类海马脑切片CA1中癫痫发作样事件。实验装置可用于筛选潜在的抗癫痫物质,以发现其对表皮活性的影响。此外,在人体组织中,使用这种方法(例如,使用贴片夹记录)验证特定化合物的假设作用机制。最后,对重要的人脑组织外活体(这里,从患有叶癫痫的患者的修复海马)的研究将改善目前对人脑生理和病理机制的知识。
引言
癫痫是最常见的神经系统疾病之一,影响世界人口的1%,并且与发病率和死亡率增加有关,。不幸的是,三分之一的癫痫患者是耐药性,尽管有大量的可用治疗方案,包括超过20个批准的抗癫痫药物(AED)3。未能将临床前动物研究的结果转化为临床试验,是许多患者前景看好的治疗策略无效的一个原因。最近,神经肽Y(NPY)和加拉宁在动物模型中被证明具有抗癫痫作用;然而,当在被修复的人类脑组织中测试时,只有NPY是有效的5。
关于基本神经机制和疾病治疗方法的现有知识大部分来自动物模型和细胞培养实验。虽然信息丰富,但这些模型只代表复杂的人类疾病和成人人类大脑网络的单一方面。或者,人脑组织有可能弥合转化间隙,但很少可用于功能研究。例如,死后脑组织一直是研究蛋白质表达、脑形态或解剖联系的宝贵工具,尽管神经元活动,经常受到损害,就是这种,组织66、7、8、9、10、11。9,10,11,78
相比之下,对活的人类脑组织进行了临床前药物评估、基本神经元功能和基因表达模式12、13、14、15、16、17,13,14,15,16,等研究。与啮齿类切片相比,人脑切片的一大优势是神经组织在切除和制备后具有长期生存能力。与啮齿动物大脑切片相比,人类大脑切片在制备后通常可记录长达8小时,其神经元切片显示稳定的神经元活性长达72小时,能够彻底调查这些稀有和有价值的样本12,18。12,
一些研究调查了表皮动物活性在切除皮质和海马人体组织不同区域的特性,并使用不同的方法诱导表皮表活性。在啮齿类切片中,表皮活性可以通过几种方法诱导:DG高耳细胞的电刺激,细胞外K+(8~12 mM KCl)的增加,双细胞素(BIC)阻断GABAAA受体,用4-氨基基氨酸(4-AP)阻断钾通道,去除或减少细胞外A溶液中的Mg+ 2+。然而,诱导表皮在人体组织中的活动需要至少两种方法的组合20,21,22。,21,22
这里介绍的是一种用于制备人类海马脑切片的方法,该切片可存活长达20小时,在应用高K+(8 mM)和4-AP或低Mg2+ 和BIC时显示表皮活性的诱导。
研究方案
患者必须在手术前给予知情的书面同意,并且必须在实验前达成必要的道德协议。关于代表性的结果,所有涉及人类参与者的研究都得到柏林慈善大学(EA2/111/14)的审查和批准。
1. 准备 10x 解决方案
注:由于规划获取人脑组织方面的困难,建议准备 10 倍解决方案,如此处所述。或者,通过将单个物质在最终浓度中加入到双蒸馏水(ddH2O)中,可以新鲜地准备最终的 1x 解决方案。
- 对于单个 10x 溶液,根据表1将物质添加到 ddH 2 O 中, 搅拌直到溶解。
- 在制备后 1 个月内使用 10x 解决方案(冷冻 10 倍胆碱 aCSF 最多 1 年)。
- 对于 10x 胆碱 aCSF,准备 50 mL 等分 10x 1.1 胆碱 aCSF (表 1) 并冻结在 -20°C 或 -80 °C,直到进一步使用。
注:不要添加葡萄糖和CaCl2 至10x 1.1胆碱ACSF,以防止细菌和碳酸钙沉淀物的污染。 - 10x 解决方案 2 可用于所有 1x 最终解决方案,而 10x 解决方案 1.1–1.4 则进行自定义并相应地命名 (表 1)。
2. 准备1个最终解决方案
注:最终 1x 解决方案应在使用前一天尽早准备新鲜或尽早准备好。所有最终溶液应使用玻璃气体分散器用 5% CO2 和 95% O2 进行碳化,以用氧气丰富溶液,并调整 pH 值至 7.4(最大值 = 7.4 ± 0.2)。
- 用于运输和制备的胆碱 aCSF
- 对于最终的 500 mL 溶液,在 37 °C 水浴中解冻 10x 溶液 1.1 等分的 50 mL 等分。
- 将解冻的 50 mL 等分 10x 溶液 1.1 和 50 mL 的 10x 溶液 2 添加到约 300 mL 的 ddH2O。
- 加入葡萄糖和CaCl2的最终浓度,然后搅拌直到溶解(表1,溶液1.1)。
- 将 ddH2O 添加到 500 mL 的最终体积中,并测量渗透度(300 mOsm = 10 mOsm)。
- 可选地,使用过滤器对溶液进行灭菌(请参阅关于无菌条件下长期切片可行性的讨论)。
- 将一个单独瓶子装满大约 100 mL 的 1x 胆碱 aCSF,用于从操作室运送到实验室。
- 可选:根据从操作室到实验室的运输时间,考虑使用气密瓶盖,以确保在较长的运输期间 aCSF 的 pH 稳定。
- 将最终溶液存放在 4~8°C,直到进一步使用。
- 在操作当天,使用连接到碳原气体的玻璃气体分散器(5% CO 2,95% O2),在冰上和碳化物上冷却 1x 胆碱 aCSF 至少 10-15分钟。
注:如果等待时间较长,请考虑让气瓶进入操作室,这需要重新碳化运输解决方案。然而,我们在长和短的运输时间(15分钟对60分钟)之前运输了海马组织,没有再造,并且没有观察到表皮活性的诱导差异。
- 用于存储和录制的 aCSF
- 对于最终的 2 L 溶液,将 200 mL 的 10x 溶液 1.2 (aCSF) 和 200 mL 的 10x 溶液 2 和葡萄糖 (表 1)添加到 ±1500 mL 的 ddH2O。
注:最终溶液的体积取决于应用实验和用于存储和记录的房间类型。 - 将 ddH2O 添加到 2 L 的最终体积中,并测量渗透度(300 mOsm ±10 mOsm)。
- 将溶液预热至35°C和碳酸盐,使用前至少10~15分钟。
- 对于最终的 2 L 溶液,将 200 mL 的 10x 溶液 1.2 (aCSF) 和 200 mL 的 10x 溶液 2 和葡萄糖 (表 1)添加到 ±1500 mL 的 ddH2O。
- 高K=+4-AP aCSF,用于诱导突发活动
- 对于最终的 1 L 解决方案,添加 100 mL 的 10x 溶液 1.3(高K=+4-AP aCSF)和 100 mL 的 10x 溶液 2 至 +700 mL 的 ddH2O。
- 根据表 1加入葡萄糖和4-AP(最终浓度= 100μM)。
- 将 ddH2O 添加到 1 L 的最终音量,并测量渗透度(300 mOsm =10 mOsm)。
- 将溶液预热至35°C和碳酸盐,使用前至少10~15分钟。
- LowMg2=[BIC aCSF 用于诱导癫痫样事件 (SES)
- 对于最终的 1 L 溶液,添加 100 mL 的 10x 溶液 1.4(低Mg2++BIC aCSF)和 100 mL 的 10x 溶液 2 至 +700 mL 的 ddH2O。
- 根据表 1加入葡萄糖和BIC(最终浓度= 10 μM)。
- 将 ddH2O 添加到 1 L 的最终音量,并测量渗透度(300 mOsm = 10 mOsm)。
- 将溶液预热至35°C和碳酸盐,使用前至少10~15分钟。
3. 接口室的准备
- 在接口室中,切片放在三层滤纸上,以确保切片下方有足够的溶液。为此,请为每个切片隔间(所述接口室由两个隔间组成)切割两块 ±4 厘米 x ±2 厘米的滤纸,并将它们彼此放在上面。
- 将细棉串放在 4 厘米 x 2 厘米滤纸周围的隔间内,以打破溶液的张力。确保均匀流动(此处,使用黑色尼龙紧身衣切割至细切字符串+10厘米长;对于放置,请参见 图1)。
- 将小块滤纸放在较大的滤纸上,放在切片隔间内。小的过滤组织片的大小应大致相当于一个大脑切片(±1.5 厘米 x ±1.0 厘米),并且能够进一步处理单个切片。在每个隔间中放置三到四个小滤纸片。
- 使用近位泵确保 ACSF 流量为 1.8 mL/min。
- 将切模块和预热接口室至 +35 °C(切片的最终温度应为 ±32 °C)。
4. 准备区设置
注:可以在无菌条件下进行制备,以避免污染和拉长切片生存。然而,并非所有振动器都适合在无菌罩下,在制备过程中需要采取其他措施减少污染。本节介绍其中一些措施。
- 用 70% EtOH 擦拭制备区域,并在区域顶部放置铝箔或无菌盖。
- 准备超级胶水,两个锋利的钳子,一个铲子,一个带刀片的手术刀,和一个刀片粗糙切割脑组织。可以在程序之前对工具进行消毒,以减少污染。
- 用 70% EtOH 擦拭振动器的缓冲盘和试样板。缓冲盘完全干燥后,用铝箔盖住,将托盘放在冰浴中。用碎冰填充冰浴,并保持在-20°C,直到准备。
- 用 70% EtOH 擦拭振动器和剃须刀刀片,并校准振动器,以在切片过程中最大限度地减少垂直振动和组织损伤。
5. 组织切片和储存
- 切除后,立即将组织放在冷、碳化胆碱中,并迅速运送到实验室。
注意:在准备过程中,请时刻戴上手套和面罩,因为人脑组织可能含有潜在的病原体。此外,在无菌罩下不工作时戴上面罩将大大减少溶液和脑组织的污染。 - 从胆碱ACSF中去除组织,切掉任何烧伤的组织部分。
- 切匀表面,将组织片粘在试样板上,同时考虑切割角度和组织层。理想情况下,海马切片包含 DG、CA1-4 和(如果可能)亚分。
- 将脑组织切成400μm厚的切片,并在切割过程中调整振幅和速度。由于可能剩余的皮娅母体,人体脑组织表现出更多的抵抗力,可能需要较慢的切割。
注:切片厚度极大地影响可用网络(较厚切片中的神经元更多)或切片的可行性(将溶液渗透到切片中)。我们使用 500 μm 切片来增加潜在的可用微网络,并且无法观察到表皮活性诱导的差异。300 μm 切片通常用于贴片实验,但这些切片中表皮活性的诱导尚未在此进行测试。我们使用 400 μm 作为标准切片厚度,但 300×500 μm 切片可能就足够了。 - 在收集之前,使用手术刀来减小大脑切片的大小,以适应记录室。对于膜室的使用(参见第 6 节),切片应最大为 1.5 厘米 x 1 厘米。在减少时,请考虑记录所需的特定层和连接(例如,在 CA1 和 DG 中记录,切掉亚分层和周围的白色组织)。
- 使用铲子和小钳子,小心地将切片放在小滤纸的接口室中,让切片在 aCSF 中休息 1 小时,直到记录。
- 切片可记录长达 20 小时(在无菌条件下甚至更长)。
6. 表皮活动记录
- 在膜室(浸入式记录室)中,将大脑切片放在透明半渗透膜上,该膜粘附在塑料环24上。为此,使用超级胶水将塑料环连接到细胞培养插入的膜上。
- 使用手术刀去除塑料环外层的任何膜。在将膜放入腔室之前,确保膜均匀且完全连接到环上。
注:膜可储存在4~8°C的ddH2O中,重复使用长达1个月。使膜一直保持湿润。 - 膜室的流入和流出都连接到溶液供应管。将管子放在近流泵中,使流入和流出向相反方向移动。
- 将流入和流出管放在碳化物中,预热为 ACSF,直到所有管和腔室都充满溶液。调整近源泵的速度,实现 10~13 mL/min 的均匀流速。
注:此处使用的膜室是一个高流速、水下式记录室,可实现高达 14 mL/min24 的溶液流量。在使用不同的水下型记录室的情况下,需要调整流速。然而,对于表皮活性的诱导,强烈建议使用膜室。 - 使用连接到靠近膜室的流入的加热元件,以确保温度稳定在 32 °C。
- 使用垂直拉拔器准备 1~2 MΩ 玻璃移液器。用 154 mM NaCl 溶液填充移液器,并将它们放在电极支架中。
- 使用钳子和铲子,将海马切片从界面室中去除,用小滤纸取出切片,并将两者放入装满碳化 aCSF 的培养皿中。从海马片中去除小滤纸,(如有必要)用移液器施加一些用力将滤纸从滤纸中分离出来。小心不要翻转切片。
- 将切片放在记录室中,并使用切片网格将切片放在一起。
注:由于伯努利的原理,在用过的水下型膜室中,切片通常稳定,无需使用额外的切片网。 - 将电极放在感兴趣的区域和层(此处,CA1)中,并开始录制。
- 记录当前夹紧模式下的场电位活动,采样速率为 10~20 kHz,低通滤波器为 2 kHz。
- 在 aCSF 中记录基底活动长达 5 分钟。
- 将流入管从 aCSF 切换到高+K +4AP 或 lowMg2++BIC aCSF 和流出管到废物容器,以防止溶液混合。2 分钟后,将流出管放在与流入相同的溶液中,以保存溶液。
- 高K+4-AP引起的突发活性应在洗涤后 2~5 分钟可见。但是,通过 LowMg2+ +BIC诱导 S下可能需要长达 30 分钟。如有必要,请仔细更改电极的位置,以获得最佳效果。
- 一旦进入最终位置,记录基线活动至少 20 分钟。如果录制 S 自,请考虑由于 S 自的低频率而延长基线录制。
- 在基线活性稳定的情况下(事件频率的波德),用所需的药物清洗。请注意,由于药物的流量高洗涤只需 2~5 分钟,允许快速更换溶液。
- 记录药物应用期间的活动至少20分钟,洗净后。活动应稳定至少 60~90 分钟,允许较长的录制时间。
7. 分析
- 可以使用任何可用的软件对频率和振幅进行分析。到目前为止,我们尚未能够建立对 SES 或突发活动的可靠自动分析,而是使用半自动分析来直观地确认已识别的活动。
- 突发活动的特点是双相、正偏和负偏转,持续时间为 ±100 ms。
注:由于突发活动频率高,每个应用阶段的最后5分钟通常分析20。 - 可以像 Heuzeroth 等人所述那样分析 S。 已识别的 S自可可进一步分析补品(高频尖峰)与克隆(低频尖峰)相位持续时间的持续时间、振幅、尖峰频率和持续时间。应从分析中排除持续时间为 <10 s 的 SLT。
注:对于可能的抗癫痫物质的临床前评估,由于在被修复的海马组织中建立了诱导,正在调查+对突发活性的影响(由高K +++4AP引起)。关于使用低Mg2++BIC诱导S <2>一个 S经的初步结果已经报告(图2),尽管此处未包含此数据的分析。
结果
癫痫表活性已成功记录在来自多达15名患者的被切除的人类海马组织中。建立稳定的运输和制备程序对于成功诱导人脑组织表皮活动至关重要。最近公布的结果显示,1)稳定诱导不同患者的癫痫组织,以及2)使用被切除的人类脑组织作为临床前工具,用于评估新的抗癫痫机制14,20。14,
在几分钟内以突发活动的形式应用高K =+4-AP诱导表皮活性(图2A,B,C,D)。,B,C,D由于人类海马组织的神经元分布低或由于叶癫痫(TLE)引起的高神经元细胞损失,电极的位置可以在记录开始时进行调整。如果 10 分钟后 CA1 区域中看不到切片的突发活性(与电极放置无关),则切片的活性可能会受到影响,并且需要更换切片。
S自,持续时间为>10 s,可通过应用低Mg2++BIC(图2E,F)进行诱导。图 2E显示几分钟后 S太少电的平稳感应和整个录制过程中的稳定频率。在这里,SLE活性在接受调查的患者的四片中成功诱导。一个切片在 SLE 活动 15 分钟后仅显示突发活动,而另一个切片即使在 40 分钟后也没有显示 SLE。
对于对物质效应的临床前评价,调查了高K++4-AP对突发活动的潜在抗癫+痫作用。已测试已知和潜在的抗癫痫物质(乳酰胺、DMEA、二诺啡14),此处显示了常规的AED乳糖酰胺(钠通道阻滞剂)以及DMEA(一种新型潜在抗癫痫物质)20的例子。在应用乳酰胺和DMEA(图3C)期间,突发事件的事件数和事件间间隔(IEI)均有所下降,但振幅大多未受影响(图3D)。在切片的子集中,即使前几分钟实现了突发事件的感应,但活动频率在洗涤应用的 AED 期间没有恢复(此处未显示的数据,请参见 Kraus 等人20)。在这里,应用的药物被认为是诱导效果;然而,在长时间录制期间,突发活动的减少可能受到活动逐渐衰减的影响。因此,必须仔细解释结果。
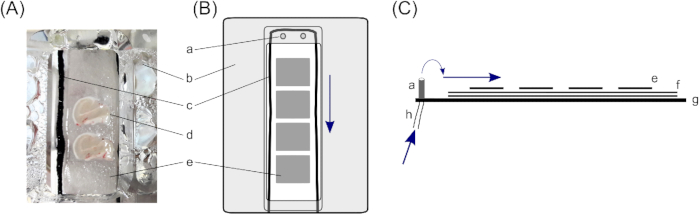
图1:接口室。用于存储人海马脑切片,使用具有两个脑片保持室的接口室 (A);具体来说,哈斯型接口室23。在这里,海马脑片以(d) 三层滤纸、(e) 小片来处理单个脑片,以及 (f) 较大的滤纸片,以确保切片下方有足够的溶液层。(c) 在滤纸顶部围绕大脑切片的棉串,确保从隔间顶部的 ( a )入口流出均匀的溶液。(b) 盖盖将氧气从隔间下方引导到切片上。 (B) 一个切片保持舱的顶视图。 (C) 侧视图,以说明过滤纸的层。 (g) 室的底部。(h) 溶液流入管,连接到近源泵(蓝色箭头标记溶液流的方向)。 请单击此处查看此图的较大版本。
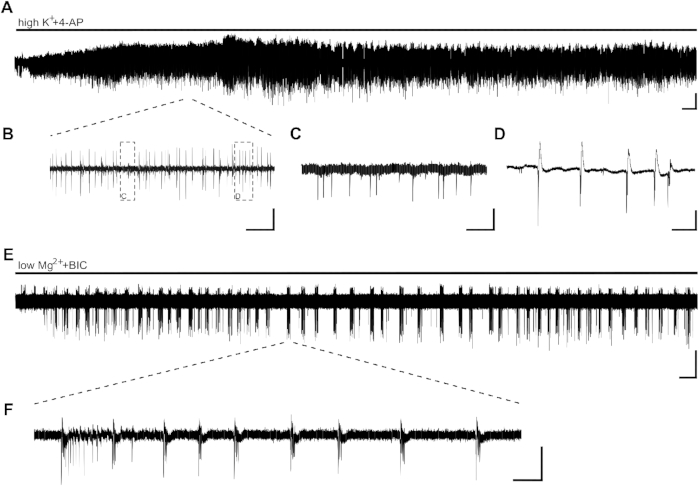
图2:由高K+4-AP和低MG2=BIC诱导的人类海+马切片的表皮活性。CA1 示例录制和摘录应用高K= (8 mM)+4-AP (100 μM) (A,B,C,D) 和低MG2 =BIC (10 μM) (E,F)。(A)高K +4-AP 的沐浴应用可在几分钟内诱导表皮活动,活动至少稳定 60 分钟。 (A) 的详细信息见 (B)。+在人类海马切片的CA1区域中诱导了两种不同类型的活动:间向尖刺(C,[B] 的细节)和突发活动(D,[B] (D, 的细节)。的爆发活性被证明对抗癫痫药物敏感,因此分析潜在的抗癫痫物质的作用(图3)。(E,F)LowMg2++BIC 的应用会在几分钟内在 CA1 中诱导在 +gt;10 s (F) 的持续时间内进行 S太少。但是,在其他切片中,S自感应最多可能需要 30 分钟。刻度杆 = 0.2 mV、2 分钟 (A,E)、5 s (B)、500 ms (C,D)、5 分钟 (E) 和 2 s (F)。这个数字是根据克劳斯等人20。请单击此处查看此图的较大版本。
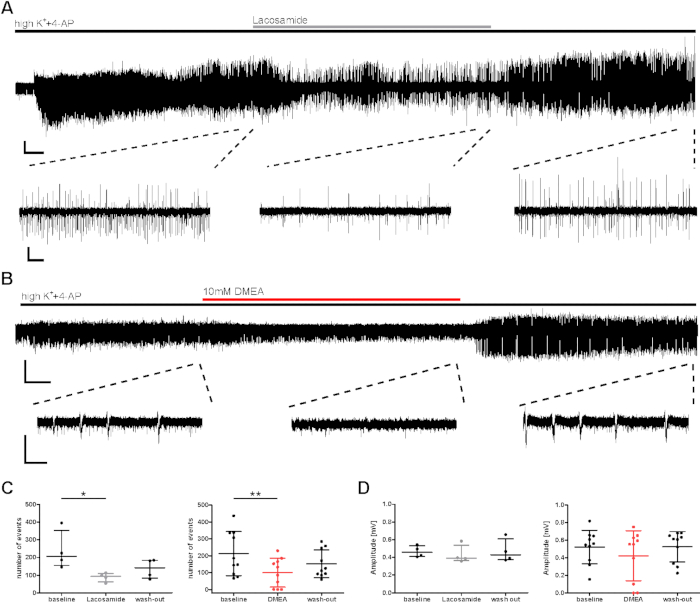
图3:在应用乳酰胺或DMEA期间,人体切片的癫痫突发活性降低。在应用(A) 乳酰胺和 ( B )DMEA时,爆发活性降低, 这是一种潜在的新型抗癫痫分子.(A) 和 (B) 显示 CA1 区域的模范记录,并摘录用于 (C) 和 (D) 中用于分析的区域。在乳酰胺 (100 μM) 和 DMEA (10 mM) 应用期间,突发活性降低,中间摘录显示,在洗涤期间再次增加。(C,D)在每个应用阶段的最后 5 分钟(基线、乳酰胺/DMEA、洗涤)中分析了突发活动的数量和振幅,并显示为所有患者的汇总结果(事件数、C;振幅、D)为均值 + SD。每个点表示一个患者。星号标记弗里德曼测试和后场评估显著差异,Dunnett 对组进行多重比较,以分析乳酰胺应用(*p < 0.05,n = 4),或重复测量 ANOVA 和后刻与 Tukey 的比较,用于分析 DMEA 应用(**p < 0.01,n = 10)。比例线 = 0.2 mV,2 分钟(完整录制,A),5 秒(摘录,A),3 分钟(完整录制,B)和 1 秒(摘录,B)。这个数字是根据克劳斯等人20。请单击此处查看此图的较大版本。
| 解决方案 1.1 胆碱 aCSF | |||
| 物质 | 10 倍浓度 (mM) | 1 倍浓度 (mM) | 注意 |
| 胆碱 Cl | 1100 | 110 | |
| (*) - 娜 L - 抗血 | 116 | 11.6 | |
| Mgcl2x6H2O | 70 | 7 | |
| 纳皮鲁瓦特 | 31 | 3.1 | |
| 氯化钾 | 25 | 2.5 | |
| NaH2PO4 | 12.5 | 1.25 | |
| 纳赫科3 | 260 | 26 | |
| CaCl2 | - | 0.5 | 添加到最终解决方案 |
| 葡萄糖 | - | 10 | 添加到最终解决方案 |
| 解决方案 1.2 aCSF | |||
| 物质 | 10 倍浓度 (mM) | 1 倍浓度 (mM) | 注意 |
| Nacl | 1290 | 129 | |
| NaH2PO4 | 12.5 | 1.25 | |
| CaCl2 | 16 | 1.6 | |
| 氯化钾 | 30 | 3 | |
| Mgso4 | 18 | 1.8 | |
| 葡萄糖 | - | 10 | 添加到最终解决方案 |
| 解决方案 1.3 高 K = +4-AP aCSF+ | |||
| 物质 | 10 倍浓度 (mM) | 1 倍浓度 (mM) | 注意 |
| Nacl | 1240 | 124 | |
| NaH2PO4 | 12.5 | 1.25 | |
| CaCl2 | 16 | 1.6 | |
| 氯化钾 | 80 | 8 | |
| Mgso4 | 18 | 1.8 | |
| 葡萄糖 | - | 10 | 添加到最终解决方案 |
| 4-AP | - | 0.1 | 添加到最终解决方案 |
| 解决方案 1.4 lowMg2=BIC aCSF | |||
| 物质 | 10 倍浓度 (mM) | 1 倍浓度 (mM) | 注意 |
| Nacl | 1300 | 130 | |
| NaH2PO4 | 12.5 | 1.25 | |
| CaCl2 | 16 | 1.6 | |
| 氯化钾 | 30 | 3 | |
| 葡萄糖 | - | 10 | 添加到最终解决方案 |
| 比克 | - | 0.01 | 添加到最终解决方案 |
| 解决方案 2 | |||
| 物质 | 10 倍浓度 (mM) | 1 倍浓度 (mM) | 注意 |
| 纳赫科3 | 210 | 21 | |
表1:为运输、准备和记录准备10倍和最后1x解决方案。
讨论
活的人类脑组织是进行前临床评估的一种非常有价值的工具,因为它恰当地代表了一个完好无损的人类大脑微网络。所提出的协议描述了一种组织运输和制备方法,该方法确保了高质量的海马切片,以及一种对进行 AED 评估至关重要的表皮活性的稳定诱导方法。
研究表皮表的活动,以及化学或电诱导的方法在人脑切片之前已经显示其他组17,20,21,22。,21,2217,该协议描述了通过应用高K+++4-AP,在不同患者的切片中诱导+稳定的突发活性,以及通过低Mg 2++BIC在CA1区域诱导S一次S经:研究发现,与诱导S经测试切片(一个患者中50%的经测试切片)更一致(15例患者中80%的试验切片)。然而,到目前为止,S下环的诱导只在一名患者中进行了测试。然而,建议采用低 Mg2++BIC 诱导 SES,因为 S下尚未能够使用高 K++4-AP 诱导。
一些研究引入了人类脑组织的运输和制备方法,并经常强调对神经元生存至关重要的三个因素:运输时间、使用的运输解决方案和储存条件。
为了获得最佳的切片生存能力,一些小组建议,被切除的脑组织的传输尽可能短。但是,操作室和实验室很少靠近,这意味着切片质量可能会因运输时间长而受到影响。一些组克服了这一障碍,在传输12期间对溶液应用常数 O 2。我们已经运输脑组织短(最大 = 15分钟)和长(长达1小时)的时间没有恒定的额外O 2供应在运输过程中,类似于其他组18,25。,25在这些情况下,在表皮记录期间未观察到组织质量的差异。在与其他研究所的交流中,切片质量也没有改变,因为贴片钳实验也没有变化。相比之下,组织质量的差异可能源于手术期间的损伤、长时间的切除和切片过程。
关于运输和切割溶液,所有已发布的方法都从溶液中省略了 NaCl,以减少由于渗透压力导致的细胞肿胀,类似于啮齿动物贴片夹实验的标准程序。然而,到目前为止,已经引进了几种替代品(即,基于蔗糖的ACSF13、22、,22基于NMDG的ACSF12、26,26和基于胆碱的ACSF 27)。Ting 和他的同事在 2014 年26年介绍了基于 NMDG 的 aCSF 切片准备,随后添加了恢复协议,该协议缓慢地将 NaCl 重新引入切片 28。然而,正如Ting等人所描述的,在基于NMDG的ACSF中培养的脑组织神经元表现出较高的膜电阻,从而在贴片夹实验26期间影响全细胞密封。因此,我们已经从基于NMDG的ACSF过渡到使用基于胆碱的ACSF 20,它为现场电位和补丁夹记录产生高质量的切片。
关于切片的储存,人们普遍认为接口条件为长片生存提供了最佳的氧合。然而,其他组显示切片生存长达72小时在水下条件下12。与之前的假设相反,与啮齿动物切片相比,人类脑片似乎对低氧合或氧化应激的抵抗力更强。接口室以前主要用于储存人类海马切片,但建议在贴片实验中为维持人脑切片而采用水下条件。
正如其他组所讨论的,长片生存的另一个关键步骤(接口为<48 h18,淹没为<72 h12)是防止细菌污染。啮齿动物脑片通常用于长达 8 小时的物理物理记录,细菌污染不被认为会影响切片在此期间的生存能力。从一次切除中准备的切片数量之多,以及人类脑组织异常可用,都凸显了延长人类脑切片生存能力的需要。该方法成功地描述了活人海马脑切片的准备,它很容易适应无菌条件。但是,对于此处执行的录制,切片生存期延长 20 h 不是优先事项。
在接口室中记录也被证明对诱导表皮活动(如SLE22)至关重要。由于低氧合,被淹没的条件很少用于记录 SES;然而,它们是贴片夹实验所需的光学高分辨率所必需的。由于高氧合和快速药物应用,使用优化的水下型记录室可以记录人脑切片中的表皮活性(细胞外场或单神经元)。在这里,介绍了现场潜在记录的方法和结果,但应该强调的是,使用这个修改的录音室在小鼠和人脑切片中成功地执行了贴片夹记录(未显示数据)。
与啮齿动物模型相比,被切除的人类脑组织具有较高的转化价值。它代表一个成人,患病的神经元网络,不能由icPC复制。然而,在任何体 外系统中, 人脑切片并不代表完整的人脑。此外,被切除的脑组织记录的神经元网络在手术或制备过程中由于损伤而可能发生大量的分子和功能变化。切片程序已被证明影响GABAergic功能,并可能影响表皮活性30的诱导。在制定假设时应考虑这些限制。在测试潜在的抗癫痫药物时,应考虑使用不同的大脑区域,因为药物靶点可能并非在所有人脑区域或所有患者中表达。特别是,TLE患者的海马经常表现出海马硬化症的迹象,并伴有严重的神经元细胞丧失。建议获取患者有关病理变化和疾病史的信息,如药物的潜在耐火材料,并在数据解释过程中考虑这一点。
总之,该方法成功地描述了活人海马脑切片的准备和诱导技术,用于记录两种不同类型的表皮活动。由于活的人类脑组织的供应是罕见的,应使用优化的传输和记录条件,以确保使用人脑切片的实验的最大输出。建议除啮齿动物模型和细胞培养实验外,可用作临床前验证工具。
披露声明
提交人声明没有利益冲突。
致谢
我们感谢曼迪·马布勒-普埃特(柏林的慈善-无名小子)的出色技术援助。P.F. 由德国研究基金会 (DFG, 德国 Forschungsgemeinschaft) 根据德国的卓越战略 - EXC-2049-390688087 资助。这项工作得到了柏林卫生研究院QUEST生物医学研究中心的支持。
材料
| Name | Company | Catalog Number | Comments |
| (+)-Na L-ascorbate | Sigma Aldrich | A4034 | |
| 4-AP | Sigma Aldrich | 275875-5G | |
| Blades | eliteSERVE GmbH | HW3 | used for the vibratome |
| CaCl2 | Merck | 102382 | |
| Choline Cl | Sigma Aldrich | C1879 | |
| Filter paper | Tiffen | EK1546027T | |
| Gas-tight bottle caps | Carl Roth GmbH+Co.KG | E694.1 | |
| Glass filaments | Science Products | GB150F-8P | for recording electrodes |
| Glass gas disperser | DWK Life Sciences GmbH | 258573309 | |
| Glucose | Sigma Aldrich | G7528 | |
| Interface Chamber | inhouse made | - | see Haas et al., 1979 |
| KCl | AppliChem | 131494.1210 | |
| Membrane (Cell culture inserts) | Merck | PICM030050 | |
| Membrane chamber | inhouse made | - | see Hill and Greenfield, 2011 |
| MgCl2?6H2O | Carl Roth | HNO3.2 | |
| MgSO4 | Sigma Aldrich | M7506 | |
| Na pyruvate | Sigma Aldrich | P8574 | |
| NaCl | Carl Roth | 3957.1 | |
| NaH2PO4 | Merck | 106346 | |
| NaHCO3 | Carl Roth | HNO1.2 | |
| Peristaltic pump | Gilson | Minipuls 3 | |
| Slice holder | Warner instruments | SHD-41/15 | |
| Vertical puller | Narishige | PC-10 | |
| Vibratome | Leica | VT1200S |
参考文献
- Hirtz, D., et al. How common are the "common" neurologic disorders. Neurology. 68 (5), 326-337 (2007).
- Ngugi, A. K., Bottomley, C., Kleinschmidt, I., Sander, J. W., Newton, C. R. Estimation of the burden of active and life-time epilepsy: a meta-analytic approach. Epilepsia. 51 (5), 883-890 (2010).
- Kwan, P., Brodie, M. J. Early Identification of Refractory Epilepsy. New England Journal of Medicine. 342 (5), 314-319 (2000).
- Löscher, W. Critical review of current animal models of seizures and epilepsy used in the discovery and development of new antiepileptic drugs. Seizure. 20 (5), 359-368 (2011).
- Ledri, M., et al. Differential Effect of Neuropeptides on Excitatory Synaptic Transmission in Human Epileptic Hippocampus. The Journal of Neuroscience: the official journal of the Society for Neuroscience. 35 (26), 9622-9631 (2015).
- Qi, X. R., et al. Alterations in the steroid biosynthetic pathways in the human prefrontal cortex in mood disorders: A post-mortem study. Brain Pathology. 28 (4), 536-547 (2018).
- Verwer, R. W. H., et al. Post-mortem brain tissue cultures from elderly control subjects and patients with a neurodegenerative disease. Experimental Gerontology. 38 (1-2), 167-172 (2003).
- Verwer, R. W. H., et al. Cells in human postmortem brain tissue slices remain alive for several weeks in culture. FASEB journal official publication of the Federation of American Societies for Experimental Biology. 16 (1), 54-60 (2002).
- Le Maître, T. W., Dhanabalan, G., Bogdanovic, N., Alkass, K., Druid, H. Effects of Alcohol Abuse on Proliferating Cells, Stem/Progenitor Cells, and Immature Neurons in the Adult Human Hippocampus. Neuropsychopharmacology. 43 (4), 690-699 (2018).
- Dennis, C. V., Suh, L. S., Rodriguez, M. L., Kril, J. J., Sutherland, G. T. Human adult neurogenesis across the ages: An immunohistochemical study. Neuropathology and Applied Neurobiology. 42 (7), 621-638 (2016).
- Verwer, R. W. H., et al. Mature astrocytes in the adult human neocortex express the early neuronal marker doublecortin. Brain. 130 (12), 3321-3335 (2007).
- Ting, J. T., et al. A robust ex vivo experimental platform for molecular-genetic dissection of adult human neocortical cell types and circuits. Scientific Reports. 8 (1), 8407 (2018).
- Le Duigou, C., et al. Imaging pathological activities of human brain tissue in organotypic culture. Journal of Neuroscience Methods. 298, 33-44 (2018).
- Agostinho, A. S., et al. Dynorphin-based "release on demand" gene therapy for drug-resistant temporal lobe epilepsy. EMBO molecular medicine. 11 (10), 9963 (2019).
- Hodge, R. D., et al. Conserved cell types with divergent features in human versus mouse cortex. Nature. 573 (7772), 61-68 (2019).
- Beaulieu-Laroche, L., et al. Enhanced Dendritic Compartmentalization in Human Cortical Neurons. Cell. 175 (3), 643-651 (2018).
- Sandow, N., et al. Drug resistance in cortical and hippocampal slices from resected tissue of epilepsy patients: no significant impact of p-glycoprotein and multidrug resistance-associated proteins. Frontiers in Neurology. 6, 30 (2015).
- Wickham, J., et al. Prolonged life of human acute hippocampal slices from temporal lobe epilepsy surgery. Scientific Reports. 8 (1), (2018).
- Avoli, M., Jefferys, J. G. R. Models of drug-induced epileptiform synchronization in vitro. Journal of Neuroscience Methods. , (2015).
- Kraus, L., et al. Dimethylethanolamine Decreases Epileptiform Activity in Acute Human Hippocampal Slices in vitro. Frontiers in Molecular Neuroscience. 12, 209 (2019).
- Antonio, L. L., et al. In vitro seizure like events and changes in ionic concentration. Journal of Neuroscience Methods. , (2016).
- Gabriel, S., et al. Stimulus and Potassium-Induced Epileptiform Activity in the Human Dentate Gyrus from Patients with and without Hippocampal Sclerosis. Journal of Neuroscience. 24 (46), 10416-10430 (2004).
- Haas, H. L., Schaerer, B., Vosmansky, M. A simple perfusion chamber for the study of nervous tissue slices in vitro. Journal of Neuroscience Methods. 1 (4), 323-325 (1979).
- Hill, M. R. H., Greenfield, S. A. The membrane chamber: a new type of in vitro recording chamber. Journal of neuroscience methods. 195 (1), 15-23 (2011).
- Andersson, M., et al. Optogenetic control of human neurons in organotypic brain cultures. Scientific Reports. 6, 24818 (2016).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. Acute brain slice methods for adult and aging animals: application of targeted patch clamp analysis and optogenetics. Methods in molecular biology. 1183, 221-242 (2014).
- Testa-Silva, G., et al. Human synapses show a wide temporal window for spike-timing-dependent plasticity. Frontiers in Synaptic Neuroscience. 2, 12 (2010).
- Ting, J. T., et al. Preparation of Acute Brain Slices Using an Optimized N-Methyl-D-glucamine Protective Recovery Method. Journal of Visualized Experiments. (132), (2018).
- Morris, G., Jiruska, P., Jefferys, J. G. R., Powell, A. D. A New Approach of Modified Submerged Patch Clamp Recording Reveals Interneuronal Dynamics during Epileptiform Oscillations. Frontiers in Neuroscience. 10, 519 (2016).
- Valeeva, G., Valiullina, F., Khazipov, R. Excitatory actions of GABA in the intact neonatal rodent hippocampus in vitro. Frontiers in Cellular Neuroscience. , (2013).
Erratum
Formal Correction: Erratum: Preparation of Acute Human Hippocampal Slices for Electrophysiological Recordings
Posted by JoVE Editors on 7/13/2020. Citeable Link.
An erratum was issued for: Preparation of Acute Human Hippocampal Slices for Electrophysiological Recordings. Step 2.1.3 in the Protocol was corrected.
Step 2.1.3 in the Protocol was updated from:
Add final concentrations of glucose and MgCl, then stir until dissolved (Table 1, solution 1.1).
to:
Add final concentrations of glucose and CaCl2, then stir until dissolved (Table 1, solution 1.1).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。