Method Article
توليد عضويات معوية مشتقة من hiPSC لتطبيقات النمذجة التنموية والمرضية
In This Article
Summary
يسمح هذا البروتوكول بتمايز الخلايا البشرية متعددة القدرات إلى عضويات معوية. يحاكي البروتوكول التطور البشري الطبيعي عن طريق تمييز الخلايا إلى مجموعة من الأديم الباطن النهائي والأديم الباطن الخلفي ثم ظهارة الأمعاء. هذا يجعل البروتوكول مناسبا لدراسة كل من نمو الأمعاء وكذلك تطبيقات نمذجة الأمراض.
Abstract
العضويات المعوية المشتقة من hiPSC هي هياكل ظهارية تتجمع ذاتيا من الخلايا المتمايزة إلى هياكل 3D معقدة ، ممثلة لظهارة الأمعاء البشرية ، حيث تظهر هياكل تشبه القبو / الزغب. هنا ، نصف توليد العضويات المعوية المشتقة من hiPSC من خلال التمايز التدريجي ل hiPSCs إلى الأديم الباطن النهائي ، والذي يتم بعد ذلك خلفه لتشكيل ظهارة الأمعاء الخلفية قبل نقله إلى ظروف ثقافة 3D. تتكون بيئة الثقافة ثلاثية الأبعاد من مصفوفة خارج الخلية (ECM) (على سبيل المثال ، Matrigel أو غيرها من ECM المتوافقة) مكملة ب SB202190 و A83-01 و Gastrin و Noggin و EGF و R-spondin-1 و CHIR99021. تخضع المواد العضوية للمرور كل 7 أيام ، حيث يتم تعطيلها ميكانيكيا قبل نقلها إلى مصفوفة جديدة خارج الخلية ويسمح لها بالتوسع. يؤكد QPCR والكيمياء الخلوية المناعية أن الكائنات العضوية المعوية المشتقة من hiPSC تحتوي على أنواع الخلايا الظهارية المعوية الناضجة بما في ذلك الخلايا الكأسية وخلايا بانيث والخلايا المعوية. بالإضافة إلى ذلك ، تظهر الكائنات العضوية دليلا على الاستقطاب عن طريق التعبير عن الفيلين الموضعي على السطح القمي للخلايا الظهارية.
يمكن استخدام المواد العضوية الناتجة لنمذجة نمو الأمعاء البشرية بالإضافة إلى العديد من الأمراض المعوية البشرية بما في ذلك مرض التهاب الأمعاء. لنمذجة الالتهاب المعوي ، يمكن أن تتعرض الكائنات العضوية لوسطاء التهابيين مثل TNF-α و TGF-β و LPS البكتيرية. تظهر الكائنات العضوية المعرضة للسيتوكينات المسببة للالتهابات نمطا ظاهريا التهابيا وتليفيا استجابة لذلك. قد يكون الاقتران بين الأصحاء مقابل hiPSCs المشتقة من مرضى داء الأمعاء الالتهابي مفيدا في فهم الآليات التي تقود مرض التهاب الأمعاء. قد يكشف هذا عن أهداف علاجية جديدة ومؤشرات حيوية جديدة للمساعدة في التشخيص المبكر للمرض.
Introduction
خصائص الخلايا الجذعية متعددة القدرات (PSCs) ، مثل التجديد الذاتي والقدرة على التمايز إلى أي نوع من الخلايا في جسم الإنسان ، تجعلها أدوات قيمة في دراسة التنمية وأمراض الأمراض واختبار الأدوية1. تعد الخلايا الجذعية متعددة القدرات التي يسببها الإنسان (hiPSC) مفيدة بشكل خاص لدراسات نمذجة الأمراض حيث يمكن اشتقاقها من المرضى ، حيث تلتقط مباشرة الجينوم المسؤول عن النمط الظاهريللمرض 2,3. يمكن تمييز هذه hiPSCs إلى نوع الخلية المتأثر بالعيب الجيني مما يسمح بالفحص الدقيق للآلية الجزيئية للمرض4.
تهدف بروتوكولات التمايز ل PSCs البشرية إلى توجيه تمايز الخلايا عبر مراحل النمو الرئيسية عن طريق تنشيط أو تثبيط مسارات إشارات محددة تحكم الالتزام بالنسب والمواصفات. يتطلب الحفاظ على hiPSC في حالة متعددة القدرات مستويات معتدلة من إشارات Activin A (Act-A) ، في حين أن جرعة عالية من Act-A لمدة 3 أيام تلزم hiPSC بمصير نهائي للأديم الباطن (DE) 5,6. مسارات Act-A و Wnt الهوية الأمامية والخلفية المباشرة ل DE. تحفز الإشارات بواسطة Act-A علامات الأمعاء الأمامية (FG) مثل HEX و HNF4α و GATA4 ، بينما تمنع التعبير عن جينات الأمعاء الخلفية (HG) مثل CDX2. تحفز إشارات Wnt على التخلف عن DE ، والتي تتبنى بعد ذلك ملف تعريف التعبير الجيني HG 7,8. بمجرد تحديد هوية خلية HG ، يمكن نقل التمايز من 2D إلى 3D وتوجيهه نحو تكوين عضويات معوية.
عادة ما يتم استزراع الكائنات العضوية المعوية في مصفوفة 3D خارج الخلية (على سبيل المثال ، Matrigel أو غيرها من ECMs المتوافقة) نظام الثقافةالقائم على 9 ، ويتألف من اللامينين والكولاجين الرابع والأنتاكتين والمخصب بعوامل النمو مثل EGF و FGF و PDGF و IGF-1 للمساهمة في دعم البقاء والانتشار. يتم استزراع الكائنات العضوية في وسط محدد يحتوي على Gastrin و Noggin و CHIR لتحفيز ودعم نمو الخلايا الجذعية المعوية وتكاثرها أثناء الزراعة طويلة الأجل.
بعد تضمين الخلايا الظهارية المعوية في المصفوفة خارج الخلية ، تبدأ الخبايا المعوية في التكون والتوسع في النهاية مكونة كرويات. هذه تنضج في الهياكل العضوية التي تحاكي الأداء الفسيولوجي للظهارة المعوية. يمكن عادة استزراع المواد العضوية لأكثر من 1 سنة دون خسارة كبيرة في ملامح التعبير الوظيفي والجيني. مطلوب المرور على أساس أسبوعي باستخدام الهضم الأنزيمي للعضويات إلى أجزاء أصغر ثم إعادة تجميعها ذاتيا في عضويات كاملة.
يمكن استخدام الخطوط العضوية الراسخة كنموذج موثوق للعديد من الاضطرابات المرتبطة بالأمعاء ، بما في ذلك مرض كرون والتهاب القولون التقرحي وسرطان القولون والمستقيم10،11،12،13. هذا هو النموذج المفضل للخلايا الحيوانية لأنها تعبر عن الجينات البشرية المرتبطة بهذه الاضطرابات وتستجيب للمنبهات الخارجية التي تشبه إلى حد كبير تلك التي تحدث في الأنسجة البشرية في الجسم الحي.
Protocol
ملاحظة: يجب أن تتم جميع أعمال زراعة الأنسجة المفصلة أدناه في غطاء التدفق الصفحي من الفئة الثانية.
1. تمايز الخلايا الجذعية متعددة القدرات التي يسببها الإنسان (hiPSCs) إلى الأديم الباطن في الأمعاء الخلفية
- لطلاء قارورة زراعة الخلايا بمصفوفة خارج الخلية ، احسب أولا كمية المصفوفة المطلوبة. فيما يلي مثال على صفيحة ذات 12 بئرا مطلية ب Matrigel. احسب الكمية المطلوبة من المصفوفة خارج الخلية لتغطية لوحة 12 بئر. استخدم الصيغة التالية:
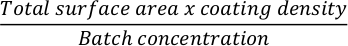
ملاحظة: قم بتغطية أطباق زراعة الخلايا بمصفوفة خارج الخلية من اختيارك. في حالة استخدام Matrigel ، استخدم تركيز 0.035 مجم / سم2 24 ساعة قبل البذر للتمايز. تحقق من تركيز دفعة المصفوفة خارج الخلية على ورقة المنتج وقم بإعداد حصص أصغر قبل التجارب وفقا لتعليمات الشركة المصنعة. - قم بتخفيف الكمية المطلوبة من المصفوفة خارج الخلية في وسائط DMEM الباردة باستخدام ماصة p1000.
- تخلط جيدا باستخدام شريط 5 مل.
- أضف 500 ميكرولتر من المصفوفة المخففة إلى كل لوحة بئر. رج الطبق برفق لتوزيع المصفوفة المخففة خارج الخلية بالتساوي واحتضانها لمدة لا تقل عن 12 ساعة عند 37 درجة مئوية.
- قبل زرع الخلايا في اللوحة ، اغسل كل بئر ب 500 ميكرولتر من PBS لإزالة المصفوفة الزائدة خارج الخلية. هذا سيمنع انفصال الخلية أثناء التمايز.
- اترك الغسل الأخير في الآبار حتى يصبح جاهزا للبذور لمنع جفاف المصفوفة خارج الخلية.
- لزرع تمايز hiPSCs نحو الأديم الباطن النهائي (DE) أو الأمعاء الخلفية (HG) ، خذ قارورة من hiPSCs المزروعة في وسائط صيانة من اختيارك (على سبيل المثال: وسائط 8 أساسية) واستنشق الوسائط. (هنا ، نقوم بزرع الخلايا بمعدل 25000 خلية / سم2).
ملاحظة: كثافة البذر أمر بالغ الأهمية للتمايز الناجح وتحتاج إلى تحسين لكل خط خلية hiPSC فردي. - اغسل الخلايا في القارورة ب 5 مل من برنامج تلفزيوني. نضح برنامج تلفزيوني.
- أضف 2.5 مل من محلول تفكك الخلايا (على سبيل المثال ، TrypLE) واتركه في RT لمدة 4 دقائق. نضح محلول تفكك الخلايا واضغط على القارورة برفق لفصل الخلايا.
- اغسل القارورة ب 5 مل من وسائط DMEM الدافئة إلى 37 درجة مئوية واجمع كل الخلايا في أنبوب سعة 15 مل.
- خذ 10 ميكرولتر من محلول الخلايا المعاد تعليقه وقم بقياس كثافة الخلية باستخدام مقياس الدم.
- خذ ما يكفي من معلق الخلية لجمع 1.05 × 106 خلايا ووضعها في أنبوب 15 مل.
- تدور في 160 × غرام لمدة 3 دقائق. أثناء طرد الخلايا ، قم بنضح PBS من المصفوفة خارج الخلية المغلفة ب 12 صفيحة بئر.
- بعد الطرد المركزي ، قم بشفط المادة الطافية وإعادة تعليق حبيبات الخلية في 12 مل من وسائط الصيانة باستخدام مثبط ROCK (10 ميكرومتر).
- باستخدام ماصة p1000 ، أضف 1 مل من تعليق الخلية إلى كل بئر من لوحة البئر 12. إعادة تعليق الخلايا جيدا لضمان التوزيع المتساوي بين الآبار.
- هز اللوحة برفق لتوزيع الخلايا داخل آبار اللوحة ولكن تجنب دوامات الوسائط لأنها ستركز الخلايا في منتصف الآبار.
- ضع في حاضنة 37 درجة مئوية ، 5٪ CO2 .
- قم بتغيير الوسائط إلى وسائط الصيانة (على سبيل المثال ، 8 وسائط أساسية) فقط (بدون مثبط ROCK) بعد 24 ساعة من البذر.
- لبدء التمايز إلى DE ، قم بإعداد وسط الأديم الباطن القاعدي وفقا للجدول 1.
ملاحظة: في بداية خلايا التمايز يجب أن تكون بين التقاء 60-80٪. - قم بإعداد 12 مل من وسائط DE عن طريق إضافة Activin A (100 نانوغرام / مل) و Wnt3 (50 نانوغرام / مل) إلى وسط الأديم الباطن القاعدي.
- قم بتسخين الوسائط إلى 37 درجة مئوية.
- نضح الوسائط من كل بئر من صفيحة أو قارورة زراعة الأنسجة.
- ابدأ تمايز DE بإضافة 1 مل من وسائط DE إلى كل بئر من لوحة البئر ال 12.
- في 24 ساعة بعد بدء تمايز DE (D1 DE) ، قم بإعداد وسائط DE جديدة وقم بإجراء تغيير الوسائط.
- كرر الخطوة 1.24 عند 48 ساعة (D2 DE). في حالة وجود الكثير من موت الخلايا في هذه المرحلة ، اغسل جميع الآبار ب 500 ميكرولتر من PBS قبل تغيير الوسائط.
ملاحظة: لتأكيد تمايز الأديم الباطن الناجح ، قم بإجراء قياس التدفق الخلوي لتقييم التعبير عن SOX17. نتوقع عادة أن تكون >80٪ من الخلايا موجبة SOX17 بواسطة D3 DE. إذا كان التعبير عن SOX17 دون المستوى الأمثل ، فيجب تحسين كثافة بذر الخلايا وكذلك تركيزات Act-A. - ابدأ تمايز الزئبق عند هذه النقطة ، أي 72 ساعة بعد بدء تمايز DE. تحضير 12 مل من وسائط الزئبق بإضافة CHIR99021 (3 ميكرومتر) و RA (1 ميكرومتر) إلى وسط الأديم الباطن القاعدي (الجدول 1).
ملاحظة: في D3 DE ، يجب أن تكون الخلية قد شكلت طبقة أحادية موحدة. التمايز الأمثل DE أمر بالغ الأهمية لمراحل أخرى من التمايز. - نضح DE وسائل الإعلام.
- ابدأ تمايز HG بإضافة 1 مل من وسائط HG إلى كل بئر من لوحة البئر ال 12.
- استمر في التمايز لمدة 4 أيام مع تغييرات الوسائط اليومية.
ملاحظة: لتحديد نجاح DE posteriorization ، قم بإجراء قياس التدفق الخلوي لتقييم التعبير عن CDX2. بحلول D4 من تمايز HG ، نتوقع عادة أن تكون >80٪ من الخلايا إيجابية CDX2. إذا كان التأخير دون المستوى الأمثل ، فيجب تحسين تركيز CHIR99021. - لجمع عينة لاستخراج الحمض النووي الريبي ، قم بنضح وسائط التمايز واغسل البئر ب 500 ul من PBS.
- نضح PBS وإضافة حجم مناسب من المخزن المؤقت لتحلل الخلية من مجموعة استخراج الحمض النووي الريبي.
- باستخدام ماصة p1000 ، اكشط قاع البئر لضمان تحلل جميع الخلايا.
- نضح الخلية المحللة ووضعها في أنبوب نظيف.
- انتقل إلى استخراج الحمض النووي الريبي أو قم بتجميد المحللة عند -20 درجة مئوية حتى تصبح جاهزة لاستخراج الحمض النووي الريبي.
- للتلطيخ المناعي ، نضح وسائط التمايز وغسل الآبار مع 500 ميكرولتر من PBS.
- نضح PBS وإضافة 500 ميكرولتر من 4٪ PFA.
ملاحظة: PFA سامة. استخدم معدات الوقاية الشخصية المناسبة واتبع الإجراءات المختبرية المحلية للتخلص من PFA. - احتضان في 4 درجات مئوية لمدة 20 دقيقة.
- قم بإزالة PFA واغسل الآبار ب 500 ميكرولتر من PBS ثلاث مرات.
- اترك آخر غسل PBS على الخلايا حتى تصبح جاهزة لأداء تلطيخ المناعة.
2. تمرير العضويات المعوية
- تحضير الوسائط القاعدية المعوية وفقا للجدول 2.
- للانتقال من ثقافة الخلايا 2D إلى 3D ، استخدم لوحة بئر 6 لتوليد خلايا DE من hiPSCS. افصل الطبقة الأحادية للخلايا عن لوحة 6 خلايا باستخدام شريط سعة 5 مل.
- اجمع الخلايا في أنبوب طرد مركزي سعة 15 مل ، قبل الطرد المركزي عند 400 × جم لمدة 1 دقيقة لإنتاج حبيبات خلوية.
- إعادة تعليق حبيبات الخلية في أوساط نمو الأمعاء التي تحتوي على عوامل النمو: SB202190 (10 ميكرومتر) ، A83-01 (500 نانومتر) ، جاسترين (10 نانومتر) ، نوجين (100 نانوغرام / ميكرولتر) ، EGF (500 نانوغرام / ميكرولتر) ، R-Spondin1 (100 نانوغرام / مل) ، CHIR99021 (6 ميكرومتر) ، مثبط ROCK (10 ميكرومتر).
- أضف حجما مناسبا من المصفوفة خارج الخلية اعتمادا على عدد الآبار التي يتم طلاؤها. يمكن حساب ذلك باستخدام المعادلات الآتية.
[1] الحجم الإجمالي للمصفوفة / الوسائط خارج الخلية (ميكرولتر) = 30 ميكرولتر * عدد الآبار ذات الصفيحة المكونة من 48 بئرا
[2] الحجم المطلوب للمصفوفة خارج الخلية (ميكرولتر) = إجابة من [1] * 2/3
[3] الحجم المطلوب للوسائط (ميكرولتر) = إجابة من [1] * 1/3 - أضف 30 ميكرولتر من تعليق الخلية إلى مركز كل بئر من لوحة 48 بئرا.
- احتضن اللوحة في حاضنة 37 درجة مئوية لمدة لا تقل عن 5 دقائق للسماح للمصفوفة خارج الخلية بالضبط.
- بمجرد ضبط قباب المصفوفة خارج الخلية ، أضف 300 ميكرولتر من وسائط نمو الأمعاء التي تحتوي على جميع عوامل النمو إلى كل بئر.
- أعد اللوحة إلى حاضنة 37 درجة مئوية مع 5٪ CO2.
ملاحظة: إذا لم يكن من الممكن ملاحظة أي عضويات بعد 48 ساعة و / أو كان هناك موت كبير للخلايا ، فقد تحتاج تركيزات ROCKi و NOGGIN إلى التحسين. - لتمرير الكائنات العضوية ، راقب الخلايا تحت المجهر الضوئي لتقييم كثافة وحجم الكائنات العضوية وتحديد ما إذا كانت بحاجة إلى المرور.
- استبدل وسائط زراعة الخلايا ب PBS بارد الجليد.
ملاحظة: ستحتاج الثقافات العضوية إلى الانقسام كل 5-7 أيام تقريبا. مطلوب تمرير الثقافات العضوية المعوية بمجرد تراكم حطام الخلايا الواضح داخل تجويف العضو واصفرار وسط نمو الأمعاء المحيط. - افصل ميكانيكيا المواد العضوية وكرة المصفوفة خارج الخلية عن اللوحة باستخدام حركة كشط بشريط 5 مل.
- اجمع المواد العضوية من كل بئر في أنبوب طرد مركزي سعة 15 مل.
- تعليق عضوي للطرد المركزي عند 400 × ز لمدة 1 دقيقة لحبيبات المواد العضوية. نضح المادة الطافية حتى تصل إلى قمة حبيبات الخلية ، مع توخي الحذر عند الوصول إلى طبقة المصفوفة خارج الخلية المرئية.
- أعد تعليق الحبيبات في 15 مل من برنامج تلفزيوني بارد مثلج.
ملاحظة: تعمل هذه الخطوة على غسل أي مصفوفة خارج الخلية متبقية لم تتم إزالتها في الدوران الأولي. - أجهزة الطرد المركزي في 400 × ز لمدة 1 دقيقة. نضح الوسائط حتى الحبيبات ، التي تحتوي على المواد العضوية.
- إعادة تعليق في 1 مل من برنامج تلفزيوني بارد مثلج. باستخدام ماصة p200 ، قم بتعطيل المواد العضوية السليمة يدويا عن طريق السحب لأعلى ولأسفل عدة مرات.
ملاحظة: راقب حجم الكائنات العضوية باستخدام المجهر الضوئي لتحديد ما إذا كانت بحاجة إلى مزيد من الانفصال. - أضف 9 مل من الوسائط بدون عوامل نمو.
- أجهزة الطرد المركزي في 400 × ز لمدة 1 دقيقة. نضح الطافي حتى حبيبات المواد العضوية.
- احسب الكمية المطلوبة من المصفوفة والوسائط خارج الخلية باستخدام المعادلات أدناه:
[1] الحجم الإجمالي للمصفوفة / الوسائط خارج الخلية (ميكرولتر) = 30 ميكرولتر * عدد الآبار ذات الصفيحة المكونة من 48 بئرا
[2] الحجم المطلوب للمصفوفة خارج الخلية (ميكرولتر) = إجابة من [1] * 2/3
[3] الحجم المطلوب للوسائط (ميكرولتر) = إجابة من [1] * 1/3 - أعد تعليق الحبيبات العضوية في الحجم المحسوب للوسائط المعوية مع عوامل النمو (بما في ذلك مثبطات Noggin و ROCK).
- أضف الحجم المطلوب من المصفوفة خارج الخلية إلى تعليق الخلية هذا وأعد تعليقه لضمان التوزيع المتساوي للعضويات.
- ماصة 30 ميكرولتر من هذا التعليق في وسط كل بئر من صفيحة بئر 48 (يفضل تسخينها مسبقا في حاضنة 37 درجة مئوية).
- أعد اللوحة إلى حاضنة 37 درجة مئوية لمدة 5 دقائق حتى يتم ضبط المصفوفة خارج الخلية.
- تحضير الوسائط المعوية مع عوامل النمو (+ مثبط ROCK) (حوالي 17 مل لكل 48 صفيحة بئر).
- أضف 300 ميكرولتر إلى كل بئر.
- احتضان عند 37 درجة مئوية عند 5٪ CO2.
- بعد المرور ، قم باستنشاق الوسائط للعضويات المعوية واستبدلها بوسائط معوية جديدة بعوامل نمو (بدون مثبط Noggin و ROCK) كل 2-4 أيام.
ملاحظة: إذا لم يكن من الممكن ملاحظة أي عضويات بعد 48 ساعة و / أو كان هناك موت كبير للخلايا ، فقد تحتاج تركيزات ROCKi و NOGGIN إلى التحسين.
ملاحظة: تستجيب الكائنات العضوية المعوية لمجموعة من الوسطاء الالتهابيين في الجسم الحي. TNFα هو بروتين يشير إلى الخلية يشارك في العديد من العمليات الالتهابية. - لتحفيز استجابة التهابية في العضويات المعوية ، قم بإعداد TNFα بتركيز 40 نانوغرام / مل في الوسط القاعدي فقط.
- نضح الوسائط من 48 لوحة بئر.
- أضف 300 ميكرولتر من الوسط القاعدي المحضر الذي يحتوي على 40 نانوغرام / مل TNFα.
- احتضان لوحة على حرارة 37 درجة مئوية لمدة 48 ساعة لتكرار بيئة مؤيدة للالتهابات.
ملاحظة: تستجيب الكائنات العضوية المعوية لمجموعة من الوسطاء الالتهابيين في الجسم الحي. TNFα هو بروتين يشير إلى الخلية يشارك في العديد من العمليات الالتهابية. - تخلص من أي خلايا متبقية عن طريق الشفط في مصيدة فراغ تحتوي على 5٪ Trigene.
النتائج
يظهر رسم تخطيطي لبروتوكول التمايز في الشكل 1 أ. في اليوم 1 من البروتوكول ، يجب أن تكون hiPSCs مضغوطة وتشكل مستعمرات صغيرة مع التقاء كلي حوالي 50-60٪. بعد 24 ساعة من تحريض التمايز نحو خلايا DE تبدأ في الهجرة بعيدا عن مستعمرات الخلايا الجذعية لتشكيل طبقة أحادية من الخلايا. يستمر هذا خلال الأيام الثلاثة التالية ويجب أن يشكل طبقة أحادية كاملة على D3 من تمايز DE (الشكل 1). يجب مراقبة التعبير الجيني على مدار التمايز باستخدام علامات تعدد القدرات (OCT4 ، NANOG ، SOX2) التي يتم التعبير عنها بشكل كبير على D0 ويتم تخفيضها بسرعة أثناء تمايز DE. أثناء التمايز DE ، يجب أن يصل تعبير T إلى ذروته في D1 ، يليه EOMES و MIXL على D2. على جينات D2 DE (SOX17 ، FOXA2 ، GATA4 ، CXCR4) يجب أن يبدأ التعبير عنها ويبلغ ذروتها عند D3 (الشكل 2 والشكل 3). يجب أن تكون الخلايا أحادية الطبقة بواسطة DE D3 ويمكن بعد ذلك وضعها في الأديم الباطن الخلفي. خلال حدث ما بعد الحدث ، ستبدأ الهياكل ثلاثية الأبعاد في التكون في وقت مبكر من D2. ومع ذلك ، في بعض الأحيان سيبدأون في الظهور فقط في D4 أو لا يظهرون على الإطلاق ؛ هذا لا يشير دائما إلى ما إذا كانت الخلايا ستستمر وتشكل عضويات معوية أم لا (الشكل 1). خلال مواصفات HG ، يجب تحفيز تعبير CDX2 و HNF4a وزيادة بمرور الوقت (الشكل 3).
بعد نقل صفائح 2D من الخلايا إلى مصفوفة خارج الخلية ، سيتم ملاحظة كتل من الخلايا ثنائية الأبعاد لأول 24 ساعة. بعد 48 ساعة ، يجب أن تبدأ أوراق الخلايا في التنظيم التلقائي في هياكل كروية ثلاثية الأبعاد أكثر ضغطا تكون صغيرة في البداية (الشكل 4 أ) ثم تزداد تدريجيا في الحجم والتعقيد على مدار 7-10 أيام من الثقافة (الشكل 4 ب والشكل 4 ج). لا ينبغي تمرير الكائنات العضوية حتى تحقق مورفولوجيا عضوية / كروية واضحة مع ظهارة واضحة مع توجيه التجويف نحو مركز العضوي / الكروي (الشكل 4 د). في هذه المرحلة ، يمكن استخدام الكيمياء المناعية لتأكيد التعبير عن علامات الأمعاء مثل villin و CDX2 (الشكل 5). لن تتطور جميع كتل خلايا 2D إلى عضويات وستكون هناك بعض الخلايا الميتة الملوثة داخل المصفوفة خارج الخلية. يجب تجاهل هذه الأوراق الميتة من الخلايا حتى تشكل الخلايا الباقية عضويات كبيرة وتكون جاهزة للمرور.
لنمذجة الالتهاب ، يمكن إضافة TNFα إلى وسط زراعة الأنسجة لمدة 24-48 ساعة. بعد الحضانة مع الجزيئات المسببة للالتهابات ، يتم حصاد الكائنات العضوية باستخدام نفس التقنية المستخدمة لعزلها وتمريرها ثم يتم تحليلها باستخدام تطبيق متوافق مع المخزن المؤقت للخلية مثل QPCR أو النشاف الغربي. إذا كانت هناك حاجة إلى تعرضات أقصر ، فيجب أولا إزالة المواد العضوية من المصفوفة خارج الخلية وتعريضها ل TNFα في التعليق باستخدام أنبوب 1.5 مل. عادة ما يؤدي علاج العضويات المعوية باستخدام TNFα لمدة 48 ساعة إلى التعبير عن العلامات المؤيدة للالتهابات (TNFα ، IL1B ، IL8 ، IL23) بينما يؤثر سلبا على التعبير عن العلامات الظهارية المعوية (LGR5 ، VIL) (الشكل 6).
| الأديم الباطن القاعدي وسائل الإعلام | 50 مل | |
| RPMI 1640 | 48.5 مل | |
| ملحق B27 | 1 مل | |
| 1٪ NEAA | 0.5 مل | |
الجدول 1: تكوين الوسط القاعدي الباطن لتمايز الأديم الباطن.
| وسائل الإعلام القاعدية المعوية | 50 مل | |
| DMEM/F12 المتقدم | 46.5 مل | |
| هيبس العازلة | 0.5 مل | |
| جلوتا ماكس | 0.5 مل | |
| نيكوتيناميد | 0.5 مل | |
| ملحق N2 | 0.5 مل | |
| ملحق B27 | 1.0 مل | |
| قلم/بكتيريا | 0.5 مل | |
الجدول 2: تكوين الوسائط القاعدية المعوية لثقافة الكائنات العضوية المعوية
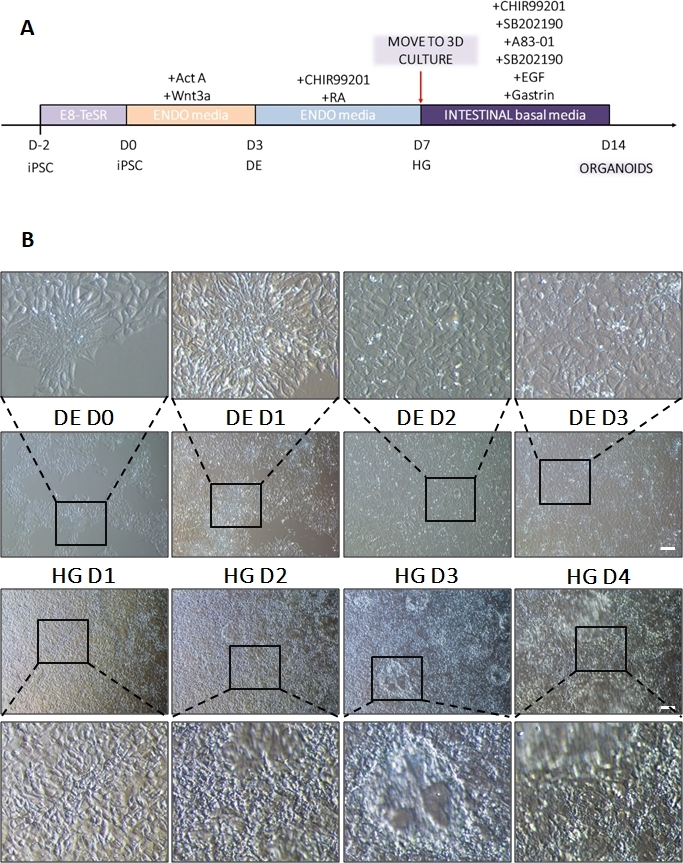
الشكل 1: التغيرات المورفولوجية أثناء تمايز hiPSC عبر الأديم الباطن النهائي إلى سلالة الأمعاء الخلفية.
(أ) نظرة عامة تخطيطية على بروتوكول التمايز المعوي. يشكل هذا الخط الخلوي من hiPSC مستعمرات فضفاضة من الخلايا الصغيرة ذات نسبة عالية من النواة إلى السيتوبلازم. مع استمرار التمايز ، تخضع الخلايا لتغييرات تتفق مع الانتقال من النمط الظاهري الظهاري إلى النمط الظاهري الوسيطة وبواسطة DE D3 تشكل طبقة أحادية موحدة. بمجرد تسليم الإشارات المناسبة ، تستطيل خلايا DE وتشكل طبقة أحادية أكثر كثافة مع ظهور كرويات ثلاثية الأبعاد بمجرد ظهور HD D3 ولكن هذا يعتمد على خط الخلية المستخدم وليس شرطا للانتقال إلى ثقافة ثلاثية الأبعاد (B). شريط المقياس: 100 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
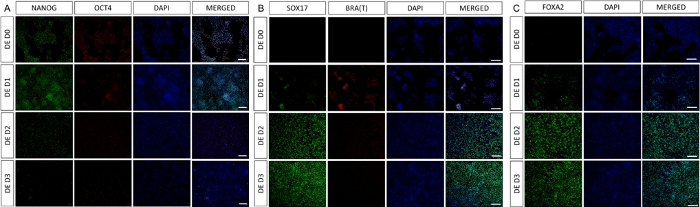
الشكل 2: يؤدي تمايز hiPSCs إلى الأديم الباطن HG إلى التعبير عن جينات الأديم الباطن.
يظهر التلوين المناعي ل hiPSC المتمايز إلى الأديم الباطن النهائي تغيرات في التعبير عن TFs على مستوى البروتين. يتم تخفيض علامات تعدد القدرات (NANOG و OCT4) بواسطة DE D3 (A). التعبير عن علامة الأديم المتوسط BRA (T) موجود في D1 من البروتوكول (B) و DE محددة TFs SOX17 و FOXA2 تظهر على D2 (B &C). شريط المقياس: 200 مم. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
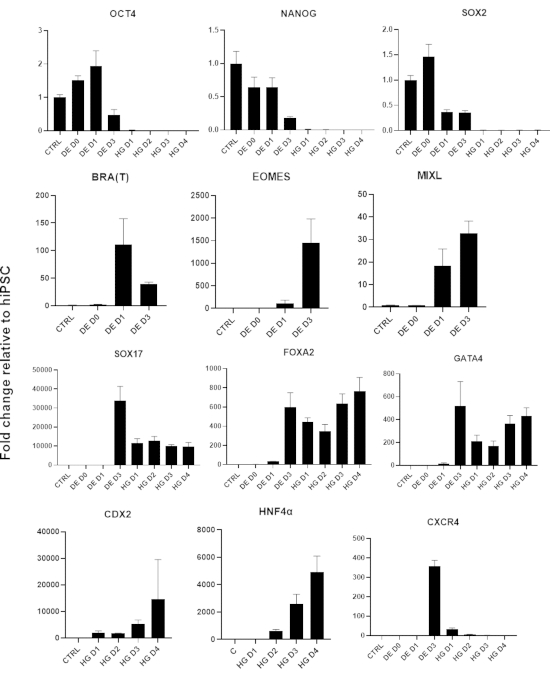
الشكل 3: يتغير التعبير الجيني بواسطة qPCR أثناء تمايز hiPSC إلى الأديم الباطن في الأمعاء الخلفية (HG).
يتم تنظيم الجينات المرتبطة بتعدد القدرات (OCT4 ، NANOG ، SOX2) متبوعة بالتعبير العابر لجينات الأديم المتوسط (T ، EOMES ، MIXL1) ، وأخيرا التعبير عن جينات DE (SOX17 ، FOXA2 ، CXCR4) وجينات الأمعاء الخلفية (CDX2 ، GATA4 ، HNF4a). البيانات المقدمة كمتوسط ±SD. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
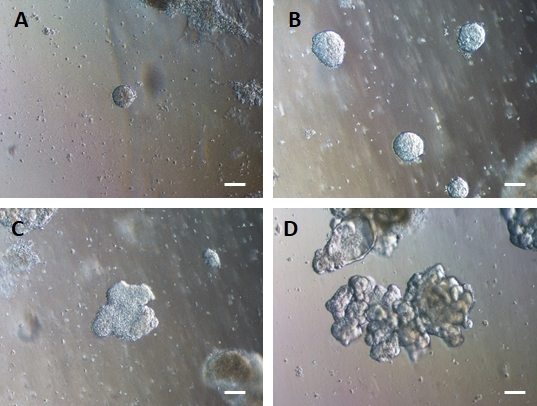
الشكل 4: يتجمع الأديم الباطن HG ذاتيا لتشكيل عضويات معوية ثلاثية الأبعاد في ثقافة مصفوفة خارج الخلية ثلاثية الأبعاد.
يتم نقل الأديم الباطن HG إلى ثقافة مصفوفة 3D خارج الخلية مناسبة ويشكل في البداية كتل صلبة صغيرة من الخلايا (A). تتوسع كتل الأديم الباطن HG على مدى 7-10 أيام من المزرعة (B) ثم تصبح غير متماثلة وتبدأ في تكوين ظهارة أكثر تعقيدا (C) مما يؤدي في النهاية إلى ظهور عضويات ذات مورفولوجيا ظهارية واضحة وسطح لمعي يواجه مركز العضو العضوي (D). أشرطة المقياس = 50 ميكرومتر يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
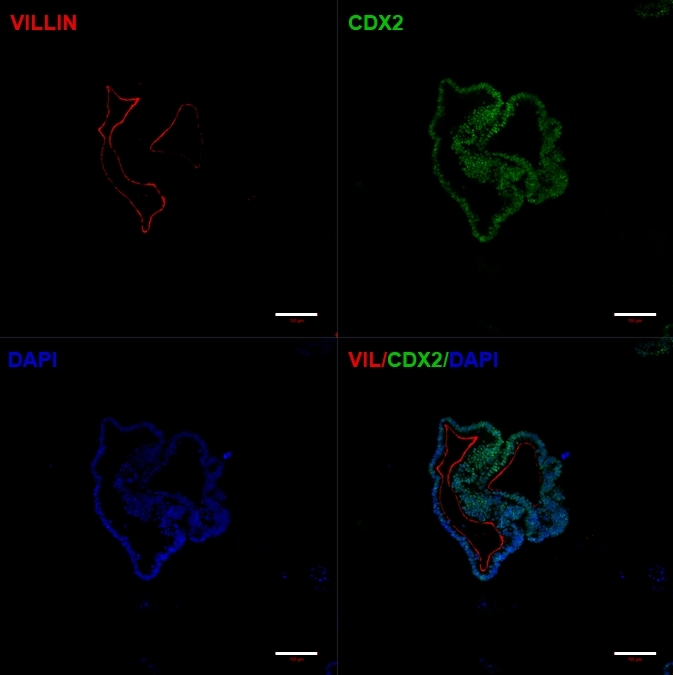
الشكل 5: تعبر الكائنات العضوية المعوية المشتقة من hiPSC عن علامات الأمعاء.
الكيمياء الخلوية المناعية تظهر تعبير CDX2 و Villin. قضبان المقياس = 100 ميكرومتر الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
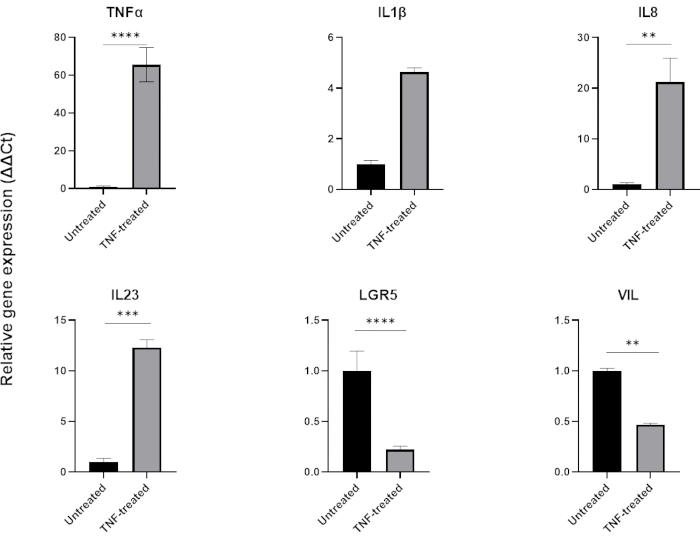
الشكل 6: تأثير TNFα على المظهر الالتهابي وتعبير الخلايا المعوية للعضويات المعوية الصحية.
الملف الالتهابي لعضويات القولون السليمة بعد العلاج لمدة 48 ساعة باستخدام TNFα (40 نانوغرام / مل). يزداد التعبير عن العلامات المؤيدة للالتهابات (TNFα و IL-8 و IL-23) بعد التعرض ل TNFα ، بينما في نفس الوقت يتم تنظيم التعبير عن العلامات الظهارية المعوية (LGR5 ، VIL). تم إجراء التحليلات الإحصائية بواسطة اختبار t للطالب على الوجهين. يتم التعبير عن البيانات كمتوسط ± SD لكل مجموعة. *P < .01; ** P < .001; P < .0001. (ن = 3). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
نصف هنا بروتوكولا لتمايز الخلايا البشرية متعددة القدرات إلى عضويات معوية بشرية. نثبت استخدامها لدراسة الالتهاب. ومع ذلك ، يمكن تطبيق هذا على سياقات مختلفة ، إلى جانب نهج تحرير الجينات CRISPR / Cas914 ، على أي خلفية وراثية. بمجرد التمايز ، باتباع تسلسل التمايز التنموي الطبيعي للأديم الباطن النهائي ، والأديم الباطن الخلفي ثم ظهارة الأمعاء ، يمكن زراعة المواد العضوية الناتجة وتمريرها باستمرار لأكثر من 12 شهرا.
أحد الجوانب الحاسمة لهذا البروتوكول هو كثافة الطلاء الأولية للخلايا الجذعية غير المتمايزة قبل تمايز الأديم الباطن. إذا لم يتم تحسين ذلك بشكل كاف ، فمن المحتمل أن تموت الخلايا أثناء خطوة تمايز DE الأولية (إذا كانت الخلايا متناثرة جدا) أو تقلل من كفاءة تمايز DE (إذا كانت الخلايا كثيفة جدا). يجب تحسين كثافة البدء الصحيحة لخط الخلية المستخدم ، ويجب أن تولد الكثافة الصحيحة طبقة أحادية بنهاية DE D3. يجب استخدام قياس التدفق الخلوي لتحديد كفاءة مواصفات DE ونرى عادة >80٪ من الخلايا إيجابية ل SOX17 و / أو CXCR4. عندما يكون عدد الخلايا الإيجابية SOX17 أقل من 60٪ ، تتأثر كفاءة نمط الزئبق ، مما يؤدي إلى تكوين عدد أقل من المواد العضوية عند نقلها إلى المصفوفة خارج الخلية. سيؤدي هذا في النهاية إلى فشل الثقافات العضوية الناتجة. لتحديد ما إذا كان نمط DE إلى HG ناجحا ، نقوم بتقييم عدد الخلايا الإيجابية CDX2 عن طريق قياس التدفق الخلوي ونتوقع عادة رؤية >80٪ خلايا إيجابية. مرة أخرى ، إذا انخفض عدد الخلايا الإيجابية CDX2 إلى أقل من 50٪ ، فسيكون لذلك تأثير سلبي على عدد الكائنات العضوية المعوية التي يتم إنشاؤها عند نقلها إلى ثقافة مصفوفة 3D خارج الخلية.
بعد نقل أحاديات الطبقات 2D إلى ثقافة 3D ، يجب أن تظهر كرات صغيرة مدمجة بعد 24-48 ساعة من النقل. يمكن أن تظهر صفائح كبيرة من الخلايا الميتة اعتمادا على كفاءة التمايز لخط الخلية المستخدم. بدلا من تمرير الثقافات على الفور لإزالة هذه الحطام ، نسمح للعضويات بتكوين وتطوير هيكلها المطوي الأكثر تعقيدا. الانتظار 7-10 أيام قبل محاولة المرور الأول يضمن وجود خلايا انقسام كافية لتوليد العديد من الكائنات العضوية المعوية الجديدة. يمكن إزالة أي حطام لا يزال موجودا في المزرعة بسهولة أثناء عملية المرور عن طريق تدوير مخاليط العضوية / الحطام المنفصلة ببطء في أنبوب بسرعة كافية لتكوير الكائنات العضوية ولكن ترك ورقة من الخلايا تطفو في الوسائط. يمكن بعد ذلك استنشاق الوسائط والحطام الخلوي بحيث تبقى حبيبات المواد العضوية فقط.
يتمثل الحد من هذا النهج في أن أنواع الخلايا المشتقة من hiPSC ليست ناضجة تماما في كثير من الأحيان من حيث التعبير الجيني والملامح الوظيفية. لتحديد ما إذا كانت الأنسجة المعوية المشتقة من hiPSC مناسبة لتطبيقات محددة ، يجب تمييز الكائنات العضوية لأنواع مختلفة من الخلايا بما في ذلك الخلايا المعوية (VIL) وخلايا الغدد الصماء المعوية (neurog3) والخلايا الكأسية (MUC2) وخلايا التضخيم العابرة (CD133) وخلايا البانيث (FZD5) والخلايا الجذعية LGR5 + (LGR5) لتحديد التركيب الخلوي العضوي.
بشكل عام ، الميزة الرئيسية لهذا البروتوكول على العديد من بروتوكولات التمايز العضوية الأخرى هي أن منصة الاستزراع هذه فعالة للغاية من حيث التكلفة بسبب استبدال العديد من البروتينات المؤتلفة ومستحضرات الوسائط المكيفة بجزيئات صغيرة15,16. التمايز إلى HG بسيط وسريع للغاية ويمكن تطبيقه على كل من الخلايا الجذعية الجنينية البشرية والمستحثة متعددة القدرات مع نتائج متطابقة. عند اتباعها بدقة ، وتحسينها لخطوط الخلايا المستخدمة ، فإنها توفر منصة نموذجية بسيطة نسبيا خالية من تلويث خلايا اللحمة المتوسطة التي يمكن تطبيقها بعد ذلك لدراسة ظهارة الأمعاء في مجموعة متنوعة من السياقات بما في ذلك الالتهاب ، تفاعلات مسببات الأمراض المضيفة7. يمكن التحقيق في نمذجة التليف المعوي من خلال توفير محفزات مؤيدة للتليف ثم تقييم التعبير عن بروتينات المصفوفة خارج الخلية مثل الكولاجين واللامينين والفبرونيكتين بواسطة QPCR واللطخة الغربية و ELISA. يسمح استخدام تقنيات تحرير الجينات CRISPR / Cas9 على خطوط الخلايا الجذعية غير المتمايزة قبل التمايز بإنشاء خروج المغلوب الجيني أو الإفراط في التعبير عن البروتين الذي يمكن استخدامه لإنشاء عضويات خاصة بالمرض ونماذج أمراض أكثر تعقيدا14،17،18.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
يتم تمويل NH من قبل MRC (MR / S009930 / 1) و Wellcome Trust (204267 / Z / 16 / Z) ، يتم تمويل PD من قبل MRC PhD DTP ، يتم تمويل KLF من قبل BBSRC iCASE.
Materials
| Name | Company | Catalog Number | Comments |
| A83-01 | Tocris | 2939 | |
| Activin A | R&D | 338-AC | |
| Advanced DMEM/F12 (1X) | Life Technologies | 12654-010 | |
| B27 supplement | Gibco | 17504044 | |
| CHIR99021 | Sigma | SML1046-5MG | |
| Epidermal Growth Factor | R&D Systems | 236-EG-01M | |
| Gastrin | Sigma Aldrich | G9145 | |
| GlutaMAX (100X) | Life Technologies | 15630-056 | |
| Growth Factor reduced Matrigel | BD | ||
| HEPES Buffer solution (1M) | Life Technologies | 15630-080 | |
| N2 Supplement (100X) | Gibco | 17502-048 | |
| N-acetyl-cysteine | Sigma Aldrich | A7250 | |
| Nicotinamide | Sigma Aldrich | N0636 | |
| Noggin | R&D Systems | 6057-NG | |
| Non-essential amino acids | Gibco | 11140-050 | |
| Paraformaldehyde | VWR | 9713.5 | |
| Penicillin/Streptomycin | Gibco | 15140122 | |
| Phosphate Buffered Saline | Gibco | 14190-094 | |
| Retinoic Acid | Sigma | 302-79-4 | |
| ROCK inhibitor | Tocris | 1254/1 | |
| ROCK inhibitor Y-27632 | Tocris | 1254 | |
| RPMI | Sigma | R8758-500ml | |
| R-Spondin-1 | Peprotech | 120-38 | |
| SB202190 | Tocris | 1264 | |
| TrypLe Express | Gibco | 12604-021 | |
| Wnt 3a | R&D | 5036-WN |
References
- Thomson, J. A., et al. Embryonic stem cell lines derived from human blastocysts. Science. 282, 1145-1147 (1998).
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126, 663-676 (2006).
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131, 861-872 (2007).
- Rashid, S. T., et al. Modeling inherited metabolic disorders of the liver using human induced pluripotent stem cells. Journal of Clinical Investigation. 120, 3127-3136 (2010).
- Vallier, L., Alexander, M., Pedersen, R. A. Activin/Nodal and FGF pathways cooperate to maintain pluripotency of human embryonic stem cells. Journal of Cell Science. 118, 4495-4509 (2005).
- Jaremko, K. L., Marikawa, Y. Regulation of developmental competence and commitment towards the definitive endoderm lineage in human embryonic stem cells. Stem Cell Research. 10, 489-502 (2013).
- Forbester, J. L., et al. Interaction of Salmonella enterica Serovar Typhimurium with Intestinal Organoids Derived from Human Induced Pluripotent Stem Cells. Infection and Immunity. 83, 2926-2934 (2015).
- Hannan, N. R., et al. Generation of multipotent foregut stem cells from human pluripotent stem cells. Stem Cell Reports. 1, 293-306 (2013).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459, 262-265 (2009).
- de Souza, H. S., Fiocchi, C. Immunopathogenesis of IBD: current state of the art. Nature Reviews Gastroenterology & Hepatology. 13, 13-27 (2016).
- Tripathi, K., Feuerstein, J. D. New developments in ulcerative colitis: latest evidence on management, treatment, and maintenance. Drugs in Context. 8, 212572 (2019).
- Ganesh, K., et al. A rectal cancer organoid platform to study individual responses to chemoradiation. Nature Medicine. 25, 1607-1614 (2019).
- Fair, K. L., Colquhoun, J., Hannan, N. R. F. Intestinal organoids for modelling intestinal development and disease. Philosophical Transactions of the Royal Society B: Biological Sciences. 373, (2018).
- Cuevas-Ocaña, S., Yang, J. Y., Aushev, M., Schlossmacher, G., Bear, C. E., Hannan, N. R. F., Perkins, N. D., Rossant, J., Wong, A. P., Gray, M. A. A Cell- Based Optimised Approach for Rapid and Efficient Gene Editing of Human Pluripotent Stem Cells. Int. J. Mol. Sci. 24, 10266 (2023).
- Spence, J. R., et al. Directed differentiation of human pluripotent stem cells into intestinal tissue in vitro. Nature. 470, 105-109 (2011).
- Sato, T., et al. Long-term Expansion of Epithelial Organoids From Human Colon, Adenoma, Adenocarcinoma, and Barrett's Epithelium. Gastroenterology. 141, 1762-1772 (2011).
- Giacalone, J. C., et al. CRISPR-Cas9-Based Genome Editing of Human Induced Pluripotent Stem Cells. Current Protocols in Stem Cell Biology. 44, 1-22 (2018).
- Bruntraeger, M., Byrne, M., Long, K., Bassett, A. R., Luo, Y. . CRISPR Gene Editing: Methods and Protocols. , 153-183 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved