Method Article
발달 및 질병 모델링 응용 분야를 위한 hiPSC 유래 장 오가노이드 생성
요약
이 프로토콜은 인간 만능 세포를 장내 오가노이드로 분화할 수 있습니다. 이 프로토콜은 세포를 최종 내배엽, 후장 내배엽 및 장 상피의 집단으로 분화하여 정상적인 인간 발달을 모방합니다. 따라서 이 프로토콜은 장 발달과 질병 모델링 응용 분야를 모두 연구하는 데 적합합니다.
초록
hiPSC 유래 장 오가노이드는 분화된 세포에서 복잡한 3D 구조로 자가 조립되는 상피 구조로, 인간의 장 상피를 대표하며, 이 구조에서 크립트/융모와 같은 구조를 나타냅니다. 여기서는 hiPSC를 최종 내배엽으로 단계적으로 분화한 다음 3D 배양 조건으로 옮기기 전에 후방으로 후장 상피를 형성하여 hiPSC 유래 장 오가노이드를 생성하는 과정을 설명합니다. 3D 배양 환경은 SB202190, A83-01, Gastrin, Noggin, EGF, R-spondin-1 및 CHIR99021가 보충된 세포외 기질(ECM)(예: Matrigel 또는 기타 호환 가능한 ECM)로 구성됩니다. 오가노이드는 7일마다 패세이징을 거치며, 여기서 기계적으로 파괴된 후 새로운 세포외 기질로 전달되어 팽창할 수 있습니다. QPCR 및 면역세포화학은 hiPSC 유래 장 오가노이드가 잔 세포, 파네스 세포 및 장세포를 포함한 성숙한 장 상피 세포 유형을 포함하고 있음을 확인합니다. 또한 오가노이드는 상피 세포의 정점 표면에 국한된 빌린의 발현에 의한 분극의 증거를 보여줍니다.
생성된 오가노이드는 인간의 장 발달뿐만 아니라 염증성 장 질환을 포함한 수많은 인간 장 질환을 모델링하는 데 사용할 수 있습니다. 장 염증을 모델링하기 위해 오가노이드를 TNF-α, TGF-β 및 박테리아 LPS와 같은 염증 매개체에 노출시킬 수 있습니다. 전염증성 사이토카인에 노출된 오가노이드는 이에 반응하여 염증성 및 섬유화 표현형을 나타냅니다. IBD 환자로부터 유래한 건강한 HIPC와 HIPC를 함께 사용하면 IBD를 유발하는 기전을 이해하는 데 도움이 될 수 있습니다. 이를 통해 질병 조기 진단에 도움이 되는 새로운 치료 표적과 새로운 바이오마커를 밝힐 수 있습니다.
서문
자가 재생 및 인체의 모든 세포 유형으로 분화할 수 있는 능력과 같은 만능줄기세포(PSC)의 특성은 발달, 질병 병리학 및 약물 테스트 연구에서 귀중한 도구가 됩니다1. 인간 유도 만능 줄기 세포(hiPSC)는 질병 표현형 2,3의 원인이 되는 게놈을 직접 캡처하여 환자로부터 유도할 수 있기 때문에 질병 모델링 연구에 특히 유용합니다. 이러한 hiPSC는 유전적 결함의 영향을 받는 세포 유형으로 분화될 수 있어 질병의 분자 메커니즘을 주의 깊게 검사할 수 있다4.
인간 PSC에 대한 분화 프로토콜은 계통 헌신 및 사양을 제어하는 특정 신호 전달 경로의 활성화 또는 억제를 통해 주요 발달 단계를 통해 세포의 분화를 지시하는 것을 목표로 합니다. 만능 상태에서 hiPSC를 유지하려면 중간 수준의 Activin A(Act-A) 신호 전달이 필요하며, 3일 동안 Act-A를 고용량으로 투여하면 hiPSC가 최종 내배엽(DE) 운명에 도달하게 됩니다 5,6. Act-A 및 Wnt 경로는 DE의 전방-후방 정체성을 지시합니다. Act-A에 의한 신호전달은 HHEX, HNF4α 및 GATA4와 같은 앞창자(FG) 마커를 유도하고 CDX2와 같은 뒷창자(HG) 유전자의 발현을 차단합니다. Wnt 신호전달은 DE의 사후화를 유도하여 HG 유전자 발현 프로파일 7,8을 채택합니다. HG 세포 식별이 확립되면 분화를 2D에서 3D로 이동하여 장내 오가노이드 형성으로 유도할 수 있습니다.
장내 오가노이드는 일반적으로 라미닌, 콜라겐 IV 및 엔탁틴으로 구성되고 EGF, FGF, PDGF 및 IGF-1과 같은 성장 인자가 풍부하여 생존 및 증식에 기여하는 3D 세포외 기질(예: Matrigel 또는 기타 호환 가능한 ECM) 기반 배양 시스템(9)에서 배양됩니다. 오가노이드는 Gastrin, Noggin 및 CHIR을 함유한 정의된 배지에서 배양되어 장기 배양 중에 장내 줄기세포 성장과 증식을 자극하고 지원합니다.
장 상피 세포가 세포외 기질에 박힌 후 장 크립트가 형성되고 확장되기 시작하여 결국 스페로이드를 형성합니다. 이들은 장 상피의 생리적 기능을 모방하는 오가노이드 구조로 성숙합니다. 오가노이드는 일반적으로 기능적 및 유전자 발현 프로파일의 큰 손실 없이 1년 이상 배양할 수 있습니다. 오가노이드를 더 작은 조각으로 효소로 분해한 다음 완전한 오가노이드로 자체 재조립하는 Passaging을 매주 수행해야 합니다.
확립된 오가노이드 라인은 크론병, 궤양성 대장염 및 대장암을 포함한 장과 관련된 수많은 질환의 신뢰할 수 있는 모델로 사용될 수 있습니다 10,11,12,13. 이것은 동물 세포가 이러한 장애와 관련된 인간 유전자를 발현하고 생체 내에서 인간 조직에서 발생하는 것과 더 유사한 외부 자극에 반응하기 때문에 선호되는 모델입니다.
프로토콜
알림: 아래에 자세히 설명된 모든 조직 배양 작업은 클래스 II 층류 후드에서 수행해야 합니다.
1. 후장 내배엽에 대한 인간 유도 만능 줄기 세포(hiPSC) 분화
- 세포 배양 플라스크를 세포외 기질로 코팅하려면 먼저 필요한 기질의 양을 계산합니다. 다음은 Matrigel로 코팅된 12웰 플레이트의 예입니다. 12웰 플레이트를 코팅하는 데 필요한 세포외 기질의 양을 계산합니다. 다음 공식을 사용합니다.
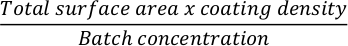
참고: 선택한 세포외 기질로 세포 배양 접시를 코팅합니다. Matrigel을 사용하는 경우 분화를 위해 파종 2 24시간 전에 0.035mg/cm2 24시간의 농도를 사용하십시오. 제품 시트에서 세포외 기질의 배치 농도를 확인하고 제조업체의 지침에 따라 실험에 앞서 더 작은 부분 표본을 준비합니다. - p1000 피펫을 사용하여 차가운 DMEM 배지에 필요한 양의 세포외 기질을 희석합니다.
- 5mL 스트리펫을 사용하여 잘 섞는다.
- 각 웰 플레이트에 500μL의 희석된 매트릭스를 추가합니다. 플레이트를 부드럽게 흔들어 희석된 세포외 기질을 고르게 분포시키고 37°C에서 최소 12시간 동안 배양합니다.
- 플레이트에 세포를 파종하기 전에 500μL의 PBS로 각각을 잘 세척하여 과도한 세포외 기질을 제거합니다. 이렇게 하면 분화 중에 세포가 분리되는 것을 방지할 수 있습니다.
- 세포외 기질의 건조를 방지하기 위해 씨를 뿌릴 준비가 될 때까지 우물에 마지막 세척을 그대로 두십시오.
- 최종 내배엽(DE) 또는 후배엽(HG)에 대한 hiPSC 분화를 위해 시드하려면 선택한 유지 배지(예: 필수 8 배지)에서 배양된 hiPSC 플라스크를 취하고 배지를 흡입합니다. (여기서는 25,000 cells/cm2로 세포를 시드합니다.)
참고: 파종 밀도는 성공적인 분화에 매우 중요하며 각 개별 hiPSC 세포주에 맞게 최적화해야 합니다. - 플라스크의 세포를 5mL의 PBS로 세척합니다. PBS를 흡인합니다.
- 2.5mL의 세포 해리 용액(예: TrypLE)을 넣고 상온에서 4분 동안 그대로 둡니다. 세포 해리 용액을 흡인하고 플라스크를 가볍게 두드려 세포를 분리합니다.
- 37°C로 예열한 5mL의 DMEM 배지로 플라스크를 세척하고 모든 세포를 15mL 튜브에 수집합니다.
- 10μL의 재현탁 세포 용액을 가지고 혈구계로 세포 밀도를 측정합니다.
- 세포 현탁액을 충분히 취하여 1.05 x 106 세포를 수집하고 15mL 튜브에 넣습니다.
- 160 x g 에서 3분 동안 회전합니다. 세포가 원심분리되는 동안 세포외 기질로 코팅된 12웰 플레이트에서 PBS를 흡입합니다.
- 원심분리 후 상층액을 흡인하고 ROCK 억제제(10μM)를 사용하여 12mL의 유지 배지에 세포 펠릿을 재현탁시킵니다.
- p1000 피펫을 사용하여 12웰 플레이트의 각 웰에 1mL의 셀 현탁액을 추가합니다. 웰 사이에 균등한 분포를 보장하기 위해 세포를 잘 재현탁합니다.
- 플레이트를 부드럽게 흔들어 플레이트의 웰 내에 세포를 분산시키되 웰 중앙에 세포가 집중되므로 매체의 소용돌이를 피하십시오.
- 37°C, 5%CO2 인큐베이터에 넣습니다.
- 파종 후 24시간 후에 미디어를 유지 관리 미디어(예: 필수 8 미디어)로만 교체합니다(ROCK 억제제 없음).
- DE로의 분화를 시작하려면 표 1에 따라 내배엽 기저 배지를 준비합니다.
참고: 분화 시작 시 세포는 60-80% 합류 지점에 있어야 합니다. - 내배엽 기저 배지에 Activin A(100ng/mL) 및 Wnt3(50ng/mL)를 추가하여 12mL의 DE 배지를 준비합니다.
- 미디어를 37°C로 예열합니다.
- 조직 배양 플레이트 또는 플라스크의 각 웰에서 배지를 흡입합니다.
- 12웰 플레이트의 각 웰에 1mL의 DE 배지를 추가하여 DE 분화를 시작합니다.
- DE 분화(D1 DE)를 시작한 후 24시간이 지나면 새 DE 배지를 준비하고 배지 교환을 수행합니다.
- 1.24시간(D48 DE)에서 2단계를 반복합니다. 이 단계에서 세포 사멸이 많이 발생하면 배지 교체 전에 500μL의 PBS로 모든 웰을 세척하십시오.
참고: 성공적인 내배엽 분화를 확인하려면 유세포 분석을 수행하여 SOX17의 발현을 평가하십시오. 우리는 일반적으로 세포의 >80%가 D3 DE에 의해 SOX17 양성이 될 것으로 예상합니다. SOX17의 발현이 최적이 아닌 경우 세포 파종 밀도와 Act-A의 농도를 최적화해야 합니다. - 이 시점, 즉 DE 분화 시작 후 72시간 후에 HG 분화를 시작합니다. 내배엽 기저 배지에 CHIR99021(3μM) 및 RA(1μM)를 추가하여 HG 배지 12mL를 준비합니다(표 1).
참고: D3 DE에서 셀은 균일한 단층을 형성해야 합니다. 최적의 DE 분화는 추가 분화 단계에 매우 중요합니다. - DE 배지를 흡입합니다.
- 12웰 플레이트의 각 웰에 1mL의 HG 배지를 추가하여 HG 분화를 시작합니다.
- 매일 미디어를 교체하면서 4일 동안 차별화를 계속합니다.
참고: DE 사후화의 성공 여부를 확인하려면 유세포 분석을 수행하여 CDX2의 발현을 평가하십시오. HG 분화의 D4에 의해 우리는 일반적으로 세포의 >80%가 CDX2 양성이 될 것으로 예상합니다. 사후화가 차선책인 경우 CHIR99021의 집중을 최적화해야 합니다. - RNA 추출을 위한 샘플을 수집하려면 분화 배지를 흡인하고 500ul의 PBS로 웰을 세척합니다.
- PBS를 흡인하고 RNA 추출 키트에서 적절한 양의 세포 용해 완충액을 추가합니다.
- p1000 피펫을 사용하여 웰 바닥을 긁어 모든 세포가 용해되도록 합니다.
- 세포 용해물을 흡인하고 깨끗한 튜브에 넣습니다.
- RNA 추출을 진행하거나 RNA 추출이 준비될 때까지 -20°C에서 용해물을 동결합니다.
- 면역염색의 경우 분화 배지를 흡입하고 500μL의 PBS로 웰을 세척합니다.
- PBS를 흡입하고 500μL의 4% PFA를 추가합니다.
참고: PFA는 독성이 있습니다. 적절한 PPE를 사용하고 PFA 폐기를 위한 현지 실험실 절차를 따르십시오. - 4 °C에서 20 분 동안 배양합니다.
- PFA를 제거하고 500μL의 PBS로 웰을 세 번 세척합니다.
- 면역염색을 수행할 준비가 될 때까지 세포에 마지막 PBS 세척을 그대로 둡니다.
2. 장내 오가노이드의 노화
- 표 2에 따라 장 기초 배지를 준비합니다.
- 2D에서 3D 세포 배양으로 전환하려면 6웰 플레이트를 사용하여 hiPSCS에서 DE 세포를 생성합니다. 5mL 스트리펫을 사용하여 6 cell plate를 형성하는 세포의 단층을 분리합니다.
- 세포를 15mL 원심분리 튜브에 모은 후 400 x g 에서 1분 동안 원심분리하여 세포 펠릿을 생성합니다.
- SB202190(10μM), A83-01(500nM), 가스트린(10nM), 노긴(100ng/μL), EGF(500ng/μL), R-Spondin1(100ng/mL), CHIR99021(6μM), ROCK 억제제(10μM)와 같은 성장 인자를 포함하는 장 성장 배지에 세포 펠릿을 재현탁시킵니다.
- 도금되는 웰의 수에 따라 적절한 부피의 세포외 기질을 추가합니다. 이것은 아래 방정식을 사용하여 계산할 수 있습니다.
[1] 세포외 기질/배지의 총 부피(μL) = 30μL * 48웰 플레이트의 웰 수
[2] 세포외 기질의 필요 부피 (μL) = [1]의 답변 * 2/3
[3] 필요한 매체 부피 (μL) = [1]의 답 * 1/3 - 30 μL의 셀 현탁액을 48웰 플레이트의 각 웰 중앙에 추가합니다.
- 세포외 기질이 굳을 수 있도록 37°C 인큐베이터에서 최소 5분 동안 플레이트를 배양합니다.
- 세포외 기질 돔이 굳으면 모든 성장 인자를 포함하는 300μL의 장 성장 배지를 각 웰에 추가합니다.
- 플레이트를 5%CO2가 있는 37°C 인큐베이터로 되돌립니다.
알림: 48시간 후에도 오가노이드가 관찰되지 않거나 상당한 세포 사멸이 있는 경우 ROCKi 및 NOGGIN 농도를 최적화해야 할 수 있습니다. - 오가노이드를 통과시키려면 광학 현미경으로 세포를 관찰하여 오가노이드의 밀도와 크기를 평가하고 통과가 필요한지 여부를 결정합니다.
- 세포 배양 배지를 얼음처럼 차가운 PBS로 교체합니다.
참고: 오가노이드 배양은 약 5-7일마다 분할해야 합니다. 장내 오가노이드 배양물의 패시징은 오가노이드 내강 내에 세포 파편이 축적되고 주변 장 성장 배지가 황변되면 필요합니다. - 5mL 스트리펫으로 긁는 동작을 사용하여 플레이트에서 오가노이드와 세포외 기질 구체를 기계적으로 분리합니다.
- 각 웰의 오가노이드를 15mL 원심분리 튜브에 수집합니다.
- 오가노이드를 펠트하기 위해 400 x g 에서 1분 동안 오가노이드 현탁액을 원심분리합니다. 세포 펠릿의 상단에 도달할 때까지 상층액을 흡인하고 눈에 보이는 세포외 기질층에 도달할 때 주의하십시오.
- 펠릿을 얼음처럼 차가운 PBS 15mL에 재현탁시킵니다.
알림: 이 단계는 초기 스핀에서 제거되지 않은 남아 있는 세포외 기질을 세척하는 역할을 합니다. - 400 x g 에서 1분 동안 원심분리기 오가노이드가 포함된 펠릿까지 배지를 흡인합니다.
- 얼음처럼 차가운 PBS 1mL에 재현탁합니다. p200 피펫을 사용하여 위아래로 여러 번 피펫팅하여 온전한 오가노이드를 수동으로 파괴합니다.
알림: 광학 현미경을 사용하여 오가노이드의 크기를 관찰하여 추가 해리가 필요한지 여부를 결정합니다. - 성장 인자 없이 배지 9mL를 추가합니다.
- 400 x g 에서 1분 동안 원심분리기 오가노이드가 펠릿이 될 때까지 상층액을 흡인합니다.
- 아래 방정식을 사용하여 필요한 세포외 기질 및 배지의 양을 계산합니다.
[1] 세포외 기질/배지의 총 부피(μL) = 30μL * 48웰 플레이트의 웰 수
[2] 세포외 기질의 필요 부피 (μL) = [1]의 답변 * 2/3
[3] 필요한 매체 부피 (μL) = [1]의 답 * 1/3 - 성장 인자 (Noggin & ROCK 억제제 포함)가있는 장 배지의 계산 된 부피에 오가노이드 펠릿을 재현탁시킵니다.
- 이 세포 현탁액에 필요한 양의 세포외 기질을 추가하고 재현탁하여 오가노이드의 균일한 분포를 보장합니다.
- 이 현탁액 30μL를 48웰 플레이트의 각 웰 중앙에 피펫팅합니다(바람직하게는 37°C 인큐베이터에서 예열).
- 플레이트를 37°C 인큐베이터에 다시 넣고 세포외 기질이 굳을 때까지 5분 동안 기다립니다.
- 성장 인자(+ ROCK 억제제)가 있는 장 배지를 준비합니다(48웰 플레이트당 약 17mL).
- 각 웰에 300μL를 추가합니다.
- 37 °C에서 5 % CO2 로 배양합니다.
- 패시에이징 후 장내 오가노이드에 대한 배지를 흡인하고 2-4일마다 성장 인자(Noggin & ROCK 억제제 제외)가 있는 신선한 장 배지로 교체합니다.
알림: 48시간 후에도 오가노이드가 관찰되지 않거나 상당한 세포 사멸이 있는 경우 ROCKi 및 NOGGIN 농도를 최적화해야 할 수 있습니다.
참고: 장내 오가노이드는 in vivo에서 다양한 염증 매개체에 반응합니다. TNFα는 여러 염증 과정에 관여하는 세포 신호 전달 단백질입니다. - 장내 오가노이드에서 염증 반응을 유발하려면 기저 배지에만 40ng/mL 농도로 TNFα를 준비합니다.
- 48웰 플레이트에서 매체를 흡입합니다.
- 40ng/mL TNFα를 함유한 준비된 기초 배지 300μL를 추가합니다.
- 플레이트를 37°C에서 48시간 동안 배양하여 염증 유발 환경을 재현합니다.
참고: 장내 오가노이드는 in vivo에서 다양한 염증 매개체에 반응합니다. TNFα는 여러 염증 과정에 관여하는 세포 신호 전달 단백질입니다. - 흡인으로 남은 세포를 5% Trigene이 포함된 진공 트랩에 폐기합니다.
결과
차별화 프로토콜의 개략도는 그림 1A에 나와 있습니다. 프로토콜 1일차에 hiPSC는 조밀해야 하며 총 합류율이 약 50-60%인 작은 콜로니를 형성해야 합니다. DE 세포로의 분화 유도 후 24시간이 지나면 줄기 세포 콜로니에서 멀어지기 시작하여 세포 단층을 형성합니다. 이것은 다음 3일 동안 계속되며 DE 분화의 D3에 완전한 단층을 형성해야 합니다(그림 1). D0에서 높게 발현되고 DE 분화 중에 빠르게 하향 조절되는 만능 마커(OCT4, NANOG, SOX2)를 사용하여 분화 과정에서 유전자 발현을 모니터링해야 합니다. DE 분화 중에 T 발현은 D1에서 최고조에 달하고 D2에서 EOMES 및 MIXL이 뒤따라야 합니다. D2에서 DE 유전자(SOX17, FOXA2, GATA4, CXCR4)가 발현되기 시작하고 D3에서 최고조에 달해야 합니다(그림 2 및 그림 3). 세포는 DE D3에 의해 단층이어야 하며 후장 내배엽으로 후방화될 수 있습니다. 사후화 이벤트 동안 3D 구조는 빠르면 D2부터 형성되기 시작합니다. 그러나 때로는 D4에서만 나타나기 시작하거나 전혀 나타나지 않을 수도 있습니다. 이것은 세포가 진행되어 장내 오가노이드를 형성하는지 여부를 항상 나타내는 것은 아닙니다(그림 1). HG 사양 동안 CDX2 및 HNF4a 발현이 유도되고 시간이 지남에 따라 증가해야 합니다(그림 3).
세포의 2D 시트를 세포외 기질로 옮긴 후 처음 24시간 동안 2D 세포 덩어리가 관찰됩니다. 48시간 후 세포는 처음에는 작은 더 압축된 3D 스페로이드 구조로 자동 구성되기 시작하고(그림 4A), 7-10일의 배양에 걸쳐 점차적으로 크기와 복잡성이 증가합니다(그림 4B 및 그림 4C). 오가노이드는 내강이 오가노이드/스페로이드의 중심을 향하고 있는 명백한 상피를 가진 명확한 오가노이드/스페로이드 형태를 얻을 때까지 통과해서는 안 됩니다(그림 4D). 이 단계에서 면역세포화학을 사용하여 빌린 및 CDX2와 같은 장 마커의 발현을 확인할 수 있습니다(그림 5). 모든 2D 세포 덩어리가 오가노이드로 발달하는 것은 아니며 세포외 기질 내에 일부 오염된 죽은 세포가 있을 수 있습니다. 이러한 죽은 세포는 살아남은 세포가 큰 오가노이드를 형성하고 통과할 준비가 될 때까지 무시해야 합니다.
염증을 모델링하기 위해 TNFα를 조직 배양 배지에 24-48시간 동안 첨가할 수 있습니다. 전염증성 분자로 배양한 후 분리 및 패시징에 사용되는 것과 동일한 기술을 사용하여 오가노이드를 수확한 다음 QPCR 또는 웨스턴 블로팅과 같은 세포 완충액 호환 애플리케이션을 사용하여 용해합니다. 더 짧은 노출이 필요한 경우 먼저 세포외 기질에서 오가노이드를 제거하고 1.5mL 튜브를 사용하여 현탁액에서 TNFα에 노출시켜야 합니다. 장 오가노이드를 TNFα로 48시간 동안 처리하면 일반적으로 전염증 마커(TNFα, IL1B, IL8, IL23)의 발현을 유도하는 동시에 장 상피 마커(LGR5, VIL)의 발현에 부정적인 영향을 미칩니다(그림 6).
| 내배엽 기저 배지 | 50 mL | |
| 재질 보기 RPMI 1640 | 48.5 mL | |
| B27 보충제 | 1mL | |
| 니아 1% | 0.5 mL | |
표 1: 내배엽 분화를 위한 내배엽 기저 배지의 조성.
| 장 기초 배지 | 50 mL | |
| 고급 DMEM/F12 | 46.5 mL | |
| HEPES 완충액 | 0.5 mL | |
| 글루타맥스 | 0.5 mL | |
| 니코틴아미드 | 0.5 mL | |
| N2 보충제 | 0.5 mL | |
| B27 보충제 | 1.0 mL | |
| 펜/연쇄상구균 | 0.5 mL | |
표 2: 장 오가노이드 배양을 위한 장 기초 배지의 조성
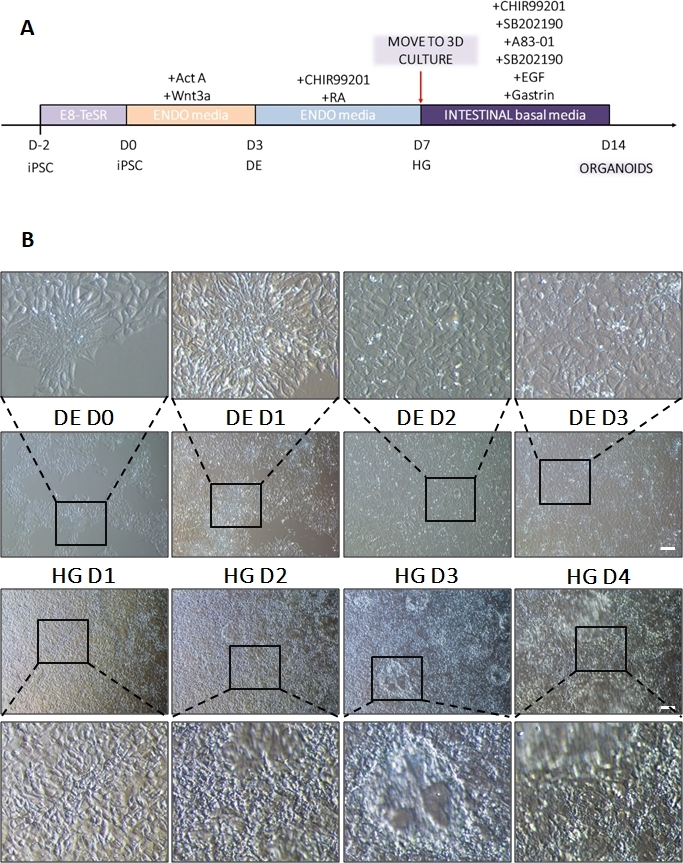
그림 1: 최종 내배엽을 통해 뒷장 계통으로 hiPSC를 분화하는 동안의 형태학적 변화.
(A) 장 분화 프로토콜의 개략도. 이 hiPSC 세포주는 핵 대 세포질 비율이 높은 작은 세포의 느슨한 군집을 형성합니다. 분화가 진행됨에 따라 세포는 상피에서 중간엽 표현형으로의 전이와 일치하는 변화를 겪고 DE D3에 의해 균일한 단층을 형성합니다. 적절한 신호가 전달되면 DE 세포가 늘어나고 HD D3가 나오자마자 3D 스페로이드가 나타나는 더 조밀하게 채워진 단층을 형성하지만 이는 사용된 세포주에 따라 다르며 3D 배양(B)으로 전환하기 위한 필수 요건은 아닙니다. 척도 막대: 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
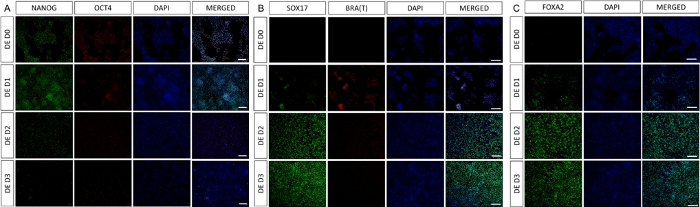
그림 2: hiPSC에서 HG 내배엽으로의 분화는 내배엽 유전자의 발현을 유도합니다.
최종 내배엽으로 분화하는 hiPSC의 면역염색은 단백질 수준에서 TF 발현의 변화를 보여줍니다. 만능 마커(NANOG 및 OCT4)는 DE D3(A)에 의해 하향 조절됩니다. 중배엽 마커 BRA(T)의 발현은 프로토콜(B)의 D1에 존재하고 DE 특이적 TF SOX17 및 FOXA2는 D2(B&C)에 나타납니다. 축척 막대: 200mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
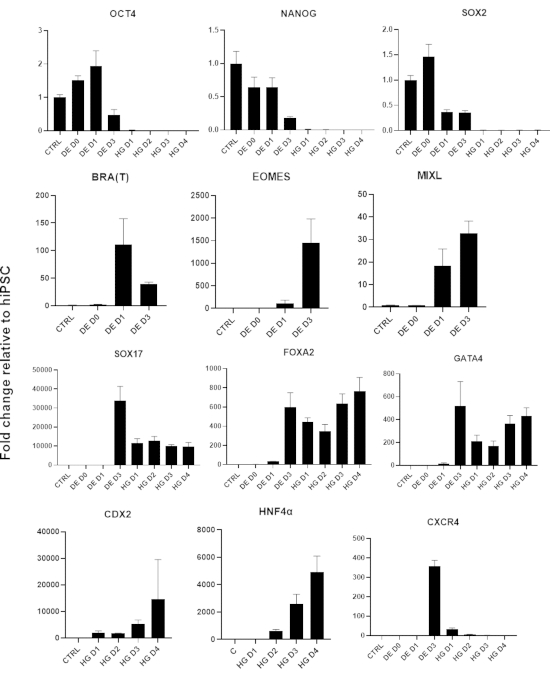
그림 3: 후장 내배엽(HG)에 대한 hiPSC 분화 중 qPCR에 의한 유전자 발현 변화.
다능성과 관련된 유전자는 하향 조절되고(OCT4, NANOG, SOX2), 중배엽 유전자(T, EOMES, MIXL1)의 일시적인 발현이 뒤따르며, 마지막으로 DE 유전자(SOX17, FOXA2, CXCR4) 및 후장 유전자(CDX2, GATA4, HNF4a)의 발현이 뒤따릅니다. 데이터는 평균 ±SD로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
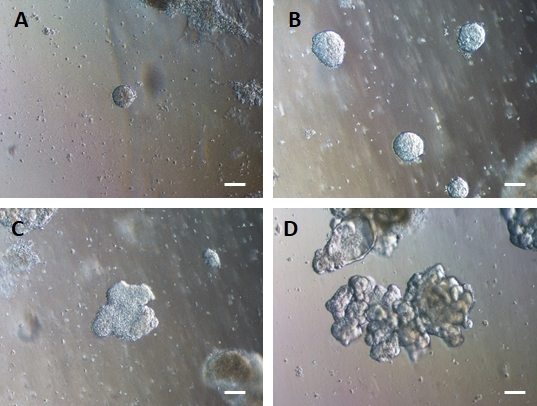
그림 4: HG 내배엽은 3D 세포외 기질 배양에서 3D 장 오가노이드를 형성하기 위해 자가 조립됩니다.
HG 내배엽은 적절한 3D 세포외 기질 배양으로 옮겨져 초기에 작은 고체 세포 덩어리(A)를 형성합니다. HG 내배엽 덩어리는 배양 7-10일 동안 팽창한 다음(B) 비대칭이 되어 더 복잡한 상피(C)를 형성하기 시작하여 결국 상피 형태가 명확하고 오가노이드의 중심을 향하는 발광 표면(D)을 가진 오가노이드를 생성합니다. 스케일 바 = 50 μm 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
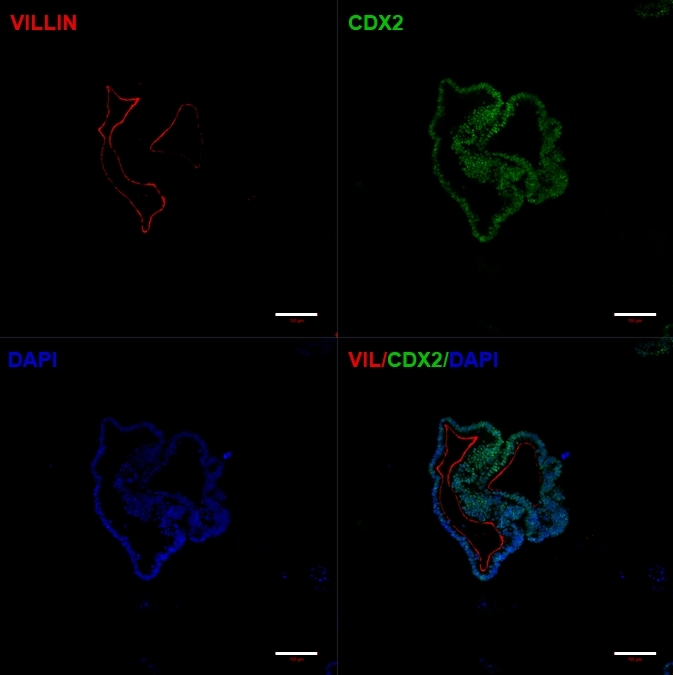
그림 5: 확립된 hiPSC 유래 장 오가노이드는 장 마커를 발현합니다.
CDX2와 Villin의 발현을 보여주는 면역세포화학. 스케일 바 = 100 μm 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
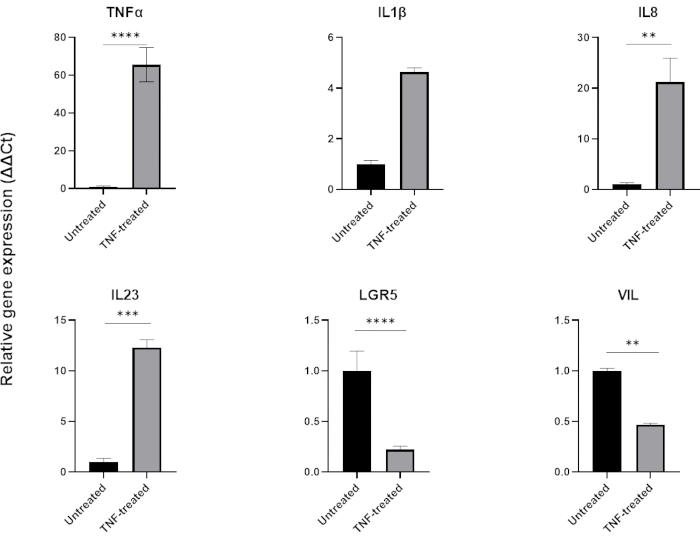
그림 6: 건강한 장 오가노이드의 염증 프로파일 및 장 세포 발현에 대한 TNFα의 효과.
TNFα(40ng/mL)로 48시간 치료 후 건강한 대장 오가노이드의 염증 프로필. TNFα에 노출되면 전염증성 마커(TNFα, IL-8 & IL-23)의 발현이 증가하는 반면, 동시에 장 상피 마커(LGR5, VIL)의 발현은 하향 조절됩니다. 통계 분석은 양측 학생 t-검정에 의해 수행되었습니다. 데이터는 각 그룹의 평균 ± SD로 표현됩니다. *P < .01; **P < .001; P < .0001입니다. (n=3)입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
여기서는 인간 만능 세포를 인간 장 오가노이드로 분화하기 위한 프로토콜을 설명합니다. 우리는 염증을 연구하기 위해 그들의 사용을 보여줍니다. 그러나 이것은 다양한 맥락에 적용될 수 있으며, 모든 유전적 배경에서 CRISPR/Cas9 유전자 편집 접근법14와 결합될 수 있습니다. 일단 분화되면 최종 내배엽, 뒷장 내배엽 및 장 상피의 자연 발달 분화 시퀀스에 따라 생성된 오가노이드는 12개월 이상 지속적으로 배양 및 통과할 수 있습니다.
이 프로토콜의 중요한 측면은 내배엽 분화 전에 미분화 줄기 세포의 초기 도금 밀도입니다. 이것이 충분히 최적화되지 않으면 초기 DE 분화 단계에서 세포가 죽거나(세포가 너무 희박한 경우) DE 분화의 효율성이 감소할 수 있습니다(세포가 너무 조밀한 경우). 올바른 시작 밀도는 사용 중인 세포주에 맞게 최적화되어야 하며, 올바른 밀도는 DE D3 말까지 단층을 생성해야 합니다. 유세포 분석은 DE 사양의 효율성을 결정하기 위해 사용되어야 하며 일반적으로 >80%의 세포가 SOX17 및/또는 CXCR4에 양성인 것을 볼 수 있습니다. SOX17 양성 세포의 수가 60% 미만이면 HG 패터닝의 효율성에 영향을 미쳐 세포외 기질로 전달될 때 형성되는 오가노이드가 줄어듭니다. 이로 인해 결국 오가노이드 배양이 실패하게 됩니다. DE를 HG로 패터닝하는 것이 성공적인지 확인하기 위해 유세포 분석으로 CDX2 양성 세포의 수를 평가하고 일반적으로 >80%의 양성 세포를 볼 수 있을 것으로 예상합니다. 다시 말하지만, CDX2 양성 세포의 수가 50% 미만으로 떨어지면 3D 세포외 기질 배양으로 옮길 때 생성되는 장 오가노이드의 수에 부정적인 영향을 미칩니다.
2D 단층을 3D 배양으로 옮긴 후 24-48시간 후에 작고 조밀한 구체가 나타나야 합니다. 죽은 세포의 큰 시트는 사용된 세포주의 분화 효율에 따라 나타날 수 있습니다. 이러한 파편을 제거하기 위해 배양액을 즉시 통과시키는 대신, 오가노이드가 더 복잡하고 접힌 구조를 완전히 형성하고 발달하도록 합니다. 첫 번째 통과를 시도하기 전에 7-10일을 기다리면 많은 새로운 장 오가노이드를 생성하기에 충분한 분열 세포가 존재하게 됩니다. 배양물에 여전히 존재하는 모든 이물질은 오가노이드를 펠릿화하지만 배지에 세포 시트를 떠 두기에 충분한 속도로 튜브에서 해리된 오가노이드/이물질 혼합물을 천천히 회전시켜 패시에이징 과정에서 쉽게 제거할 수 있습니다. 그런 다음 배지 및 세포 파편을 흡인하여 오가노이드의 펠릿만 남길 수 있습니다.
이 접근법의 한계는 hiPSC 유래 세포 유형이 유전자 발현 및 기능적 프로파일 측면에서 완전히 성숙하지 않은 경우가 많다는 것입니다. hiPSC 유래 장 조직이 특정 응용 분야에 적합한지 확인하려면 장세포(VIL), 장내분비 세포(neurog3), 잔 세포(MUC2), 일시적 증폭 세포(CD133), 파네스 세포(FZD5) 및 LGR5+ 줄기 세포(LGR5)를 포함한 다양한 세포 유형에 대해 오가노이드를 특성화하여 오가노이드 세포 구성을 결정해야 합니다.
전반적으로, 다른 많은 오가노이드 분화 프로토콜에 비해 이 프로토콜의 주요 장점은 이 배양 플랫폼이 여러 재조합 단백질 및 조건화된 배지 제제를 소분자로 대체하기 때문에 매우 비용 효율적이라는 것입니다15,16. HG로의 분화는 매우 간단하고 빠르며 인간 배아 줄기세포와 유도만능줄기세포 모두에 동일한 결과를 얻을 수 있습니다. 엄격하게 추적하고 사용 중인 세포주에 최적화하면 중간엽 세포를 오염시키지 않는 비교적 간단한 모델 플랫폼을 제공하여 염증, 숙주 병원체 상호 작용을 포함한 다양한 맥락에서 장 상피를 연구하는 데 적용할 수 있습니다7. 장 섬유증 모델링은 섬유화 자극을 제공한 다음 QPCR, 웨스턴 블롯 및 ELISA에 의한 콜라겐, 라미닌 및 피브로넥틴과 같은 세포외 기질 단백질의 발현을 평가하여 조사할 수 있습니다. 분화 전에 미분화 줄기 세포주에서 CRISPR/Cas9 유전자 편집 기술을 사용하면 질병 특이적 오가노이드 및 보다 복잡한 질병 모델을 생성하는 데 사용할 수 있는 유전자 녹아웃 또는 단백질 과발현 오가노이드를 생성할 수 있습니다 14,17,18.
공개
저자는 공개할 것이 없습니다.
감사의 말
NH는 MRC(MR/S009930/1)와 Wellcome Trust(204267/Z/16/Z)에서 자금을 지원하고, PD는 MRC PhD DTP에서 자금을 지원하고, KLF는 BBSRC iCASE에서 자금을 지원합니다.
자료
| Name | Company | Catalog Number | Comments |
| A83-01 | Tocris | 2939 | |
| Activin A | R&D | 338-AC | |
| Advanced DMEM/F12 (1X) | Life Technologies | 12654-010 | |
| B27 supplement | Gibco | 17504044 | |
| CHIR99021 | Sigma | SML1046-5MG | |
| Epidermal Growth Factor | R&D Systems | 236-EG-01M | |
| Gastrin | Sigma Aldrich | G9145 | |
| GlutaMAX (100X) | Life Technologies | 15630-056 | |
| Growth Factor reduced Matrigel | BD | ||
| HEPES Buffer solution (1M) | Life Technologies | 15630-080 | |
| N2 Supplement (100X) | Gibco | 17502-048 | |
| N-acetyl-cysteine | Sigma Aldrich | A7250 | |
| Nicotinamide | Sigma Aldrich | N0636 | |
| Noggin | R&D Systems | 6057-NG | |
| Non-essential amino acids | Gibco | 11140-050 | |
| Paraformaldehyde | VWR | 9713.5 | |
| Penicillin/Streptomycin | Gibco | 15140122 | |
| Phosphate Buffered Saline | Gibco | 14190-094 | |
| Retinoic Acid | Sigma | 302-79-4 | |
| ROCK inhibitor | Tocris | 1254/1 | |
| ROCK inhibitor Y-27632 | Tocris | 1254 | |
| RPMI | Sigma | R8758-500ml | |
| R-Spondin-1 | Peprotech | 120-38 | |
| SB202190 | Tocris | 1264 | |
| TrypLe Express | Gibco | 12604-021 | |
| Wnt 3a | R&D | 5036-WN |
참고문헌
- Thomson, J. A., et al. Embryonic stem cell lines derived from human blastocysts. Science. 282, 1145-1147 (1998).
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126, 663-676 (2006).
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131, 861-872 (2007).
- Rashid, S. T., et al. Modeling inherited metabolic disorders of the liver using human induced pluripotent stem cells. Journal of Clinical Investigation. 120, 3127-3136 (2010).
- Vallier, L., Alexander, M., Pedersen, R. A. Activin/Nodal and FGF pathways cooperate to maintain pluripotency of human embryonic stem cells. Journal of Cell Science. 118, 4495-4509 (2005).
- Jaremko, K. L., Marikawa, Y. Regulation of developmental competence and commitment towards the definitive endoderm lineage in human embryonic stem cells. Stem Cell Research. 10, 489-502 (2013).
- Forbester, J. L., et al. Interaction of Salmonella enterica Serovar Typhimurium with Intestinal Organoids Derived from Human Induced Pluripotent Stem Cells. Infection and Immunity. 83, 2926-2934 (2015).
- Hannan, N. R., et al. Generation of multipotent foregut stem cells from human pluripotent stem cells. Stem Cell Reports. 1, 293-306 (2013).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459, 262-265 (2009).
- de Souza, H. S., Fiocchi, C. Immunopathogenesis of IBD: current state of the art. Nature Reviews Gastroenterology & Hepatology. 13, 13-27 (2016).
- Tripathi, K., Feuerstein, J. D. New developments in ulcerative colitis: latest evidence on management, treatment, and maintenance. Drugs in Context. 8, 212572 (2019).
- Ganesh, K., et al. A rectal cancer organoid platform to study individual responses to chemoradiation. Nature Medicine. 25, 1607-1614 (2019).
- Fair, K. L., Colquhoun, J., Hannan, N. R. F. Intestinal organoids for modelling intestinal development and disease. Philosophical Transactions of the Royal Society B: Biological Sciences. 373, (2018).
- Cuevas-Ocaña, S., Yang, J. Y., Aushev, M., Schlossmacher, G., Bear, C. E., Hannan, N. R. F., Perkins, N. D., Rossant, J., Wong, A. P., Gray, M. A. A Cell- Based Optimised Approach for Rapid and Efficient Gene Editing of Human Pluripotent Stem Cells. Int. J. Mol. Sci. 24, 10266 (2023).
- Spence, J. R., et al. Directed differentiation of human pluripotent stem cells into intestinal tissue in vitro. Nature. 470, 105-109 (2011).
- Sato, T., et al. Long-term Expansion of Epithelial Organoids From Human Colon, Adenoma, Adenocarcinoma, and Barrett's Epithelium. Gastroenterology. 141, 1762-1772 (2011).
- Giacalone, J. C., et al. CRISPR-Cas9-Based Genome Editing of Human Induced Pluripotent Stem Cells. Current Protocols in Stem Cell Biology. 44, 1-22 (2018).
- Bruntraeger, M., Byrne, M., Long, K., Bassett, A. R., Luo, Y. . CRISPR Gene Editing: Methods and Protocols. , 153-183 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유