Method Article
יצירת אורגנואידי מעיים שמקורם ב-hiPSC עבור יישומים התפתחותיים ומידול מחלות
In This Article
Summary
פרוטוקול זה מאפשר התמיינות של תאים פלוריפוטנטיים אנושיים לאורגנואידי מעיים. הפרוטוקול מחקה התפתחות אנושית תקינה על ידי התמיינות תאים לאוכלוסייה של אנדודרם סופי, אנדודרם של המעי האחורי ולאחר מכן אפיתל מעיים. זה הופך את הפרוטוקול למתאים לחקר התפתחות מעיים כמו גם יישומי מידול מחלות.
Abstract
אורגנואידי מעיים שמקורם ב-hiPSC הם מבני אפיתל המתאספים בעצמם מתאים ממוינים למבנים תלת-ממדיים מורכבים, המייצגים את אפיתל המעי האנושי, שבו הם מציגים מבנים דמויי קריפטה/וילוס. כאן, אנו מתארים את הדור של אורגנואידים מעיים שמקורם ב-hiPSC על ידי התמיינות הדרגתית של hiPSCs לאנדודרם סופי, אשר לאחר מכן עובר פוסטריאורציה ליצירת אפיתל אחורי לפני העברתו לתנאי תרבית תלת-ממדיים. סביבת התרבית התלת-ממדית מורכבת ממטריצה חוץ-תאית (ECM) (למשל, מטריג'ל או ECM תואם אחר) בתוספת SB202190, A83-01, Gastrin, Noggin, EGF, R-spondin-1 ו-CHIR99021. אורגנואידים עוברים מעבר כל 7 ימים, שם הם משובשים מכנית לפני העברתם למטריצה חוץ-תאית טרייה ומאפשרים להם להתרחב. QPCR ואימונוציטוכימיה מאשרים כי אורגנואידי מעיים שמקורם ב- hiPSC מכילים סוגי תאי אפיתל מעיים בוגרים, כולל תאי גביע, תאי Paneth ו- enterocytes. בנוסף, אורגנואידים מראים עדות לקיטוב על ידי ביטוי של וילין הממוקם על פני השטח האפי של תאי אפיתל.
האורגנואידים המתקבלים יכולים לשמש כמודל להתפתחות מעיים אנושית, כמו גם למחלות מעיים אנושיות רבות, כולל מחלות מעי דלקתיות. כדי למדל דלקת מעיים, אורגנואידים יכולים להיחשף למתווכי דלקת כגון TNF-α, TGF-β ו-LPS חיידקי. אורגנואידים שנחשפו לציטוקינים מעודדי דלקת מציגים פנוטיפ דלקתי ופיברוטי בתגובה. זיווג של בריא לעומת hiPSCs שמקורם בחולים עם IBD עשוי להיות שימושי בהבנת מנגנונים המניעים IBD. זה עשוי לחשוף מטרות טיפוליות חדשות וסמנים ביולוגיים חדשים כדי לסייע באבחון מוקדם של המחלה.
Introduction
התכונות של תאי גזע פלוריפוטנטיים (PSCs), כגון התחדשות עצמית והיכולת להתמיין לכל סוג תא בגוף האדם, הופכות אותם לכלים יקרי ערך בחקר התפתחות, פתולוגיה של מחלות ובדיקות סמים1. תאי גזע פלוריפוטנטיים המושרים על ידי בני אדם (hiPSC) שימושיים במיוחד למחקרי מידול מחלות מכיוון שניתן להפיק אותם מחולים, וללכוד ישירות את הגנום האחראי לפנוטיפהמחלה 2,3. hiPSCs כאלה יכולים להיות מובחנים לסוג התא המושפע מהפגם הגנטי המאפשר בדיקה זהירה של המנגנון המולקולרי של המחלה4.
פרוטוקולי התמיינות עבור PSCs אנושיים שואפים לכוון התמיינות של תאים דרך שלבי ההתפתחות העיקריים על ידי הפעלה או עיכוב של מסלולי איתות ספציפיים המסדירים מחויבות ושושלת ומפרט. שמירה על hiPSC במצב פלוריפוטנטי דורשת רמות מתונות של איתות Activin A (Act-A), בעוד שמינון גבוה של Act-A במשך 3 ימים מחייב את hiPSC לגורל אנדודרם סופי (DE) 5,6. מסלולי Act-A ו-Wnt מכוונים את הזהות הקדמית-אחורית של ה-DE. איתות על ידי Act-A גורם לסמנים של המעי הקדמי (FG) כגון HHEX, HNF4α ו-GATA4, תוך חסימת ביטוי של גנים אחוריים (HG) כגון CDX2. איתות Wnt גורם לפוסטריוריזציה של DE, אשר לאחר מכן מאמצת פרופיל ביטוי גן HG 7,8. לאחר קביעת זהות תאי HG, ניתן להעביר את ההתמיינות מדו-ממד לתלת-ממד ולכוון ליצירת אורגנואידים במעי.
אורגנואידים במעיים מגודלים בדרך כלל בתרבית תלת-ממדית חוץ-תאית (למשל, מטריג'ל או ECM תואם אחר) המבוססת על מערכת תרבית9, המורכבת מלמינין, קולגן IV ואנטקטין ומועשרת בגורמי גדילה כגון EGF, FGF, PDGF ו-IGF-1 כדי לתרום לתמיכה בהישרדות ובשגשוג. האורגנואידים מתורבתים במדיום מוגדר המכיל גסטרין, נוגין ו-CHIR כדי לעורר ולתמוך בגדילה ובשגשוג של תאי גזע במעי במהלך תרבית ארוכת טווח.
לאחר שתאי אפיתל המעי מוטמעים במטריצה החוץ תאית, קריפטות מעיים מתחילות להיווצר ולהתרחב ובסופו של דבר יוצרות ספרואידים. אלה מבשילים למבנים אורגנואידים המחקים תפקוד פיזיולוגי של אפיתל מעיים. אורגנואידים יכולים בדרך כלל להיות בתרבית במשך יותר משנה אחת ללא אובדן משמעותי של פרופילי תפקוד וביטוי גנים. העברה נדרשת על בסיס שבועי באמצעות עיכול אנזימטי של האורגנואידים למקטעים קטנים יותר אשר לאחר מכן מתאספים מחדש לאורגנואידים שלמים.
קווי אורגנואידים מבוססים יכולים לשמש כמודל אמין של הפרעות רבות הקשורות למעי, כולל מחלת קרוהן, קוליטיס כיבית וסרטן המעי הגס 10,11,12,13. זהו מודל מועדף על תאי בעלי חיים מכיוון שהם מבטאים גנים אנושיים הקשורים להפרעות אלה ומגיבים לגירויים חיצוניים הדומים יותר לאלה המתרחשים ברקמה האנושית in vivo.
Protocol
הערה: כל עבודת תרבית הרקמה המפורטת להלן צריכה להיעשות במכסה מנוע זרימה למינרית Class II.
1. התמיינות תאי גזע פלוריפוטנטיים המושרים על ידי בני אדם (hiPSCs) לאנדודרם המעי האחורי
- כדי לצפות בקבוק תרבית תאים במטריצה חוץ-תאית, חשב תחילה את כמות המטריצה הדרושה. הנה דוגמה של צלחת 12 בארות להיות מצופה Matrigel. חשב את הכמות הנדרשת של מטריצה חוץ-תאית כדי לצפות צלחת 12 באר. השתמש בנוסחה הבאה:
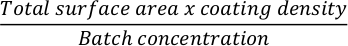
הערה: צפו צלחות תרבית תאים במטריצה חוץ-תאית לבחירה. אם אתם משתמשים במטריג'ל, יש להשתמש בריכוז של 0.035 מ"ג/ס"מ2 24 שעות לפני הזריעה לצורך בידול. בדוק את ריכוז האצווה של מטריצה חוץ-תאית בדף המוצר והכן אליציטוטים קטנים יותר לפני ניסויים בהתאם להוראות היצרן. - לדלל את הכמות הנדרשת של מטריצה חוץ-תאית במדיה DMEM קרה באמצעות פיפטה p1000.
- מערבבים היטב באמצעות סטריפט 5 מ"ל.
- הוסף 500μL של מטריצה מדוללת לכל צלחת באר. נערו את הצלחת בעדינות כדי לפזר באופן שווה את המטריצה החוץ תאית המדוללת ולדגור במשך 12 שעות לפחות ב-37°C.
- לפני זריעת תאים לצלחת, לשטוף כל באר עם 500 μL של PBS כדי להסיר מטריצה חוץ-תאית עודפת. זה ימנע ניתוק תאים במהלך ההתמיינות.
- השאירו את השטיפה האחרונה בבארות עד שהיא מוכנה לזרע כדי למנוע התייבשות של מטריצה חוץ-תאית.
- כדי לזרוע התמיינות של hiPSCs לכיוון אנדודרם סופי (DE) או מעיים אחוריים (HG), קחו בקבוק של hiPSCs שגודלו בתרבית באמצעי תחזוקה לפי בחירה (למשל: מדיה חיונית 8) ושאפו את המדיה. (כאן, אנו זורעים תאים ב 25,000 תאים לסמ"ק2).
הערה: צפיפות הזריעה חיונית להתמיינות מוצלחת ויש למטב אותה עבור כל קו תאי hiPSC בנפרד. - לשטוף את התאים בבקבוק עם 5 מ"ל של PBS. שאפו את PBS.
- הוסף 2.5 מ"ל של תמיסת דיסוציאציה של תאים (למשל, TrypLE) והשאר ב- RT למשך 4 דקות. שאפו את תמיסת הדיסוציאציה התאית וטפחו על הבקבוק בעדינות כדי לנתק את התאים.
- לשטוף את הבקבוק עם 5 מ"ל של מדיה DMEM מחומם ל 37 ° C ולאסוף את כל התאים לתוך צינור 15 מ"ל.
- קח 10 μL של תמיסת תא מרחף ולמדוד את צפיפות התא עם המוציטומטר.
- קח מספיק של תרחיף התא כדי לאסוף 1.05 x 106 תאים ומניחים בצינור 15 מ"ל.
- סבבו במהירות של 160 x גרם במשך 3 דקות. בזמן שהתאים עוברים צנטריפוגה, שאפו PBS מהמטריצה החוץ תאית המצופה 12 בארות.
- לאחר הצנטריפוגה, יש לשאוף את הסופרנאטנט ולהשהות מחדש את כדורית התא ב-12 מ"ל של אמצעי תחזוקה עם מעכב ROCK (10 מיקרומטר).
- באמצעות פיפטה p1000, להוסיף 1 מ"ל של תרחיף התא לכל באר של צלחת 12 באר. להשהות מחדש את התאים היטב כדי להבטיח חלוקה שווה בין הבארות.
- נערו את הצלחת בעדינות כדי לפזר את התאים בתוך בארות הצלחת אך הימנעו מערבולות של המדיה מכיוון שהיא תרכז את התאים במרכז הבארות.
- מניחים באינקובטור 37°C, 5% CO2 .
- שינוי מדיה למדיית תחזוקה (למשל, מדיה חיונית 8) בלבד (ללא מעכב ROCK) 24 שעות לאחר הזריעה.
- כדי להתחיל בהתמיינות ל-DE, הכינו את המדיה הבסיסית של אנדודרם לפי טבלה 1.
הערה: בתחילת ההתמיינות התאים צריכים להיות במפגש של 60-80%. - הכן 12 מ"ל של מדיה DE על ידי הוספת Activin A (100 ng/mL) ו- Wnt3 (50 ng/mL) למדיה הבסיסית של האנדודרם .
- חממו את המדיה ל-37°C.
- שאפו מדיה מכל באר של צלחת תרבית הרקמה או הצלוחית.
- התחל את בידול DE על ידי הוספת 1 מ"ל של מדיה DE לכל באר של צלחת 12 באר.
- ב-24 שעות לאחר התחלת בידול DE (D1 DE), הכינו מדיית DE טרייה ובצעו שינוי מדיה.
- חזור על שלב 1.24 ב- 48 שעות (D2 DE). אם הרבה מוות תאי קיים בשלב זה, לשטוף את כל הבארות עם 500 μL של PBS לפני שינוי התקשורת.
הערה: כדי לאשר התמיינות אנדודרם מוצלחת, בצע ציטומטריית זרימה כדי להעריך ביטוי של SOX17. בדרך כלל אנו מצפים >80% מהתאים להיות SOX17 חיובי על ידי D3 DE. אם הביטוי של SOX17 הוא תת-אופטימלי, צפיפות זריעת התאים צריכה להיות אופטימלית, כמו גם ריכוזים של Act-A. - התחל התמיינות HG בנקודה זו, כלומר 72 שעות לאחר תחילת התמיינות DE. הכן 12 מ"ל של מדיה HG על-ידי הוספת CHIR99021 (3 מיקרומטר) ו- RA (1 מיקרומטר) למדיה הבסיסית של אנדודרם (טבלה 1).
הערה: ב-D3 DE התא היה צריך ליצור חד-שכבה אחידה. בידול DE אופטימלי הוא קריטי לשלבים נוספים של בידול. - לשאוף DE מדיה.
- התחל בידול HG על ידי הוספת 1 מ"ל של מדיה HG לכל באר של צלחת 12 באר.
- המשך את הבידול במשך 4 ימים עם שינויי מדיה יומיים.
הערה: כדי לקבוע הצלחה של פוסטריוריזציה של DE, בצע ציטומטריית זרימה כדי להעריך ביטוי של CDX2. על ידי D4 של התמיינות HG אנו מצפים בדרך כלל >80% מהתאים להיות CDX2 חיובי. אם הפוסטריוריזציה אינה אופטימלית, ריכוז CHIR99021 צריך להיות אופטימלי. - כדי לאסוף דגימה למיצוי RNA, שאפו אמצעי התמיינות ושטפו את הבאר עם 500 ul של PBS.
- שאפו PBS והוסיפו נפח מתאים של חיץ ליזה תאי מערכת מיצוי RNA.
- באמצעות פיפטה p1000, לגרד את החלק התחתון של הבאר כדי להבטיח ליזה של כל התאים.
- שואפים את התא ליזט ומניחים בצינור נקי.
- המשך למיצוי RNA או הקפיא את הליזט ב -20 ° C עד מוכן למיצוי RNA.
- עבור immunostaining, לשאוף הבחנה מדיה לשטוף בארות עם 500 μL של PBS.
- שאפו את PBS והוסיפו 500 μL של 4% PFA.
הערה: PFA רעיל. השתמש בציוד הגנה אישי מתאים ופעל לפי נהלי מעבדה מקומיים לסילוק PFA. - יש לדגור ב-4°C למשך 20 דקות.
- הסר PFA ולשטוף את הבארות עם 500 μL של PBS שלוש פעמים.
- השאירו את שטיפת PBS האחרונה על התאים עד מוכנים לביצוע immunostaining.
2. מעבר של אורגנואידים במעיים
- הכינו את מצע הבסיס של המעי לפי טבלה 2.
- כדי לעבור מתרבית תאים דו-ממדית לתלת-ממדית, השתמש בלוח 6 בארות כדי ליצור תאי DE בצורת hiPSCS. נתקו את שכבת התאים החד-שכבתית ויוצרים את צלחת 6 התאים באמצעות פסים של 5 מ"ל.
- לאסוף תאים לתוך צינור צנטריפוגה 15 מ"ל, לפני צנטריפוגה ב 400 x גרם במשך 1 דקה כדי לייצר גלולה התא.
- יש להשהות מחדש את כדורית התא במצע גדילה של המעי המכיל גורמי גדילה: SB202190 (10 מיקרומטר), A83-01 (500 ננומטר), גסטרין (10 ננומטר), נוגין (100 ננוגרם/מיקרוליטר), EGF (500 ננוגרם/מיקרוליטר), R-ספונדין1 (100 ננוגרם/מ"ל), CHIR99021 (6 מיקרומטר), מעכב רוק (10 מיקרומטר).
- הוסף נפח מתאים של מטריצה חוץ-תאית בהתאם למספר הבארות המצופות לתוכן. ניתן לחשב זאת באמצעות המשוואות שלהלן.
[1] נפח כולל של מטריצה/מדיה חוץ-תאית (μL) = 30 μL * מספר הבארות של צלחת 48 בארות
[2] נפח נדרש של מטריצה חוץ-תאית (μL) = מענה מאת [1] * 2/3
[3] נפח מדיה נדרש (μL) = מענה מאת [1] * 1/3 - הוסף 30 μL של תרחיף תאים למרכז כל באר של צלחת 48 באר.
- דוגרים על הצלחת באינקובטור של 37 מעלות צלזיוס למשך 5 דקות לפחות כדי לאפשר למטריצה החוץ תאית להתמקם.
- לאחר שכיפות המטריקס החוץ תאיות שקעו, הוסיפו 300 μL של מצע גדילה במעיים המכיל את כל גורמי הגדילה לכל באר.
- מחזירים את הצלחת לאינקובטור של 37°C עם 5% CO2.
הערה: אם לאחר 48 שעות לא ניתן לראות אורגנואידים ו / או יש מוות תאי משמעותי, ייתכן שיהיה צורך למטב את ריכוזי ROCKi ו- NOGGIN. - כדי לעבור את האורגנואידים, התבוננו בתאים תחת מיקרוסקופ אור כדי להעריך את צפיפות וגודל האורגנואידים ולקבוע אם הם זקוקים למעבר.
- החלף מדיה של תרבית תאים ב- PBS קר כקרח.
הערה: תרביות אורגנואידים יצטרכו להתפצל בערך כל 5-7 ימים. מעבר של תרביות אורגנואידים במעי נדרש ברגע שיש הצטברות של פסולת תאים ניכרת בתוך לומן אורגנואיד והצהבה של מצהיב של מצע הגידול במעי שמסביב. - נתק באופן מכני אורגנואידים וכדור מטריצה חוץ-תאי מהצלחת באמצעות תנועת גירוד עם פס 5 מ"ל.
- אספו את האורגנואידים מכל באר לתוך צינור צנטריפוגה של 15 מ"ל.
- תרחיף אורגנואיד צנטריפוגה ב 400 x גרם למשך דקה אחת כדי לגלול את האורגנואידים. שאפו את הסופרנאטנט עד שיגיעו לחלק העליון של גלולת התא, תוך זהירות כאשר הגיעו לשכבת המטריצה החוץ-תאית הנראית לעין.
- להשעות את הגלולה ב 15 מ"ל של PBS קר כקרח.
הערה: שלב זה משמש לשטיפת כל מטריצה חוץ-תאית שנותרה שלא הוסרה בסחרור הראשוני. - צנטריפוגה ב 400 x גרם במשך 1 דקה. שואפים את התקשורת עד הכדור, המכיל את האורגנואידים.
- Resuspend ב 1 מ"ל של PBS קר כקרח. באמצעות פיפטה p200, לשבש ידנית את האורגנואידים השלמים על ידי פיפטציה למעלה ולמטה מספר פעמים.
הערה: התבונן בגודל האורגנואידים באמצעות מיקרוסקופ אור כדי לקבוע אם יש צורך בניתוק נוסף. - הוסף 9 מ"ל של מדיה ללא גורמי צמיחה.
- צנטריפוגה ב 400 x גרם במשך 1 דקה. שואפים את הסופרנאטנט עד לכדור האורגנואידים.
- חשב את הכמות הנדרשת של מטריצה חוץ-תאית ומדיה באמצעות המשוואות הבאות:
[1] נפח כולל של מטריצה/מדיה חוץ-תאית (μL) = 30 μL * מספר הבארות של צלחת 48 בארות
[2] נפח נדרש של מטריצה חוץ-תאית (μL) = מענה מאת [1] * 2/3
[3] נפח מדיה נדרש (μL) = מענה מאת [1] * 1/3 - יש להשהות מחדש את כדורית האורגנואיד בנפח המחושב של מצע המעי עם גורמי גדילה (כולל מעכב Noggin & ROCK).
- הוסף את הנפח הנדרש של מטריצה חוץ-תאית לתרחיף תא זה והשהה מחדש כדי להבטיח פיזור אחיד של אורגנואידים.
- פיפטה 30 μL של השעיה זו למרכז כל באר של צלחת 48 באר (רצוי מחומם מראש באינקובטור 37 מעלות צלזיוס).
- מחזירים את הצלחת לאינקובטור בטמפרטורה של 37°C למשך 5 דקות עד שהמטריצה החוץ תאית שוקעת.
- הכן מדיה מעיים עם גורמי גדילה (+ מעכב ROCK) (כ 17 מ"ל לכל צלחת 48 באר).
- הוסיפו 300 μL לכל באר.
- יש לדגור ב-37°C ב-5% CO2.
- לאחר המעבר, יש לשאוף את המצע לאורגנואידים במעי ולהחליף במצע מעי טרי בגורמי גדילה (ללא מעכב Noggin & ROCK) כל 2-4 ימים.
הערה: אם לאחר 48 שעות לא ניתן לראות אורגנואידים ו / או יש מוות תאי משמעותי, ייתכן שיהיה צורך למטב את ריכוזי ROCKi ו- NOGGIN.
הערה: אורגנואידים במעיים מגיבים למגוון מתווכי דלקת in vivo. TNFα הוא חלבון איתות תאי המעורב במספר תהליכים דלקתיים. - כדי לעורר תגובה דלקתית באורגנואידים במעי, יש להכין TNFα בריכוז של 40 ננוגרם/מ"ל במצע הבסיסי בלבד.
- לשאוף מדיה מ 48 צלחת באר.
- הוסף 300 μL של מדיה בסיסית מוכנה המכילה 40 ng/mL TNFα.
- יש לדגור על הצלחת בטמפרטורה של 37°C למשך 48 שעות כדי לשכפל סביבה פרו-דלקתית.
הערה: אורגנואידים במעיים מגיבים למגוון מתווכי דלקת in vivo. TNFα הוא חלבון איתות תאי המעורב במספר תהליכים דלקתיים. - יש להיפטר מכל התאים הנותרים על ידי שאיפה למלכודת ואקום המכילה 5% טריגן.
תוצאות
סכמה של פרוטוקול ההבחנה מוצגת באיור 1A. ביום הראשון של הפרוטוקול, hiPSCs צריך להיות קומפקטי וליצור מושבות קטנות עם מפגש כולל כ 50-60%. 24 שעות לאחר השראת ההתמיינות לכיוון DE, תאים מתחילים לנדוד הרחק ממושבות תאי הגזע וליצור שכבה אחת של תאים. זה נמשך במהלך 3 הימים הבאים ואמור ליצור מונושכבה שלמה על D3 של התמיינות DE (איור 1). ביטוי גנים צריך להיות מנוטר במהלך התמיינות עם סמנים פלוריפוטנטיים (OCT4, NANOG, SOX2) מבוטא מאוד על D0 ומווסת במהירות במהלך התמיינות DE. במהלך התמיינות DE ביטוי T צריך להגיע לשיא ב-D1, ואחריו EOMES ו-MIXL ב-D2. ב-D2 גנים מסוג DE (SOX17, FOXA2, GATA4, CXCR4) אמורים להתחיל להתבטא ולהגיע לשיא ב-D3 (איור 2 ואיור 3). התאים צריכים להיות חד-שכבתיים על ידי DE D3 ולאחר מכן ניתן להפוך אותם לאנדודרם של המעי האחורי. במהלך אירוע הפוסטריוריזציה מבנים תלת-ממדיים יתחילו להיווצר כבר ב-D2. עם זאת, לפעמים הם יתחילו להופיע רק ב D4 או בכלל לא; זה לא תמיד מעיד אם התאים יתקדמו ויצרו אורגנואידים במעיים (איור 1). במהלך מפרט HG יש לגרום לביטוי CDX2 ו-HNF4a ולגדול עם הזמן (איור 3).
לאחר העברת יריעות דו-ממדיות של תאים למטריצה חוץ-תאית, ייצפו גושים של תאים דו-ממדיים במשך 24 השעות הראשונות. לאחר 48 שעות, גיליונות של תאים אמורים להתחיל להתארגן באופן אוטומטי למבנים ספרואידים תלת-ממדיים דחוסים יותר, שבתחילה הם קטנים (איור 4A), ואז להגדיל בהדרגה את גודלם ומורכבותם במשך 7-10 ימי תרבית (איור 4B ואיור 4C). אין להעביר אורגנואידים עד שהם השיגו מורפולוגיית אורגנואיד/ספרואיד ברורה עם אפיתל ברור כאשר הלומן פונה לכיוון מרכז האורגנואיד/ספרואיד (איור 4D). בשלב זה ניתן להשתמש באימונוציטוכימיה כדי לאשר ביטוי של סמני מעיים כמו וילין ו-CDX2 (איור 5). לא כל הגושים של תאים דו-ממדיים יתפתחו לאורגנואידים ויהיו כמה תאים מתים מזהמים בתוך המטריצה החוץ-תאית. יש להתעלם מיריעות תאים מתות אלה עד שהתאים ששרדו יצרו אורגנואידים גדולים ויהיו מוכנים למעבר.
כדי למדל דלקת, ניתן להוסיף TNFα למדיום תרבית הרקמה למשך 24-48 שעות. לאחר הדגירה עם מולקולות מעודדות דלקת, אורגנואידים נקצרים באותה טכניקה המשמשת לבידודם ולמעברם, ולאחר מכן נקצרים באמצעות יישום תואם חיץ תאים כגון QPCR או כתם מערבי. אם נדרשות חשיפות קצרות יותר, יש להסיר תחילה אורגנואידים מהמטריצה החוץ תאית ולחשוף אותם ל-TNFα בתרחיף באמצעות צינור של 1.5 מ"ל. טיפול באורגנואידים של המעי עם TNFα במשך 48 שעות בדרך כלל גורם לביטוי של סמנים מעודדי דלקת (TNFα, IL1B, IL8, IL23) תוך השפעה שלילית על ביטוי סמני אפיתל המעי (LGR5, VIL) (איור 6).
| אנדודרם מדיה בזאלית | 50 מ"ל | |
| RPMI 1640 | 48.5 מ"ל | |
| תוסף B27 | 1 מ"ל | |
| 1% NEAA | 0.5 מ"ל | |
טבלה 1: הרכב המדיה הבסיסית האנדודרמלית להתמיינות אנדודרם.
| מדיה בסיסית במעיים | 50 מ"ל | |
| DMEM/F12 מתקדם | 46.5 מ"ל | |
| חיץ HEPES | 0.5 מ"ל | |
| גלוטמקס | 0.5 מ"ל | |
| ניקוטינאמיד | 0.5 מ"ל | |
| תוספת N2 | 0.5 מ"ל | |
| תוסף B27 | 1.0 מ"ל | |
| עט/סטרפ | 0.5 מ"ל | |
טבלה 2: הרכב המדיה הבסיסית של המעי לתרבית אורגנואידים במעי
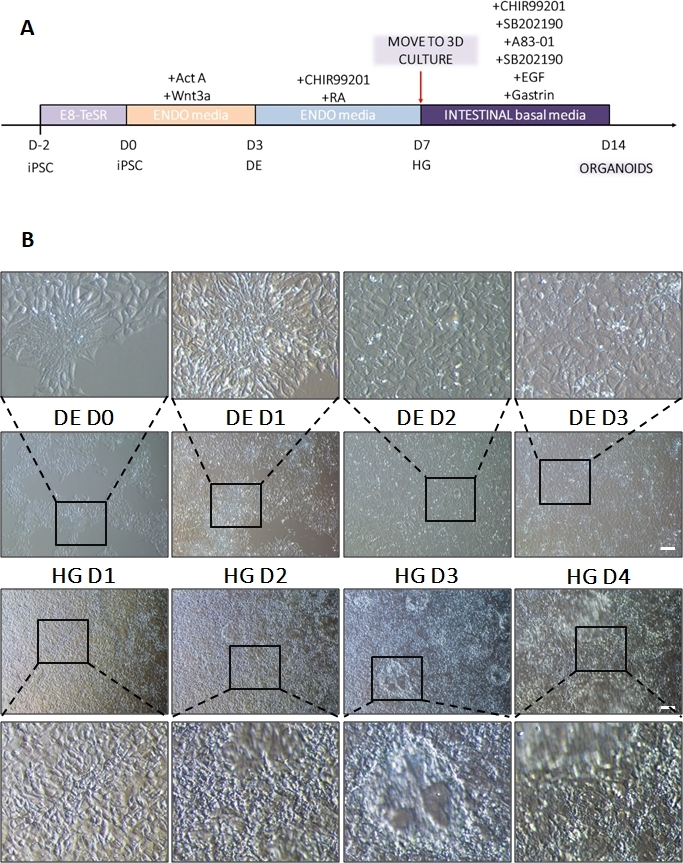
איור 1: שינויים מורפולוגיים במהלך התמיינות של hiPSC באמצעות אנדודרם סופי לשושלת האחורית.
(A) סקירה סכמטית של פרוטוקול התמיינות מעיים. קו תאים זה של hiPSC יוצר מושבות רופפות של תאים קטנים עם יחס גרעין לציטופלסמה גבוה. ככל שההתמיינות מתקדמת, התאים עוברים שינויים התואמים את המעבר מהאפיתל לפנוטיפ המזנכימלי ועל ידי DE D3 יוצרים חד-שכבה אחידה. ברגע שהאותות המתאימים מועברים, תאי DE מתארכים ויוצרים שכבה חד-שכבתית צפופה יותר עם ספרואידים תלת-ממדיים המופיעים ברגע HD D3, אך הדבר תלוי בקו התא המשמש ואינו מהווה דרישה למעבר לתרבית תלת-ממדית (B). סרגל קנה מידה: 100 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
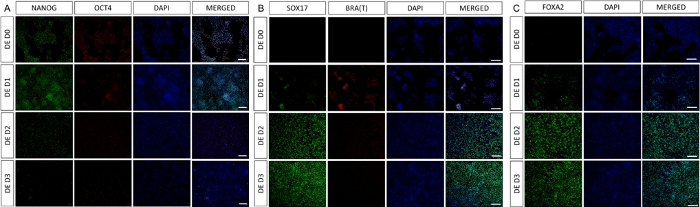
איור 2: התמיינות של hiPSCs לאנדודרם HG גורמת לביטוי של גנים אנדודרמליים.
אימונוסטיין של התמיינות hiPSC לאנדודרם סופי מראה שינויים בביטוי של TFs ברמת החלבון. סמני פלוריפוטנציה (NANOG ו- OCT4) מווסתים על ידי DE D3 (A). ביטוי של סמן mesendoderm BRA(T) קיים ב-D1 של הפרוטוקול (B) ו-TFs ספציפיים ל-DE SOX17 ו-FOXA2 מופיעים ב-D2 (B & C). סרגל קנה מידה: 200 מ"מ. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
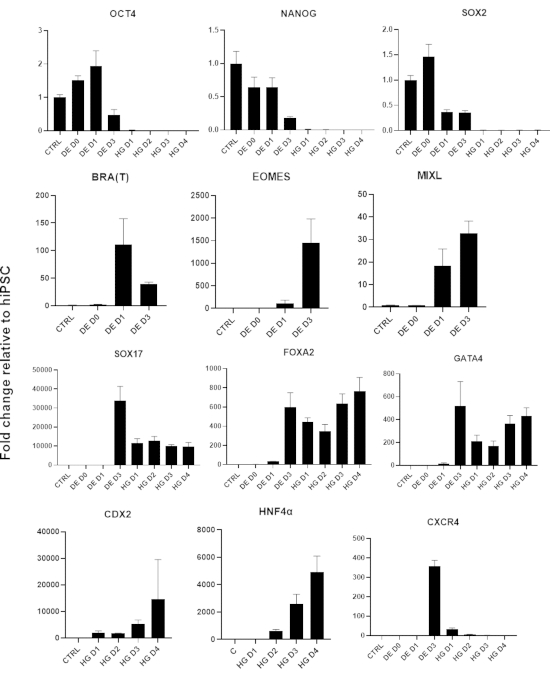
איור 3: שינויים בביטוי גנים על-ידי qPCR במהלך התמיינות hiPSC לאנדודרם של המעי האחורי (HG).
גנים הקשורים לפלוריפוטנציה מווסתים מטה (OCT4, NANOG, SOX2) ולאחר מכן ביטוי חולף של גנים mesendoderm (T, EOMES, MIXL1), ולבסוף ביטוי של גנים DE (SOX17, FOXA2, CXCR4) וגנים אחוריים (CDX2, GATA4, HNF4a). הנתונים מוצגים כממוצע ±SD. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
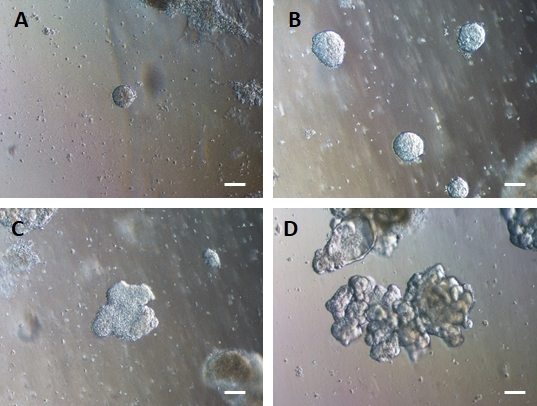
איור 4: אנדודרם HG מתאסף בעצמו כדי ליצור אורגנואידי מעיים תלת-ממדיים בתרבית מטריצה חוץ-תאית תלת-ממדית.
אנדודרם HG מועבר לתרבית מטריצה חוץ-תאית תלת-ממדית מתאימה ויוצר בתחילה גושים מוצקים קטנים של תאים (A). גושים של אנדודרם HG מתרחבים במשך 7-10 ימים של תרבית (B) ואז הופכים לא-סימטריים ומתחילים ליצור אפיתל מורכב יותר (C), ובסופו של דבר יוצרים אורגנואידים עם מורפולוגיה אפיתל ברורה ומשטח לומינלי הפונה לכיוון מרכז האורגנואיד (D). פסי קנה מידה = 50 מיקרומטר לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
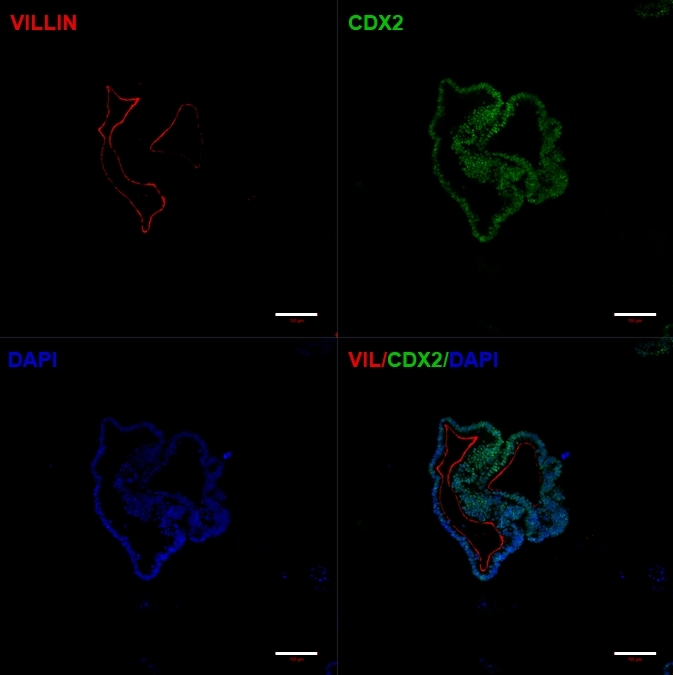
איור 5: אורגנואידי מעיים מבוססים שמקורם ב-hiPSC מבטאים סמני מעיים.
אימונוציטוכימיה מראה ביטוי של CDX2 ו Villin. פסי קנה מידה = 100 מיקרומטר לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
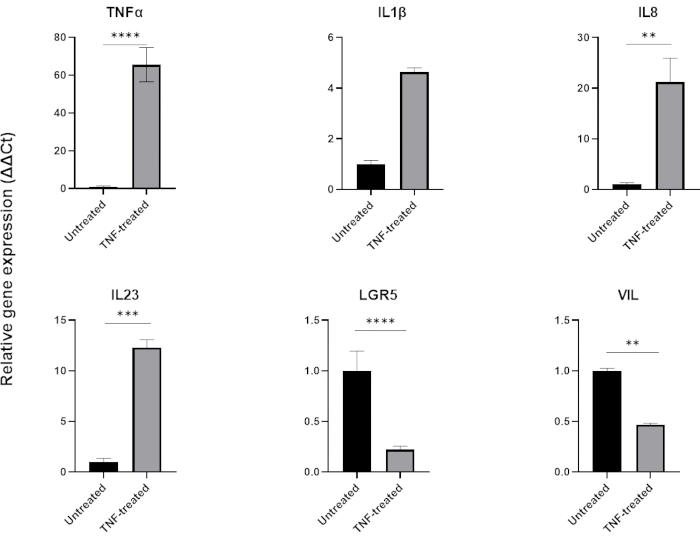
איור 6: ההשפעה של TNFα על הפרופיל הדלקתי ועל ביטוי תאי המעי של אורגנואידים בריאים במעי.
פרופיל דלקתי של אורגנואידים בריאים במעי הגס לאחר טיפול של 48 שעות ב-TNFα (40 ננוגרם/מ"ל). הביטוי של סמנים מעודדי דלקת (TNFα, IL-8 ו-IL-23) עולה בעקבות חשיפה ל-TNFα, ובמקביל הביטוי של סמני אפיתל במעי (LGR5, VIL) מווסת פחות. הניתוחים הסטטיסטיים בוצעו על ידי מבחן t דו-צדדי של הסטודנט. הנתונים מבוטאים כממוצע ± SD של כל קבוצה. *P < 0.01; **P < .001; P < .0001. (n=3). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
במאמר זה אנו מתארים פרוטוקול להתמיינות של תאים פלוריפוטנטיים אנושיים לאורגנואידים אנושיים במעי. אנו מדגימים את השימוש בהם לחקר דלקת; עם זאת, ניתן ליישם זאת בהקשרים שונים, בשילוב עם גישות עריכת גנים CRISPR/Cas914, על כל רקע גנטי. לאחר ההבחנה, בעקבות רצף ההתמיינות ההתפתחותי הטבעי של אנדודרם סופי, אנדודרם המעי האחורי ולאחר מכן אפיתל מעיים, האורגנואידים המתקבלים יכולים להיות מתורבתים ברציפות ולעבור במשך יותר מ -12 חודשים.
היבט קריטי של פרוטוקול זה הוא צפיפות הציפוי הראשונית של תאי גזע לא ממוינים לפני התמיינות אנדודרם. אם זה לא אופטימלי מספיק, תאים צפויים למות במהלך שלב התמיינות DE הראשוני (אם התאים דלילים מדי) או להפחית את היעילות של התמיינות DE (אם התאים צפופים מדי). צפיפות ההתחלה הנכונה צריכה להיות ממוטבת עבור קו התא שבו נעשה שימוש, והצפיפות הנכונה צריכה ליצור שכבה אחת עד סוף DE D3. יש להשתמש בציטומטריית זרימה כדי לקבוע יעילות של מפרט DE ובדרך כלל אנו רואים >80% מהתאים חיוביים ל-SOX17 ו/או CXCR4. כאשר מספר התאים החיוביים SOX17 קטן מ-60%, היעילות של תבניות HG מושפעת, מה שגורם לפחות אורגנואידים להיווצר כאשר הם מועברים למטריצה החוץ תאית. זה בסופו של דבר יגרום לתרביות האורגנואידים שנוצרו להיכשל. כדי לקבוע אם דפוס DE ל- HG היה מוצלח, אנו מעריכים את מספר התאים החיוביים CDX2 על ידי ציטומטריית זרימה ובדרך כלל מצפים לראות >80% תאים חיוביים. שוב, אם מספר התאים החיוביים CDX2 נופל מתחת ל -50% תהיה לכך השפעה שלילית על מספר אורגנואידי המעי הנוצרים כאשר מועברים לתרבית מטריצה חוץ-תאית תלת-ממדית.
לאחר העברת חד-שכבות דו-ממדיות לתרבית תלת-ממדית, כדורים קומפקטיים קטנים אמורים להופיע 24-48 שעות לאחר ההעברה. יריעות גדולות של תאים מתים יכולות להופיע בהתאם ליעילות ההתמיינות של קו התא בו נעשה שימוש. במקום לעבור מיד תרביות כדי לסלק את הפסולת הזו, אנו מאפשרים לאורגנואידים להיווצר באופן מלא ולפתח את המבנה המורכב והמקופל יותר שלהם. המתנה של 7-10 ימים לפני ניסיון המעבר הראשון מבטיחה כי מספיק תאים מתחלקים נמצאים כדי לייצר אורגנואידים חדשים רבים במעי. כל פסולת שעדיין קיימת בתרבית ניתנת להסרה בקלות במהלך תהליך המעבר על ידי סיבוב איטי של תערובות האורגנואידים / הפסולת המנותקות בצינור במהירות מספקת כדי לזרוק את האורגנואידים אך להשאיר יריעת תאים צפה במדיה. לאחר מכן ניתן לשאוף מדיה ופסולת תאית כך שתישאר רק גלולת האורגנואידים.
המגבלה של גישה זו היא שסוגי תאים שמקורם ב-hiPSC אינם לעתים קרובות בשלים לחלוטין במונחים של ביטוי גנים ופרופילים פונקציונליים. כדי לקבוע אם רקמת מעיים שמקורה ב- hiPSC מתאימה ליישומים ספציפיים, יש לאפיין את האורגנואידים עבור סוגי תאים שונים, כולל אנטרוציטים (VIL), תאים אנטרואנדוקריניים (neurog3), תאי גביע (MUC2), תאי הגברה חולפים (CD133), תאי פאנת (FZD5) ותאי גזע LGR5+ (LGR5) כדי לקבוע את הרכב תאי האורגנואידים.
בסך הכל, היתרון העיקרי של פרוטוקול זה על פני פרוטוקולי התמיינות אורגנואידים רבים אחרים הוא שפלטפורמת תרבית זו חסכונית מאוד בשל החלפת מספר חלבונים רקומביננטיים ותכשירי מדיה מותנים במולקולות קטנות15,16. ההתמיינות ל- HG היא פשוטה ומהירה מאוד וניתן ליישם אותה הן על תאי גזע עובריים אנושיים והן על תאי גזע פלוריפוטנטיים מושרים עם תוצאות זהות. כאשר עוקבים אחריו בקפדנות, ומותאמים לקווי התאים הנמצאים בשימוש, הוא מספק פלטפורמת מודל פשוטה יחסית ללא תאים מזנכימליים מזהמים שניתן ליישם לאחר מכן לחקר אפיתל המעי במגוון הקשרים, כולל דלקת, אינטראקציות פתוגן מארח7. מודלים של פיברוזיס במעי יכולים להיחקר על ידי מתן גירויים פרו-פיברוטיים ולאחר מכן הערכת ביטוי של חלבוני מטריצה חוץ-תאיים כגון קולגן, למינין ופיברונקטין על ידי QPCR, Western Blot ו-ELISA. שימוש בטכניקות עריכת גנים CRISPR/Cas9 על קווי תאי גזע לא ממוינים לפני התמיינות מאפשר יצירת אורגנואידים של נוקאאוט גנים או ביטוי יתר של חלבונים שניתן להשתמש בהם ליצירת אורגנואידים ספציפיים למחלה ומודלים מורכבים יותר של מחלות 14,17,18.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
NH ממומן על ידי MRC (MR/S009930/1) וקרן Wellcome (204267/Z/16/Z), PD ממומן על ידי MRC PhD DTP, KLF ממומן על ידי BBSRC iCASE.
Materials
| Name | Company | Catalog Number | Comments |
| A83-01 | Tocris | 2939 | |
| Activin A | R&D | 338-AC | |
| Advanced DMEM/F12 (1X) | Life Technologies | 12654-010 | |
| B27 supplement | Gibco | 17504044 | |
| CHIR99021 | Sigma | SML1046-5MG | |
| Epidermal Growth Factor | R&D Systems | 236-EG-01M | |
| Gastrin | Sigma Aldrich | G9145 | |
| GlutaMAX (100X) | Life Technologies | 15630-056 | |
| Growth Factor reduced Matrigel | BD | ||
| HEPES Buffer solution (1M) | Life Technologies | 15630-080 | |
| N2 Supplement (100X) | Gibco | 17502-048 | |
| N-acetyl-cysteine | Sigma Aldrich | A7250 | |
| Nicotinamide | Sigma Aldrich | N0636 | |
| Noggin | R&D Systems | 6057-NG | |
| Non-essential amino acids | Gibco | 11140-050 | |
| Paraformaldehyde | VWR | 9713.5 | |
| Penicillin/Streptomycin | Gibco | 15140122 | |
| Phosphate Buffered Saline | Gibco | 14190-094 | |
| Retinoic Acid | Sigma | 302-79-4 | |
| ROCK inhibitor | Tocris | 1254/1 | |
| ROCK inhibitor Y-27632 | Tocris | 1254 | |
| RPMI | Sigma | R8758-500ml | |
| R-Spondin-1 | Peprotech | 120-38 | |
| SB202190 | Tocris | 1264 | |
| TrypLe Express | Gibco | 12604-021 | |
| Wnt 3a | R&D | 5036-WN |
References
- Thomson, J. A., et al. Embryonic stem cell lines derived from human blastocysts. Science. 282, 1145-1147 (1998).
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126, 663-676 (2006).
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131, 861-872 (2007).
- Rashid, S. T., et al. Modeling inherited metabolic disorders of the liver using human induced pluripotent stem cells. Journal of Clinical Investigation. 120, 3127-3136 (2010).
- Vallier, L., Alexander, M., Pedersen, R. A. Activin/Nodal and FGF pathways cooperate to maintain pluripotency of human embryonic stem cells. Journal of Cell Science. 118, 4495-4509 (2005).
- Jaremko, K. L., Marikawa, Y. Regulation of developmental competence and commitment towards the definitive endoderm lineage in human embryonic stem cells. Stem Cell Research. 10, 489-502 (2013).
- Forbester, J. L., et al. Interaction of Salmonella enterica Serovar Typhimurium with Intestinal Organoids Derived from Human Induced Pluripotent Stem Cells. Infection and Immunity. 83, 2926-2934 (2015).
- Hannan, N. R., et al. Generation of multipotent foregut stem cells from human pluripotent stem cells. Stem Cell Reports. 1, 293-306 (2013).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459, 262-265 (2009).
- de Souza, H. S., Fiocchi, C. Immunopathogenesis of IBD: current state of the art. Nature Reviews Gastroenterology & Hepatology. 13, 13-27 (2016).
- Tripathi, K., Feuerstein, J. D. New developments in ulcerative colitis: latest evidence on management, treatment, and maintenance. Drugs in Context. 8, 212572 (2019).
- Ganesh, K., et al. A rectal cancer organoid platform to study individual responses to chemoradiation. Nature Medicine. 25, 1607-1614 (2019).
- Fair, K. L., Colquhoun, J., Hannan, N. R. F. Intestinal organoids for modelling intestinal development and disease. Philosophical Transactions of the Royal Society B: Biological Sciences. 373, (2018).
- Cuevas-Ocaña, S., Yang, J. Y., Aushev, M., Schlossmacher, G., Bear, C. E., Hannan, N. R. F., Perkins, N. D., Rossant, J., Wong, A. P., Gray, M. A. A Cell- Based Optimised Approach for Rapid and Efficient Gene Editing of Human Pluripotent Stem Cells. Int. J. Mol. Sci. 24, 10266 (2023).
- Spence, J. R., et al. Directed differentiation of human pluripotent stem cells into intestinal tissue in vitro. Nature. 470, 105-109 (2011).
- Sato, T., et al. Long-term Expansion of Epithelial Organoids From Human Colon, Adenoma, Adenocarcinoma, and Barrett's Epithelium. Gastroenterology. 141, 1762-1772 (2011).
- Giacalone, J. C., et al. CRISPR-Cas9-Based Genome Editing of Human Induced Pluripotent Stem Cells. Current Protocols in Stem Cell Biology. 44, 1-22 (2018).
- Bruntraeger, M., Byrne, M., Long, K., Bassett, A. R., Luo, Y. . CRISPR Gene Editing: Methods and Protocols. , 153-183 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved