A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الآلي التفاضلية النووية التفضيل الملطخة اختبار لتحديد دقيق للسمية الخلوية الميتوك
* These authors contributed equally
In This Article
Summary
يصف البروتوكول فحص سريع وعالي الإنتاجية وموثوقًا به وغير مكلف وغير متحيز لتحديد الجدوى الخلوية بكفاءة. هذا الفحص مفيد بشكل خاص عندما تضررت الميتوكوندريا الخلايا ، مما يتداخل مع التشايسات الأخرى. يستخدم الفحص العد الآلي للخلايا الملطخة بصبغتين نوويتين – Hoechst 33342 و ميووديد البروديوم.
Abstract
مساهمة الميتوكوندريا في التحول على الوسووجين هو موضوع اهتمام واسع ودراسة نشطة. كما يصبح مجال الأيض السرطان أكثر تعقيدا, هدف استهداف الميتوكوندريا باستخدام المركبات المختلفة التي تسبب الضرر الميتوكوندريا (ما يسمى الميتوكان) أصبحت شعبية جدا. لسوء الحظ، تتطلب العديد من مقايسات السمية الخلوية الموجودة، مثل تلك القائمة على أملاح تترازوليوم أو ريسازونين إنزيمات الميتوكوندريا الوظيفية لأدائها. الأضرار التي تلحقها المركبات التي تستهدف الميتوكوندريا غالبا ما يعرض للخطر دقة هذه المقايسات. هنا، نحن وصف بروتوكول معدلة على أساس التصبغ التفاضلي مع اثنين من الأصباغ الفلورية، واحدة منها هي الخلية permeant (Hoechst 33342) والآخر الذي ليس (يوديد البرودييوم). الفرق في تلطيخ يسمح الخلايا الحية والميتة أن يكون التمييز. الميكنة قابلة للمجهر الآلي وتحليل الصور ، مما يزيد من الإنتاجية ويقلل من التحيز. وهذا يسمح أيضا أن تستخدم في الميكون عالية الإنتاجية باستخدام لوحات 96-well، مما يجعلها خيارا قابلا للتطبيق لجهود اكتشاف المخدرات، لا سيما عندما تكون الأدوية المعنية لديها بعض مستوى السمية الميتومي. الأهم من ذلك، النتائج التي حصلت عليها Hoechst / PI تلطيخ قياس إظهار زيادة الاتساق، سواء مع نتائج استبعاد الأزرق trypan وبين يكرر البيولوجية عندما تتم مقارنة المقايسة إلى أساليب أخرى.
Introduction
الخطوة الأولى لتحديد علاجات السرطان الفعالة هي اختيار اختبار قوي وغير متحيز للسمية الخلوية التي يمكن استخدامها لفحص تأثير العلاج. خيار شائع لتجارب منخفضة الإنتاجية هو استبعاد الصبغة الزرقاء trypan من الخلايا الحية. يفضل هذا الأسلوب لأنه يسمح بطريقة غير متحيزة نسبيا لتحديد مدى بقاء الخلية. trypan الأزرق ينشر بشكل سلبي في الخلايا التي تتعرض للخطر الأغشية، ولكن يتم حظره بشكل فعال من دخول الخلايا السليمة1. حاصل الخلايا الحية والخلايا الكلية يمثل نسبة البقاء في المئة، مما يدل على فعالية العلاج. العيب الأكثر أهمية من المقايسة الزرقاء trypan هو أنه غير مناسب لمنهجيات عالية الإنتاجية. لديها نسبة منخفضة نسبيا إشارة إلى الضوضاء وتلطيخ لفترات طويلة يمكن أن يؤدي إلى القطع الأثرية بسبب تلطيخ الخلايا القابلة للحياة. وبالتالي، يتم استبعاد trypan الأزرق عادة، ولكن ليس دائما2، هبط إلى العد اليدوي. وهذا يجعلها بطيئة جدا ويدخل إمكانية قوية للتحيز بسبب الحكم الذاتي للباحث (ما لم يتم استخدام التهم المسببة للعمى أو مستقلة، مما يقلل من الإنتاجية المختبرية). بشكل عام ، فإن معدل نقل هذا الفحص غير كاف لاكتشاف الأدوية الحديثة.
إن عمليات الفحص التي تكون لها القدرة على البقاء، والتي عادة ما يكون لها إنتاجية أعلى بكثير، تسمح للباحثين بالتحايل على هذا القيد، ولكن تأتي مع محاذير كبيرة (انظر الجدول 1). هذه الأساليب تقع عموما في مجموعتين. تتكون مجموعة واحدة من المعايرات colorimetric التي تستند إلى وظيفة إنزيمات الأكسدة الخلوية. يتم تحويل ركائز عديم اللون أو غير الفلورسنت إلى منتجات نابضة بالحياة يمكن تحديدها كميا باستخدام مقياس الطيف. وتشمل الأمثلة الكلاسيكية أملاح تترازوليوم (MTT، WST-1، XTT، الخ) و resazurin. وتشمل هذه الفئة أيضا المقايسات الإنارة التي تستخدم لوسيفيرين لتقييم مستوى ATP. وتوجد في هذه المقاييس من هذا النوع قيود على أنها تقيس عملية التمثيل الغذائي الخلوي، وهي ليست قابلية البقاء الخلوية في حد ذاتها. من الشائع جداً أن تصبح الخلايا هادئة في ظل ظروف معاكسة، ولكنها لا تزال تحتفظ بالقدرة على تقسيم3و4و5. على سبيل المثال، الخلايا الجذعية السرطانية غالبا ما تكون هادئة نسبيا6،7،8،9، ومن المرجح أن يكون من الصعب إجراء فحص باستخدام هذه التقنيات. ومن المرجح أيضا أن تكون هناك مبالغة كبيرة في تقدير فعالية العلاجات التي تضر بوظيفة الميتوكوندريا، مثل معظم الميتوك.
وتستفيد المنهجية البديلة من الخواص الكيميائية للمواد المختلفة التي تسمح لها إما بعبور الأغشية البيولوجية أو عدم عبورها. ومن الأمثلة على ذلك البقع النووية مثل SYTOX أو يوديد البروديوم (PI). وتشمل هذه الفئة أيضا المقايسات التي هي مماثلة في المفهوم ولكن مختلفة في وظيفة، مثل dehydrogenase اللاكتات (LDH) المقايسة، الذي يقيس الإفراج عن LDH في الوسط خارج الخلية كمؤشر النخر الخلوي(الشكل 1،الجدول 1). هذه المقايسات هي أكثر قدرة على التمييز بين الخلايا غير النشطة الأيضية والميتة.
| مقايسة / صبغة | نوع (ق) من موت الخلية المكتشفة | المعدات اللازمة | الميزات الرئيسية |
| MTT، CKK-8، علامة الأزرق (resazurin) | المبرمج المبرمج / نخر | مقياس الطيف الضوئي | غير مكلفة، سريعة؛ نقطة النهاية المقايسة؛ تعتمد على نشاط الانزيمات (المتقدر الحصري في حالة MTT) ولا يميز بين أنماط موت الخلايا1,10 |
| الافراج عن LDH | نخر | مقياس الطيف الضوئي | سريع, مستقلة عن نشاط الإنزيمات الميتوكوندريا; مكلفة لاختبارات عالية الإنتاجية؛ يكتشف الخلايا النخرية مع غشاء البلازما compromized11،12 |
| تريبان بلو (TB) | المبرمج المبرمج / نخر | المجهر | خلية impermeant; لا يميز بين طرق موت الخلايا؛ مُجهدة وغير مناسبة للفحص عالي الإنتاجية؛ أكثر صعوبة في الاستخدام مع الخلايا المنضمة. عرضة للحكم الذاتي للمستخدم، ولكن يعتبر معيار الخلية طريقة قياس قابلية البقاء13 |
| أكريدين البرتقالي (AO) | المبرمج المبرمج/ النخر/ | مجهر الفلوريسنس | صبغة حمض نووي مع خصائص طيفية فريدة من نوعها، يمكن أن تميز بين المبرمج والنخر / نخر14 |
| نكروباتوس | |||
| Hoechst 33342, DAPI | مرض اpoptosis | مجهر الفلوريسنس أو مقياس تدفق | خلية نفاذية؛ غير لائق من تلقاء نفسها لرصد موت الخلايا ؛ مفيدة لالتلوث المشترك. يمكن استخدامها لتقييم التكثيف الكروماتين وتفتيت النوى في المبرمج المبكر. يمكن أن يقترن مع يوديد بروبدييوم للتمييز المبرمج من نخر15،16 |
| بروبيديوم يوديد (PI) | موتوبوبتوس في وقت متأخر / نخر | مجهر الفلوريسنس أو مقياس تدفق | الخلية impermeant مُتشابك؛ يكتشف كل من موت الخلايا المبرمج في وقت متأخر وأوضاع نخر موت الخلية17. سام ونفاذ بعد فترة طويلة حضانة مرات18 |
الجدول 1- الانبعاثات 1000 قائمة من مقايسات السمية الخلوية. مسايسات السمية الخلوية، التي تم استخدام بعضها في هذه الدراسة، مدرجة مع وصف موجز لخصائصها الرئيسية.
وقد أظهرت الدراسات الحديثة أن يتم تغيير التمثيل الغذائي الميتوكوندريا في بعض أنواع السرطان19,20,21,22,23,24,25. على سبيل المثال، وقد أظهرت سرطان الدم النخاعي الحاد (AML) ل upregulate كتلة الميتوكوندريا، محتوى mtDNA، والتنفس الميتوكوندريا لتلبية متطلبات الطاقة الخاصة بهم19،26،27. من ناحية أخرى ، تتميز بعض الأورام الصلبة بالخلل الميتوكوندريا ، أو بالأحرى "إعادة برمجة التمثيل الغذائي" ، مثل داونراسم البروتينات الميتوكوندريا المشاركة في OXPHOS أو انخفاض محتوى mtDNA ، التي ارتبطت مع غزوة الورم ، وإمكانات النقيلي ومقاومة للأدوية المسببة للتخثر28،29. وعلاوة على ذلك, في الآونة الأخيرة, كان هناك اهتمام متزايد في استخدام المركبات المتنوعة ميكانيكيا التي تؤثر على وظيفة الميتوكوندريا (تسمى عموما mitocans30),العلاجات المحتملة لأنواع معينة من السرطان. هذه الأدوية تستهدف تركيب ATP, الحمض النووي الميتوكوندريا, OXPHOS, و روس الإنتاج, فضلا عن البروتينات الموالية لبروتينات المبرمجة و المضادة لهيبوتوتيك المرتبطة الميتوكوندريا30,31. وقد أظهرت العديد من الدراسات أن هذا النهج له وعد كبير19،32،33،34. ومع ذلك، قد تؤثر هذه الانحرافات الأيضية في بيولوجيا الخلايا السرطانية أو العلاجات التي تستهدف الميتوكوندريا بشكل كبير على مقايسات الجدوى التقليدية التي تستند إلى وظائف الميتوكوندريا.
هنا، يتم وصف بروتوكول الأمثل لخلاف تفاضلي تلطخ النووية. البروتوكول يسمح بسرعة ودقة تحديد السمية الخلوية للميتوكان أو تركيباتها مع المركبات الأخرى. Hoechst 33342 هو صبغة نووية الخلية permeant التي تعبر بسهولة أغشية الخلايا لطخة الحمض النووي، مما يسمح للعد الخلايا الإجمالية التي يتعين الحصول عليها. عن طريق التلطيخ المشترك مع PI، الذي يدخل فقط نواة الخلايا الميتة، يمكن تحديد نسبة المعيشة (Hoechst فقط) والقتلى (ملطخة مع كل من) الخلايا بدقة. هذا البروتوكول ينقّح المقايسةالمنشورة 35 عن طريق إضافة خطوة لتحسين تركيز الصبغة (عن طريق الرجوع إلى النتائج باستخدام طريقة الترباني الأزرق المتعمّدة) والطرد المركزي لللوحة قبل التصوير. وبما أن العديد من خطوط الخلية شبه المنضمة أو المعلقة، فإن الطرد المركزي يزيد من نسبة الخلايا التي يتم تصويرها ويحسن الدقة بقوة. الفحص له العديد من المزايا، بما في ذلك أن تلطيخ لا يتطلب إزالة وسائل الإعلام أو الغسيل. خليط الصبغة هو أيضا غير مكلفة وسهلة التحضير، ومتوافقة مع أنظمة الأنابيب متعددة القنوات / الروبوتية.
بعد أن تكون الخلايا ملطخة ، يتم تصويرها بمجهر آلي. هذا له ميزة إضافية لخلق سجل دائم من الصور التي يمكن إعادة تحليلها في وقت لاحق ويمكن إعادة تقييم آثار مركبات معينة عن طريق التفتيش البصري للصور التي تم التقاطها. بمجرد الحصول على الصور، يمكن عد الخلايا إما يدويا أو باستخدام أي من عدة حزم برامجية، بما في ذلك كل من الحرة (على سبيل المثال، ImageJ، CellProfiler، الخ) والبرمجيات التجارية (مثل، التحول، Gen5، الخ). العد الآلي للخلايا هو الأفضل عموما منذ وضعت بشكل صحيح خطوط أنابيب العد الآلي للخلايا هي أكثر دقة وأقل تحيزا من التهم اليدوية. كما أنها تتجاهل بشكل أكثر فعالية حطام الخلية أو المجمعات غير القابلة للذوبان. تطوير هذه الأنابيب هو واضح عموما وتبسيطها من خلال كفاءة البقع المستخدمة. الإخراج هو كمية منذ العدد الفعلي للخلايا الميتة تحسب تلقائيا فيما يتعلق العدد الإجمالي الخلية، ويمكن تطبيق عتبات مختلفة لزيادة أو تقليل صرامة الكشف35. للراحة، يتم تضمين معلمات محسنة لعد الخلايا باستخدام Gen5 v. 3.00 برنامج متوافق Cytation 5 الخلية التصوير متعدد وضع قارئ.
Protocol
1. فحص السمية الخلوية: الإعداد
- إعداد حلول من المركبات ذات الأهمية عند التركيزات المطلوبة في وسائل الإعلام المناسبة (خالية من المصل أو 1، 2.5، أو 5٪ FBS RPMI-1640).
- لقياس السمية الخلوية لمركب واحد (على سبيل المثال، لتحديد جرعات فعالة)، وإعداد المركبات في التركيز النهائي 2x.
- لقياس السمية الخلوية من مجموعات مركبة، وإعداد المركبات في التركيز النهائي 4x.
- إعداد عناصر تحكم المذيب فقط عن طريق خلط نفس الكمية من المذيبات مع الوسيلة المناسبة. على سبيل المثال، إذا كانت المركبات الاختبارية المذابة في DMSO والميثانول، جعل السيطرة المذيبات فقط لكل مذيب.
- جمع الخلايا من طبق الثقافة أو قارورة في أنبوب مخروطي 15 مل.
- نقل 10 ميكرولتر من تعليق الخلية إلى أنبوب microcentrifuge وصمة عار مع 10 ميكرول 0.4٪ trypan الأزرق. استخدم مقياس الهيموسيتلت لحساب الخلايا القابلة للحياة وغير القابلة للحياة لكل مصدر خلية.
- خلايا بيليه في 200 غرام لمدة 5 دقائق. اتعرق أو مسخ ة.
- Resuspend خلية بيليه في وسائل الإعلام المقايسة المناسبة (المصل خالية أو 1، 2.5، 5٪ FBS RPMI-1640) في كثافة خلية من 3 * 105 خلايا / مل.
ملاحظة 1: كثافة الخلايا 3*105 خلايا/مل توفر كثافة البذر من 15000 خلية/بئر. كثافة البذر هو معلمة هامة وينبغي أن تكون محددة مسبقاً قبل التجربة. وينبغي أن تأخذ كثافة البذر في الاعتبار 1) حجم الخلية – عادة ما تزرع الخلايا الأكبر في كثافة أقل; 2) مدة العلاج – الخلايا عادة ما تزرع في كثافة أقل للتجارب التي سوف تستمر لفترة أطول; و 3) معدل انقسام الخلايا – الخلايا ذات معدل أعلى من الانقسام هي المصنفة في كثافة أقل. أمثلة محددة من كثافة البذر الأمثل: K562 الخلايا, أكبر, 24 ساعة المدة – 10,000 الخلايا/جيدا; خلايا MOLM-13، متوسطة الحجم، 24 ح العلاج – 15,000/well; خلايا MOLM-13, 48 h العلاج – 8,000/well; خلايا الدم أحادية النوى الطرفية السليمة (PBMCs)، 24 h العلاج – 50,000/well; خلايا AML الأولية، 24 ح العلاج – 15،000-20،000/well.
ملاحظة 2: قد يؤثر وجود FBS في الوسائط على نشاط المركبات. تقليل تركيز FBS قد يجعل نتائج الفحص أبسط لتفسير، ولكنه يقلل أيضا من الدقة الفسيولوجية. - البذور 50 ميكرولتر من تعليق الخلية من الخطوة 1.5 في كل بئر من لوحة 96-جيدا باستخدام ماصة متعددة القنوات.
- إضافة مركبات على النحو التالي:
- بالنسبة للمُسَاَنَة المركبة الواحدة، أضف 50 ميكرولتر من محلول مركب 2x في كل بئر. بالنسبة لآبار التحكم بالمذيبات، أضف 50 ميكرولتر من وسائط الاختبار التي تحتوي على المذيبات بتركيز 2x.
- بالنسبة للمحسانات المركبة، أضف 25 ميكرولتر من كل مركب (4x الحلول) في كل بئر. بالنسبة لآبار التحكم في المركبات المفردة، أضف 25 ميكرولتر من محلول مركب 4x و25 ميكرولتر من متوسط الاختبار. بالنسبة لآبار التحكم بالمذيبات، أضف 50 ميكرولتر من متوسط الاختبار أو متوسط الاختبار الذي يحتوي على المذيبات.
ملاحظة 1: لا ينبغي أن يتجاوز التركيز النهائي لـ DMSO 0.5٪.
ملاحظة 2: يوصى بإضافة الوسائط التي تحتوي على المركبات مع لمس الماصات جدار كل بئر بسبب انخفاض حجمها.
- اضغط بلطف على اللوحة لضمان خلط محتويات الآبار.
- ألواح احتضان عند 37 درجة مئوية في جو من CO2 مرطب بنسبة 5٪ لفترة مناسبة، على سبيل المثال، 24 ساعة.
2. Cytotoxicity Assay: تلطيخ مع Hoechst 33342 وPropidium يوديد
- إعداد 10x تلطيخ الحل. هذا الحل يحتاج إلى أن تكون مستعدة جديدة قبل كل تجربة، لا يمكن تخزينها. وينبغي تحديد تركيزات الصبغة النهائية قبل التجربة.
- بالنسبة لخطوط خلايا سرطان الدم وخلايا سرطان الدم الأولية، يحتوي 1 مل من 10x من عازلة تلطيخ 10 ميكرولتر من 20 mM Hoechst 33342 و 50 ميكرولتر من 1 ملغ/مل بروبديسيوم يوديد في برنامج تلفزيوني معقمة (التركيزات النهائية: Hoechst 33342 20 ميكرومتر، PI 5 ميكروغرام/مل).
- بالنسبة لـ PBMCs الصحية، يحتوي 1 مل من 10x من عازلة تلطيخ 10μL من 20 mM Hoechst 33342 و 10 ميكرولتر من 1 ملغ/مل بروبديسيوم يوديد في برنامج تلفزيوني معقم (التركيزات النهائية: Hoechst 33342 μM, PI 1 ميكروغرام/مل).
ملاحظة: يجب تحديد التركيز النهائي من يوديد البروديوم قبل التجارب. يجب اختبار الخلايا باستخدام مجموعة من تركيزات PI (1، 2.5، 5 ميكروغرام/مل)، ومن ثم ينبغي مقارنة قابلية الهويشت/PI المحسوبة بالقدرة على البقاء تقاس بواسطة زرق trypan الأزرق. تم اختيار تركيزات PI المذكورة أعلاه بناءً على جدوى الخلية المستهدفة في آبار التحكم في الوسائط (أعلى من 90٪ تقريبًا لخطوط خلايا سرطان الدم ، فوق ~ 70٪ لـ PBMCs صحية).
تنبيه: هويشت 33342 وبوديديوم مادة اليوديد من المواد المسرطنة المحتملة. ارتداء معدات الحماية الشخصية المناسبة عند التعامل معها.
- بعد الحضانة، استخدم ماصة متعددة القنوات لإضافة 10 ميكرولتر من 10x عازلة تلطيخ لكل بئر.
ملاحظة: لمنع التلوث المتبادل، تأكد من أن نصائح ماصة لا تلمس وسائل الإعلام. - اضغط بلطف على اللوحة لخلط الفقاعات ومسحها. وصمة عار عند 37 درجة مئوية لمدة 15 دقيقة.
- الطرد المركزي لوحة في 200 غرام لمدة 4 دقائق لجلب كل من الخلايا إلى الجزء السفلي من لوحة. قم بمسح الجزء السفلي من اللوحة بعناية باستخدام كيمويب رطب لإزالة الألياف و/أو الحطام الذي سيتداخل مع التصوير.
ملاحظة 1: يضمن الطرد المركزي للصفيحة أعلى الفرص لالتقاط جميع الخلايا في الصورة. في كثير من الأحيان الخلايا الميتة سوف تنفصل وتطفو، وتوفير قيم مضللة للسموم الخلوية. ويخفف الطرد المركزي من هذا التأثير.
ملاحظة 2: يجب أن يتم تصوير اللوحة بأسرع وقت ممكن بعد الطرد المركزي، من الناحية المثالية، في غضون 15 دقيقة. يمكن للطرد المركزي تقليل انتقائية تلطيخ PI وقد يسمح للخلايا بتراكم يوديد البروديسيوم ببطء. التحسن في الدقة المكتسبة من خلال تصور الخلايا الميتة تفوق الزيادة الطفيفة في تلطيخ PI. فمن المستحسن لإنهاء التصوير في غضون 1 ساعة من الطرد المركزي.
3. فحص السمية الخلوية: الحصول على البيانات
- تعيين البرنامج للمجهر الآلي / لوحة التصوير للكشف عن الفلوريسنس لكل من Hoechst 33342 (الإثارة الحد الأقصى 350 نانومتر، والانبعاثات القصوى 461 نانومتر) وPI (الإثارة الحد الأقصى 493 نانومتر، والانبعاثات القصوى 636 نانومتر). الحصول على صور لكل بئر في كلتا القناتين.
- باستخدام البرنامج (مثل CellProfiler ، استوديو تحليل الصور الحرة على أساس MatLab http://cellprofiler.org/ ، ImageJ ، أو البرمجيات الملكية مثل Gen5) عد الخلايا في كل بئر في كل قناة.
ملاحظة: منذ كل خلية يجب أن تكون ملطخة Hoechst 33342، وينبغي أن تكون ملطخة الخلايا الميتة مع PI، ونسبة القتلى إلى جميع يمثل جزء من الخلايا التي هي ميتة. على سبيل المثال، إذا كان العد الآلي في عينة غير المعالجة يظهر 467 خلايا ملطخة ببي (الخلايا الميتة) و 2335 الخلايا الملطخة Hoechst 33342 (الخلايا الكلية)، فإن الكسر الميت هو 0.2 أو 20٪. ثم تتم مقارنة هذه القيمة مع عينة مناوله متطابقة حيث تم استخدام العلاج. - وصف مفصل من هويشست / PI الحصول على البيانات باستخدام Cytation5 الخلية التصوير متعدد وضع قارئ و Gen5 v. 3.00 البرمجيات:
- تعيين Cytation5 متعدد المستويات لوحة قارئ / صورة لخلايا الصورة في أسفل مسطحة ، 96 جيدا ، لوحات بلاستيكية سوداء عامة.
- قم بتعيين بروتوكول تصوير للاستفادة من مجموعات مرشح DAPI وتكساس Red القياسية. التقاط الصور في مركز البئر باستخدام هدف التكبير 4x. لا تستخدم أي إزاحة (س / ص أو Z). استخدام إعدادات التصوير التالية: DAPI - LED - 10، وقت التكامل - 99، كسب - 0؛ تكساس الأحمر - الصمام - 8، وقت التكامل - 950، كسب - 18. تنفيذ ضبط تلقائي باستخدام إشارة DAPI؛ يجب أن يكون هناك أي تعويض في التركيز بين القنوات.
- إجراء تحليل الصورة باستخدام برنامج Gen5 v 3.00. في إعدادات البرنامج، تعرّف الخلايا على أنها أشكال تتراوح بين 5 و25 ميكرومتر في حجمها. استبعاد كائنات الحافة الأساسية وتقسيم لمس الكائنات عن طريق تشغيل خيار خاص "سبليت لمس الكائنات". بعد ذلك، معالجة الصورة لإزالة الخلفية (الطرح الخلفية الداكنة) وتطبيق قناع نووي (قيمة عتبة DAPI >= 6000 الاتحاد الافريقي)، وعدد الكائنات. إجراء تحليل للسكان الفرعيين استناداً إلى تلطيخ PI (قيمة العتبة تكساس الأحمر >= 5000 AU)، وعدد الكائنات. نسبة بقاء الخلية معرفة (1 -
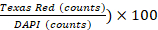 .
.
النتائج
وقد تم تطوير البروتوكول المذكور أعلاه باستخدام خلايا OCI-AML2، والتي تم اتخاذها كممثل خط خلايا سرطان الدم النخاعي الحاد. يتميز AML بالانتشار غير الطبيعي للخلايا غير المتمايزة وغير الوظيفية في نخاع العظام26. على الرغم من التطورات الأخيرة في مكافحة غسل الأموال العلاج المستهدف، وقد ?...
Discussion
على الرغم من أن بروتوكول هويشست / PI اختبار السمية الخلوية قوية وتتطلب القليل نسبيا التدريب العملي على الوقت، وهناك العديد من التفاصيل التجريبية التي هي مهمة جدا لضمان نتائج دقيقة. أولاً، من الضروري التأكد من أن تركيز نظام إدارة الانبعاثات ما زال أقل من 0.5 في المائة (v/v). ومن المتفق عليه عموم?...
Disclosures
ليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
NVK، وهو باحث في CPRIT في أبحاث السرطان، يشكر معهد الوقاية من السرطان والبحوث في ولاية تكساس (CPRIT) لدعمهم السخي، منحة CPRIT RR150044. وقد تم دعم هذا العمل أيضا من قبل مؤسسة ويلش منحة البحوث C-1930، والمعاهد الوطنية للصحة R35 GM129294 منحت لNK. ولم يكن للممولين أي دور في تصميم الدراسة، وجمع البيانات وتحليلها، أو قرار نشرها، أو إعدادها.
Materials
| Name | Company | Catalog Number | Comments |
| 2-Deoxy-D-glucose/2-DG | Chem-Impex | 50-519-067 | |
| 3-bromo-pyruvate | Alfa Aesar | 1113-59-3 | |
| 96-Well plates | Greiner Bio-One | 655090 | Black or clear flat-bottomed 96-well plates |
| Alamar blue HS cell viability reagent (100mL) | Thermo Fisher | A50101 | |
| Countess II automated cell counter | Thermo Fisher | ||
| Cytation 5 Cell Imaging Multi-Mode Reader | BioTek | ||
| Hoechst 33342 | Thermo Fisher | 62249 | 20 mM solution; final concentration 1:1,000 |
| HyClone fetal bovine serum | GE Healthcare | #25-514 | |
| m-chlorophenylhydrazone/CCCP | Sigma Aldrich | C2759 | |
| PBS tablets | Thermo Fisher | BP2944100 | 1 tablet + 200 mL of sterile water = 1x PBS solution |
| Penicillin-Streptomycin-Glutamine (100X) | Gibco | 10378016 | |
| Pierce LDH assay kit | Thermo Fisher | 50-103-5952 | |
| Propidium Iodide | Thermo Fisher | 50-596-072 | Dry powder; stock 1 mg/mL in PBS; final concentration 5 µg/mL (leukemia cells), 1 µg/mL (normal PBMCs) |
| Rotenone | Ark Pharm | AK115691 | |
| RPMI-1640 Medium With L-glutamine and sodium bicarbonate, liquid, sterile-filtered, suitable for cell culture | Sigma Aldrich | R8758-500ML | |
| Thiazolyl blue tetrazolium bromide | ACROS Organics | AC158990010 | |
| Trypan blue stain (0.4%) | Gibco | 15250-061 | |
| Cell lines | |||
| K562 | ATCC | CCL-243 | CML cell line |
| MOLM-13 | ATCC | AML cell line | |
| MOLT-4 | ATCC | CRL-1582 | ALL cell line |
| OCI-AML2 | ATCC | AML cell line |
References
- Ramirez, C. N., Antczak, C., Djaballah, H. Cell viability assessment: toward content-rich platforms. Expert Opinion on Drug Discovery. 5 (3), 223-233 (2010).
- Melzer, S., et al. Trypan blue as an affordable marker for automated live-dead cell analysis in image cytometry. Scanning. 38 (6), 857-863 (2016).
- Sikora, E., Mosieniak, G., Sliwinska, M. A. Morphological and Functional Characteristic of Senescent Cancer Cells. Current Cancer Drug Targets. 17 (4), 377-387 (2016).
- Coppé, J. P., Desprez, P. Y., Krtolica, A., Campisi, J. The senescence-associated secretory phenotype: the dark side of tumor suppression. Annual Review of Pathology. 5, 99-118 (2010).
- Castro-Vega, L. J., et al. The senescent microenvironment promotes the emergence of heterogeneous cancer stem-like cells. Carcinogenesis. 36 (10), 1180-1192 (2015).
- Weihua, Z., Lin, Q., Ramoth, A. J., Fan, D., Fidler, I. J. Formation of solid tumors by a single multinucleated cancer cell. Cancer. 117 (17), 4092-4099 (2011).
- Osisami, M., Keller, E. T. Mechanisms of Metastatic Tumor Dormancy. Clinical Medicine. 2 (3), 136-150 (2013).
- Zhang, S., et al. Generation of cancer stem-like cells through the formation of polyploid giant cancer cells. Oncogene. 33 (1), 116-128 (2014).
- Mittal, K., et al. Multinucleated polyploidy drives resistance to Docetaxel chemotherapy in prostate cancer. British Journal of Cancer. 116 (9), 1186-1194 (2017).
- McKeague, A. L., Wilson, D. J., Nelson, J. Staurosporine-induced apoptosis and hydrogen peroxide-induced necrosis in two human breast cell lines. British Journal of Cancer. 88 (1), 125-131 (2003).
- Kaja, S., et al. An optimized lactate dehydrogenase release assay for screening of drug candidates in neuroscience. Journal of Pharmacological and Toxicological Methods. 73, 1-6 (2015).
- Chan, F. K., Moriwaki, K., De Rosa, M. J. Detection of necrosis by release of lactate dehydrogenase activity. Methods in Molecular Biology. 979, 65-70 (2013).
- Piccinini, F., Tesei, A., Arienti, C., Bevilacqua, A. Cell Counting and Viability Assessment of 2D and 3D Cell Cultures: Expected Reliability of the Trypan Blue Assay. Biological Procedures Online. 19, 8 (2017).
- Plemel, J. R., et al. Unique spectral signatures of the nucleic acid dye acridine orange can distinguish cell death by apoptosis and necroptosis. Journal of Cell Biology. 216 (4), 1163-1181 (2017).
- Galluzzi, L., et al. Guidelines for the use and interpretation of assays for monitoring cell death in higher eukaryotes. Cell Death & Differentiation. 16 (8), 1093-1107 (2009).
- Cummings, B. S., Schnellmann, R. G. Measurement of cell death in mammalian cells. Current Protocols in Pharmacology. , (2004).
- Brauchle, E., Thude, S., Brucker, S. Y., Schenke-Layland, K. Cell death stages in single apoptotic and necrotic cells monitored by Raman microspectroscopy. Scientific Reports. 4, 4698 (2014).
- Chiaraviglio, L., Kirby, J. E. Evaluation of impermeant, DNA-binding dye fluorescence as a real-time readout of eukaryotic cell toxicity in a high throughput screening format. Assay and Drug Development Technologies. 12 (4), 219-228 (2014).
- Panina, S. B., Baran, N., Brasil da Costa, F. H., Konopleva, M., Kirienko, N. V. A mechanism for increased sensitivity of acute myeloid leukemia to mitotoxic drugs. Cell Death & Disease. 10 (8), 617 (2019).
- Caro, P., et al. Metabolic signatures uncover distinct targets in molecular subsets of diffuse large B cell lymphoma. Cancer Cell. 22 (4), 547-560 (2012).
- Lagadinou, E. D., et al. BCL-2 inhibition targets oxidative phosphorylation and selectively eradicates quiescent human leukemia stem cells. Cell Stem Cell. 12 (3), 329-341 (2013).
- Senft, D., Ronai, Z. A. Regulators of mitochondrial dynamics in cancer. Current Opinion in Cell Biology. 39, 43-52 (2016).
- Vazquez, F., et al. PGC1α expression defines a subset of human melanoma tumors with increased mitochondrial capacity and resistance to oxidative stress. Cancer Cell. 23 (3), 287-301 (2013).
- Caino, M. C., Altieri, D. C. Cancer cells exploit adaptive mitochondrial dynamics to increase tumor cell invasion. Cell Cycle. 14 (20), 3242-3247 (2015).
- Ralph, S. J., Rodríguez-Enríquez, S., Neuzil, J., Saavedra, E., Moreno-Sánchez, R. The causes of cancer revisited: "mitochondrial malignancy" and ROS-induced oncogenic transformation - why mitochondria are targets for cancer therapy. Molecular Aspects of Medicine. 31 (2), 145-170 (2010).
- Kreitz, J., et al. Metabolic Plasticity of Acute Myeloid Leukemia. Cells. 8 (8), (2019).
- Sriskanthadevan, S., et al. AML cells have low spare reserve capacity in their respiratory chain that renders them susceptible to oxidative metabolic stress. Blood. 125 (13), 2120-2130 (2015).
- Guerra, F., et al. Mitochondrial Dysfunction: A Novel Potential Driver of Epithelial-to-Mesenchymal Transition in Cancer. Frontiers in Oncology. 7, 295 (2017).
- Guerra, F., Arbini, A. A., Moro, L. Mitochondria and cancer chemoresistance. Biochimica et Biophysica Acta. 1858 (8), 686-699 (2017).
- Neuzil, J., Dong, L. F., Rohlena, J., Truksa, J., Ralph, S. J. Classification of mitocans, anti-cancer drugs acting on mitochondria. Mitochondrion. 13 (3), 199-208 (2013).
- Ubah, O. C., Wallace, H. M. Cancer therapy: Targeting mitochondria and other sub-cellular organelles. Current Pharmaceutical Design. 20 (2), 201-222 (2014).
- Yamaguchi, R., et al. Efficient elimination of cancer cells by deoxyglucose-ABT-263/737 combination therapy. PLoS One. 6 (9), 24102 (2011).
- Hahn, T., et al. Use of anti-cancer drugs, mitocans, to enhance the immune responses against tumors. Current Pharmaceutical Biotechnology. 14 (3), 357-376 (2013).
- Panina, S. B., Pei, J., Baran, N., Konopleva, M., Kirienko, N. V. Utilizing Synergistic Potential of Mitochondria-Targeting Drugs for Leukemia Therapy. Frontiers in Oncology. 10, 435 (2020).
- Lema, C., Varela-Ramirez, A., Aguilera, R. J. Differential nuclear staining assay for high-throughput screening to identify cytotoxic compounds. Current Cellular Biochemistry. 1 (1), 1-14 (2011).
- Döhner, H., et al. Diagnosis and management of acute myeloid leukemia in adults: recommendations from an international expert panel, on behalf of the European LeukemiaNet. Blood. 115 (3), 453-474 (2010).
- Heinz, S., et al. Mechanistic Investigations of the Mitochondrial Complex I Inhibitor Rotenone in the Context of Pharmacological and Safety Evaluation. Scientific Reports. 7, 45465 (2017).
- Fan, T., et al. Tumor Energy Metabolism and Potential of 3-Bromopyruvate as an Inhibitor of Aerobic Glycolysis: Implications in Tumor Treatment. Cancers (Basel). 11 (3), (2019).
- Pal, R., Mamidi, M. K., Das, A. K., Bhonde, R. Diverse effects of dimethyl sulfoxide (DMSO) on the differentiation potential of human embryonic stem cells. Archives of Toxicology. 86 (4), 651-661 (2012).
- Tunçer, S., et al. Low dose dimethyl sulfoxide driven gross molecular changes have the potential to interfere with various cellular processes. Scientific Reports. 8 (1), 14828 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved