Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Автоматизированное дифференциальное ядерное окрашивание анализ для точного определения цитотоксичности митокана
* Эти авторы внесли равный вклад
В этой статье
Резюме
Протокол описывает быструю, высокую пропускную способность, надежную, недорогую и непредвзятую оценку для эффективного определения жизнеспособности клеток. Этот анализ особенно полезен, когда митохондрии клеток были повреждены, что мешает другим анализам. Анализ использует автоматизированный подсчет клеток, окрашенных двумя ядерными красителями - Hoechst 33342 и йодидом пропидия.
Аннотация
Вклад митохондрий в онкогенную трансформацию является предметом широкого интереса и активного изучения. По мере того как поле метаболизма рака будет более сложным, цель пристрелить митохондрии используя различные соединения которые inflict митохондриальное повреждение (so-called митоканы) будет довольно популярным. К сожалению, многие существующие анализы цитотоксии, такие как тетразолиумные соли или резазурин, требуют функциональных митохондриальных ферментов для их работы. Ущерб, нанесенный соединениями, нацеленными на митохондрии, часто ставит под угрозу точность этих анализов. Здесь мы описываем измененный протокол, основанный на дифференциальном окрашивание двумя флуоресцентными красителями, один из которых является клеточным проницателем (Hoechst 33342), а другой не является (propidium iodide). Разница в окрашивание позволяет живых и мертвых клеток, которые будут дискриминированы. Анализ подменяется для автоматизированной микроскопии и анализа изображений, что увеличивает пропускную способность и уменьшает предвзятость. Это также позволяет использовать анализ в высокой пропускной способности моды с использованием 96-хорошо пластин, что делает его жизнеспособным вариантом для усилий по обнаружению наркотиков, особенно когда наркотики в вопросе имеют некоторый уровень митотоксичности. Важно отметить, что результаты, полученные Hoechst / PI окрашивания анализ показывают повышенную последовательность, как с trypan синий результаты исключения и между биологическими репликациями, когда анализ по сравнению с другими методами.
Введение
Первым шагом к выявлению эффективных методов лечения рака является выбор надежного, беспристрастного анализа цитотоксичности, который может быть использован для изучения эффекта лечения. Распространенным выбором для экспериментов с низкой пропускной способностью является исключение трипанового синего красителя из живых клеток. Этот метод является благоприятствования, поскольку он позволяет относительно беспристрастный метод количественной оценки выживания клеток. trypan синий пассивно рассеивается в клетки, мембраны которых скомпрометированы, но это эффективно блокируется от входа здоровых клеток1. Коэффициент живых клеток и общей клетки представляет собой процент жизнеспособности, что указывает на эффективность лечения. Наиболее существенным недостатком trypan синий анализ является то, что он плохо подходит для высокой пропускной способности методологии. Он имеет относительно низкий коэффициент сигнала к шуму и длительное окрашивание может привести к артефактам из-за окрашивания жизнеспособных клеток. Следовательно, trypan синий исключение, как правило, но невсегда 2, низведена до ручного подсчета. Это делает его слишком медленным и вводит сильную возможность смещения из-за субъективного суждения исследователя (если не используются ослепляющие или независимые подсчеты, которые еще больше уменьшают пропускную способность лаборатории). В целом, пропускная способность этого анализа недостаточна для современных открытий наркотиков.
Анализ жизнеспособности, которые, как правило, имеют гораздо более высокую пропускную способность, позволяют исследователям обойти это ограничение, но приходят со значительными оговорками (см. таблицу 1). Эти методы обычно подпадают под две группы. Одна группа состоит из колоритных анализов, которые основаны на функции клеточных ферментов редокса. Бесцветные или нефлуоресцентные субстраты преобразуются в яркие продукты, которые можно количественно оценить с помощью спектрофотометра. Классическими примерами являются тетразолийные соли (МТТ, WST-1, XTT и т.д.) и резазурин. Эта категория также включает люминесцентные анализы, которые используют люциферин для оценки уровня АТФ. Анализы этого типа имеют основное ограничение, что они измеряют клеточный метаболизм, который не является клеточной жизнеспособности как таковой. Это довольно часто для клеток, чтобы стать тихие в неблагоприятных условиях, но все жесохранить способность разделить 3,4,5. Например, раковые стволовые клетки часто относительно метаболическитихие 6,7,8,9, и, вероятно, будет трудно продать с помощью этих методов. Эффективность лечения, которые повреждают митохондриальные функции, такие как большинство митоканов, также, вероятно, будет значительно завышена.
Альтернативная методология использует химические свойства различных веществ, которые позволяют им либо пересекать или не пересекать биологические мембраны. Одним из примеров являются ядерные пятна, такие как SYTOX или йодид пропидия (PI). Эта категория также включает в себя анализы, которые похожи по концепции, но отличаются по функциям, таким как лактат дегидрогеназа (LDH) анализ, который измеряет высвобождение LDH во внеклеточной среде в качестве индикатора клеточного некроза(рисунок 1, Таблица 1). Эти анализы более способны различать метаболически неактивные и мертвые клетки.
| Анализ/краситель | Тип (ы) обнаруженной клеточной смерти | Необходимое оборудование | Основные функции |
| МТТ, ККК-8, Аламар Блю (резазурин) | Апоптоз/Некроз | Спектрофотометр | Недорогой, быстрый; анализ конечных точек; зависит от активности ферментов (исключительно митохондриальных в случае МТТ) и не проводит различий между способамиклеточной смерти 1,10 |
| Выпуск LDH | Некроз | Спектрофотометр | Быстрая, независимая от активности митохондриальных ферментов; дорогие для высокой пропускной способности тестов; обнаруживает некротические клетки с компромиссной плазменноймембраной 11,12 |
| Трипан Блю (TB) | Апоптоз/Некроз | Микроскоп | Сотовый непроницаемый; не проводит различий между способами клеточной смерти; трудоемкий и не подходит для высокой пропускной способности скрининга; более трудно использовать с адептом клеток; склонны к субъективному суждению пользователя, но считается стандартным методом измерения жизнеспособностиклеток 13 |
| Акридин оранжевый (АО) | Апоптоз/Некроз/ | Флуоресцентный микроскоп | Нуклеиновой кислотный краситель с уникальными спектральными свойствами, может различать апоптоз и некроз/некроптоз14 |
| Некроптоз | |||
| Хохст 33342, DAPI | Апоптоза | Флуоресцентный микроскоп или цитометр потока | Сотовый проницаем; неподходящий сам по себе для мониторинга смерти клеток; полезно для совместного окрашивания; может быть использован для оценки конденсата хроматина и фрагментации ядер при раннем апоптозе; можно спарить с йодидом пропидия для того чтобы различить апоптоз отнекроза 15.16 |
| Пропидий йодид (PI) | Поздний апоптоз/некроз | Флуоресцентный микроскоп или цитометр потока | Сотовый империальный интеркалатор; обнаруживает как поздний апоптоз, так и режимы некроза клеточной смерти17. Токсичные и проницаемые после длительного инкубациираз 18 |
Таблица 1. Список анализов цитотоксичности. Анализы цитотоксичности, некоторые из которых были использованы в данном исследовании, перечислены вместе с кратким описанием их ключевых особенностей.
Недавние исследования показали, что митохондриальный метаболизм изменяется внекоторых видах рака 19,20,21, 22,23,24,25. Например, было показано, что острые миелоидные лейкозы (АМЛ) upregulate их митохондриальной массы, содержание мтДНК, и митохондриальногодыхания для удовлетворения своих потребностей в энергии 19,26,27. С другой стороны, некоторые твердые опухоли характеризуются митохондриальной дисфункцией, или, скорее, "метаболическим перепрограммированием", такими как даунрегуляция митохондриальных белков, участвующих в OXPHOS или снижение содержания мтДНК, что было связано с инвазивностью опухоли, метастатическим потенциалом и устойчивостью к апоптоза вызывающихпрепараты 28,29. Кроме того, в последнее время возрос интерес к использованию механистически разнообразных соединений, влияющих на митохондриальную функцию (обычноназываемых митоканами 30),в качестве потенциальных методов лечения конкретных видов рака. Эти препараты нацелены на синтез АТФ, митохондриальной ДНК, OXPHOS и ROS производства, а также про-апоптотических и анти-апоптотических белков, связанных смитохондриями 30,31. Несколько исследований показали, что этот подход имеет значительныеперспективы 19,32,33,34. Тем не менее, эти метаболические отклонения в биологии раковых клеток или митохондрий ориентации лечения может значительно повлиять на обычные анализы жизнеспособности, которые основаны на митохондриальной функциональности.
Здесь описан оптимизированный протокол для дифференциального анализа ядерного окрашивания. Протокол позволяет быстро и точно определить цитотоксику митоканов или их комбинации с другими соединениями. Hoechst 33342 является клеточным ядерным красителем, который легко пересекает клеточные мембраны, чтобы окрашивать ДНК, что позволяет получить общее количество клеток. Путем совместного окрашивания с PI, который только входит в ядра мертвых клеток, доля живых (только Hoechst) и мертвых (окрашенных с обоими) клетки могут быть точно определены. Этот протокол уточняет опубликованный анализ35, добавляя шаг для оптимизации концентрации красителя (путем перекрестных ссылок результатов с ортогональным методом трипан синий) и центрифугации пластины до визуализации. Поскольку многие клеточные линии являются полуприемляемы или приостановлены, центрифуга увеличивает долю клеток, которые изображены и сильно повышает точность. Анализ имеет ряд преимуществ, в том числе, что окрашивание не требует удаления средств массовой информации или стирки. Смесь красителя также недорога, проста в подготовке и совместима с многоканальные/роботизированные трубоугляемые системы.
После того, как клетки были окрашены, они изображены с помощью автоматизированного микроскопа. Это имеет дополнительное преимущество создания постоянной записи изображений, которые могут быть повторно проанализированы позже и последствия конкретных соединений могут быть переоценены путем визуального осмотра захваченных изображений. После получения изображений ячейки могут быть подсчитаны вручную или с помощью любого из нескольких пакетов программного обеспечения, включая как бесплатные (например, ImageJ, CellProfiler и т.д.), так и коммерческое программное обеспечение (например, Metamorph, Gen5 и т.д.). Автоматизированный подсчет ячеев, как правило, предпочтительнее, так как правильно разработанные автоматизированные конвейеры подсчета ячеев являются более точными и менее предвзятыми, чем ручные подсчеты. Они также более эффективно игнорируют клеточный мусор или нерастворимые комплексы. Разработка этих трубопроводов, как правило, проста и упрощается эффективностью используемых пятен. Выход является количественным, так как фактическое количество мертвых ячеек автоматически рассчитывается в отношении общего числа клеток, и различные пороги могут быть применены для увеличения или уменьшения строки обнаружения35. Для удобства включены оптимизированные параметры для подсчета ячеек с использованием программного обеспечения Gen5 v. 3.00, совместимого с Cytation 5 Cell Imaging Multi-Mode Reader.
протокол
1. Анализ цитотоксичности: Настройка
- Подготовка растворов соединений, представляющих интерес при желаемых концентрациях в соответствующих средствах массовой информации (без сыворотки или 1, 2,5, или 5% FBS RPMI-1640).
- Для измерения цитотоксии одного соединения (например, для определения эффективных доз) подготовьте соединения при 2-й конечной концентрации.
- Для измерения цитотоксии комбинаций соединений подготовьте соединения в 4-й степени конечной концентрации.
- Подготовьте элементы управления только растворителем, смешивая одинаковое количество растворителя с соответствующей средой. Например, если испытательные соединения растворяются в ДМСО и метаноле, сделайте растворителя только для каждого растворителя.
- Соберите клетки из культуры блюдо или колбу в 15 мл конической трубки.
- Передача 10 МКЛ клеточной суспензии в микроцентрифуг трубки и пятно с 10 йл 0,4% трипан синий. Используйте гемоцитометр для подсчета жизнеспособных и не жизнеспособных ячеек для каждого источника ячейки.
- Пеллетные клетки по 200 г в течение 5 мин. Аспират или декант супернатант.
- Resuspend ячейки гранулы в анализ соответствующих средств массовой информации (сыворотка свободных или 1, 2,5, 5% FBS RPMI-1640) при плотности клеток 3'105 клеток / мл.
ПРИМЕЧАНИЕ 1: Плотность клеток от 3 до10 5 клеток/мл обеспечивает плотность посева 15 000 клеток/хорошо. Плотность посева является важным параметром и в идеале должна быть заранее определена до начала эксперимента. Плотность посева должна принимать во внимание 1) размер клеток - как правило, большие клетки посеяны при более низкой плотности; 2) продолжительность лечения - клетки, как правило, посеяны при более низкой плотности для экспериментов, которые будут длиться дольше; и 3) скорость деления клеток - клетки с более высокой скоростью деления посеяны при более низкой плотности. Конкретные примеры оптимизированной плотности посева: клетки K562, больше, продолжительность 24 ч - 10 000 клеток/хорошо; КЛЕТКИ MOLM-13, умеренного размера, 24 ч лечения - 15 000/хорошо; MOLM-13 клетки, 48 ч лечение - 8000/хорошо; небольшие здоровые периферические моноядерные клетки крови (ПБМТ), 24 ч лечения - 50 000/хорошо; первичные клетки AML, 24 ч лечения - 15000-20000/хорошо.
ПРИМЕЧАНИЕ 2: Присутствие FBS в средствах массовой информации может повлиять на активность соединений. Снижение концентрации FBS может сделать результаты анализа проще интерпретировать, но это также снижает физиологическую точность. - Семя 50 МКЛ клеточной подвески от шага 1,5 в каждый колодец 96-хорошо пластины с использованием многоканальной пипетки.
- Добавить соединения следующим образом:
- Для одного соединения анализы, добавить 50 йл 2x раствор соединения в каждой хорошо. Для растворителей-контрольных скважин добавьте 50 МКЛ испытательных средств, содержащих растворитель при концентрации 2x.
- Для комбинированных анализов добавьте в каждую колодец по 25 мкл каждого соединения (4x раствора). Для одной из скважин, иллюстрируемых соединениями, добавьте 25 МКЛ раствора соединения 4x и 25 МКЛ испытательной среды. Для скважин, иллюстрируемых растворителями, добавьте 50 МКЛ испытательной среды или испытательной среды, содержащей растворитель.
ПРИМЕЧАНИЕ 1: Окончательная концентрация ДМСО не должна превышать 0,5%.
ПРИМЕЧАНИЕ 2: Рекомендуется добавить средства массовой информации, содержащие соединения с пипеткой касаясь стены каждой хорошо из-за низкого объема.
- Аккуратно коснитесь пластины, чтобы обеспечить смешивание содержимого колодцев.
- Инкубационные пластины при 37 градусах Цельсия в увлажненной атмосфере 5% CO2 в течение соответствующего времени, например, 24 ч.
2. Цитотоксичность Анализ: окрашивание с Hoechst 33342 и propidium йодид
- Подготовка 10x окрашивания раствора. Это решение должно быть подготовлено свежим перед каждым экспериментом, оно не может храниться. Окончательные концентрации красителя должны быть определены до начала эксперимента.
- Для линий клеток лейкемии и первичных клеток лейкемии, 1 мл 10x окрашивания буфера содержит 10 МКл из 20 мММ Hoechst 33342 и 50 йл 1 мг / мл пропидия йодида в стерильных PBS (окончательные концентрации: Hoechst 33342 20 МКМ, PI 5 мкг / мл).
- Для здоровых ПБМТ 1 мл 10-х буфера окрашивания содержит 10 л 20 мМх Hoechst 33342 и 10 л 1 мг/мл пропидия йодида в стерильных PBS (окончательные концентрации: Hoechst 33342 20 МКМ, PI 1 мкг/мл).
ПРИМЕЧАНИЕ: Окончательная концентрация йодида пропидия должна быть определена до экспериментов. Клетки должны быть протестированы с использованием диапазона концентраций PI (1, 2,5, 5 мкг/мл), а затем Hoechst / PI-рассчитанной жизнеспособности следует сравнить с жизнеспособностью измеряется с помощью трипан синий. Концентрации PI, перечисленные выше, были выбраны на основе жизнеспособности целевых клеток в скважинах для контроля мультимедиа (выше 90% для линий клеток лейкемии, выше 70% для здоровых ПБМТ).
ВНИМАНИЕ: Hoechst 33342 и йодид пропидия являются потенциальными канцерогенами. Носите соответствующее средства индивидуальной защиты при обращении с ними.
- После инкубации используйте многоканальный пипетку, чтобы добавить 10 МКЛ 10-х буфера окрашивания к каждой хорошо.
ПРИМЕЧАНИЕ: Чтобы предотвратить перекрестное загрязнение, убедитесь, что советы пипетки не касаются средств массовой информации. - Аккуратно коснитесь пластины, чтобы смешать и очистить пузырьки. Пятно при 37 градусов по Цельсию в течение 15 мин.
- Центрифуга пластины на 200 г в течение 4 минут, чтобы довести все клетки до нижней части пластины. Тщательно протрите дно пластины влажной кимвипе, чтобы удалить волокна и / или мусора, который будет мешать изображению.
ПРИМЕЧАНИЕ 1: Центрифугация пластины обеспечивает самые высокие шансы для всех клеток, которые будут захвачены на изображении. Часто мертвые клетки отсоединяются и плавают, обеспечивая вводящие в заблуждение значения цитотоксичности. Центрифуга смягчает этот эффект.
ПРИМЕЧАНИЕ 2: Пластина должна быть изображена как можно быстрее после центрифугации, в идеале, в течение 15 минут. Центрифугация может уменьшить избирательность Окрашивания ИП и может позволить клеткам медленно накапливать йодид пропидия. Улучшение точности, полученная путем визуализации мертвых клеток, перевешивает небольшое увеличение Окрашивания ИП. Рекомендуется закончить визуализацию в течение 1 ч центрифугации.
3. Анализ цитотоксичности: получение данных
- Установите программное обеспечение для автоматизированного изображения микроскопа/пластины для обнаружения флуоресценции как для Hoechst 33342 (возбуждение максимум 350 нм, максимальная эмиссия 461 нм) так и для ИП (возбуждение максимум 493 нм, максимальная эмиссия 636 нм). Приобретайте изображения для каждой колодец в обоих каналах.
- Используя программное обеспечение (например, CellProfiler, бесплатную студию анализа изображений, основанную на MatLab http://cellprofiler.org/, ImageJ или несвободных программах, таких как Gen5), подсчитывайте ячейки в каждом хорошо в каждом канале.
ПРИМЕЧАНИЕ: Поскольку каждая клетка должна быть окрашена Hoechst 33342, и мертвые клетки должны быть окрашены PI, соотношение мертвых ко всем представляет собой долю клеток, которые мертвы. Например, если автоматизированный подсчет в необработанной выборке показывает 467 клеток, окрашенных PI (мертвые клетки) и 2335 клеток, окрашенных Hoechst 33342 (общие клетки), фракция мертвых составляет 0,2 или 20%. Это значение затем сравнивается с идентично обработанной выборкой, где использовалась обработка. - Подробное описание получения данных Hoechst/PI с помощью программного обеспечения Cytation5 Cell Imaging Multi-Mode Reader и Gen5 v. 3.00:
- Установите Cytation5 мультимодной пластины читателя / изображения клеток в плоском дне, 96-ну, общие черные пластиковые пластины.
- Установите протокол визуализации для использования стандартных наборов фильтров DAPI и Texas Red. Возьмите изображения в центре хорошо с помощью 4x увеличение цели. Не используйте смещения (X/Y или q). Используйте следующие настройки изображения: DAPI - LED - 10, время интеграции - 99, gain - 0; Texas Red - LED - 8, время интеграции - 950, выигрыш - 18. Выполните автофокусирование с помощью сигнала DAPI; не должно быть никакой компенсации в фокусировке между каналами.
- Выполните анализ изображений с помощью программного обеспечения Gen5 v 3.00. В настройках программного обеспечения определите ячейки как фигуры размером от 5 до 25 мкм. Исключите объекты первичного края и разделите трогательные объекты, включив специальную опцию "Разделить трогательные объекты". Затем обработать изображение, чтобы удалить фон (вычитание темного фона), применить ядерную маску (пороговое значение DAPI 6000 au) и подсчитать объекты. Выполните анализ субпопуляции на основе Окрашивания PI (пороговое значение Texas Red (5000 au) и подсчитайте объекты. Жизнеспособность клеток % определяется как (1 -
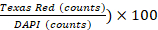 .
.
Результаты
Вышеупомянутый протокол был разработан с использованием клеток OCI-AML2, которые были приняты в качестве репрезентативной линии острой миелоидной лейкемии. AML характеризуется аномальным распространением недифференцированных и нефункциональных гематопоэтических клеток в костном мозге...
Обсуждение
Хотя протокол анализа цитотоксичности Hoechst/PI является надежным и требует сравнительно небольшого практического времени, существует несколько экспериментальных деталей, которые очень важны для обеспечения точных результатов. Во-первых, необходимо убедиться, что концентрация ДМСО ост...
Раскрытие информации
Авторов нечего раскрывать.
Благодарности
NVK, CPRIT ученый в области исследований рака, благодаря профилактике рака и научно-исследовательский институт Техаса (CPRIT) за их щедрую поддержку, ГРАНТ CPRIT RR150044. Эта работа была также поддержана Уэлч Фонд исследований Грант C-1930, и Национальные институты здравоохранения R35 GM129294 присуждена NVK. Спонсоры не играли никакой роли в разработке, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
| 2-Deoxy-D-glucose/2-DG | Chem-Impex | 50-519-067 | |
| 3-bromo-pyruvate | Alfa Aesar | 1113-59-3 | |
| 96-Well plates | Greiner Bio-One | 655090 | Black or clear flat-bottomed 96-well plates |
| Alamar blue HS cell viability reagent (100mL) | Thermo Fisher | A50101 | |
| Countess II automated cell counter | Thermo Fisher | ||
| Cytation 5 Cell Imaging Multi-Mode Reader | BioTek | ||
| Hoechst 33342 | Thermo Fisher | 62249 | 20 mM solution; final concentration 1:1,000 |
| HyClone fetal bovine serum | GE Healthcare | #25-514 | |
| m-chlorophenylhydrazone/CCCP | Sigma Aldrich | C2759 | |
| PBS tablets | Thermo Fisher | BP2944100 | 1 tablet + 200 mL of sterile water = 1x PBS solution |
| Penicillin-Streptomycin-Glutamine (100X) | Gibco | 10378016 | |
| Pierce LDH assay kit | Thermo Fisher | 50-103-5952 | |
| Propidium Iodide | Thermo Fisher | 50-596-072 | Dry powder; stock 1 mg/mL in PBS; final concentration 5 µg/mL (leukemia cells), 1 µg/mL (normal PBMCs) |
| Rotenone | Ark Pharm | AK115691 | |
| RPMI-1640 Medium With L-glutamine and sodium bicarbonate, liquid, sterile-filtered, suitable for cell culture | Sigma Aldrich | R8758-500ML | |
| Thiazolyl blue tetrazolium bromide | ACROS Organics | AC158990010 | |
| Trypan blue stain (0.4%) | Gibco | 15250-061 | |
| Cell lines | |||
| K562 | ATCC | CCL-243 | CML cell line |
| MOLM-13 | ATCC | AML cell line | |
| MOLT-4 | ATCC | CRL-1582 | ALL cell line |
| OCI-AML2 | ATCC | AML cell line |
Ссылки
- Ramirez, C. N., Antczak, C., Djaballah, H. Cell viability assessment: toward content-rich platforms. Expert Opinion on Drug Discovery. 5 (3), 223-233 (2010).
- Melzer, S., et al. Trypan blue as an affordable marker for automated live-dead cell analysis in image cytometry. Scanning. 38 (6), 857-863 (2016).
- Sikora, E., Mosieniak, G., Sliwinska, M. A. Morphological and Functional Characteristic of Senescent Cancer Cells. Current Cancer Drug Targets. 17 (4), 377-387 (2016).
- Coppé, J. P., Desprez, P. Y., Krtolica, A., Campisi, J. The senescence-associated secretory phenotype: the dark side of tumor suppression. Annual Review of Pathology. 5, 99-118 (2010).
- Castro-Vega, L. J., et al. The senescent microenvironment promotes the emergence of heterogeneous cancer stem-like cells. Carcinogenesis. 36 (10), 1180-1192 (2015).
- Weihua, Z., Lin, Q., Ramoth, A. J., Fan, D., Fidler, I. J. Formation of solid tumors by a single multinucleated cancer cell. Cancer. 117 (17), 4092-4099 (2011).
- Osisami, M., Keller, E. T. Mechanisms of Metastatic Tumor Dormancy. Clinical Medicine. 2 (3), 136-150 (2013).
- Zhang, S., et al. Generation of cancer stem-like cells through the formation of polyploid giant cancer cells. Oncogene. 33 (1), 116-128 (2014).
- Mittal, K., et al. Multinucleated polyploidy drives resistance to Docetaxel chemotherapy in prostate cancer. British Journal of Cancer. 116 (9), 1186-1194 (2017).
- McKeague, A. L., Wilson, D. J., Nelson, J. Staurosporine-induced apoptosis and hydrogen peroxide-induced necrosis in two human breast cell lines. British Journal of Cancer. 88 (1), 125-131 (2003).
- Kaja, S., et al. An optimized lactate dehydrogenase release assay for screening of drug candidates in neuroscience. Journal of Pharmacological and Toxicological Methods. 73, 1-6 (2015).
- Chan, F. K., Moriwaki, K., De Rosa, M. J. Detection of necrosis by release of lactate dehydrogenase activity. Methods in Molecular Biology. 979, 65-70 (2013).
- Piccinini, F., Tesei, A., Arienti, C., Bevilacqua, A. Cell Counting and Viability Assessment of 2D and 3D Cell Cultures: Expected Reliability of the Trypan Blue Assay. Biological Procedures Online. 19, 8 (2017).
- Plemel, J. R., et al. Unique spectral signatures of the nucleic acid dye acridine orange can distinguish cell death by apoptosis and necroptosis. Journal of Cell Biology. 216 (4), 1163-1181 (2017).
- Galluzzi, L., et al. Guidelines for the use and interpretation of assays for monitoring cell death in higher eukaryotes. Cell Death & Differentiation. 16 (8), 1093-1107 (2009).
- Cummings, B. S., Schnellmann, R. G. Measurement of cell death in mammalian cells. Current Protocols in Pharmacology. , (2004).
- Brauchle, E., Thude, S., Brucker, S. Y., Schenke-Layland, K. Cell death stages in single apoptotic and necrotic cells monitored by Raman microspectroscopy. Scientific Reports. 4, 4698 (2014).
- Chiaraviglio, L., Kirby, J. E. Evaluation of impermeant, DNA-binding dye fluorescence as a real-time readout of eukaryotic cell toxicity in a high throughput screening format. Assay and Drug Development Technologies. 12 (4), 219-228 (2014).
- Panina, S. B., Baran, N., Brasil da Costa, F. H., Konopleva, M., Kirienko, N. V. A mechanism for increased sensitivity of acute myeloid leukemia to mitotoxic drugs. Cell Death & Disease. 10 (8), 617 (2019).
- Caro, P., et al. Metabolic signatures uncover distinct targets in molecular subsets of diffuse large B cell lymphoma. Cancer Cell. 22 (4), 547-560 (2012).
- Lagadinou, E. D., et al. BCL-2 inhibition targets oxidative phosphorylation and selectively eradicates quiescent human leukemia stem cells. Cell Stem Cell. 12 (3), 329-341 (2013).
- Senft, D., Ronai, Z. A. Regulators of mitochondrial dynamics in cancer. Current Opinion in Cell Biology. 39, 43-52 (2016).
- Vazquez, F., et al. PGC1α expression defines a subset of human melanoma tumors with increased mitochondrial capacity and resistance to oxidative stress. Cancer Cell. 23 (3), 287-301 (2013).
- Caino, M. C., Altieri, D. C. Cancer cells exploit adaptive mitochondrial dynamics to increase tumor cell invasion. Cell Cycle. 14 (20), 3242-3247 (2015).
- Ralph, S. J., Rodríguez-Enríquez, S., Neuzil, J., Saavedra, E., Moreno-Sánchez, R. The causes of cancer revisited: "mitochondrial malignancy" and ROS-induced oncogenic transformation - why mitochondria are targets for cancer therapy. Molecular Aspects of Medicine. 31 (2), 145-170 (2010).
- Kreitz, J., et al. Metabolic Plasticity of Acute Myeloid Leukemia. Cells. 8 (8), (2019).
- Sriskanthadevan, S., et al. AML cells have low spare reserve capacity in their respiratory chain that renders them susceptible to oxidative metabolic stress. Blood. 125 (13), 2120-2130 (2015).
- Guerra, F., et al. Mitochondrial Dysfunction: A Novel Potential Driver of Epithelial-to-Mesenchymal Transition in Cancer. Frontiers in Oncology. 7, 295 (2017).
- Guerra, F., Arbini, A. A., Moro, L. Mitochondria and cancer chemoresistance. Biochimica et Biophysica Acta. 1858 (8), 686-699 (2017).
- Neuzil, J., Dong, L. F., Rohlena, J., Truksa, J., Ralph, S. J. Classification of mitocans, anti-cancer drugs acting on mitochondria. Mitochondrion. 13 (3), 199-208 (2013).
- Ubah, O. C., Wallace, H. M. Cancer therapy: Targeting mitochondria and other sub-cellular organelles. Current Pharmaceutical Design. 20 (2), 201-222 (2014).
- Yamaguchi, R., et al. Efficient elimination of cancer cells by deoxyglucose-ABT-263/737 combination therapy. PLoS One. 6 (9), 24102 (2011).
- Hahn, T., et al. Use of anti-cancer drugs, mitocans, to enhance the immune responses against tumors. Current Pharmaceutical Biotechnology. 14 (3), 357-376 (2013).
- Panina, S. B., Pei, J., Baran, N., Konopleva, M., Kirienko, N. V. Utilizing Synergistic Potential of Mitochondria-Targeting Drugs for Leukemia Therapy. Frontiers in Oncology. 10, 435 (2020).
- Lema, C., Varela-Ramirez, A., Aguilera, R. J. Differential nuclear staining assay for high-throughput screening to identify cytotoxic compounds. Current Cellular Biochemistry. 1 (1), 1-14 (2011).
- Döhner, H., et al. Diagnosis and management of acute myeloid leukemia in adults: recommendations from an international expert panel, on behalf of the European LeukemiaNet. Blood. 115 (3), 453-474 (2010).
- Heinz, S., et al. Mechanistic Investigations of the Mitochondrial Complex I Inhibitor Rotenone in the Context of Pharmacological and Safety Evaluation. Scientific Reports. 7, 45465 (2017).
- Fan, T., et al. Tumor Energy Metabolism and Potential of 3-Bromopyruvate as an Inhibitor of Aerobic Glycolysis: Implications in Tumor Treatment. Cancers (Basel). 11 (3), (2019).
- Pal, R., Mamidi, M. K., Das, A. K., Bhonde, R. Diverse effects of dimethyl sulfoxide (DMSO) on the differentiation potential of human embryonic stem cells. Archives of Toxicology. 86 (4), 651-661 (2012).
- Tunçer, S., et al. Low dose dimethyl sulfoxide driven gross molecular changes have the potential to interfere with various cellular processes. Scientific Reports. 8 (1), 14828 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены