Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Ein automatisierter Differential-Nuklearfärbungstest zur genauen Bestimmung der Mitocan-Zytotoxizität
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Das Protokoll beschreibt einen schnellen, hohen Durchsatz, zuverlässigen, kostengünstigen und unvoreingenommenen Test zur effizienten Bestimmung der Zelllebensfähigkeit. Dieser Test ist besonders nützlich, wenn die Mitochondrien der Zellen geschädigt wurden, was andere Assays stört. Der Test verwendet die automatisierte Zählung von Zellen, die mit zwei Kernfarbstoffen – Hoechst 33342 und Propidiumiodid – befleckt sind.
Zusammenfassung
Der Beitrag der Mitochondrien zur onkogenen Transformation ist ein Thema von großem Interesse und aktiver Studie. Da das Feld des Krebsstoffwechsels komplexer wird, wird das Ziel, Mitochondrien mit verschiedenen Verbindungen anzugreifen, die mitochondriale Schäden verursachen (sogenannte Mitocans), immer beliebter. Leider benötigen viele bestehende Zytotoxizitätstests, wie z. B. solche, die auf Tetrazoliumsalzen oder Resazurin basieren, funktionelle mitochondriale Enzyme für ihre Leistung. Der Schaden, der durch Verbindungen verursacht wird, die auf Mitochondrien abzielen, beeinträchtigt oft die Genauigkeit dieser Assays. Hier beschreiben wir ein modifiziertes Protokoll, das auf Differentialfärbung mit zwei fluoreszierenden Farbstoffen basiert, von denen einer zellpermeant (Hoechst 33342) und der andere nicht (Propidiumiodid) ist. Der Unterschied in der Färbung ermöglicht es, lebende und abgestorbene Zellen zu diskriminieren. Der Assay ist für die automatisierte Mikroskopie und Bildanalyse zugänglich, was den Durchsatz erhöht und Verzerrungen reduziert. Dies ermöglicht auch die Verwendung des Assays in High-Throughput-Manier mit 96-Well-Platten, so dass es eine praktikable Option für Drogenentdeckungbemühungen, vor allem, wenn die betreffenden Medikamente haben ein gewisses Maß an Mitotoxizität. Wichtig ist, dass die Ergebnisse des Hoechst/PI-Färbetestes eine erhöhte Konsistenz aufweisen, sowohl mit Trypan-Blau-Ausschlussergebnissen als auch zwischen biologischen Replikationen, wenn der Test mit anderen Methoden verglichen wird.
Einleitung
Der erste Schritt zur Identifizierung wirksamer Krebsbehandlungen ist die Auswahl eines robusten, unvoreingenommenen Zytotoxizitäts-Assays, der verwendet werden kann, um die Wirkung der Behandlung zu untersuchen. Eine häufige Wahl für Versuche mit niedrigem Durchsatz ist der Ausschluss von Trypan-Blaufarbstoff enthäupfen zellendes. Diese Methode wird bevorzugt, weil sie eine relativ unvoreingenommene Methode zur Quantifizierung des Zellüberlebens ermöglicht. Trypan blau diffundiert passiv in Zellen, deren Membranen kompromittiert sind, aber es wird effektiv daran gehindert, in gesunde Zellen einzudringen1. Der Quotient der lebenden Zellen und der Gesamtzellen stellt die prozentuale Lebensfähigkeit dar, was auf die Wirksamkeit der Behandlung hinweist. Der größte Nachteil des Trypan-Blau-Assays ist, dass er für Methoden mit hohem Durchsatz schlecht geeignet ist. Es hat ein relativ niedriges Signal-Rausch-Verhältnis und längere Färbung kann zu Artefakten aufgrund der Färbung lebensfähiger Zellen führen. Folglich wird Trypan-Blau-Ausschluss in der Regel, aber nicht immer2, auf manuelle Zählung reduziert. Dies macht es zu langsam und führt die starke Möglichkeit der Voreingenommenheit aufgrund der subjektiven Beurteilung des Forschers (es sei denn, blendende oder unabhängige Zählungen verwendet werden, die den Labordurchsatz weiter reduzieren). Im Allgemeinen ist der Durchsatz dieses Assays nicht ausreichend für die moderne Entdeckung von Medikamenten.
Viability Assays, die im Allgemeinen einen viel höheren Durchsatz haben, ermöglichen es forschern, diese Einschränkung zu umgehen, haben aber erhebliche Vorbehalte (siehe Tabelle 1). Diese Methoden lassen sich in der Regel in zwei Gruppen unterteilen. Eine Gruppe besteht aus kolorimetrischen Assays, die auf der Funktion zellulärer Redoxenzyme basieren. Farblose oder nicht fluoreszierende Substrate werden in lebendige Produkte umgewandelt, die mit einem Spektralphotometer quantifiziert werden können. Klassische Beispiele sind Tetrazoliumsalze (MTT, WST-1, XTT, etc.) und Resazurin. Diese Kategorie umfasst auch lumineszierende Assays, die Luziferin verwenden, um ATP-Niveau zu bewerten. Assays dieser Art haben die zugrunde liegende Einschränkung, dass sie den Zellstoffwechsel messen, was nicht die zelluläre Lebensfähigkeit per se ist. Es ist durchaus üblich, dass Zellen unter widrigen Bedingungen still werden, aber immer noch die Fähigkeit behalten,3,4,5zu teilen. Zum Beispiel, Krebsstammzellen sind oft relativ metabolischruhend 6,7,8,9, und sind wahrscheinlich schwierig, mit diesen Techniken zu assay. Die Wirksamkeit von Behandlungen, die die mitochondriale Funktion schädigen, wie die meisten Mitocans, wird wahrscheinlich ebenfalls deutlich überschätzt.
Eine alternative Methode nutzt die chemischen Eigenschaften verschiedener Substanzen, die es ihnen ermöglichen, biologische Membranen entweder zu kreuzen oder nicht. Ein Beispiel sind nukleare Flecken wie SYTOX oder Propidiumiodid (PI). Diese Kategorie umfasst auch Assays, die im Konzept ähnlich sind, aber in ihrer Funktion unterschiedlich sind, wie z. B. der Lactatdehydrogenase (LDH)-Assay, der die Freisetzung von LDH in das extrazelluläre Milieu als Indikator für zelluläre Nekrose misst (Abbildung 1,Tabelle 1). Diese Assays sind eher in der Lage, zwischen metabolisch inaktiven und abgestorbenen Zellen zu unterscheiden.
| Assay/Farbstoff | Typ(e) des zelltoten Todes erkannt | Notwendige Ausrüstung | Hauptmerkmale |
| MTT, CKK-8, Alamar Blue (Resazurin) | Apoptose/Nekrose | Spektrophotometer | Preiswert, schnell; Endpunkt-Assay; abhängig von der Enzymaktivität (ausschließlich mitochondrial bei MTT) und unterscheidet nicht zwischen den Arten des Zelltodes1,10 |
| LDH-Freigabe | Nekrose | Spektrophotometer | Schnell, unabhängig von der Aktivität mitochondrialer Enzyme; teuer für Tests mit hohem Durchsatz; erkennt nekrotische Zellen mit compromisierter Plasmamembran11,12 |
| Trypan Blue (TB) | Apoptose/Nekrose | Mikroskop | Zellimpermeant; unterscheidet nicht zwischen den Arten des Zelltodes; mühsam und nicht geeignet für Hochdurchsatz-Screening; schwieriger zu verwenden mit anhaftenden Zellen; anfällig für subjektive Beurteilung des Anwenders, gilt aber als Standard-Zelllebensfähigkeitsmessmethode13 |
| Acridine orange (AO) | Apoptose/Nekrose/ | Fluoreszenzmikroskop | Ein Nukleinsäurefarbstoff mit einzigartigen spektralen Eigenschaften kann zwischen Apoptose und Nekrose/Nekroroptose14 unterscheiden |
| Nekrotose | |||
| Hoechst 33342, DAPI | Apoptose | Fluoreszenzmikroskop oder Durchflusszytometer | Zelldurchlässig; für sich allein ungeeignet, den Zelltod zu überwachen; nützlich für die Co-Färbung; kann verwendet werden, um Chromatinkondensation und Kernfragmentierung bei früher Apoptose zu bewerten; kann mit Propidiumjodid gepaart werden, um Apoptose von Nekrose zu unterscheiden15,16 |
| Propidium Iodid (PI) | Späte Apoptose/Nekrose | Fluoreszenzmikroskop oder Durchflusszytometer | Zellimpermeant Intercalator; erkennt sowohl späte Apoptose als auch Nekrosemodi des Zelltodes17. Giftig und durchlässig nach langen Inkubationszeiten18 |
Tabelle 1. Liste der Zytotoxizitäts-Assays. Cytotoxizität-Assays, von denen einige in dieser Studie verwendet wurden, wurden zusammen mit der kurzen Beschreibung ihrer wichtigsten Merkmale aufgeführt.
Jüngste Studien haben gezeigt, dass der mitochondriale Stoffwechsel bei einigen Krebsarten verändert wird19,20,21,22,23,24,25. Zum Beispiel, akute myeloische Leukämien (AML) haben gezeigt, dass ihre mitochondriale Masse, mtDNA-Gehalt und mitochondriale Atmung zu upregulieren, um ihre Energieanforderungen zu erfüllen19,26,27. Auf der anderen Seite sind einige solide Tumoren durch mitochondriale Dysfunktion, oder besser gesagt "metabolische Reprogrammierung", wie Downregulation von mitochondrialen Proteinen in OXPHOS beteiligt oder verminderte mtDNA-Gehalt, die mit Tumor-Invasivität, metastasierendem Potenzial und Resistenz gegen Apoptose-induzierende Medikamente verbunden ist28,29. Darüber hinaus hat in letzter Zeit ein erhöhtes Interesse an der Verwendung mechanistisch vielfältiger Verbindungen, die mitochondriale Funktion beeinflussen (im Allgemeinen mitocans30genannt), als mögliche Therapien für bestimmte Krebsarten. Diese Medikamente zielen auf ATP-Synthese, mitochondriale DNA, OXPHOS, und ROS-Produktion, sowie pro-apoptotische und anti-apoptotische Proteine im Zusammenhang mit Mitochondrien30,31. Mehrere Studien haben gezeigt, dass dieser Ansatz hat erhebliche Versprechen19,32,33,34. Diese metabolischen Abweichungen in der Krebszellbiologie oder mitochondrien-targeting-Behandlungen können jedoch die konventionellen Lebensfähigkeitstests, die auf mitochondrialer Funktionalität basieren, signifikant beeinflussen.
Hier wird ein optimiertes Protokoll für einen differenziellen kerniellen Färbetest beschrieben. Das Protokoll ermöglicht eine schnelle und genaue Bestimmung der Zytotoxizität von Mitocanen oder deren Kombinationen mit anderen Verbindungen. Hoechst 33342 ist ein zellpermeant Kernfarbstoff, der Zellmembranen leicht kreuzt, um DNA zu färben, so dass die Gesamtzellzahl ermittelt werden kann. Durch die Co-Färbung mit PI, die nur in die Kerne abgestorbener Zellen eindringt, kann der Anteil der lebenden (nur Hoechst) und toten (mit beiden) Zellen genau bestimmt werden. Dieses Protokoll verfeinert den veröffentlichten Assay35 durch Hinzufügen eines Schritts zur Optimierung der Farbstoffkonzentration (durch Querverweise mit orthogonalen Trypan-Blau-Verfahrens) und Zentrifugieren der Platte vor der Bildgebung. Da viele Zelllinien halbhaft oder suspendiert sind, erhöht die Zentrifugation den Anteil der abgebildeten Zellen und verbessert die Genauigkeit erheblich. Der Test hat mehrere Vorteile, einschließlich, dass Färbung nicht die Entfernung von Medien oder Waschen erfordert. Die Farbstoffmischung ist auch kostengünstig, einfach zu zubereiten und kompatibel mit Mehrkanal-/Roboter-Pipettiersystemen.
Nachdem Zellen gefärbt wurden, werden sie mit einem automatisierten Mikroskop abgebildet. Dies hat den zusätzlichen Vorteil, eine permanente Aufzeichnung der Bilder zu erstellen, die später neu analysiert werden kann und die Auswirkungen bestimmter Verbindungen können durch visuelle Inspektion von aufgenommenen Bildern neu bewertet werden. Sobald Bilder erhalten wurden, können Zellen entweder manuell oder mithilfe eines von mehreren Softwarepaketen gezählt werden, einschließlich freier (z. B. ImageJ, CellProfiler, etc.) und kommerzieller Software (z. B. Metamorph, Gen5 usw.). Automatisierte Zellzählung ist im Allgemeinen vorzuziehen, da ordnungsgemäß entwickelte automatisierte Zellzählpipelines genauer und weniger verzerrt sind als manuelle Zählungen. Sie ignorieren auch leichter Zellablagerungen oder unlösliche Komplexe. Die Entwicklung dieser Rohrleitungen ist im Allgemeinen einfach und wird durch die Effizienz der verwendeten Flecken vereinfacht. Die Ausgabe ist quantitativ, da die tatsächliche Anzahl der abgestorbenen Zellen automatisch in Bezug auf die Gesamtzahl der Zellen berechnet wird und verschiedene Schwellenwerte angewendet werden können, um die Stringenz der Erkennung zu erhöhen oder zu verringern35. Für den Komfort sind optimierte Parameter für das Zählen von Zellen mit Gen5 v. 3.00 softwarekompatiblem Cytation 5 Cell Imaging Multi-Mode Reader enthalten.
Protokoll
1. Zytotoxizitätstest: Setup
- Herstellung von Lösungen von Verbindungen von Interesse bei gewünschten Konzentrationen in den entsprechenden Medien (serumfrei oder 1, 2,5 oder 5% FBS RPMI-1640).
- Zur Messung der Zytotoxizität einer einzelnen Verbindung (z. B. zur Bestimmung der effektiven Dosen) bereiten Sie Verbindungen in 2x Endkonzentration vor.
- Zur Messung der Zytotoxizität von zusammengesetzten Kombinationen, bereiten Sie Verbindungen in 4x Endkonzentration vor.
- Bereiten Sie nur Lösungsmittelsteuerungen vor, indem Sie die gleiche Menge Lösungsmittel mit dem entsprechenden Medium mischen. Wenn z. B. in DMSO und Methanol gelöste Prüfstoffe hergestellt werden, können Sie für jedes Lösungsmittel nur lösungsmittelhaft steuern.
- Sammeln Sie Zellen aus Kulturschale oder Kolben in einem 15 ml konischen Rohr.
- Übertragen Sie 10 l Zellsuspension in ein Mikrozentrifugenrohr und färben Sie mit 10 l 0,4% Trypanblau. Verwenden Sie ein Hämozytometer, um lebensfähige und nicht lebensfähige Zellen für jede Zellquelle zu zählen.
- Pelletzellen bei 200 g für 5 min. Aspirat oder Dekanat überstand.
- Zellpellet in assay-geeigneten Medien (serumfrei oder 1, 2,5, 5% FBS RPMI-1640) bei einer Zelldichte von 3*105 Zellen/ml wieder aufsetzen.
ANMERKUNG 1: Die Zelldichte von 3*105 Zellen/ml bietet eine Sädichte von 15.000 Zellen/Well. Die Saatdichte ist ein wichtiger Parameter und sollte idealerweise vor dem Experiment vordefiniert werden. Die Saatdichte sollte 1) die Zellgröße berücksichtigen – in der Regel werden größere Zellen mit einer niedrigeren Dichte gesät; 2) Behandlungsdauer – Zellen werden in der Regel mit einer niedrigeren Dichte für Experimente gesät, die länger dauern; und 3) Zellteilungsrate – Zellen mit einer höheren Teilungsrate werden mit einer niedrigeren Dichte gesät. Spezifische Beispiele für optimierte Sädichten: K562-Zellen, größer, 24 h Dauer – 10.000 Zellen/Well; MOLM-13-Zellen, moderate Größe, 24 h Behandlung – 15.000/well; MOLM-13-Zellen, 48 h Behandlung – 8.000/well; kleine gesunde periphere mononukleäre Blutzellen (PBMCs), 24 h Behandlung – 50.000/gut; primäre AML-Zellen, 24-h-Behandlung – 15.000-20.000/well.
ANMERKUNG 2: Das Vorhandensein von FBS in Medien kann die Aktivität der Verbindungen beeinflussen. Die Verringerung der FBS-Konzentration kann die Interpretation der Assay-Ergebnisse vereinfachen, aber auch die physiologische Genauigkeit verringern. - Samen 50 l Zellsuspension von Schritt 1,5 in jeden Brunnen einer 96-Well-Platte mit einer Mehrkanalpipette.
- Fügen Sie Verbindungen wie folgt hinzu:
- Für einzelne zusammengesetzte Assays fügen Sie jedem Bohrgut 50 l 2x Compoundlösung hinzu. Für Lösemittel-Kontrollbrunnen 50 l Testmedien hinzufügen, die das Lösungsmittel in der 2x-Konzentration enthalten.
- Für Kombinationstests fügen Sie jeweils 25 L der Verbindung (4x Lösungen) in jeden Brunnen ein. Für einzelne Compound-Kontroll-Bohrungen, fügen Sie 25 l 4x Compound-Lösung und 25 l Testmedium. Für Lösemittel-Kontrollbrunnen 50 l Prüfmedium oder Prüfmedium hinzufügen, das das Lösungsmittel enthält.
ANMERKUNG 1: Die endgültige Konzentration von DMSO sollte 0,5 % nicht überschreiten.
ANMERKUNG 2: Es wird empfohlen, die Medien, die die Verbindungen enthalten, mit der Pipette hinzuzufügen, die die Wand jedes Brunnens aufgrund des geringen Volumens berührt.
- Tippen Sie vorsichtig auf die Platte, um das Mischen des Inhalts der Brunnen zu gewährleisten.
- Inkubieren Sie Platten bei 37 °C in einer befeuchteten 5%CO2-Atmosphäre für eine angemessene Zeit, z.B. 24 h.
2. Cytotoxizität Assay: Färbung mit Hoechst 33342 und Propidium Iodid
- Bereiten Sie 10x Färbelösung vor. Diese Lösung muss vor jedem Experiment neu vorbereitet werden, sie kann nicht gespeichert werden. Die endgültigen Farbstoffkonzentrationen sollten vor dem Experiment bestimmt werden.
- Bei Leukämie-Zelllinien und primären Leukämiezellen enthält 1 ml 10x Färbepuffer 10 l von 20 mM Hoechst 33342 und 50 l von 1 mg/ml Propidiumjodid in sterilem PBS (Endkonzentrationen: Hoechst 33342 20 'M, PI 5 g/ml).
- Für gesunde PBMCs enthält 1 ml 10x Färbepuffer 10 l mit 20 mM Hoechst 33342 und 10 l mit 1 mg/ml Propidiumjodid in sterilem PBS (Endkonzentrationen: Hoechst 33342 20 mM, PI 1 g/ml).
HINWEIS: Die endgültige Konzentration von Propidiumjodid muss vor den Experimenten bestimmt werden. Die Zellen sollten mit einer Reihe von PI-Konzentrationen (1, 2,5, 5 g/ml) getestet werden, und dann sollte die von Hoechst/PI berechnete Lebensfähigkeit mit der Lebensfähigkeit verglichen werden, die über Trypanblau gemessen wird. Die oben aufgeführten PI-Konzentrationen wurden auf der Grundlage der Lebensfähigkeit der Zielzellen in Medienkontrollbrunnen ausgewählt (über 90 % bei Leukämie-Zelllinien, über 70 % für gesunde PBMCs).
VORSICHT: Hoechst 33342 und Propidiumiodid sind potenzielle Karzinogene. Tragen Sie beim Umgang mit ihnen geeignete persönliche Schutzausrüstungen.
- Verwenden Sie nach der Inkubation eine Mehrkanalpipette, um jedem Bohrwert 10 L mit 10x Färbepuffer hinzuzufügen.
HINWEIS: Um Kreuzkontaminationen zu vermeiden, stellen Sie sicher, dass die Pipettenspitzen das Medium nicht berühren. - Tippen Sie vorsichtig auf die Platte, um Blasen zu mischen und zu löschen. Bei 37 °C für 15 min.
- Zentrifugieren Sie die Platte bei 200 g für 4 min, um alle Zellen an den Boden der Platte zu bringen. Wischen Sie den Boden der Platte vorsichtig mit einem feuchten Kimwipe ab, um Fasern und/oder Schmutz zu entfernen, die die Bildgebung stören.
ANMERKUNG 1: Die Zentrifugierung der Platte stellt die höchsten Chancen sicher, dass alle Zellen im Bild erfasst werden. Oft lösen sich abgestorbene Zellen und schweben, was irreführende Werte der Zytotoxizität liefert. Zentrifugation mildert diesen Effekt.
ANMERKUNG 2: Die Platte sollte so schnell wie möglich nach der Zentrifugation abgebildet werden, idealerweise innerhalb von 15 min. Zentrifugation kann die Selektivität der PI-Färbung reduzieren und es den Zellen ermöglichen, langsam Propidiumjodid anzusammeln. Die Verbesserung der Genauigkeit, die durch die Visualisierung der abgestorbenen Zellen gewonnen wird, überwiegt den leichten Anstieg der PI-Färbung. Es wird empfohlen, die Bildgebung innerhalb von 1 h zentrifugierend abzuschließen.
3. Cytotoxizität Assay: Datenerfassung
- Stellen Sie die Software für den automatisierten Mikroskop-/Plattenbildner ein, um Diefluoreszenz sowohl für Hoechst 33342 (Anregungsmaximum 350 nm, Emissionsmaximum 461 nm) als auch für PI (Anregungsmaximum 493 nm, Emissionsmaximum 636 nm) zu erkennen. Erfassen Sie Bilder für jeden Brunnen in beiden Kanälen.
- Mit der Software (wie CellProfiler, einem kostenlosen Bildanalysestudio basierend auf MatLab http://cellprofiler.org/, ImageJ oder proprietärer Software wie Gen5) zählen die Zellen in jedem Brunnen in jedem Kanal.
HINWEIS: Da jede Zelle mit Hoechst 33342 gefärbt werden sollte und abgestorbene Zellen mit PI befleckt werden sollten, stellt das Verhältnis von Totzutot zu allen den Bruchteil der toten Zellen dar. Wenn beispielsweise die automatisierte Anzahl in unbehandelten Proben 467 Zellen zeigt, die mit PI (tote Zellen) und 2335 Zellen mit Hoechst 33342 (Gesamtzellen) befleckt sind, beträgt der tote Anteil 0,2 oder 20 %. Dieser Wert wird dann mit einer identisch behandelten Probe verglichen, in der die Behandlung verwendet wurde. - Detaillierte Beschreibung der Hoechst/PI Datenerfassung mit Cytation5 Cell Imaging Multi-Mode Reader und Gen5 v. 3.00 Software:
- Stellen Sie den Cytation5 Multimode-Plattenleser/-bildwands auf Bildzellen in flachen unteren, 96-well, generischen schwarzen Kunststoffplatten ein.
- Legen Sie ein Imaging-Protokoll fest, um die standardmäßigen Filtersätze DAPI und Texas Red zu verwenden. Nehmen Sie Bilder in der Brunnenmitte mit einem 4-fachen Vergrößerungsobjektiv auf. Verwenden Sie keinen Offset (X/Y oder Z). Verwenden Sie die folgenden Bildeinstellungen: DAPI – LED - 10, Integrationszeit - 99, Gain - 0; Texas Red – LED - 8, Integrationszeit - 950, Gewinn - 18. Automatische Stellik mit dem DAPI-Signal durchführen; es sollte keinen Versatz bei der Fokussierung zwischen den Kanälen geben.
- Bildanalyse mit Gen5-Software v 3.00 durchführen. Definieren Sie in den Softwareeinstellungen Zellen als Formen zwischen 5 und 25 m größe. Schließen Sie primäre Kantenobjekte aus und teilen Sie berührende Objekte, indem Sie die spezielle Option "Berührende Objekte teilen" aktivieren. Als Nächstes verarbeiten Sie das Bild, um den Hintergrund zu entfernen (dunkle Hintergrundsubtraktion), wenden Sie eine Kernmaske (Schwellenwert DAPI >= 6000 AE) an und zählen Sie Objekte. Führen Sie eine Subpopulationsanalyse basierend auf PI-Färbung (Schwellenwert Texas Rot >= 5000 AE) durch, und zählen Sie Objekte. Die Zelllebensfähigkeit % ist definiert als (1 -
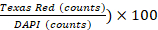 .
.
Ergebnisse
Das oben genannte Protokoll wurde mit OCI-AML2-Zellen entwickelt, die als repräsentative akute myeloische Leukämie-Zelllinie genommen wurden. AML ist durch abnorme Proliferation undifferenzierter und nicht-funktioneller hämatopoetischer Zellen im Knochenmarkgekennzeichnet 26. Trotz der jüngsten Entwicklungen in der AML-gezielten Therapie, ist der Standard der Pflege seit mehreren Jahrzehnten unverändert geblieben, und besteht aus Induktionstherapie (in der Regel bestehend aus drei Tagen Anthr...
Diskussion
Obwohl das Protokoll für Hoechst/PI Cytotoxizität-Assay robust ist und vergleichsweise wenig Hands-on-Zeit erfordert, gibt es mehrere experimentelle Details, die sehr wichtig sind, um genaue Ergebnisse zu gewährleisten. Zunächst ist darauf zu achten, dass die DMSO-Konzentration unter 0,5 % (v/v) bleibt. Es ist allgemein vereinbart, dass die Exposition gegenüber selbst niedrigen Dosen von DMSO die Morphologie und Anhaftung von Zellen wesentlich verändern und die Zellzyklusprogression signifikant verzögern kann
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
NVK, ein CPRIT-Stipendiat in der Krebsforschung, dankt dem Cancer Prevention and Research Institute of Texas (CPRIT) für die großzügige Unterstützung, CPRIT-Stipendium RR150044. Diese Arbeit wurde auch durch den Welch Foundation Research Grant C-1930 und von den National Institutes of Health R35 GM129294 an NVK verliehen. Die Geldgeber spielten keine Rolle bei der Studiengestaltung, Datenerhebung und -analyse, der Entscheidung zur Veröffentlichung oder der Vorbereitung des Manuskripts.
Materialien
| Name | Company | Catalog Number | Comments |
| 2-Deoxy-D-glucose/2-DG | Chem-Impex | 50-519-067 | |
| 3-bromo-pyruvate | Alfa Aesar | 1113-59-3 | |
| 96-Well plates | Greiner Bio-One | 655090 | Black or clear flat-bottomed 96-well plates |
| Alamar blue HS cell viability reagent (100mL) | Thermo Fisher | A50101 | |
| Countess II automated cell counter | Thermo Fisher | ||
| Cytation 5 Cell Imaging Multi-Mode Reader | BioTek | ||
| Hoechst 33342 | Thermo Fisher | 62249 | 20 mM solution; final concentration 1:1,000 |
| HyClone fetal bovine serum | GE Healthcare | #25-514 | |
| m-chlorophenylhydrazone/CCCP | Sigma Aldrich | C2759 | |
| PBS tablets | Thermo Fisher | BP2944100 | 1 tablet + 200 mL of sterile water = 1x PBS solution |
| Penicillin-Streptomycin-Glutamine (100X) | Gibco | 10378016 | |
| Pierce LDH assay kit | Thermo Fisher | 50-103-5952 | |
| Propidium Iodide | Thermo Fisher | 50-596-072 | Dry powder; stock 1 mg/mL in PBS; final concentration 5 µg/mL (leukemia cells), 1 µg/mL (normal PBMCs) |
| Rotenone | Ark Pharm | AK115691 | |
| RPMI-1640 Medium With L-glutamine and sodium bicarbonate, liquid, sterile-filtered, suitable for cell culture | Sigma Aldrich | R8758-500ML | |
| Thiazolyl blue tetrazolium bromide | ACROS Organics | AC158990010 | |
| Trypan blue stain (0.4%) | Gibco | 15250-061 | |
| Cell lines | |||
| K562 | ATCC | CCL-243 | CML cell line |
| MOLM-13 | ATCC | AML cell line | |
| MOLT-4 | ATCC | CRL-1582 | ALL cell line |
| OCI-AML2 | ATCC | AML cell line |
Referenzen
- Ramirez, C. N., Antczak, C., Djaballah, H. Cell viability assessment: toward content-rich platforms. Expert Opinion on Drug Discovery. 5 (3), 223-233 (2010).
- Melzer, S., et al. Trypan blue as an affordable marker for automated live-dead cell analysis in image cytometry. Scanning. 38 (6), 857-863 (2016).
- Sikora, E., Mosieniak, G., Sliwinska, M. A. Morphological and Functional Characteristic of Senescent Cancer Cells. Current Cancer Drug Targets. 17 (4), 377-387 (2016).
- Coppé, J. P., Desprez, P. Y., Krtolica, A., Campisi, J. The senescence-associated secretory phenotype: the dark side of tumor suppression. Annual Review of Pathology. 5, 99-118 (2010).
- Castro-Vega, L. J., et al. The senescent microenvironment promotes the emergence of heterogeneous cancer stem-like cells. Carcinogenesis. 36 (10), 1180-1192 (2015).
- Weihua, Z., Lin, Q., Ramoth, A. J., Fan, D., Fidler, I. J. Formation of solid tumors by a single multinucleated cancer cell. Cancer. 117 (17), 4092-4099 (2011).
- Osisami, M., Keller, E. T. Mechanisms of Metastatic Tumor Dormancy. Clinical Medicine. 2 (3), 136-150 (2013).
- Zhang, S., et al. Generation of cancer stem-like cells through the formation of polyploid giant cancer cells. Oncogene. 33 (1), 116-128 (2014).
- Mittal, K., et al. Multinucleated polyploidy drives resistance to Docetaxel chemotherapy in prostate cancer. British Journal of Cancer. 116 (9), 1186-1194 (2017).
- McKeague, A. L., Wilson, D. J., Nelson, J. Staurosporine-induced apoptosis and hydrogen peroxide-induced necrosis in two human breast cell lines. British Journal of Cancer. 88 (1), 125-131 (2003).
- Kaja, S., et al. An optimized lactate dehydrogenase release assay for screening of drug candidates in neuroscience. Journal of Pharmacological and Toxicological Methods. 73, 1-6 (2015).
- Chan, F. K., Moriwaki, K., De Rosa, M. J. Detection of necrosis by release of lactate dehydrogenase activity. Methods in Molecular Biology. 979, 65-70 (2013).
- Piccinini, F., Tesei, A., Arienti, C., Bevilacqua, A. Cell Counting and Viability Assessment of 2D and 3D Cell Cultures: Expected Reliability of the Trypan Blue Assay. Biological Procedures Online. 19, 8 (2017).
- Plemel, J. R., et al. Unique spectral signatures of the nucleic acid dye acridine orange can distinguish cell death by apoptosis and necroptosis. Journal of Cell Biology. 216 (4), 1163-1181 (2017).
- Galluzzi, L., et al. Guidelines for the use and interpretation of assays for monitoring cell death in higher eukaryotes. Cell Death & Differentiation. 16 (8), 1093-1107 (2009).
- Cummings, B. S., Schnellmann, R. G. Measurement of cell death in mammalian cells. Current Protocols in Pharmacology. , (2004).
- Brauchle, E., Thude, S., Brucker, S. Y., Schenke-Layland, K. Cell death stages in single apoptotic and necrotic cells monitored by Raman microspectroscopy. Scientific Reports. 4, 4698 (2014).
- Chiaraviglio, L., Kirby, J. E. Evaluation of impermeant, DNA-binding dye fluorescence as a real-time readout of eukaryotic cell toxicity in a high throughput screening format. Assay and Drug Development Technologies. 12 (4), 219-228 (2014).
- Panina, S. B., Baran, N., Brasil da Costa, F. H., Konopleva, M., Kirienko, N. V. A mechanism for increased sensitivity of acute myeloid leukemia to mitotoxic drugs. Cell Death & Disease. 10 (8), 617 (2019).
- Caro, P., et al. Metabolic signatures uncover distinct targets in molecular subsets of diffuse large B cell lymphoma. Cancer Cell. 22 (4), 547-560 (2012).
- Lagadinou, E. D., et al. BCL-2 inhibition targets oxidative phosphorylation and selectively eradicates quiescent human leukemia stem cells. Cell Stem Cell. 12 (3), 329-341 (2013).
- Senft, D., Ronai, Z. A. Regulators of mitochondrial dynamics in cancer. Current Opinion in Cell Biology. 39, 43-52 (2016).
- Vazquez, F., et al. PGC1α expression defines a subset of human melanoma tumors with increased mitochondrial capacity and resistance to oxidative stress. Cancer Cell. 23 (3), 287-301 (2013).
- Caino, M. C., Altieri, D. C. Cancer cells exploit adaptive mitochondrial dynamics to increase tumor cell invasion. Cell Cycle. 14 (20), 3242-3247 (2015).
- Ralph, S. J., Rodríguez-Enríquez, S., Neuzil, J., Saavedra, E., Moreno-Sánchez, R. The causes of cancer revisited: "mitochondrial malignancy" and ROS-induced oncogenic transformation - why mitochondria are targets for cancer therapy. Molecular Aspects of Medicine. 31 (2), 145-170 (2010).
- Kreitz, J., et al. Metabolic Plasticity of Acute Myeloid Leukemia. Cells. 8 (8), (2019).
- Sriskanthadevan, S., et al. AML cells have low spare reserve capacity in their respiratory chain that renders them susceptible to oxidative metabolic stress. Blood. 125 (13), 2120-2130 (2015).
- Guerra, F., et al. Mitochondrial Dysfunction: A Novel Potential Driver of Epithelial-to-Mesenchymal Transition in Cancer. Frontiers in Oncology. 7, 295 (2017).
- Guerra, F., Arbini, A. A., Moro, L. Mitochondria and cancer chemoresistance. Biochimica et Biophysica Acta. 1858 (8), 686-699 (2017).
- Neuzil, J., Dong, L. F., Rohlena, J., Truksa, J., Ralph, S. J. Classification of mitocans, anti-cancer drugs acting on mitochondria. Mitochondrion. 13 (3), 199-208 (2013).
- Ubah, O. C., Wallace, H. M. Cancer therapy: Targeting mitochondria and other sub-cellular organelles. Current Pharmaceutical Design. 20 (2), 201-222 (2014).
- Yamaguchi, R., et al. Efficient elimination of cancer cells by deoxyglucose-ABT-263/737 combination therapy. PLoS One. 6 (9), 24102 (2011).
- Hahn, T., et al. Use of anti-cancer drugs, mitocans, to enhance the immune responses against tumors. Current Pharmaceutical Biotechnology. 14 (3), 357-376 (2013).
- Panina, S. B., Pei, J., Baran, N., Konopleva, M., Kirienko, N. V. Utilizing Synergistic Potential of Mitochondria-Targeting Drugs for Leukemia Therapy. Frontiers in Oncology. 10, 435 (2020).
- Lema, C., Varela-Ramirez, A., Aguilera, R. J. Differential nuclear staining assay for high-throughput screening to identify cytotoxic compounds. Current Cellular Biochemistry. 1 (1), 1-14 (2011).
- Döhner, H., et al. Diagnosis and management of acute myeloid leukemia in adults: recommendations from an international expert panel, on behalf of the European LeukemiaNet. Blood. 115 (3), 453-474 (2010).
- Heinz, S., et al. Mechanistic Investigations of the Mitochondrial Complex I Inhibitor Rotenone in the Context of Pharmacological and Safety Evaluation. Scientific Reports. 7, 45465 (2017).
- Fan, T., et al. Tumor Energy Metabolism and Potential of 3-Bromopyruvate as an Inhibitor of Aerobic Glycolysis: Implications in Tumor Treatment. Cancers (Basel). 11 (3), (2019).
- Pal, R., Mamidi, M. K., Das, A. K., Bhonde, R. Diverse effects of dimethyl sulfoxide (DMSO) on the differentiation potential of human embryonic stem cells. Archives of Toxicology. 86 (4), 651-661 (2012).
- Tunçer, S., et al. Low dose dimethyl sulfoxide driven gross molecular changes have the potential to interfere with various cellular processes. Scientific Reports. 8 (1), 14828 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten