Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un ensayo automatizado de tinción nuclear diferencial para la determinación precisa de la citotoxicidad mitoca
* Estos autores han contribuido por igual
En este artículo
Resumen
El protocolo describe un ensayo rápido, de alto rendimiento, confiable, económico e imparcial para determinar eficientemente la viabilidad celular. Este ensayo es particularmente útil cuando las mitocondrias de las células han sido dañadas, lo que interfiere con otros ensayos. El ensayo utiliza el conteo automatizado de células manchadas con dos tintes nucleares: Hoechst 33342 y yoduro de propidium.
Resumen
La contribución de las mitocondrias a la transformación oncogénica es un tema de amplio interés y estudio activo. A medida que el campo del metabolismo del cáncer se vuelve más complejo, el objetivo de apuntar a las mitocondrias utilizando varios compuestos que infligen daño mitocondrial (los llamados mitocanes) se está volviendo bastante popular. Desafortunadamente, muchos ensayos de citotoxicidad existentes, como los basados en sales de tetrazolium o resazurin requieren enzimas mitocondriales funcionales para su rendimiento. El daño infligido por los compuestos que apuntan a las mitocondrias a menudo compromete la precisión de estos ensayos. Aquí, describimos un protocolo modificado basado en la tinción diferencial con dos tintes fluorescentes, uno de los cuales es permeante de células (Hoechst 33342) y el otro de los cuales no es (yoduro de propidium). La diferencia en la tinción permite discriminar las células vivas y muertas. El ensayo es susceptible de microscopía automatizada y análisis de imágenes, lo que aumenta el rendimiento y reduce el sesgo. Esto también permite que el ensayo se utilice de manera de alto rendimiento utilizando placas de 96 pozos, por lo que es una opción viable para los esfuerzos de descubrimiento de fármacos, particularmente cuando los fármacos en cuestión tienen algún nivel de mitotoxicidad. Es importante destacar que los resultados obtenidos por el ensayo de tinción Hoechst/PI muestran una mayor consistencia, tanto con los resultados de exclusión azul tripano como entre réplicas biológicas cuando el ensayo se compara con otros métodos.
Introducción
El primer paso para identificar tratamientos eficaces contra el cáncer es la selección de un ensayo de citotoxicidad robusto e imparcial que se puede utilizar para examinar el efecto del tratamiento. Una opción común para experimentos de bajo rendimiento es la exclusión del tinte azul trypan de las células vivas. Este método se ve favorecido porque permite un método relativamente imparcial para cuantificar la supervivencia celular. el azul de tripano se difunde pasivamente en las células cuyas membranas están comprometidas, pero está efectivamente bloqueado para entrar en las células sanas1. El cociente de las células vivas y las células totales representa el porcentaje de viabilidad, lo que indica la eficacia del tratamiento. La desventaja más significativa del ensayo azul tripano es que es poco adecuado para metodologías de alto rendimiento. Tiene una relación señal-ruido relativamente baja y la tinción prolongada puede resultar en artefactos debido a la tinción de células viables. Por lo tanto, la exclusión azul de trypan suele ser, pero no siempre2,relegada al recuento manual. Esto hace que sea demasiado lento e introduce la fuerte posibilidad de sesgo debido al juicio subjetivo del investigador (a menos que se utilicen recuentos cegados o independientes, lo que reduce aún más el rendimiento del laboratorio). En general, el rendimiento de este ensayo es insuficiente para el descubrimiento de fármacos modernos.
Los ensayos de viabilidad, que generalmente tienen un rendimiento mucho mayor, permiten a los investigadores eludir esta limitación, pero vienen con advertencias significativas (véase el Cuadro 1). Estos métodos generalmente se dividen en dos grupos. Un grupo se compone de ensayos colorimétricos que se basan en la función de las enzimas redox celulares. Los sustratos incoloros o no fluorescentes se convierten en productos vibrantes que se pueden cuantificar mediante un espectrofotómetro. Ejemplos clásicos incluyen sales de tetrazolium (MTT, WST-1, XTT, etc.) y resazurin. Esta categoría también incluye ensayos luminiscentes que utilizan luciferina para evaluar el nivel de ATP. Los ensayos de este tipo tienen la limitación subyacente de que están midiendo el metabolismo celular, que no es la viabilidad celular per se. Es bastante común que las células se vuelvan en reposo en condiciones adversas, pero aún así conservan la capacidad de dividir3,4,5. Por ejemplo, las células madre cancerosas son a menudo relativamente metabólicamente en reposo6,7,8,9, y es probable que sean difíciles de ensayar utilizando estas técnicas. También es probable que la eficacia de los tratamientos que dañan la función mitocondrial, como la mayoría de los mitocanos, se sobreestime significativamente.
Una metodología alternativa aprovecha las propiedades químicas de varias sustancias que les permiten cruzar o no cruzar membranas biológicas. Un ejemplo son las manchas nucleares como SYTOX o yoduro propidium (PI). Esta categoría también incluye ensayos que son similares en concepto pero diferentes en función, como el ensayo de lactato deshidrogenasa (LDH), que mide la liberación de LDH en el ambiente extracelular como indicador de necrosis celular (Figura 1, Tabla 1). Estos ensayos son más capaces de distinguir entre células metabólicamente inactivas y células muertas.
| Ensayo/teñido | Tipo(s) de muerte celular detectada | Equipo necesario | Características clave |
| MTT, CKK-8, Azul Alamar (resazurin) | Apoptosis/Necrosis | Espectrofotómetro | Barato, rápido; ensayo de punto final; actividad de las enzimas (exclusivamente mitocondrial en caso de MTT) y no discrimina entre los modos de muerte celular1,10 |
| Versión de LDH | Necrosis | Espectrofotómetro | Rápido, independiente de la actividad de las enzimas mitocondriales; costoso para pruebas de alto rendimiento; detecta células necróticas con membrana plasmáticacompromizada 11,12 |
| Azul Trypan (TB) | Apoptosis/Necrosis | Microscopio | Celda-impermeante; no discrimina entre los modos de muerte celular; laborioso y no adecuado para el cribado de alto rendimiento; más difícil de usar con células adherentes; propensa al juicio subjetivo del usuario, pero se considera el método estándar de medición de la viabilidad celular13 |
| Naranja acridina (AO) | Apoptosis/Necrosis/ | Microscopio de fluorescencia | Un tinte de ácido nucleico con propiedades espectrales únicas, puede distinguir entre apoptosis y necrosis/necroptosis14 |
| Necroptosis | |||
| Hoechst 33342, DAPI | Apoptosis | Microscopio de fluorescencia o citómetro de flujo | Permeable a la célula; inapropiado por sí solo para monitorear la muerte celular; útil para la co-tinción; se puede utilizar para evaluar la condensación de cromatina y la fragmentación de los núcleos en la apoptosis temprana; puede ser emparejado con yoduro propidium para distinguir la apoptosis de la necrosis15,16 |
| Yoduro de propidium (PI) | Apoptosis/Necrosis tardía | Microscopio de fluorescencia o citómetro de flujo | Intercalador de células impermeant; detecta tanto la apoptosis tardía como los modos de necrosis de la muerte celular17. Tóxico y permeable después de largos tiempos de incubación18 |
Tabla 1. Lista de ensayos de citotoxicidad. Los ensayos de citotoxicidad, algunos de los cuales se utilizaron en este estudio, enumeraron junto con la breve descripción de sus características clave.
Estudios recientes han demostrado que el metabolismo mitocondrial se altera en algunos tipos de cáncer19,20,21,22,23,24,25. Por ejemplo, se ha demostrado que las leucemias mieloides agudas (LMA) regulan su masa mitocondrial, su contenido en ADNnm y la respiración mitocondrial para satisfacer sus demandas energéticas19,26,27. Por otro lado, algunos tumores sólidos se caracterizan por una disfunción mitocondrial, o más bien "reprogramación metabólica", como la regulación descendente de las proteínas mitocondriales implicadas en OXPHOS o la disminución del contenido de ADNm, que se ha asociado con la invasividad tumoral, el potencial metastásico y la resistencia a los medicamentos inductores de apoptosis28,29. Además, recientemente, ha habido un mayor interés en el uso de compuestos mecanicísticamente diversos que afectan la función mitocondrial (generalmente llamados mitocanes30), como terapias potenciales para cánceres particulares. Estos fármacos se dirigen a la síntesis de ATP, ADN mitocondrial, OXPHOS, y la producción de ROS, así como proteínas pro-apoptóticas y anti-apoptóticas asociadas con las mitocondrias30,31. Varios estudios han demostrado que este enfoque tiene una promesa significativa19,32,33,34. Sin embargo, estas desviaciones metabólicas en la biología de las células cancerosas o los tratamientos dirigidos a las mitocondrias pueden afectar significativamente a los ensayos de viabilidad convencionales que se basan en la funcionalidad mitocondrial.
Aquí se describe un protocolo optimizado para un ensayo diferencial de tinción nuclear. El protocolo permite una determinación rápida y precisa de la citotoxicidad de los mitocanes o sus combinaciones con otros compuestos. Hoechst 33342 es un tinte nuclear permeante de células que cruza fácilmente las membranas celulares para manchar el ADN, lo que permite obtener el recuento total de células. Al co-tinción con PI, que sólo entra en los núcleos de las células muertas, la proporción de células vivas (solo Hoechst) y muertas (manchadas con ambas) se puede determinar con precisión. Este protocolo refina el ensayo publicado35 añadiendo un paso para la optimización de la concentración de tinte (mediante la referencia cruzada de resultados con el método ortogonal trypan blue) y la centrifugación de la placa antes de la toma de imágenes. Dado que muchas líneas celulares son semiadheridas o suspendidas, la centrifugación aumenta la proporción de células que se utilizan y mejora fuertemente la precisión. El ensayo tiene varias ventajas, incluyendo que la tinción no requiere la eliminación de medios o lavado. La mezcla de tinte también es económica, fácil de preparar y compatible con sistemas de pipeteo multicanal/robótico.
Después de que las células han sido manchadas, se toman imágenes con un microscopio automatizado. Esto tiene la ventaja añadida de crear un registro permanente de las imágenes que se pueden volver a analizar más adelante y los efectos de determinados compuestos se pueden reevaluar mediante la inspección visual de las imágenes capturadas. Una vez obtenidas las imágenes, las celdas se pueden contar manualmente o mediante cualquiera de los varios paquetes de software, incluyendo tanto software gratuito (por ejemplo, ImageJ, CellProfiler, etc.) como software comercial (por ejemplo, Metamorph, Gen5, etc.). El recuento automatizado de células es generalmente preferible, ya que las tuberías de recuento de células automatizadas desarrolladas correctamente son más precisas y menos sesgadas que los recuentos manuales. También ignoran de manera más efectiva los desechos celulares o los complejos insolubles. El desarrollo de estas tuberías es generalmente sencillo y se simplifica por la eficiencia de las manchas utilizadas. La salida es cuantitativa ya que el número real de celdas muertas se calcula automáticamente con respecto al número de celda total, y se pueden aplicar diferentes umbrales para aumentar o disminuir la rigurosidad de la detección35. Para mayor comodidad, se incluyen parámetros optimizados para contar celdas mediante el lector multimodo Cytation 5 Cell Imaging compatible con el software Gen5 v. 3.00.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Ensayo de citotoxicidad: Configuración
- Preparar soluciones de compuestos de interés a las concentraciones deseadas en los medios apropiados (sin suero o 1, 2,5 o 5% FBS RPMI-1640).
- Para medir la citotoxicidad de un solo compuesto (por ejemplo, para determinar dosis efectivas), prepare compuestos a 2 veces la concentración final.
- Para medir la citotoxicidad de las combinaciones de compuestos, prepare compuestos a 4x concentración final.
- Prepare controles solo con disolventes mezclando la misma cantidad de disolvente con el medio adecuado. Por ejemplo, si los compuestos de ensayo se disuelven en DMSO y metanol, realice un control solo con disolventes para cada disolvente.
- Recoger las células de un plato de cultivo o matraz en un tubo cónico de 15 ml.
- Transfiera 10 l de suspensión celular a un tubo de microcentrífuga y manche con 10 l 0,4% de color azul tripano. Utilice un hemocitociómetro para contar células viables e in viables para cada fuente celular.
- Células de pellets a 200 g durante 5 min. Aspirar o decantar sobrenadante.
- Resuspendid pellet de células en medios apropiados para el ensayo (libre de suero o 1, 2.5, 5% FBS RPMI-1640) a una densidad celular de 3*105 células/ml.
NOTA 1: La densidad celular de 3*105 células/ml proporciona una densidad de siembra de 15.000 células/pozo. La densidad de siembra es un parámetro importante e idealmente debe estar predefinida antes del experimento. La densidad de siembra debe tener en cuenta 1) tamaño de celda – por lo general, las células más grandes se siembran a una densidad más baja; 2) duración del tratamiento – las células se siembran típicamente a una densidad más baja para experimentos que durarán más tiempo; y 3) tasa de división celular – las células con una mayor tasa de división se siembran a una densidad más baja. Ejemplos específicos de densidades de siembra optimizadas: células K562, más grandes, duración de 24 horas – 10.000 células/pozo; Células MOLM-13, tamaño moderado, tratamiento de 24 h – 15.000/pozo; Células MOLM-13, tratamiento de 48 h – 8.000/pozo; pequeñas células mononucleares de sangre periférica sana (PBMC), tratamiento de 24 h – 50.000/pozo; células LMA primarias, tratamiento de 24 h – 15,000-20,000/well.
NOTA 2: La presencia de FBS en los medios puede afectar a la actividad de los compuestos. La reducción de la concentración de FBS puede hacer que los resultados del ensayo sean más fáciles de interpretar, pero también reduce la precisión fisiológica. - Semilla de 50 ml de suspensión celular desde el paso 1.5 en cada pocómo de una placa de 96 pocillos utilizando una pipeta multicanal.
- Agregue compuestos de la siguiente manera:
- Para ensayos compuestos individuales, agregue 50 l de solución compuesta 2x en cada pocól. Para los pozos de control de disolventes, añada 50 l de medios de ensayo que contengan el disolvente a la concentración de 2x.
- Para ensayos combinados, añada 25 l de cada uno de los compuestos (soluciones 4x) en cada pocól. Para pozos de control compuesto único, añada 25 l de solución compuesta de 4x y 25 ml de medio de ensayo. Para los pozos de control de disolventes, añada 50 l de medio de ensayo o medio de ensayo que contenga el disolvente.
NOTA 1: La concentración final de DMSO no debe exceder el 0,5%.
NOTA 2: Se recomienda añadir el soporte que contiene los compuestos con la pipeta tocando la pared de cada pozo debido a su bajo volumen.
- Toque suavemente la placa para asegurar la mezcla del contenido de los pozos.
- Incubar las placas a 37oC en una atmósfera humidificada de 5% deCO2 durante un tiempo adecuado, por ejemplo, 24 h.
2. Ensayo de citotoxicidad: tinción con Hoechst 33342 y yoduro propidium
- Prepare una solución de tinción 10x. Esta solución debe prepararse de nuevo antes de cada experimento, no se puede almacenar. Las concentraciones finales de tinte deben determinarse antes del experimento.
- Para las líneas celulares de la leucemia y las células de leucemia primaria, 1 ml de tampón de tinción de 10x contiene 10 l de 20 mM Hoechst 33342 y 50 l de yoduro de propidium de 1 mg/ml en PBS estéril (concentraciones finales: Hoechst 33342 20 m, PI 5 g/ml).
- Para los PBMC sanos, 1 ml de tampón de tinción de 10x contiene 10 ml de 20 mM Hoechst 33342 y 10 l de yoduro propidium de 1 mg/ml en PBS estéril (concentraciones finales: Hoechst 33342 20 m, PI 1 g/ml).
NOTA: La concentración final de yoduro propidium debe determinarse antes de los experimentos. Las células deben probarse utilizando un rango de concentraciones de PI (1, 2,5, 5 g/ml), y luego la viabilidad calculada por Hoechst/PI debe compararse con la viabilidad medida a través del azul tripano. Las concentraciones de PI enumeradas anteriormente se eligieron en función de la viabilidad de las células diana en pozos de control de medios (por encima del 90 % para las líneas celulares de leucemia, por encima del 70 % para los PBCC sanos).
ADVERTENCIA: Hoechst 33342 y yoduro propidium son potenciales carcinógenos. Use el equipo de protección personal adecuado cuando los manipule.
- Después de la incubación, utilice una pipeta multicanal para añadir 10 l de tampón de tinción 10x a cada pocól.
NOTA: Para evitar la contaminación cruzada, asegúrese de que las puntas de la pipeta no toquen el soporte. - Toque suavemente la placa para mezclar y limpiar las burbujas. Mancha a 37oC durante 15 min.
- Centrifugar la placa a 200 g durante 4 min para llevar todas las células a la parte inferior de la placa. Limpie cuidadosamente la parte inferior de la placa con un kimwipe húmedo para eliminar fibras y/o desechos que interfieran con la toma de imágenes.
NOTA 1: La centrifugación de la placa garantiza las mayores posibilidades de capturar todas las celdas en la imagen. A menudo, las células muertas se desprenden y flotan, proporcionando valores engañosos de citotoxicidad. La centrifugación mitiga este efecto.
NOTA 2: La placa debe ser imagen tan rápido como sea posible después de la centrifugación, idealmente, dentro de 15 min. La centrifugación puede reducir la selectividad de la tinción de PI y puede permitir que las células acumulen lentamente yoduro de propidio. La mejora en la precisión obtenida al visualizar las células muertas supera el ligero aumento de la tinción de PI. Se recomienda terminar la toma de imágenes dentro de 1 h de centrifugación.
3. Ensayo de citotoxicidad: adquisición de datos
- Configure el software para el microscopio automatizado/imágenes de placa para detectar la fluorescencia para Hoechst 33342 (máximo de excitación 350 nm, emisión máxima 461 nm) y PI (máximo de excitación 493 nm, emisión máxima 636 nm). Adquiere imágenes para cada pozo en ambos canales.
- Usando el software (como CellProfiler, un estudio de análisis de imágenes gratuito basado en MatLab http://cellprofiler.org/, ImageJ o software propietario como Gen5) cuentan las celdas en cada pozo en cada canal.
NOTA: Dado que cada celda debe estar manchada con Hoechst 33342, y las células muertas deben mancharse con PI, la proporción de muertos a todos representa la fracción de células que están muertas. Por ejemplo, si el recuento automatizado en la muestra no tratada muestra 467 células manchadas con PI (células muertas) y 2335 células manchadas con Hoechst 33342 (células totales), la fracción muerta es 0,2 o 20%. Este valor se compara entonces con una muestra de tratamiento idéntico donde se utilizó el tratamiento. - Descripción detallada de la adquisición de datos Hoechst/PI utilizando Cytation5 Cell Imaging Multi-Mode Reader y el software Gen5 v. 3.00:
- Establezca el lector/imágenes de placas multimodo Cytation5 en celdas de imagen en placas de plástico negro genéricos de 96 pozos y fondo plano.
- Establezca un protocolo de imágenes para utilizar los conjuntos de filtros DAPI y Texas Red estándar. Tome imágenes en el centro del pozo usando un objetivo de aumento 4x. No utilice ningún desplazamiento (X/Y o Z). Utilice los siguientes ajustes de imagen: DAPI – LED - 10, tiempo de integración - 99, ganancia - 0; Texas Red – LED - 8, tiempo de integración - 950, ganancia - 18. Realizar el enfoque automático utilizando la señal DAPI; no debe haber ningún desplazamiento en el enfoque entre los canales.
- Realice análisis de imágenes con el software Gen5 v 3.00. En la configuración del software, defina las celdas como formas entre 5 y 25 m en su tamaño. Excluya los objetos de arista primarios y divida los objetos que se tocan activando la opción especial "Dividir objetos tocables". A continuación, procese la imagen para eliminar el fondo (resta de fondo oscuro), aplique una máscara nuclear (valor de umbral DAPI > 6000 AU) y cuente los objetos. Realice un análisis de subpoblación basado en la tinción de PI (valor umbral Texas Red > 5000 AU) y cuente los objetos. El % de viabilidad celular se define como (1 -
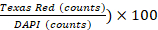 .
.
Access restricted. Please log in or start a trial to view this content.
Resultados
El protocolo antes mencionado se ha desarrollado utilizando células OCI-AML2, que fueron tomadas como una línea celular representativa de la leucemia mieloide aguda. La LMA se caracteriza por una proliferación anormal de células hematopoyéticas indiferenciadas y no funcionales en la médula ósea26. A pesar de los recientes avances en la terapia dirigida a LMA, el estándar de atención ha permanecido inalterado durante varias décadas, y consiste en terapia de inducción (típicamente compue...
Access restricted. Please log in or start a trial to view this content.
Discusión
Aunque el protocolo para el ensayo de citotoxicidad Hoechst/PI es robusto y requiere relativamente poco tiempo práctico, hay varios detalles experimentales que son muy importantes para garantizar resultados precisos. En primer lugar, es esencial asegurarse de que la concentración de DMSO se mantenga por debajo del 0,5% (v/v). Generalmente se acuerda que la exposición a dosis incluso bajas de DMSO puede alterar sustancialmente la morfología y la unión de las células y retrasar significativamente la progresión del c...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
NVK, un estudiante de CPRIT en Investigación del Cáncer, agradece al Instituto de Prevención e Investigación del Cáncer de Texas (CPRIT) por su generoso apoyo, la subvención CPRIT RR150044. Este trabajo también fue apoyado por la Beca de Investigación C-1930 de la Fundación Welch, y por los Institutos Nacionales de Salud R35 GM129294 otorgados a NVK. Los financiadores no tenían ningún papel en el diseño de estudios, la recopilación y el análisis de datos, la decisión de publicar o la preparación del manuscrito.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| 2-Deoxy-D-glucose/2-DG | Chem-Impex | 50-519-067 | |
| 3-bromo-pyruvate | Alfa Aesar | 1113-59-3 | |
| 96-Well plates | Greiner Bio-One | 655090 | Black or clear flat-bottomed 96-well plates |
| Alamar blue HS cell viability reagent (100mL) | Thermo Fisher | A50101 | |
| Countess II automated cell counter | Thermo Fisher | ||
| Cytation 5 Cell Imaging Multi-Mode Reader | BioTek | ||
| Hoechst 33342 | Thermo Fisher | 62249 | 20 mM solution; final concentration 1:1,000 |
| HyClone fetal bovine serum | GE Healthcare | #25-514 | |
| m-chlorophenylhydrazone/CCCP | Sigma Aldrich | C2759 | |
| PBS tablets | Thermo Fisher | BP2944100 | 1 tablet + 200 mL of sterile water = 1x PBS solution |
| Penicillin-Streptomycin-Glutamine (100X) | Gibco | 10378016 | |
| Pierce LDH assay kit | Thermo Fisher | 50-103-5952 | |
| Propidium Iodide | Thermo Fisher | 50-596-072 | Dry powder; stock 1 mg/mL in PBS; final concentration 5 µg/mL (leukemia cells), 1 µg/mL (normal PBMCs) |
| Rotenone | Ark Pharm | AK115691 | |
| RPMI-1640 Medium With L-glutamine and sodium bicarbonate, liquid, sterile-filtered, suitable for cell culture | Sigma Aldrich | R8758-500ML | |
| Thiazolyl blue tetrazolium bromide | ACROS Organics | AC158990010 | |
| Trypan blue stain (0.4%) | Gibco | 15250-061 | |
| Cell lines | |||
| K562 | ATCC | CCL-243 | CML cell line |
| MOLM-13 | ATCC | AML cell line | |
| MOLT-4 | ATCC | CRL-1582 | ALL cell line |
| OCI-AML2 | ATCC | AML cell line |
Referencias
- Ramirez, C. N., Antczak, C., Djaballah, H. Cell viability assessment: toward content-rich platforms. Expert Opinion on Drug Discovery. 5 (3), 223-233 (2010).
- Melzer, S., et al. Trypan blue as an affordable marker for automated live-dead cell analysis in image cytometry. Scanning. 38 (6), 857-863 (2016).
- Sikora, E., Mosieniak, G., Sliwinska, M. A. Morphological and Functional Characteristic of Senescent Cancer Cells. Current Cancer Drug Targets. 17 (4), 377-387 (2016).
- Coppé, J. P., Desprez, P. Y., Krtolica, A., Campisi, J. The senescence-associated secretory phenotype: the dark side of tumor suppression. Annual Review of Pathology. 5, 99-118 (2010).
- Castro-Vega, L. J., et al. The senescent microenvironment promotes the emergence of heterogeneous cancer stem-like cells. Carcinogenesis. 36 (10), 1180-1192 (2015).
- Weihua, Z., Lin, Q., Ramoth, A. J., Fan, D., Fidler, I. J. Formation of solid tumors by a single multinucleated cancer cell. Cancer. 117 (17), 4092-4099 (2011).
- Osisami, M., Keller, E. T. Mechanisms of Metastatic Tumor Dormancy. Clinical Medicine. 2 (3), 136-150 (2013).
- Zhang, S., et al. Generation of cancer stem-like cells through the formation of polyploid giant cancer cells. Oncogene. 33 (1), 116-128 (2014).
- Mittal, K., et al. Multinucleated polyploidy drives resistance to Docetaxel chemotherapy in prostate cancer. British Journal of Cancer. 116 (9), 1186-1194 (2017).
- McKeague, A. L., Wilson, D. J., Nelson, J. Staurosporine-induced apoptosis and hydrogen peroxide-induced necrosis in two human breast cell lines. British Journal of Cancer. 88 (1), 125-131 (2003).
- Kaja, S., et al. An optimized lactate dehydrogenase release assay for screening of drug candidates in neuroscience. Journal of Pharmacological and Toxicological Methods. 73, 1-6 (2015).
- Chan, F. K., Moriwaki, K., De Rosa, M. J. Detection of necrosis by release of lactate dehydrogenase activity. Methods in Molecular Biology. 979, 65-70 (2013).
- Piccinini, F., Tesei, A., Arienti, C., Bevilacqua, A. Cell Counting and Viability Assessment of 2D and 3D Cell Cultures: Expected Reliability of the Trypan Blue Assay. Biological Procedures Online. 19, 8(2017).
- Plemel, J. R., et al. Unique spectral signatures of the nucleic acid dye acridine orange can distinguish cell death by apoptosis and necroptosis. Journal of Cell Biology. 216 (4), 1163-1181 (2017).
- Galluzzi, L., et al. Guidelines for the use and interpretation of assays for monitoring cell death in higher eukaryotes. Cell Death & Differentiation. 16 (8), 1093-1107 (2009).
- Cummings, B. S., Schnellmann, R. G. Measurement of cell death in mammalian cells. Current Protocols in Pharmacology. , Chapter 12, Unit 12.18 (2004).
- Brauchle, E., Thude, S., Brucker, S. Y., Schenke-Layland, K. Cell death stages in single apoptotic and necrotic cells monitored by Raman microspectroscopy. Scientific Reports. 4, 4698(2014).
- Chiaraviglio, L., Kirby, J. E. Evaluation of impermeant, DNA-binding dye fluorescence as a real-time readout of eukaryotic cell toxicity in a high throughput screening format. Assay and Drug Development Technologies. 12 (4), 219-228 (2014).
- Panina, S. B., Baran, N., Brasil da Costa, F. H., Konopleva, M., Kirienko, N. V. A mechanism for increased sensitivity of acute myeloid leukemia to mitotoxic drugs. Cell Death & Disease. 10 (8), 617(2019).
- Caro, P., et al. Metabolic signatures uncover distinct targets in molecular subsets of diffuse large B cell lymphoma. Cancer Cell. 22 (4), 547-560 (2012).
- Lagadinou, E. D., et al. BCL-2 inhibition targets oxidative phosphorylation and selectively eradicates quiescent human leukemia stem cells. Cell Stem Cell. 12 (3), 329-341 (2013).
- Senft, D., Ronai, Z. A. Regulators of mitochondrial dynamics in cancer. Current Opinion in Cell Biology. 39, 43-52 (2016).
- Vazquez, F., et al. PGC1α expression defines a subset of human melanoma tumors with increased mitochondrial capacity and resistance to oxidative stress. Cancer Cell. 23 (3), 287-301 (2013).
- Caino, M. C., Altieri, D. C. Cancer cells exploit adaptive mitochondrial dynamics to increase tumor cell invasion. Cell Cycle. 14 (20), 3242-3247 (2015).
- Ralph, S. J., Rodríguez-Enríquez, S., Neuzil, J., Saavedra, E., Moreno-Sánchez, R. The causes of cancer revisited: "mitochondrial malignancy" and ROS-induced oncogenic transformation - why mitochondria are targets for cancer therapy. Molecular Aspects of Medicine. 31 (2), 145-170 (2010).
- Kreitz, J., et al. Metabolic Plasticity of Acute Myeloid Leukemia. Cells. 8 (8), (2019).
- Sriskanthadevan, S., et al. AML cells have low spare reserve capacity in their respiratory chain that renders them susceptible to oxidative metabolic stress. Blood. 125 (13), 2120-2130 (2015).
- Guerra, F., et al. Mitochondrial Dysfunction: A Novel Potential Driver of Epithelial-to-Mesenchymal Transition in Cancer. Frontiers in Oncology. 7, 295(2017).
- Guerra, F., Arbini, A. A., Moro, L. Mitochondria and cancer chemoresistance. Biochimica et Biophysica Acta. 1858 (8), 686-699 (2017).
- Neuzil, J., Dong, L. F., Rohlena, J., Truksa, J., Ralph, S. J. Classification of mitocans, anti-cancer drugs acting on mitochondria. Mitochondrion. 13 (3), 199-208 (2013).
- Ubah, O. C., Wallace, H. M. Cancer therapy: Targeting mitochondria and other sub-cellular organelles. Current Pharmaceutical Design. 20 (2), 201-222 (2014).
- Yamaguchi, R., et al. Efficient elimination of cancer cells by deoxyglucose-ABT-263/737 combination therapy. PLoS One. 6 (9), 24102(2011).
- Hahn, T., et al. Use of anti-cancer drugs, mitocans, to enhance the immune responses against tumors. Current Pharmaceutical Biotechnology. 14 (3), 357-376 (2013).
- Panina, S. B., Pei, J., Baran, N., Konopleva, M., Kirienko, N. V. Utilizing Synergistic Potential of Mitochondria-Targeting Drugs for Leukemia Therapy. Frontiers in Oncology. 10, 435(2020).
- Lema, C., Varela-Ramirez, A., Aguilera, R. J. Differential nuclear staining assay for high-throughput screening to identify cytotoxic compounds. Current Cellular Biochemistry. 1 (1), 1-14 (2011).
- Döhner, H., et al. Diagnosis and management of acute myeloid leukemia in adults: recommendations from an international expert panel, on behalf of the European LeukemiaNet. Blood. 115 (3), 453-474 (2010).
- Heinz, S., et al. Mechanistic Investigations of the Mitochondrial Complex I Inhibitor Rotenone in the Context of Pharmacological and Safety Evaluation. Scientific Reports. 7, 45465(2017).
- Fan, T., et al. Tumor Energy Metabolism and Potential of 3-Bromopyruvate as an Inhibitor of Aerobic Glycolysis: Implications in Tumor Treatment. Cancers (Basel). 11 (3), (2019).
- Pal, R., Mamidi, M. K., Das, A. K., Bhonde, R. Diverse effects of dimethyl sulfoxide (DMSO) on the differentiation potential of human embryonic stem cells. Archives of Toxicology. 86 (4), 651-661 (2012).
- Tunçer, S., et al. Low dose dimethyl sulfoxide driven gross molecular changes have the potential to interfere with various cellular processes. Scientific Reports. 8 (1), 14828(2018).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados