需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
自动差分核染色测定,准确测定三元细胞毒性
摘要
该协议描述了一种快速、高通量、可靠、廉价和公正的检测方法,用于有效确定细胞的可行性。当细胞的线粒体受损时,这种测定特别有用,这干扰了其他检测。该测定使用自动计数细胞染色的两种核染料 - Hoechst 33342 和碘化丙二钠。
摘要
线粒体对致癌转化的贡献是一个广泛关注和积极研究的课题。随着癌症代谢领域变得越来越复杂,使用各种化合物(所谓的米托坎)瞄准线粒体的目标正变得相当流行。不幸的是,许多现有的细胞毒性测定,如那些基于四佐盐或雷萨祖林需要功能线粒体酶,以他们的表现。以线粒体为目标的化合物造成的损害往往会损害这些测定的准确性。在这里,我们描述了一个基于两种荧光染料的差分染色的修饰协议,其中一种是细胞渗透剂(Hoechst 33342),另一种不是(碘化二氧化二钠)。染色的差异允许活细胞和死细胞被区分。该检测可支持自动显微镜和图像分析,可提高吞吐量并减少偏差。这也允许使用96孔板以高通量的方式使用测定,这使得它成为药物发现努力的可行选择,特别是当有关药物具有一定水平的米托毒性时。重要的是,Hoechst/PI染色测定获得的结果表明,在测定与其他方法进行比较时,与尝试蓝色排除结果和生物复制之间,一致性都有所提高。
引言
确定有效癌症治疗的第一步是选择一种稳健、无偏的细胞毒性检测,可用于检查治疗的效果。低通量实验的一个常见选择是将锥蓝染料排除在活细胞之外。这种方法之所以受到青睐,是因为它允许采用相对公正的方法量化细胞存活率。trypan蓝色被动地扩散到膜受损的细胞中,但它被有效地阻止进入健康的细胞1。活细胞和总细胞的商数代表生存能力的百分比,这表示治疗的功效。trypan 蓝色测定最大的缺点是它不适合高通量方法。它具有相对较低的信噪比,由于活细胞的染色,长时间的染色可能导致伪影。因此,trypan 蓝色排除通常是,但并不总是2,降级到手动计数。这使得它太慢,并引入了由于研究人员的主观判断(除非使用致盲或独立计数,这进一步降低实验室的吞吐量)的强烈偏见的可能性)。一般来说,这种测定的通量不足以发现现代药物。
可行性测定通常具有更高的吞吐量,使研究人员能够绕过这一限制,但需要注意一些重大警告(参见表1)。这些方法通常分为两组。一组由基于细胞氧化酶功能的色度测定组成。无色或非荧光基板可转换为充满活力的产品,可使用分光光度计进行量化。经典示例包括四分之一盐(MTT、WST-1、XTT 等)和雷萨祖林。此类别还包括利用荧光素评估 ATP 水平的发光检测。这种类型的分析有其潜在的限制,即它们正在测量细胞代谢,这本身不是细胞生存能力。细胞在不利条件下变得静止是很常见的,但仍保留分裂3、4、5的能力。例如,癌症干细胞通常相对代谢静默6,7,8,9,并且很可能很难使用这些技术进行检测。损害线粒体功能的治疗的有效性,如大多数米托坎,也可能被大大高估。
另一种方法利用各种物质的化学性质,允许它们交叉或不交叉生物膜。一个例子是核污渍,如SYTOX或碘化二甲(PI)。此类别还包括在概念上相似但功能不同的测定,如乳酸脱氢酶 (LDH) 测定,它测量 LDH 释放到细胞外环境作为细胞坏死的指标(图1,表 1)。这些测定更能够区分代谢不活跃细胞和死细胞。
| 检测/染色 | 检测到的细胞死亡类型 | 必要设备 | 主要功能 |
| MTT, CKK-8, 阿拉玛蓝 (雷萨祖林) | 凋亡/坏死 | 分 光 光度计 | 价格便宜,速度快;端点测定;依赖于酶的活性(在MTT的情况下完全线粒体),并且不区分细胞死亡模式1,10 |
| LDH 版本 | 坏死 | 分 光 光度计 | 快速,独立于线粒体酶的活性;高通量测试费用昂贵;检测坏死细胞与复合血浆膜11,12 |
| 试盘蓝色 (TB) | 凋亡/坏死 | 显微镜 | 细胞不渗透剂;不区分细胞死亡模式;劳动,不适合高通量筛选;更难与粘附细胞一起使用;容易对用户的主观判断,但被认为是标准细胞生存能力测量方法13 |
| 阿克里丁橙 (AO) | 凋亡/坏死/ | 荧光显微镜 | 具有独特光谱特性的核酸染料,可区分凋亡和坏死/坏死14 |
| 坏死 | |||
| 霍赫斯特 33342, 达皮 | 凋 亡 | 荧光显微镜或流动环流仪 | 细胞渗透;不宜自己监测细胞死亡;有用的共同染色;可用于评估早期凋亡中的染色质凝结和核分裂;可与碘化丙二基配对,以区分凋亡与坏死15,16 |
| 碘化(PI) | 晚期凋亡/坏死 | 荧光显微镜或流动环流仪 | 细胞不渗透的干扰器;检测细胞死亡的晚期凋亡和坏死模式17。长期孵育后有毒和可渗透18 |
表1.细胞毒性测定列表。细胞毒性测定,其中一些用于本研究,列及其主要特征的简要描述。
最近的研究表明,线粒体代谢在一些癌症中改变19,20,21,22,23,24,25。例如,急性骨髓性白血病(AML)已被证明可调节其线粒体质量、mtDNA含量和线粒体呼吸,以满足其能量需求19、26、27。另一方面,一些实体肿瘤的特点是线粒体功能障碍,或者更确切地说是"代谢重新编程",如对涉及OXPHOS的线粒体蛋白的降低调节或mtDNA含量降低,这一点与肿瘤侵入性、转移性潜力和抗凋亡诱导药物28、29有关。此外,最近,人们对于使用影响线粒体功能的机械多样化化合物(通常称为米托坎30)作为特定癌症的潜在疗法的兴趣也日益增加。这些药物针对ATP合成,线粒体DNA,OXPHOS和ROS生产,以及亲凋亡和抗凋亡蛋白相关的线粒体30,31。多项研究表明,这种方法有显著的希望19,32,33,34。然而,这些代谢偏差在癌细胞生物学或线粒体靶向治疗可能会显著影响传统的生存能力测定,基于线粒体功能。
这里介绍了差分核染色测定的优化方案。该协议允许快速和准确地测定米托坎的细胞毒性或它们与其他化合物的组合。Hoechst 33342 是一种细胞渗透性核染料,它很容易穿过细胞膜来染色 DNA,从而获得细胞总数。通过与只进入死细胞核的PI共同染色,可以准确确定活细胞(仅霍赫斯特)和死细胞(两者染色)的比例。该协议通过添加一个步骤来优化染料浓度(通过用正交 trypan 蓝色方法交叉引用结果)和在成像前离心板来优化已发布的测定35。 由于许多细胞系是半粘附的或悬浮的,离心会增加图像化的细胞比例,并显著提高精度。该检测有几个优点,包括染色不需要去除介质或洗涤。染料混合物价格低廉,易于准备,并且与多通道/机器人移液系统兼容。
细胞被染色后,用自动显微镜成像。这还有一个好处,即创建图像的永久记录,以后可以重新分析,并且可以通过对捕获的图像进行目视检查来重新评估特定化合物的效果。获得图像后,可以手动或使用多个软件包中的任何一个进行计数,包括免费(例如,ImageJ、CellProfiler 等)和商业软件(例如,变形、Gen5 等)。自动细胞计数通常更可取,因为正确开发的自动细胞计数管道比手动计数更准确,偏置更少。它们还更有效地忽略细胞碎片或不溶性复合物。这些管道的开发通常很简单,并且被使用的污渍的效率简化。输出是定量的,因为死细胞的实际数量是自动计算的总细胞数,并且可以应用不同的阈值来增加或减少检测35 的串数。为方便起见,包括使用 Gen5 v. 3.00 软件兼容 Cytation 5 细胞成像多模式读取器计算细胞的优化参数。
研究方案
1. 细胞毒性测定:设置
- 在适当的介质(无血清或 1、2.5 或 5% FBS RPMI-1640)中,以所需浓度准备感兴趣的化合物溶液。
- 要测量单个化合物的细胞毒性(例如,确定有效剂量),以2倍的最终浓度准备化合物。
- 要测量化合物组合的细胞毒性,以4倍的最终浓度准备化合物。
- 通过将相同数量的溶剂与适当的介质混合,准备仅溶剂控制。例如,如果测试化合物溶解在DMSO和甲醇中,则对每种溶剂进行溶剂控制。
- 从培养皿或烧瓶中收集细胞,放入15 mL锥形管中。
- 将 10 μL 的细胞悬浮液转移到微离心管中,用 10 μL 0.4% 的锥板蓝色染色。使用血细胞计计算每个细胞源的可行和非可行细胞。
- 200 g的颗粒 细胞 5 分钟。吸气或去味上一杯。
- 在3*105 细胞/mL的细胞密度下,在测定合适的介质中重新释放细胞颗粒(无血清或1,2.5,5%FBS RPMI-1640)。
注1:细胞密度为3*105 细胞/mL,提供15,000个细胞/井的播种密度。播种密度是一个重要的参数,最好在实验前预先定义。播种密度应考虑 1) 细胞大小 – 通常较大的细胞以较低的密度播种;2) 治疗持续时间 – 细胞通常以较低的密度播种,用于持续更长时间的实验;3) 细胞分裂率 – 分裂率较高的细胞以较低的密度播种。优化播种密度的具体示例:K562细胞,较大,24小时持续时间 = 10,000 个细胞/井;MOLM-13细胞,中等大小,24小时治疗=15,000/井;MOLM-13细胞,48小时治疗=8,000/井;小健康外周血单核细胞(PBMC),24小时治疗=50,000/井;原发性 AML 细胞,24 小时治疗 = 15,000-20,000/well。
注2:介质中FBS的存在可能会影响化合物的活性。降低FBS的浓度可以使检测结果解释更简单,但也降低了生理精度。 - 使用多通道移液器将细胞悬浮液从步骤 1.5 移入 96 井板的每个井的种子 50 μL。
- 添加化合物如下:
- 对于单化合物测定,将50μL的2x化合物溶液加入到每个井中。对于溶剂控制井,以 2 倍浓度加入 50 μL 含有溶剂的测试介质。
- 对于组合测定,将每种化合物的25μL(4x溶液)添加到每一个井中。对于单一化合物控制井,加入25μL的4x复合溶液和25μL的测试介质。对于溶剂控制井,加入50μL的测试介质或含有溶剂的测试介质。
注1:DMSO的最终浓度不应超过0.5%。
注2:建议添加含有化合物的介质,由于体积小,移液器接触每一个井壁。
- 轻轻敲击板,以确保混合井内装物。
- 在37°C的加湿5%CO2大气中孵 育板,适当时间,例如24小时。
2. 细胞毒性测定:用霍赫斯特33342和碘化物的染色
- 准备 10 倍染色溶液。此解决方案需要在每个实验之前进行新鲜准备,无法存储。最终染料浓度应在实验前确定。
- 对于白血病细胞系和原发性白血病细胞,1 mL 的 10 倍染色缓冲液含有 10 μL 的 20 mM Hoechst 33342 和 50 μL 的 1 mg/mL 碘化二丁二烯(最终浓度:Hoechst 33342 20 μM,PI 5 μg/mL)。
- 对于健康的 PBMC,1 mL 的 10 倍染色缓冲液含有 10 μL 的 20 mM Hoechst 33342 和 10 μL 的 1 mg/mL 碘化二甲二丁烷(最终浓度:Hoechst 33342 20 μM,PI 1 μg/mL)。
注:在实验前,必须确定碘化丙胺的最终浓度。应使用 PI 浓度范围(1、2.5、5 μg/mL)对细胞进行测试,然后将 Hoechst/PI 计算的可行性与通过 trypan Blue 测量的生存能力进行比较。上面列出的 PI 浓度是根据培养基控制井中的目标细胞生存能力选择的(白血病细胞系高于 ±90%,健康 PBMC 高于 ±70%)。
注意:Hoechst 33342 和碘化丙二是潜在的致癌物质。处理时,请穿戴适当的个人防护设备。
- 孵育后,使用多通道移液器向每井添加10μL的10倍染色缓冲液。
注:为防止交叉污染,请确保移液器尖端不接触介质。 - 轻轻敲击板以混合并清除气泡。在37°C下染色15分钟。
- 将板在200克下 离心4分钟,将所有电池带到板的底部。小心地用潮湿的金擦拭板的底部,以去除会干扰成像的纤维和/或碎屑。
注1:板的离心确保了图像中捕获所有细胞的最高机会。通常死细胞会分离和浮点,提供细胞毒性的误导性值。离心可减轻这种影响。
注2:离心后,最好在15分钟内对板进行成像。离心可以降低PI染色的选择性,并可能使细胞慢慢产生碘化丙二。通过可视化死细胞获得的精度的提高超过了 PI 染色的轻微增加。建议在离心后 1 小时内完成成像。
3. 细胞毒性测定:数据采集
- 为自动显微镜/板成像器设置软件,以检测 Hoechst 33342(激发最大 350 nm、发射最大 461 nm)和 PI(激发最大 493 nm,发射最大 636 nm)的荧光。在两个通道中获取每一个井的图像。
- 使用该软件(如 CellProfiler,基于 MatLab http://cellprofiler.org/、ImageJ 或专有软件(如 Gen5)的免费图像分析工作室可对每个通道中每个井中的细胞进行计数。
注:由于每个细胞都应沾染 Hoechst 33342,死细胞应沾染 PI,因此死细胞与所有细胞的比例代表死亡细胞的分数。例如,如果未经处理的样本中的自动计数显示 467 个沾染 PI(死细胞)的细胞和 2335 个沾染 Hoechst 33342(总细胞)的细胞,则死馏分数为 0.2 或 20%。然后将此值与使用治疗的相同处理样本进行比较。 - 使用 Cytation5 细胞成像多模式读卡器和 Gen5 v. 3.00 软件对 Hoechst/PI 数据采集的详细说明:
- 将 Cytation5 多模板读取器/成像器设置为在平底、96 孔、通用黑色塑料板中成像细胞。
- 设置映像协议以利用标准 DAPI 和德州红色滤波器集。使用 4 倍放大目标在井中心拍摄图像。不使用偏移量(X/Y 或 Z)。使用以下成像设置:DAPI + LED - 10,集成时间 - 99,增益 - 0;德州红 + LED - 8,集成时间 - 950,增益 - 18。使用 DAPI 信号执行自动对焦;在通道之间聚焦时不应有偏移。
- 使用 Gen5 软件 v 3.00 执行图像分析。在软件设置中,将单元格定义为大小介于 5 到 25 μm 之间的形状。通过打开特殊选项"拆分接触对象"来排除主边缘对象和拆分触摸对象。 接下来,处理图像以删除背景(深色背景减法),应用核掩码(阈值 DAPI >= 6000 AU),并计算对象。根据 PI 染色(阈值德州红 >= 5000 AU)执行子填充分析,并计算对象。细胞生存能力 % 定义为 (1 -
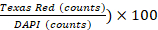 .
.
结果
上述协议是使用OCI-AML2细胞开发的,该细胞作为具有代表性的急性骨髓性白血病细胞系。AML的特点是骨髓26中未分化和非功能性造血细胞的异常增殖。尽管 AML 靶向治疗最近有所发展,但护理标准几十年来一直保持不变,包括诱导疗法(通常包括三天的环丙氨酸,例如,多诺鲁比辛、伊达鲁比辛或安赛迪翁尼米托桑特龙,以及7天的环丙氨酸),然后是整合(通常包括环丙氨酸治疗...
讨论
尽管 Hoechst/PI 细胞毒性测定的协议是可靠的,需要相对少的动手时间,但有几个实验细节对于确保准确结果非常重要。首先,必须确保DMSO浓度低于0.5%(v/v)。人们普遍认为,即使低剂量的DMSO暴露也可以显著改变细胞的形态和附着,并显著延迟细胞周期进展39,40。
第二,在治疗后应尽快进行染色。由于没有洗涤步骤,化合物留在?...
披露声明
作者没有什么可透露的。
致谢
NVK,癌症研究的CPRIT学者,感谢德克萨斯癌症预防和研究所(CPRIT)的慷慨支持,CPRIT授予RR150044。这项工作还得到了韦尔奇基金会研究赠款C-1930和国家卫生研究院R35 GM129294授予NVK的支持。资助者在研究设计、数据收集和分析、决定出版或准备手稿方面没有作用。
材料
| Name | Company | Catalog Number | Comments |
| 2-Deoxy-D-glucose/2-DG | Chem-Impex | 50-519-067 | |
| 3-bromo-pyruvate | Alfa Aesar | 1113-59-3 | |
| 96-Well plates | Greiner Bio-One | 655090 | Black or clear flat-bottomed 96-well plates |
| Alamar blue HS cell viability reagent (100mL) | Thermo Fisher | A50101 | |
| Countess II automated cell counter | Thermo Fisher | ||
| Cytation 5 Cell Imaging Multi-Mode Reader | BioTek | ||
| Hoechst 33342 | Thermo Fisher | 62249 | 20 mM solution; final concentration 1:1,000 |
| HyClone fetal bovine serum | GE Healthcare | #25-514 | |
| m-chlorophenylhydrazone/CCCP | Sigma Aldrich | C2759 | |
| PBS tablets | Thermo Fisher | BP2944100 | 1 tablet + 200 mL of sterile water = 1x PBS solution |
| Penicillin-Streptomycin-Glutamine (100X) | Gibco | 10378016 | |
| Pierce LDH assay kit | Thermo Fisher | 50-103-5952 | |
| Propidium Iodide | Thermo Fisher | 50-596-072 | Dry powder; stock 1 mg/mL in PBS; final concentration 5 µg/mL (leukemia cells), 1 µg/mL (normal PBMCs) |
| Rotenone | Ark Pharm | AK115691 | |
| RPMI-1640 Medium With L-glutamine and sodium bicarbonate, liquid, sterile-filtered, suitable for cell culture | Sigma Aldrich | R8758-500ML | |
| Thiazolyl blue tetrazolium bromide | ACROS Organics | AC158990010 | |
| Trypan blue stain (0.4%) | Gibco | 15250-061 | |
| Cell lines | |||
| K562 | ATCC | CCL-243 | CML cell line |
| MOLM-13 | ATCC | AML cell line | |
| MOLT-4 | ATCC | CRL-1582 | ALL cell line |
| OCI-AML2 | ATCC | AML cell line |
参考文献
- Ramirez, C. N., Antczak, C., Djaballah, H. Cell viability assessment: toward content-rich platforms. Expert Opinion on Drug Discovery. 5 (3), 223-233 (2010).
- Melzer, S., et al. Trypan blue as an affordable marker for automated live-dead cell analysis in image cytometry. Scanning. 38 (6), 857-863 (2016).
- Sikora, E., Mosieniak, G., Sliwinska, M. A. Morphological and Functional Characteristic of Senescent Cancer Cells. Current Cancer Drug Targets. 17 (4), 377-387 (2016).
- Coppé, J. P., Desprez, P. Y., Krtolica, A., Campisi, J. The senescence-associated secretory phenotype: the dark side of tumor suppression. Annual Review of Pathology. 5, 99-118 (2010).
- Castro-Vega, L. J., et al. The senescent microenvironment promotes the emergence of heterogeneous cancer stem-like cells. Carcinogenesis. 36 (10), 1180-1192 (2015).
- Weihua, Z., Lin, Q., Ramoth, A. J., Fan, D., Fidler, I. J. Formation of solid tumors by a single multinucleated cancer cell. Cancer. 117 (17), 4092-4099 (2011).
- Osisami, M., Keller, E. T. Mechanisms of Metastatic Tumor Dormancy. Clinical Medicine. 2 (3), 136-150 (2013).
- Zhang, S., et al. Generation of cancer stem-like cells through the formation of polyploid giant cancer cells. Oncogene. 33 (1), 116-128 (2014).
- Mittal, K., et al. Multinucleated polyploidy drives resistance to Docetaxel chemotherapy in prostate cancer. British Journal of Cancer. 116 (9), 1186-1194 (2017).
- McKeague, A. L., Wilson, D. J., Nelson, J. Staurosporine-induced apoptosis and hydrogen peroxide-induced necrosis in two human breast cell lines. British Journal of Cancer. 88 (1), 125-131 (2003).
- Kaja, S., et al. An optimized lactate dehydrogenase release assay for screening of drug candidates in neuroscience. Journal of Pharmacological and Toxicological Methods. 73, 1-6 (2015).
- Chan, F. K., Moriwaki, K., De Rosa, M. J. Detection of necrosis by release of lactate dehydrogenase activity. Methods in Molecular Biology. 979, 65-70 (2013).
- Piccinini, F., Tesei, A., Arienti, C., Bevilacqua, A. Cell Counting and Viability Assessment of 2D and 3D Cell Cultures: Expected Reliability of the Trypan Blue Assay. Biological Procedures Online. 19, 8 (2017).
- Plemel, J. R., et al. Unique spectral signatures of the nucleic acid dye acridine orange can distinguish cell death by apoptosis and necroptosis. Journal of Cell Biology. 216 (4), 1163-1181 (2017).
- Galluzzi, L., et al. Guidelines for the use and interpretation of assays for monitoring cell death in higher eukaryotes. Cell Death & Differentiation. 16 (8), 1093-1107 (2009).
- Cummings, B. S., Schnellmann, R. G. Measurement of cell death in mammalian cells. Current Protocols in Pharmacology. , (2004).
- Brauchle, E., Thude, S., Brucker, S. Y., Schenke-Layland, K. Cell death stages in single apoptotic and necrotic cells monitored by Raman microspectroscopy. Scientific Reports. 4, 4698 (2014).
- Chiaraviglio, L., Kirby, J. E. Evaluation of impermeant, DNA-binding dye fluorescence as a real-time readout of eukaryotic cell toxicity in a high throughput screening format. Assay and Drug Development Technologies. 12 (4), 219-228 (2014).
- Panina, S. B., Baran, N., Brasil da Costa, F. H., Konopleva, M., Kirienko, N. V. A mechanism for increased sensitivity of acute myeloid leukemia to mitotoxic drugs. Cell Death & Disease. 10 (8), 617 (2019).
- Caro, P., et al. Metabolic signatures uncover distinct targets in molecular subsets of diffuse large B cell lymphoma. Cancer Cell. 22 (4), 547-560 (2012).
- Lagadinou, E. D., et al. BCL-2 inhibition targets oxidative phosphorylation and selectively eradicates quiescent human leukemia stem cells. Cell Stem Cell. 12 (3), 329-341 (2013).
- Senft, D., Ronai, Z. A. Regulators of mitochondrial dynamics in cancer. Current Opinion in Cell Biology. 39, 43-52 (2016).
- Vazquez, F., et al. PGC1α expression defines a subset of human melanoma tumors with increased mitochondrial capacity and resistance to oxidative stress. Cancer Cell. 23 (3), 287-301 (2013).
- Caino, M. C., Altieri, D. C. Cancer cells exploit adaptive mitochondrial dynamics to increase tumor cell invasion. Cell Cycle. 14 (20), 3242-3247 (2015).
- Ralph, S. J., Rodríguez-Enríquez, S., Neuzil, J., Saavedra, E., Moreno-Sánchez, R. The causes of cancer revisited: "mitochondrial malignancy" and ROS-induced oncogenic transformation - why mitochondria are targets for cancer therapy. Molecular Aspects of Medicine. 31 (2), 145-170 (2010).
- Kreitz, J., et al. Metabolic Plasticity of Acute Myeloid Leukemia. Cells. 8 (8), (2019).
- Sriskanthadevan, S., et al. AML cells have low spare reserve capacity in their respiratory chain that renders them susceptible to oxidative metabolic stress. Blood. 125 (13), 2120-2130 (2015).
- Guerra, F., et al. Mitochondrial Dysfunction: A Novel Potential Driver of Epithelial-to-Mesenchymal Transition in Cancer. Frontiers in Oncology. 7, 295 (2017).
- Guerra, F., Arbini, A. A., Moro, L. Mitochondria and cancer chemoresistance. Biochimica et Biophysica Acta. 1858 (8), 686-699 (2017).
- Neuzil, J., Dong, L. F., Rohlena, J., Truksa, J., Ralph, S. J. Classification of mitocans, anti-cancer drugs acting on mitochondria. Mitochondrion. 13 (3), 199-208 (2013).
- Ubah, O. C., Wallace, H. M. Cancer therapy: Targeting mitochondria and other sub-cellular organelles. Current Pharmaceutical Design. 20 (2), 201-222 (2014).
- Yamaguchi, R., et al. Efficient elimination of cancer cells by deoxyglucose-ABT-263/737 combination therapy. PLoS One. 6 (9), 24102 (2011).
- Hahn, T., et al. Use of anti-cancer drugs, mitocans, to enhance the immune responses against tumors. Current Pharmaceutical Biotechnology. 14 (3), 357-376 (2013).
- Panina, S. B., Pei, J., Baran, N., Konopleva, M., Kirienko, N. V. Utilizing Synergistic Potential of Mitochondria-Targeting Drugs for Leukemia Therapy. Frontiers in Oncology. 10, 435 (2020).
- Lema, C., Varela-Ramirez, A., Aguilera, R. J. Differential nuclear staining assay for high-throughput screening to identify cytotoxic compounds. Current Cellular Biochemistry. 1 (1), 1-14 (2011).
- Döhner, H., et al. Diagnosis and management of acute myeloid leukemia in adults: recommendations from an international expert panel, on behalf of the European LeukemiaNet. Blood. 115 (3), 453-474 (2010).
- Heinz, S., et al. Mechanistic Investigations of the Mitochondrial Complex I Inhibitor Rotenone in the Context of Pharmacological and Safety Evaluation. Scientific Reports. 7, 45465 (2017).
- Fan, T., et al. Tumor Energy Metabolism and Potential of 3-Bromopyruvate as an Inhibitor of Aerobic Glycolysis: Implications in Tumor Treatment. Cancers (Basel). 11 (3), (2019).
- Pal, R., Mamidi, M. K., Das, A. K., Bhonde, R. Diverse effects of dimethyl sulfoxide (DMSO) on the differentiation potential of human embryonic stem cells. Archives of Toxicology. 86 (4), 651-661 (2012).
- Tunçer, S., et al. Low dose dimethyl sulfoxide driven gross molecular changes have the potential to interfere with various cellular processes. Scientific Reports. 8 (1), 14828 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。