A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
القياس الكمي لمدون المغذيات الكبيرة في شاشة عصبية حرارية جينية باستخدام يرقات دروسوفيلا
In This Article
Erratum Notice
Summary
الموصوف هنا هو بروتوكول يمكن من القياس الكمي اللوني لكمية الطعام التي تؤكل في غضون فترة زمنية محددة من قبل يرقات Drosophila melanogaster المعرضة لأنظمة غذائية ذات جودة مختلفة من المغذيات الكبيرة. يتم إجراء هذه المقايسات في سياق شاشة عصبية حرارية.
Abstract
تسمح سلوكيات الأعلاف والتغذية للحيوانات بالوصول إلى مصادر الطاقة والمواد المغذية الضرورية لتطورها وصحتها وملاءمتها البدنية. التحقيق في تنظيم الخلايا العصبية من هذه السلوكيات أمر ضروري لفهم الآليات الفسيولوجية والجزيئية الكامنة وراء التوازن الغذائي. إن استخدام نماذج حيوانية قابلة للسحب وراثيا مثل الديدان والذباب والأسماك يسهل إلى حد كبير هذه الأنواع من الدراسات. في العقد الماضي، ذبابة الفاكهة Drosophila melanogaster وقد استخدمت كنموذج قوي من قبل علماء الأعصاب التحقيق في السيطرة العصبية من التغذية وسلوكيات الأعلاف. في حين أن قيمة بلا شك، معظم الدراسات دراسة الذباب الكبار. هنا ، نصف بروتوكولا يستفيد من الجهاز العصبي اليرقات الأبسط للتحقيق في الركائز العصبية التي تتحكم في سلوكيات التغذية عندما تتعرض اليرقات للوجبات الغذائية المختلفة في محتواها من البروتين والكربوهيدرات. تستند أساليبنا على فحص التغذية الكمي الملون بدون اختيار ، الذي يتم إجراؤه في سياق شاشة تنشيط حراري عصبي. كمقروءة ، تم استخدام كمية الطعام التي تأكلها اليرقات على مدى فترة ساعة واحدة عند التعرض لأحد الوجبات الغذائية الثلاثة المسماة بالصبغة التي تختلف في نسب البروتين إلى الكربوهيدرات (P:C). ويتضح فعالية هذا البروتوكول في سياق شاشة عصبية جينية في Drosophilaاليرقات , من خلال تحديد المجموعات العصبية المرشح تنظيم كمية الطعام تؤكل في الوجبات الغذائية من نوعية المغذيات الكبيرة المختلفة. كما تمكنا من تصنيف وتجميع الأنماط الجينية التي تم اختبارها في فصول فينوتبيك. وإلى جانب استعراض موجز للأساليب المتاحة حاليا في المؤلفات، تناقش مزايا هذه الأساليب وحدودها، كما تقدم بعض الاقتراحات بشأن كيفية تكييف هذا البروتوكول مع تجارب محددة أخرى.
Introduction
تعتمد جميع الحيوانات على نظام غذائي متوازن للحصول على الكميات الضرورية من المواد الغذائية للبقاء والنمو والتكاثر1. يتأثر اختيار ما وكمية الطعام بالعديد من العوامل المتفاعلة المتعلقة بحالة الحيوان الداخلية ، مثل مستوى الشبع ، والظروف البيئية ، مثل جودة الطعام2و3و 4و5. البروتين والكربوهيدرات هما المغذيات الكبيرة الرئيسية وتناولها متوازن ضروري للحفاظ على العمليات الفسيولوجية للحيوانات. لذلك ، فإن فهم الآليات العصبية التي تتحكم في سلوكيات التغذية والحفاظ على كمية متوازنة من هذه المغذيات الكبيرة أمر وثيق الصلة للغاية. وذلك لأن سمات تاريخ الحياة مثل العمر، والبراز، والصحة الأيضية تتأثر مباشرة بمستويات تناول البروتين6،7،8،9،10.
إن استخدام كائنات أبسط أكثر قابلية للسحب تظهر عادات تغذية محفوظة تطوريا مع الحيوانات المعقدة، بما في ذلك الثدييات، أمر ضروري لهذا النوع من الدراسات. والأهم من ذلك أن هذه النماذج الحيوانية الأبسط توفر فرصة جيدة لتشريح الأسئلة البيولوجية المعقدة في سياق مكلف وأخلاقي وتقني أكثر فعالية. في العقود الأخيرة ، كان Drosophila، مع مجموعة أدواته الجينية القوية ، والسلوك المعقد والنمطي والهندسة المعمارية المحفوظة لآليات استشعار المحيطية والمغذيات مع الثدييات ، نموذجا مثمرا لعلماء الأعصاب السلوكية11. في نهاية المطاف ، والأمل هو أنه من خلال فهم كيفية تنظيم تناول الطعام في هذا الحيوان ، مع أبسط جهاز عصبي ، يمكننا بعد ذلك البدء في فك الأعطال العصبية الكامنة وراء اضطرابات الأكل البشرية.
تعتمد دراسة الركائز العصبية لسلوكيات التغذية بشكل عميق على القدرة على قياس تناول الحيوانات الغذائي في وقت واحد مع التلاعب بنشاطها العصبي. نظرا للكميات الدنيا من الطعام الذي يتم تناوله ، فإن تحديد كمية الطعام الذي يأكله الذباب أمر صعب للغاية ، وجميع الطرق المتاحة حاليا تمثل قيودا كبيرة. وبالتالي ، فإن معيار الذهب هو استخدام مزيج من المنهجيات التكميلية12. الذباب البالغ كان مفضلا تاريخيا كنموذج وراثي وسلوكي. ومع ذلك ، تقدم يرقات Drosophila أيضا فرصا للتحقيق في الركائز العصبية التي ترميز سلوك التغذية. الجهاز العصبي المركزي اليرقات (CNS)، مع حوالي 12،000 الخلايا العصبية، هو أقل تعقيدا بكثير من الكبار، الذي يحتوي على ما يقرب من 150،000 الخلايا العصبية. هذا التعقيد الأدنى ليس فقط عدديا ولكنه وظيفي أيضا ، نظرا لأن سلوكيات اليرقات تعتمد على وظائف قاطرة أبسط وأنظمة حسية. على الرغم من البساطة الواضحة لأنظمتها العصبية ، لا تزال اليرقات تظهرسلوكياتتغذية كاملة ، وقد تم وصف بعض الطرق لقياس ابتلاع الطعام في يرقات Drosophila 5و13و14و15. من خلال الاقتران مع التلاعب في نشاط الخلايا العصبية ، يمكن أن تشكل يرقات Drosophila نموذجا قابلا للسحب للغاية لفهم التنظيم العصبي لتناول الطعام.
يقدم هنا بروتوكول مفصل لتحديد كمية تناول الطعام في اليرقات المعرضة لأنظمة غذائية ذات جودة مغذيات كبيرة مختلفة. اختلفت الوجبات الغذائية، التي تسمى الوجبات الغذائية لتحقيق التوازن بين المغذيات الكبيرة، في محتويات البروتين والكربوهيدرات، وتحديدا فيما يتعلق بنسب البروتين إلى الكربوهيدرات (P:C): 1:1 (النظام الغذائي الغني بالبروتين)، و 1:4 (النظام الغذائي المتوسط)، و 1:16 (النظام الغذائي الفقير بالبروتين)، كما هو موضح في الشكل 1A. باختصار، تم إنشاء فحص التغذية الكمي بدون خيار باستخدام هذه الوجبات الغذائية الثلاثة القائمة على السكروز (SY) المصبوغة بصبغة غذائية زرقاء. لأن استخراج الخميرة والسكروز كانت تستخدم كمصادر البروتين والكربوهيدرات، وكلاهما يحتوي على الكربوهيدرات، تم الحصول على الاختلاف في نسب P:C عن طريق تغيير توازن هذين العنصرين، كما هو موضح سابقا16 وكما هو مبين في الشكل 1B. تتوفر نظرة عامة تخطيطية للبروتوكول، تظهر الخطوات التجريبية الرئيسية، في الشكل 2.
تم إنشاء هذا البروتوكول بهدف التحقيق في دور مجموعات معينة من الخلايا العصبية على تنظيم مستويات تغذية اليرقات في الوجبات الغذائية ذات نسب P:C المختلفة وفي سياق شاشة الخلايا العصبية الحرارية. تم استخدام أداة عصبية وراثية تتميز بشكل جيد من عائلة إمكانات المستقبلات العابرة (TRP): قناة Drosophila Transient Receptor Potential (dTRPA1) ، وهي قناة تسيؤ ذات درجة حرارة وبطرة ، مما يسمح بإطلاق إمكانات العمل عندما ترتفع درجات الحرارة المحيطة فوق 25 درجة مئوية17. للتعبير عن تحويل dTRPA1 ، استفدنا من خطوط Gal4 القائمة على المناطق التنظيمية لرابطة الدول المستقلةمن جينوم Drosophila ، الذي أنشئ في مختبر روبن ، في سياق مشروع FlyLight في حرم أبحاث Janelia18،19.
على الرغم من أن البروتوكول، هنا وصفها، وقد أنشئت في سياق شاشة التنشيط، فإنه يمكن تكييفها بسهولة من قبل المجرب لاحتياجات محددة أخرى أو المصالح، وهي لأداء شاشة قمع باستخدام حساسة لدرجة الحرارة الخلايا العصبية كاتم الصوت ShibireTS20،بدلا من dTRPA1. وتناقش هذه المواءمة وغيرها في أقسام البروتوكول والمناقشة.
Protocol
1. إعداد الوجبات الغذائية السكروز الخميرة (SY)
- وزن جميع المكونات الجافة (أجار، الخميرة، السكروز) لتحقيق التوازن بين المغذيات الكبيرة والوجبات الغذائية L3 تربية. الكميات بالجرام لكل مكون من المكونات اللازمة لإعداد 1 لتر من الطعام مبينة في الشكل 1B.
ملاحظة: خذ في الاعتبار أن هناك حاجة إلى ما يقرب من 13 مل من المواد الغذائية لملء طبق بيتري 60 ملم. - حل جميع المكونات في الماء المقطر العقيم (استخدام ما يقرب من 50٪ من إجمالي حجم المياه اللازمة لإعداد الطعام) ويحرك المتوسط لمدة 5-10 دقيقة.
- الأوتوكلاف لمدة 50 دقيقة.
- بعد السماح للوسط لتهدئة, إضافة حلول حمض نيباجين وبروبوينيك إلى الوجبات الغذائية, في تركيز النهائي (v/v) من 3٪ و 0.3٪, على التوالي. إلى الوجبات الغذائية موازنة المغذيات الكبيرة، إضافة صبغة الطعام الأزرق إلى تركيز النهائي (v/v) من 1٪. أكمل الكميات الإجمالية بالماء المقطر.
- صب بعناية الوجبات الغذائية إلى أطباق بيتري 60 ملم، بحيث كمية الطعام سكب هو نفسه تقريبا في كل واحد من لوحات. تسمية لوحات مع نسب P:C من الوجبات الغذائية.
ملاحظة: إعداد الوجبات الغذائية موازنة المغذيات الكبيرة في يوم الفحص التغذية. إذا لم يكن ذلك ممكنا، وتخزين الوجبات الغذائية المعدة في 4 درجة مئوية، في حاوية مختومة، لمدة أقصاها 3 أيام. فترات التخزين الأطول تجعل النظام الغذائي جافا وصعبا جدا ، ولا يمكن لليرقات أن تحفر في الوسط.
2. الصليب الوراثي للخطوط الأبوية
ملاحظة: استخدم Gal4/UAS النظام21 لإعداد الصلبان الوراثية. في هذا البروتوكول، من أجل تنشيط وظيفة الخلايا العصبية في مجموعات معينة من الخلايا العصبية، استخدمت العذارى الإناث من خط DTRPA1 UAS17 وعبرت إلى الذكور من خطوط جانيليا Gal4 (الشكل 2A). كانت السيطرة الجينية المستخدمة هي ذرية الصليب بين خط dTRPA1 وخط "GAL4 الفارغ" ، الذي يحمل Gal4 في المتجه المستخدم لتوليد مجموعة روبن Gal4 ولكن بدون وجود جزء تنظيمي (attP2)22. لتعزيز قمع الخلايا العصبية، يمكن استخدام خط UAS ترميز ShibireTS20، بدلا من dTRPA1.
- إعداد أقفاص جمع الأجنة 60 ملم مع لوحات النظام الغذائي L3 تربية، تكملها مع بعض عجينة الخميرة النشطة.
- نقل الكبار UAS dTRPA1 أنثى العذارى والذكور جانيليا Gal4، الذين تتراوح أعمارهم بين 5-8 أيام، إلى أقفاص جمع الأجنة والسماح للتزاوج أن يحدث لمدة 24-48 ساعة، في 25 درجة مئوية، مع 60٪ الرطوبة ودورة 12:12 ضوء الظلام (الشكل 2A). بالنسبة لأقفاص جمع الأجنة مقاس 60 مم، استخدم حوالي 100 أنثى عذراء و30 ذكرا لكل صليب.
- في نهاية فترة التزاوج، قم بإزالة وتخلص من لوحات النظام الغذائي للتربية L3 المستخدمة في الصلبان الوراثية. استبدالها لوحات النظام الغذائي L3 تربية الطازجة، من أجل تنفيذ يضع البيض والتدريج اليرقات.
3. إعداد يرقات النجم الثالث (L3)
- نقل الذباب الكبار تزاوج إلى لوحات النظام الغذائي الطازج L3 تربية والسماح لوضع البيض أن يحدث لمدة 3-4 ساعة، في 25 درجة مئوية (الشكل 2B). تأكد من أن جميع لوحات وصفت مع النمط الجيني، P: C نسبة النظام الغذائي وتاريخ وضع البيض.
ملاحظة: لتوفير الوقت، قم بوضع البيض مباشرة في نظام L3 الغذائي للتربية، والذي يتجنب التعامل مع البيض بشكل إضافي. في حالة الفحوصات الجينية الصغيرة الحجم ، يمكن الحصول على تحسين وضع البيض باستخدام لوحات عصير التفاح. - في نهاية فترة وضع البيض، قم بإزالة الصفائح من الأقفاص وتغطيتها بأغطية بلاستيكية. في حالة استخدام استخراج الخميرة لتكملة لوحات تربية L3، تأكد من إزالة جميع الخميرة المتبقية في نهاية وضع البيض. وهذا أمر مهم لتجنب التغذية غير الموحدة أثناء نمو اليرقات.
ملاحظة: يمكن نقل البالغين المتزاوجين إلى لوحات النظام الغذائي الطازجة L3 ، لذلك يتم إجراء المزيد من بويضات اليرقات ، ويمكن الحصول على المزيد من اليرقات التجريبية. يمكن إجراء وضع البيض المتتالي مع نفس البالغين خلال أسبوع عمل واحد كامل. - تقدير عدد البويضات لكل طبق والحفاظ على كثافة اليرقات إلى 200 جنين كحد أقصى لكل طبق. يمكن إجراء هذا التقدير عن طريق حساب عدد الأجنة في ربع اللوحة.
ملاحظة: ستؤخر الصفيحة المكتظة تطور اليرقات وتؤثر على سلوكيات تغذية اليرقات. - احتضان لوحات تربية L3 عند 18 درجة مئوية (درجة حرارة متساهلة) ، رطوبة 60 ٪ ودورة 12:12 ضوء الظلام ، والسماح لليرقات بالنمو لمدة 9 أيام(الشكل 2B).
- في اليوم التاسع بعد وضع البيض (AEL)، جمع ثلاث مجموعات من 10 L3 من كل من الأنماط الجينية (وللكرات المتماثلة) ليتم اختبارها. بالإضافة إلى ذلك، جمع مجموعات من 10 L3 للسيطرة على "الغذاء صفر صبغ". تأكد من أن جمع اليرقات يتم خلال فترات زمنية مكافئة من اليوم تستخدم للقيام وضع البيض (على سبيل المثال، إذا كان زرع البيض حدث بين 10am-2pm، وجمع اليرقات خلال نفس الفترة من الزمن 9 أيام AEL) ويتم تنفيذها، بلطف قدر الإمكان، وذلك باستخدام ملقط #5 أو ملقط وزن الريشة. نقل اليرقات مباشرة كما هو مبين في الخطوة التالية (3.6).
ملاحظة: "الغذاء صفر صبغ" السيطرة على الحيوانات هي اليرقات التي تعطى في المقايسة التغذية الغذاء دون صبغة زرقاء. هذه السيطرة ضرورية لإزالة امتصاص الخلفية من مقتطفات اليرقات. - نقل اليرقات التجريبية التي تم جمعها إلى قوارب وزن طبق بلاستيكي تحتوي على 1 مل من الماء. تأكد من جمع L3، وليس L2، باتباع التوجيهات الواردة في الشكل 3.
ملاحظة: من المهم جمع L3 إلى القوارب البلاستيكية التي تحتوي على الماء أو المالحة العازلة بالفوسفات (PBS) ، للحفاظ على رطوبة اليرقات جيدا قبل بدء فحص التغذية. وهذا أمر مهم بشكل خاص إذا تم جمع العديد من مجموعات L3 التجريبية من أنماط جينية مختلفة في نفس الوقت. تتبع أمر التحصيل لكل مجموعة، لذلك يتم تقليل الاختلافات في مدة الحرمان من الطعام لكل مجموعة. يسهل استخدام القوارب البلاستيكية في هذه الخطوة الخطوة الاختيارية 4.3 لأنها تمكن اليرقات من الطفو مباشرة في حمام الماء.
4. التنشيط الحراري والتغذية لا خيار المقايسة
ملاحظة: يوصى بإجراء فحوصات التغذية في نفس الوقت تقريبا من اليوم لتقليل الاختلافات المحتملة المتعلقة بالإيقاعات الإيقاعية. أيضا ، قم بتشغيل تجارب التحكم دائما (عبرت ذرية خط "Gal4 الفارغ" إلى UAS dTRPA1 ويرقات "الطعام الصفري الصبغة") ، بالتوازي مع الأنماط الجينية للاهتمام.
- إنشاء حاضنة إلى 30 درجة مئوية (درجة حرارة غير مسموح بها) والحفاظ على مستويات عالية من الرطوبة (65٪ على الأقل) لتجنب جفاف اليرقات أثناء الفحص.
- قبل البدء في فحص التغذية، يمكنك إعادة توازن درجة حرارة لوحات المقايسة عن طريق تسخينها عند 30 درجة مئوية لمدة 30 دقيقة.
- (اختياري) الحرارة صدمة اليرقات التجريبية لمدة 2 دقيقة في حمام الماء 37 درجة مئوية. تنفيذ هذه الخطوة مع الحيوانات في قوارب الوزن البلاستيك التي تحتوي على بعض الماء.
ملاحظة: الهدف من هذه الخطوة هو تكثيف تنشيط الخلايا العصبية من خلال تعزيز إطلاق الخلايا العصبية منذ بداية الفحص التغذية. - حافظ على ضبط الوقت المتعدد لمدة ساعة واحدة جاهزة. يعتمد عدد أجهزة ضبط الوقت التي سيتم استخدامها على عدد المجموعات التجريبية التي يتم اختبارها وعلى مستوى مهارة المجرب في التعامل مع اليرقات.
ملاحظة: استخدام أجهزة ضبط الوقت متعددة أمر بالغ الأهمية للحفاظ على مدة الفحص متناسقة لكافة الأنماط الجينية. - استنزاف بعناية المياه من القوارب البلاستيكية، وباستخدام فرشاة ناعمة مبللة، ونقل بلطف مجموعات L3 من القوارب إلى وسط لوحات المقايسة. ضع أغطية اللوحات مرة أخرى وابدأ جهاز توقيت لكل لوحة (أو مجموعة من اللوحات) للحفاظ على جلسات تغذية دقيقة 1 ساعة.
- السماح لليرقات لتغذية لمدة 1 ساعة، في 30 درجة مئوية، في الظلام(الشكل 2C).
ملاحظة: أداء المقايسة في الظلام مهم للسيطرة على الاختلافات في الإشارات البصرية عبر الوجبات الغذائية، كما سوف تختلف الوجبات الغذائية في نغمات، على الرغم من أنها تحتوي على نفس تركيز صبغة. - وقف المقايسة التغذية عن طريق نقل لوحات لحمام جليدي. اضغط أسفل الجليد قدر الإمكان لتوفير سطح مستقر للوحات.
ملاحظة: سوف تعزز درجات الحرارة الباردة نهاية التغذية عن طريق تثبيط سلوكيات التجشؤ والحفر. معظم اليرقات سوف تطفو على السطح لوحات الطعام بعد بضع دقائق، وتسهيل شفائهم في الخطوات التالية.
5. استخراج صبغة الطعام
- إعداد 2 مل الأنابيب الدقيقة لكل مجموعة من 10 L3 اختبار، تحتوي على ما يقرب من نفس الكميات من الخرز الزجاج 0.5 ملم (ما يكفي لملء الجزء السفلي من microtube) و 300 ميكرولتر من الميثانول الجليد الباردة. الحفاظ على microtubes في البرد، وذلك باستخدام برودة مقاعد البدلاء.
تحذير: الميثانول شديد الاشتعال والسامة. اتبع جميع إجراءات السلامة الموصى بها للتعامل مع هذا الكاشف، بما في ذلك العمل في منطقة جيدة التهوية وارتداء قفازات النتريل.
ملاحظة: استخدام الميثانول مهم لإصلاح عينات اليرقات وتجنب ردود الفعل الميلانة في الجلدية. - باستخدام #5 أو ملقط وزن الريشة، واستعادة بعناية مجموعات من 10 L3 من لوحات المقايسة التغذية ونقلها إلى أغطية لوحات المقايسة التي تحتوي على بعض الماء. شطف اليرقات لإزالة أي حطام غذائي على أجسامها أثناء التعامل بلطف مع اليرقات لتجنب أي إصابات. احتفظ بسجل لعدد اليرقات المستردة لكل نمط جيني لكل تكرار ، بحيث يمكن قياس متوسط كمية المداواة الغذائية لكل يرقة كميا.
ملاحظة: يجب التخلص من اليرقات المصابة لأنها ستكون قد قطعت الميلان ، كونها غير مناسبة للقياس الكمي للألوان. - نقل مجموعات L3 إلى 2 مل microtubes أعدت في 5.1.
- ليس أنسجة اليرقات لاستخراج صبغة الطعام من الأحشاء عن طريق طريقة تحلل ميكانيكية باستخدام lyzer الأنسجة والخرز الزجاجي المضافة في الخطوة 5.1. (إذا لم يكن الأنسجة lyzer متوفرة، استخدم الحشرات المتجانسة). بشكل تفضيلي، قم بتنفيذ هذه الخطوة عند 4 °C(الشكل 2D).
ملاحظة: تعتمد مدة هذه الخطوة على المعدات المستخدمة. باستخدام ليسر الأنسجة التقليدية، استخراج 1 دقيقة كافية. في حالة انقباضات الوقت، يمكن إيقاف البروتوكول مؤقتا في نهاية هذه الخطوة ثم المضي قدما لاحقا. تخزين العينات في -20 درجة مئوية. - نقل مقتطفات لتنظيف 1.5 مل الأنابيب الصغيرة، عن طريق عكس مباشرة الأنابيب الصغيرة 2 مل على الأنابيب الصغيرة 1.5 مل جديدة. إذا أجريت بلطف، فإن معظم الخرز الزجاجي يبقى في الجزء السفلي من الأنابيب الدقيقة 2 مل.
- إزالة الحطام الخلوي عن طريق الطرد المركزي مقتطفات، بأقصى سرعة لمدة 10 دقيقة، في 4 درجة مئوية.
- جمع supernatants لتنظيف 1.5 مل الأنابيب الدقيقة. إذا كان الحطام الخلوي لا يزال مرئيا في المضادات الفائقة، كرر الخطوتين 5.6 و5.7.
6. القياس الكمي للألوان لاستهلاك الأغذية
- إعداد حلول قياسية، لتوليد منحنى المعايرة، من خلال تنفيذ المسلسل 1:2 التخفيف في الميثانول من محلول صبغة زرقاء بدءا. كما فارغة، واستخدام الميثانول فقط. ويعتمد تركيز المعايير على مستويات تناول الحيوانات للغذاء.
ملاحظة: في حالة الشاشة التجريبية المعروضة هنا ، حيث تراوحت تركيزات الصبغة التي تم الحصول عليها لمستخلصات اليرقات من 0.02 إلى 1.93 ميكرولتر / مل ، تم استخدامه منحنى قياسي تم الحصول عليه عن طريق قياس امتصاص 8 تمييعات متسلسلة لمحلول صبغ أزرق 2 ميكرولتر / مل في الميثانول. إذا لزم الأمر، وزيادة أو تقليل تركيز هذه الحلول، اعتمادا على تركيز صبغة من العينات التجريبية. - نقل 100 ميكرولتر من العينات التجريبية (التي تم الحصول عليها في الخطوة 5.7) ، والمعايير والفارغة (الخطوة 6.1) إلى آبار لوحة صغيرة 96 جيدا وقياس الامتصاص في 600 نانومتر ، وذلك باستخدام قارئ لوحة(الشكل 2E). لإزالة امتصاص الخلفية ، قم بقياس امتصاص المستخلصات التي تم الحصول عليها من اليرقات التي تتغذى على الطعام دون صبغة زرقاء ك "صفر" لمستخلصات اليرقات ("التحكم الغذائي بدون صبغة).
- توليد منحنى قياسي وربط قيم الامتصاص التي تم الحصول عليها للعينات من كل مجموعة يرقات تجريبية مع كمية المداواة الغذائية (الحجم بال مل). ابحث عن متوسط استهلاك الغذاء لكل يرقة من خلال مراعاة عدد اليرقات التي تم جمعها لكل مجموعة في الخطوة 5.2
النتائج
تنظم يرقات Drosophila تناول البروتين على حساب تناول الكربوهيدرات الزائدة23 (مؤامرة تخطيطية في الشكل 2E). في الواقع، وقد لوحظ هذا تحديد أولويات تناول البروتين في العديد من الحيوانات الأخرى، ويسمى البروتين الاستفادة24،25.
Discussion
مع هذا البروتوكول ، يمكن للمرء اختبار قدرة اليرقات تحت تنشيط الخلايا العصبية الحرارية المحددة لتنظيم مستويات تناول البروتين والكربوهيدرات ، وهما مغذيات كبيرة ، عندما تتعرض لوجبات غذائية ذات تكوين P:C مختلف. تم اختبار هذه الطريقة في سياق الفحص الأولي لليرقات بهدف تحديد مجموعات الخلايا الع...
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
ونود أن نشكر معهد غولبنكيان دي سينسيا على إتاحة إمكانية الوصول إلى جزء من المعدات التجريبية الموصوفة في هذا البروتوكول. وقد تم دعم هذا العمل من قبل المؤسسة البرتغالية للعلوم والتكنولوجيا (FCT)، LISBOA-01-0145-FEDER-007660، PTDC/NEU- NMC/2459/2014، IF/00697/2014 وLa Caixa HR17-00595 إلى PMD وزمالة مستقبلية لمجلس البحوث الأسترالي (FT170100259) إلى CKM.
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL microtubes | Sarstedt AG & Co. | 72.690.001 | |
| 10xPBS | Nytech | MB18201 | |
| 2.0 mL microtubes | Sarstedt AG & Co. | 72.695.500 | |
| 60 mm petri dishes | Greiner Bio-one, Austria | 628161 | |
| 96 well microplates | Santa Cruz Biotechnology | SC-204453 | |
| Agar | Pró-vida, Portugal | ||
| Bench cooler | Nalgene, USA | Labtop Cooler 5115-0032 | |
| Blue food dye | Rayner, Billingshurst, UK | ||
| Cell disruption media | Scientific Industries, Inc. | 888-850-6208 | (0.5 mm glass beads) |
| Dish weight boats | Santa Cruz Biotechnology | SC-201606 | |
| Embryo collection cage for 60 mm petri dishes | Flystuff, Scientific Laboratory Supplies, UK | FLY1212 (59-100) | |
| Featherweight forceps | BioQuip Products, USA | 4750 | |
| Fly food for stocks maintenance | 1 L food contains: 10 g Agar, 100 g Yeast Extract, 50 g Sucrose, 30 mL Nipagin, 3 mL propionic acid | ||
| Forceps #5 | Dumont | 0108-5-PS | Standard tips, INOX, 11cm |
| Incubator | LMS Ltd, UK | Series 2, Model 230 | For thermogenetic feeding assay (30?C) |
| Incubator | Percival Scientific, USA | DR36NL | To stage larvae (19?C) |
| Janelia lines | Janelia Research Campus | Detailed information in Table 2 | |
| Macronutrient balancing diets | Composition and nutritional information in Figure 1 | ||
| Methanol | VWR | CAS number: 67-56-1 | |
| Nipagin (Methyl 4-hydroxybenzoate) | Sigma-Aldrich | H5501 | |
| Nitrile gloves | VWR, USA | ||
| Refrigerated centrifuge | Eppendorf, Germany | 5804 R / Serial number: 5805CI364293 | |
| Rubin Gal4 ines | Janelia Research Campus | Stoks available at Bloomington Drosophila Stock Center | |
| ShibireTS UAS line | Bloomington Drosophila Stock Center | BDSC number: 66600 | Provided by Carlos Ribeiro Group |
| Soft brushes | For sorting anaesthetised fruit flies | ||
| Spectrophotometer plate reader | Thermo Fisher Scientific | Multiskan Go 51119300 | |
| Stereo microscope | Nikon | 1016625 | |
| Sucrose | Sidul, Portugal | ||
| Third-instar larvae (L3) rearing diet | Composition and nutritional information in Figure 1 | ||
| Timer | |||
| Tissue lyzer / bead beater | MP Biomedicals, USA | FastPrep-24 6004500 | |
| TRPA1 UAS line | Bloomington Drosophila Stock Center | BDSC number: 26264 | Expresses TrpA1 under UAS control; may be used to activate neurons experimentally at 25 ?C |
| Water bath | Sheldon Manufacturing Inc., USA | W20M-2 / 03068308 / 9021195 | |
| Yeast extract | Pró-vida, Portugal | 51% Protein, 15% Carbohydrate |
References
- Raubenheimer, D. . Nature of nutrition - a unifying framework from animal adaptation to human. , (2012).
- Carvahlo, M. J. a., Mirth, C. K. Coordinating morphology with behavior during development: an integrative approach from a fly perspective. Frontiers in Ecology and Evolution. , (2015).
- Steck, K., et al. Internal amino acid state modulates yeast taste neurons to support protein homeostasis in Drosophila. Elife. 7, 31625 (2018).
- Itskov, P. M., Ribeiro, C. The dilemmas of the gourmet fly: the molecular and neuronal mechanisms of feeding and nutrient decision making in Drosophila. Frontiers in Neuroscience. 7, 12 (2013).
- Bjordal, M., Arquier, N., Kniazeff, J., Pin, J. P., Leopold, P. Sensing of amino acids in a dopaminergic circuitry promotes rejection of an incomplete diet in Drosophila. Cell. 156 (3), 510-521 (2014).
- Grandison, R. C., Piper, M. D., Partridge, L. Amino-acid imbalance explains extension of lifespan by dietary restriction in Drosophila. Nature. 462 (7276), 1061-1064 (2009).
- Lee, K. P., et al. Lifespan and reproduction in Drosophila: New insights from nutritional geometry. Proceedings of the National Academy of Sciences of the United States of America. 105 (7), 2498-2503 (2008).
- Levine, M. E., et al. Low protein intake is associated with a major reduction in IGF-1, cancer, and overall mortality in the 65 and younger but not older population. Cell Metabolism. 19 (3), 407-417 (2014).
- Solon-Biet, S. M., et al. The ratio of macronutrients, not caloric intake, dictates cardiometabolic health, aging, and longevity in ad libitum-fed mice. Cell Metabolism. 19 (3), 418-430 (2014).
- Piper, M. D., et al. A holidic medium for Drosophila melanogaster. Nature Methods. 11 (1), 100-105 (2014).
- Jones, W. D. The expanding reach of the GAL4/UAS system into the behavioral neurobiology of Drosophila. BMB Reports. 42 (11), 705-712 (2009).
- Deshpande, S. A., et al. Quantifying Drosophila food intake: comparative analysis of current methodology. Nature Methods. 11 (5), 535-540 (2014).
- Neckameyer, W. S. A trophic role for serotonin in the development of a simple feeding circuit. Developmental Neuroscience. 32 (3), 217-237 (2010).
- Gasque, G., Conway, S., Huang, J., Rao, Y., Vosshall, L. B. Small molecule drug screening in Drosophila identifies the 5HT2A receptor as a feeding modulation target. Scientific Reports. 3, (2013).
- Schoofs, A., et al. Selection of motor programs for suppressing food intake and inducing locomotion in the Drosophila brain. PLoS Biology. 12 (6), 1001893 (2014).
- Pocas, G. M., Crosbie, A. E., Mirth, C. K. When does diet matter? The roles of larval and adult nutrition in regulating adult size traits in Drosophila melanogaster. Journal of Insect Physiology. , 104051 (2020).
- Hamada, F. N., et al. An internal thermal sensor controlling temperature preference in Drosophila. Nature. 454 (7201), 217-220 (2008).
- Pfeiffer, B. D., et al. Tools for neuroanatomy and neurogenetics in Drosophila. Proceedings of the National Academy of Sciences of the United States of America. 105 (28), 9715-9720 (2008).
- Jenett, A., et al. A GAL4-driver line resource for Drosophila neurobiology. Cell Reports. 2 (4), 991-1001 (2012).
- Kitamoto, T. Conditional modification of behavior in Drosophila by targeted expression of a temperature-sensitive shibire allele in defined neurons. Journal of Neurobiology. 47 (2), 81-92 (2001).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Shirangi, T. R., Stern, D. L., Truman, J. W. Motor control of Drosophila courtship song. Cell Reports. 5 (3), 678-686 (2013).
- Mirth, C. M. J. Food intake and food choice are altered by the developmental transition at critical weight in Drosophila melanogaster. Animal Behaviour. 126, 195-208 (2017).
- Simpson, S. J., Raubenheimer, D. Obesity: the protein leverage hypothesis. Obesity Reviews. 6 (2), 133-142 (2005).
- Raubenheimer, D., Simpson, S. J. Integrative models of nutrient balancing: application to insects and vertebrates. Nutrition Research Reviews. 10 (1), 151-179 (1997).
- Li, H. H., et al. A GAL4 driver resource for developmental and behavioral studies on the larval CNS of Drosophila. Cell Reports. 8 (3), 897-908 (2014).
- Bhatt, P. K., Neckameyer, W. S. Functional analysis of the larval feeding circuit in Drosophila. Journal of Visualized Experiments. (81), e51062 (2013).
- Wong, R., Piper, M. D. W., Blanc, E., Partridge, L. Pitfalls of measuring feeding rate in the fruit fly Drosophila melanogaster. Nature Methods. 5 (3), 214-215 (2008).
- Almeida-Carvalho, M. J., et al. The Ol1mpiad: concordance of behavioural faculties of stage 1 and stage 3 Drosophila larvae. Journal of Experimental Biology. 220, 2452-2475 (2017).
- Rodrigues, M. A., et al. Drosophila melanogaster larvae make nutritional choices that minimize developmental time. Journal of Insect Physiology. 81, 69-80 (2015).
- Wong, R., Piper, M. D., Wertheim, B., Partridge, L. Quantification of food intake in Drosophila. PLoS One. 4 (6), 6063 (2009).
- Wu, Q., et al. Developmental control of foraging and social behavior by the Drosophila neuropeptide Y-like system. Neuron. 39 (1), 147-161 (2003).
- Wu, Q., Zhang, Y., Xu, J., Shen, P. Regulation of hunger-driven behaviors by neural ribosomal S6 kinase in Drosophila. Proceedings of the National Academy of Sciences of the United States of America. 102 (37), 13289-13294 (2005).
- Lingo, P. R., Zhao, Z., Shen, P. Co-regulation of cold-resistant food acquisition by insulin- and neuropeptide Y-like systems in Drosophila melanogaster. Neuroscience. 148 (2), 371-374 (2007).
Erratum
Formal Correction: Erratum: Quantification of Macronutrients Intake in a Thermogenetic Neuronal Screen using Drosophila Larvae
Posted by JoVE Editors on 10/06/2020. Citeable Link.
An erratum was issued for: Quantification of Macronutrients Intake in a Thermogenetic Neuronal Screen using Drosophila Larvae. A figure was updated.
Figure 1 was updated from:
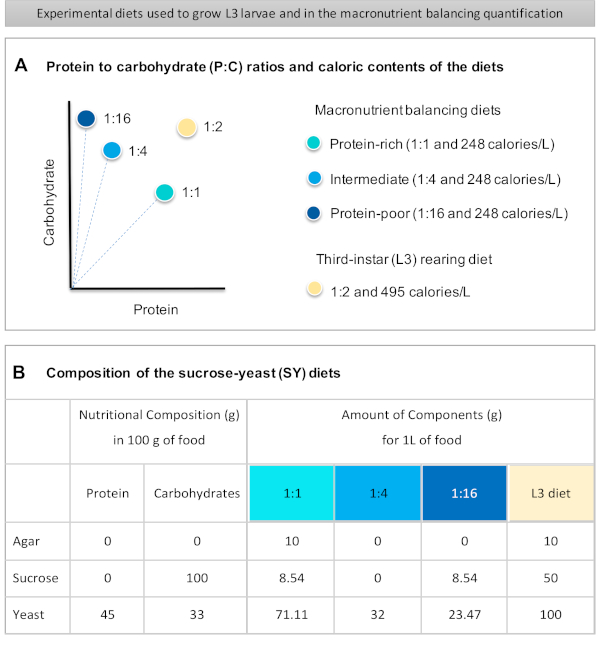
Figure 1: The sucrose-yeast (SY) diets used in our protocol. (A) The blue dots represent the isocaloric (248 calories/L) macronutrient balancing diets used in the feeding assay, which differ in the protein to carbohydrate (P:C) ratios: 1:1, 1:4 and 1:16. The beige dot represents the diet used to rear the experimental third-instar larvae (L3), which contained a P:C ratio of 1:2 and a caloric density of 495 calories/L. (B) Detailed composition and nutritional information of the sucrose-yeast (SY) based diets. The components are the same for all the diets: agar, sucrose and yeast. The amount in grams of the components needed to prepare 1 L of diet is shown. Note that 1% (v/v) of blue dye must be added to the macronutrient balancing diets and to the L3 rearing diet nipagin and propionic acid solutions must be added to a final concentration (v/v) of 3% and 0.3%, respectively. Please click here to view a larger version of this figure.
to:
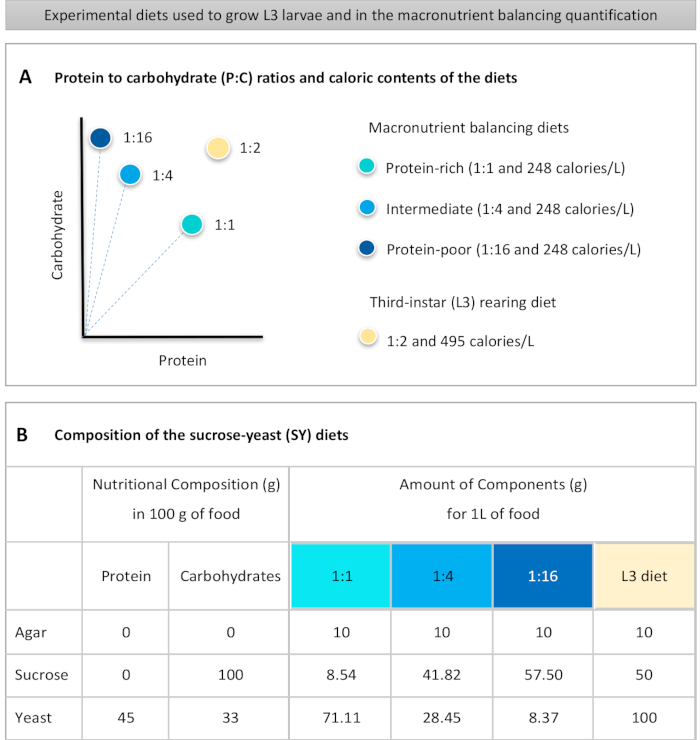
Figure 1: The sucrose-yeast (SY) diets used in our protocol. (A) The blue dots represent the isocaloric (248 calories/L) macronutrient balancing diets used in the feeding assay, which differ in the protein to carbohydrate (P:C) ratios: 1:1, 1:4 and 1:16. The beige dot represents the diet used to rear the experimental third-instar larvae (L3), which contained a P:C ratio of 1:2 and a caloric density of 495 calories/L. (B) Detailed composition and nutritional information of the sucrose-yeast (SY) based diets. The components are the same for all the diets: agar, sucrose and yeast. The amount in grams of the components needed to prepare 1 L of diet is shown. Note that 1% (v/v) of blue dye must be added to the macronutrient balancing diets and to the L3 rearing diet nipagin and propionic acid solutions must be added to a final concentration (v/v) of 3% and 0.3%, respectively. Please click here to view a larger version of this figure.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved