È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Quantificazione dell'assunzione di macronutrienti in uno schermo neuronale termogenetico usando larve di Drosophila
In questo articolo
Erratum Notice
Riepilogo
Qui descritto è un protocollo che consente la quantificazione colorimetrica della quantità di cibo mangiata entro un intervallo di tempo definito dalle larve di Drosophila melanogaster esposte a diete di diversa qualità macronutriente. Questi test sono condotti nel contesto di uno schermo termogenetico neuronale.
Abstract
I comportamenti di foraggiamento e alimentazione consentono agli animali di accedere a fonti di energia e nutrienti essenziali per il loro sviluppo, salute e fitness. Studiare la regolazione neuronale di questi comportamenti è essenziale per la comprensione dei meccanismi fisiologici e molecolari alla base dell'omeostasi nutrizionale. L'uso di modelli animali geneticamente trattabili come vermi, mosche e pesci facilita notevolmente questo tipo di studi. Nell'ultimo decennio, la mosca della frutta Drosophila melanogaster è stata utilizzata come potente modello animale dai neurobiologi che indagano il controllo neuronale dei comportamenti di alimentazione e foraggiamento. Sebbene indubbiamente prezioso, la maggior parte degli studi esamina le mosche adulte. Qui, descriviamo un protocollo che sfrutta il sistema nervoso larvale più semplice per indagare i substrati neuronali che controllano i comportamenti di alimentazione quando le larve sono esposte a diete diverse nel loro contenuto di proteine e carboidrati. I nostri metodi si basano su un saggio quantitativo colorimetrico di alimentazione senza scelta, eseguito nel contesto di uno schermo neuronale termogenetico-attivazione. Come lettura, la quantità di cibo mangiata dalle larve per un intervallo di 1 h è stata utilizzata quando esposta a una delle tre diete etichettate con colorante che differiscono nei rapporti tra proteine e carboidrati (P:C). L'efficacia di questo protocollo è dimostrata nel contesto di uno schermo neurogenetico in Drosophila larvale, identificando popolazioni neuronali candidate che regolano la quantità di cibo mangiato in diete di diversa qualità macronutriente. Siamo stati anche in grado di classificare e raggruppare i genotipi testati in classi fenotipiche. Oltre ad una breve rassegna dei metodi attualmente disponibili in letteratura, vengono discussi i vantaggi e i limiti di questi metodi e, inoltre, vengono forniti alcuni suggerimenti su come questo protocollo potrebbe essere adattato ad altri esperimenti specifici.
Introduzione
Tutti gli animali dipendono da una dieta equilibrata per acquisire le quantità necessarie di nutrienti per la sopravvivenza, la crescita e la riproduzione1. La scelta di cosa e quanto mangiare è influenzata da una moltitudine di fattori interagenti legati allo stato interno dell'animale, come il livello di sazietà, e le condizioni ambientali, come la qualità delcibo 2,3,4,5. Proteine e carboidrati sono due dei principali macronutrienti e il suo apporto equilibrato è essenziale per sostenere i processi fisiologici degli animali. Pertanto, la comprensione dei meccanismi neurali che controllano i comportamenti di alimentazione e sostengono un'assunzione equilibrata di questi macronutrienti è estremamente rilevante. Questo perché i tratti della storia della vita come la durata della vita, la fecondità e la salute metabolica sono direttamente influenzati dai livelli di assunzione di proteine6,7,8,9,10.
L'uso di organismi più semplici e trattabili che mostrano abitudini alimentari evolutivamente conservate con animali complessi, compresi i mammiferi, è essenziale per questo tipo di studi. È importante sottolineare che questi modelli animali più semplici offrono una buona opportunità per sezionare complesse questioni biologiche in un contesto costoso, eticamente e tecnicamente più efficace. Negli ultimi decenni, Drosophila, conil suo potente toolkit genetico, il comportamento intricato e stereotipato e l'architettura conservata dei meccanismi periferici e di rilevamento dei nutrienti con i mammiferi, è stato un modello fruttuoso per i neurobiologi comportamentali11. In definitiva, la speranza è che comprendendo come l'assunzione di cibo sia regolata in questo animale, con un sistema nervoso più semplice, possiamo quindi iniziare a districare i malfunzionamenti neuronali alla base dei disturbi alimentari umani.
Lo studio dei substrati neuronali per i comportamenti di alimentazione dipende profondamente dalla capacità di misurare contemporaneamente l'assunzione di cibo degli animali manipolando la loro attività neuronale. A causa delle quantità minime di cibo ingerito, quantificare la quantità di cibo mangiato dalle mosche è estremamente impegnativo e tutti i metodi attualmente disponibili presentano limitazioni significative. Pertanto, il gold standard è quello di utilizzare una combinazione di metodologie complementari12. Le mosche adulte sono state storicamente favorite come modello genetico e comportamentale. Tuttavia, le larve di Drosophila offrono anche l'opportunità di indagare i substrati neuronali che codificano il comportamento di alimentazione. Il sistema nervoso centrale larvale (SNC), con circa 12.000 neuroni, è significativamente meno complesso di quello dell'adulto, che contiene circa 150.000 neuroni. Questa minore complessità non è solo numerica ma anche funzionale, poiché i comportamenti larvali si basano su funzioni locomotiva più semplici e sistemi sensoriali. Nonostante l'apparente semplicità del loro sistema nervoso, le larve mostrano ancora comportamenti di alimentazione completi e alcuni metodi per quantificare l'ingestione di cibo nelle larve di Drosophila sono statidescritti 5,13,14,15. Abbinandosi a manipolazioni dell'attività neuronale, le larve di Drosophila possono costituire un modello altamente trattabile per comprendere la regolazione neurale dell'assunzione di cibo.
Fornito qui è un protocollo dettagliato per quantificare l'assunzione di cibo nelle larve esposte a diete di diversa qualità macronutriente. Le diete, le cosiddette diete equilibranti macronutrienti, differivano nel contenuto di proteine e carboidrati, in particolare per quanto riguarda i rapporti proteina-carboidrati (P:C): 1:1 (dieta ricca di proteine), 1:4 (dieta intermedia) e 1:16 (dieta povera di proteine), come mostrato nella figura 1A. In breve, è stato stabilito un saggio quantitativo di alimentazione senza scelta utilizzando queste tre diete a base di lievito di saccarosio isocalorico (SY) tinte con un colorante alimentare blu. Poiché l'estratto di lievito e il saccarosio sono stati utilizzati come fonti proteiche e di carboidrati ed entrambi contengono carboidrati, la variazione dei rapporti P:C è stata ottenuta modificando l'equilibrio di questi due componenti, come descritto inprecedenza 16 e come indicato nella figura 1B. Una panoramica schematica del protocollo, che mostra i principali passaggi sperimentali, è disponibile nella figura 2.
Questo protocollo è stato stabilito con l'obiettivo di indagare il ruolo di specifiche popolazioni neuronali sulla regolazione dei livelli di alimentazione larvale nelle diete di diversi rapporti P:C e nel contesto di uno schermo neuronale termogenetico. Uno strumento neurogenetico ben caratterizzato è stato utilizzato dalla famiglia TRP (Transient Receptor Potential): Drosophila Transient Receptor Potential channel (dTRPA1), che è un canale di temperatura e tensione-gated, consentendo la cottura di potenziali d'azione quando le temperature ambientali salgono sopra i 25 °C17. Per esprimere il transgene dTRPA1, abbiamo sfruttato le linee Gal4 basate sulle regioni regolatorie cisdel genoma drosophila, stabilite nel laboratorio Rubin, nell'ambito del progetto FlyLight presso Janelia Research Campus18,19.
Sebbene il protocollo, qui descritto, sia stato stabilito nel contesto di una schermata di attivazione, può essere facilmente adattato dallo sperimentatore ad altre esigenze o interessi specifici, vale a dire eseguire uno schermo di soppressione utilizzando il silenziatore neuronale sensibile alla temperatura ShibireTS20, in alternativa a dTRPA1. Questo e altri adattamenti sono discussi nelle sezioni relative al protocollo e alle discussioni.
Protocollo
1. Preparazione delle diete di lievito di saccarosio (SY)
- Pesare tutti gli ingredienti secchi (agar, lievito, saccarosio) per il bilanciamento dei macronutrienti e le diete di allevamento L3. Le quantità in grammi per ciascuno degli ingredienti necessari per preparare 1 L di cibo sono indicate nella figura 1B.
NOTA: Tenere conto del fatto che sono necessari circa 13 mL di cibo per riempire una piastra di Petri da 60 mm. - Sciogliere tutti gli ingredienti in acqua distillata sterile (utilizzare circa il 50% del volume totale di acqua necessaria per preparare il cibo) e mescolare il mezzo per 5-10 minuti.
- Autoclave per 50 min.
- Dopo aver permesso ai mezzi di raffreddarsi, aggiungere soluzioni di nipagin e acido propionico alle diete, ad una concentrazione finale (v/v) rispettivamente del 3% e dello 0,3%. Alle diete equilibranti macronutrienti, aggiungere colorante alimentare blu a una concentrazione finale (v/v) dell'1%. Completa i volumi totali con acqua distillata.
- Versare con cura le diete alimentari a 60 mm di piastre di Petri, in modo che la quantità di cibo versato sia approssimativamente la stessa in ciascuno dei piatti. Etichettare le piastre con i rapporti P:C delle diete.
NOTA: Preparare le diete di bilanciamento dei macronutrienti il giorno del test di alimentazione. Se non è possibile, conservare le diete preparate a 4 °C, in un contenitore sigillato, per una durata massima di 3 giorni. Periodi di conservazione più lunghi rendono la dieta troppo secca e dura e le larve non possono scavare nel mezzo.
2. Croce genetica delle linee parentali
NOTA: Utilizzare il sistema Gal4/UAS21 per impostare le croci genetiche. In questo protocollo, al fine di attivare la funzione neuronale in specifiche popolazioni neuronali, le vergini femminili della linea17 UAS dTRPA1 sono state utilizzate e incrociate ai maschi dalle linee Janelia Gal4 (Figura 2A). Il controllo genetico utilizzato era la progenie di un incrocio tra la linea dTRPA1 e una linea "GAL4 vuota", che trasporta Gal4 nel vettore utilizzato per generare la collezione Rubin Gal4 ma senza frammento regolatore presente (attP2)22. Per promuovere la soppressione neuronale, è possibile utilizzare una linea UAS che codifica ShibireTS20, invece di dTRPA1.
- Impostare gabbie per la raccolta degli embrioni da 60 mm con piastre dietetiche per l'allevamento L3, integrate con una pasta di lievito attiva.
- Trasferire le vergini femmine UAS dTRPA1 adulte e i maschi Janelia Gal4, di età compresa tra 5 e 8 giorni, nelle gabbie di raccolta degli embrioni e consentire l'accoppiamento per 24-48 ore, a 25 °C, con il 60% di umidità e un ciclo luce-buio 12:12(Figura 2A). Per gabbie di raccolta degli embrioni da 60 mm, utilizzare circa 100 femmine vergini e 30 maschi per croce.
- Alla fine del periodo di accoppiamento, rimuovere e scartare le piastre dietetiche di allevamento L3 utilizzate nelle croci genetiche. Sostituirli con piatti freschi di dieta per l'allevamento L3, al fine di eseguire le deposizioni delle uova e la stadiazione larvale.
3. Preparazione di larve di terza stella (L3)
- Trasferire le mosche adulte accoppiate su piatti freschi di dieta per l'allevamento L3 e consentire la deposizione delle uova per 3-4 ore, a 25 °C(Figura 2B). Assicurarsi che tutti i piatti siano etichettati con il genotipo, rapporto P:C della dieta e data della deposizione delle uova.
NOTA: Per risparmiare tempo, eseguire la deposizione delle uova direttamente nella dieta di allevamento L3, che evita una maggiore manipolazione delle uova. Nel caso di screening genetici su piccola scala, l'ottimizzazione della deposizione delle uova può essere ottenuta utilizzando piastre di agar di succo di mela. - Alla fine del periodo di deposizione delle uova, rimuovere i piatti dalle gabbie e coprirli con coperchi di plastica. Nel caso in cui l'estratto di lievito sia utilizzato per integrare le piastre di allevamento L3, assicurarsi di rimuovere tutto il lievito residuo alla fine della deposizione delle uova. Questo è importante per evitare un'alimentazione non uniforme durante la crescita larvale.
NOTA: Gli adulti accoppiati possono essere trasferiti su piatti di dieta di allevamento L3 freschi, quindi vengono eseguiti più deposizioni di uova e si possono ottenere larve più sperimentali. Gli egg-deponenti consecutivi possono essere eseguiti con gli stessi adulti durante un'intera settimana lavorativa. - Stimare il numero di uova per piastra e mantenere la densità larvale a un massimo di 200 embrioni per piastra. Questa stima può essere fatta contando il numero di embrioni in un quarto della piastra.
NOTA: Una piastra sovraffollata ritarderà lo sviluppo larvale e influenzerà i comportamenti di alimentazione larvale. - Incubare le piastre di allevamento L3 a 18 °C (temperatura permissiva), umidità del 60% e un ciclo luce-buio 12:12 e consentire alle larve di crescere per 9 giorni(Figura 2B).
- Il nono giorno dopo la deposizione delle uova (AEL), raccogliere tre gruppi di 10 L3 da ciascuno dei genotipi (e per le repliche) da testare. Inoltre, raccogli gruppi di 10 L3 per il controllo "cibo a colorante zero". Assicurarsi che la raccolta delle larve sia fatta durante periodi di tempo equivalenti del giorno utilizzato per fare la deposizione delle uova (ad esempio, se la deposizione delle uova si è verificata tra le 10:00 e le 14:00, raccogliere le larve durante lo stesso periodo di tempo 9 giorni AEL) e viene eseguita, il più delicatamente possibile, utilizzando forcelle #5 o una forcelle di peso piuma. Trasferire direttamente le larve come indicato nel passaggio successivo (3.6).
NOTA: Gli animali di controllo "cibo a colorante zero" sono larve che nel saggio di alimentazione ricevono cibo senza colorante blu. Questo controllo è imperativo per rimuovere l'assorbanza di fondo degli estratti larvali. - Trasferire le larve sperimentali raccolte su barche di peso per piatti di plastica contenenti 1 mL di acqua. Assicurarsi che L3 sia raccolto, e non L2, seguendo le indicazioni fornite nella figura 3.
NOTA: La raccolta di L3 su barche di plastica contenenti acqua o 1x soluzione salina tamponata da fosfati (PBS), è importante per mantenere le larve ben idratate prima dell'inizio del test di alimentazione. Ciò è particolarmente importante se vengono raccolti contemporaneamente diversi gruppi sperimentali L3 di diversi genotipi. Tieni traccia dell'ordine di raccolta per ogni gruppo, in modo che le differenze nella durata della privazione di cibo per ogni gruppo siano ridotte al minimo. L'uso di barche di plastica in questo passaggio facilita il passaggio opzionale 4.3 in quanto consente alle larve di galleggiare direttamente nel bagno d'acqua.
4. Attivazione termogenetica e test di alimentazione a scelta
NOTA: Si raccomanda di eseguire i test di alimentazione all'incirca nello stesso momento della giornata per ridurre al minimo le possibili variazioni legate ai ritmi circadiani. Inoltre, eseguire sempre gli esperimenti di controllo (la progenie della linea "Gal4 vuota" attraversata fino a UAS dTRPA1 e le larve "cibo a colorante zero", in parallelo con i genotipi di interesse.
- Impostare un incubatore a 30 °C (temperatura non permissiva) e mantenere alti livelli di umidità (almeno il 65%) per evitare la disidratazione larvale durante il saggio.
- Prima di iniziare il saggio di alimentazione, equilibrare la temperatura delle piastre di dosaggio riscaldandole a 30 °C per 30 minuti.
- (Facoltativo) Shock termico le larve sperimentali per 2 minuti in un bagno d'acqua a 37 ° C. Eseguire questo passaggio con gli animali nelle barche di peso di plastica contenenti un po 'd'acqua.
NOTA: Lo scopo di questo passaggio è quello di intensificare l'attivazione neuronale promuovendo il fuoco dei neuroni dall'inizio del test di alimentazione. - Tieni pronti più timer per 1 h. Il numero di timer da utilizzare dipende dal numero di gruppi sperimentali testati e dal livello di abilità dello sperimentatore nella manipolazione delle larve.
NOTA: L'uso di più timer è fondamentale per mantenere la durata del saggio coerente per tutti i genotipi. - Scolare con cura l'acqua dalle barche di plastica e, utilizzando una spazzola morbida inumidita, trasferire delicatamente i gruppi L3 dalle barche al centro delle piastre di dosaggio. Rimettere i coperchi delle piastre e avviare un timer per ogni piastra (o gruppo di piastre) per mantenere accurate sessioni di alimentazione di 1 h.
- Lasciare che le larve si alimentino per 1 h, a 30 °C, al buio(Figura 2C).
NOTA: Le prestazioni del saggio al buio sono importanti da controllare per le differenze nei segnali visivi tra le diete, poiché le diete differiranno nei toni, anche se contengono la stessa concentrazione di coloranti. - Interrompere il saggio di alimentazione trasferendo le piastre in un bagno di ghiaccio. Premere il ghiaccio il più possibile per fornire una superficie stabile per le piastre.
NOTA: Le temperature fredde promuoveranno la fine dell'alimentazione inibendo comportamenti di scavo e scavo. La maggior parte delle larve farà emergere i piatti alimentari dopo alcuni minuti, facilitando il loro recupero nei seguenti passaggi.
5. Estrazione di coloranti alimentari
- Preparare 2 microtubi mL per ciascun gruppo di 10 L3 testati, contenenti approssimativamente le stesse quantità di perline di vetro da 0,5 mm (sufficienti a riempire la parte inferiore del microtubo) e 300 μL di metanolo ghiacciato. Tenere i microtubi al freddo, utilizzando un refrigeratore da banco.
ATTENZIONE: Il metanolo è altamente infiammabile e tossico. Seguire tutte le procedure di sicurezza raccomandate per la manipolazione di questo reagente, incluso lavorare in un'area ben ventilata e indossare guanti in nitrile.
NOTA: L'uso del metanolo è importante per fissare i campioni larvali ed evitare reazioni di melanizzazione nella cuticola. - Utilizzando #5 o forcep di peso piuma, recuperare con cura i gruppi di 10 L3 dalle piastre di dosaggio di alimentazione e trasferirli nei coperchi delle piastre di dosaggio contenenti un po 'd'acqua. Risciacquare le larve per rimuovere eventuali detriti alimentari sui loro corpi mentre maneggiano delicatamente le larve per evitare lesioni. Tenere un registro del numero di larve recuperate per ogni genotipo per replica, in modo che la quantità media di assunzione di cibo per larva possa essere quantificata.
NOTA: Le larve ferite devono essere scartate in quanto avranno cuticola melanizzata, non essendo adatte alla quantificazione colorimetrica. - Trasferire i gruppi L3 ai microtubi da 2 mL preparati in 5.1.
- Liscivia i tessuti larvali per estrarre il colorante alimentare dalle viscere con un metodo meccanico di lisi utilizzando un liscivia tissutale e perline di vetro aggiunte nel passaggio 5.1. (se un listore tissutale non è disponibile, utilizzare un pestello omogeneizzante). Esegua preferenzialmentementementementemente a 4 °C (Figura 2D).
NOTA: La durata di questo passaggio dipenderà dall'attrezzatura utilizzata. Utilizzando un liscitrie tissutale convenzionale, è sufficiente un'estrazione di 1 minuto. In caso di costrizioni di tempo, il protocollo può essere messo in pausa alla fine di questo passaggio e proceduto in seguito. Conservare i campioni a -20 °C. - Trasferire gli estratti in microtubi da 1,5 mL puliti, invertendo direttamente i microtubi da 2 mL sui nuovi microtubi da 1,5 mL. Se eseguita delicatamente, la maggior parte delle perline di vetro rimarrà nella parte inferiore del microtubo da 2 mL.
- Sgombro i detriti cellulari centrifugando gli estratti, ad una velocità massima di 10 min, a 4 °C.
- Raccogliere i supernatanti per pulire microtubi da 1,5 mL. Se i detriti cellulari sono ancora visibili nei supernatanti, ripetere i passaggi 5.6 e 5.7.
6. Quantificazione colorimetrica del consumo alimentare
- Preparare soluzioni standard, per generare una curva di calibrazione, eseguendo diluizioni seriali 1:2 in metanolo di una soluzione di colorante blu iniziale. Come vuoto, usa solo metanolo. La concentrazione delle norme dipende dai livelli di assunzione di cibo degli animali.
NOTA: Nel caso dello schermo pilota qui presentato, poiché le concentrazioni di coloranti ottenute per gli estratti larvali variavano da 0,02 a 1,93 μL/mL, è stata utilizzata una curva standard ottenuta misurando le assorbanze di 8 diluizioni seriali di una soluzione di colorante blu da 2 μL/mL in metanolo. Se necessario, aumentare o diminuire la concentrazione di queste soluzioni, a seconda della concentrazione di coloranti dei campioni sperimentali. - Trasferire 100 μL dei campioni sperimentali (ottenuti nella fase 5.7), standard e bianco (fase 6.1) ai pozzi di una micropiastra a 96 pozzi e misurare l'assorbanza a 600 nm, utilizzando un lettore di piastre(figura 2E). Per rimuovere l'assorbanza di fondo, misurare l'assorbanza degli estratti ottenuti dalle larve alimentate con cibo senza colorante blu come "zero" per gli estratti larvali ("controllo degli alimenti a colorante zero).
- Generare una curva standard e correlare i valori di assorbanza ottenuti per i campioni da ogni gruppo larvale sperimentale con la quantità di assunzione di cibo (volume in mL). Trova il consumo medio di cibo per larva tenendo conto del numero di larve raccolte per ogni gruppo nel passaggio 5.2
Risultati
Le larve di Drosophila regolano il loro apporto proteico a costo di ingerire carboidrati ineccesso 23 (grafico schematico nella figura 2E). In realtà, questa priorità dell'assunzione di proteine è stata osservata in molti altri animali ed è chiamata proteina chesfrutta 24,25.
Sfruttando questa robusta risposta comportamentale alimentare, è stato progettato uno schermo ...
Discussione
Con questo protocollo, si potrebbe testare la capacità delle larve sotto l'attivazione termogenetica di specifiche popolazioni neuronali di regolare i livelli di assunzione di proteine e carboidrati, due principali macronutrienti, quando esposte a diete di diversa composizione P:C. Questo metodo è stato testato nel contesto di uno screening preliminare larvale con l'obiettivo di identificare le popolazioni neuronali associate al controllo dell'assunzione di cibo attraverso diete di diversa qualità macronutriente. Ques...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo l'Instituto Gulbenkian de Ciência (CIG) per averci fornito l'accesso a una parte delle attrezzature sperimentali descritte in questo protocollo. Questo lavoro è stato sostenuto dalla Fondazione portoghese per la scienza e la tecnologia (FCT), LISBOA-01-0145-FEDER-007660, PTDC/NEU- NMC/2459/2014, IF/00697/2014 e La Caixa HR17-00595 a PMD e da un Australian Research Council Future Fellowship (FT170100259) a CKM.
Materiali
| Name | Company | Catalog Number | Comments |
| 1.5 mL microtubes | Sarstedt AG & Co. | 72.690.001 | |
| 10xPBS | Nytech | MB18201 | |
| 2.0 mL microtubes | Sarstedt AG & Co. | 72.695.500 | |
| 60 mm petri dishes | Greiner Bio-one, Austria | 628161 | |
| 96 well microplates | Santa Cruz Biotechnology | SC-204453 | |
| Agar | Pró-vida, Portugal | ||
| Bench cooler | Nalgene, USA | Labtop Cooler 5115-0032 | |
| Blue food dye | Rayner, Billingshurst, UK | ||
| Cell disruption media | Scientific Industries, Inc. | 888-850-6208 | (0.5 mm glass beads) |
| Dish weight boats | Santa Cruz Biotechnology | SC-201606 | |
| Embryo collection cage for 60 mm petri dishes | Flystuff, Scientific Laboratory Supplies, UK | FLY1212 (59-100) | |
| Featherweight forceps | BioQuip Products, USA | 4750 | |
| Fly food for stocks maintenance | 1 L food contains: 10 g Agar, 100 g Yeast Extract, 50 g Sucrose, 30 mL Nipagin, 3 mL propionic acid | ||
| Forceps #5 | Dumont | 0108-5-PS | Standard tips, INOX, 11cm |
| Incubator | LMS Ltd, UK | Series 2, Model 230 | For thermogenetic feeding assay (30?C) |
| Incubator | Percival Scientific, USA | DR36NL | To stage larvae (19?C) |
| Janelia lines | Janelia Research Campus | Detailed information in Table 2 | |
| Macronutrient balancing diets | Composition and nutritional information in Figure 1 | ||
| Methanol | VWR | CAS number: 67-56-1 | |
| Nipagin (Methyl 4-hydroxybenzoate) | Sigma-Aldrich | H5501 | |
| Nitrile gloves | VWR, USA | ||
| Refrigerated centrifuge | Eppendorf, Germany | 5804 R / Serial number: 5805CI364293 | |
| Rubin Gal4 ines | Janelia Research Campus | Stoks available at Bloomington Drosophila Stock Center | |
| ShibireTS UAS line | Bloomington Drosophila Stock Center | BDSC number: 66600 | Provided by Carlos Ribeiro Group |
| Soft brushes | For sorting anaesthetised fruit flies | ||
| Spectrophotometer plate reader | Thermo Fisher Scientific | Multiskan Go 51119300 | |
| Stereo microscope | Nikon | 1016625 | |
| Sucrose | Sidul, Portugal | ||
| Third-instar larvae (L3) rearing diet | Composition and nutritional information in Figure 1 | ||
| Timer | |||
| Tissue lyzer / bead beater | MP Biomedicals, USA | FastPrep-24 6004500 | |
| TRPA1 UAS line | Bloomington Drosophila Stock Center | BDSC number: 26264 | Expresses TrpA1 under UAS control; may be used to activate neurons experimentally at 25 ?C |
| Water bath | Sheldon Manufacturing Inc., USA | W20M-2 / 03068308 / 9021195 | |
| Yeast extract | Pró-vida, Portugal | 51% Protein, 15% Carbohydrate |
Riferimenti
- Raubenheimer, D. . Nature of nutrition - a unifying framework from animal adaptation to human. , (2012).
- Carvahlo, M. J. a., Mirth, C. K. Coordinating morphology with behavior during development: an integrative approach from a fly perspective. Frontiers in Ecology and Evolution. , (2015).
- Steck, K., et al. Internal amino acid state modulates yeast taste neurons to support protein homeostasis in Drosophila. Elife. 7, 31625 (2018).
- Itskov, P. M., Ribeiro, C. The dilemmas of the gourmet fly: the molecular and neuronal mechanisms of feeding and nutrient decision making in Drosophila. Frontiers in Neuroscience. 7, 12 (2013).
- Bjordal, M., Arquier, N., Kniazeff, J., Pin, J. P., Leopold, P. Sensing of amino acids in a dopaminergic circuitry promotes rejection of an incomplete diet in Drosophila. Cell. 156 (3), 510-521 (2014).
- Grandison, R. C., Piper, M. D., Partridge, L. Amino-acid imbalance explains extension of lifespan by dietary restriction in Drosophila. Nature. 462 (7276), 1061-1064 (2009).
- Lee, K. P., et al. Lifespan and reproduction in Drosophila: New insights from nutritional geometry. Proceedings of the National Academy of Sciences of the United States of America. 105 (7), 2498-2503 (2008).
- Levine, M. E., et al. Low protein intake is associated with a major reduction in IGF-1, cancer, and overall mortality in the 65 and younger but not older population. Cell Metabolism. 19 (3), 407-417 (2014).
- Solon-Biet, S. M., et al. The ratio of macronutrients, not caloric intake, dictates cardiometabolic health, aging, and longevity in ad libitum-fed mice. Cell Metabolism. 19 (3), 418-430 (2014).
- Piper, M. D., et al. A holidic medium for Drosophila melanogaster. Nature Methods. 11 (1), 100-105 (2014).
- Jones, W. D. The expanding reach of the GAL4/UAS system into the behavioral neurobiology of Drosophila. BMB Reports. 42 (11), 705-712 (2009).
- Deshpande, S. A., et al. Quantifying Drosophila food intake: comparative analysis of current methodology. Nature Methods. 11 (5), 535-540 (2014).
- Neckameyer, W. S. A trophic role for serotonin in the development of a simple feeding circuit. Developmental Neuroscience. 32 (3), 217-237 (2010).
- Gasque, G., Conway, S., Huang, J., Rao, Y., Vosshall, L. B. Small molecule drug screening in Drosophila identifies the 5HT2A receptor as a feeding modulation target. Scientific Reports. 3, (2013).
- Schoofs, A., et al. Selection of motor programs for suppressing food intake and inducing locomotion in the Drosophila brain. PLoS Biology. 12 (6), 1001893 (2014).
- Pocas, G. M., Crosbie, A. E., Mirth, C. K. When does diet matter? The roles of larval and adult nutrition in regulating adult size traits in Drosophila melanogaster. Journal of Insect Physiology. , 104051 (2020).
- Hamada, F. N., et al. An internal thermal sensor controlling temperature preference in Drosophila. Nature. 454 (7201), 217-220 (2008).
- Pfeiffer, B. D., et al. Tools for neuroanatomy and neurogenetics in Drosophila. Proceedings of the National Academy of Sciences of the United States of America. 105 (28), 9715-9720 (2008).
- Jenett, A., et al. A GAL4-driver line resource for Drosophila neurobiology. Cell Reports. 2 (4), 991-1001 (2012).
- Kitamoto, T. Conditional modification of behavior in Drosophila by targeted expression of a temperature-sensitive shibire allele in defined neurons. Journal of Neurobiology. 47 (2), 81-92 (2001).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Shirangi, T. R., Stern, D. L., Truman, J. W. Motor control of Drosophila courtship song. Cell Reports. 5 (3), 678-686 (2013).
- Mirth, C. M. J. Food intake and food choice are altered by the developmental transition at critical weight in Drosophila melanogaster. Animal Behaviour. 126, 195-208 (2017).
- Simpson, S. J., Raubenheimer, D. Obesity: the protein leverage hypothesis. Obesity Reviews. 6 (2), 133-142 (2005).
- Raubenheimer, D., Simpson, S. J. Integrative models of nutrient balancing: application to insects and vertebrates. Nutrition Research Reviews. 10 (1), 151-179 (1997).
- Li, H. H., et al. A GAL4 driver resource for developmental and behavioral studies on the larval CNS of Drosophila. Cell Reports. 8 (3), 897-908 (2014).
- Bhatt, P. K., Neckameyer, W. S. Functional analysis of the larval feeding circuit in Drosophila. Journal of Visualized Experiments. (81), e51062 (2013).
- Wong, R., Piper, M. D. W., Blanc, E., Partridge, L. Pitfalls of measuring feeding rate in the fruit fly Drosophila melanogaster. Nature Methods. 5 (3), 214-215 (2008).
- Almeida-Carvalho, M. J., et al. The Ol1mpiad: concordance of behavioural faculties of stage 1 and stage 3 Drosophila larvae. Journal of Experimental Biology. 220, 2452-2475 (2017).
- Rodrigues, M. A., et al. Drosophila melanogaster larvae make nutritional choices that minimize developmental time. Journal of Insect Physiology. 81, 69-80 (2015).
- Wong, R., Piper, M. D., Wertheim, B., Partridge, L. Quantification of food intake in Drosophila. PLoS One. 4 (6), 6063 (2009).
- Wu, Q., et al. Developmental control of foraging and social behavior by the Drosophila neuropeptide Y-like system. Neuron. 39 (1), 147-161 (2003).
- Wu, Q., Zhang, Y., Xu, J., Shen, P. Regulation of hunger-driven behaviors by neural ribosomal S6 kinase in Drosophila. Proceedings of the National Academy of Sciences of the United States of America. 102 (37), 13289-13294 (2005).
- Lingo, P. R., Zhao, Z., Shen, P. Co-regulation of cold-resistant food acquisition by insulin- and neuropeptide Y-like systems in Drosophila melanogaster. Neuroscience. 148 (2), 371-374 (2007).
Erratum
Formal Correction: Erratum: Quantification of Macronutrients Intake in a Thermogenetic Neuronal Screen using Drosophila Larvae
Posted by JoVE Editors on 10/06/2020. Citeable Link.
An erratum was issued for: Quantification of Macronutrients Intake in a Thermogenetic Neuronal Screen using Drosophila Larvae. A figure was updated.
Figure 1 was updated from:
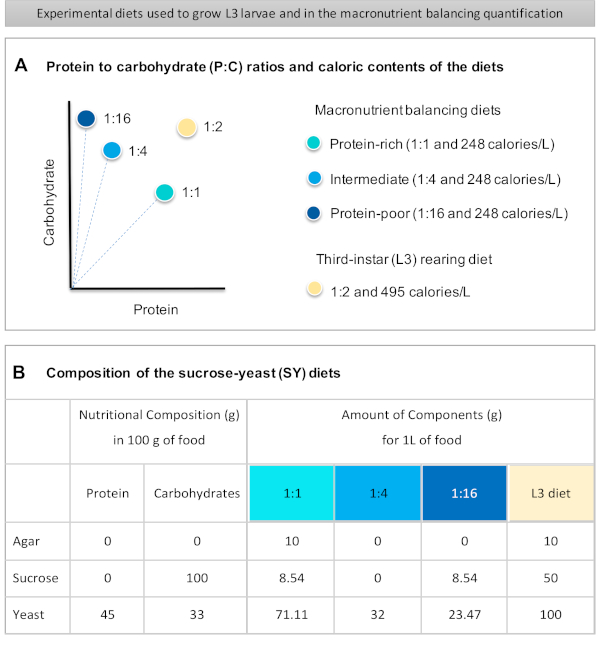
Figure 1: The sucrose-yeast (SY) diets used in our protocol. (A) The blue dots represent the isocaloric (248 calories/L) macronutrient balancing diets used in the feeding assay, which differ in the protein to carbohydrate (P:C) ratios: 1:1, 1:4 and 1:16. The beige dot represents the diet used to rear the experimental third-instar larvae (L3), which contained a P:C ratio of 1:2 and a caloric density of 495 calories/L. (B) Detailed composition and nutritional information of the sucrose-yeast (SY) based diets. The components are the same for all the diets: agar, sucrose and yeast. The amount in grams of the components needed to prepare 1 L of diet is shown. Note that 1% (v/v) of blue dye must be added to the macronutrient balancing diets and to the L3 rearing diet nipagin and propionic acid solutions must be added to a final concentration (v/v) of 3% and 0.3%, respectively. Please click here to view a larger version of this figure.
to:
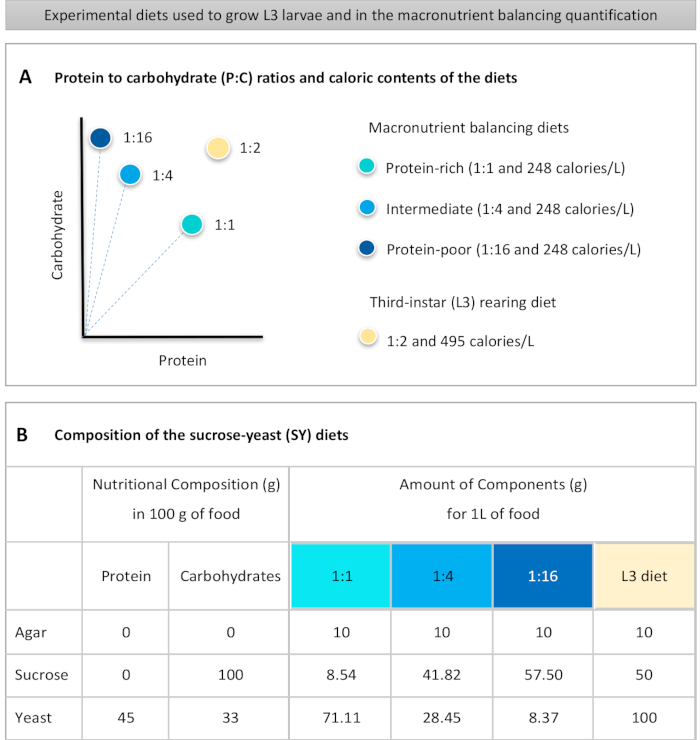
Figure 1: The sucrose-yeast (SY) diets used in our protocol. (A) The blue dots represent the isocaloric (248 calories/L) macronutrient balancing diets used in the feeding assay, which differ in the protein to carbohydrate (P:C) ratios: 1:1, 1:4 and 1:16. The beige dot represents the diet used to rear the experimental third-instar larvae (L3), which contained a P:C ratio of 1:2 and a caloric density of 495 calories/L. (B) Detailed composition and nutritional information of the sucrose-yeast (SY) based diets. The components are the same for all the diets: agar, sucrose and yeast. The amount in grams of the components needed to prepare 1 L of diet is shown. Note that 1% (v/v) of blue dye must be added to the macronutrient balancing diets and to the L3 rearing diet nipagin and propionic acid solutions must be added to a final concentration (v/v) of 3% and 0.3%, respectively. Please click here to view a larger version of this figure.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon