Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Cuantificación De La Ingesta De Macronutrientes En Una Pantalla Neuronal Termogenética Usando Larvas De Drosophila
En este artículo
Erratum Notice
Resumen
Aquí se describe un protocolo que permite la cuantificación colorimétrica de la cantidad de alimentos ingeridos dentro de un intervalo de tiempo definido por las larvas de Drosophila melanogaster expuestas a dietas de diferente calidad de macronutrientes. Estos ensayos se llevan a cabo en el contexto de una pantalla termogenética neuronal.
Resumen
Los comportamientos de forrajeo y alimentación permiten a los animales acceder a fuentes de energía y nutrientes esenciales para su desarrollo, salud y condición física. La investigación de la regulación neuronal de estos comportamientos es esencial para la comprensión de los mecanismos fisiológicos y moleculares que subyacen a la homeostasis nutricional. El uso de modelos animales genéticamente manejables como gusanos, moscas y peces facilita en gran medida este tipo de estudios. En la última década, la mosca de la fruta Drosophila melanogaster ha sido utilizada como un poderoso modelo animal por los neurobiólogos que investigan el control neuronal de la alimentación y los comportamientos de forrajeo. Aunque indudablemente valioso, la mayoría de los estudios examinan las moscas adultas. Aquí, describimos un protocolo que se aprovecha del sistema nervioso larval más simple para investigar los sustratos neuronales que controlan los comportamientos de alimentación cuando las larvas se exponen a dietas que difieren en su contenido de proteínas y carbohidratos. Nuestros métodos se basan en un ensayo cuantitativo de alimentación colorimétrica sin elección, realizado en el contexto de una pantalla de activación termogenética neuronal. Como lectura, la cantidad de comida consumida por las larvas durante un intervalo de 1 h fue utilizada cuando estaba expuesta a una de las tres dietas tinte-etiquetadas que diferencian en su proteína a los ratios de los carbohidratos (P: C). La eficacia de este protocolo se demuestra en el contexto de un cribado neurogenético en larvas de Drosophila,mediante la identificación de poblaciones neuronales candidatas que regulan la cantidad de alimentos ingeridos en dietas de diferente calidad macronutrientes. También pudimos clasificar y agrupar los genotipos probados en clases fenotípicas. Además de una breve revisión de los métodos actualmente disponibles en la literatura, las ventajas y las limitaciones de estos métodos se discuten y, también, algunas sugerencias se proporcionan sobre cómo este protocolo se pudo adaptar a otros experimentos específicos.
Introducción
Todos los animales dependen de una dieta equilibrada para adquirir las cantidades necesarias de nutrientes para la supervivencia, el crecimiento y la reproducción1. La elección de qué y cuánto comer está influenciada por una multitud de factores que interactúan relacionados con el estado interno del animal, como el nivel de saciedad, y las condiciones ambientales, como la calidad de los alimentos2,3,4,5. Las proteínas y los carbohidratos son dos macronutrientes principales y su ingesta equilibrada es esencial para sostener los procesos fisiológicos de los animales. Por lo tanto, la comprensión de los mecanismos neuronales que controlan los comportamientos de alimentación y el mantenimiento de una ingesta equilibrada de estos macronutrientes es extremadamente relevante. Esto se debe a que los rasgos de la historia de vida como la esperanza de vida, la fecundidad y la salud metabólica se ven directamente afectados por los niveles de ingesta de proteínas6,7,8,9,10.
El uso de organismos más simples y manejables que exhiben hábitos de alimentación conservados evolutivamente con animales complejos, incluidos mamíferos, es esencial para este tipo de estudios. Es importante destacar que estos modelos animales más simples proporcionan una buena oportunidad para diseccionar preguntas biológicas complejas en un contexto costoso, ética y técnicamente más efectivo. En las últimas décadas, Drosophila,con su potente conjunto de herramientas genéticas, su comportamiento intrincado y estereotipado y su arquitectura conservada de mecanismos periféricos y de detección de nutrientes con mamíferos, ha sido un modelo fructífero para los neurobiólogos conductuales11. En última instancia, la esperanza es que al entender cómo se regula la ingesta de alimentos en este animal, con un sistema nervioso más simple, podamos comenzar a desenredar las disfunciones neuronales subyacentes a los trastornos de la alimentación humana.
El estudio de los sustratos neuronales para los comportamientos de alimentación depende profundamente de poder medir simultáneamente la ingesta de alimentos de los animales mientras se manipula su actividad neuronal. Debido a las cantidades mínimas de alimentos ingeridos, cuantificar la cantidad de alimentos ingeridos por las moscas es extremadamente difícil, y todos los métodos actualmente disponibles presentan limitaciones significativas. Por lo tanto, el patrón oro es utilizar una combinación de metodologías complementarias12. Las moscas adultas han sido históricamente favorecidas como un modelo genético y conductual. Sin embargo, las larvas de Drosophila, también ofrecen oportunidades para investigar sustratos neuronales que codifican el comportamiento de alimentación. El sistema nervioso central (SNC) larval, con alrededor de 12.000 neuronas, es significativamente menos complejo que el del adulto, que contiene aproximadamente 150.000 neuronas. Esta menor complejidad no es solo numérica sino también funcional, ya que los comportamientos larvales dependen de funciones locomotoras y sistemas sensoriales más simples. A pesar de la aparente simplicidad de sus sistemas nerviosos, las larvas todavía exhiben comportamientos de alimentación completos, y se han descrito algunos métodos para cuantificar la ingestión de alimentos en larvas de Drosophila 5,13,14,15. Al emparejarse con manipulaciones de la actividad neuronal, las larvas de Drosophila pueden constituir un modelo altamente manejable para comprender la regulación neuronal de la ingesta de alimentos.
Aquí se proporciona un protocolo detallado para cuantificar la ingesta de alimentos en larvas expuestas a dietas de diferente calidad de macronutrientes. Las dietas, las llamadas dietas de equilibrio de macronutrientes, diferían en el contenido de proteínas y carbohidratos, específicamente con respecto a las proporciones de proteína a carbohidrato (P:C): 1:1 (dieta rica en proteínas), 1:4 (dieta intermedia) y 1:16 (dieta pobre en proteínas), como se muestra en la Figura 1A. Brevemente, un análisis de alimentación cuantitativo de la ninguna-opción fue establecido usando estos tres isocalóricos de la sacarosa-levadura (SY) - dietas basadas teñidas con un tinte azul de la comida. Debido a que el extracto de levadura y la sacarosa se utilizaron como fuentes de proteínas y carbohidratos, y ambos contienen carbohidratos, la variación en las relaciones P:C se obtuvo cambiando el equilibrio de estos dos componentes, como se describió anteriormente16 y como se indica en la Figura 1B. Una visión general esquemática del protocolo, que muestra los principales pasos experimentales, está disponible en la Figura 2.
Este protocolo se estableció con el objetivo de investigar el papel de poblaciones neuronales específicas en la regulación de los niveles de alimentación larvaria en dietas de diferentes ratios P:C y en el contexto de una pantalla neuronal termogenética. Se utilizó una herramienta neurogenética bien caracterizada de la familia del potencial del receptor transitorio (TRP): canal de potencial del receptor transitorio de Drosophila (dTRPA1), que es un canal cationario de temperatura y voltaje bloqueado, que permite el disparo de potenciales de acción cuando las temperaturas ambiente se elevan por encima de 25 °C17. Para expresar el transgén dTRPA1, aprovechamos las líneas Gal4 basadas en regiones cis-reguladoras del genoma de Drosophila, establecidas en el laboratorio Rubin, en el contexto del proyecto FlyLight en janelia Research Campus18,19.
Aunque el protocolo, aquí descrito, se ha establecido en el contexto de una pantalla de activación, puede ser fácilmente adaptado por el experimentador a otras necesidades o intereses específicos, a saber, para realizar una pantalla de supresión utilizando el silenciador neuronal sensible a la temperatura ShibireTS20,en alternativa a dTRPA1. Esta y otras adaptaciones se discuten en las secciones de protocolo y discusión.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Preparación de las dietas de sacarosa-levadura (SY)
- Pesar todos los ingredientes secos (agar, levadura, sacarosa) para el equilibrio de macronutrientes y L3 dietas de cría. Las cantidades en gramos para cada uno de los ingredientes necesarios para preparar 1 L de alimento se indican en la Figura 1B.
NOTA: Tenga en cuenta que se necesitan aproximadamente 13 mL de alimento para llenar una placa de Petri de 60 mm. - Disuelva todos los ingredientes en agua destilada estéril (use aproximadamente el 50% del volumen total de agua necesario para preparar el alimento) y revuelva el medio durante 5-10 min.
- Autoclave durante 50 min.
- Después de dejar que los medios se enfríen, agregue soluciones de nipagina y ácido propiónico a las dietas, a una concentración final (v / v) de 3% y 0.3%, respectivamente. A las dietas de equilibrio de macronutrientes, agregue colorante alimentario azul a una concentración final (v/v) del 1%. Complete los volúmenes totales con agua destilada.
- Vierta cuidadosamente las dietas de los alimentos a placas de Petri de 60 mm, para que la cantidad de alimentos vertidos sea aproximadamente la misma en cada uno de los platos. Etiquete los platos con las proporciones P:C de las dietas.
NOTA: Prepare las dietas de equilibrio de macronutrientes el día del ensayo de alimentación. Si no es posible, guarde las dietas preparadas a 4 °C, en un recipiente sellado, durante un período máximo de 3 días. Los períodos de almacenamiento más largos hacen que la dieta sea demasiado seca y dura, y las larvas no pueden excavar en el medio.
2. Cruce genético de las líneas parentales
NOTA: Utilice el sistema Gal4/UAS21 para configurar los cruces genéticos. En este protocolo, con el fin de activar la función neuronal en poblaciones neuronales específicas, se utilizaron vírgenes femeninas de la línea17 de UAS dTRPA1 y se cruzaron a los machos de las líneas Janelia Gal4(Figura 2A). El control genético utilizado fue la progenie de un cruce entre la línea dTRPA1 y una línea "GAL4 vacía", que lleva Gal4 en el vector utilizado para generar la colección Rubin Gal4 pero sin fragmento regulador presente (attP2)22. Para promover la supresión neuronal, se puede utilizar una línea UAS que codifica ShibireTS20, en lugar de dTRPA1.
- Configure jaulas de recolección de embriones de 60 mm con placas de dieta de cría L3, complementadas con un poco de pasta de levadura activa.
- Transferir las hembras vírgenes UAS dTRPA1 adultas y los machos Janelia Gal4, de 5-8 días de edad, a las jaulas de recolección de embriones y permitir que el apareamiento se produzca durante 24-48 h, a 25 ºC, con un 60% de humedad y un ciclo de luz-oscuridad de 12:12 (Figura 2A). Para jaulas de recolección de embriones de 60 mm, utilice alrededor de 100 hembras vírgenes y 30 machos por cruz.
- Al final del período de apareamiento, retire y deseche las placas de dieta de cría L3 utilizadas en los cruces genéticos. Sustituirlos por placas de dieta de cría L3 frescas, con el fin de realizar la puesta de huevos y la estadificación larvaria.
3. Preparación de larvas de tercer estadio (L3)
- Transferir las moscas adultas apareadas a placas de dieta de cría L3 frescas y permitir que la puesta de huevos se produzca durante 3-4 h, a 25 °C (Figura 2B). Asegúrese de que todos los platos estén etiquetados con el genotipo, la relación P:C de la dieta y la fecha de la disposición del huevo.
NOTA: Para ahorrar tiempo, realice la puesta de huevos directamente en la dieta de cría L3, lo que evita la manipulación adicional de los huevos. En el caso de los tamones genéticos a pequeña escala, la optimización de la puesta de huevos se puede obtener mediante el uso de placas de agar jugo de manzana. - Al final del período de puesta de huevos, retire los platos de las jaulas y cúbralos con tapas de plástico. En caso de que el extracto de levadura se utilice para complementar las placas de cría L3, asegúrese de eliminar toda la levadura residual al final de la puesta de huevos. Esto es importante para evitar la alimentación no uniforme durante el crecimiento larval.
NOTA: Los adultos apareados se pueden transferir a placas de dieta de cría L3 frescas, por lo que se realizan más pones de huevos y se pueden obtener más larvas experimentales. Las pones consecutivas se pueden realizar con los mismos adultos durante toda una semana laboral. - Estimar el número de huevos por plato y mantener la densidad larvaria a un máximo de 200 embriones por plato. Esta estimación se puede hacer contando el número de embriones en una cuarta parte de la placa.
NOTA: Una placa superpoblada retrasará el desarrollo larval y afectará los comportamientos de alimentación de las larvas. - Incubar las placas de cría L3 a 18 °C (temperatura permisiva), 60% de humedad y un ciclo claro-oscuro 12:12, y dejar que las larvas crezcan durante 9 días (Figura 2B).
- En el noveno día después de la puesta de huevos (AEL), recoger tres grupos de 10 L3 de cada uno de los genotipos (y para las réplicas) a probar. Además, recoger grupos de 10 L3 para el control de "alimentos de cero colorantes". Asegúrese de que la recolección de larvas se realiza durante períodos de tiempo equivalentes del día utilizado para hacer la puesta de huevos (por ejemplo, si la puesta de huevos se produjo entre las 10 am-2 pm, recoger las larvas durante el mismo período de tiempo 9 días AEL) y se realiza, tan suavemente como sea posible, mediante el uso de fórceps #5 o un fórceps de peso pluma. Transferir directamente las larvas como se indica en el siguiente paso (3.6).
NOTA: Los animales de control de "alimentos de tinte cero" son larvas que en el ensayo de alimentación reciben alimentos sin colorante azul. Este control es imprescindible para eliminar la absorbancia de fondo de los extractos larvales th. - Transfiera las larvas experimentales recolectadas a botes de plástico que contengan 1 mL de agua. Asegúrese de que se recogen L3, y no L2, siguiendo las instrucciones dadas en la Figura 3.
NOTA: La recolección de L3 a barcos de plástico que contienen agua o 1x solución salina tamponada con fosfato (PBS), es importante para mantener las larvas bien hidratadas antes del inicio del ensayo de alimentación. Esto es especialmente importante si se están recolectando varios grupos experimentales L3 de diferentes genotipos al mismo tiempo. Lleve un registro de la orden de recolección para cada grupo, de modo que se minimicen las diferencias en la duración de la privación de alimentos para cada grupo. El uso de barcos de plástico en este paso facilita el paso opcional 4.3, ya que permite que las larvas floten directamente en el baño de agua.
4. Activación termogenética y ensayo de alimentación sin elección
NOTA: Se recomienda realizar los ensayos de alimentación aproximadamente a la misma hora del día para minimizar las posibles variaciones relacionadas con los ritmos circadianos. Además, siempre se ejecutan los experimentos de control (la progenie de la línea "Gal4 vacía" cruzada a UAS dTRPA1 y las larvas de "alimento de tinte cero" ), en paralelo con los genotipos de interés.
- Configure una incubadora a 30 °C (temperatura no permisiva) y mantenga altos niveles de humedad (al menos 65%) para evitar la deshidratación larvaria durante el ensayo.
- Antes de comenzar el ensayo de alimentación, equilibre la temperatura de las placas de ensayo calentándolas a 30 °C durante 30 min.
- (Opcional) Choque térmico de las larvas experimentales durante 2 min en un baño de agua de 37 °C. Realice este paso con los animales en los botes de peso de plástico que contienen algo de agua.
NOTA: El objetivo de este paso es intensificar la activación neuronal mediante la promoción de la cocción de las neuronas desde el inicio del ensayo de alimentación. - Mantenga los temporizadores múltiples fijados para 1 h listo. El número de temporizadores a utilizar depende del número de grupos experimentales que se están probando y del nivel de habilidad del experimentador en el manejo de larvas.
NOTA: El uso de temporizadores múltiples es crítico para mantener la duración del ensayo consistente para todos los genotipos. - Drene cuidadosamente el agua de los barcos de plástico y, usando un cepillo suave humedado, transfiera suavemente los grupos L3 de los barcos al centro de las placas de ensayo. Vuelva a colocar las tapas de las placas y enciele un temporizador para cada placa (o grupo de placas) para mantener sesiones precisas de alimentación de 1 h.
- Dejar que las larvas se alimenten durante 1 h, a 30 °C, en la oscuridad (Figura 2C).
NOTA: El rendimiento del ensayo en la oscuridad es importante para controlar las diferencias en las señales visuales a través de las dietas, ya que las dietas diferirán en tonos, a pesar de que contienen la misma concentración de colorante. - Detenga el ensayo de alimentación transfiriendo las placas a un baño de hielo. Presione el hielo tanto como sea posible para proporcionar una superficie estable para las placas.
NOTA: Las temperaturas frías promoverán el final de la alimentación al inhibir los comportamientos de madriguera y excavación. La mayoría de las larvas aflorarán los platos de comida después de algunos minutos, facilitando su recuperación en los siguientes pasos.
5. Extracción de colorantes alimentarios
- Prepare 2 mL de microtubos para cada grupo de 10 L3 ensayados, que contengan aproximadamente las mismas cantidades de perlas de vidrio de 0,5 mm (suficientes para llenar la parte inferior del microtubo) y 300 μL de metanol helado. Mantenga los microtubos en el frío, usando un enfriador de banco.
PRECAUCIÓN: El metanol es altamente inflamable y tóxico. Siga todos los procedimientos de seguridad recomendados para manipular este reactivo, incluido el trabajo en un área bien ventilada y el uso de guantes de nitrilo.
NOTA: El uso de metanol es importante para fijar las muestras larvales y evitar reacciones de melanización en la cutícula. - Usando #5 o de peso pluma-lórceps, recupere cuidadosamente los grupos de 10 L3 de las placas de ensayo de alimentación y transfiéralos a las tapas de las placas de ensayo que contienen algo de agua. Enjuague las larvas para eliminar cualquier resto de comida en sus cuerpos mientras manipula suavemente las larvas para evitar cualquier lesión. Mantenga un registro del número de larvas recuperadas para cada genotipo por réplica, de modo que se pueda cuantificar la cantidad media de ingesta de alimentos por larva.
NOTA: Las larvas lesionadas deben ser desechadas ya que tendrán cutícula melanized, siendo inadecuadas para la cuantificación colorimétrica. - Transferir los grupos L3 a los 2 mL de microtubos preparados en 5.1.
- Lyse los tejidos larvales para extraer el colorante alimentario de las tripas por un método de lisis mecánica utilizando un lizer de tejido y perlas de vidrio añadidas en el paso 5.1. (si un lyzer de tejido no está disponible, utilice un pestle homogeneizante). Preferentemente, realice este paso a 4 °C (Figura 2D).
NOTA: La duración de este paso dependerá del equipo utilizado. Usando un lyser convencional del tejido, la extracción de 1 minuto es suficiente. En caso de constricciones de tiempo, el protocolo se puede pausar al final de este paso y continuar más tarde. Almacene las muestras a -20 °C. - Transfiera los extractos para limpiar los microtubos de 1,5 mL, invirtiendo directamente los microtubos de 2 mL en los nuevos microtubos de 1,5 mL. Si se realiza suavemente, la mayoría de las cuentas de vidrio permanecerán en la parte inferior del microtubo de 2 mL.
- Despeje los desechos celulares centrifugasndo los extractos, a una velocidad máxima de 10 min, a 4 °C.
- Recoger los sobrenadantes para limpiar 1,5 mL de microtubos. Si los desechos celulares todavía son visibles en los sobrenadantes, repita los pasos 5.6 y 5.7.
6. Cuantificación colorimétrica del consumo de alimentos
- Preparar soluciones estándar, para generar una curva de calibración, mediante la realización de diluciones de serie 1:2 en metanol de una solución de colorante azul inicial. Como en blanco, use solo metanol. La concentración de las normas depende de los niveles de ingesta de alimentos de los animales.
NOTA: En el caso de la pantalla piloto aquí presentada, como las concentraciones de colorante obtenidas para los extractos larvales variaron de 0,02 a 1,93 μL/mL, se utilizó una curva estándar obtenida midiendo las absorbancias de 8 diluciones seriales de una solución de colorante azul de 2 μL/mL en metanol. Si es necesario, aumente o disminuya la concentración de estas soluciones, dependiendo de la concentración de colorante de las muestras experimentales. - Transferir 100 μL de las muestras experimentales (obtenidas en el paso 5.7), estándares y en blanco (paso 6.1) a los pozos de una microplaca de 96 pozos y medir la absorbancia a 600 nm, utilizando un lector de placas (Figura 2E). Para eliminar la absorbancia de fondo, mida la absorbancia de los extractos obtenidos de larvas alimentadas con alimentos sin colorante azul como un "cero" para los extractos larvales ("control de alimentos de tinte cero").
- Generar una curva estándar y correlacionar los valores de absorbancia obtenidos para las muestras de cada grupo larval experimental con la cantidad de ingesta de alimentos (volumen en mL). Encontrar el consumo medio de alimentos por larva teniendo en cuenta el número de larvas recogidas para cada grupo en el paso 5.2
Access restricted. Please log in or start a trial to view this content.
Resultados
Las larvas de Drosophila regulan su ingesta de proteínas a costa de ingerir el exceso de carbohidratos23 (gráfica esquemática en la Figura 2E). En realidad, esta priorización de la ingesta de proteínas se ha observado en muchos otros animales y se denomina el aprovechamiento de proteínas24,25.
Aprovechando esta robusta respuesta conductual de alimentación, se diseñ?...
Access restricted. Please log in or start a trial to view this content.
Discusión
Con este protocolo, se podría probar la capacidad de las larvas bajo activación termogenética de poblaciones neuronales específicas para regular los niveles de ingesta de proteínas y carbohidratos, dos macronutrientes principales, cuando se exponen a dietas de diferente composición P:C. Este método se probó en el contexto de un cribado preliminar larvario con el objetivo de identificar poblaciones neuronales asociadas con el control de la ingesta de alimentos a través de dietas de diferente calidad de macronutri...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Nos gustaría dar las gracias al Instituto Gulbenkian de Ciência (IGC) por proporcionarnos acceso a parte de los equipos experimentales descritos en este protocolo. Este trabajo fue apoyado por la Fundación Portuguesa para la Ciencia y la Tecnología (FCT), LISBOA-01-0145-FEDER-007660, PTDC/NEU- NMC/2459/2014, IF/00697/2014 y La Caixa HR17-00595 a PMD y por una beca del Australian Research Council Future (FT170100259) a CKM.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| 1.5 mL microtubes | Sarstedt AG & Co. | 72.690.001 | |
| 10xPBS | Nytech | MB18201 | |
| 2.0 mL microtubes | Sarstedt AG & Co. | 72.695.500 | |
| 60 mm petri dishes | Greiner Bio-one, Austria | 628161 | |
| 96 well microplates | Santa Cruz Biotechnology | SC-204453 | |
| Agar | Pró-vida, Portugal | ||
| Bench cooler | Nalgene, USA | Labtop Cooler 5115-0032 | |
| Blue food dye | Rayner, Billingshurst, UK | ||
| Cell disruption media | Scientific Industries, Inc. | 888-850-6208 | (0.5 mm glass beads) |
| Dish weight boats | Santa Cruz Biotechnology | SC-201606 | |
| Embryo collection cage for 60 mm petri dishes | Flystuff, Scientific Laboratory Supplies, UK | FLY1212 (59-100) | |
| Featherweight forceps | BioQuip Products, USA | 4750 | |
| Fly food for stocks maintenance | 1 L food contains: 10 g Agar, 100 g Yeast Extract, 50 g Sucrose, 30 mL Nipagin, 3 mL propionic acid | ||
| Forceps #5 | Dumont | 0108-5-PS | Standard tips, INOX, 11cm |
| Incubator | LMS Ltd, UK | Series 2, Model 230 | For thermogenetic feeding assay (30?C) |
| Incubator | Percival Scientific, USA | DR36NL | To stage larvae (19?C) |
| Janelia lines | Janelia Research Campus | Detailed information in Table 2 | |
| Macronutrient balancing diets | Composition and nutritional information in Figure 1 | ||
| Methanol | VWR | CAS number: 67-56-1 | |
| Nipagin (Methyl 4-hydroxybenzoate) | Sigma-Aldrich | H5501 | |
| Nitrile gloves | VWR, USA | ||
| Refrigerated centrifuge | Eppendorf, Germany | 5804 R / Serial number: 5805CI364293 | |
| Rubin Gal4 ines | Janelia Research Campus | Stoks available at Bloomington Drosophila Stock Center | |
| ShibireTS UAS line | Bloomington Drosophila Stock Center | BDSC number: 66600 | Provided by Carlos Ribeiro Group |
| Soft brushes | For sorting anaesthetised fruit flies | ||
| Spectrophotometer plate reader | Thermo Fisher Scientific | Multiskan Go 51119300 | |
| Stereo microscope | Nikon | 1016625 | |
| Sucrose | Sidul, Portugal | ||
| Third-instar larvae (L3) rearing diet | Composition and nutritional information in Figure 1 | ||
| Timer | |||
| Tissue lyzer / bead beater | MP Biomedicals, USA | FastPrep-24 6004500 | |
| TRPA1 UAS line | Bloomington Drosophila Stock Center | BDSC number: 26264 | Expresses TrpA1 under UAS control; may be used to activate neurons experimentally at 25 ?C |
| Water bath | Sheldon Manufacturing Inc., USA | W20M-2 / 03068308 / 9021195 | |
| Yeast extract | Pró-vida, Portugal | 51% Protein, 15% Carbohydrate |
Referencias
- Raubenheimer, D. Nature of nutrition - a unifying framework from animal adaptation to human. , (2012).
- Carvahlo, M. J. a, Mirth, C. K. Coordinating morphology with behavior during development: an integrative approach from a fly perspective. Frontiers in Ecology and Evolution. , (2015).
- Steck, K., et al. Internal amino acid state modulates yeast taste neurons to support protein homeostasis in Drosophila. Elife. 7, 31625(2018).
- Itskov, P. M., Ribeiro, C. The dilemmas of the gourmet fly: the molecular and neuronal mechanisms of feeding and nutrient decision making in Drosophila. Frontiers in Neuroscience. 7, 12(2013).
- Bjordal, M., Arquier, N., Kniazeff, J., Pin, J. P., Leopold, P. Sensing of amino acids in a dopaminergic circuitry promotes rejection of an incomplete diet in Drosophila. Cell. 156 (3), 510-521 (2014).
- Grandison, R. C., Piper, M. D., Partridge, L. Amino-acid imbalance explains extension of lifespan by dietary restriction in Drosophila. Nature. 462 (7276), 1061-1064 (2009).
- Lee, K. P., et al. Lifespan and reproduction in Drosophila: New insights from nutritional geometry. Proceedings of the National Academy of Sciences of the United States of America. 105 (7), 2498-2503 (2008).
- Levine, M. E., et al. Low protein intake is associated with a major reduction in IGF-1, cancer, and overall mortality in the 65 and younger but not older population. Cell Metabolism. 19 (3), 407-417 (2014).
- Solon-Biet, S. M., et al. The ratio of macronutrients, not caloric intake, dictates cardiometabolic health, aging, and longevity in ad libitum-fed mice. Cell Metabolism. 19 (3), 418-430 (2014).
- Piper, M. D., et al. A holidic medium for Drosophila melanogaster. Nature Methods. 11 (1), 100-105 (2014).
- Jones, W. D. The expanding reach of the GAL4/UAS system into the behavioral neurobiology of Drosophila. BMB Reports. 42 (11), 705-712 (2009).
- Deshpande, S. A., et al. Quantifying Drosophila food intake: comparative analysis of current methodology. Nature Methods. 11 (5), 535-540 (2014).
- Neckameyer, W. S. A trophic role for serotonin in the development of a simple feeding circuit. Developmental Neuroscience. 32 (3), 217-237 (2010).
- Gasque, G., Conway, S., Huang, J., Rao, Y., Vosshall, L. B. Small molecule drug screening in Drosophila identifies the 5HT2A receptor as a feeding modulation target. Scientific Reports. 3, (2013).
- Schoofs, A., et al. Selection of motor programs for suppressing food intake and inducing locomotion in the Drosophila brain. PLoS Biology. 12 (6), 1001893(2014).
- Pocas, G. M., Crosbie, A. E., Mirth, C. K. When does diet matter? The roles of larval and adult nutrition in regulating adult size traits in Drosophila melanogaster. Journal of Insect Physiology. , 104051(2020).
- Hamada, F. N., et al. An internal thermal sensor controlling temperature preference in Drosophila. Nature. 454 (7201), 217-220 (2008).
- Pfeiffer, B. D., et al. Tools for neuroanatomy and neurogenetics in Drosophila. Proceedings of the National Academy of Sciences of the United States of America. 105 (28), 9715-9720 (2008).
- Jenett, A., et al. A GAL4-driver line resource for Drosophila neurobiology. Cell Reports. 2 (4), 991-1001 (2012).
- Kitamoto, T. Conditional modification of behavior in Drosophila by targeted expression of a temperature-sensitive shibire allele in defined neurons. Journal of Neurobiology. 47 (2), 81-92 (2001).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Shirangi, T. R., Stern, D. L., Truman, J. W. Motor control of Drosophila courtship song. Cell Reports. 5 (3), 678-686 (2013).
- Mirth, C. M. J. Food intake and food choice are altered by the developmental transition at critical weight in Drosophila melanogaster. Animal Behaviour. 126, 195-208 (2017).
- Simpson, S. J., Raubenheimer, D. Obesity: the protein leverage hypothesis. Obesity Reviews. 6 (2), 133-142 (2005).
- Raubenheimer, D., Simpson, S. J. Integrative models of nutrient balancing: application to insects and vertebrates. Nutrition Research Reviews. 10 (1), 151-179 (1997).
- Li, H. H., et al. A GAL4 driver resource for developmental and behavioral studies on the larval CNS of Drosophila. Cell Reports. 8 (3), 897-908 (2014).
- Bhatt, P. K., Neckameyer, W. S. Functional analysis of the larval feeding circuit in Drosophila. Journal of Visualized Experiments. (81), e51062(2013).
- Wong, R., Piper, M. D. W., Blanc, E., Partridge, L. Pitfalls of measuring feeding rate in the fruit fly Drosophila melanogaster. Nature Methods. 5 (3), 214-215 (2008).
- Almeida-Carvalho, M. J., et al. The Ol1mpiad: concordance of behavioural faculties of stage 1 and stage 3 Drosophila larvae. Journal of Experimental Biology. 220, Pt 13 2452-2475 (2017).
- Rodrigues, M. A., et al. Drosophila melanogaster larvae make nutritional choices that minimize developmental time. Journal of Insect Physiology. 81, 69-80 (2015).
- Wong, R., Piper, M. D., Wertheim, B., Partridge, L. Quantification of food intake in Drosophila. PLoS One. 4 (6), 6063(2009).
- Wu, Q., et al. Developmental control of foraging and social behavior by the Drosophila neuropeptide Y-like system. Neuron. 39 (1), 147-161 (2003).
- Wu, Q., Zhang, Y., Xu, J., Shen, P. Regulation of hunger-driven behaviors by neural ribosomal S6 kinase in Drosophila. Proceedings of the National Academy of Sciences of the United States of America. 102 (37), 13289-13294 (2005).
- Lingo, P. R., Zhao, Z., Shen, P. Co-regulation of cold-resistant food acquisition by insulin- and neuropeptide Y-like systems in Drosophila melanogaster. Neuroscience. 148 (2), 371-374 (2007).
Access restricted. Please log in or start a trial to view this content.
Erratum
Formal Correction: Erratum: Quantification of Macronutrients Intake in a Thermogenetic Neuronal Screen using Drosophila Larvae
Posted by JoVE Editors on 10/06/2020. Citeable Link.
An erratum was issued for: Quantification of Macronutrients Intake in a Thermogenetic Neuronal Screen using Drosophila Larvae. A figure was updated.
Figure 1 was updated from:
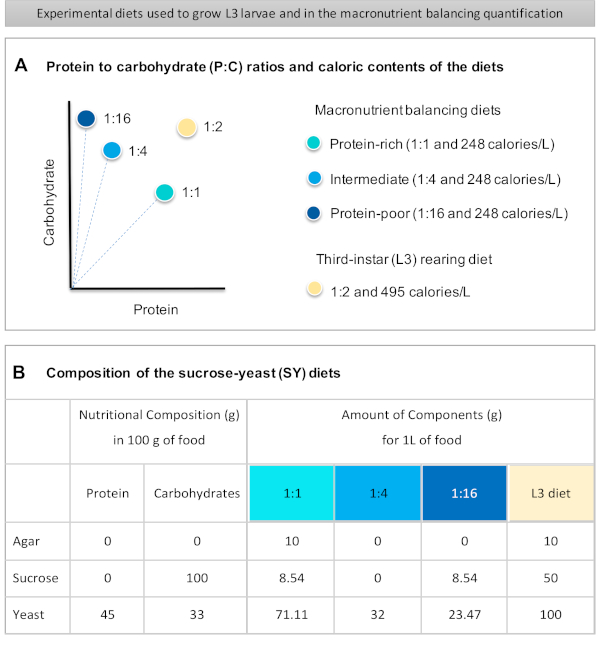
Figure 1: The sucrose-yeast (SY) diets used in our protocol. (A) The blue dots represent the isocaloric (248 calories/L) macronutrient balancing diets used in the feeding assay, which differ in the protein to carbohydrate (P:C) ratios: 1:1, 1:4 and 1:16. The beige dot represents the diet used to rear the experimental third-instar larvae (L3), which contained a P:C ratio of 1:2 and a caloric density of 495 calories/L. (B) Detailed composition and nutritional information of the sucrose-yeast (SY) based diets. The components are the same for all the diets: agar, sucrose and yeast. The amount in grams of the components needed to prepare 1 L of diet is shown. Note that 1% (v/v) of blue dye must be added to the macronutrient balancing diets and to the L3 rearing diet nipagin and propionic acid solutions must be added to a final concentration (v/v) of 3% and 0.3%, respectively. Please click here to view a larger version of this figure.
to:
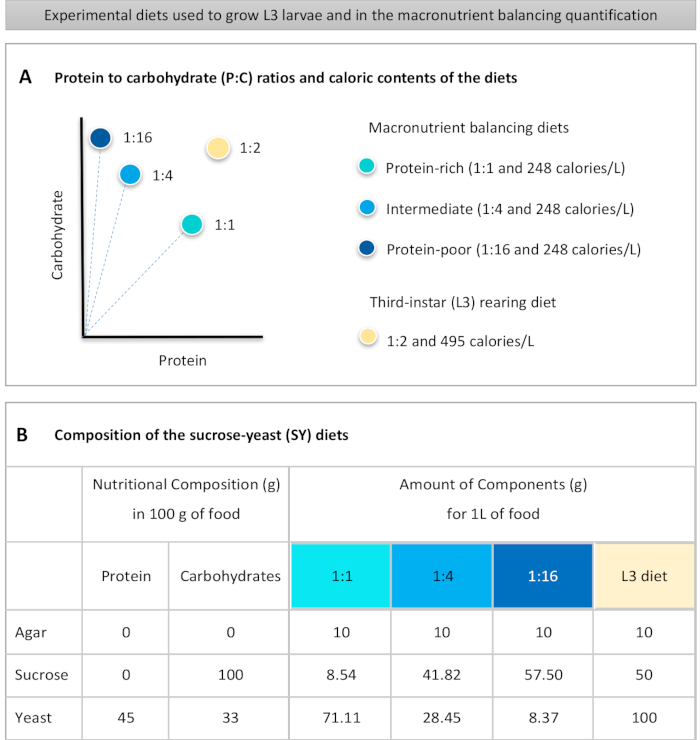
Figure 1: The sucrose-yeast (SY) diets used in our protocol. (A) The blue dots represent the isocaloric (248 calories/L) macronutrient balancing diets used in the feeding assay, which differ in the protein to carbohydrate (P:C) ratios: 1:1, 1:4 and 1:16. The beige dot represents the diet used to rear the experimental third-instar larvae (L3), which contained a P:C ratio of 1:2 and a caloric density of 495 calories/L. (B) Detailed composition and nutritional information of the sucrose-yeast (SY) based diets. The components are the same for all the diets: agar, sucrose and yeast. The amount in grams of the components needed to prepare 1 L of diet is shown. Note that 1% (v/v) of blue dye must be added to the macronutrient balancing diets and to the L3 rearing diet nipagin and propionic acid solutions must be added to a final concentration (v/v) of 3% and 0.3%, respectively. Please click here to view a larger version of this figure.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados