Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Количественная оценка приема макроэлементов в термогенетического нейронального экрана с использованием drosophila Larvae
В этой статье
Erratum Notice
Резюме
Описано здесь протокол, который позволяет колоритной количественной оценки количества пищи, съеденной в течение определенного промежутка времени личинками Drosophila melanogaster подвергаются диеты различного качества макроэлементов. Эти анализы проводятся в контексте нейронального термогенетического экрана.
Аннотация
Поведение кормления и кормления позволяет животным получить доступ к источникам энергии и питательных веществ, необходимых для их развития, здоровья и фитнеса. Исследование нейронной регуляции этих поведений имеет важное значение для понимания физиологических и молекулярных механизмов, лежащих в основе питания гомеостаза. Использование генетически урочищеемых моделей животных, таких как черви, мухи и рыбы значительно облегчает эти типы исследований. В последнее десятилетие, плодовая муха Drosophila меланогастер был использован в качестве мощной модели животных нейробиологов исследования нейронального контроля кормления и кормления поведения. Хотя, несомненно, ценно, большинство исследований изучить взрослых мух. Здесь мы описываем протокол, который использует более простую личиночинок нервной системы для исследования нейрональных субстратов, контролирующих поведение кормления, когда личинки подвергаются воздействию диет, отличающихся содержанием белка и углеводов. Наши методы основаны на количественном колоритном не-выбор кормления анализ, выполненный в контексте нейронной термогенетической активации экрана. Как считыв, количество пищи, съеденной личинками в течение 1 ч интервал был использован при воздействии одного из трех красителей помечены диеты, которые отличаются по своим белкам углеводов (P:C) отношения. Эффективность этого протокола демонстрируется в контексте нейрогенетического экрана в личинке Drosophila, путем выявления кандидатов нейрональных популяций, регулирующих количество пищи, съеденной в диетах различного качества макроэлементов. Мы также смогли классифицировать и группировал генотипы, протестированные на фенотипические классы. Помимо краткого обзора имеющихся в настоящее время методов в литературе, обсуждаются преимущества и ограничения этих методов, а также некоторые предложения о том, каким образом этот протокол может быть адаптирован к другим конкретным экспериментам.
Введение
Все животные зависят от сбалансированного питания, чтобы приобрести необходимое количество питательных веществ для выживания, роста и воспроизводства1. На выбор того, что и сколько есть, влияет множество взаимодействующих факторов, связанных с внутренним состоянием животного, таких как уровень сытости, и условия окружающей среды, такие каккачество продуктов питания 2,3,4,5. Белок и углеводы являются двумя основными макроэлементами, и их сбалансированное потребление имеет важное значение для поддержания физиологических процессов животных. Таким образом, понимание нейронных механизмов, контролирующих поведение кормления и поддержания сбалансированного потребления этих макроэлементов является чрезвычайно актуальным. Это потому, что черты истории жизни, как продолжительность жизни, плодовитость, и метаболическоездоровье непосредственно зависит от уровня потребления белка 6,7,8,9,10.
Использование более простых более урочищенные организмы, которые демонстрируют эволюционно сохраненные привычки кормления со сложными животными, в том числе млекопитающих, имеет важное значение для этого типа исследований. Важно отметить, что эти более простые модели животных дают хорошую возможность для вскрытия сложных биологических вопросов в дорогостоящем, этически и технически более эффективном контексте. В последние десятилетия, Drosophila, с его мощным генетическим инструментарием, сложные и стереотипное поведение и сохраненной архитектуры периферических и питательных механизмов зондирования с млекопитающими, была плодотворной моделью для поведенческих нейробиологов11. В конечном счете, надежда заключается в том, что, понимая, как потребление пищи регулируется в этом животном, с более простой нервной системы, мы можем начать распутать нейрональных неисправностей, лежащих в основе расстройства пищевого поведения человека.
Изучение нейрональных субстратов для кормления поведения глубоко зависит от возможности одновременно измерять потребление пищи животными при манипулировании их нейрональной активностью. Из-за минимального количества пищи попадает, количественное количество пищи, съеденной мухами является чрезвычайно сложной задачей, и все методы в настоящее время имеются в настоящее время представляют значительные ограничения. Таким образом, золотой стандарт заключается в использовании комбинации дополнительных методологий12. Взрослые мухи исторически благоприятствования в качестве генетической и поведенческой модели. Тем не менее, личинки дрозофилы, также предлагают возможности для исследования нейрональных субстратов, кодирующих поведение кормления. Личиновала центральной нервной системы (ЦНС), около 12000 нейронов, значительно менее сложным, чем у взрослых, который содержит около 150000 нейронов. Эта более низкая сложность не только численная, но и функциональная, так как личинонное поведение зависит от более простых локомотивных функций и сенсорных систем. Несмотря на кажущуюся простоту их нервной системы, личинки по-прежнему демонстрируют полное поведение кормления, и некоторые методы количественного приема пищи в личинках дрозофилыбыли описаны 5,13,14,15. Спаривая с манипуляциями нейронной активности, личинки дрозофилы могут представлять собой очень урочиваемую модель для понимания нервной регуляции потребления пищи.
Здесь представлен подробный протокол количественной оценки потребления пищи личинками, подвергаемыми воздействию диет различного макроэлементного качества. Диеты, так называемые макроэлементные балансирующие диеты, отличались содержанием белков и углеводов, в частности, в отношении соотношения белка к углеводам (P:C) 1:1 (богатая белком диета), 1:4 (промежуточная диета) и 1:16 (плохое питание с белками), как показано на рисунке 1A. Кратко, количественный не-выбор кормления анализ был создан с использованием этих трех изокалорических сахарозы-дрожжи (SY) на основе диеты окрашены с синим красителем пищи. Поскольку экстракт дрожжей и сахароза были использованы в качестве белковых и углеводных источников, и оба содержат углеводы, изменение в соотношении P:C было получено путем изменения баланса этих двух компонентов, как ранееописано 16 и, как указано на рисунке 1B. Схематический обзор протокола, показывающий основные экспериментальные этапы, доступен на рисунке 2.
Этот протокол был создан с целью изучения роли конкретных популяций нейронов на регулирование уровней кормления личинок в диетах различных соотношений P:C и в контексте термогенетического нейронального экрана. Хорошо охарактеризованный нейрогенетический инструмент был использован из семьи Transient Receptor Potential (TRP) : Drosophila Transient Receptor Potential channel (dTRPA1), который является температурным и напряжением закрытым каналом катиона, позволяющим стрелять потенциалами действия, когда температура окружающей среды поднимается выше 25градусов по Цельсию 17. Чтобы выразить dTRPA1 трансген, мы воспользовались Gal4 линий, основанных на cis-регулятивных регионах из генома Drosophila, созданный в лаборатории Рубин, в контексте проекта FlyLight в Janelia Research Campus18,19.
Хотя протокол, здесь описано, был создан в контексте экрана активации, он может быть легко адаптирован экспериментатором к другим конкретным потребностям или интересам, а именно для выполнения подавления экрана с использованием температуры чувствительных нейронов глушитель ShibireTS20, в качестве альтернативы dTRPA1. Эта и другие адаптации обсуждаются в разделах протокола и обсуждения.
Access restricted. Please log in or start a trial to view this content.
протокол
1. Подготовка сахарозно-дрожжевой (SY) диеты
- Взвесите все сухие ингредиенты (агар, дрожжи, сахароза) для макроэлементной балансировки и L3 воспитания диеты. Количество в граммах для каждого из ингредиентов, необходимых для приготовления 1 л пищи, указано на рисунке 1B.
ПРИМЕЧАНИЕ: Примите во внимание, что для заполнения 60-мм чашки Петри необходимо около 13 мл пищи. - Растворите все ингредиенты в стерильной дистиллированной воде (используйте около 50% от общего объема воды, необходимой для приготовления пищи) и перемешайте среду в течение 5-10 мин.
- Автоклав за 50 мин.
- После того, как среды остынет, добавьте в рацион растворы нипагина и пропионовой кислоты, при окончательной концентрации (v/v) 3% и 0,3% соответственно. К макроэлементным балансирующим диетам добавьте синий пищевой краситель в окончательную концентрацию (v/v) в размере 1%. Завершите общие объемы дистиллированной водой.
- Тщательно налейте пищевые диеты до 60 мм чашки Петри, так что количество налитой пищи примерно одинаково в каждой из тарелок. Этикетка пластин с P:C отношения диет.
ПРИМЕЧАНИЕ: Подготовьте макроэлементные балансирующие диеты в день анализа кормления. Если это невозможно, храните подготовленные диеты при 4 градусах Цельсия, в запечатанном контейнере, в течение максимум 3 дней. Более длительные периоды хранения делают диету слишком сухой и трудной, и личинки не могут зарыться в среду.
2. Генетический крест родительских линий
ПРИМЕЧАНИЕ: Используйте систему Gal4/UAS21 для настройки генетических крестов. В этом протоколе, для того, чтобы активировать нейронную функцию в конкретных популяциях нейронов, женские девственницы линии17 UAS dTRPA1 были использованы и перешли к мужчинам из линий Janelia Gal4 (Рисунок 2A). Используемый генетический контроль был потомок креста между линией dTRPA1 и линией "пустой GAL4", которая несет Gal4 в векторе, используемом для создания коллекции Rubin Gal4, но без регулятивного фрагмента (attP2)22. Для содействия подавлению нейронов вместо dTRPA1 можно использовать линию UAS, кодирующей ShibireTS20.
- Настройка 60 мм эмбриона сбора клеток с L3 воспитания диетические пластины, дополненные некоторыми активными дрожжевой пасты.
- Перенесите взрослых девочек-девственниц UAS dTRPA1 и самцов Janelia Gal4 в возрасте 5-8 дней в клетки сбора эмбрионов и позвольте спариваться в течение 24-48 ч, при 25 градусах Цельсия, с влажностью 60% и светло-темным циклом 12:12(рисунок 2A). Для 60 мм эмбрионов сбора клеток, использовать около 100 девственных женщин и 30 мужчин на крест.
- В конце брачного периода удалите и отбросьте пластины L3, воспитающие диетические пластины, используемые в генетических крестах. Замените их свежими пластинами L3, для выполнения яичного откладки и постановки личинок.
3. Подготовка личинок третьей звезды (L3)
- Передача спариваемых взрослых мух на свежие пластины L3 воспитания диеты и позволяют яйцекладки происходит в течение 3-4 ч, при 25 градусов по Цельсию (Рисунок 2B). Убедитесь, что все пластины помечены генотипом, P:C соотношение диеты и даты яичного откладывают.
ПРИМЕЧАНИЕ: Чтобы сэкономить время, выполнить яйцекладки непосредственно в L3 воспитания диеты, которая позволяет избежать дополнительной обработки яиц. В случае небольших генетических скринингов, оптимизация яйцекладки может быть получена с помощью яблочного сока агар пластин. - В конце периода откладки яиц снимите пластины с клеток и накройте их пластиковыми крышками. В случае, если дрожжевой экстракт используется в дополнение к L3 воспитания пластин, убедитесь, что удалить все остаточные дрожжи в конце яйцекладки. Это важно, чтобы избежать необугового кормления во время роста личинок.
ПРИМЕЧАНИЕ: Спариваемые взрослые могут быть переведены на свежие L3 воспитания диетические тарелки, так что больше яиц откладывает выполняются, и более экспериментальных личинок могут быть получены. Последовательные яйцеклады могут быть выполнены с теми же взрослыми в течение одной рабочей недели. - Оцените количество яйцеклеток на тарелку и держите плотность личинок максимум до 200 эмбрионов на тарелку. Эту оценку можно сделать, подсчитав количество эмбрионов в одной четверти пластины.
ПРИМЕЧАНИЕ: Переполненная пластина задерживает развитие личинок и влияет на поведение кормления личинок. - Инкубировать L3 воспитания пластин при температуре 18 градусов по Цельсию (разрешительной температуры), 60% влажности и 12:12 светло-темный цикл, и позволяют личинкам расти в течение 9 дней(рисунок 2B).
- На девятый день после откладки яиц (AEL) соберите три группы по 10 Л3 с каждого из генотипов (и для репликаций), которые будут протестированы. Кроме того, собирать группы по 10 L3 для "нулевой краситель пищи" контроля. Убедитесь, что сбор личинок осуществляется в течение эквивалентных периодов времени дня, используемых для яичного откладывания (например, если откладывания яиц произошло между 10 утра-2 вечера, собирать личинки в течение того же периода времени 9 дней AEL) и выполняется, как можно мягче, с помощью миппов #5 или полулегком типпов. Непосредственно перенесите личинки, как указано на следующем шаге (3,6).
ПРИМЕЧАНИЕ: "нулевой краситель пищи" контроль животных личинок, которые в кормления анализ дают пищу без синего красителя. Этот контроль необходим для удаления фонового поглощения экстрактов личинок. - Перенесите собранные экспериментальные личинки на пластиковые лодки весом в тарелку, содержащие 1 мл воды. Убедитесь, что L3 собраны, а не L2, следуя указаниям, приведенные на рисунке 3.
ПРИМЕЧАНИЕ: Сбор L3 для пластиковых лодок, содержащих воду или 1x фосфат-буферный солевой раствор (PBS), важно держать личинки хорошо гидратированных до начала кормления анализа. Это особенно важно, если одновременно собирают несколько экспериментальных групп L3 из разных генотипов. Следите за порядком сбора для каждой группы, поэтому различия в продолжительности нехватки продовольствия для каждой группы сведены к минимуму. Использование пластиковых лодок на этом этапе облегчает дополнительный шаг 4.3, поскольку он позволяет личинкам плавать прямо в водяной бане.
4. Термогенетическая активация и анализ кормления без выбора
ПРИМЕЧАНИЕ: Рекомендуется проводить анализы кормления примерно в одно и то же время дня, чтобы свести к минимуму возможные изменения, связанные с циркадными ритмами. Кроме того, всегда запускать контрольные эксперименты (потомство "пустой Gal4" линии перешли на UAS dTRPA1 и "нулевой краситель пищи" личинки), параллельно с генотипами интереса.
- Настройка инкубатора до 30 градусов по Цельсию (не вседозволенность) и поддерживать высокий уровень влажности (не менее 65%) чтобы избежать обезвоживания личинок во время анализа.
- Перед началом анализа кормления, уравночные анализ пластин температуры, нагревая их при температуре 30 градусов по Цельсию в течение 30 минут.
- (По желанию) Тепло-шок экспериментальных личинок в течение 2 мин в 37 С водяной бане. Выполните этот шаг с животными в пластиковых лодках вес, содержащий немного воды.
ПРИМЕЧАНИЕ: Цель этого шага заключается в активизации нейрональной активации путем поощрения стрельбы нейронов с начала кормления анализа. - Держите несколько таймеров набор для 1 ч готов. Количество используемых таймеров зависит от количества тестируемых экспериментальных групп и от уровня мастерства экспериментатора по обработке личинок.
ПРИМЕЧАНИЕ: Использование нескольких таймеров имеет решающее значение для того, чтобы сохранить продолжительность анализа последовательной для всех генотипов. - Тщательно слейте воду из пластиковых лодок и, используя увлажненной мягкой щеткой, аккуратно перенесите группы L3 с лодок в центр анализных пластин. Положите крышки пластин обратно и начать таймер для каждой пластины (или группы пластин) для поддержания точных 1-ч кормления сессий.
- Разрешить личинки кормить в течение 1 ч, при 30 градусов по Цельсию, в темноте(рисунок 2C).
ПРИМЕЧАНИЕ: Производительность анализа в темноте важно контролировать различия в визуальных сигналов через диеты, так как диеты будут отличаться в тонах, даже если они содержат ту же концентрацию красителя. - Остановите анализ кормления путем переноса тарелок в ледяную ванну. Нажмите вниз лед как можно больше, чтобы обеспечить стабильную поверхность для пластин.
ПРИМЕЧАНИЕ: Холодные температуры будут способствовать концу кормления путем ингибирования рытья и копать поведения. Большинство личинок будет поверхность пищевых пластин через несколько минут, облегчая их восстановление в следующих шагах.
5. Извлечение пищевых красителей
- Приготовьте 2 мл микротрубок для каждой группы из 10 проверенных L3, содержащих примерно одинаковое количество 0,5 мм стеклянных бусин (достаточно, чтобы заполнить нижнюю часть микротрубки) и 300 л ледяного метанола. Держите микротрубки на холоде, используя кулер скамейки.
ВНИМАНИЕ: Метанол легковоспламеняющийся и токсичный. Следуйте всем процедурам безопасности, рекомендованным для обработки этого реагента, включая работу в хорошо проветриваемой зоне и ношение нитриловых перчаток.
ПРИМЕЧАНИЕ: Использование метанола важно исправить личиночных образцов и избежать меланизации реакций в кутикуле. - Используя #5 или полулегком храпс, тщательно восстановить группы 10 L3 от кормления анализ пластин и передать их на крышки анализных пластин, содержащих немного воды. Промыть личинки, чтобы удалить любой пищевой мусор на их телах при мягкой обработке личинок, чтобы избежать каких-либо травм. Велась запись о количестве личинок, восстановленных для каждого генотипа на репликацию, так что среднее количество потребления пищи на личинку может быть количественно.
ПРИМЕЧАНИЕ: Травмированные личинки должны быть отброшены, поскольку они будут иметь меланизованную кутикулу, будучи непригодными для колоритной количественной оценки. - Перенесите группы L3 на микротрубки 2 мл, подготовленные за 5,1.
- Lyse личиночинок тканей для извлечения пищевого красителя из кишечника методом механического лиза с помощью ткани лизер и стеклянные бусы добавил в шаге 5.1. (если лизер ткани недоступен, используйте гомогенизирующий пестик). Преимущественно, выполните этот шаг при 4 кк(рисунок 2D).
ПРИМЕЧАНИЕ: Продолжительность этого шага будет зависеть от используемого оборудования. Используя обычный тканевой лизер, достаточно 1 мин экстракции. В случае сужения времени протокол может быть приостановлен в конце этого шага и продолжен позже. Храните образцы при -20 градусов по Цельсию. - Перенесите экстракты на чистые микротрубки 1,5 мл, непосредственно инвертирование микротрубок 2 мл на новые микротрубки 1,5 мл. При мягком исполнении большая часть стеклянных бусин останется в нижней части микротрубки 2 мл.
- Очистим клеточный мусор, центрифугировать экстракты, на максимальной скорости в течение 10 минут, при 4 градусах Цельсия.
- Соберите супернатанты для очистки микротрубок 1,5 мл. Если клеточный мусор все еще виден в супернатантах, повторите шаги 5.6 и 5.7.
6. Колоритетрическая количественная оценка потребления продовольствия
- Подготовь стандартные решения, чтобы создать кривую калибровки, выполняя серийные разбавления 1:2 метанолом стартового раствора синего красителя. Как пустой, использовать метанол только. Концентрация стандартов зависит от уровня потребления пищи животными.
ПРИМЕЧАНИЕ: В случае пилотного экрана, представленного здесь, так как концентрации красителя, полученные для экстрактов личинок, варьировались от 0,02 до 1,93 мкл/мл, использовалась стандартная кривая, полученная путем измерения абсорбций 8 серийных разбавлений раствора синего красителя 2 мл/мл в метаноле. При необходимости увеличьте или уменьшите концентрацию этих растворов, в зависимости от концентрации красителя экспериментальных образцов. - Передача 100 МКЛ экспериментальных образцов (полученных в шаге 5.7), стандартов и пустой (шаг 6.1) к скважинам 96-хорошо микроплюеты и измерить абсорбанс на 600 нм, используя считыватель пластины (Рисунок 2E). Чтобы удалить фоновое поглощение, измерьте абсорбтность экстрактов, полученных из личинок, питающихся пищей без синего красителя, как «ноль» для экстрактов личинок («нулевой контроль качества пищи»).
- Создайте стандартную кривую и соотносите значения абсорбтора, полученные для образцов из каждой экспериментальной группы личинок, с количеством потребления пищи (объем в мл). Найдите среднее потребление пищи на личинку, принимая во внимание количество личинок, собранных для каждой группы в шаге 5.2
Access restricted. Please log in or start a trial to view this content.
Результаты
Личинки дрозофилы регулируют потребление белка за счет приема лишних углеводов23 (схематический участок на рисунке 2E). На самом деле, это приоритетность потребления белка наблюдается во многих других животных и называется белка,используя 24
Access restricted. Please log in or start a trial to view this content.
Обсуждение
С помощью этого протокола можно было проверить способность личинок под термогенетическую активацию конкретных нейронных популяций регулировать уровень потребления белков и углеводов, двух основных макроэлементов, при воздействии диеты разного состава P:C. Этот метод был протестиров?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторов нечего раскрывать.
Благодарности
Мы хотели бы поблагодарить Институт Гульбенкян де Сиенсия (МКГР) за предоставление нам доступа к части экспериментального оборудования, описанного в этом протоколе. Эта работа была поддержана Португальским фондом науки и техники (FCT), LISBOA-01-0145-FEDER-007660, PTDC/NEU- NMC/2459/2014, IF/00697/2014 и La Caixa HR17-00595 для PMD и Австралийского исследовательского совета будущего стипендий (FT170100259) в CKM.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 1.5 mL microtubes | Sarstedt AG & Co. | 72.690.001 | |
| 10xPBS | Nytech | MB18201 | |
| 2.0 mL microtubes | Sarstedt AG & Co. | 72.695.500 | |
| 60 mm petri dishes | Greiner Bio-one, Austria | 628161 | |
| 96 well microplates | Santa Cruz Biotechnology | SC-204453 | |
| Agar | Pró-vida, Portugal | ||
| Bench cooler | Nalgene, USA | Labtop Cooler 5115-0032 | |
| Blue food dye | Rayner, Billingshurst, UK | ||
| Cell disruption media | Scientific Industries, Inc. | 888-850-6208 | (0.5 mm glass beads) |
| Dish weight boats | Santa Cruz Biotechnology | SC-201606 | |
| Embryo collection cage for 60 mm petri dishes | Flystuff, Scientific Laboratory Supplies, UK | FLY1212 (59-100) | |
| Featherweight forceps | BioQuip Products, USA | 4750 | |
| Fly food for stocks maintenance | 1 L food contains: 10 g Agar, 100 g Yeast Extract, 50 g Sucrose, 30 mL Nipagin, 3 mL propionic acid | ||
| Forceps #5 | Dumont | 0108-5-PS | Standard tips, INOX, 11cm |
| Incubator | LMS Ltd, UK | Series 2, Model 230 | For thermogenetic feeding assay (30?C) |
| Incubator | Percival Scientific, USA | DR36NL | To stage larvae (19?C) |
| Janelia lines | Janelia Research Campus | Detailed information in Table 2 | |
| Macronutrient balancing diets | Composition and nutritional information in Figure 1 | ||
| Methanol | VWR | CAS number: 67-56-1 | |
| Nipagin (Methyl 4-hydroxybenzoate) | Sigma-Aldrich | H5501 | |
| Nitrile gloves | VWR, USA | ||
| Refrigerated centrifuge | Eppendorf, Germany | 5804 R / Serial number: 5805CI364293 | |
| Rubin Gal4 ines | Janelia Research Campus | Stoks available at Bloomington Drosophila Stock Center | |
| ShibireTS UAS line | Bloomington Drosophila Stock Center | BDSC number: 66600 | Provided by Carlos Ribeiro Group |
| Soft brushes | For sorting anaesthetised fruit flies | ||
| Spectrophotometer plate reader | Thermo Fisher Scientific | Multiskan Go 51119300 | |
| Stereo microscope | Nikon | 1016625 | |
| Sucrose | Sidul, Portugal | ||
| Third-instar larvae (L3) rearing diet | Composition and nutritional information in Figure 1 | ||
| Timer | |||
| Tissue lyzer / bead beater | MP Biomedicals, USA | FastPrep-24 6004500 | |
| TRPA1 UAS line | Bloomington Drosophila Stock Center | BDSC number: 26264 | Expresses TrpA1 under UAS control; may be used to activate neurons experimentally at 25 ?C |
| Water bath | Sheldon Manufacturing Inc., USA | W20M-2 / 03068308 / 9021195 | |
| Yeast extract | Pró-vida, Portugal | 51% Protein, 15% Carbohydrate |
Ссылки
- Raubenheimer, D. Nature of nutrition - a unifying framework from animal adaptation to human. , (2012).
- Carvahlo, M. J. a, Mirth, C. K. Coordinating morphology with behavior during development: an integrative approach from a fly perspective. Frontiers in Ecology and Evolution. , (2015).
- Steck, K., et al. Internal amino acid state modulates yeast taste neurons to support protein homeostasis in Drosophila. Elife. 7, 31625(2018).
- Itskov, P. M., Ribeiro, C. The dilemmas of the gourmet fly: the molecular and neuronal mechanisms of feeding and nutrient decision making in Drosophila. Frontiers in Neuroscience. 7, 12(2013).
- Bjordal, M., Arquier, N., Kniazeff, J., Pin, J. P., Leopold, P. Sensing of amino acids in a dopaminergic circuitry promotes rejection of an incomplete diet in Drosophila. Cell. 156 (3), 510-521 (2014).
- Grandison, R. C., Piper, M. D., Partridge, L. Amino-acid imbalance explains extension of lifespan by dietary restriction in Drosophila. Nature. 462 (7276), 1061-1064 (2009).
- Lee, K. P., et al. Lifespan and reproduction in Drosophila: New insights from nutritional geometry. Proceedings of the National Academy of Sciences of the United States of America. 105 (7), 2498-2503 (2008).
- Levine, M. E., et al. Low protein intake is associated with a major reduction in IGF-1, cancer, and overall mortality in the 65 and younger but not older population. Cell Metabolism. 19 (3), 407-417 (2014).
- Solon-Biet, S. M., et al. The ratio of macronutrients, not caloric intake, dictates cardiometabolic health, aging, and longevity in ad libitum-fed mice. Cell Metabolism. 19 (3), 418-430 (2014).
- Piper, M. D., et al. A holidic medium for Drosophila melanogaster. Nature Methods. 11 (1), 100-105 (2014).
- Jones, W. D. The expanding reach of the GAL4/UAS system into the behavioral neurobiology of Drosophila. BMB Reports. 42 (11), 705-712 (2009).
- Deshpande, S. A., et al. Quantifying Drosophila food intake: comparative analysis of current methodology. Nature Methods. 11 (5), 535-540 (2014).
- Neckameyer, W. S. A trophic role for serotonin in the development of a simple feeding circuit. Developmental Neuroscience. 32 (3), 217-237 (2010).
- Gasque, G., Conway, S., Huang, J., Rao, Y., Vosshall, L. B. Small molecule drug screening in Drosophila identifies the 5HT2A receptor as a feeding modulation target. Scientific Reports. 3, (2013).
- Schoofs, A., et al. Selection of motor programs for suppressing food intake and inducing locomotion in the Drosophila brain. PLoS Biology. 12 (6), 1001893(2014).
- Pocas, G. M., Crosbie, A. E., Mirth, C. K. When does diet matter? The roles of larval and adult nutrition in regulating adult size traits in Drosophila melanogaster. Journal of Insect Physiology. , 104051(2020).
- Hamada, F. N., et al. An internal thermal sensor controlling temperature preference in Drosophila. Nature. 454 (7201), 217-220 (2008).
- Pfeiffer, B. D., et al. Tools for neuroanatomy and neurogenetics in Drosophila. Proceedings of the National Academy of Sciences of the United States of America. 105 (28), 9715-9720 (2008).
- Jenett, A., et al. A GAL4-driver line resource for Drosophila neurobiology. Cell Reports. 2 (4), 991-1001 (2012).
- Kitamoto, T. Conditional modification of behavior in Drosophila by targeted expression of a temperature-sensitive shibire allele in defined neurons. Journal of Neurobiology. 47 (2), 81-92 (2001).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Shirangi, T. R., Stern, D. L., Truman, J. W. Motor control of Drosophila courtship song. Cell Reports. 5 (3), 678-686 (2013).
- Mirth, C. M. J. Food intake and food choice are altered by the developmental transition at critical weight in Drosophila melanogaster. Animal Behaviour. 126, 195-208 (2017).
- Simpson, S. J., Raubenheimer, D. Obesity: the protein leverage hypothesis. Obesity Reviews. 6 (2), 133-142 (2005).
- Raubenheimer, D., Simpson, S. J. Integrative models of nutrient balancing: application to insects and vertebrates. Nutrition Research Reviews. 10 (1), 151-179 (1997).
- Li, H. H., et al. A GAL4 driver resource for developmental and behavioral studies on the larval CNS of Drosophila. Cell Reports. 8 (3), 897-908 (2014).
- Bhatt, P. K., Neckameyer, W. S. Functional analysis of the larval feeding circuit in Drosophila. Journal of Visualized Experiments. (81), e51062(2013).
- Wong, R., Piper, M. D. W., Blanc, E., Partridge, L. Pitfalls of measuring feeding rate in the fruit fly Drosophila melanogaster. Nature Methods. 5 (3), 214-215 (2008).
- Almeida-Carvalho, M. J., et al. The Ol1mpiad: concordance of behavioural faculties of stage 1 and stage 3 Drosophila larvae. Journal of Experimental Biology. 220, Pt 13 2452-2475 (2017).
- Rodrigues, M. A., et al. Drosophila melanogaster larvae make nutritional choices that minimize developmental time. Journal of Insect Physiology. 81, 69-80 (2015).
- Wong, R., Piper, M. D., Wertheim, B., Partridge, L. Quantification of food intake in Drosophila. PLoS One. 4 (6), 6063(2009).
- Wu, Q., et al. Developmental control of foraging and social behavior by the Drosophila neuropeptide Y-like system. Neuron. 39 (1), 147-161 (2003).
- Wu, Q., Zhang, Y., Xu, J., Shen, P. Regulation of hunger-driven behaviors by neural ribosomal S6 kinase in Drosophila. Proceedings of the National Academy of Sciences of the United States of America. 102 (37), 13289-13294 (2005).
- Lingo, P. R., Zhao, Z., Shen, P. Co-regulation of cold-resistant food acquisition by insulin- and neuropeptide Y-like systems in Drosophila melanogaster. Neuroscience. 148 (2), 371-374 (2007).
Access restricted. Please log in or start a trial to view this content.
Erratum
Formal Correction: Erratum: Quantification of Macronutrients Intake in a Thermogenetic Neuronal Screen using Drosophila Larvae
Posted by JoVE Editors on 10/06/2020. Citeable Link.
An erratum was issued for: Quantification of Macronutrients Intake in a Thermogenetic Neuronal Screen using Drosophila Larvae. A figure was updated.
Figure 1 was updated from:
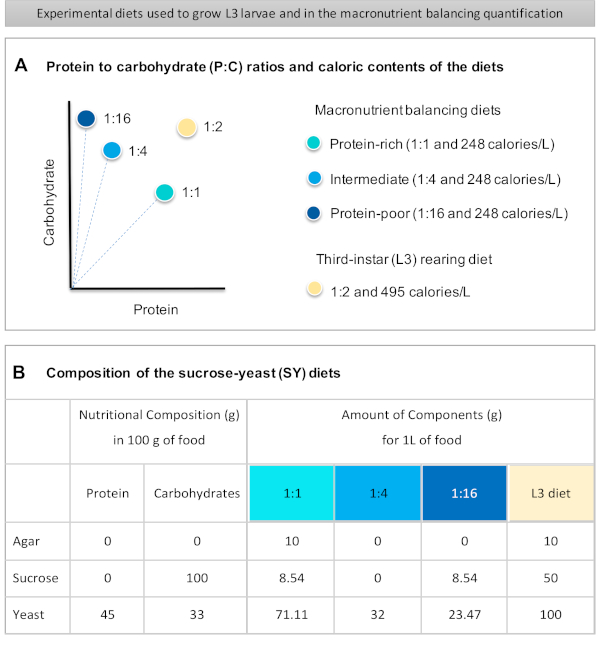
Figure 1: The sucrose-yeast (SY) diets used in our protocol. (A) The blue dots represent the isocaloric (248 calories/L) macronutrient balancing diets used in the feeding assay, which differ in the protein to carbohydrate (P:C) ratios: 1:1, 1:4 and 1:16. The beige dot represents the diet used to rear the experimental third-instar larvae (L3), which contained a P:C ratio of 1:2 and a caloric density of 495 calories/L. (B) Detailed composition and nutritional information of the sucrose-yeast (SY) based diets. The components are the same for all the diets: agar, sucrose and yeast. The amount in grams of the components needed to prepare 1 L of diet is shown. Note that 1% (v/v) of blue dye must be added to the macronutrient balancing diets and to the L3 rearing diet nipagin and propionic acid solutions must be added to a final concentration (v/v) of 3% and 0.3%, respectively. Please click here to view a larger version of this figure.
to:
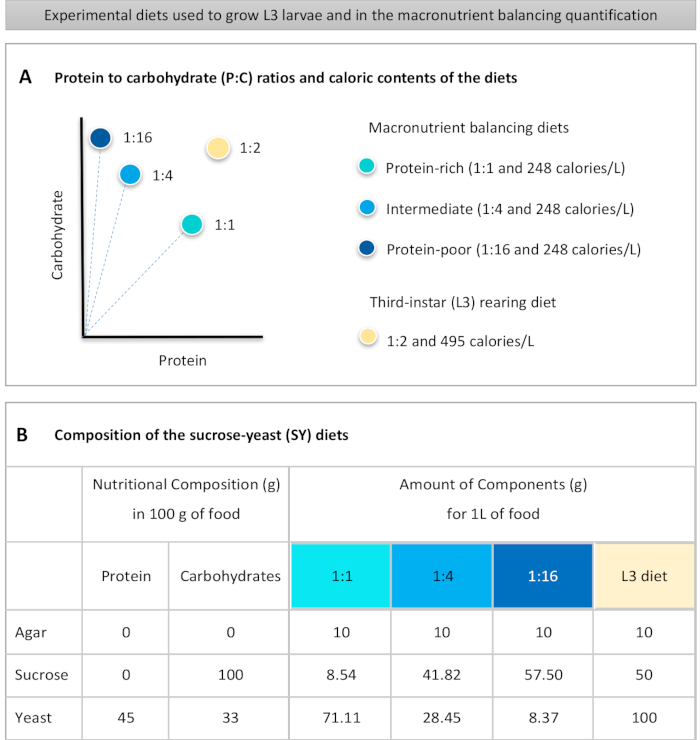
Figure 1: The sucrose-yeast (SY) diets used in our protocol. (A) The blue dots represent the isocaloric (248 calories/L) macronutrient balancing diets used in the feeding assay, which differ in the protein to carbohydrate (P:C) ratios: 1:1, 1:4 and 1:16. The beige dot represents the diet used to rear the experimental third-instar larvae (L3), which contained a P:C ratio of 1:2 and a caloric density of 495 calories/L. (B) Detailed composition and nutritional information of the sucrose-yeast (SY) based diets. The components are the same for all the diets: agar, sucrose and yeast. The amount in grams of the components needed to prepare 1 L of diet is shown. Note that 1% (v/v) of blue dye must be added to the macronutrient balancing diets and to the L3 rearing diet nipagin and propionic acid solutions must be added to a final concentration (v/v) of 3% and 0.3%, respectively. Please click here to view a larger version of this figure.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены