A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
כימות צריכת מקרונוטריאנטים במסך עצבי תרמוגנטי באמצעות זחלי דרוזופילה
In This Article
Erratum Notice
Summary
להלן פרוטוקול המאפשר כימות צבעוני של כמות המזון הנאכל בתוך פרק זמן מוגדר על ידי זחלי מלנוגאסטר דרוזופילה שנחשפו לדיאטות באיכות מקרונוטריאנטית שונה. מבחנים אלה מתבצעים בהקשר של מסך תרמוגנטי עצבי.
Abstract
התנהגויות ליקוט והאכלה מאפשרות לבעלי חיים לגשת למקורות אנרגיה וחומרים מזינים החיוניים להתפתחותם, לבריאותם ולכשירותם. חקירת הרגולציה העצבית של התנהגויות אלה חיונית להבנת המנגנונים הפיזיולוגיים והמולקולריים שבבסיס הומאוסטזיס תזונתי. השימוש במודלים גנטיים של בעלי חיים כגון תולעים, זבובים ודגים מקל מאוד על מחקרים מסוג זה. בעשור האחרון, זבוב הפירות Drosophila melanogaster שימש כמודל בעל חיים רב עוצמה על ידי נוירוביולוגים החוקרים את השליטה העצבית של התנהגויות האכלה וליקוט. אמנם ללא ספק בעל ערך, רוב המחקרים בוחנים זבובים בוגרים. כאן, אנו מתארים פרוטוקול המנצל את מערכת העצבים הזחלית הפשוטה יותר כדי לחקור מצעים עצביים השולטים בהתנהגויות האכלה כאשר הזחלים נחשפים לדיאטות שונות בתכולת החלבון והפחמימות שלהם. השיטות שלנו מבוססות על בדיקת האכלה כמותית של צבעים ללא ברירה, המבוצעת בהקשר של מסך הפעלה תרמוגנטית עצבית. כקריאה, כמות המזון שנאכל על ידי זחלים על פני מרווח זמן של 1 שעות שימשה כאשר נחשפה לאחת משלוש דיאטות עם תווית צבע השונות בחלבון שלהם ליחסי פחמימות (P:C). היעילות של פרוטוקול זה מודגמת בהקשר של מסך נוירוגנטי בזחל Drosophila, על ידי זיהוי אוכלוסיות עצביות מועמד המסדיר את כמות המזון שנאכל דיאטות באיכות macronutrient שונים. הצלחנו גם לסווג ולקבץ את הגנוטיפים שנבדקו לשיעורי פנוטיפים. מלבד סקירה קצרה של השיטות הזמינות כיום בספרות, היתרונות והמגבלות של שיטות אלה נדונים, כמו כן, כמה הצעות ניתנות על איך פרוטוקול זה עשוי להיות מותאם לניסויים ספציפיים אחרים.
Introduction
כל בעלי החיים תלויים בתנור תזונה מאוזנת כדי לרכוש את הכמויות הדרושות של חומרים מזינים להישרדות, צמיחה, רבייה1. הבחירה של מה וכמה לאכול מושפעת ממספר רב של גורמים אינטראקציה הקשורים למצב הפנימי של החיה, כמו רמת השובע, ותנאים סביבתיים, כגון איכות המזון2,3,4,5. חלבונים ופחמימות הם שני מקרונוטריאנטים עיקריים והצריכה המאוזנת שלה חיונית כדי לקיים תהליכים פיזיולוגיים של בעלי חיים. לכן, ההבנה של המנגנונים העצביים השולטים בהתנהגויות האכלה ושמירה על צריכה מאוזנת של מקרונוטריאנטים אלה רלוונטית ביותר. הסיבה לכך היא שתכונות היסטוריית החיים כמו תוחלת חיים, פוריות ובריאות מטבולית מושפעות ישירות מרמות צריכת החלבון6,7,8,9,10.
השימוש באורגניזמים פשוטים יותר הניתנים למתיחה, המציגים הרגלי האכלה שמורים מבחינה אבולוציונית עם בעלי חיים מורכבים, כולל יונקים, חיוני למחקרים מסוג זה. חשוב לציין, מודלים פשוטים אלה של בעלי חיים מספקים הזדמנות טובה לנתח שאלות ביולוגיות מורכבות בהקשר יקר, אתי ויעיל יותר מבחינה טכנית. בעשורים האחרונים, Drosophila, עם ערכת הכלים הגנטית רבת העוצמה שלה, התנהגות מורכבת וסטריאוטיפית וארכיטקטורה שמורה של מנגנוני חישה היקפיים וחומרים מזינים עם יונקים, היה מודל פורה לנוירוביולוגים התנהגותיים11. בסופו של דבר, התקווה היא כי על ידי הבנת איך צריכת המזון מוסדר בבעלי חיים אלה, עם מערכת עצבים פשוטה יותר, אז אנחנו יכולים להתחיל להתיר תקלות עצביות ביסוד הפרעות אכילה אנושיות.
המחקר של מצעים עצביים להתנהגויות האכלה תלוי עמוק ביכולת למדוד בו זמנית את צריכת המזון של בעלי חיים תוך מניפולציה של הפעילות העצבית שלהם. בשל כמויות המזון המינימליות שנבלעו, כימות כמות המזון הנאכלת על ידי זבובים הוא מאתגר ביותר, וכל השיטות הזמינות כיום מציבות מגבלות משמעותיות. לכן, תקן הזהב הוא להשתמש בשילוב של מתודולוגיות משלימות12. זבובים בוגרים זכו להעדפה היסטורית כמודל גנטי והתנהגותי. אף על פי כן, זחלים Drosophila, גם להציע הזדמנויות לחקור מצעים עצביים קידוד התנהגות האכלה. מערכת העצבים המרכזית הזחל (CNS), עם כ 12,000 נוירונים, הוא משמעותית פחות מורכב מזה של המבוגר, אשר מכיל כ 150,000 נוירונים. מורכבות נמוכה זו היא לא רק מספרית אלא גם פונקציונלית, שכן התנהגויות הזחל מסתמכות על פונקציות קטר פשוטות יותר ומערכות חושיות. למרות הפשטות לכאורה של מערכות העצבים שלהם, זחלים עדיין להפגין התנהגויות האכלה מלאה, וכמה שיטות לכמת בליעה מזון בזחלים Drosophila תוארו5,13,14,15. על ידי זיווג עם מניפולציות של פעילות עצבית, זחלים Drosophila יכול להוות מודל מאוד נוח להבנת הרגולציה העצבית של צריכת המזון.
בתנאי שלהלן פרוטוקול מפורט לכימות צריכת המזון בזחלים החשופים לדיאטות באיכות מקרונוטריאנטית שונה. הדיאטות, מה שמכונה דיאטות איזון macronutrient, היו שונות בתכולת החלבון והפחמימות, במיוחד ביחס בין החלבון לפחמימות (P:C): 1:1 (תזונה עשירה בחלבון), 1:4 (דיאטת ביניים) ו- 1:16 (תזונה לקויה בחלבון), כפי שמוצג באיור 1A. בקצרה, בדיקה כמותית ללא ברירה האכלה הוקמה באמצעות אלה שלוש דיאטות סוכרוז-שמרים isocaloric (SY)מבוסס צבוע עם צבע מזון כחול. מכיוון שתמצית שמרים וסוקרוז שימשו כמקורות חלבון ופחמימות, ושניהם מכילים פחמימות, השונות ביחסי P:C הושגה על ידי שינוי האיזון בין שני מרכיבים אלה, כפי שתואר קודם לכן16 וכפי שצוין באיור 1B. סקירה סכמטית של הפרוטוקול, המציגה את שלבי הניסוי העיקריים, זמינה באיור 2.
פרוטוקול זה הוקם במטרה לחקור את תפקידן של אוכלוסיות עצביות ספציפיות על ויסות רמות האכלת הזחלים בדיאטות של יחסי P:C שונים ובהקשר של מסך עצבי תרמוגנטי. כלי נוירוגנטי מאופיין היטב שימש ממשפחת פוטנציאל הקולטן הארעי (TRP): Drosophila חולף קולטן פוטנציאל ערוץ (dTRPA1), שהוא ערוץ קטיון טמפרטורה ומתח מגודר, המאפשר ירי של פוטנציאל פעולה כאשר טמפרטורות הסביבה לעלות מעל 25 °C17. כדי לבטא את טרנסג'ין dTRPA1, ניצלנו את קווי Gal4 המבוססים על אזורים רגולטורייםמן הגנום Drosophila, שהוקם במעבדת רובין, בהקשר של פרויקט FlyLight בקמפוס המחקר Janelia18,19.
למרות הפרוטוקול, כאן מתואר, נקבע בהקשר של מסך הפעלה, זה יכול להיות מותאם בקלות על ידי הנסיין לצרכים ספציפיים אחרים או תחומי עניין, כלומר לבצע מסך דיכוי באמצעות משתיק עצבים רגיש לטמפרטורה ShibireTS20, חלופה dTRPA1. התאמה זו והסתגלויות אחרות נידונות בסעיפי הפרוטוקול והדיון.
Protocol
1. הכנת דיאטות סוכרוז-שמרים (SY)
- שוקלים את כל החומרים היבשים (אגר, שמרים, סוכרוז) עבור איזון macronutrient ודיאטות גידול L3. הכמויות בגרמים עבור כל אחד מהמרכיבים הדרושים להכנת 1 L של מזון מסומנות באיור 1B.
הערה: יש לקחת בחשבון כי כ 13 מ"ל של מזון יש צורך למלא צלחת פטרי 60 מ"מ. - ממיסים את כל החומרים במים מזוקקים סטריליים (משתמשים בכ-50% מסך המים הדרוש להכנת המזון) ומערבבים את המדיום במשך 5-10 דקות.
- אוטוקלאב במשך 50 דקות.
- לאחר מתן אפשרות למדיומים להתקרר, מוסיפים פתרונות ניפגין וחומצה פרופונית לדיאטות, בריכוז סופי (v/v) של 3% ו-0.3%, בהתאמה. לדיאטות האיזון המקרונוטריאנטיות, הוסיפו צבע מאכל כחול לריכוז סופי (v/v) של 1%. להשלים את הנפחים הכוללים עם מים מזוקקים.
- יוצקים בזהירות את דיאטות המזון ל 60 מ"מ פטרי מנות, כך כמות המזון שפכו הוא בערך זהה בכל אחת הצלחות. תווית הצלחות עם יחסי P:C של הדיאטות.
הערה: הכינו את דיאטות האיזון המקרונוטריינט ביום מבחני ההאכלה. אם לא ניתן, לאחסן את הדיאטות מוכנות ב 4 מעלות צלזיוס, במיכל אטום, למשך זמן מרבי של 3 ימים. תקופות אחסון ארוכות יותר הופכות את הדיאטה ליבשה וקשה מדי, והזחלים אינם יכולים להתחפר במדיום.
2. צלב גנטי של קווי הורים
הערה: השתמש במערכת Gal4/UAS21 כדי להגדיר את הצלבים הגנטיים. בפרוטוקול זה, על מנת להפעיל את התפקוד העצבי באוכלוסיות עצביות ספציפיות, נעשה שימוש בתולות נקבות של קו UAS dTRPA117 וחצו לזכרים מקווי Janelia Gal4(איור 2A). הבקרה הגנטית בה נעשה שימוש הייתה צאצא של הכלאה בין קו dTRPA1 לבין קו "GAL4 ריק", הנושא את Gal4 בווקטור ששימש ליצירת אוסף רובין גל4 אך ללא שבר רגולטורי נוכח (attP2)22. כדי לקדם את הדיכוי העצבי, ניתן להשתמש בקידוד קו UAS ShibireTS20, במקום dTRPA1.
- הגדר כלובי איסוף עוברים 60 מ"מ עם L3 גידול צלחות דיאטה, בתוספת כמה משחת שמרים פעילה.
- העבר את הבתולות הנשיות הבוגרות UAS dTRPA1 ואת זכרי Janelia Gal4, בני 5-8 ימים, לכלובי איסוף העוברים ואפשר להזדווגות להתרחש במשך 24-48 שעות, ב 25 °C (60°C), עם 60% לחות ומחזור 12:12 כהה בהיר(איור 2A). עבור כלובי איסוף עוברים 60 מ"מ, יש להשתמש בכ-100 נקבות בתולות וב-30 זכרים לכל צלב.
- בסוף תקופת ההזדווגות, להסיר ולהשליך את L3 גידול צלחות דיאטה המשמשים הצלבים הגנטיים. החליפו אותם בצלחות דיאטה טריות לגידול L3, על מנת לבצע את מטילי הביצים ואת בימוי הזחל.
3. הכנת זחלים כוכב שלישי (L3)
- מעבירים את הזבובים הבוגרים ההזדווגות לצלחות דיאטה טריות לגידול L3 ומאפשרים להטלת הביצים להתרחש למשך 3-4 שעות, ב-25°C(איור 2B). ודא כי כל הצלחות מסומנות עם הגנוטיפ, יחס P:C של הדיאטה ואת התאריך של מטיל ביצה.
הערה: כדי לחסוך זמן, לבצע את הטלת הביצים ישירות לתוך דיאטה גידול L3, אשר נמנע טיפול נוסף של הביצים. במקרה של הקרנות גנטיות בקנה מידה קטן, אופטימיזציה של הטלת הביצים ניתן להשיג באמצעות צלחות אגר מיץ תפוחים. - בסוף תקופת הטלת הביצים, מוציאים את הצלחות מהכלובים ומכסים אותן במכסי פלסטיק. במקרה תמצית שמרים משמש כדי להשלים את צלחות גידול L3, הקפד להסיר את כל השמרים שיורית בסוף הטלת הביצה. זה חשוב כדי למנוע האכלה לא אחידה במהלך צמיחת הזחל.
הערה: ניתן להעביר את המבוגרים ההזדווגות לצלחות דיאטה טריות לגידול L3, כך שיותר מטילי ביצים מבוצעים, וניתן להשיג זחלים ניסיוניים יותר. מטילי ביצים רצופים יכולים להתבצע עם אותם מבוגרים במהלך שבוע עבודה שלם. - להעריך את מספר הביצים לכל צלחת ולשמור על צפיפות הזחל למקסימום של 200 עוברים לכל צלחת. הערכה זו יכולה להיעשות על ידי ספירת מספר העוברים ברבע מהצלחת.
הערה: צלחת צפופה תעכב את התפתחות הזחל ותשפיע על התנהגויות האכלת הזחלים. - דגירה L3 צלחות גידול ב 18 °C (טמפרטורה מתירנית), 60% לחות מחזור 12:12 כהה בהיר, ולאפשר הזחלים לגדול במשך 9 ימים (איור 2B).
- ביום התשיעי לאחר הטלת הביצים (AEL), לאסוף שלוש קבוצות של 10 L3 מכל אחד הגנוטיפים (ועבור שכפולים) להיבדק. בנוסף, לאסוף קבוצות של 10 L3 עבור בקרת "מזון אפס צבע". ודא כי אוסף הזחלים נעשה בתקופות זמן שוות ערך של היום המשמש לביצוע הטלת הביצית (למשל, אם הטלת הביצים התרחשה בין השעות 10:00-14:00, לאסוף את הזחלים במהלך אותה תקופה של זמן 9 ימים AEL) והוא מבוצע, בעדינות רבה ככל האפשר, באמצעות מלקחיים #5 או מלקחיים במשקל נוצה. העבר ישירות את הזחלים כפי שצוין בשלב הבא (3.6).
הערה: בעלי החיים השולטים ב"מזון ללא צבע אפס" הם זחלים שבמהלך מבחני ההאכלה מקבלים מזון ללא צבע כחול. פקד זה הוא הכרחי כדי להסיר את ספיגת הרקע של תמציות הזחל. - מעבירים את הזחלים הניסיוניים שנאספו לסירות פלסטיק במשקל צלחת המכילות 1 מ"ל מים. ודאו ש-L3 נאסף, ולא L2, על-ידי ביצוע ההוראות המופיעות באיור 3.
הערה: האוסף של L3 לסירות פלסטיק המכילות מים או מלוחים 1x פוספט אגירה (PBS), חשוב לשמור על זחלים hydrated היטב לפני תחילת מבחני האכלה. זה חשוב במיוחד אם מספר קבוצות L3 ניסיוניות מגנוטיפים שונים נאספים בו זמנית. עקוב אחר סדר הגבייה עבור כל קבוצה, כך שההבדלים במשך מניעת המזון עבור כל קבוצה ממוזערים. השימוש בסירות פלסטיק בשלב זה מקל על השלב האופציונלי 4.3 כפי שהוא מאפשר זחלים לצוף ישירות לתוך אמבט המים.
4. הפעלה תרמוגנטית ומזינה ללא ברירה
הערה: מומלץ לבצע את מבחני ההאכלה בערך באותו זמן של היום כדי למזער וריאציות אפשריות הקשורות למקצבים הביולוגיים. כמו כן, תמיד להפעיל את ניסויי הבקרה (הצאצאים של הקו "Gal4 ריק" חצה UAS dTRPA1 ואת "אפס צבע מזון" זחלים), במקביל הגנוטיפים של עניין.
- הגדר חממה ל 30 °C (טמפרטורה לא מתירנית) ולשמור על רמות גבוהות של לחות (לפחות 65%) כדי למנוע התייבשות זחל במהלך ההסתעפות.
- לפני תחילת מבחני ההאכלה, יש לאיית את טמפרטורת לוחות ההזנה על ידי חימום שלהם ב-30 מעלות צלזיוס למשך 30 דקות.
- (אופציונלי) לחצו על הלחצן 'קביעות' מחממים את הזחלים הניסיוניים במשך 2 דקות באמבט מים של 37 מעלות צלזיוס. בצע שלב זה עם בעלי החיים בסירות משקל פלסטיק המכיל קצת מים.
הערה: מטרת צעד זה היא להגביר את ההפעלה העצבית על ידי קידום הירי של הנוירונים מאז תחילת מבחני ההאכלה. - שמור על טיימרים מרובים מוכנים למשך שעה אחת. מספר הטיימרים לשימוש תלוי במספר קבוצות הניסוי הנבדקות וברמת המיומנות של הנסיין בטיפול בזחלים.
הערה: השימוש בעוקבי זמן מרובים הוא קריטי כדי לשמור על משך הזמן של הבוחן עקבי עבור כל הגנוטיפים. - מסננים בזהירות את המים מסירות הפלסטיק, ובאמצעות מברשת רכה ולחה, מעבירים בעדינות את קבוצות L3 מהסירות למרכז לוחות ההסעה. מחזירים את מכסי הצלחות ומתחילים טיימר לכל צלחת (או קבוצת צלחות) כדי לשמור על מפגשי הזנה מדויקים של שעה.
- אפשר לזחלים להזין במשך שעה, ב-30°C, בחושך(איור 2C).
הערה: הביצועים של ההסמכה בחושך חשוב לשלוט על הבדלים רמזים חזותיים על פני דיאטות, כמו דיאטות יהיו שונים בגוונים, למרות שהם מכילים את אותו ריכוז צבע. - לעצור את מבחני האכלה על ידי העברת הצלחות לאמבט קרח. לחץ על הקרח ככל האפשר כדי לספק משטח יציב עבור הצלחות.
הערה: טמפרטורות קרות יקדמו את סוף ההאכלה על ידי עיכוב התנהגויות חפירה וחפירה. רוב הזחלים יעלו על צלחות המזון לאחר מספר דקות, ויקלו על החלמתם בשלבים הבאים.
5. מיצוי צבע מזון
- הכן 2 microtubes מ"ל עבור כל קבוצה של 10 L3 נבדק, המכיל בערך את אותן כמויות של חרוזים זכוכית 0.5 מ"מ (מספיק כדי למלא את החלק התחתון של microtube) ו 300 μL של מתנול קר כקרח. שמור את microtubes בקור, באמצעות צידנית ספסל.
התראה: מתנול הוא מאוד דליק ורעיל. בצע את כל נהלי הבטיחות המומלצים לטיפול מגיב זה, כולל עבודה באזור מאוורר היטב ללבוש כפפות ניטריל.
הערה: השימוש במתנול חשוב כדי לתקן את דגימות הזחל ולהימנע מתגובות מלניזציה בקוטיקל. - באמצעות #5 או מלקחיים במשקל נוצה, לשחזר בזהירות את הקבוצות של 10 L3 מלוחות מבחני האכלה ולהעביר אותם למכסים של לוחות ההסמכה המכילים קצת מים. יש לשטוף את הזחלים כדי להסיר פסולת מזון על גופם תוך טיפול עדין בזחלים כדי למנוע פציעות. שמור תיעוד של מספר הזחלים שנמצאו עבור כל גנוטיפ לכל שכפול, כך שניתן לכמת את הכמות הממוצעת של צריכת מזון לכל זחל.
הערה: זחלים פצועים צריכים להיות מושלכים כפי שהם יהיו קוטיקל מלני, להיות מתאים לכימות צבעוני. - העבר את קבוצות L3 למיקרו-צינורות 2 מ"ל שהוכנו ב-5.1.
- Lyse את רקמות הזחל כדי לחלץ את צבע המזון מהמעיים על ידי שיטת תמוגה מכנית באמצעות ליזר רקמה חרוזי זכוכית הוסיף בשלב 5.1. (אם ליזר רקמה אינו זמין, השתמש עלה הומוגניזציה). באופן מועדף, בצע שלב זה ב- 4 °C(איור 2D).
הערה: משך שלב זה יהיה תלוי בציוד שבו נעשה שימוש. באמצעות ליצר רקמה קונבנציונלי, 1 דקות החילוץ מספיק. במקרה של התכווצות זמן, ניתן להשהות את הפרוטוקול בסוף שלב זה ולהמשיך מאוחר יותר. אחסן את הדגימות ב- -20 °C (69 °F). - להעביר את התמציות כדי לנקות 1.5 מ"ל microtubes, על ידי היפוך ישיר של 2 microtubes 2 מ"ל על microtubes 1.5 מ"ל החדש. אם מבוצע בעדינות, רוב חרוזי הזכוכית יישארו בתחתית microtube 2 מ"ל.
- לנקות את הפסולת התאית על ידי צנטריפוגה תמציות, במהירות מקסימלית במשך 10 דקות, ב 4 מעלות צלזיוס.
- לאסוף את supernatants לנקות 1.5 microtubes מ"ל. אם פסולת תאית עדיין גלויה ב supernatants, לחזור על שלבים 5.6 ו 5.7.
6. כימות צבעוני של צריכת המזון
- הכן פתרונות סטנדרטיים, כדי ליצור עקומת כיול, על-ידי ביצוע דילול טורי של 1:2 במתנול של פתרון צבע כחול מתחיל. כריק, השתמש במתנול בלבד. ריכוז התקנים תלוי ברמות צריכת המזון של בעלי החיים.
הערה: במקרה של מסך הפיילוט המוצג כאן, כמו ריכוזי הצבע שהושגו עבור תמציות הזחל נע בין 0.02 ל 1.93 μL / mL, זה שימש עקומה סטנדרטית המתקבלת על ידי מדידת הספיגות של 8 דילול סדרתי של פתרון 2 μL / mL כחול צבע במתנול. במידת הצורך, להגדיל או להקטין את הריכוז של פתרונות אלה, בהתאם לריכוז הצבע של דגימות הניסוי. - העבר 100 μL של דגימות הניסוי (המתקבלות בשלב 5.7), תקנים וריקים (שלב 6.1) לבארות של מיקרופלאט 96 בארות ומדוד את הספיגה ב- 600 ננומטר, באמצעות קורא לוחות (איור 2E). כדי להסיר את ספיגת הרקע, למדוד את ספיגת תמציות המתקבל זחלים מוזנים על מזון ללא צבע כחול כמו "אפס" עבור תמציות הזחל ("אפס צבע בקרת מזון).
- צור עקומה סטנדרטית ותאם את ערכי הספיגה המתקבלים עבור הדגימות מכל קבוצת זחל ניסיונית עם כמות צריכת המזון (נפח ב- mL). מצא את צריכת המזון הממוצעת לכל זחל על ידי התחשבות במספר הזחלים שנאספו עבור כל קבוצה בשלב 5.2
תוצאות
זחלי דרוזופילה מווסתים את צריכת החלבון שלהם במחיר בליעת פחמימות עודפות23 (עלילה סכמטית באיור 2E). למעשה, תעדוף זה של צריכת חלבון נצפתה בבעלי חיים רבים אחרים והוא נקרא מינוף החלבון24,25.
תוך ניצול התגובה ההתנהגות?...
Discussion
עם פרוטוקול זה, ניתן לבדוק את היכולת של זחלים תחת התרמוגנטית-הפעלה של אוכלוסיות עצביות ספציפיות כדי לווסת את רמות צריכת החלבון והפחמימות, שני macronutrients העיקריים, כאשר נחשפים דיאטות של הרכב P:C שונים. שיטה זו נבדקה בהקשר של הקרנה ראשונית של הזחל שמטרתה לזהות אוכלוסיות עצביות הקשורות לשליטה בצ?...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
ברצוננו להודות למכון גולבנקיאן דה סינסיה (IGC) על שסיפק לנו גישה לחלק מהציוד הניסיוני המתואר בפרוטוקול זה. עבודה זו נתמכה על ידי הקרן הפורטוגזית למדע וטכנולוגיה (FCT), LISBOA-01-0145-FEDER-007660, PTDC/NEU- NMC/2459/2014, IF/00697/2014 ולה Caixa HR17-00595 ל PMD ועל ידי מלגת מחקר עתידית של מועצת המחקר האוסטרלית (FT170100259) ל- CKM.
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL microtubes | Sarstedt AG & Co. | 72.690.001 | |
| 10xPBS | Nytech | MB18201 | |
| 2.0 mL microtubes | Sarstedt AG & Co. | 72.695.500 | |
| 60 mm petri dishes | Greiner Bio-one, Austria | 628161 | |
| 96 well microplates | Santa Cruz Biotechnology | SC-204453 | |
| Agar | Pró-vida, Portugal | ||
| Bench cooler | Nalgene, USA | Labtop Cooler 5115-0032 | |
| Blue food dye | Rayner, Billingshurst, UK | ||
| Cell disruption media | Scientific Industries, Inc. | 888-850-6208 | (0.5 mm glass beads) |
| Dish weight boats | Santa Cruz Biotechnology | SC-201606 | |
| Embryo collection cage for 60 mm petri dishes | Flystuff, Scientific Laboratory Supplies, UK | FLY1212 (59-100) | |
| Featherweight forceps | BioQuip Products, USA | 4750 | |
| Fly food for stocks maintenance | 1 L food contains: 10 g Agar, 100 g Yeast Extract, 50 g Sucrose, 30 mL Nipagin, 3 mL propionic acid | ||
| Forceps #5 | Dumont | 0108-5-PS | Standard tips, INOX, 11cm |
| Incubator | LMS Ltd, UK | Series 2, Model 230 | For thermogenetic feeding assay (30?C) |
| Incubator | Percival Scientific, USA | DR36NL | To stage larvae (19?C) |
| Janelia lines | Janelia Research Campus | Detailed information in Table 2 | |
| Macronutrient balancing diets | Composition and nutritional information in Figure 1 | ||
| Methanol | VWR | CAS number: 67-56-1 | |
| Nipagin (Methyl 4-hydroxybenzoate) | Sigma-Aldrich | H5501 | |
| Nitrile gloves | VWR, USA | ||
| Refrigerated centrifuge | Eppendorf, Germany | 5804 R / Serial number: 5805CI364293 | |
| Rubin Gal4 ines | Janelia Research Campus | Stoks available at Bloomington Drosophila Stock Center | |
| ShibireTS UAS line | Bloomington Drosophila Stock Center | BDSC number: 66600 | Provided by Carlos Ribeiro Group |
| Soft brushes | For sorting anaesthetised fruit flies | ||
| Spectrophotometer plate reader | Thermo Fisher Scientific | Multiskan Go 51119300 | |
| Stereo microscope | Nikon | 1016625 | |
| Sucrose | Sidul, Portugal | ||
| Third-instar larvae (L3) rearing diet | Composition and nutritional information in Figure 1 | ||
| Timer | |||
| Tissue lyzer / bead beater | MP Biomedicals, USA | FastPrep-24 6004500 | |
| TRPA1 UAS line | Bloomington Drosophila Stock Center | BDSC number: 26264 | Expresses TrpA1 under UAS control; may be used to activate neurons experimentally at 25 ?C |
| Water bath | Sheldon Manufacturing Inc., USA | W20M-2 / 03068308 / 9021195 | |
| Yeast extract | Pró-vida, Portugal | 51% Protein, 15% Carbohydrate |
References
- Raubenheimer, D. . Nature of nutrition - a unifying framework from animal adaptation to human. , (2012).
- Carvahlo, M. J. a., Mirth, C. K. Coordinating morphology with behavior during development: an integrative approach from a fly perspective. Frontiers in Ecology and Evolution. , (2015).
- Steck, K., et al. Internal amino acid state modulates yeast taste neurons to support protein homeostasis in Drosophila. Elife. 7, 31625 (2018).
- Itskov, P. M., Ribeiro, C. The dilemmas of the gourmet fly: the molecular and neuronal mechanisms of feeding and nutrient decision making in Drosophila. Frontiers in Neuroscience. 7, 12 (2013).
- Bjordal, M., Arquier, N., Kniazeff, J., Pin, J. P., Leopold, P. Sensing of amino acids in a dopaminergic circuitry promotes rejection of an incomplete diet in Drosophila. Cell. 156 (3), 510-521 (2014).
- Grandison, R. C., Piper, M. D., Partridge, L. Amino-acid imbalance explains extension of lifespan by dietary restriction in Drosophila. Nature. 462 (7276), 1061-1064 (2009).
- Lee, K. P., et al. Lifespan and reproduction in Drosophila: New insights from nutritional geometry. Proceedings of the National Academy of Sciences of the United States of America. 105 (7), 2498-2503 (2008).
- Levine, M. E., et al. Low protein intake is associated with a major reduction in IGF-1, cancer, and overall mortality in the 65 and younger but not older population. Cell Metabolism. 19 (3), 407-417 (2014).
- Solon-Biet, S. M., et al. The ratio of macronutrients, not caloric intake, dictates cardiometabolic health, aging, and longevity in ad libitum-fed mice. Cell Metabolism. 19 (3), 418-430 (2014).
- Piper, M. D., et al. A holidic medium for Drosophila melanogaster. Nature Methods. 11 (1), 100-105 (2014).
- Jones, W. D. The expanding reach of the GAL4/UAS system into the behavioral neurobiology of Drosophila. BMB Reports. 42 (11), 705-712 (2009).
- Deshpande, S. A., et al. Quantifying Drosophila food intake: comparative analysis of current methodology. Nature Methods. 11 (5), 535-540 (2014).
- Neckameyer, W. S. A trophic role for serotonin in the development of a simple feeding circuit. Developmental Neuroscience. 32 (3), 217-237 (2010).
- Gasque, G., Conway, S., Huang, J., Rao, Y., Vosshall, L. B. Small molecule drug screening in Drosophila identifies the 5HT2A receptor as a feeding modulation target. Scientific Reports. 3, (2013).
- Schoofs, A., et al. Selection of motor programs for suppressing food intake and inducing locomotion in the Drosophila brain. PLoS Biology. 12 (6), 1001893 (2014).
- Pocas, G. M., Crosbie, A. E., Mirth, C. K. When does diet matter? The roles of larval and adult nutrition in regulating adult size traits in Drosophila melanogaster. Journal of Insect Physiology. , 104051 (2020).
- Hamada, F. N., et al. An internal thermal sensor controlling temperature preference in Drosophila. Nature. 454 (7201), 217-220 (2008).
- Pfeiffer, B. D., et al. Tools for neuroanatomy and neurogenetics in Drosophila. Proceedings of the National Academy of Sciences of the United States of America. 105 (28), 9715-9720 (2008).
- Jenett, A., et al. A GAL4-driver line resource for Drosophila neurobiology. Cell Reports. 2 (4), 991-1001 (2012).
- Kitamoto, T. Conditional modification of behavior in Drosophila by targeted expression of a temperature-sensitive shibire allele in defined neurons. Journal of Neurobiology. 47 (2), 81-92 (2001).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Shirangi, T. R., Stern, D. L., Truman, J. W. Motor control of Drosophila courtship song. Cell Reports. 5 (3), 678-686 (2013).
- Mirth, C. M. J. Food intake and food choice are altered by the developmental transition at critical weight in Drosophila melanogaster. Animal Behaviour. 126, 195-208 (2017).
- Simpson, S. J., Raubenheimer, D. Obesity: the protein leverage hypothesis. Obesity Reviews. 6 (2), 133-142 (2005).
- Raubenheimer, D., Simpson, S. J. Integrative models of nutrient balancing: application to insects and vertebrates. Nutrition Research Reviews. 10 (1), 151-179 (1997).
- Li, H. H., et al. A GAL4 driver resource for developmental and behavioral studies on the larval CNS of Drosophila. Cell Reports. 8 (3), 897-908 (2014).
- Bhatt, P. K., Neckameyer, W. S. Functional analysis of the larval feeding circuit in Drosophila. Journal of Visualized Experiments. (81), e51062 (2013).
- Wong, R., Piper, M. D. W., Blanc, E., Partridge, L. Pitfalls of measuring feeding rate in the fruit fly Drosophila melanogaster. Nature Methods. 5 (3), 214-215 (2008).
- Almeida-Carvalho, M. J., et al. The Ol1mpiad: concordance of behavioural faculties of stage 1 and stage 3 Drosophila larvae. Journal of Experimental Biology. 220, 2452-2475 (2017).
- Rodrigues, M. A., et al. Drosophila melanogaster larvae make nutritional choices that minimize developmental time. Journal of Insect Physiology. 81, 69-80 (2015).
- Wong, R., Piper, M. D., Wertheim, B., Partridge, L. Quantification of food intake in Drosophila. PLoS One. 4 (6), 6063 (2009).
- Wu, Q., et al. Developmental control of foraging and social behavior by the Drosophila neuropeptide Y-like system. Neuron. 39 (1), 147-161 (2003).
- Wu, Q., Zhang, Y., Xu, J., Shen, P. Regulation of hunger-driven behaviors by neural ribosomal S6 kinase in Drosophila. Proceedings of the National Academy of Sciences of the United States of America. 102 (37), 13289-13294 (2005).
- Lingo, P. R., Zhao, Z., Shen, P. Co-regulation of cold-resistant food acquisition by insulin- and neuropeptide Y-like systems in Drosophila melanogaster. Neuroscience. 148 (2), 371-374 (2007).
Erratum
Formal Correction: Erratum: Quantification of Macronutrients Intake in a Thermogenetic Neuronal Screen using Drosophila Larvae
Posted by JoVE Editors on 10/06/2020. Citeable Link.
An erratum was issued for: Quantification of Macronutrients Intake in a Thermogenetic Neuronal Screen using Drosophila Larvae. A figure was updated.
Figure 1 was updated from:
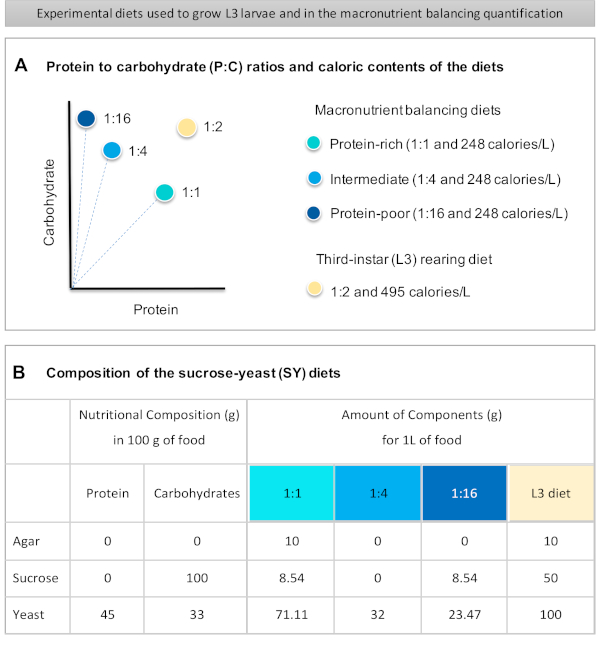
Figure 1: The sucrose-yeast (SY) diets used in our protocol. (A) The blue dots represent the isocaloric (248 calories/L) macronutrient balancing diets used in the feeding assay, which differ in the protein to carbohydrate (P:C) ratios: 1:1, 1:4 and 1:16. The beige dot represents the diet used to rear the experimental third-instar larvae (L3), which contained a P:C ratio of 1:2 and a caloric density of 495 calories/L. (B) Detailed composition and nutritional information of the sucrose-yeast (SY) based diets. The components are the same for all the diets: agar, sucrose and yeast. The amount in grams of the components needed to prepare 1 L of diet is shown. Note that 1% (v/v) of blue dye must be added to the macronutrient balancing diets and to the L3 rearing diet nipagin and propionic acid solutions must be added to a final concentration (v/v) of 3% and 0.3%, respectively. Please click here to view a larger version of this figure.
to:
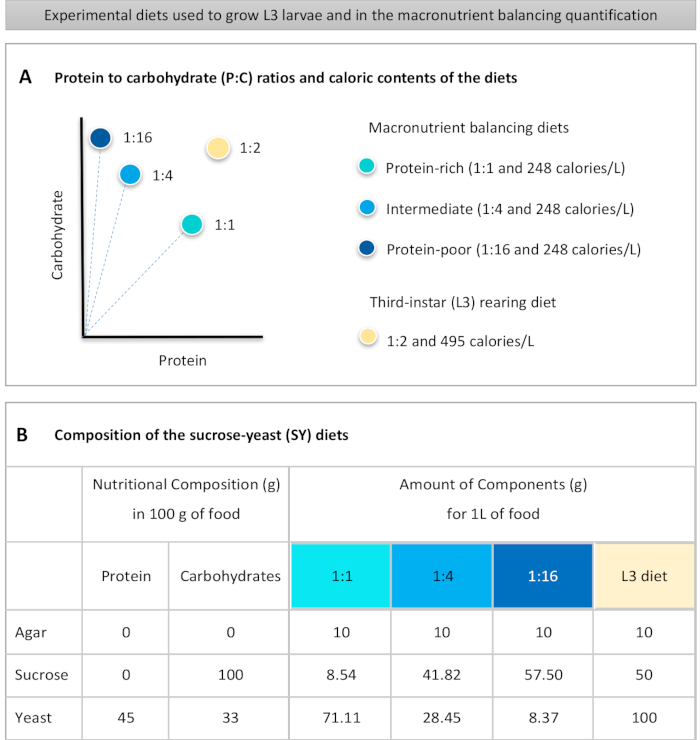
Figure 1: The sucrose-yeast (SY) diets used in our protocol. (A) The blue dots represent the isocaloric (248 calories/L) macronutrient balancing diets used in the feeding assay, which differ in the protein to carbohydrate (P:C) ratios: 1:1, 1:4 and 1:16. The beige dot represents the diet used to rear the experimental third-instar larvae (L3), which contained a P:C ratio of 1:2 and a caloric density of 495 calories/L. (B) Detailed composition and nutritional information of the sucrose-yeast (SY) based diets. The components are the same for all the diets: agar, sucrose and yeast. The amount in grams of the components needed to prepare 1 L of diet is shown. Note that 1% (v/v) of blue dye must be added to the macronutrient balancing diets and to the L3 rearing diet nipagin and propionic acid solutions must be added to a final concentration (v/v) of 3% and 0.3%, respectively. Please click here to view a larger version of this figure.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved