Method Article
تحسين النمو البلوري للبلورات النيوترونية الجزيئية
In This Article
Summary
تتطلب الدراسات الهيكلية للجزيئات الحيوية بواسطة البلورات بلورات عالية الجودة. هنا نبرهن على بروتوكول يمكن استخدامه من قبل OptiCrys (أداة مؤتمتة بالكامل تم تطويرها في مختبرنا) و / أو أزرار التحليل الدقيق لزراعة بلورات كبيرة عالية الجودة استنادًا إلى معرفة الرسم التخطيطي لمرحلة التبلور.
Abstract
إن استخدام البلورات الجزيئية النيوترونية (NMX) يتوسع بسرعة مع تحديد معظم الهياكل في العقد الماضي بفضل خطوط شعاع NMX الجديدة التي تم بناؤها وزيادة توافر برامج صقل الهيكل. ومع ذلك، فإن مصادر النيوترونات المتاحة حالياً لمي إم إكس أضعف بكثير من المصادر المكافئة للتصوير البلوري بالأشعة السينية. وعلى الرغم من التقدم في هذا المجال، فإن البلورات الكبيرة ستكون مطلوبة دائماً لدراسات الحيود النيوتروني، لا سيما مع الميل إلى دراسة الجزيئات الكبيرة والمجمعات الأكبر من أي وقت مضى. ولذلك فإن إدخال المزيد من التحسينات على الأساليب والأجهزة المناسبة لزراعة بلورات أكبر ضرورية لتوسيع نطاق استخدام NMX.
في هذا العمل، نقدم استراتيجيات عقلانية ومقاعد البلورات (OptiCrys) التي وضعت في مختبرنا الذي يجمع بين المراقبة في الوقت الحقيقي من خلال كاميرا فيديو محمولة على المجهر مع التحكم الآلي الدقيق من حلول التبلور (على سبيل المثال، تركيز حاد، درجة ح/ ، المضافة، درجة الحرارة). ثم نبين كيف أن هذا التحكم في درجة الحرارة والتركيب الكيميائي يسهل البحث عن ظروف التبلور المثلى باستخدام البروتينات القابلة للذوبان في النموذج. المعرفة الدقيقة لمخطط مرحلة التبلور أمر حاسم في اختيار موضع البداية والمسار الحركي لأي تجربة تبلور. نُظهر كيف يمكن لنهج عقلاني أن يتحكم في حجم وعدد البلورات التي يتم إنشاؤها استنادًا إلى معرفة الرسوم البيانية متعددة الأبعاد للمرحلة.
Introduction
فهم العلاقة بين الهيكل والوظائف من البروتينات وآلية المسارات الفسيولوجية غالبا ما يعتمد على معرفة مواقف ذرات الهيدروجين (H) وكيف يتم نقل شحنة داخل البروتين1،2. منذ ذرات الهيدروجين تشتت الأشعة السينية ضعيفة، لا يمكن تحديد مواقعها إلا مع بيانات الحيود الأشعة السينية عالية الدقة (> 1 Å)3،4. وعلى العكس من ذلك، يمكن استخدام البلورات النيوترونية للحصول على موضع دقيق لذرات الهيدروجين في الجزيئات الحيوية مثل الهيدروجين والديوتيريوم (H2، نظير الهيدروجين) ذرات لها أطوال متناثرة ذات حجم متساو تقريبا مثل الأكسجين والنيتروجين والكربون5. ومع ذلك، فإن تدفق النيوترونات من المصادر النيوترونية المتاحة أضعف من شعاع الأشعة السينية، لذلك يجب تعويض هذا في كثير من الأحيان عن2،3. ويمكن تحقيق ذلك عن طريق تبادل H مع H2 و / أو زيادة حجم البلورات للحد من التشتت غير المتماسك للهيدروجين وزيادة نسبة الإشارة إلى الضوضاء لصور الحيود.
هناك العديد من مقاربات التبلور (الرسم التخطيطي المقابل للمرحلة موضح في الشكل 1)للحصول على بلورات كبيرة وعالية الجودة لكل من الأشعة السينية والنيوترونات الحيوية الجزيئية البلورية6. في انتشار البخار ، يتم تعديل القطرات المعدة من خليط من البروتين وحل التبلور بمرور الوقت ، من خلال تبخر الماء أو الأنواع المتطايرة الأخرى ، مقابل خزان يحتوي على تركيز أعلى من الراسعة من نفس محلول التبلور. إن زيادة تركيز البروتينات والزلال في القطرات تؤدي إلى التشبع الزائد المطلوب للانوية العفوية يليه نمو البلورات في هذه النوى6،7. على الرغم من أن انتشار البخار هو الأسلوب الأكثر استخداما لزراعة البلورات4، لا يمكن أن تكون عملية التبلور تسيطر عليها بدقة8. في طريقة نشر الواجهة المجانية ، ينتشر حل التبلور في محلول بروتين مركز ، ويوجه النظام ببطء شديد نحو التشبع الفائق. ويمكن اعتبار هذا الأسلوب كطريقة دفعة مع معدل خلط بطيء6،9،10،11،12. في طريقة الدفعة ، يتم خلط البروتين بسرعة مع محلول تبلور يؤدي إلى التشبع السريع وينوية موحدة بدورها مع العديد من البلورات3،7. هذه الطريقة تمثل حوالي ثلث جميع الهياكل المودعة حاليا في بنك بيانات البروتين. كما تستخدم طريقة غسيل الكلى لزراعة بلورات البروتين عالية الجودة و والتفيش. في طريقة غسيل الكلى، جزيئات من منتشر من خزان من خلال غشاء شبه نفاذية في غرفة منفصلة مع محلول البروتين. حركية التوازن تعتمد على عوامل مختلفة، مثل درجة الحرارة، وحجم المسام الغشاء، وحجم وتركيز عينات البروتين وعوامل التبلور6.
يمكن استخدام مخططات مرحلة التبلور لوصف حالات مختلفة من البروتين كدالة لمتغير فيزيائي أو كيميائي مختلف3. كما هو موضح في الشكل 1، يمكن تصور كل تقنية تبلور على أنها تستخدم مسارًا حركيًا مختلفًا للوصول إلى مناطق التنو والفوقية لمثل هذا الرسم البياني6و10و13. وهذا يوفر معلومات حول ذوبان البروتين وتركيز البروتين الذي لوحظ فيه توازن دينامي حراري بين الكريستال والحل ، وبالتالي إيجاد الظروف المثلى للنيوية والنمو3،14. في مخطط المرحلة ثنائي الأبعاد، يتم رسم تركيز البروتين كدالة متغير واحد ويتم الاحتفاظ بالمتغيرات الأخرى ثابتة15. في مثل هذا الرسم التخطيطي للمرحلة، عندما يكون تركيز البروتين أقل من منحنى القابلية للذوبان، يكون الحل في المنطقة غير المشبعة ولا يحدث أي نواة أو نمو بلوري. فوق هذا المنحنى توجد منطقة التشبع الفائق حيث تركيز البروتين أعلى من حد الذوبان3،14. وتنقسم هذه المنطقة إلى ثلاث مناطق: منطقة الفوقية، ومنطقة النوى العفوية، ومنطقة هطول الأمطار. في منطقة الفوقابل، التشبع الزائد لا يكفي للنيوية أن تحدث في غضون فترة زمنية معقولة ولكن يمكن أن يحدث نمو بلورات بذر. ويفضل التجميع وهطول الأمطار في منطقة هطول الأمطار، حيث التشبع الزائد مرتفع جدا14،15.
عندما يتم تحقيق التشبع الزائد الكافي للنيوية التلقائية، ستظهر النواة الأولى10. يؤدي نمو البلورات إلى انخفاض في تركيز البروتين حتى يتم الوصول إلى حد الذوبان. طالما أن التشبع الفائق يبقى في المنطقة المجاورة لمنحنى القابلية للذوبان، لن يكون هناك تغيير كبير في حجم البلورات. ومع ذلك ، فقد تبين أن الاختلافات في درجة الحرارة والتركيب الكيميائي لمحلول التبلور (على سبيل المثال ، تركيز الزلال) ستؤثر على قابلية الذوبان في البروتين وقد تؤدي إلى بدء المزيد من النمو البلوري8و13و16.
كما غسيل الكلى هو مفيد لنمو الكريستال ذات نوعية جيدة، و OptiCrys تبلور مقاعد البدلاء يتضح في الشكل 2، تم تصميمها وتطويرها في مختبرنا لمراقبة تبلور بطريقة مؤتمتة بالكامل8. لهذا الغرض، تم كتابة برنامج مع LabVIEW التي تسمح لمراقبة ورصد درجة حرارة إعداد غسيل الكلى الخزان المتدفقة في اتصال مع عناصر بلتيير، عن طريق وحدة تحكم إلكترونية ومبرد. نفس البرنامج أيضا ينظم تلقائيا التركيب الكيميائي لمحلول التبلور (على سبيل المثال تبادل عوامل التبلور) باستخدام نظام متعدد القنوات fluidic. بالإضافة إلى ذلك، يتم استخدام كاميرا رقمية ومجهر مقلوب لتصور وتسجيل عملية التبلور. تتوفر غرفتان للتبلور مع 15 ميكرولتر و 250 ميكرولتر لزراعة البلورات لأغراض مختلفة. كما عملية التبلور هو عكسها، والفرز لظروف مختلفة من الممكن مع عدد قليل من ميكرولترات من محلول البروتين طالما لم يتم تلف العينة8. ونتيجة لذلك، فإن استخدام هذه الطريقة يقلل من كمية المواد البروتينية المستخدمة.
من العمل السابق8، من الواضح أنه خلال عملية النمو البلوري ، يجب إجراء عمليات المراقبة في الموقع على فترات زمنية منتظمة. ويمكن أن تتراوح هذه من بضع ثوان إلى عدة أيام، اعتمادا على الحدث تحت الملاحظة (هطول الأمطار، nucleation، أو نمو البلورات).
ويستند تحسين النمو البلورية مع OptiCrys على الرسم البياني مرحلة تركيز درجة الحرارة. في حالة البروتينات مع الذوبان كدالة مباشرة لدرجة الحرارة، فمن الممكن الاستفادة من نظام التملاحالتدريجي 18. هذا هو المكان الذي يزيد من قوة أيونية من الحل، والتي يمكن تصورها باستخدام رسومات تخطيطية مرحلة البروتين- الانتهابي، يقلل من ذوبان البروتين. وبالمثل، يمكن للبروتينات مع الذوبان العكسي الاستفادة من التململ في النظام18. تحدث النوى في منطقة التنو، في محيط المنطقة الفوقية، ثم يحدث نمو البلورات في المنطقة الفوقية من الرسم التخطيطي للمرحلة حتى يصل تركيز البروتين إلى حد الذوبان. كما هو مبين في الشكل 3A، مع درجة حرارة التركيب الكيميائي الثابتة يمكن أن تنخفض للحفاظ على حل التبلور في منطقة ميتاستابل لمنع نوية جديدة. بلورات تنمو حتى يتحقق التوازن الثاني الكريستال / حل وبعد ذلك، لا توجد زيادة أخرى في حجم بلورات لوحظ. يتم تقليل درجة الحرارة عدة مرات حتى تصل البلورات إلى الحجم المطلوب. في الشكل 3B، في درجة حرارة ثابتة ، يزيد التركيز المائل يحافظ على المحلل في منطقة metastable. ويمكن بعد ذلك تكرار هذه العملية عدة مرات للحصول على بلورات كبيرة. تغيير درجة الحرارة والتلاعب في ظروف حل التبلور ، من خلال التحكم في مستويات التشبع الفائق ، هما أداتان قويتان لفصل نوات ونمو البلورات التي يتم التحكم فيها بدقة وتلقائيا من قبل OptiCrys5،8،14.
أمثلة من بلورات البروتين التي نمت من قبل درجة الحرارة التي تسيطر عليها، أو درجة الحرارة وتبلور التركيز التي تسيطر عليها، فضلا عن البيانات الحيود النسبية التي تم الحصول عليها هي متوفرة في الأدب وPDB. من بينها الإنسان γ-crystallin E, PA-IIL lectin, الخميرة غير العضوية بيروفوسفاتاز, أوسترات أوكسيديز, الإنسان الكربوني anhydrase الثاني, YchB kinase, و لاكتات ديهيدروجيناز5,14,17,18.
على الرغم من أن OptiCrys تم تسويقها من قبل NatX-ray ، هناك العديد من المختبرات التي لا يمكن الوصول إلى هذا الصك أو إلى النهج التسلسلي الذي تقدمه. البديل لهذه التقنية هو استخدام أزرار غسيل الكلى البلاستيك المتاحة تجاريا مع وحدات التخزين المختلفة. باستخدام هذه، يمكن تعديل درجة الحرارة والتركيب الكيميائي وتنوعها يدويا. لا يمكن فحص أزرار التحليل المجهري في الموقع ويجب بدلا من ذلك أن يتم يدويا مع المجهر البصري. ويمكن تحقيق التحكم في درجة الحرارة عن طريق الحفاظ على العينة في حاضنة خالية من الاهتزاز درجة الحرارة التي تسيطر عليها. من الضروري الحفاظ على ثبات درجة الحرارة لضمان أن تكون تجارب التبلور قابلة للتكرار. قد يؤدي اختلاف كبير في درجة الحرارة أيضا إلى تلف أو تدمير بلورات5.
هنا نقدم بروتوكول مفصل يصف إعداد العينة واستخدام برامج التحكم لنمو بلورات كبيرة وعالية الجودة مناسبة لبلورات البروتين النيوترونية. تم تصميم هذا الإجراء خطوة بخطوة للاستفادة من الرسم التخطيطي لمرحلة التبلور من أجل تحديد موضع البداية والمسار الحركي للتحكم في حجم ونوعية البلورات التي تم إنشاؤها. بالإضافة إلى ذلك، يتم تقديم بروتوكول مفصل لزراعة البلورات مع أزرار غسيل المجهر الذي يستخدم نفس الأساس المنطقي للحصول على بلورات كبيرة وعالية الجودة.
Protocol
1. طريقة غسيل الكلى مع أزرار غسيل الكلى
- إعداد العينة
- إعداد محلول البروتين عن طريق حل 30 ملغ من البيض lysozyme كمسحوق lyophilized في 1 مل من CH3كونا العازلة (100 mM خلات الصوديوم، ح 4) من أجل الحصول على حل مع تركيز نهائي من 30 ملغ ·مل-1.
- جهاز طرد مركزي العينة في 13000 × ز لمدة 10 دقيقة في 277 K. تساعد هذه العملية على إزالة أي تجميعات قبل بدء عملية التبلور.
- تحقق من امتصاص العينة عند 280 نانومتر واحسب تركيز البروتين باستخدام معادلة بير-لامبرت (A = εcl).
ملاحظة: وفقا لمعادلة بير لامبرت، الامتصاص الإلكتروني (A) يتناسب بشكل مباشر مع التركيز (c، mg·mL-1)من الأنواع الممتصة نظراً لطول مُعَل البصرية الثابتة (l، سم). إن تدرج هذه العلاقة الخطية هو معامل الانقراض الضروس (ε، بالنسبة للlysozyme في 280 نانومتر هو 2.64 مل·ملغ−1·سم−1)19. و sidechains من الأحماض الأمينية العطرية (التيروسين, التربتوفان, وفينيلالانين) وسندات كبريتيد بين بقايا السيستين امتصاص قوية في ~ 280 نانومتر الناشئة عن π spectroscopically المسموح بها – π* التحولات. وبما أن غالبية البروتينات تحتوي على هذه المخلفات، يمكن عادة حساب تركيز البروتين بسهولة عن طريق قياس الامتصاص عند 280 نانومتر، مع العلم بمعامل الانقراض. - إعداد حلول التبلور كما هو موضح في الشكل 4. قم بتصفية جميع حلول الأسهم مع مرشحات ميليبور 0.22 ميكرومتر قبل إعداد محلول التبلور.
- الكريستال النمو
- قطع غشاء غسيل الكلى السليلوز مع الوزن الجزيئي المناسب قطع (6-8 كيلو Da) ونقع في الماء المقطر.
ملاحظة: تتوفر أقراص غشاء غسيل الكلى تجاريًا لأزرار غسيل الكلى، ولكن إذا تم استخدام أنابيب غسيل الكلى، فلا تنس قطع الحواف من أجل فصل طبقتي الغشاء عن الأنبوب للحصول على أغشية طبقة واحدة فقط. - ملء آبار علبة 24-well مع 2 مل من حل التبلور في نفس الترتيب كما هو مبين في الشكل 4.
ملاحظة: إذا استخدمت الأزرار ذات الأحجام الأكبر (على سبيل المثال، 200 ميكرولتر)، املأ أنابيب 50 مل بحد أدنى 5 مل حل تبلور من أجل ضمان التبادل الفعال. - إضافة / pipette 35 μL من حل lysozyme إلى غرفة زر التحليل الدقيق كما هو موضح في الشكل 5A.
ملاحظة: لتجنب تشكيل فقاعات الهواء في زر غسيل الكلى 30 ميكرولتر عند إغلاقه، يجب إضافة حجم إضافي (حجم ميت) من 5 ميكرولتر من البروتين الإضافي، مما يعني ما مجموعه 35 ميكرولتر من عينة البروتين. هذه العينة إضافية من البروتين يخلق شكل مقبب قليلا على الجزء العلوي من الغرفة، كما هو مبين في الشكل 5B، الذي يمنع تشكيل فقاعات الهواء. - اتخاذ قضيب من الحجم المناسب ووضع مرنة O-حلقة في أقصى لها (الشكل 5C). ثم ضع الغشاء، الذي سبق مسحه/استنزفته باستخدام قطعة من الورق الخالي من الألياف، على أعلى غرفة زر غسيل الكلى. يجب الحرص على عدم وضع الغبار في الغرفة عند تطبيق ورقة. ضبط غشاء غسيل الكلى في مكان عن طريق نقل مرنة O-حلقة من قضيب إلى الأخدود من زر غسيل الكلى(الشكل 5C).
ملاحظة: لحظة حرجة من التعامل هو تحديد غشاء غسيل الكلى على أعلى الغرفة عن طريق نقل مرونة O-حلقة من قضيب في الأخدود من زر غسيل الكلى. يجب أن تكون جميع الحركات متزامنة تماما لتجنب إحاطة فقاعات الهواء مع العينة في غرفة البروتين. من المفيد ممارسة تمديد O-ring المرن قبل تطبيقه لمعرفة صلابة، واستخدام ملاقط لعقد جزء من الغشاء أثناء تطبيقه وإجراء تجارب الاختبار الأولى مع بروتين نموذجي. - نقل الزر إلى البئر أو إلى أنبوب 50 مل باستخدام ملاقط (الشكل 5D).
- غطي البئر بغطاء، اضغط عليه بلطف على الشحوم لختم البئر (الشكل 5E).
ملاحظة: إذا لم يكن هناك شحم فوق الآبار، تأكد من إضافة هذا قبل بدء التجربة أو استخدام قطعة من الشريط بدلاً من غطاء الزجاج. ويتضح مبدأ تبلور البروتين باستخدام أزرار التحليل الدقيق في الشكل 5. - الاحتفاظ بالعينة في 293 K في حاضنة حرارية. قد تكون درجات الحرارة المختلفة ضرورية وفقًا للبروتين وظروف التبلور المستخدمة.
ملاحظة: يمكن فحص نفس الشبكة من ظروف التبلور الموضحة في الشكل 4 (مما يسمح بتباين تركيز الزفير) كدالة لدرجة الحرارة. في مثل هذه الحالة، يجب إعادة إنتاج نفس لوحة التبلور ويجب وضع كل نسخة في حاضنة تنظم في درجة حرارة مختلفة. وهذا يتطلب وجود العديد من الحاضنات الحرارية الخالية من الاهتزازات. - تحقق من علبة أو أنابيب لبلورات (الشكل 4) وتدوين الملاحظات على أساس منتظم ، عادة يوميا ، للتمييز بين ما هو في كل علبة. ملاحظات جيدة ضرورية لتجنب نتائج إيجابية كاذبة والتمييز الغبار من بلورات.
- قطع غشاء غسيل الكلى السليلوز مع الوزن الجزيئي المناسب قطع (6-8 كيلو Da) ونقع في الماء المقطر.
2. عملية النمو كريستال باستخدام OptiCrys
- إعداد العينة
- إعداد محلول البروتين وغشاء غسيل الكلى كما هو موضح في القسم 1.1.
- إعداد حلول الأسهم من NaCl (4 M) و CH31 COONA pH 4 (1 M) وتصفية لهم في أنابيب 50 مل.
- إضافة محلول البروتين (15 μL من lysozyme مع 30 ملغ · مل-1) إلى غرفة غسيل الكلى من درجة الحرارة التي تسيطر عليها تدفق الغسيل الكلوي إعداد. راجع الشكل 6 للحصول على تفاصيل عن إعداد غسيل الكلى المتدفق الذي يتم التحكم فيه بدرجة الحرارة. يحتوي OptiCrys على غرفتين لغسيل الكلى، والحد الأدنى للحجم هو 15 ميكرولتر والحد الأقصى للحجم هو 250 ميكرولتر.
- تغطية overchamber مع غشاء غسيل الكلى وإصلاح الغشاء مع مرنة O-حلقة (الشكل 6B).
ملاحظة: يختلف هذا الإعداد عن أزرار غسيل الكلى حيث يتم إغلاق كل غرفة مباشرة بواسطة غشاء غسيل الكلى. في خلية التدفق ، يتم تثبيت غشاء غسيل الكلى بدلاً من ذلك إلى الغرفة التي تسمح بتركيب البلورات دون إزالتها. لهذا الغرض، يمكن ببساطة أن تكون غرفة فوق من الخزان غير مفككة. - اقلب الغرفة العلوية وضعه فوق غرفة غسيل الكلى. ببطء وبلطف اضغط عليه لإزالة جميع الهواء المحاصرين بين قطعتين وتجنب فقاعات في الغرفة (الشكل 6C). يمكن أن يكون التدريب مع نموذج البروتين مفيدًا عند التدريب لتجنب فقاعات الهواء وفقدان العينات.
- إصلاح الخزان في موقفها عن طريق الشد بلطف على رأس overchamber، ويجري مرة أخرى تضع في اعتبارها لتجنب محاصرة فقاعات الهواء. الإفراط في تشديد الخزان يمكن أيضا تشكيل فقاعات في غرفة التبلور (الشكل 6D).
- إضافة محلول التبلور وتغطية غرفة الخزان مع غطاء محكم. (الشكل 6G). الحد الأقصى لحجم الخزان هو 1 مل.
- نقل هذا التجمع وإدراجه في دعم النحاس. هذا الدعم هو على اتصال مع عناصر بلتيير التي تستخدم للسيطرة على درجة الحرارة.
- كما هو موضح في الشكل 6، تم تجهيز الغطاء محكم مع نافذة بصرية للسماح اضاءة أعلى من غرفة غسيل الكلى. وضع مصدر الضوء (الشكل 2) على النافذة مما يسمح للضوء بالمرور عبر الغرفة.
- يمكن توصيل غرفة الخزان بمضخة للسماح لها بالعمل كخلية تدفق مستمر. توصيل الأنابيب على رأس أنابيب 50 مل التي تحتوي على حلول المخزون والمياه المقطرة إلى صمام دوار كما هو موضح في الشكل 7.
ملاحظة: إذا لم يتم المطلوب الإعداد التلقائي وتغيير حلول التبلور أثناء التجربة، حذف الخطوة 2.1.10. وفي هذه الحالة، يجب إعداد محلول التبلور وتعبئة الخزان مسبقاً يدوياً.
- البرمجيات
- تشغيل الكمبيوتر وإطلاق برنامج كروايسانس كريستالين [الكريستال النمو]. تتم كتابة برنامج التحكم هذا باستخدام LabVIEW (http://www.ni.com/labview/) ويوفر واجهة رسومية سهلة الاستخدام. ويشمل 4 واجهات رسومية مختلفة (Accueil [مرحبا]، Paramétrage [الإعداد]، عيسي [اختبار]، والصيانة [الصيانة])(الشكل 8).
ملاحظة: الترجمات من الفرنسية بين قوسين. - حدد طريقة العرض الصيانة بالنقر فوق الزر كما هو موضح في الشكل 8. هذا العرض هو حاليا الأكثر استخداما ويسمح للمستخدمين للسيطرة على معظم المعلمات أثناء التجربة.
ملاحظة: بعد النقر على طريقة العرض Maintenance، ستظهر نافذة جديدة ذات أقسام مختلفة للتحكم في المعلمات مثل درجة الحرارة أو الضوء. في الشكل 8 يتم عرض أجزاء مختلفة من هذا الرأي مع السهام والإطارات. في الخطوات التالية، نُوضح كيفية التحكم في كل معلمة باستخدام البرنامج. - الفصل دي température [درجة الحرارة تحكم] قسم يسمح التحكم ومراقبة درجة الحرارة. انقر على زر ، رقم واحد (1) في الشكل 8، لتشغيله.
ملاحظة: تتراوح درجة الحرارة في OptiCrys هو 233.0 - 353.0 ± 0.1 K. - تعيين درجة الحرارة على المرسل [setpoint] المقطع والصحافة enter(الشكل 8(2)). أسفل هذا الزر، يوجد رسم بياني مع 2 آثار (الأحمر والأصفر). يظهر التتبع الأحمر درجة الحرارة النهائية (مرتبة) ويظهر التتبع الأصفر درجة الحرارة الحالية. كما هو مبين في الشكل 8(2)، يتم تعيين درجة الحرارة عند 20 درجة مئوية.
ملاحظة: من أجل أن تنمو الكريستال، كما هو موضح في قسم نمو البلورات، وسوف تحتاج إلى اختيار العديد من درجات الحرارة. لتغيير درجة الحرارة، أضف كل درجة حرارة جديدة في المقطع [نقطة setpoint] المرسَل إليها واضغط على الزر Enter على لوحة المفاتيح. - تشغيل الضوء عن طريق زيادة اللمعان من Lumières [أضواء] المقطع في الشكل 8. اللمعان يتراوح من 0 إلى 100، "0" يشير إلى أن الضوء هو إيقاف وعند "100" يتم تعيين الضوء إلى الحد الأقصى من كثافة وسطوع. عن طريق زيادة الضوء، في قسم المجهر، يمكن للمرء أن يرى داخل غرفة غسيل الكلى. خلال التجربة، قد تختلف السطوع في الخلية; ضبط المعلمات تصور بوضوح داخل غرفة غسيل الكلى. يمكن أيضًا زيادة التكبير أو تقليله باستخدام الزرين + و - أمام "التكبير" لعرض أفضل.
- على الجانب الأيمن من قسم المجهر، هناك عدة أقسام لتخزين المعلومات ذات الصلة لكل تجربة تبلور. يمكن لكل مستخدم إنشاء مجلد لتخزين المعلومات عن ظروف التبلور، وأسماء البروتينات وقطع الوزن الجزيئي لغشاء الغسيل الكلوي المستخدم(الشكل 8(3)).
- يمكن للمستخدم تعريف اسم للتجربة ببساطة بكتابته على Nom ملف [اسم المجلد]. بالنقر على ملف [زر مجلد] (يظهر مع إطار أخضر في الشكل 8) يفتح نافذة جديدة. في هذا الإطار، سيكون هناك ملف نصي يحتوي على كافة المعلومات المعرفة للتجربة. بالإضافة إلى ذلك، يتم حفظ الصور ذات الطابع الزمني في هذا المجلد للمعالجة المستقبلية.
- من قسم صور NB ، حدد عدد الصور التي يجب التقاطها أثناء سير التجربة. حدد عدد الصور في اللوحة اليمنى مع الفاصل الزمني المطلوب بين هذه الصور (على سبيل المثال، الحد الأدنى، الساعة، اليوم). ويبين الشكل 8 إعداد البرنامج لتسجيل الصور صفر في دقيقة واحدة.
ملاحظة: استخدم قسم [مضخة] بومبي لخلط حلول المخزونات وحقن محلول التبلور في غرفة الخزان. انظر القسم 2-1-10 والشكل 7 للاطلاع على شرح لمبدأ نظام خلط السوائل. - تركيزات المدخلات من حلول المخزون في Etape 1 [الخطوة 1]: مخزون الحلول. لتجربة التبلور في القسم التالي، سيتم استخدام NaCl 4 M و CH3COONa 1 M PH 4.
ملاحظة: تركيزات من الأسهم الحلول في وحدات المول. - تحديد التركيز النهائي لكل حل. على سبيل المثال 0.75 M ل NaCl و 0.1 M لCH31 10000000000000000000000000000000000000000000000000000000000000000 إدخال هذه في قسم التركيز النهائي (الشكل 8) في Etape 2 [الخطوة 2]: حل à préparer [حل للتحضير]. اضغط على زر Calcul [Compute] ، الذي يظهر بإطار أحمر في الشكل 8. سيتم عرض الحجم النهائي لكل حل مخزون التي سيتم استخدامها في خلط في لوحة وحدة التخزين أمام كل لوحة تركيز.
- اضغط على زر [إعداد الإطلاق] لـ Lancer (الشكل 8). كما هو موضح في الشكل 7، يأخذ الصمام الدوار كل حل مخزون ويحقنها إلى أنبوب الخلط عبر التبديل.
- بعد أن تم إعداد حل التبلور، انقر على زر حل Entrée [إدخال الحل] في Etape 3 [الخطوة 3]: تدفق قسم المضخة (الإطار الأصفر في الشكل 8). يتغير المفتاح لحقن محلول التبلور الجديد من أنبوب الخلط في غرفة الخزان. لإيقاف عملية التبادل، اضغط على زر توزيع Arrêt [إيقاف التوزيع].
ملاحظة: مراقبة عملية التبلور أثناء التجربة وتعديل المعلمات مثل درجة الحرارة، حل التبلور والتكبير، في واجهة رسومية المقابلة من برنامج الإشراف. باستخدام البرنامج ليست هناك حاجة لإزالة غطاء محكم أو خلية تدفق خلال التجربة حتى المتغير الوحيد سيكون واحد أن المستخدم التغييرات من خلال البرنامج.
- تشغيل الكمبيوتر وإطلاق برنامج كروايسانس كريستالين [الكريستال النمو]. تتم كتابة برنامج التحكم هذا باستخدام LabVIEW (http://www.ni.com/labview/) ويوفر واجهة رسومية سهلة الاستخدام. ويشمل 4 واجهات رسومية مختلفة (Accueil [مرحبا]، Paramétrage [الإعداد]، عيسي [اختبار]، والصيانة [الصيانة])(الشكل 8).
- نمو بلوري كبير
- إضافة 15 μL من lysozyme مع تركيز 30 ملغ · مل-1 إلى غرفة غسيل الكلى (الشكل 6A).
ملاحظة: إعداد عينة البروتين كما هو موضح في القسم 1.1. - تجميع درجة الحرارة التي تسيطر عليها تدفق الغسيل الكلوي إعداد الخزان كما هو موضح في القسم 2.1 والشكل 6.
- إعداد حل التبلور. لا ننسى لتصفية جميع حلول الأسهم قبل إعداد العينة مع مرشحات 0.22 μm. لهذه التجربة، يحتوي حل التبلور على 0.75 M NaCl و 0.1 M CH3COONa pH 4. ويمكن أن يضاف هذا يدويا أو باستخدام غرفة الخزان ونظام الضخ كما هو موضح في الأقسام 2-2-10 إلى 2-2-12.
- تعيين درجة الحرارة إلى 295 K كما هو موضح في الأقسام 2.2.3 و 2.2.4 ويظهر في صورة 8. وفي ظل الظروف الأولية، سيتم التوصل إلى التوازن بين غرفة الغسيل الكلوي والخزان بعد حوالي 90 دقيقة، وستظهر أول نوى مرئية بعد 22 ساعة.
- السماح للبلورات لتنمو حتى لا يتم ملاحظة أي تغييرات أكثر وضوحا في حجم البلورات(الشكل 9، لوحة 1).
ملاحظة: من أجل تحديد وقت التنو وقياس الاختلاف في حجم البلورات، تسجيل الصور كل 15 أو 20 دقيقة، وهو على التوالي 4 أو 3 صور في الساعة في قسم صور NB. للمراقبة في الموقع من التخمس البروتين، وتجميع وهطول الأمطار أو ذوبان الكريستال أو نوات، وعادة ما تكون بين بضع ثوان إلى بضع عشرات من دقائق مطلوبة. ومع ذلك، لنمو البلورة، وهذا النطاق هو بين بضع دقائق إلى بضع ساعات. - بعد ثلاثة أيام، خفض درجة الحرارة إلى 291 K لإعادة تشغيل نمو البلورة. الحفاظ على درجة الحرارة ثابتة والسماح للبلورة تطوير(الشكل 9، لوحة 2). في هذه المرحلة من التجربة، سيكون كافيا لتسجيل الصور كل 2 ساعة والتحقق من كل 10 إلى 12 ساعة لأي تغيير في حجم البلورات. ويمكن مواصلة التجربة إذا لم يلاحظ أي تغيير في حجم البلورات.
ملاحظة: اعتمادا على البروتين وتركيزات متهورة في محلول التبلور وحجم البروتين المستخدمة، قد تختلف الوقت اللازم للوصول إلى التوازن لكل خطوة. - خفض درجة الحرارة إلى 288 K لإعادة تشغيل نمو البلورات. في الحالة التجريبية للحالة المعروضة هنا، يكفي يوم واحد للوصول إلى التوازن(الشكل 9، اللوحة 3).
- تحقق من حجم البلورات والحفاظ على درجة حرارة ثابتة طالما أن البلورة لا تزال تنمو.
- بعد 4 أيام، وانخفاض درجة الحرارة إلى 275 K من أجل إعادة تشغيل نمو البلورات(الشكل 9، لوحة 4).
– في الظروف التجريبية للحالة المعروضة، وبعد حوالي 10 أيام سيتم الحصول على الكريستال الذي هو 500 ميكرومتر في بعد واحد (الشكل 9).
- إضافة 15 μL من lysozyme مع تركيز 30 ملغ · مل-1 إلى غرفة غسيل الكلى (الشكل 6A).
- التحكم في حجم الكريستال
- إعداد محلول البروتين وغسيل الكلى الخزان المتدفق الذي يتم التحكم فيه بدرجة الحرارة على النحو المبين في القسمين 2.3.1 و 2.3.2.
- إعداد حلول التبلور مع 0.9 M NaCl و 0.1 M CH3COONa pH 4.
- تعيين درجة الحرارة إلى 291 K والسماح للبلورات لتنمو. في ظل الظروف الأولية، سيبدأ أول حدث نوية بعد حوالي ساعة واحدة، وسوف تنمو العديد من البلورات في غرفة غسيل الكلى لمدة ثلاث ساعات(الشكل 10، الخطوات: 1 و 2). تسجيل الصور كل 20 دقيقة للتحقق من حجم البلورات خلال عملية النمو.
ملاحظة: تحسين ظروف التبلور أمر بالغ الأهمية في التحكم في معظم الخصائص النهائية للبلورات المولدة. يمكن تغيير درجة الحرارة والتركيب الكيميائي لحلول التبلور إلى حل وإعادة زراعة بلورات ذات حجم موحد. وتجدر الإشارة أيضا إلى أن عينة البروتين لا تستهلك في مثل هذه التجربة، كما يمكن عكس الشروط لإعادة حل العينة طالما أنها ليست التشويه. عند حل البلورات عن طريق تغيير درجة الحرارة والحفاظ على التركيب الكيميائي المستمر، مواصلة التجربة على النحو التالي: - مرة واحدة نمت بلورات في 291 K، يمكن أن تذوب هذه لإعادة زراعة أقل، أكبر بلورات. زيادة درجة الحرارة تدريجيا أكثر من 20 دقيقة لتصل إلى 313 K. يستغرق حوالي ساعة واحدة لتذويب جميع البلورات داخل غرفة غسيل الكلى(الشكل 10، الخطوات: 3-5). تسجيل الصور كل 5 إلى 15 دقيقة لمراقبة عملية الحل.
ملاحظة: العديد من البروتينات حساسة لارتفاع درجات الحرارة. تأكد من العمل ضمن نطاق درجة الحرارة حيث البروتين مستقر لتجنب أي ضرر / denaturation. بالإضافة إلى ذوبان البروتين، تؤثر درجة الحرارة أيضا على محلول العازلة. على سبيل المثال، يمكن أن يتغير درجة الـ PH للمخزن المؤقت مع درجة الحرارة، خاصة في المخزن المؤقت تريس. في مثل هذه الحالة، من المهم جداً ضبط درجة الـ (درجة الـ PH) وفقاً لدرجة الحرارة التي يتم فيها تنفيذ التجربة18. وتجدر الإشارة أيضا إلى أن حل البروتين يستغرق وقتا أقل بكثير (من بضع دقائق إلى بضع ساعات) مقارنة بنمو البروتين الكريستال (من بضع ساعات إلى بضعة أيام). بشكل عام ، أثناء حل البلورات ، تزداد درجة الحرارة تدريجيًا وببطء (مع احترام وقت الحل الكلي القصير) ، بشكل رئيسي في حالة الإنحلال الجزئي للبلورات لتجنب زيادة الفسيفساء البلورية. عندما تنمو البلورات، يمكن أن تنخفض درجة الحرارة بسرعة (في أقل من دقيقة) إلى درجة الحرارة المحددة (احترام وقت النمو الإجمالي الطويل). من المستحسن مراقبة منتظمة لغرفة التبلور عن طريق تسجيل الصور لمنع تلف البروتين والمساعدة في تحديد الوقت الأمثل للذوبان أو نمو البلورات لكل بروتين درس. - بعد أن ذاب كل بلورات تعيين درجة الحرارة إلى 295 K لبدء حدث نوية الثانية(الشكل 10، الخطوات : 6،7). تسجيل الصور كل 5 دقائق لمراقبة عملية النوى الثانية. في هذه الخطوة، تظهر النوى الأولى بعد حوالي 18 دقيقة.
ملاحظة: في هذه الدرجة، سيكون الحل في منطقة النوى، في المنطقة المجاورة للمنطقة الفوقية. ونتيجة لذلك، ستظهر في غرفة التبلور سوى عدد قليل من النوى. - متابعة التجربة تكرار سير العمل الأمثل الموضحة في القسم 2.3 لزراعة بلورات أكبر. المدة الإجمالية للتجربة الممثلة في الشكل 10 هي فقط بضعة أيام.
ملاحظة: إذا ظهرت البلورات خلال مرحلة التنو في أوقات مختلفة، يتم الحصول على بلورات ذات أحجام مختلفة في غرفة التبلور. في مثل هذه الحالة ، فإن الزيادة في درجة الحرارة (في حالة البروتينات ذات الذوبان المباشر) ستؤدي إلى حل أسرع للبلورات الأصغر. اعتمادا على تأثير النضوج الحركية، يمكن بعد ذلك استخدام البروتين الإضافي (المكتسب من الحل) لنمو البلورات الأكبر.
عند إذابة البلورات في درجة حرارة ثابتة عن طريق تغيير التركيب الكيميائي لمحلول التبلور ، استمر التجربة على النحو التالي:
ومن الممكن أيضاً أن تذوب البلورات التي نمت سابقاً عن طريق تغيير التركيب الكيميائي لمحلول التبلور خلال التجربة لإعادة زراعة عدد من البلورات ذات الحجم الموحد في ظل ظروف جديدة. - قم بإعداد محلول البروتين (2.3.1) وإعداد غسيل الكلى المتدفق لخزان درجة الحرارة (2.1) وحل التبلور (2.4.2) كما هو موضح أعلاه. في ظل الظروف الأولية في منطقة التنو بعيدا عن منطقة ميتابل، سوف تظهر العديد من البلورات الصغيرة في غرفة التبلور وتبدأ في النمو (الشكل 11، الخطوات: 1،2).
- بعد ثلاث ساعات، عندما تكون العديد من البلورات المتوسطة الحجم مرئية في غرفة التبلور(الشكل 11، الخطوة: 3) ، تقليل تركيز NaCl (0.9 M) تدريجيا للوصول إلى الصفر. لهذا، إعداد حل تبلور جديد يحتوي على حل عازلة فقط مع 0.1 M CH33 100000000000000000000000000000000000000000000000000000000000000000000 استخدام نظام الضخ لتبادله مع حل التبلور في غرفة الخزان. اتبع الخطوات 2-2-10 إلى 2-2-12 لإعداد وضخ حل جديد في غرفة الخزان. مع هذا الحل الجديد، عندما يتم تبادل الحلول ينخفض تركيز NaCl في الغرفة حتى لا يحتوي الحل النهائي في غرفة الخزان على أكثر من 0.1 متر من CH3COONa pH 4 ولا يحتوي على أي NaCl. التقاط الصور كل 10 دقائق لتسجيل عملية حل.
- السماح للبلورات أن تذوب تماما (الشكل 11، الخطوات : 4،5). وقت الإنحلال حوالي ساعتين لهذه التجربة. كما ذكر سابقا، وقت حل يعتمد على نظام البروتين، وبلورة الظروف، وحجم غرفة غسيل الكلى المستخدمة. المراقبة المنتظمة لغرفة التبلور (انظر قسم المجهر) وتسجيل الصور والملاحظات أثناء التجربة أمر ضروري.
- عندما يتم حل جميع البلورات داخل الغرفة(الشكل 11، الخطوة: 5) ، استخدم نظام الضخ مرة أخرى لإعداد محلول تبلور جديد عن طريق حقن NaCl بتركيز أقل من السابق (0.75 M NaCl في 0.1 M CH3COONa pH 4).
- حقن الحل الجديد في غرفة الخزان(الشكل 11، الخطوات : 6،7) وتكرار تبلور النمو الأمثل سير العمل كما هو موضح في القسم 2.3. سيتم توليد عدد موحد من البلورات أكبر. وقد تم الحصول على النتائج المبينة في الشكل 11 بعد بضعة أيام.
النتائج
في القسمين 2.3 و 2.4، يتم عرض ثلاثة أمثلة على النمو الأمثل للبلورات، والتي تبين استخدام الأداة وتصميم تجريبي لزراعة بلورات كبيرة. لهذا العرض، استخدمنا lysozyme كبروتين نموذجي، على الرغم من أن تجارب النمو البلوري قد أجريت بنجاح مع العديد من أنظمة البروتين الأخرى باستخدام هذه الطريقة (انظر أعلاه). باستخدام واتقان البروتوكول المقدم هنا يمكن للمرء أن تكييفه للمرشحين البروتين الأخرى.
في القسم 2.3 أظهرنا أن استراتيجيات التبلور العقلانية الراسخة يمكن أن تكون مفيدة في زراعة البلورات مع كميات متناثرة كافية لبلورات البروتين النيوتروني. هنا، نبرهن على أن استراتيجيات التحسين الرشيد المقترحة تسمح أيضاً بتوليد مجموعة موحدة من البلورات من أي حجم محدد مطلوب للنهج النهائية لتحديد الهيكل.
تم تصميم هاتين التجربتين للتأكيد على أهمية الرسوم البيانية للمرحلة في التحكم في نوات الكريستال والنمو. هنا ، يتم استخدام التحكم في درجة الحرارة والتركيب الكيميائي لحلول التبلور في تركيبة مع مراقبة عملية التبلور في الوقت الحقيقي لدراسة الرسم التخطيطي للمرحلة النوعية. باستخدام هذه الطريقة، يمكن تحسين التنو ونمو البلورات بشكل عقلاني بطريقة قابلة للعكس. كما أن استخدام مثل هذا النهج التسلسلي يقلل من كمية البروتين والوقت اللازم للتحكم في حجم البلورات وجودةها.
في طريقة غسيل الكلى ، يتم فصل محلول البروتين عن محلول التبلور بواسطة غشاء شبه نفاذي6 (الشكل 5). يسمح هذا الغشاء غسيل الكلى جزيئات صغيرة مثل المضافات، العازلة، والأيونات بالمرور من خلال الغشاء ولكن ليس الجزيئات مثل البروتينات6،20. تسمح هذه الميزة بتعديل محلول التبلور خلال التجربة6. ويمكن أن يتم تبادل الحل يدويا، على سبيل المثال في أزرار التحليل الدقيق، أو بطريقة آلية باستخدام أداة وضعت لهذا الغرض، OptiCrys8.
في المجموعة الأولى من التجارب، استخدمت أزرار التحليل الدقيق لبلورة البيض الدجاج الأبيض lysozyme. كانت أزرار غسيل المجهر مغمورة في حلول التبلور مع تركيزات ملح مختلفة. في هذه التجربة شبكة التبلور بسيطة، المتغير الوحيد هو تركيز حاد بينما تبقى درجة الحرارة ثابتة (293 K). كما هو مبين في الشكل 4، فإن الاختلافات الطفيفة في تركيز الملح تحفز على تغيير في حجم وأعداد البلورات الملاحظة ، مما يسمح بالتحقيق في مخطط مرحلة التبلور. في الشكل 4، اللوحة 1 ، يحتوي حل التبلور على 0.7 M NaCl وظهر عدد محدود من البلورات الكبيرة في الأزرار. عن طريق زيادة تركيز الملح من 0.7 إلى 1.2 م، يزيد التشبع الفائق ويتحرك الحل في منطقة النوى بعيدا عن منطقة الفوقية (الشكل 4، لوحات 1 إلى 6). ونتيجة لذلك، يزداد عدد البلورات ويقل حجمها.
في التجربة الأولى مع أداة مؤتمتة بالكامل تمكين درجة الحرارة التي تسيطر عليها تبلور غسيل الكلى، OptiCrys (الشكل 9)،تم تصميم تجربة النمو البلورية لتوليد نمو بلوري كبير. وقد أطلقت التجربة في درجة حرارة أولية قدرها 295 ك مع محلول تبلور يحتوي على 0.75 M NaCl و 0.1 M Na درجة الأسيتات العازلة 4. في ظل هذه الظروف التجريبية، وصل محلول التبلور إلى منطقة النوى في محيط منطقة الفوقا للمخطط(الشكل 9، السهم 1). ونتيجة لذلك، تم توليد عدد قليل من النوى خلال المرحلة الأولى من التجربة. من أجل أن تنمو بلورات مختارة مزيد من (هو مبين في الشكل 9)، وكان الدافع وراء تدفق العمل الأمثل نمو البلورات نحو منطقة metastable بدرجات حرارة متفاوتة بمجرد التوصل إلى توازن حل الكريستال.
في كل مرة تم التوصل إلى التوازن بين الكريستال والحل، تم تخفيض درجة الحرارة، أولا إلى 291 K، ثم إلى 288 K وأخيرا إلى 275 K، للحفاظ على حل التبلور في منطقة ميتابل. نتيجة هذه التجربة هي واحدة كبيرة الكريستال مناسبة لكل من الأشعة السينية الجزيئية الجزيئات والبلورات النيوترونية.
بالنسبة لمعظم البروتينات، لم يتم بعد الحصول على الرسم التخطيطي الدقيق للمرحلة الكمية (أو مجرد رسم تخطيطي نوعي) بسبب نقص الأجهزة التجريبية القادرة على قياس تركيز البروتين بدقة (أو مجرد مراقبة/ اكتشاف عملية التبلور في الوقت الحقيقي) أثناء تجارب التبلور18. ونتيجة لذلك، غالباً ما لا يكون من الممكن تصميم التجربة بطريقة تبدأ التبلور في المنطقة المثلى للرسم التخطيطي للمرحلة، في المنطقة المجاورة لمنطقة الفوقابل.
لذلك ، يجب أن يتم إجراء دراسة تحسين التبلور قبل إجراء التجربة المخصصة لنمو بلورة كبيرة الحجم. في هذه الدراسة، باستخدام التغيرات في درجة الحرارة (في التركيب الكيميائي الثابت) من ناحية والاختلافات في التركيب الكيميائي (في درجة حرارة ثابتة) من ناحية أخرى، هي ضرورية لتحديد المنطقة metastable وتحديد الظروف المثلى لبدء تجربة نمو بلورية كبيرة.
وتحقيقا لهذه الغاية، يتم عرض تجربتين أخريين تم تصميمهما لإثبات عكس تجارب تبلور غسيل الكلى التي يتم التحكم فيها بدرجة الحرارة مع OptiCrys للانوية والنمو البلورية والذوبان وإعادة النمو. تم التحكم في سير العمل الأمثل للنمو البلوري بحيث نمت مجموعة سكانية موحدة من بلورات lysozyme أكبر ، باستخدام اختلاف درجة الحرارة أو التركيز المتعجل.
في التجربة الثانية مع OptiCrys، تم الاحتفاظ التركيب الكيميائي لمحلول التبلور ثابتًا طوال التجربة (0.9 M NaCl في 0.1 M CH3COONa pH 4) مع درجة حرارة متغيرة. وحددت درجة الحرارة الأولية عند 291 ك. وقد تم تلخيص نتائج هذه التجربة في الشكل 10. بسبب ارتفاع التشبع، ظهر عدد كبير من البلورات الصغيرة في غرفة التبلور(الشكل 10، الألواح 1 و 2). وفقا لمفهوم ذوبان البروتين المباشر، عن طريق زيادة درجة الحرارة تدريجيا إلى 313 K، تم حل جميع البلورات(الشكل 10،لوحات 3، 4 و 5). وأخيراً، من خلال خفض درجة الحرارة إلى 295 ك، بدأت النوى الثانية في المنطقة المجاورة للمنطقة القابلة للفوقية وسمحت بتشكيل مسيطر عليه لعدد أقل من النوى. وأدى المزيد من النمو الكريستال في جيل موحد من سكان أكبر بلورات(الشكل 10, لوحة 7).
كما هو مبين في الشكل 11، يمكن استخدام تباين التركيب الكيميائي لمحلول التبلور ، عند درجة حرارة ثابتة قدرها 291 K ، للحصول على مجموعة موحدة من البلورات الأكبر. وعلى غرار التجربة السابقة، كانت الحالة الأولية 0.9 م 1 في 0.1 م CH3COONa الرقم الH 4. ثم تم تخفيض تركيز NaCl تدريجيا من 0.9 M إلى صفر إلى حل البلورات (الشكل 11، الألواح 4 و 5). عند هذه النقطة، تم استبدال NaCl تماماً بمحلول عازل قدره 0.1 م CH3أونا درجة PH 4. يقلل من تركيز الملح يحافظ على المحلل في المنطقة غير المشبعة من الرسم التخطيطي للمرحلة ، مما يؤدي إلى ذوبان البلورات. ثم، تم حقن محلول تبلور جديد مع قوة الأيونية أقل، في 0.75 M NaCl في 0.1 م CH3 3155000، في غرفة الخزان. في هذا التركيز المتعجل، ظهرت النوى الأولى(الشكل 11، اللوحة 6) بعد 90 دقيقة. وكان عدد البلورات المتولدة أقل وبلورات تصل إلى حجم أكبر(الشكل 11، لوحة 7) من ذي قبل.
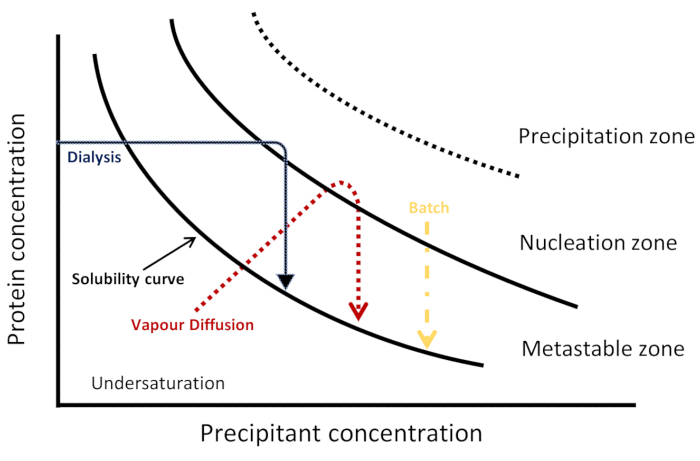
الشكل 1: مخطط المرحلة التخطيطي. يتم تمثيل المسارات الحركية لتقنيات التبلور الثلاث في نظام التملاح. كل طريقة يحقق التنو والتبلور بشكل مختلف، تصورها مسار حركي مختلف من خلال الرسم البياني للمرحلة للوصول إلى مناطق التنو والفوقية. يفصل منحنى الذوبان بين المناطق غير المشبعة والبيراشبية. وتنقسم التشبع الفائق إلى ثلاث مناطق: metastable، nucleation وهطول الأمطار. في منطقة النوى، تحدث النوى التلقائية بينما يحدث في المنطقة الفوقية نمو البلورات. يتم تكييف هذا الرقم من جونيوس وآخرون. 8يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
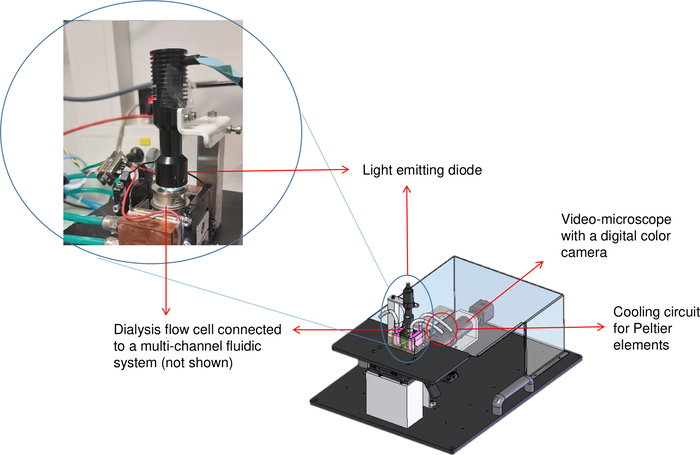
الشكل 2: التمثيل التخطيطي لمقاعد التبلور (OptiCrys). مصدر ضوء LED يقع على قمة خلية تدفق غسيل الكلى التي تسيطر عليها درجة الحرارة. يتم عرض مجهر مقلوب والكاميرا الرقمية في أعلى يمين الصورة مع السهم الأحمر. تمثل الدائرة الحمراء موقع أنابيب المبرد. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: مخطط مرحلة تبلور البروتين ثنائي الأبعاد التخطيطي كدالة لدرجة الحرارة (A) والتركيز (B). (أ) في حالة وجود بروتين مع الذوبان المباشر، وانخفاض درجة الحرارة يحافظ على محلول التبلور في منطقة ميتابل. ويمكن تكرار تغير درجة الحرارة عدة مرات للسيطرة على عملية نمو البلورات حتى يتم الحصول على بلورات مع حجم المطلوب. (ب) يمكن أيضا تغيير تركيز حل متعجل يمكن استخدامها للحفاظ على حل التبلور في منطقة ميتابل لزراعة البلورات. يتم تكييف هذا الرقم من جونيوس وآخرون. 8يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: بلورات الليشف التي تم الحصول عليها باستخدام طريقة غسيل الكلى. وقد أجريت هذه التجربة في درجة حرارة ثابتة من 293 K في 0.1 M خلات الصوديوم العازلة الأسك 4. زيادة تركيز الناول من 0.7 M إلى 1.2 M يزيد من معدل النوى ويؤدي إلى عدد أكبر من البلورات. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
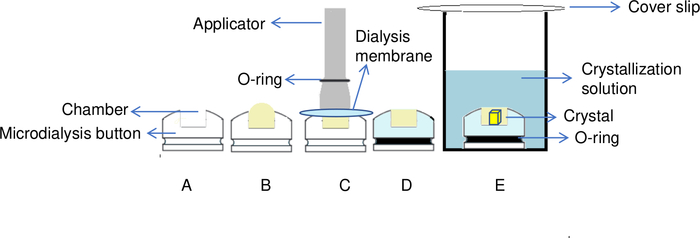
الشكل 5: نظرة عامة على عملية تبلور البروتين من خلال طريقة غسيل الكلى. (أ) عن طريق إضافة البروتين إلى غرفة زر غسيل الكلى، (ب) يتم إنشاء شكل قبة على الجزء العلوي من الغرفة. (ج) يستخدم قضيب لنقل O-ring إلى الأخدود من زر غسيل الكلى من أجل إصلاح غشاء الغسيل الكلوي في مكان. (د) زر غسيل الكلى جاهز للغمر في محلول الخزان. (ه) حل التبلور يمر عبر غشاء نصف نفاذ والبلورات تبدأ في التشكل داخل الغرفة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
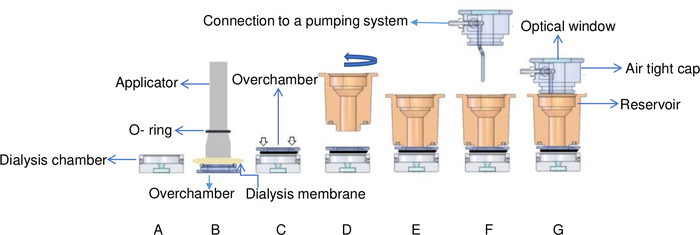
الشكل 6: عرض تخطيطي لإعداد غسيل الكلى المتدفق الذي يتم التحكم فيه بدرجة الحرارة. (أ) تضاف عينة البروتين إلى غرفة غسيل الكلى. (ب) يتم إصلاح غشاء غسيل الكلى على غرفة النوم مع O-حلقة باستخدام قضيب. (C) يتم تشغيل overchamber وثابتة على الجزء العلوي من غرفة غسيل الكلى. الأسهم البيضاء تشير إلى مكان مسامير توضع على overchamber. (د) يتم تشغيل غرفة الخزان في اتجاه عقارب الساعة (E) وثابتة على رأس الغرفة العلوية. (و) غرفة الخزان مغطاة بغطاء محكم مع موصلات لنظام ضخ و (ز) يتم وضع خلية التدفق في دعم النحاس. يتم تكييف هذا الرقم من جونيوس وآخرون. 8يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
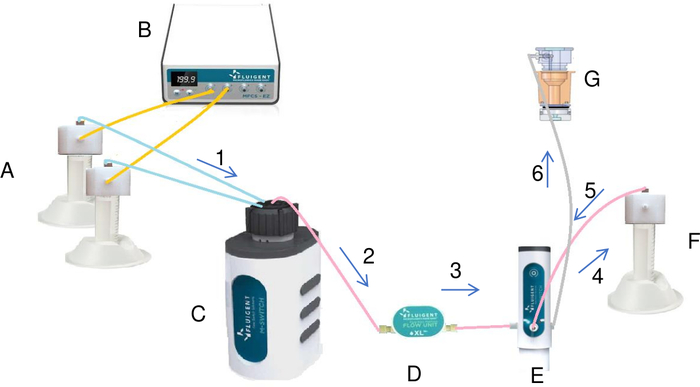
الشكل 7: تحضير حقن محلول التبلور في الخزان بواسطة النظام السائل (A). ترتبط الأنابيب التي تحتوي على الملح والماء بوحدة التحكم بالضغط/الفراغ (B) والصمام الدوار (C). باستخدام الضغط، الضغط / فراغ وحدة تحكم يخلق تدفق مستمر من السوائل من الأنابيب إلى صمام دوارة. يتم حقن كل سائل يمر عبر متر التدفق (D) والتبديل في أنبوب الخلط (F). مرة واحدة وقد تم إضافة جميع السوائل إلى أنبوب خلط، التبديل من قبل بعض التعديلات يحقن الحل النهائي من أنبوب خلط في الخزان (G). يتدفق السائل عبر النظام في اتجاه الأسهم في الرسم البياني الذي تم وضع علامة عليه بترتيب تصاعدي (من 1 إلى 6). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 8: عرض صيانة برامج الإشراف. يتم استخدام هذا الرأي للسيطرة على المعلمات المختلفة مثل درجة الحرارة، والضوء، حل التبلور والتكبير. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
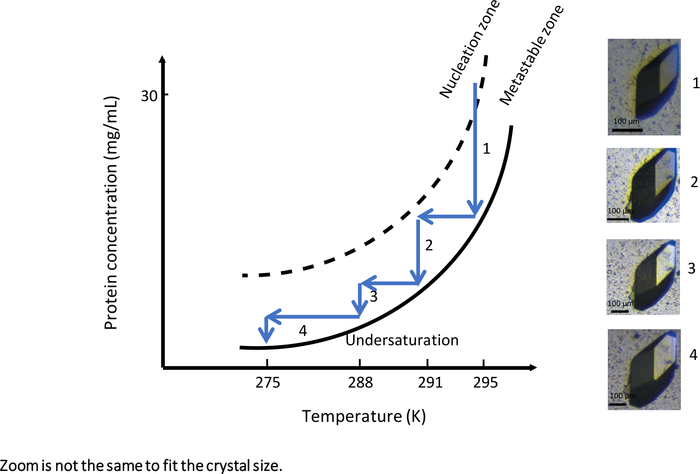
الشكل 9: الرسم التخطيطي للمرحلة كدالة لدرجة الحرارة (الصور المختارة يجب تتبعها بترتيب تصاعدي). يتم الحصول على بلورة lysozyme كبيرة واحدة عن طريق تغيير درجة الحرارة بشكل منهجي من 295 K إلى 275 K. في كل خطوة، يتم إيقاف نمو البلورات عند الوصول إلى منحنى الذوبان. خفض درجة الحرارة عن طريق الحفاظ على الحل في منطقة metastable إعادة تشغيل نمو البلورات. الصور لها مستويات مختلفة من التكبير. يتم تكييف هذا الرقم من جونيوس وآخرون. 8,18الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
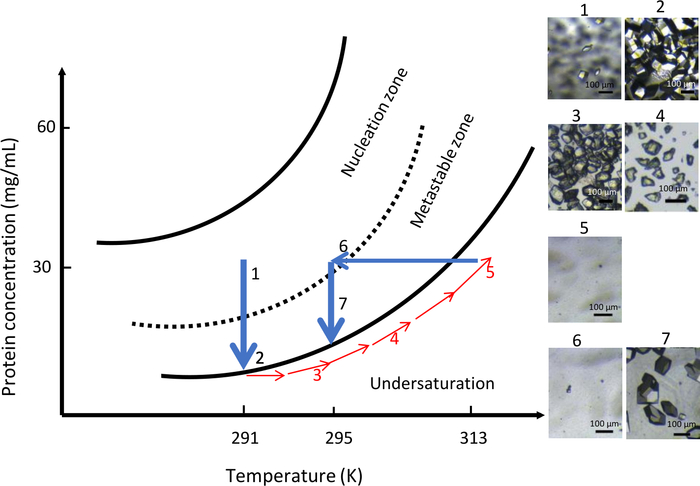
الشكل 10: تحسين نمو البلورات في التركيب الكيميائي الثابت باستخدام التحكم في درجة الحرارة (يجب تتبع الصور المختارة بترتيب تصاعدي). بدء عملية التنو في منطقة التنو في 291 K، بعيدا عن منطقة metastable، يؤدي إلى تشكيل بلورات عديدة. زيادة درجة الحرارة إلى 313 ك ثم يذوب البلورات حتى لا ينظر إلى نوات مرئية في غرفة غسيل الكلى. وأخيرا، خفض درجة الحرارة إلى 295 K إعادة تشغيل عملية النوى للمرة الثانية مما يؤدي إلى عدد محدود من بلورات أكبر. يتم تكييف هذا الرقم من جونيوس وآخرون. 8,18الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
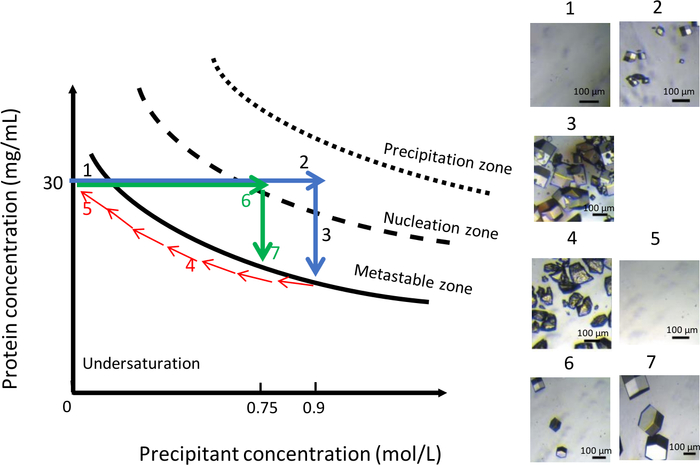
الشكل 11: تحسين نمو البلورات في درجة حرارة ثابتة باستخدام اختلافات في التركيز المتعجل (يجب تتبع الصور المختارة بترتيب تصاعدي). إن تقليل التركيز المائل من 0.9 م إلى 0 M يؤدي إلى حل البلورات التي تم الحصول عليها خلال أول حدث نوية. إعادة تشغيل عملية التبلور عن طريق حقن نفس الزفير ولكن في قوة الأيونية أقل، 0.75 M، مما يؤدي إلى تشكيل بلورات قليلة أكبر. يتم تكييف هذا الرقم من جونيوس وآخرون. 8,18الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
المتغيرات الفيزيائية والكيميائية والبيولوجية المختلفة تؤثر على تبلور البروتين من خلال التأثير على ذوبان البروتين21. من بين هذه المتغيرات، يتم استخدام درجة الحرارة والتركيب الكيميائي لمحلول التبلور هنا في تركيبة مع تقنية غسيل الكلى لتحسين وزراعة بلورات كبيرة عالية الجودة من الجزيئات الحيوية لدراسات الحيود النيوتروني. باستخدام المعرفة من الرسوم البيانية المرحلة، يتم إجراء التبلور أكثر قابلية للتنبؤ. على الرغم من أن فحص ظروف التبلور المختلفة في نهج تسلسلي ممكن أيضًا ، فإن الهدف الرئيسي من استخدام النهج العقلانية المقدمة هو فصل والسيطرة على حركية النوى الكريستالية والنمو.
على غرار جميع دراسات التبلور ، فإن عينات البروتين النقي والمجانسة عالية الجودة ، وحلول التبلور الخالية من الغبار تزيد من معدل نجاح التجربة. الترشيح والطرد المركزي للحلول هي خطوات أساسية في البروتوكولات الموصوفة. معرفة الخصائص الفيزيائية الكيميائية للبروتينات درس مثل الوزن الجزيئي (لاختيار غشاء غسيل الكلى المناسب)، ونقطة isoelectric، والذوبان البروتين حاسمة لتصميم تجربة نمو البلورات الأمثل. أيضا، يجب النظر في استقرار البروتين في درجات حرارة مختلفة أو مع مواد كيميائية مختلفة لمنع فقدان العينة وزيادة احتمال النجاح. وبالنظر إلى مدى درجة حرارة OptiCrys (233.0-353.0 ± 0.1 K)، يمكن بلورة مجموعة واسعة من البروتينات باستخدامها. ولكن تجدر الإشارة إلى أن البروتينات التي هي في المقام الأول مستقرة حراريا، مثل البروتينات من مصادر ثيرموسية، سوف تستفيد أكثر في درجة الحرارة التي تسيطر عليها تجارب النمو البلورية كبيرة الحجم التي تقدمها هذه الأداة.
باستخدام غرفة غسيل الكلى منخفضة الحجم (عند استخدام OptiCrys) أو أزرار التحليل الدقيق وفحص العديد من درجات الحرارة وظروف التبلور (على سبيل المثال، شبكات التركيز السريع أو درجة الحرارة)، من الممكن الحصول على معلومات عن موقع الحد الأقصى للمنطقة الفوقية (التوازن الحركي بين النويات ومناطق metastable). هذا لا يقدر بثمن عند تصميم تجربة نمو البلورة الناجحة وخاصة بالنسبة للمرشحين البروتين الجديد في التبلور. بدون هذه المعلومات التجارب يمكن أن تبدأ من منطقة من الرسم البياني للمرحلة مع التشبع الفائق عالية، بعيدا جدا عن الحد من منطقة الفوقا للسيطرة بسهولة نوات الكريستال. على الرغم من أن حل الترسبات البروتينية قد يكون محاولة، على سبيل المثال عن طريق زيادة درجة الحرارة في حالة الذوبان المباشر، للبروتينات مع انخفاض الحرارة، والحفاظ على العينة في درجة حرارة عالية لفترة أطول من الزمن قد تجعل من البروتين هطول الأمطار لا رجعة فيه. وهكذا، فإن أفضل استراتيجية تتكون من استخدام شرط أولي مع انخفاض التشبع الفائق تقع بالقرب من الحد الأقصى للاشتعال، حيث يمكن السيطرة على النوى وتجنب هطول الأمطار البروتين. وتمشيا مع هذا، تبلور الفحص المسبق يقلل من فرصة وجود البروتين راسب في غرفة غسيل الكلى ويزيد من معدل نجاح التجربة.
بعد تصميم التجربة، يعد إعداد غرف غسيل الكلى (OptiCrys) أو أزرار غسيل الكلى الدقيقة خطوة مهمة أخرى. منع تشكيل فقاعة الهواء في غرفة غسيل الكلى / زر يزيد من فرصة تبلور ناجحة وخصوصا عندما يتم استخدام كميات صغيرة. وجود فقاعات الهواء في غرفة غسيل الكلى قد يغير أيضا حركية عملية التبلور والحد من استنساخ التجربة (لأن بروتين / حل سطح الاتصال قد تم تعديلها). ليس فقط البروتين ولكن أيضا حل التبلور يمكن أن تؤثر على نجاح التجربة. استخدام أنابيب جديدة 50 مل لنظام الضخ في كل مرة يريد المرء بدء تجربة جديدة وغسل الأنابيب بعد كل تجربة يقلل من فرصة التلوث ويتجنب إنشاء بلورات الملح في الجهاز.
استخدام أزرار غسيل المجهر هو بديل عندما لا يكون OptiCrys متوفرا. استراتيجيات لتحقيق أقصى قدر من التبلور ورصد نمو البلورات المذكورة أعلاه، يجب أن تنفذ يدويا. وعادة ما يتطلب هذا أن تكون خارج حاضنة حرارية، والتي يمكن أن تكون إشكالية عندما يكون تنظيم درجة الحرارة خطوة حاسمة في المنهجية الموصوفة. هذا لا يسهل تغيير التركيب الكيميائي لحلول التبلور ، أو مراقبة نمو البلورات عن طريق التصوير ، لذلك لا يمكن التحكم في عملية نمو البلورات في الوقت الحقيقي.
المعرفة من الرسم البياني المرحلة هو الأساس لاستخدام مقاعد البدلاء تبلور، OptiCrys، لتنمو بشكل منهجي كبيرة، بلورات عالية الجودة بطريقة آلية. التحكم في المعلمات الفيزيائية الكيميائية مثل درجة الحرارة، والتركيز المتعجل، ودرجة حِس حُسّ أثناء التبلور، ينقل توازن محلول البروتين في مسار حركي واضح المعالم عبر الرسم التخطيطي للمرحلة. ويكمل هذا باستخدام غشاء غسيل الكلى لضبط النقل الجماعي وخلق تدرج مسيطر عليه في غرفة التبلور التي تؤثر على حجم ونوعية البلورات. لذلك، استخدام كل من البيانات الديناميكا الحرارية والمسارات الحركية أمر ضروري للسيطرة على عملية التبلور من أجل زراعة بلورات عالية الجودة. بفضل OptiCrys ، يمكن دراسة الرسومات التخطيطية للطور المنهجي في مساحة متعددة الأبعاد باستخدام نهج تسلسلي باستخدام مواد أقل بكثير من ذي قبل. لإثبات هذه المنهجية، ونحن نقدم هنا دراسة حالة مع بروتين نموذجي، الدجاج البيض الأبيض lysozyme. باستخدام واتقان البروتوكول المقدم هنا يمكن للمرء أن تكييفه لنظم البروتين الحقيقي5،14،17،18.
Disclosures
ليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
تعترف شركة محمد بن سلمان بالدعم المقدم من شركة LABEX VALO GRAL بموجب العقد 2015. NJ يعترف CEA الدولي برنامج أبحاث الدكتوراه (Irtelis) للحصول على زمالة الدكتوراه. يعترف المؤلفون بالتمويل من برنامج البحث والابتكار في أفق الاتحاد الأوروبي 2020 تحت اتفاقية منحة ماري سكودودوسكا كوري رقم 722687. كما يعرب المؤلفون عن امتنانهم للدكتور إسكو أوكسانين (ESS، لوند) والدكتور جان لوك فيرير (IBS، Grenoble) لمحادثاتهما وأفكارهما المفيدة. يقر IBS بالاندماج في معهد أبحاث غرونوبل متعدد التخصصات (IRIG, CEA).
Materials
| Name | Company | Catalog Number | Comments |
| 200 µl Dialysis Button | Hampton Research | HR3-330 | Dialysis button |
| 24 well plates | Jena Bioscience | CPL-132 | Crystallization plate |
| 2-Switch | FLUIGENT | 2SW001 | Switch |
| 30 μl Dialysis Button | Hampton Research | HR3-324 | Dialysis button |
| 50 mL Corning Centrifuge tubes | Sigma-Aldrich | CLS430828-500EA | Centrifuge tubes |
| Acetic acid | Sigma-Aldrich | S2889 | Chemical |
| Chicken Egg White Lysozyme | Sigma-Aldrich | L6876 | Lyophilized protein powder |
| Dialysis Membrane Discs 6-8 kDa MWCO | Spectrum | 132478 | Dialysis membrane |
| Dialysis Membrane Tubing 6-8 kDa MWCO | Spectrum | 132650T | Dialysis membrane |
| Microcentrifuge | Eppendorf | Minispin | Bench-top centrifuge |
| Flow Unit | FLUIGENT | FLU-XL | Flow meter |
| Flowboard | FLUIGENT | FLB | Flowboard |
| Microfluidic Flow Control System EZ | FLUIGENT | EZ-01000002 | Pressure/vacuum controller |
| MilliporeSigma 0.22 µm syringe Filters | Millipore | GSWP04700 | 0.22 μm pore size filter |
| M-Switch | FLUIGENT | MSW002 | Rotary valve |
| Opticrys | NatX-ray | PRT008 | Crystallization bench |
| Siliconized circle cover slides | Hampton Research | HR3-231 | Glass slides |
| Sodium Chloride ≥ 99% | Sigma-Aldrich | 746398 | Chemical |
| Switchboard | FLUIGENT | SWB002 | Switchboard |
| Thermoregulated incubator | Memmert | IPP30 | Thermoregulated incubator |
References
- Blakeley, M. P., Langan, P., Niimura, N., Podjarny, A. Neutron crystallography: opportunities, challenges, and limitations. Current Opinion in Structural Biology. 18 (5), 593-600 (2008).
- Snell, E. H., Van Der Woerd, M. J., Damon, M., Judge, R. A., Myles, D. A. A., Meilleur, F. Optimizing crystal volume for neutron diffraction: D-xylose isomerase. European Biophysics Journal. 35 (7), 621-632 (2006).
- Ng, J. D., Baird, J. K., Coates, L., Garcia-Ruiz, J. M., Hodge, T. A., Huang, S. Large-volume protein crystal growth for neutron macromolecular crystallography. Acta Crystallographica Section F:Structural Biology Communications. 71, 358-370 (2015).
- O'Dell, W. B., Bodenheimer, A. M., Meilleur, F. Neutron protein crystallography: A complementary tool for locating hydrogens in proteins. Archives of Biochemistry and Biophysics. 602, 48-60 (2016).
- Oksanen, E., Blakeley, M. P., Bonneté, F., Dauvergne, M. T., Dauvergne, F., Budayova-Spano, M. Large crystal growth by thermal control allows combined X-ray and neutron crystallographic studies to elucidate the protonation states in Aspergillus flavus urate oxidase. Journal of the Royal Society Interface. 6, (2009).
- Krauss, I. R., Merlino, A., Vergara, A., Sica, F. An overview of biological macromolecule crystallization. International Journal of Molecular Sciences. 14 (6), 11643-11691 (2013).
- Chayen, N. E. Comparative Studies of Protein Crystallization by Vapour-Diffusion and Microbatch Techniques. REVIEW Acta Cryst. , (1998).
- Junius, N., Oksanen, E., Terrien, M., Berzin, C., Ferrer, J. L., Budayova-Spano, M. A crystallization apparatus for temperaturecontrolled flow-cell dialysis with real-time visualization. Journal of Applied Crystallography. 49, 806-813 (2016).
- Salemme, F. R. A free interface diffusion technique for the crystallization of proteins for X-ray crystallography. Archives of Biochemistry and Biophysics. 151 (2), 533-539 (1972).
- Chayen, N. E., Saridakis, E. Protein crystallization: From purified protein to diffraction-quality crystal. Nature Methods. 5 (2), 147-153 (2008).
- Otálora, F., Gavira, J. A., Ng, J. D., García-Ruiz, J. M. Counterdiffusion methods applied to protein crystallization. Progress in Biophysics and Molecular Biology. 101 (1-3), 26-37 (2009).
- Garciá-Ruiz, J. M. Counterdiffusion Methods for Macromolecular Crystallization. Methods in Enzymology. 368, 130-154 (2003).
- Budayova-Spano, M., Koruza, K., Fisher, Z. Large crystal growth for neutron protein crystallography. Methods in Enzymology. 634, 21-46 (2020).
- Budayova-Spano, M., Dauvergne, F., Audiffren, M., Bactivelane, T., Cusack, S. A methodology and an instrument for the temperature-controlled optimization of crystal growth. Acta Crystallographica Section D: Biological Crystallography. 63 (3), 339-347 (2007).
- Asherie, N. Protein crystallization and phase diagrams. Methods. 34 (3), 266-272 (2004).
- Astier, J. P., Veesler, S. Using temperature to crystallize proteins: A mini-review. Crystal Growth and Design. 8 (12), 4215-4219 (2008).
- Budayova-Spano, M., et al. A preliminary neutron diffraction study of rasburicase, a recombinant urate oxidase enzyme, complexed with 8-azaxanthin. Acta Crystallographica Section F: Structural Biology and Crystallization Communications. 62 (3), 306-309 (2006).
- Junius, N., Vahdatahar, E., Oksanen, E., Ferrer, J. L., Budayova-Spano, M. Optimization of crystallization of biological macromolecules using dialysis combined with temperature control. Journal of Applied Crystallography. 53 (3), (2020).
- Grimsley, G. R., Pace, C. N. Spectrophotometric Determination of Protein Concentration. Current Protocols in Protein Science. 33 (1), 1-9 (2003).
- McPherson, A., Gavira, J. A. Introduction to protein crystallization. Acta Crystallographica Section F:Structural Biology Communications. 70 (1), 2-20 (2014).
- McPherson, A. Introduction to protein crystallization. Methods. 34 (3), 254-265 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved