Method Article
中性子高分子結晶学における結晶成長の最適化
要約
結晶学による生体高分子の構造研究では、高品質の結晶が必要です。ここでは、結晶化相図の知識に基づいて、大規模な高品質の結晶を成長させるためのOptiCrys(当社の研究室で開発された完全に自動化された機器)および/またはマイクロ透析ボタンで使用できるプロトコルを示しています。
要約
新しいNMXビームラインが構築され、構造改良ソフトウェアの可用性が向上したおかげで、過去10年間に決定されたほとんどの構造で、中性子高分子結晶学(NMX)の使用は急速に拡大しています。しかし、現在NMXで利用可能な中性子源は、X線結晶学の同等の源よりも著しく弱い。この分野の進歩にもかかわらず、特にこれまで以上に大きな高分子や複合体を研究する傾向があり、中性子回折研究には常に大幅に大きな結晶が必要です。したがって、NMXの使用を拡大するためには、より大きな結晶の成長に適した方法と計装のさらなる改善が必要です。
本研究では、顕微鏡搭載型ビデオカメラを用いたリアルタイム観察と、結晶化液(例えば、沈殿物濃度、pH、添加剤、温度)を組み合わせた合理的な戦略と結晶成長ベンチ(OptiCrys)を紹介します。次に、この温度と化学組成の制御が、モデル可溶性タンパク質を用いた最適な結晶化条件の探索を促進する方法を示す。結晶化の実験の開始位置と運動経路を選択するには、結晶化相図の十分な知識が不可欠です。多次元相図の知識に基づいて、合理的なアプローチが生成される結晶の大きさと数を制御する方法を示す。
概要
タンパク質の構造機能関係と生理的経路のメカニズムを理解することは、しばしば水素原子(H)の位置とタンパク質1,2内で電荷がどのように伝達されているかを知ることに依存する。水素原子はX線を弱く散乱するので、その位置は非常に高分解能のX線回折データ(>1Å)3,4でしか決定できない。逆に、中性子結晶学は、水素と重水素(H2、水素の同位体)原子が酸素、窒素および炭素5とほぼ等しい大きさの散乱長を有するように生体高分子における水素原子の正確な位置を得るために使用することができる。しかし、利用可能な中性子源からの中性子磁束はX線ビームのそれよりも弱いので、これはしばしば2、3を補わなければならない。HとHを交換したり、結晶の体積を増やしたりして、水素の支離滅裂な散乱を減らし、回折画像の信号対雑音比を高めることで実現できます。
X線および中性子生体高分子結晶学6の両方に対して大きく、高品質の結晶を得るための様々な結晶化アプローチ(図1に対応する模式相図を示す)がある。蒸気拡散では、タンパク質と結晶化溶液の混合物から調製された液滴は、水または他の揮発性種の蒸発を通じて、同じ結晶化溶液のより高い濃度の沈殿物を含む貯蔵所に対して、時間の経過とともに平衡化される。液滴中のタンパク質および沈殿物の濃度の増加は、これらの核6,7での結晶成長に続いて、自発的核形成に必要な過飽和をもたらす。水蒸気拡散は結晶4を成長する最も頻繁に使用される技術であるが、結晶化プロセスは正確に制御することができない8.自由界面拡散法では、結晶化溶液は濃縮タンパク質溶液に拡散し、システムを過飽和に向けて非常にゆっくりと導く。この方法は、遅い混合率6、9、10、11、12のバッチ方式と考えることができます。バッチ法では、タンパク質は急速に過飽和に至る結晶化溶液と混合され、多くの結晶3,7と共に均一な核形成を行う。この方法は、現在タンパク質データバンクに預け入れされているすべての構造の約3分の1を占めています。透析法は、高品質でよく拡散性の高いタンパク質結晶を成長させることにも使用されます。透析法では、沈殿物の分子が、半透過性膜を通って、タンパク質溶液を用いて別のチャンバーに貯蔵室から拡散する。平衡の動態は、温度、膜孔サイズ、タンパク質サンプルおよび結晶化剤6の体積および濃度などの様々な要因に依存する。
結晶化相図は、タンパク質の異なる状態を異なる物理変数または化学変数3の関数として記述するために使用することができる。図1に示すように、各結晶化技術は、異なる運動軌道を用いて、このような図6、10、13の核形成および転移性ゾーンに到達するように可視化することができる。結晶と溶液の熱力学的平衡が観察されるタンパク質溶解度およびタンパク質濃度に関する情報を提供し、それによって核生成および成長に最適な条件を見つける3,14。2次元相図では、タンパク質濃度は一つの変数の関数としてプロットされ、他の変数は一定の15に保たれます。このような相図では、タンパク質濃度が溶解性曲線を下回ると、溶液が不飽和領域にあり、核生成や結晶成長が生じない。この曲線の上には、タンパク質濃度が溶解限界3,14よりも高い過飽和帯がある。これはさらに3つの領域に分かれています:転移性ゾーン、自然核生成ゾーン、および降水域。転移性領域では、重飽和は、核形成が妥当な時間内に起こるには十分ではないが、種化された結晶の成長が起こり得る。凝集と降水量は、過飽和が高すぎる降水域で好まれ、14,15です。
自発的な核形成に十分な過飽和が達成されると、最初の核は10に現れる。結晶の成長は、溶解性の限界に達するまでタンパク質濃度の低下をもたらす。超飽和が溶解曲線の近傍にとどまっている限り、結晶の大きさに大きな変化はありません。しかしながら、結晶化液の温度および化学組成の変動(例えば、沈殿剤の濃度)がタンパク質溶解性に影響を及ぼし、さらに結晶成長8、13、16の開始を招く可能性が示されている。
透析は良質の結晶成長に有利であるとして、 図2に示されているOptiCrys結晶化ベンチは、完全に自動化された方法で結晶化を制御するために我々の研究室で設計され、開発された8。この目的のために、ソフトウェアは、電子コントローラとチラーを介して、ペルチェの要素と接触して流れる貯水池透析のセットアップの温度の制御と監視を可能にするLabVIEWで書かれました。同じソフトウェアは、多流流体システムを使用して、結晶化溶液の化学組成(例えば結晶化剤の交換)を自動的に調節します。さらに、デジタルカメラと反転顕微鏡を使用して、結晶化プロセスを可視化して記録します。15 μLおよび250 μLの容積の2つの結晶化の部屋は異なった目的のために成長する水晶のために利用できる。結晶化プロセスが可逆的であるため、サンプルが損傷していない限り、タンパク質溶液のほんの数マイクロリットルで異なる条件のスクリーニングが可能である8。その結果、この方法を用い、使用されるタンパク質物質の量を最小限に抑える。
前の研究8から、結晶成長過程の間、 その現場で の観察は一定の時間間隔で行う必要があることが明らかである。これらは、観察中の事象(沈殿、核生成、または結晶成長)に応じて、数秒から数日の範囲で行うことができます。
OptiCrysによる結晶成長の最適化は、温度沈殿物濃度相図に基づいています。温度の直接機能として溶解度を有するタンパク質の場合には、塩漬けレジーム18を利用することができる。このことは、タンパク質沈殿相図を用いて可視化できる溶液のイオン強度を高めることで、タンパク質の溶解度を低下させる。同様に、溶解性が逆のタンパク質は、塩漬けのレジーム18を利用することができる。核生成は、核形成領域において、メタスタブルゾーンの近傍で起こり、そして結晶成長は、タンパク質濃度が溶解限界に達するまで、相図の転移性ゾーンにおいて起こる。図3Aに示すように、一定の化学組成温度を有するとともに、新たな核生成を防止するために、結晶化液をメタスタブルゾーンに保つために低下させることができる。結晶は第2結晶/溶液平衡が達成されるまで成長し、その後、結晶のサイズのそれ以上の増加は見られません。結晶が所望の大きさに達するまで、温度は数回低下します。図3Bでは、一定温度で、沈殿物濃度を上げると、溶液がメタスタブルゾーンに保たれます。このプロセスは、大きな結晶を得るために数回繰り返すことができます。温度を変え、結晶化液条件を操作し、過飽和レベルを制御することにより、OptiCrys5,8,14によって正確かつ自動的に制御される結晶の核化と成長を分離するための2つの強力なツールである。
温度制御によって成長したタンパク質結晶の例としては、温度制御された、あるいは温度および沈殿物濃度制御結晶化、並びに得られる相対回折データが文献およびPDBに利用可能である。その中には、ヒトγ-結晶E、PA-IILレクチン、酵母無機ピロホスファターゼ、ウレートオキシダーゼ、ヒト炭酸脱水酵素II、YchBキナーゼ、乳酸脱水素酵素5、14、17、18が含まれる。
OptiCrysはNatX線によって製品化されましたが、この機器やシリアルアプローチにアクセスできない研究所が数多くあります。この技術の代替は、市販のプラスチック製のマイクロ透析ボタンを様々な容積で使用することです。これらを使用して、温度および化学組成を手動で調節し、変えることができる。マイクロ透析ボタンの検査 は、その場合 は行うことができず、光学顕微鏡で手動で行う必要があります。温度制御は、振動のない温度制御インキュベーターにサンプルを保持することによって達成することができる。結晶化実験を再現するためには温度を一定に保つことが不可欠です。温度の著しい変動は、結晶5の損傷または破壊を招く可能性もある。
ここでは、中性子タンパク質結晶学に適した大きな高品質の結晶の成長のためのサンプル調製と制御ソフトウェアの使用を説明する詳細なプロトコルを提供します。このステップバイステップの手順は、生成される結晶のサイズと品質を制御するために開始位置と運動経路を選択するために結晶化相図を利用するように設計されました。さらに、大きくて高品質な結晶を得るために同じ根拠を使用するマイクロ透析ボタンを備えた結晶を成長させる詳細なプロトコルが提示される。
プロトコル
1. マイクロ透析ボタン付き透析法
- サンプル準備
- 30mgのニワトリ卵白溶解酵素を1mLのCH3クーナバッファー(100mM酢酸ナトリウム、pH4)に凍結乾燥粉末として溶解してタンパク質溶液を調製し、30mg・mL-1の最終濃度の溶液を得た。
- 13,000×gでサンプルを277Kで10分間遠心する。このプロセスは、結晶化プロセスを開始する前に、凝集体を除去するのに役立ちます。
- 280 nmでサンプルの吸光度を確認し、ビール・ランバート方程式(A=εcl)を使用してタンパク質濃度を計算します。
注:ビール・ランバート方程式によると、電子吸光度(A)は、一定の光路長(l,cm)を与えられた吸収種の濃度(c,mg·mL-1)に直接比例する。この線形関係の勾配は、モルの絶滅係数(ε、280 nmのリソチームは2.64mL·mg−1・cm−1)19である。芳香族アミノ酸の側鎖(チロシン、トリプトファン、フェニルアラニン)とシステイン残基間のジスルフィド結合は、分光学的に許容されるπから生じる〜280 nmで強い吸光度を有する - π*遷移。タンパク質の大部分がこれらの残基を含むので、タンパク質濃度は、通常、280nmで吸光度を測定することによって容易に計算することができる、絶滅係数の知識を与えられる。 - 図 4に示すように、結晶化液を準備します。結晶化溶液を準備する前に、0.22 μm ミリポアフィルターですべてのストックソリューションをフィルター処理します。
- 結晶成長
- 適切な分子量カットオフ(6-8 kDa)でセルロース透析膜を切断し、蒸留水に浸します。
注:透析膜ディスクは、マイクロ透析ボタンのために市販されていますが、透析チューブを使用している場合は、単層膜のみを持つチューブから膜の2つの層を分離するためにエッジをカットすることを忘れないでください。 - 図 4 に示す 2 mL の結晶化溶液で 24 ウェル トレイのウェルを充填します。
注:より大きなボリュームのボタン(例えば、200 μL)を使用する場合は、50 mLのチューブに5mL以上の結晶化液を充填して、効率的な交換を行います。 - 図5Aに示すように、マイクロ透析ボタンのチャンバーにリソザイム溶液のピペット35 μLを追加します。
注:30 μL透析ボタンを閉じるときに気泡が形成されないようにするには、5 μLの余分な容量(デッドボリューム)を追加する必要があります。この追加のタンパク質サンプルは、空気泡の形成を防ぐ 図5Bに示すように、チャンバの上にわずかにドーム状の形状を作成します。 - 適切なサイズのアプリケータを取り、弾性Oリングをその先端に置きます(図5C)。その後、透析ボタンのチャンバーの上に、繊維のない紙を使用して軽く拭き取られた/排水された膜を置きます。紙を塗布する際は、チャンバーにほこりを入れないように注意してください。弾性Oリングをアプリケータから透析ボタンの溝に移すことで、透析膜を所定の位置に設定します(図5C)。
注:取り扱いの重要な瞬間は、アプリケータから透析ボタンの溝に弾性Oリングを転送することによって、チャンバーの上に透析膜を固定しています。すべての動きは、タンパク質チャンバー内のサンプルで気泡を囲むのを避けるために完全に同期する必要があります。適用前に弾性Oリングを伸ばして剛性を知り、ピンセットを使用して膜の一部を保持し、モデルタンパク質を用いて最初の試験実験を行う練習を行うと便利です。 - ボタンをピンセットを使用してウェルまたは50 mLチューブに移します(図5D)。
- ウェルをカバースリップで覆い、グリースを軽く押してウェルを密封します(図5E)。
注:井戸の上にグリースがない場合は、実験を開始する前にこれを追加するか、ガラスカバースリップの代わりにテープを使用してください。マイクロ透析ボタンを使用したタンパク質結晶化の原理を 図5に示します。 - 試料を293Kで保ち、熱調節インキュベーターに入ります。使用するタンパク質および結晶化条件に応じて、異なる温度が必要な場合があります。
注: 図4 に示す結晶化条件の同じグリッド(沈殿剤の濃度を変化させることができます)は、温度の関数としてスクリーニングすることができます。このような場合、同じ結晶板を再生する必要があり、各コピーは異なる温度で調節インキュベーターに配置する必要があります。これには、いくつかの振動を含まない耐熱制御インキュベーターが必要です。 - トレイまたはチューブに結晶がないか確認し(図4)、定期的にノートを取り、通常は毎日、各トレイに何があるかを区別します。良いノートは、偽陽性の結果を避け、結晶からほこりを区別するために不可欠です。
- 適切な分子量カットオフ(6-8 kDa)でセルロース透析膜を切断し、蒸留水に浸します。
2. オプティクライを用いた結晶成長過程
- サンプル準備
- 1.1項に記載されているように、タンパク質溶液と透析膜を調製する。
- NaCl(4 M)およびCH3COONa pH 4(1 M)のストック溶液を準備し、50 mLチューブにフィルターします。
- 温度制御流動リザーバ透析セットアップの透析チャンバーにタンパク質溶液(30 mg·mL -1のリソチームの15μL)を加えます。温度制御流動貯留層透析の設定の詳細については 、図6 を参照してください。OptiCrysは2つの透析室を有し、最小容積は15 μL、最大容積は250 μLである。
- 透析膜で室内を覆い、弾性Oリングで膜を固定します(図6B)。
注:この設定は、各チャンバーが透析膜によって直接密封されているマイクロ透析ボタンとは異なります。フローセルでは、透析膜は、その除去なしに結晶の実装を可能にする室内に固定されている代わりに。この目的のために、オーバーチャンバーは単に貯蔵所からねじ込むことができる。 - オーバーチャンバーをフリップし、透析チャンバーの上に置きます。ゆっくりと静かに押して、2つの部分の間に閉じ込められた空気をすべて取り除き、チャンバー内の泡を避けます(図6C)。モデルタンパク質を用いて練習することは、気泡やサンプル損失を避けるために訓練するときに有利です。
- オーバーチャンバーの上にそっとねじ込んで、その位置に貯水池を固定し、再び気泡をトラップしないように注意してください。リザーバの過剰締めは、結晶化チャンバー内に泡を形成することもできる(図6D)。
- 結晶化液を加え、気密性の高いキャップでリザーバチャンバーを覆います。(図6G)貯蔵所の最大容積は1mLである。
- このアセンブリを転送し、真鍮サポートに挿入します。このサポートは温度を制御するために使用されるペルチェ要素と接触している。
- 図6に示すように、気密性キャップには透析チャンバの上部照明を可能にする光学窓が装備されています。窓の上に光源(図2)を置き、室内を光が通過できるようにします。
- 貯蔵室は連続流れの細胞として機能することを可能にするポンプに接続することができる。 図 7に示すように、ストックソリューションと蒸留水を含む 50 mL チューブの上にチューブをロータリーバルブに接続します。
注: 自動調製と結晶化液の変更が実験中に望ましくない場合は、ステップ 2.1.10 を省略してください。このような場合、結晶化溶液を調製し、貯蔵所を手動で事前充填する必要があります。
- ソフトウェア
- コンピュータの電源を入れ、ソフトウェアクロワッサンクリスタリンを起動 [クリスタル成長].この制御ソフトウェアはLabVIEW(http://www.ni.com/labview/)で書かれ、使いやすいグラフィカルインタフェースを提供します。4つの異なるグラフィカルインタフェース(アキュエイ[ようこそ]、パラメトラージ[設定]、エッサイ[テスト]、およびメンテナンス[メンテナンス])が含まれています(図8)。
注: フランス語からの翻訳は括弧内にあります。 - 図 8に示すように、ボタンをクリックしてメンテナンスビューを選択します。このビューは現在最もよく使用され、実験中に大部分のパラメータを制御できます。
注: メンテナンス ビューをクリックすると、温度や光などのパラメータを制御するための別のセクションを持つ新しいウィンドウが表示されます。 図 8 では、このビューの異なる部分が矢印とフレームで示されています。次の手順では、ソフトウェアを使用して各パラメータがどのように制御されているかを示します。 - レグラトゥール・ド・テンペラチュア[温度コントローラ]セクションは、温度の制御と監視を可能にします。図 8 のボタンをクリックし、1をオンにします。
注: OptiCrys の温度範囲は 233.0 – 353.0 ± 0.1 K. - 荷受人[設定点]セクションの温度を設定し、Enterキーを押します(図8(2))。このボタンの下には、2つのトレース(赤と黄色)のグラフがあります。赤のトレースは最終(順序付き)温度を示し、黄色のトレースは現在の温度を示します。図8(2)に示すように、温度は20°Cに設定されています。
注:結晶成長セクションで説明されているように、結晶を成長させるためには、多くの温度を選択する必要があります。温度を変更するには、 荷受人[setpoint] セクションに新しい温度を追加し、キーボードのEnterボタンを押します。 - 図8のルミエール[ライト]セクションの明るさを上げることで、ライトをオンにします。光度の範囲は0から100まで、"0"は、光がオフであり、「100」で、光が最大の強度と明るさに設定されていることを示します。光を増やすことによって、顕微鏡セクションでは、透析室の内部を見ることができる。実験中、細胞の明るさは変化する可能性があります。透析チャンバ内を明確に視覚化するためにパラメータを調整してください。拡大は、より良い表示のために「ズーム」の前にある+ボタンと-ボタンを使用して、増減することができます。
- 顕微鏡セクションの右側には、各結晶化実験に関連する情報を保存するためのセクションがいくつかあります。各ユーザは、使用する透析膜の結晶化条件、タンパク質名および分子量カットオフに関する情報を格納するフォルダを作成することができる(図8(3))。
- ユーザーは 、単にノムドシエ [フォルダ名]に入力するだけで、実験の名前を定義できます。 ドシエ[フォルダ]を クリックすると( 図8に緑色のフレームで表示)、新しいウィンドウが開きます。このウィンドウには、実験に定義されているすべての情報を含むテキスト ファイルが表示されます。さらに、タイムスタンプ付きの画像は、将来の処理のためにこのフォルダに保存されます。
- [NB イメージ]セクションで、実験中に撮影するイメージの数を選択します。右側のパネルの画像の数と、これらの間の希望する時間間隔(例えば、分、時、日)を指定します。図 8は、1 分間にゼロイメージを記録するソフトウェアセットアップを示しています。
注:ストック溶液を混合し、貯蔵室に結晶化溶液を注入するために ポンペ[ポンプ] セクションを使用してください。流体混合システムの原理については、セクション2.1.10および 図7 を参照してください。 - Etape 1[ステップ1]:ソリューションの在庫における在庫液の入力濃度。次のセクションでの結晶化実験では、NaCl 4 MとCH3クーナ1 MPH4を使用します。
注: ストック溶液の濃度は、モル単位で行います。 - 各溶液の最終濃度を定義します。例えば、NaCl の場合は 0.75 M、CH3COONa pH 4 の場合は 0.1 M です。Etape 2[ステップ2]:溶液アプレパラー[準備する溶液]の最終濃度セクション(図8)にこれらを入力します。図 8に赤い枠で表示されている計算 [計算]ボタンを押します。混合に使用される各ストック溶液の最終容積は、各濃度パネルの前のボリュームパネルに表示されます。
- ランサープレパレーション[打ち上げ準備]ボタンを押します(図8)。図7に示すように、ロータリーバルブは各ストック溶液を取り出し、スイッチを介して混合管に注入します。
- 結晶化液を調製した後、Etape 3[ステップ3]:ポンプセクションのアントレ溶液[溶液エントリ]ボタンをクリックします(図8の黄色のフレーム)。スイッチは、混合チューブからリザーバーチャンバーに新しい結晶化溶液を注入するように変更します。交換処理を中止するには、Arrêt分布[配布停止]ボタンを押下します。
注: 実験中に結晶化プロセスを観察し、監督ソフトウェアの対応するグラフィカルインターフェイスで温度、結晶化溶液、ズームなどのパラメータを変更します。ソフトウェアを使用することで、実験中に気密キャップやフローセルを取り外す必要がないため、ユーザーがソフトウェアを通じて変更する変数のみが表示されます。
- コンピュータの電源を入れ、ソフトウェアクロワッサンクリスタリンを起動 [クリスタル成長].この制御ソフトウェアはLabVIEW(http://www.ni.com/labview/)で書かれ、使いやすいグラフィカルインタフェースを提供します。4つの異なるグラフィカルインタフェース(アキュエイ[ようこそ]、パラメトラージ[設定]、エッサイ[テスト]、およびメンテナンス[メンテナンス])が含まれています(図8)。
- 大きな結晶成長
- 透析チャンバーに30 mg·mL-1の濃度でリソザイムの15 μLを加える(図6A)。
注: セクション 1.1 に記述されているように、タンパク質サンプルを準備します。 - 温度制御流動貯留水槽透析セットアップを、セクション2.1および 図6に記載されているように組み立てます。
- 結晶化液を準備します。0.22 μmフィルターを使用してサンプル調製前にすべてのストックソリューションをフィルタリングすることを忘れないでください。この実験のために、結晶化液は0.75 M NaClおよび0.1 M CH3COONa pH 4を含んでいる。これは手動で加えることができるか、セクション2.2.10から2.2.12に記述されているように貯蔵室およびポンプシステムを使用して。
- 2.2.3 および 2.2.4 のセクションで説明した温度を 295 K に設定し、図 8 に示します。初期条件下では、約90分後に透析チャンバーとリザーバの間の平衡が得られ、22時間後に最初の可視核が現れます。
- 結晶のサイズが目に見えない変化が見られないまで結晶が成長することを許可します(図9、パネル1)。
注:核生成時間を決定し、結晶のサイズの変動を測定するために 、NB画像 セクションで1時間あたり4または3の画像である15または20分ごとに画像を記録します。タンパク質変性の 所見 では、凝集および沈殿または結晶溶解または核化のために、典型的には数秒から数十分の間が必要である。しかし、結晶成長のために、この範囲は数分から数時間の間である。 - 3日後、温度を291Kに下げて結晶成長を再開します。温度を一定に保ち、結晶を発達させます(図9、パネル2)。実験のこの段階では、2時間ごとに画像を記録し、結晶のサイズの変化がないか10〜12時間ごとに確認するだけで十分です。結晶の大きさの変化が見られない場合に実験を継続することができる。
注:結晶化溶液中のタンパク質と沈殿物濃度、使用されるタンパク質の量によって、各ステップの平衡に達するまでにかかる時間は異なる場合があります。 - 結晶成長を再開するには、温度を288 Kに下げます。ここで提示した場合の実験条件では、ある日で平衡に達するのに十分である(図9、パネル3)。
- 結晶の大きさを確認し、結晶が成長し続ける限り一定の温度を維持します。
- 4日後、結晶成長を再開するために温度を275Kに下げる(図9、パネル4)。
– 提示された場合の実験条件では、1次元で500μmの結晶が約10日後に得られる(図9)。
- 透析チャンバーに30 mg·mL-1の濃度でリソザイムの15 μLを加える(図6A)。
- 結晶サイズの制御
- タンパク質溶液と温度制御流動リザーバ透析を、セクション 2.3.1 および 2.3.2 に記載されているように準備します。
- 0.9 M NaClおよび0.1 M CH3COONa pH 4で結晶化液を準備する。
- 温度を291Kに設定し、結晶を成長させます。初期条件下では、最初の核生成イベントは約1時間後に開始され、多数の結晶が透析室で3時間成長します(図10、ステップ:1と2)。20分ごとに画像を記録し、成長過程で結晶の大きさを確認します。
注: 結晶化条件の最適化は、生成された結晶の最終的な特性の大部分を制御する上で重要です。結晶化液の温度と化学組成は、均一なサイズの結晶を溶解し、再成長するように変更することができます。また、タンパク質サンプルは、変性しない限り試料を再溶解する条件として、このような実験では消費されないことに留意すべきである。温度を変えて一定の化学組成を維持して結晶を溶解する場合は、次のように実験を続けます。 - 結晶が291Kで成長したら、これらはより少なく、より大きな結晶を再成長させるために溶解することができます。20分を超えて徐々に温度を上げ、313 K に達します。透析チャンバー内のすべての結晶を溶解するのに約1時間かかります(図10、ステップ:3-5)。画像を5~15分ごとに記録して、溶解プロセスを監視します。
注: 多くのタンパク質は高温に敏感です。タンパク質が安定している温度範囲内で動作し、損傷/変性を避けてください。タンパク質の溶解性に加えて、温度も緩衝液に影響を与える。例えば、バッファーの pH は温度、特に Tris バッファーで変化する可能性があります。このような場合、実験が行われる温度に応じてpHを設定することが重要である18.また、タンパク質の溶解は、タンパク質の結晶成長(数時間から数日)に比べて、かなり少ない時間(数分から数時間)を要することにも留意すべきである。一般に、結晶の溶解の間、温度は徐々にゆっくりと(短い全溶解時間を尊重する)、結晶モザイクの増加を避けるために結晶の部分的な溶解の場合を中心にする。結晶が成長しているとき、温度は設定温度(長い総成長時間を考慮して)に素早く(1分未満)低下する可能性があります。記録画像による結晶化チャンバの定期的なモニタリングは、タンパク質の損傷を防ぎ、研究した各タンパク質の結晶の溶解または成長に最適な時間を定義するのに役立ちます。 - すべての結晶が溶解した後、2番目の核生成イベントを開始するために温度を295 Kに設定します(図10、ステップ:6,7)。画像を5分ごとに記録して、2番目の核生成プロセスを監視します。このステップでは、最初の核は約18分後に現れる。
注: この温度では、溶液は核形成ゾーン、メタスタブルゾーンの近くにあります。その結果、結晶化チャンバにほんの数個の核しか現れなくなる。 - より大きな結晶を成長させる場合は、セクション2.3で説明した最適化ワークフローを繰り返して実験を続けます。 図10 に示される実験の全期間は数日に過ぎない。
注:核形成段階で結晶が異なる時期に現れる場合、結晶化チャンバ内で異なるサイズの結晶が得られます。このような場合、温度の上昇(直接溶解性を有するタンパク質の場合)は、より小さい結晶の迅速な溶解をもたらす。キネティック熟成効果に応じて、余分なタンパク質(溶解から得られる)は、より大きな結晶の成長に使用することができます。
結晶化液の化学組成を変えて一定温度で結晶を溶解する場合は、次のように実験を続けます。
また、実験中に結晶化液の化学組成を変化させて、新たな条件下で均一な大きさの結晶の集団を再成長させることにより、以前に成長した結晶を溶解させることも可能である。 - 上記のように、タンパク質溶液(2.3.1)、温度制御流動透析セットアップ(2.1)および結晶化溶液(2.4.2)を調製します。核形成ゾーンの初期条件下では、結晶化槽に多数の小結晶が現れ、成長し始めます(図11、ステップ:1、2)。
- 3時間後、結晶化チャンバーに多くの中結晶が見える場合(図11、工程:3)、NaCl濃度(0.9M)を徐々に低下させてゼロに達する。このために、0.1 M CH3COONa pH4で緩衝溶液のみを含む新しい結晶化溶液を調製する。ポンプシステムを使用して、リザーバーチャンバー内の結晶化液と交換します。新しい溶液を貯留槽室に注入するためのステップ2.2.10から2.2.12に従ってください。この新しい溶液により、溶液が交換されると、貯蔵室の最終的な溶液がCH3COONa pH 4の0.1 M以下を含み、NaClが含まれなくなるまで、チャンバー内でNaCl濃度が低下する。10分ごとに画像をキャプチャして、溶解プロセスを記録します。
- 結晶が完全に溶解することを許可します(図11、ステップ:4,5)。この実験では溶解時間は約2時間です。前述のように、溶解時間は、使用されるタンパク質系、結晶化条件、および透析チャンバ体積に依存する。結晶化チャンバー( 顕微鏡 セクション参照)の定期的な観察と、実験中の画像やメモの記録は不可欠です。
- チャンバー内のすべての結晶が溶解されたら(図11、ステップ:5)、再度ポンプシステムを使用して、前のものよりも低い濃度でNaClを注入することによって新しい結晶化液を調製する(0.1 M CH3COONa pH4)。
- 新しい溶液をリザーバーチャンバーに注入し(図11、ステップ:6,7)、結晶成長最適化ワークフローを繰り返します( 2.3.より大きな結晶の均一な集団が生成されます。 図11 に示す結果は、数日後に得られた。
結果
セクション2.3および2.4では、最適化された結晶成長の3つの例を示し、装置の使用と大きな結晶を成長するための実験設計を示す。このデモンストレーションでは、リソチームをモデルタンパク質として使用しましたが、結晶成長実験はこの方法を用いて他の多くのタンパク質システムで成功を収めています(上記参照)。ここで提示されるプロトコルを使用してマスタリングすることで、他のタンパク質候補に適応させることができます。
セクション2.3では、中性子タンパク質結晶学に十分な散乱量を持つ結晶を成長させる上で、確立された合理的結晶化戦略が有益であることを実証しました。ここでは、提案された合理的な最適化戦略により、下流構造決定アプローチに必要な特定のサイズの結晶の均一な集団の生成も可能であることを示す。
これら2つの実験は、結晶核化と成長を制御する際の相図の重要性を強調するように設計されています。ここで、結晶化過程をリアルタイムにモニタリングするとともに結晶化液の温度及び化学組成の制御が、定性的相図の研究に用いられる。この方法を用い、核形成および結晶成長を可逆的に合理的に最適化することができる。このような連続アプローチを使用すると、タンパク質の量と結晶のサイズと品質を制御するために必要な時間も削減されます。
透析法では、タンパク質溶液を半透膜6によって結晶化溶液から分離する(図5)。この透析膜は、添加剤、緩衝液、イオンなどの小分子が膜を通過することを可能にするが、タンパク質6,20のような高分子は通過しない。この機能により、実験6の過程で結晶化溶液を修正することができます。ソリューションの交換は、マイクロ透析ボタン、またはこの目的のために開発された機器を使用して自動化された方法で、手動で行うことができます, OptiCrys8.
実験の最初のセットでは、鶏卵白リソザイムの結晶化にマイクロ透析ボタンを使用しました。微小透析用ボタンを、異なる塩濃度の結晶化液に浸漬した。この単純な結晶化グリッド実験では、温度が一定に保たれている間、唯一の変数は沈殿物濃度(293 K)です。 図4に示すように、塩濃度のわずかな変動は、観察される結晶の大きさおよび数の変化を誘発し、結晶化相図の調査を可能にする。 図4では、パネル1において、結晶化溶液は0.7MNaClを含み、より大きな結晶の数が限られているボタンに現れた。塩濃度を0.7から1.2Mに増加させることで、重飽和が増加し、核形成領域内の溶液が、メタスタブルゾーンから遠ざかる(図4、パネル1~6)。その結果、結晶の数が増加し、そのサイズが小さくなります。
温度制御透析結晶化を可能にする完全自動化された機器を用いた最初の実験では、OptiCrys(図9)、結晶成長実験は、大きな結晶成長を生成するように調整されました。実験は、0.75 M NaClと0.1 M Naアセテート緩衝液pH4を含む結晶化溶液を用いて295Kの初期温度で開始した。これらの実験条件下では、結晶化液は、相図のメタスタブルゾーン付近の核形成帯に到達した(図9、矢印1)。その結果、実験の最初の段階で生成された核はわずかです。選択した結晶をさらに成長させるために( 図9参照)、結晶成長最適化ワークフローは、結晶水平衡に達するとすぐに温度を変化させることによって、メタスタブルゾーンに向かって駆動した。
結晶と溶液の平衡に達するたびに、温度を下げ、最初に291K、次に288K、そして最後に275Kにして、結晶化液をメタスタブルゾーンに保った。この実験の結果は、高分子X線と中性子結晶学の両方に適した単一の大きな結晶です。
ほとんどのタンパク質に関して、結晶化実験18の間にタンパク質濃度を正確に測定できる(または結晶化過程をリアルタイムで観察/検出するだけの)実験装置が不足しているため、正確な定量相図(または単に定性的な図)がまだ得られていない。その結果、多くの場合、結晶化が相図の最適な領域、メタスタブルゾーン付近で始まるような方法で実験を設計することができない。
したがって、大きな体積結晶の成長に特化した実験が行われる前に、結晶化最適化研究が行われなければなりません。本研究では、一方で温度変化(一定の化学組成)を用い、一方で化学組成(一定温度)の変動を用いて、メタスタブルゾーンを同定し、大きな結晶成長実験を開始するための最適条件を明示する必要がある。
この目的のために、他の2つの実験が、核化、結晶成長、溶解および再成長のためのOptiCrysによる温度制御透析結晶化実験の可逆性を実証するために調整された2つの実験を提示する。結晶成長最適化ワークフローは、温度または沈殿物濃度の変動を用いて、より少ない、より大きなリソチーム結晶の均一な集団が成長するように制御された。
OptiCrysの2回目の実験では、結晶化溶液の化学組成を可変温度で実験全体を通して一定(0.1 M CH3COONa pH4で0.9 M NaCl)を維持した。初期温度は291Kに設定した。この実験の結果を 図 10にまとめています。高過飽和のため、結晶化チャンバーに多数の小結晶が現れた(図10、パネル1、2)。直接タンパク質溶解性の概念に従って、温度を313Kに徐々に上昇させることで、全ての結晶が溶解した(図10、パネル3、4、5)。最後に、温度を295Kに下げることで、2番目の核形成をメタスタブルゾーン付近で開始し、より少ない数の核の形成を制御することができた。さらに結晶成長は、より大きな結晶の集団の均一な生成をもたらした(図10、パネル7)。
図11に示すように、結晶化液の化学組成の変動は、291Kの一定温度で、より大きな結晶の均一な集団を得るために同様に使用することができる。前の実験と同様に、初期条件は0.1 M CH3COONa pH 4において0.9 M NaClであった。次いで、NaCl濃度を0.9Mからゼロに徐々に低下させて結晶を溶解させた(図11、パネル4、5)。この時点で、NaClは0.1 M CH3COONa pH 4の緩衝液によって完全に置き換えられた。塩濃度を低下させることは、相図の不飽和ゾーンに溶液を保持し、結晶の溶解につながる。次いで、より低いイオン強度を有する新しい結晶化溶液を、0.1 MCH3COONa pH4の0.75 M NaClで、貯留室に注入した。この沈殿物濃度では、90分後に第1の核(図11、パネル6)が現れた。生成される結晶の数は少なく、結晶は以前よりも大きな体積(図11、パネル7)に達した。
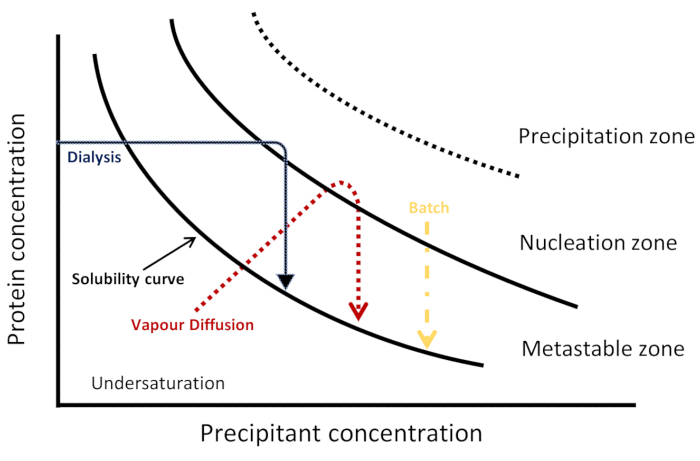
図 1: スケマティック フェーズ 図。3つの結晶化技術のための運動軌道は、塩漬けの体制で表される。各方法は、異なる方法で核化と結晶化を達成し、位相図を通して異なる運動経路によって視覚化され、核形成および転移領域に到達する。溶解性曲線は、不飽和領域と過飽和領域を分離します。過飽和は、3つのゾーンに分かれています:不安定、核形成および沈殿。核形成ゾーンでは、結晶成長が起こる中に自発的な核形成が起こる。この図は、ジュニウスらから適応 しています。8この図の大きなバージョンを表示するには、ここをクリックしてください。
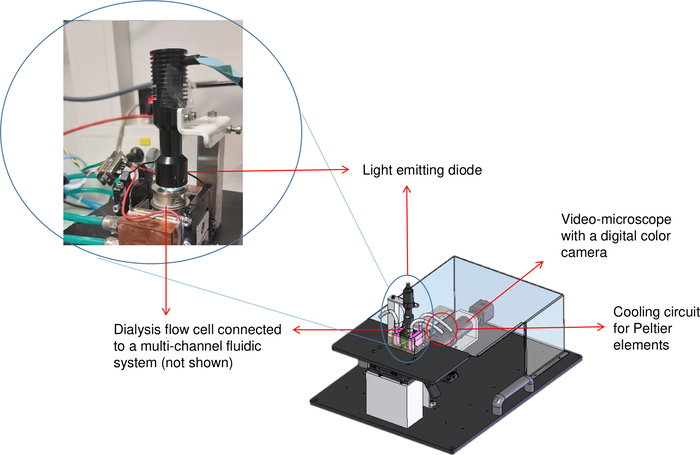
図2:結晶化ベンチ(OptiCrys)の模式図。LED光源は温度制御透析フローセルの上に位置しています。反転顕微鏡とデジタルカメラは、赤い矢印で画像の右上に表示されます。赤い円は、チラーチューブの位置を表します。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図3:温度(A)および沈殿物濃度(B)の関数としての模式的な2次元タンパク質結晶化相図。(A)直接溶解性を有するタンパク質の場合、温度を下げると、結晶化液が転移領域に保たれます。温度変化は、目的の体積を有する結晶が得られるまで結晶成長過程を制御するために数回繰り返すことができる。(B)沈殿液の濃度を変化させて結晶成長のためのメタスタブルゾーンに結晶化液を保持するためにも使用できる。この図は、ジュニウスらから適応 しています。8この図の大きなバージョンを表示するには、ここをクリックしてください。

図4:透析法を用いて得られたリソチームの結晶。本実験は、0.1Mの酢酸ナトリウム緩衝液pH4において293Kの一定温度で実施した。NaCl濃度を0.7 Mから1.2 Mに増加させることで、核生成速度が増加し、結晶の数が多くなります。 この図の大きなバージョンを表示するには、ここをクリックしてください。
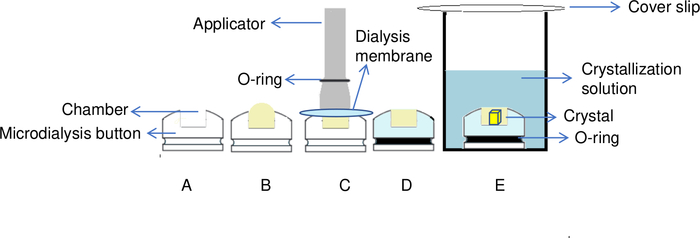
図5:透析法によるタンパク質結晶化プロセスの概要(A)透析ボタンのチャンバにタンパク質を添加することにより、(B)チャンバの上部にドーム形状が作成される。(C) アプリケータは、透析膜を固定するためにOリングを透析ボタンの溝に移すために使用されます。(D)透析ボタンは、リザーバ溶液に浸漬する準備ができています。(E)結晶化液は半透膜を通過し、結晶がチャンバー内に形成され始める。 この図の大きなバージョンを表示するには、ここをクリックしてください。
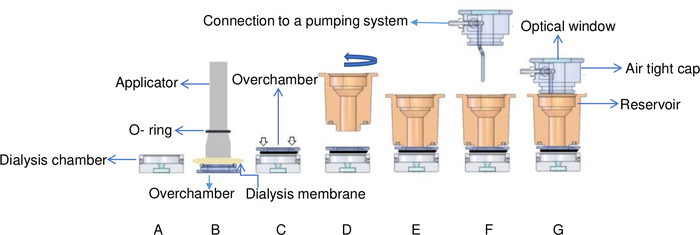
図6:温度制御流動透析セットアップの概略図。(A)タンパク質サンプルを透析チャンバーに添加する。(B) 透析膜は、アプリケータを使用してOリングで室内に固定されます。(C)室内は回され、透析チャンバーの上部に固定されます。白い矢印は、ねじが室外に置かれる場所を示します。(D)貯留室は時計回りに(E)回され、室の上に固定される。(F)貯留室はポンプシステムへのコネクターが付いた気密キャップで覆われ、(G)フローセルは真鍮の支持体に置かれる。この図は、ジュニウスらから適応 しています。8この図の大きなバージョンを表示するには、ここをクリックしてください。
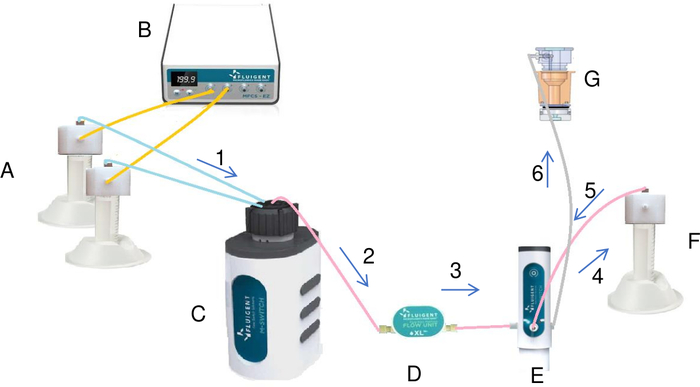
図7:流体系(A)によるリザーバ内の結晶化溶液の調製および注入。塩と水を含むチューブは、圧力/真空コントローラ(B)とロータリーバルブ(C)に接続されています。圧力/真空コントローラを使用することで、チューブからロータリーバルブへの液体の一定の流れを作成します。流量計(D)を通過する各液体は、混合管(F)に注入される。すべての液体が混合管に加えられたら、スイッチは、いくつかの変更によって、混合チューブ(G)に混合管から最終的な溶液を注入する。液体は、昇順(1から6)でマークされた図の矢印の方向にシステムを流れます。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図 8: 監督ソフトウェアのメンテナンスビューこのビューは、温度、光、結晶化溶液、ズームなどのさまざまなパラメータを制御するために使用されます。 この図の大きなバージョンを表示するには、ここをクリックしてください。
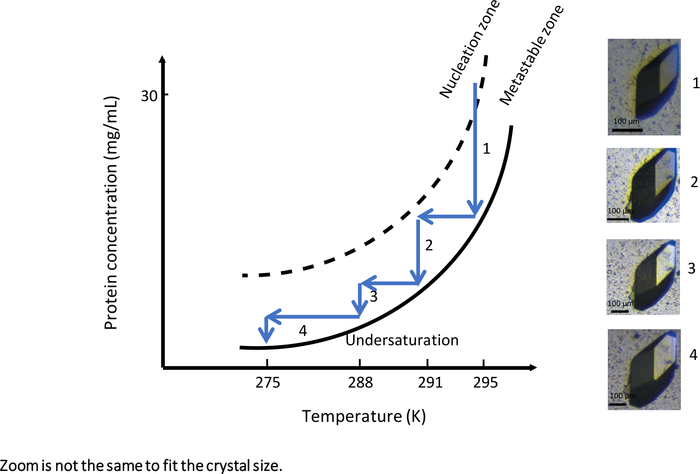
図9:温度の関数としての位相図(選択した画像は昇順で追跡する)。1つの大きなリソチーム結晶は、温度を295Kから275Kに体系的に変化させたものである。各工程において、溶解曲線に達すると結晶成長が止まる。メタスタブルゾーンに溶液を保つことによって温度を下げることで、結晶成長を再開します。画像の倍率は異なります。この図は、ジュニウスらから適応しています。8,18この図の大きなバージョンを表示するには、ここをクリックしてください。
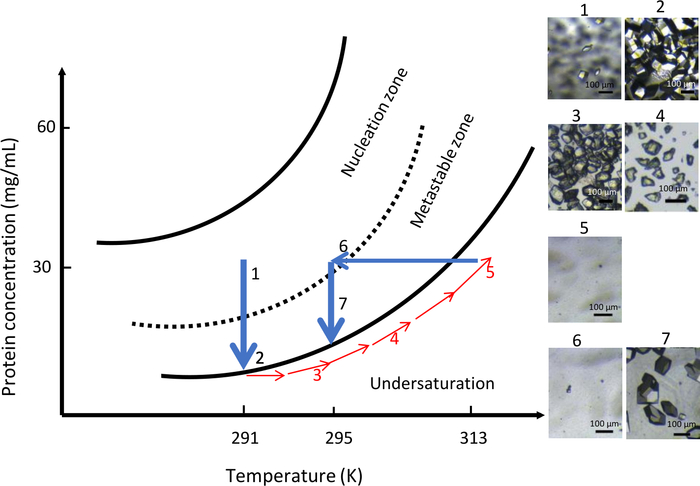
図10:温度制御を用いた一定の化学組成における結晶成長の最適化(選択した画像は昇順で追跡される)。核形成域で核形成過程を291Kで開始し、その後、転移性帯から遠く離れて、多数の結晶が形成される。温度を313Kに上げると、透析チャンバに可視核が見えなくなるまで結晶を溶解する。最後に、温度を295Kに下げると、2度目の核生成プロセスが再開され、限られた数の大きな結晶が生じる。この図は、ジュニウスらから適応しています。8,18この図の大きなバージョンを表示するには、ここをクリックしてください。
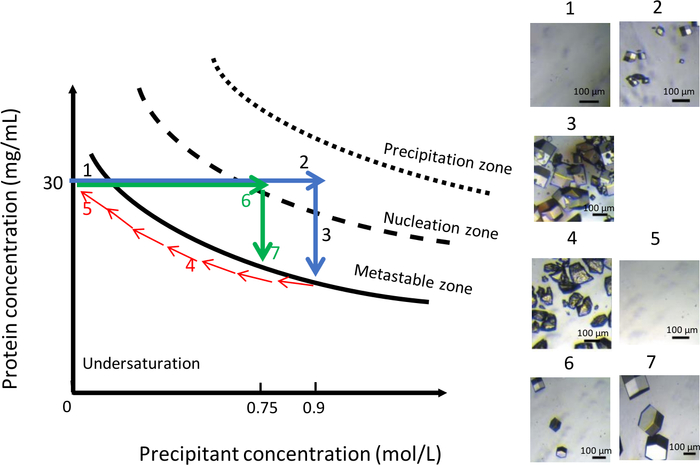
図11:沈殿物濃度の変動を用いた一定温度での結晶成長の最適化(選択した画像は昇順で追跡される)。沈殿物濃度を0.9Mから0Mに減少させることで、最初の核生成イベント中に得られた結晶を溶解する。結晶化プロセスは、同じ沈殿物の注入によって再開されるが、より低いイオン強度では0.75 M、これはいくつかの大きな結晶の形成につながる。この図は、ジュニウスらから適応しています。8,18この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
異なる物理的、化学的および生物学的変数は、タンパク質の溶解度21に影響を与えることによってタンパク質の結晶化に影響を与える。これらの変数の中でも、結晶化溶液の温度と化学組成は、中性子回折研究のために生体高分子の大きな高品質結晶を改善し、成長させるために透析技術と組み合わせて使用されています。位相図の知識を用いることで、結晶化がより予測可能になります。連続的アプローチで異なる結晶化条件のスクリーニングも可能であるが、提示された合理的なアプローチを使用する主な目的は、結晶核化および成長の運動学を分離し、制御することである。
すべての結晶化研究と同様に、高品質の純粋で均質なタンパク質サンプル、およびダストフリーの結晶化溶液は、実験の成功率を高めます。溶液の濾過および遠心分離は、記載されたプロトコルにおいて不可欠なステップである。分子量(適切な透析膜を選択する)、等電点、タンパク質溶解度など、研究したタンパク質の物理化学的性質を知ることは、最適な結晶成長実験の設計に不可欠です。また、サンプルロスを防止し、成功の可能性を高めるために、異なる温度または異なる化学物質でのタンパク質安定性を考慮する必要があります。OptiCrys (233.0 ~353.0 ± 0.1 K) の温度範囲を考慮すると、幅広いタンパク質を使用して結晶化することができます。しかし、熱性源のタンパク質など、主に熱安定性の高いタンパク質は、この装置が提供する温度制御された大量結晶成長実験で最も利益を得ることを強調する価値があります。
少量透析チャンバー(OptiCrysを使用する場合)またはミクロ透析ボタンを使用して、いくつかの温度および結晶化条件(例えば、沈殿物濃度またはpHのグリッド)をスクリーニングすることによって、転移ゾーン(核形成と転移帯の間の運動平衡)の限界の位置に関する情報を得ることは可能である。これは、特に結晶化の新しいタンパク質候補に対して成功した結晶成長実験を設計する際に非常に貴重です。この情報がなければ、高い過飽和の位相図の領域から、結晶核形成を容易に制御するには、メタスタブルゾーンの限界から遠すぎるところから実験を開始できる。タンパク質沈殿の溶解は、例えば直接溶解性の場合には温度を上昇させることによって、より低い熱安定性を有するタンパク質に対して、より長い期間高温で試料を保ち、タンパク質沈殿を不可逆的に引き起こす可能性がある。したがって、最良の戦略は、核生成を制御し、タンパク質沈殿を回避することができる転移性の限界近くに位置する低い過飽和を持つ初期条件を使用することから成り立っている。これに伴い、結晶化前スクリーニングは透析チャンバーにタンパク質沈殿物を有する可能性を減少させ、実験の成功率を増加させる。
実験を設計した後、透析室(OptiCrys)またはマイクロ透析ボタンを準備することも重要なステップです。透析チャンバー/ボタン内の気泡の形成を防ぐことは、特に少量が使用されている場合に結晶化が成功する可能性を高めます。透析チャンバ内の気泡の存在はまた、結晶化プロセスの運動を変更し、実験の再現性を低下させる可能性があります(タンパク質/溶液接触面が改変されているため)。タンパク質だけでなく、結晶化溶液も実験の成功に影響を与える可能性があります。ポンプシステムに新しい50 mLチューブを使用するたびに、新しい実験を開始し、各実験の後にチューブを洗浄すると、汚染の可能性が減少し、装置内の塩結晶の作成を回避します。
微小透析ボタンの使用は、OptiCrysが使用できない場合の代替手段です。上記の結晶成長を最適化し、結晶成長を監視するための戦略は、手動で行う必要があります。通常、これは、温度調節が記載された方法論の重要なステップである場合に問題になる可能性があり、熱調節インキュベーターの外に存在する必要があります。これは、結晶化液の化学組成の変化や、イメージングによる結晶成長のモニタリングを促進しないため、結晶成長プロセスをリアルタイムで制御することはできません。
位相図の知識は、結晶化ベンチOptiCrysを使用して、大規模で高品質の結晶を自動で体系的に成長させることの基礎です。結晶化時の温度、沈殿物濃度、pHなどの物理化学的パラメータの制御は、相図全体にわたって明確に定義された運動軌道におけるタンパク質溶液平衡を移動させる。これは、透析膜を使用して質量輸送を調整し、結晶の大きさと品質に影響を与える結晶化チャンバー内に制御された勾配を作成することによって補完されます。したがって、熱力学データと運動軌道の両方を使用することは、高品質の結晶を成長させるために結晶化プロセスを制御するために不可欠です。OptiCrysのおかげで、多次元空間における系統的な位相図は、以前よりかなり少ない材料を使用してシリアルアプローチで研究することができます。この方法論を実証するために、ここではモデルタンパク質である鶏卵白リソザイムを用いたケーススタディを提供します。ここで紹介するプロトコルを使用してマスタリングすることで、実際のタンパク質システム5、14、17、18に適応することができます。
開示事項
著者らは開示するものは何もない。
謝辞
MBSは、契約2015の下でLABEX VALO GRALからのサポートを認めています。NJは、CEAの国際博士研究プログラム(イルテリス)の博士フェローシップを認めています。著者らは、マリー・スクウォトフスカ・キュリー交付金協定番号722687の下で、欧州連合(EU)のHorizon 2020研究・イノベーションプログラムからの資金提供を認めている。著者はまた、Esko Oksanen博士(ESS、ルンド)とジャン=リュック・フェレール博士(IBS、グルノーブル)に有益な会話と洞察に感謝しています。IBSは、グルノーブル学際研究所(CEA)への統合を認めています。
資料
| Name | Company | Catalog Number | Comments |
| 200 µl Dialysis Button | Hampton Research | HR3-330 | Dialysis button |
| 24 well plates | Jena Bioscience | CPL-132 | Crystallization plate |
| 2-Switch | FLUIGENT | 2SW001 | Switch |
| 30 μl Dialysis Button | Hampton Research | HR3-324 | Dialysis button |
| 50 mL Corning Centrifuge tubes | Sigma-Aldrich | CLS430828-500EA | Centrifuge tubes |
| Acetic acid | Sigma-Aldrich | S2889 | Chemical |
| Chicken Egg White Lysozyme | Sigma-Aldrich | L6876 | Lyophilized protein powder |
| Dialysis Membrane Discs 6-8 kDa MWCO | Spectrum | 132478 | Dialysis membrane |
| Dialysis Membrane Tubing 6-8 kDa MWCO | Spectrum | 132650T | Dialysis membrane |
| Microcentrifuge | Eppendorf | Minispin | Bench-top centrifuge |
| Flow Unit | FLUIGENT | FLU-XL | Flow meter |
| Flowboard | FLUIGENT | FLB | Flowboard |
| Microfluidic Flow Control System EZ | FLUIGENT | EZ-01000002 | Pressure/vacuum controller |
| MilliporeSigma 0.22 µm syringe Filters | Millipore | GSWP04700 | 0.22 μm pore size filter |
| M-Switch | FLUIGENT | MSW002 | Rotary valve |
| Opticrys | NatX-ray | PRT008 | Crystallization bench |
| Siliconized circle cover slides | Hampton Research | HR3-231 | Glass slides |
| Sodium Chloride ≥ 99% | Sigma-Aldrich | 746398 | Chemical |
| Switchboard | FLUIGENT | SWB002 | Switchboard |
| Thermoregulated incubator | Memmert | IPP30 | Thermoregulated incubator |
参考文献
- Blakeley, M. P., Langan, P., Niimura, N., Podjarny, A. Neutron crystallography: opportunities, challenges, and limitations. Current Opinion in Structural Biology. 18 (5), 593-600 (2008).
- Snell, E. H., Van Der Woerd, M. J., Damon, M., Judge, R. A., Myles, D. A. A., Meilleur, F. Optimizing crystal volume for neutron diffraction: D-xylose isomerase. European Biophysics Journal. 35 (7), 621-632 (2006).
- Ng, J. D., Baird, J. K., Coates, L., Garcia-Ruiz, J. M., Hodge, T. A., Huang, S. Large-volume protein crystal growth for neutron macromolecular crystallography. Acta Crystallographica Section F:Structural Biology Communications. 71, 358-370 (2015).
- O'Dell, W. B., Bodenheimer, A. M., Meilleur, F. Neutron protein crystallography: A complementary tool for locating hydrogens in proteins. Archives of Biochemistry and Biophysics. 602, 48-60 (2016).
- Oksanen, E., Blakeley, M. P., Bonneté, F., Dauvergne, M. T., Dauvergne, F., Budayova-Spano, M. Large crystal growth by thermal control allows combined X-ray and neutron crystallographic studies to elucidate the protonation states in Aspergillus flavus urate oxidase. Journal of the Royal Society Interface. 6, (2009).
- Krauss, I. R., Merlino, A., Vergara, A., Sica, F. An overview of biological macromolecule crystallization. International Journal of Molecular Sciences. 14 (6), 11643-11691 (2013).
- Chayen, N. E. Comparative Studies of Protein Crystallization by Vapour-Diffusion and Microbatch Techniques. REVIEW Acta Cryst. , (1998).
- Junius, N., Oksanen, E., Terrien, M., Berzin, C., Ferrer, J. L., Budayova-Spano, M. A crystallization apparatus for temperaturecontrolled flow-cell dialysis with real-time visualization. Journal of Applied Crystallography. 49, 806-813 (2016).
- Salemme, F. R. A free interface diffusion technique for the crystallization of proteins for X-ray crystallography. Archives of Biochemistry and Biophysics. 151 (2), 533-539 (1972).
- Chayen, N. E., Saridakis, E. Protein crystallization: From purified protein to diffraction-quality crystal. Nature Methods. 5 (2), 147-153 (2008).
- Otálora, F., Gavira, J. A., Ng, J. D., García-Ruiz, J. M. Counterdiffusion methods applied to protein crystallization. Progress in Biophysics and Molecular Biology. 101 (1-3), 26-37 (2009).
- Garciá-Ruiz, J. M. Counterdiffusion Methods for Macromolecular Crystallization. Methods in Enzymology. 368, 130-154 (2003).
- Budayova-Spano, M., Koruza, K., Fisher, Z. Large crystal growth for neutron protein crystallography. Methods in Enzymology. 634, 21-46 (2020).
- Budayova-Spano, M., Dauvergne, F., Audiffren, M., Bactivelane, T., Cusack, S. A methodology and an instrument for the temperature-controlled optimization of crystal growth. Acta Crystallographica Section D: Biological Crystallography. 63 (3), 339-347 (2007).
- Asherie, N. Protein crystallization and phase diagrams. Methods. 34 (3), 266-272 (2004).
- Astier, J. P., Veesler, S. Using temperature to crystallize proteins: A mini-review. Crystal Growth and Design. 8 (12), 4215-4219 (2008).
- Budayova-Spano, M., et al. A preliminary neutron diffraction study of rasburicase, a recombinant urate oxidase enzyme, complexed with 8-azaxanthin. Acta Crystallographica Section F: Structural Biology and Crystallization Communications. 62 (3), 306-309 (2006).
- Junius, N., Vahdatahar, E., Oksanen, E., Ferrer, J. L., Budayova-Spano, M. Optimization of crystallization of biological macromolecules using dialysis combined with temperature control. Journal of Applied Crystallography. 53 (3), (2020).
- Grimsley, G. R., Pace, C. N. Spectrophotometric Determination of Protein Concentration. Current Protocols in Protein Science. 33 (1), 1-9 (2003).
- McPherson, A., Gavira, J. A. Introduction to protein crystallization. Acta Crystallographica Section F:Structural Biology Communications. 70 (1), 2-20 (2014).
- McPherson, A. Introduction to protein crystallization. Methods. 34 (3), 254-265 (2004).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved