Method Article
Оптимизация кристаллического роста для нейтронной макромолекулярной кристаллографии
В этой статье
Резюме
Структурные исследования биокромолекул с помощью кристаллографии требуют высококачественных кристаллов. Здесь мы демонстрируем протокол, который может быть использован OptiCrys (полностью автоматизированный инструмент, разработанный в нашей лаборатории) и / или microdialysis кнопки для выращивания больших высококачественных кристаллов на основе знаний о кристаллизации фазы диаграммы.
Аннотация
Использование нейтронной макромолекулярной кристаллографии (NMX) быстро расширяется, при этом большинство структур определяется в последнее десятилетие благодаря построению новых лучей NMX и повышению доступности программного обеспечения для уточнения структуры. Однако нейтронные источники, доступные в настоящее время для NMX, значительно слабее эквивалентных источников рентгеновской кристаллографии. Несмотря на достижения в этой области, для исследований нейтронной дифракции всегда потребуются значительно более крупные кристаллы, особенно с тенденцией к изучению все более крупных макромолекул и комплексов. Поэтому для расширения NMX необходимы дальнейшие усовершенствования методов и приборов, пригодных для выращивания более крупных кристаллов.
В этой работе мы вводим рациональные стратегии и скамейку роста кристаллов (OptiCrys), разработанную в нашей лаборатории, которая сочетает в себе наблюдение в режиме реального времени с помощью установленной микроскопом видеокамеры с точным автоматизированным управлением решениями кристаллизации (например, стремительной концентрацией, рН, добавкой, температурой). Затем мы демонстрируем, как этот контроль температуры и химического состава облегчает поиск оптимальных условий кристаллизации с использованием модельных растворимых белков. Тщательное знание диаграммы фазы кристаллизации имеет решающее значение для выбора исходного положения и кинетического пути для любого эксперимента кристаллизации. Мы показываем, как рациональный подход может контролировать размер и количество кристаллов, генерируемых на основе знаний многомерных фазовые диаграммы.
Введение
Понимание структуро-функциональных отношений белков и механизма физиологических путей часто зависит от знания позиций атомов водорода (H) и как заряд передается в пределахбелка 1,2. Так как атомы водорода рассеивают рентгеновские лучи слабо, их положение может быть определено только с очень высоким разрешением рентгеновских данных дифракции (Nogt;1)3,4. И наоборот, нейтронная кристаллография может быть использована для получения точного положения атомов водорода в биологических макромолекулах, так какатомы водорода и дейтерия(H 2, изотоп водорода) имеют разброс длин примерно одинаковой величины, как кислород, азот иуглерод 5. Тем не менее, нейтронный поток из имеющихся нейтронных источников слабее, чем у рентгеновских лучей, так что это часто должно бытькомпенсировано за 2,3. Этого можно достичь путем обмена H с H2 и/или увеличения объема кристаллов для уменьшения бессвязного рассеяния водородов и увеличения соотношения сигнала к шуму дифракционных изображений.
Существуют различные подходы к кристаллизации (соответствующая схематическая схема фазовая диаграмма показана на рисунке 1) для получения больших и высококачественных кристаллов как для рентгеновской, так и для нейтронной био-макромолекулярной кристаллографии6. При диффузии пара капля, приготовленная из смеси белка и раствора кристаллизации, со временем равноувеличилась через испарение воды или других летучих видов против резервуара, содержащего более высокую концентрацию осадков того же раствора кристаллизации. Увеличение концентрации белка и осадки в капле приводит к супернасыщению, необходимому для спонтанного нуклеации с последующим ростом кристалла вэтих ядрах 6,7. Хотя диффузия пара является наиболее часто используемым методомдля выращивания кристаллов 4,процесс кристаллизации не может быть точно контролируется8. В методе диффузии свободного интерфейса раствор кристаллизации рассеивается в концентрированном белковом растворе, очень медленно направляя систему на супернасыщение. Этот метод можно рассматривать как пакетный метод с медленной скоростьюсмешивания 6,9,10,11,12. В пакетной методике белок быстро смешивается с раствором кристаллизации, что приводит к быстрой супернасыщению и, в свою очередь, равномерному нуклеациисо многими кристаллами 3,7. На этот метод приходится примерно треть всех структур, которые в настоящее время депонированы в Банке данных по белкам. Метод диализа также используется для выращивания высококачественных и хорошо диффрактных кристаллов белка. В методе диализа молекулы обрывистого диффузии из резервуара через полупроницаемую мембрану в отдельную камеру с белковым раствором. Кинетики эквилибрации зависит от различных факторов, таких как температура, размер мембраны поры, а также объем и концентрация образцов белка и кристаллизацииагентов 6.
Диаграммы фазы кристаллизации могут быть использованы для описания различных состояний белка как функции различных физических или химических переменных3. Как показано на рисунке 1, каждый метод кристаллизации может быть визуализирован как использование другой кинетической траектории для достижения нуклеации и метастабибловыхзон такой диаграммы 6,10,13. Это дает информацию о растворимости белка и концентрации белка, при которой наблюдается термодинамическое равновесие между кристаллом и раствором, тем самым находя оптимальные условия длянуклеации и роста 3,14. На двухмерной фазовой диаграмме концентрация белка построена как функция одной переменной, а другие переменные остаются постоянными15. На такой фазовой диаграмме, когда концентрация белка ниже кривой растворимости, раствор находится в недонасыщенной области и не происходит нуклеации или роста кристалла. Над этой кривой находится зона супернасыщения, где концентрация белка выше, чем предел солуства3,14. Это далее делится на три области: метастабийная зона, зона самопроизвольного ядра и зона осадков. В метастабилярной зоне, супернасыщение не является достаточным для нуклеации произойти в течение разумного времени, но рост семенных кристаллов может иметь место. Агрегация и осадки благоприятствуют в зоне осадков, где супернасыщениеслишком высока 14,15.
Когда будет достигнуто достаточное количество супернасыщения для спонтанного нуклеации, первые ядра появятся10. Рост кристаллов приводит к снижению концентрации белка до тех пор, пока не будет достигнут предел растворимости. До тех пор, пока супернасыщение остается в непосредственной близости от кривой растворимости, не будет никаких существенных изменений в размерах кристаллов. Однако было показано, что колебания температуры и химического состава раствора кристаллизации (например, концентрация осадков) повлияют на раствор белка и могут привести к началу дальнейшегороста кристалла 8,13,16.
Поскольку диализ выгоден для роста кристаллов хорошего качества, скамейка кристаллизации OptiCrys, иллюстрированная на рисунке 2,была разработана и разработана в нашей лаборатории для управления кристаллизацией полностью автоматизированнойманерой 8. Для этого было написано программное обеспечение с LabVIEW, которое позволяет контролировать и контролировать температуру установки диализа резервуара в контакте с элементами Peltier, с помощью электронного контроллера и охладителя. Это же программное обеспечение также автоматически регулирует химический состав раствора кристаллизации (например, обмен кристаллическими агентами) с помощью многоканальной жидкостной системы. Кроме того, цифровая камера и перевернутый микроскоп используются для визуализации и записи процесса кристаллизации. Для выращивания кристаллов для различных целей доступны две камеры кристаллизации с объемами 15 МКл и 250 МКЛ. Поскольку процесс кристаллизации обратим, скрининг на различные условия возможен с помощью всего лишь нескольких микролитров белкового раствора до тех пор, пока образец неповрежден 8. В результате, используя этот метод сводит к минимуму количество используемого белкового материала.
Из предыдущейработы 8, очевидно, что во время процесса роста кристалла, на месте наблюдения должны проводиться через регулярные промежутки времени. Они могут варьироваться от нескольких секунд до нескольких дней, в зависимости от события под наблюдением (осадки, нуклеация, или рост кристалла).
Оптимизация роста кристаллов с помощью OptiCrys основана на диаграммах фазы температурной фазы. В случае белков с растворимости в качестве прямой функции температуры, можно использовать режим засолки из18. Именно здесь увеличение ионной прочности раствора, который можно визуализировать с помощью белково-обрывистых фазовых диаграмм, снижает растворимость белка. Аналогичным образом, белки с обратной растворимости может использовать соляной в режиме18. Нуклеация происходит в зоне нуклеации, в непосредственной близости от метастабиальной зоны, и рост кристалла происходит в метастабиальной зоне фазовой диаграммы до тех пор, пока концентрация белка не достигнет предела солублиции. Как показано на рисунке 3A, с постоянной температурой химического состава может быть уменьшена, чтобы сохранить кристаллизационный раствор в метастабиальной зоне, чтобы предотвратить новое нуклеацию. Кристаллы растут до тех пор, пока не будет достигнуто второе равновесие кристалла/раствора, и после этого дальнейшего увеличения размера кристаллов не наблюдается. Температура снижается в несколько раз, пока кристаллы не достигнут желаемого размера. На рисунке 3B,при постоянной температуре, повышение концентрации осадков сохраняет раствор в метастабильной зоне. Этот процесс может быть повторен несколько раз, чтобы получить большие кристаллы. Изменение температуры и манипулирование условиями решения кристаллизации, путем управления уровнями супернасыщения, являются двумя мощными инструментами для разделения нуклеации и роста кристаллов, которые контролируются точно и автоматически OptiCrys5,8,14.
Примеры кристаллов протеина, выращенных с помощью контролируемой температурой, или контролируемой температурой и высокой концентрацией кристаллизации, а также полученных данных относительной дифракции доступны в литературе и PDB. Среди них человеческий γ-кристаллин E, PA-IIL лектин, дрожжевые неорганические пирофосфазы, оксидазы уратов, углеродная ангидраза II человека, киназы ИчБ и лактатдегидрогеназы 5,14,17,18.
Хотя OptiCrys был коммерциализирован NatX-ray, есть много лабораторий, которые не имеют доступа к этому инструменту или серийному подходу, который он предлагает. Альтернативой этому методу является использование коммерчески доступных пластиковых кнопок микродиализа с различными объемами. Используя их, температурный и химический состав можно регулировать и менять вручную. Проверка кнопок микродиализа не может быть выполнена на месте и вместо этого должна быть сделана вручную с помощью оптического микроскопа. Контроль температуры может быть достигнут путем хранения образца в инкубаторе, свободном от вибрации, контролируемом температурой. Важно поддерживать постоянную температуру, чтобы эксперименты по кристаллизации были воспроизводимыми. Значительное изменение температуры может также привести к повреждению или разрушению кристаллов5.
Здесь мы предоставляем подробный протокол, описывающий подготовку образца и использование программного обеспечения для управления для роста больших, высококачественных кристаллов, пригодных для кристаллографии нейтронного белка. Эта пошаговая процедура была разработана, чтобы воспользоваться схемой фазы кристаллизации, чтобы выбрать исходное положение и кинетический путь для контроля размера и качества генерируемых кристаллов. Кроме того, представлен подробный протокол выращивания кристаллов с кнопками микродиализа, который использует то же обоснование для получения больших, высококачественных кристаллов.
протокол
1. Метод диализа с кнопками микродиализа
- Подготовка образца
- Подготовьте белковый раствор путем растворения 30 мг куриного яично-белого лизозима в качестве лиофилинизированного порошка в 1 мл буфера CH3COONa (100 мм ацетата натрия, рН 4) для получения раствора с конечной концентрацией 30мг-мл -1.
- Центрифуга образца на 13000 г × течение 10 мин при 277 К. Этот процесс помогает удалить все агрегаты перед началом процесса кристаллизации.
- Проверьте абсорбанс образца на уровне 280 нм и вычислите концентрацию белка с помощью уравнения Пиво-Ламберт (A qcl).
ПРИМЕЧАНИЕ: В соответствии с уравнением Пиво-Ламберт, электронное поглощение (A) прямо пропорционально концентрации (c,mg'mL -1) поглощающих видов, учитывая постоянную оптическую патлент (л, см). Градиентом этой линейной взаимосвязи является коэффициент вымирания моляров (ε, для лизозима в 280 нм составляет 2,64 мл мг1см No1)19. Боковые цепи ароматических аминокислот (тирозин, триптофан и фенилаланин) и дисульфидные связи между остатками цистеина имеют сильное поглощение на 280 нм, возникающих в результате спектроскопически разрешенных переходов π - π". Поскольку большинство белков содержат эти остатки, концентрация белка, как правило, может быть легко рассчитана путем измерения поглощения на 280 нм, учитывая знание коэффициента вымирания. - Подготовка решений кристаллизации, как показано на рисунке 4. Перед подготовкой раствора кристаллизации профильтруйтесь все фондовые решения с помощью фильтров Millipore на 0,22 мкм.
- Кристаллический рост
- Вырежьте целлюлозную диализную мембрану с соответствующим молекулярным снижением веса (6-8 кДа) и замочите ее в дистиллированной воде.
ПРИМЕЧАНИЕ: Диализ мембранные диски коммерчески доступны для кнопок микродиализа, но если диализ трубки используется, не забудьте сократить края для того, чтобы отделить два слоя мембраны от трубки, чтобы иметь только однослойные мембраны. - Заполните скважины 24-хорошо лоток с 2 мл кристаллизации раствора в том же порядке, как показано на рисунке 4.
ПРИМЕЧАНИЕ: Если используются кнопки с большими объемами (например, 200 МЛ), заполните 50 мл трубок с раствором кристаллизации 5 мл для обеспечения эффективного обмена. - Добавить/Pipette 35 йл раствора лизозима в камеру кнопки микродиализа, как показано на рисунке 5A.
ПРИМЕЧАНИЕ: Чтобы избежать образования пузырьков воздуха в 30-й кнопке диализа, когда она закрыта, дополнительный объем (мертвый объем) 5 МКЛ дополнительного белка должны быть добавлены, что означает в общей сложности 35 йл образца белка. Этот дополнительный образец белка создает слегка куполообразную форму на верхней части камеры, как показано на рисунке 5B, который предотвращает образование пузырьков воздуха. - Возьмите аппликатор соответствующего размера и поместите эластичное O-кольцо на его конечности(рисунок 5C). Затем поместите мембрану, предварительно слегка протертую/сливную с помощью куска бумаги, свободной от волокон, поверх камеры кнопки диализа. Будьте осторожны, чтобы не положить пыль в камеру при применении бумаги. Установите диализную мембрану на место, передав эластичное O-кольцо из аппликатора в паз кнопки диализа(рисунок 5C).
ПРИМЕЧАНИЕ: Критическим моментом обработки является фиксация диализной мембраны поверх камеры путем переноса эластичного O-кольца из аппликатора в паз кнопки диализа. Все движения должны быть идеально синхронизированы, чтобы избежать ограждения пузырьков воздуха с образцом в белковой камере. Полезно практиковать растяжение эластичного O-кольца перед его применением, чтобы знать его жесткость, использовать пинцет, чтобы удерживать часть мембраны во время его применения и проводить первые тестовые эксперименты с модельным белком. - Перенесите кнопку в колодец или в трубку 50 мл с помощью пинцета(рисунок 5D).
- Обложка хорошо с крышкой, нажав его осторожно на смазку, чтобы запечатать хорошо(рисунок 5E).
ПРИМЕЧАНИЕ: Если нет жира на верхней части скважин, не забудьте добавить это, прежде чем начать эксперимент или использовать кусок ленты вместо стеклянной крышки. Принцип кристаллизации белка с помощью кнопок микродиализа иллюстрируется на рисунке 5. - Храните образец на уровне 293 K в терморегулируемом инкубаторе. Различные температуры могут быть необходимы в зависимости от используемого белка и кристаллизации.
ПРИМЕЧАНИЕ: Та же сетка условий кристаллизации, показанная на рисунке 4 (позволяющая разнообразной концентрации осадков) может быть проверена в зависимости от температуры. В таком случае должна быть воспроизведена одна и та же кристаллизация пластины, и каждая копия должна быть помещена в инкубатор, регулируемый при разной температуре. Это требует наличия нескольких терморегулируемых инкубаторов без вибрации. - Проверьте лоток или трубки для кристаллов(рисунок 4) и делать заметки на регулярной основе, как правило, ежедневно, чтобы различить, что находится в каждом лоток. Хорошие ноты необходимы, чтобы избежать ложноположивых результатов и различать пыль от кристаллов.
- Вырежьте целлюлозную диализную мембрану с соответствующим молекулярным снижением веса (6-8 кДа) и замочите ее в дистиллированной воде.
2. Процесс роста кристалла с помощью OptiCrys
- Подготовка образца
- Подготовь белковый раствор и диализную мембрану, как описано в разделе 1.1.
- Подготовье фондовых растворов NaCl (4 M) и CH3COONa pH 4 (1 M) и отфильтруйте их в трубы 50 мл.
- Добавьте белковый раствор (15 л лизозима с 30мг/мл -1)в диализную камеру контролируемого температурой установки диализа резервуара. Обратитесь к рисунку 6 для получения подробной информации о контролируемой температурой установке диализа резервуара. OptiCrys имеет две диализные камеры, минимальный объем составляет 15 МКЛ, а максимальный объем составляет 250 МКЛ.
- Обложка overchamber с диализной мембраны и исправить мембрану с упругим O-кольцо (Рисунок 6B).
ПРИМЕЧАНИЕ: Эта установка отличается от кнопок микродиализа, где каждая камера запечатана непосредственно диализной мембраной. В клетке потока, мембрана диализа вместо зафиксирована к overchamber позволяющ устанавливать кристаллов без своего удаления. Для этого надхувку можно просто отвинтить от водоема. - Переверните overchamber и поместите его на верхней части камеры диализа. Медленно и осторожно нажмите на него, чтобы удалить весь воздух, оказавшихся между двумя частями и избежать пузырьков в камере (Рисунок 6C). Практика с моделью белка может быть выгодным при обучении, чтобы избежать пузырьков воздуха и потери образцов.
- Исправить резервуар в своем положении, осторожно завинчивая его на верхней части overchamber, снова быть внимательным, чтобы избежать захвата пузырьков воздуха. Чрезмерное затягивание резервуара может также образовывать пузырьки в камере кристаллизации(рисунок 6D).
- Добавьте раствор кристаллизации и накройте камеру резервуара герметичной крышкой. (Рисунок 6G). Максимальный объем водохранилища составляет 1 мл.
- Перенесите эту сборку и вставьте ее в латунную поддержку. Эта поддержка находится в контакте с элементами Peltier, которые используются для контроля температуры.
- Как показано на рисунке 6, герметичная крышка оснащена оптическим окном, чтобы обеспечить верхнее освещение диализной камеры. Положите источник света(рисунок 2) на окно, позволяющее свету проходить через камеру.
- Камера резервуара может быть подключена к насосу, чтобы он функционировал как ячейка непрерывного потока. Подключите трубки поверх труб 50 мл, которые содержат фондовые растворы и дистиллированную воду, к вращающейся клапану, как показано на рисунке 7.
ПРИМЕЧАНИЕ: Если автоматическая подготовка и изменение решений кристаллизации не являются желаемыми во время эксперимента, опустить шаг 2.1.10. В таком случае необходимо подготовить раствор кристаллизации и предварительно заполнить резервуар вручную.
- Программного обеспечения
- Включите компьютер и запустите программное обеспечение Croissance cristalline «Хрустальный рост». Это программное обеспечение управления написано с LabVIEW(http://www.ni.com/labview/)и предлагает удобный графический интерфейс. Она включает в себя 4 различных графических интерфейса(Accueil (Добро пожаловать), Параметраж (Установка), Essai (тест) и техническое обслуживание(рисунок 8).
ПРИМЕЧАНИЕ: Переводы с французского языка в скобках. - Выберите представление обслуживания, нажав на кнопку, как показано на рисунке 8. В настоящее время это представление является наиболее часто используемым и позволяет пользователям контролировать большинство параметров во время эксперимента.
ПРИМЕЧАНИЕ: После нажатия на вид обслуживания появится новое окно с различными секциями для управления параметрами, такими как температура или свет. На рисунке 8 различные части этого представления показаны стрелками и кадрами. На следующих этапах мы демонстрируем, как каждый параметр контролируется с помощью программного обеспечения. - Секция «Регулятура температуры» позволяет контролировать и контролировать температуру. Нажмите на кнопку, номер один (1) на рисунке 8, чтобы включить его.
ПРИМЕЧАНИЕ: Диапазон температур в OptiCrys составляет 233,0 - 353,0 ± 0,1 К. - Установите температуру на секции consigne (setpoint) и введите пресс(рисунок 8(2)). Под этой кнопкой находится график с 2 следами (красный и желтый). Красный след показывает окончательную (упорядоченную) температуру, а желтый след показывает текущую температуру. Как показано на рисунке 8(2), температура установлена на уровне 20 градусов по Цельсию.
ПРИМЕЧАНИЕ: Для того, чтобы вырастить кристалл, как объяснили в разделе роста кристалла, многие температуры должны быть выбраны. Чтобы изменить температуру, добавьте каждую новую температуру в секцию consigne (setpoint) и нажмите кнопку Enter на клавиатуре. - Включите свет, увеличив светимость раздела Люмьер на рисунке 8. Светимость колеблется от 0 до 100, "0" указывает на то, что свет выключен и при "100" свет устанавливается на максимальную интенсивность и яркость. Увеличивая свет, в разделе Микроскоп, можно увидеть внутри камеры диализа. В ходе эксперимента яркость в клетке может варьироваться; настроить параметры, чтобы четко визуализировать внутри камеры диализа. Увеличение также может быть увеличено или уменьшено с помощью кнопок q и - перед "зумом" для лучшего просмотра.
- На правой стороне раздела Микроскоп, Есть несколько разделов для хранения соответствующей информации для каждого эксперимента кристаллизации. Каждый пользователь может создать папку для хранения информации об условиях кристаллизации, названиях белков и молекулярном весе используемой мембраны диализа(рисунок 8(3)).
- Пользователь может определить имя для эксперимента, просто введя его на Ном Досье (имя Folder). Нажатие на досье (кнопка Folder) (показано с зеленой рамкой на рисунке 8)открывает новое окно. В этом окне будет текстовый файл, содержащий всю информацию, определенную для эксперимента. Кроме того, для дальнейшей обработки в этой папке сохраняются изображения со штампами времени.
- Из раздела NB Images выберите количество изображений, которые должны быть сделаны в ходе эксперимента. Укажите количество изображений в правой панели вместе с желаемым временным интервалом между ними (например, мин, час, день). На рисунке 8 показана настройка программного обеспечения для записи нулевых изображений в минуту.
ПРИМЕЧАНИЕ: Используйте раздел Pompe «Насос» для смешивания фондовых растворов и введения раствора кристаллизации в камеру резервуара. См раздел 2.1.10 и рисунок 7 для объяснения принципа системы смешивания жидкости. - Концентрации входных данных фондовых решений в Etape 1 «Шаг 1»: решения запасов. Для эксперимента по кристаллизации в следующем разделе будут использоваться NaCl 4 M и CH3COONa 1 M pH 4.
ПРИМЕЧАНИЕ: Концентрация фондовых решений в молярных единицах. - Определите окончательную концентрацию каждого раствора. Например, 0,75 М для NaCl и 0,1 М для CH3COONa pH 4. Вввемите их в заключительномразделе концентрации(рисунок 8 ) в Etape 2 «Шаг 2»: решение «препарер» (решение для подготовки). Нажмите кнопку Calcul (Вычислить), которая показана с красной рамкой на рисунке 8. Окончательный объем каждого стокового решения, которое будет использоваться при смешивании, будет отображаться в панели громкости перед каждой концентрационой панелью.
- Нажмите кнопку «Подготовка к запуску» (рисунок 8). Как показано на рисунке 7, роторный клапан принимает каждый стоковой раствор и впрыскивает их в трубку для смешивания через выключатель.
- После того, как решение кристаллизации будет подготовлено, нажмите на кнопку «Вход в систему» в кнопке «Выход 3»: Поток секции насоса (желтая рамка на рисунке 8). Переключатель изменяется, чтобы ввести новый раствор кристаллизации из смешивания трубки в камеру резервуара. Чтобы остановить процесс обмена, нажмите кнопку Arr't distribution (Остановка распределения).
ПРИМЕЧАНИЕ: Наблюдайте за процессом кристаллизации во время эксперимента и изменяйте параметры, такие как температура, решение кристаллизации и масштабирование, в соответствующем графическом интерфейсе программного обеспечения наблюдения. С помощью программного обеспечения нет необходимости удалять герметичную крышку или ячейку потока во время эксперимента, так что единственной переменной будет тот, который пользователь изменяет через программное обеспечение.
- Включите компьютер и запустите программное обеспечение Croissance cristalline «Хрустальный рост». Это программное обеспечение управления написано с LabVIEW(http://www.ni.com/labview/)и предлагает удобный графический интерфейс. Она включает в себя 4 различных графических интерфейса(Accueil (Добро пожаловать), Параметраж (Установка), Essai (тест) и техническое обслуживание(рисунок 8).
- Большой кристаллический рост
- Добавьте 15 л лизозима с концентрацией 30мг/мл -1 в диализную камеру(рисунок 6A).
ПРИМЕЧАНИЕ: Подготовьте образец белка, описанный в разделе 1.1. - Соберите температурно-контролируемую установку диализа резервуара как описано в разделе 2.1 и рисунке 6.
- Подготовь решение кристаллизации. Не забудьте отфильтровать все фондовые растворы перед подготовкой образца с помощью фильтров 0,22 мкм. Для этого эксперимента решение кристаллизации содержит 0,75 M NaCl и 0,1 М CH3COONa pH 4. Это может быть добавлено вручную или с помощью камеры резервуара и насосной системы, как описано в разделах 2.2.10 до 2.2.12.
- Установите температуру до 295 K, как это объясняется в разделах 2.2.3 и 2.2.4 и показано на изображении 8. В начальных условиях равновесие между диализной камерой и резервуаром будет достигнуто примерно через 90 минут, а первые видимые ядра появятся через 22 часа.
- Позвольте кристаллам расти до тех пор, пока не будут наблюдаться более заметные изменения в размерах кристаллов(рисунок 9,панель 1).
ПРИМЕЧАНИЕ: Для того, чтобы определить время нуклеации и измерить изменение размера кристаллов, записывать изображения каждые 15 или 20 минут, что, соответственно, 4 или 3 изображения в час в разделе NB Изображения. Для наблюдения на месте денатурации белка, агрегации и осадков или кристаллического растворения или нуклеации, как правило, от нескольких секунд до нескольких десятков минут не требуется. Однако, для роста кристалла, этот диапазон составляет от нескольких минут до нескольких часов. - Через три дня, снизить температуру до 291 K, чтобы перезапустить рост кристалла. Держите температуру постоянной и пусть кристалл развиваться(рисунок 9, панель 2). На этом этапе эксперимента будет достаточно записывать изображения каждые 2 часа и проверять каждые 10-12 часов на наличие каких-либо изменений в размерах кристаллов. Эксперимент может быть продолжен, если не наблюдается никаких изменений в размерах кристаллов.
ПРИМЕЧАНИЕ: В зависимости от белков и выхносятых концентраций в растворе кристаллизации и объемов используемого белка, время, необходимое для достижения равновесия для каждого шага, может варьироваться. - Снижение температуры до 288 K, чтобы перезапустить рост кристалла. В экспериментальном состоянии представленного здесь корпуса одного дня достаточно, чтобы достичь равновесия(рисунок 9, панель 3).
- Проверьте размер кристаллов и поддерживать постоянную температуру до тех пор, как кристалл продолжает расти.
- Через 4 дня, снижение температуры до 275 K для того, чтобы перезапустить рост кристалла(рисунок 9, панель 4).
- В экспериментальных условиях представленного корпуса, примерно через 10 дней будет получен кристалл, который составляет 500 мкм в одномизмерении (рисунок 9).
- Добавьте 15 л лизозима с концентрацией 30мг/мл -1 в диализную камеру(рисунок 6A).
- Управление размером кристалла
- Подготовьте белковый раствор и контролируемый температурой текучий диализ резервуара, описанный в разделах 2.3.1 и 2.3.2.
- Подготовь решения кристаллизации с помощью 0,9 M NaCl и 0,1 М CH3COONa pH 4.
- Установите температуру до 291 K и позвольте кристаллам расти. При первоначальных условиях первое нуклеацию начнется примерно через час, и в течение трех часов в диализной камере вырастет количество кристаллов(рисунок 10,шаги: 1 и 2). Запись изображений каждые 20 минут, чтобы проверить размер кристаллов во время процесса роста.
ПРИМЕЧАНИЕ: Оптимизация условий кристаллизации имеет решающее значение для контроля большинства конечных свойств генерируемых кристаллов. Температурный и химический состав растворов кристаллизации может быть изменен для растворения и повторного выращивания кристаллов равномерного размера. Следует также отметить, что образец белка не потребляется в таком эксперименте, так как условия могут быть отменены, чтобы повторно растворить образец до тех пор, пока он не денатурирован. При растворении кристаллов путем изменения температуры и поддержания постоянного химического состава продолжайте эксперимент следующим образом: - После того, как кристаллы выросли на 291 K, они могут быть растворены, чтобы вырастить меньше, большие кристаллы. Увеличьте температуру постепенно более чем на 20 минут, чтобы достичь 313 К. Это займет около одного часа, чтобы растворить все кристаллы внутри камеры диализа(рисунок 10, шаги: 3-5). Запись изображений каждые 5-15 минут для мониторинга процесса растворения.
ПРИМЕЧАНИЕ: Многие белки чувствительны к высоким температурам. Будьте уверены, чтобы работать в пределах диапазона температур, где белок стабилен, чтобы избежать каких-либо повреждений / денатурации. В дополнение к растворимости белка, температура также влияет на буферный раствор. Например, рН буфера может меняться с температурой, особенно в буфере Tris. В таком случае крайне важно установить рН в соответствии с температурой, при которой проводится эксперимент18. Следует также отметить, что растворение белка занимает значительно меньше времени (от нескольких минут до нескольких часов) по сравнению с ростом кристалла белка (от нескольких часов до нескольких дней). В целом, во время растворения кристаллов, температура повышается постепенно и медленно (с соблюдением короткого времени полного растворения), в основном в случае частичного растворения кристаллов, чтобы избежать увеличения кристаллической мозаичности. Когда кристаллы растут, температура может быстро снизиться (менее чем за минуту) до установленной температуры (с соблюдением длительного общего времени роста). Регулярный мониторинг камеры кристаллизации путем записи изображений рекомендуется для предотвращения повреждения белка и помочь определить оптимальное время для растворения или роста кристаллов для каждого изученного белка. - После того, как все кристаллы растворились установить температуру до 295 K, чтобы инициировать второе событиенуклеации (рисунок 10, шаги: 6,7). Запись изображений каждые 5 минут для мониторинга второго процесса нуклеации. На этом этапе первые ядра появляются примерно через 18 минут.
ПРИМЕЧАНИЕ: При такой температуре раствор будет в зоне нуклеации, в непосредственной близости от метастабийной зоны. В результате в камере кристаллизации появится всего несколько ядер. - Продолжить эксперимент, повторяя рабочий процесс оптимизации, описанный в разделе 2.3 для выращивания больших кристаллов. Общая продолжительность эксперимента, представленного на рисунке 10, составляет всего несколько дней.
ПРИМЕЧАНИЕ: Если во время фазы нуклеации кристаллы появляются в разное время, кристаллы разных размеров получаются в камере кристаллизации. В таком случае повышение температуры (в случае белков с прямой растворимости) приведет к более быстрому растворению мелких кристаллов. В зависимости от кинетического эффекта созревания, дополнительный белок (полученный от растворения) может быть использован для роста больших кристаллов.
При растворении кристаллов при постоянной температуре путем изменения химического состава раствора кристаллизации продолжайте эксперимент следующим образом:
Также можно растворить кристаллы, выращенные ранее, изменив химический состав раствора кристаллизации в ходе эксперимента по повторному выращиванию популяции кристаллов равномерного размера в новых условиях. - Подготовьте белковый раствор (2.3.1), контролируемую температурой установку диализа резервуара (2.1) и раствор кристаллизации (2.4.2), как описано выше. При начальных условиях в зоне нуклеации, далекой от метастабиальной зоны, в камере кристаллизации появятся многочисленные мелкие кристаллизации иначнут расти (рисунок 11, шаги: 1,2).
- Через три часа, когда многие средние кристаллы видны в камере кристаллизации(рисунок 11, шаг: 3), уменьшить концентрацию NaCl (0,9 М) постепенно, чтобы достичь нуля. Для этого подготовьтесь к новому решению кристаллизации, содержащем только буферное решение с0,1М CH 3 COONa pH 4. Используйте насосную систему для обмена ее раствором кристаллизации в резервуарной камере. Следуйте шагам от 2.2.10 до 2.2.12 для подготовки и введения нового раствора в резервуарную камеру. С помощью этого нового решения при обмене растворами концентрация NaCl уменьшается в камере до тех пор, пока окончательное решение в камере резервуара не содержит не более 0,1 М CH3COONa pH 4 и без NaCl. Захват изображений каждые 10 минут для записи процесса роспуска.
- Разрешить кристаллы полностью растворяться(рисунок 11, шаги: 4,5). Время роспуска составляет около двух часов для этого эксперимента. Как упоминалось ранее, время растворения зависит от белковой системы, условий кристаллизации и используемого объема диализной камеры. Регулярное наблюдение камеры кристаллизации (см. раздел Микроскоп) и запись изображений и заметок во время эксперимента имеют важное значение.
- Когда все кристаллы внутри камеры растворяются(рисунок 11, шаг: 5), использовать насосную систему снова подготовить новый раствор кристаллизации путем введения NaCl в более низкой концентрации, чем предыдущий (0,75 M NaCl в 0,1 М CH3COONa pH 4).
- Ввести новое решение в камеру резервуара(рисунок 11, шаги: 6,7) и повторить процесс оптимизации роста кристаллизации, как описано в разделе 2.3. Будет создана единая популяция более крупных кристаллов. Результаты, показанные на рисунке 11, были получены через несколько дней.
Результаты
В разделах 2.3 и 2.4 представлены три примера оптимизированного роста кристалла, показывающие использование инструмента и экспериментальную конструкцию для выращивания крупных кристаллов. Для этой демонстрации мы использовали лизозим в качестве модельного белка, хотя эксперименты по росту кристаллов были успешно проведены со многими другими белковых системами, использующими этот метод (см. выше). Используя и осваивая представленный здесь протокол, можно адаптировать его для других кандидатов на белок.
В разделе 2.3 мы продемонстрировали, что установленные рациональные стратегии кристаллизации могут быть полезны при выращивании кристаллов с достаточными объемами рассеяния для кристаллографии нейтронного белка. Здесь мы демонстрируем, что предлагаемые рациональные стратегии оптимизации также позволяют создать единую популяцию кристаллов любого конкретного размера, необходимых для подходов к определению структуры ниже по течению.
Эти два эксперимента призваны подчеркнуть важность фазовых диаграмм в управлении ядром кристалла и ростом. Здесь для изучения качественной фазовой диаграммы используется контроль температурного и химического состава растворов кристаллизации в сочетании с мониторингом процесса кристаллизации в режиме реального времени. Используя этот метод, нуклеация и рост кристаллов могут быть рационально оптимизированы обратимым образом. Использование такого последовательного подхода также уменьшает количество белка и время, необходимое для контроля размера и качества кристаллов.
В методе диализа белковый раствор отделяется от раствора кристаллизации полунаницаемоймембраной 6 (рисунок 5). Эта мембрана диализа позволяет небольшим молекулам, таким как добавки, буфер и ионы, проходить через мембрану, но не макромолекулы,такие как белки 6,20. Эта функция позволяет модифицировать решение кристаллизации в ходе эксперимента6. Обмен раствором можно сделать вручную, например, в кнопках микродиализа, или в автоматическом режиме с помощью инструмента, разработанного для этой цели, OptiCrys8.
В первом наборе экспериментов для кристаллизации лизозима куриного яичного белка использовались кнопки микродиализа. Кнопки microdialysis были погружены в растворы кристаллизации с различными концентрациями соли. В этом простом эксперименте сетки кристаллизации единственной переменной является выхудительная концентрация, в то время как температура остается постоянной (293 K). Как показано на рисунке 4, небольшие колебания концентрации соли вызывают изменение размера и количества кристаллов наблюдается, что позволяет исследование кристаллизации фазы диаграммы. На рисунке 4, панель 1, кристаллизация решение содержит 0,7 M NaCl и ограниченное количество больших кристаллов появились в кнопках. Увеличивая концентрацию соли с 0,7 до 1,2 м, увеличивается супернасыщение и раствор в зоне нуклеации отходит от метастабилярной зоны(рисунок 4,панели от 1 до 6). В результате количество кристаллов увеличивается и их размер уменьшается.
В первом эксперименте с полностью автоматизированным инструментом, позволяющим кристаллизацию диализа с контролем температуры, OptiCrys(рисунок 9),эксперимент по росту кристаллов был разработан с учетом большого роста кристалла. Эксперимент был запущен при начальной температуре 295 K с раствором кристаллизации, содержащим 0,75 M NaCl и 0,1 М На ацетат буфер рН 4. В этих экспериментальных условиях раствор кристаллизации достиг зоны нуклеации в непосредственной близости от метастабиальной зоны фазовой диаграммы(рисунок 9, стрелка 1). В результате на первом этапе эксперимента было создано лишь несколько ядер. Для дальнейшего роста выбранных кристаллов (показано на рисунке 9)рабочий процесс оптимизации кристалла был обусловлен метастабиальной зоной с различной температурой, как только было достигнуто равновесие кристалло-раствора.
Каждый раз, когда достигалось равновесие между кристаллом и раствором, температура опускалась сначала до 291 К, затем до 288 К и, наконец, до 275 К, чтобы сохранить кристаллизационое решение в метастабиальной зоне. Результатом этого эксперимента является один большой кристалл, пригодный как для макромолекулярной рентгеновской, так и для нейтронной кристаллографии.
Для большинства белков точная количественная фазовая диаграмма (или просто качественная диаграмма) еще не получена из-за отсутствия экспериментальных устройств, способных точно измерять концентрацию белка (или просто наблюдать/обнаруживать процесс кристаллизации в режиме реального времени) во время экспериментовкристаллизации 18. В результате зачастую невозможно спроектировать эксперимент таким образом, чтобы кристаллизация началась в оптимальной области фазовой диаграммы, в непосредственной близости от метастабиальной зоны.
Поэтому перед началом эксперимента, посвященного росту кристалла большого объема, необходимо провести исследование оптимизации кристаллизации. В этом исследовании, используя колебания температуры (при постоянном химическом составе), с одной стороны, и изменения химического состава (при постоянной температуре), с другой стороны, необходимы для определения метастабиальной зоны и определения оптимальных условий для начала большого эксперимента по росту кристалла.
С этой целью представлены два других эксперимента, которые были разработаны, чтобы продемонстрировать обратимость контролируемых температурой экспериментов по кристаллизации диализа с OptiCrys для нуклеации, роста кристаллов, растворения и повторного роста. Рабочий процесс оптимизации кристаллического роста контролировался таким образом, чтобы выращивали единую популяцию меньшего количества, больших кристаллов лизозима, используя изменение температуры или концентрации осадков.
Во втором эксперименте с OptiCrys химический состав раствора кристаллизации сохранялся на протяжении всего эксперимента (0,9 М НаКл в 0,1 МЧ CH3COONa pH 4) с переменной температурой. Начальная температура была установлена на уровне 291 К. Результаты этого эксперимента обобщены на рисунке 10. Из-за высокой супернасыщения в камере кристаллизации появилось большое количество мелких кристаллов(рисунок 10,панели 1 и 2). В соответствии с концепцией прямой растворимости белка, постепенно повышая температуру до 313 К, все кристаллы растворялись(рисунок 10,панели 3, 4 и 5). Наконец, путем понижения температуры до 295 К, второе нуклеацию было начато в непосредственной близости от метастабийной зоны и позволило контролируемое образование меньшего числа ядер. Дальнейший рост кристалла привел к равномерному поколению популяции более крупных кристаллов(рисунок 10, панель 7).
Как показано на рисунке 11, изменение химического состава раствора кристаллизации, при постоянной температуре 291 K, также может быть использован для получения равномерной популяции больших кристаллов. Как и в предыдущем эксперименте, первоначальное условие было 0,9 M NaCl в 0,1 М CH3COONa pH 4. Концентрация NaCl была затем снижена постепенно с 0,9 М до нуля, чтобы растворитькристаллы (рисунок 11, панели 4 и 5). На данный момент NaCl был полностью заменен буферным решением 0.1 M CH3COONa pH 4. Снижение концентрации соли удерживает раствор в недонасыщенной зоне фазовой диаграммы, что приводит к растворению кристаллов. Затем в камеру резервуара был введен новый раствор кристаллизации с более низкой ионной прочностью, на уровне 0,75 МНаКл в 0,1МЧ CH 3 COONa pH 4. При такой стремительной концентрации появились первые ядра(рисунок 11, панель 6) через 90 минут. Количество генерируемых кристаллов было ниже, и кристаллы достигают большего объема(рисунок 11, панель 7), чем раньше.
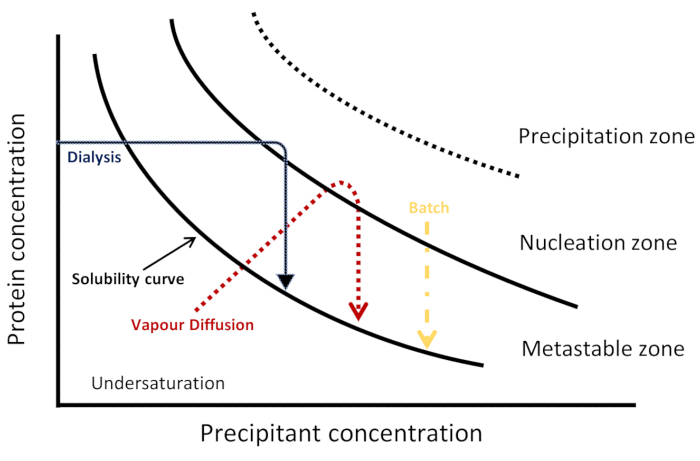
Рисунок 1: Схематическая фазовая диаграмма. Кинетические траектории для трех методов кристаллизации представлены в режиме засолки. Каждый метод достигает нуклеации и кристаллизации по-разному, визуализируется различным кинетическим путем через фазовую диаграмму для достижения нуклеации и метастабибловых зон. Кривая солуства отделяет регионы недонасыщения и супернасыщения. Супернасыщение делится на три зоны: метастабиление, нуклеацию и осадки. В зоне нуклеации происходит спонтанное нуклеацию, в то время как в метастабиальной зоне происходит рост кристалла. Эта цифра адаптирована из Junius и др. 8Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
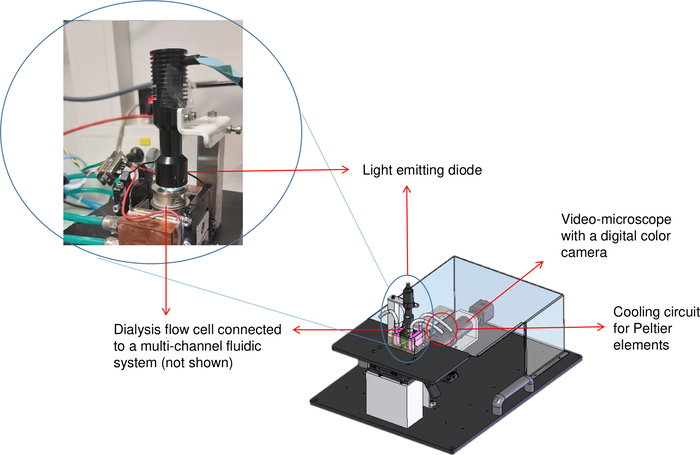
Рисунок 2: Схематическое представление скамейки кристаллизации (OptiCrys). Светодиодный источник света расположен на вершине контролируемой температурой диализной ячейки потока. Перевернутый микроскоп и цифровая камера отображаются в правом верхнем правом верхнем части изображения красной стрелкой. Красный круг представляет расположение охладителя трубки. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 3: Схематическая двухмерная схема фазы кристаллизации белка как функция температуры (A) и стремительной концентрации (B). (A) В случае белка с прямой растворимости, снижение температуры сохраняет раствор кристаллизации в метастабиальной зоне. Изменение температуры может повторяться несколько раз, чтобы контролировать процесс роста кристаллов до тех пор, пока кристаллы с желаемым объемом не будут получены. (B) Изменение концентрации стремительного раствора также может быть использовано для хозяйки раствора кристаллизации в метастабильной зоне для выращивания кристаллов. Эта цифра адаптирована из Junius и др. 8Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 4: Кристаллы лизозима, полученные с помощью метода диализа. Эксперимент проводился при постоянной температуре 293 К при буфере ацетата 0,1 М натрия рН 4. Увеличение концентрации NaCl с 0,7 М до 1,2 М увеличивает скорость нуклеации и приводит к увеличению количества кристаллов. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
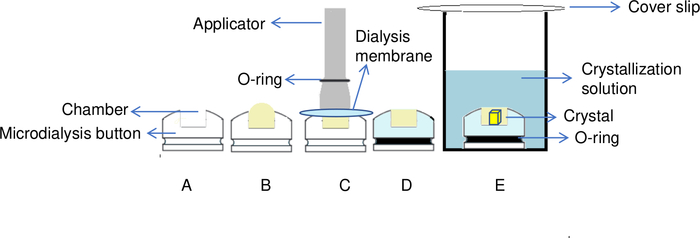
Рисунок 5: Обзор процесса кристаллизации белка методом диализа. (A) Добавляя белок в камеру кнопки диализа, (B) форма купола создается в верхней части камеры. (C) Аппликатор используется для переноса O-кольца в паз кнопки диализа, чтобы зафиксировать диализную мембрану на месте. (D) Кнопка диализа готова к погружению в раствор резервуара. (E) Кристаллизация раствор проходит через полуобуманную мембрану и кристаллы начинают формироваться внутри камеры. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
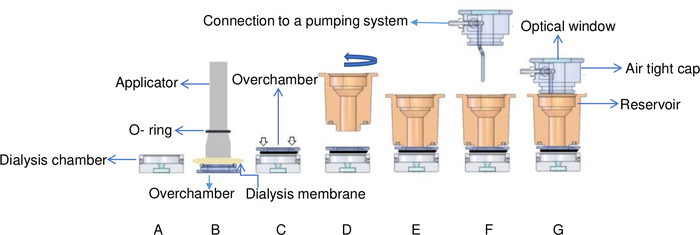
Рисунок 6: Схематический вид контролируемой температурой установки диализа. (A) Образец белка добавляется в камеру диализа. (B) Диализ мембраны фиксируется на overchamber с O-кольцо с помощью аппликатора. (C) Надколенная камера поверевлена и закреплена на верхней части диализной камеры. Белые стрелки указывают, где винты помещаются на overchamber. (D) Камера резервуара по часовой стрелке (E) и фиксируется на верхней части надколенной камеры. (F) Камера резервуара покрыта герметичной крышкой с разъемами к насосной системе и (G) ячейка потока помещается в латунную опору. Эта цифра адаптирована из Junius и др. 8Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
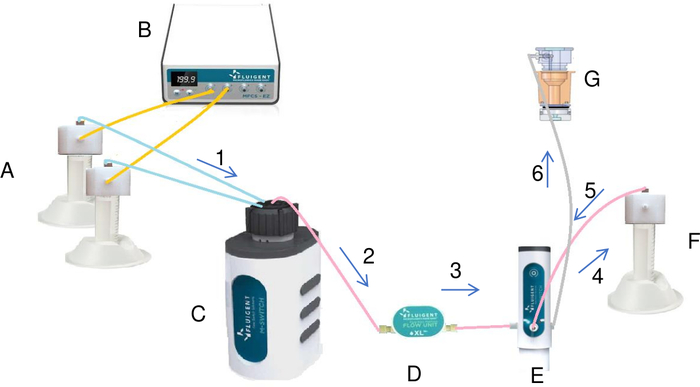
Рисунок 7: Подготовка и инъекция раствора кристаллизации в резервуаре жидкой системой (А). Трубы, содержащие соль и воду, соединены с контроллером давления/вакуума (B) и роторным клапаном (C). Используя давление, контроллер давления/вакуума создает постоянный поток жидкостей из труб к вращающемуся клапану. Каждая жидкость, проходящая через счетчик потока (D), и выключатель вводится в трубку для смешивания (F). После того, как все жидкости были добавлены в трубку для смешивания, переключатель некоторыми модификациями впрыскивает окончательный раствор из трубки смешивания в резервуар (G). Эта жидкость течет через систему в направлении стрелок на диаграмме, отмеченной восходящим порядком (от 1 до 6). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 8: Представление технического обслуживания программного обеспечения надзора. Это представление используется для управления различными параметрами, такими как температура, свет, решение кристаллизации и масштабирование. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
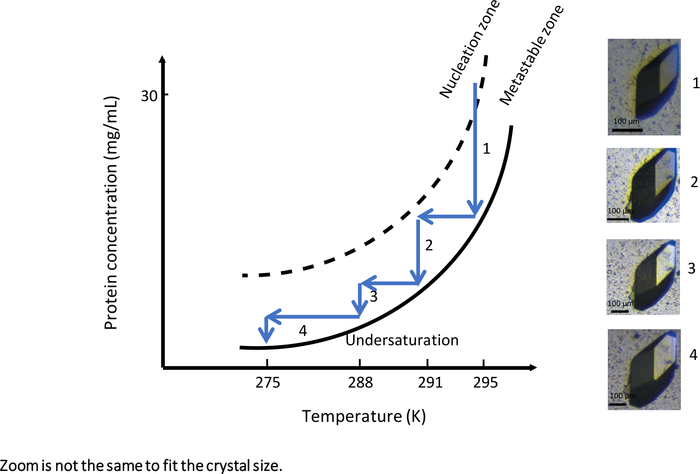
Рисунок 9: Фазовая диаграмма как функция температуры (выбранные изображения должны отслеживаться в порядке возрастания). Один большой кристалл лизозима получается путем систематического изменения температуры с 295 K до 275 K. На каждом шагу кристаллический рост останавливается по достижении кривой solubility. Снижение температуры путем сохранения раствора в метастабиальной зоне перезапускает кристаллический рост. Изображения имеют различные уровни увеличения. Эта цифра адаптирована из Junius и др. 8,18 Пожалуйста,нажмите здесь, чтобы просмотреть большую версию этой цифры.
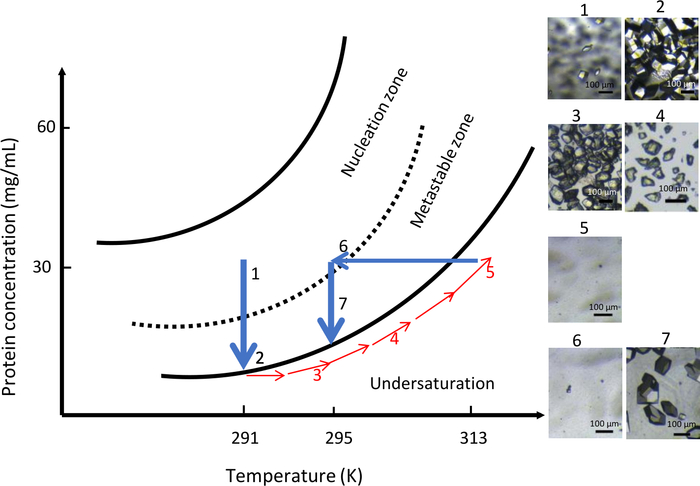
Рисунок 10: Оптимизация роста кристалла при постоянном химическом составе с использованием контроля температуры (выбранные изображения должны отслеживаться в порядке подъема). Начало процесса нуклеации в зоне нуклеации на уровне 291 К, вдали от метастабийной зоны, приводит к образованию многочисленных кристаллов. Повышение температуры до 313 K затем растворяет кристаллы до тех пор, пока видимые ядра не будут замечены в диализной камере. Наконец, снижение температуры до 295 K перезапускает процесс нуклеации во второй раз, что приводит к ограниченному числу больших кристаллов. Эта цифра адаптирована из Junius и др. 8,18 Пожалуйста,нажмите здесь, чтобы просмотреть большую версию этой цифры.
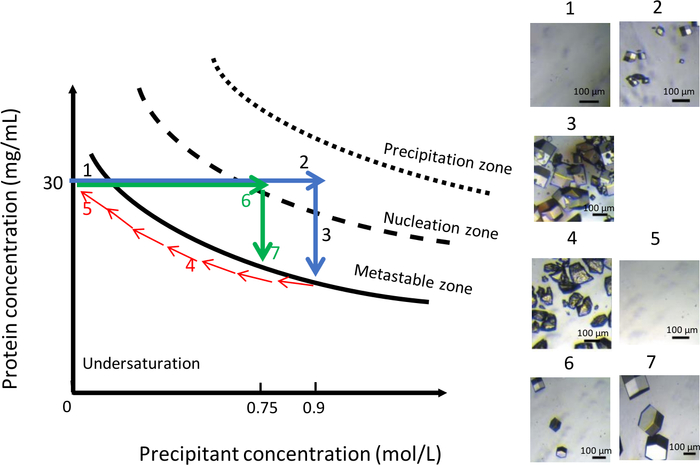
Рисунок 11: Оптимизация роста кристалла при постоянной температуре с использованием колебаний концентрации осадков (выбранные изображения должны отслеживаться в порядке подъема). Снижение концентрации осадков с 0,9 М до 0 М растворяет кристаллы, полученные во время первого нуклеации. Процесс кристаллизации перезапускается путем инъекций того же обрыва, но при меньшей ионной прочности, 0,75 М, что приводит к образованию нескольких более крупных кристаллов. Эта цифра адаптирована из Junius и др. 8,18 Пожалуйста,нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Различные физические, химические и биологические переменные влияют на кристаллизацию белка, влияя на солукостьбелка 21. Среди этих переменных, температура и химический состав раствора кристаллизации используются здесь в сочетании с методом диализа для улучшения и выращивания больших высококачественных кристаллов биокромолекул для исследований нейтронной дифракции. Используя знания фазовых диаграмм, кристаллизация делается более предсказуемой. Хотя скрининг различных условий кристаллизации в серийном подходе также возможен, основная цель использования рациональных подходов заключается в разделении и контроле кинетики кристаллического ядра и роста.
Как и во всех исследованиях кристаллизации, высококачественные чистые и однородные образцы белка, а также решения кристаллизации без пыли увеличивают успешность эксперимента. Фильтрация и центрифугация решений являются важными шагами в описанных протоколах. Зная физикохимические свойства изученных белков, таких как молекулярный вес (выбрать соответствующую мембрану диализа), изоэлектрический момент, и белок solubility имеют решающее значение для разработки оптимального эксперимента роста кристалла. Кроме того, необходимо учитывать стабильность белка при различных температурах или с различными химическими веществами, чтобы предотвратить потерю образца и увеличить вероятность успеха. Учитывая температурный диапазон OptiCrys (233.0-353.0 ± 0.1 K), широкий спектр белков может быть кристаллизован с его помощью. Но стоит подчеркнуть, что белки, которые в первую очередь термостабличный, такие как белки из термофильных источников, выиграют больше всего в контролируемых температурой больших объемов кристаллических экспериментов роста, предлагаемых этим инструментом.
Используя малооъемную диализную камеру (при использовании кнопок OptiCrys) или микродиализа и скрининг нескольких температур и условий кристаллизации (например, сетки резкой концентрации или рН), можно получить информацию о расположении предела метастабиальной зоны (кинетическое равновесие между нуклеацией и метастабильными зонами). Это имеет неоценимое значение при разработке успешного эксперимента по росту кристаллов, особенно для новых кандидатов белка в кристаллизации. Без этой информации эксперименты могут начинаться с области фазовой диаграммы с высокой супернасыщением, слишком далеко от предела метастабиальной зоны, чтобы легко контролировать кристаллическое ядро. Хотя растворение осадка протеина может быть предпринято, например путем увеличивать температуру в случае сразу растворимости, для протеинов с уменьшенной термостабельностью, держать образец на высокой температуре на более длинний период времени может сделать высыпание протеина необратимым. Таким образом, лучшая стратегия состоит в использовании первоначального состояния с более низкой супернасыщенностью, расположенной вблизи предела метеоприбывания, где нуклеацию можно контролировать и избежать выпадения белков. В соответствии с этим, кристаллизация предварительной проверки снижает вероятность того, что белок осаждается в диализной камере и увеличивает скорость успеха эксперимента.
После разработки эксперимента, подготовка диализных камер (OptiCrys) или кнопок микродиализа является еще одним важным шагом. Предотвращение образования пузырьков воздуха в диализной камере/кнопке повышает вероятность успешной кристаллизации, особенно при использовании небольших объемов. Присутствие пузырьков воздуха в диализной камере может также изменить кинетику процесса кристаллизации и уменьшить воспроизводимость эксперимента (потому что контактная поверхность белка/раствора была изменена). На успех эксперимента может повлиять не только белок, но и раствор кристаллизации. Использование новых трубок 50 мл для насосной системы каждый раз, когда один хочет начать новый эксперимент и мытье труб после каждого эксперимента снижает вероятность загрязнения и позволяет избежать создания кристаллов соли в аппарате.
Использование кнопок микродиализа является альтернативой, когда OptiCrys недоступен. Стратегии оптимизации кристаллизации и мониторинга роста кристаллов, упомянутые выше, должны осуществляться вручную. Как правило, это требует назрения за пределами терморегулируемого инкубатора, что может быть проблематичным, когда регулирование температуры является критическим шагом в описанной методологии. Это не облегчает изменение химического состава растворов кристаллизации или мониторинг роста кристаллов с помощью изображений, поэтому процесс роста кристалла не может контролироваться в режиме реального времени.
Знание фазовой диаграммы является основой использования скамейки кристаллизации OptiCrys для систематического выращивания крупных высококачественных кристаллов в автоматическом режиме. Контроль физико-химических параметров, таких как температура, концентрация осадков и рН во время кристаллизации, перемещает равновесие белкового раствора по четко определенной кинетической траектории по фазовой диаграмме. Это дополняется использованием диализной мембраны для регулировки общественного транспорта и создания контролируемого градиента в камере кристаллизации, который влияет на размер и качество кристаллов. Поэтому использование как термодинамических данных, так и кинетических траекторий необходимо для контроля процесса кристаллизации для выращивания высококачественных кристаллов. Благодаря OptiCrys систематические фазовые диаграммы в многомерном пространстве можно изучать с помощью последовательного подхода, используя значительно меньше материала, чем раньше. Чтобы продемонстрировать эту методологию, мы предоставляем здесь пример с моделью белка, куриное яйцо-белый лизозим. Используя и осваивая представленный здесь протокол, можно адаптировать его к реальнымбелковым системам 5,14,17,18.
Раскрытие информации
Авторов нечего раскрывать.
Благодарности
MBS признает поддержку LABEX VALO GRAL по контракту 2015 года. NJ признает CEA Международная докторская исследовательская программа (Irtelis) для phD стипендий. Авторы признают финансирование программы исследований и инноваций «Горизонт 2020» Европейского союза в рамках грантового соглашения Мари Склодовской-Кюри No 722687. Авторы также благодарны д-ру Эско Оксанену (ESS, Lund) и д-ру Джин-Люку Ферреру (IBS, Grenoble) за полезные беседы и идеи. IBS признает интеграцию в Междисциплинарный научно-исследовательский институт Гренобля (IRIG, CEA).
Материалы
| Name | Company | Catalog Number | Comments |
| 200 µl Dialysis Button | Hampton Research | HR3-330 | Dialysis button |
| 24 well plates | Jena Bioscience | CPL-132 | Crystallization plate |
| 2-Switch | FLUIGENT | 2SW001 | Switch |
| 30 μl Dialysis Button | Hampton Research | HR3-324 | Dialysis button |
| 50 mL Corning Centrifuge tubes | Sigma-Aldrich | CLS430828-500EA | Centrifuge tubes |
| Acetic acid | Sigma-Aldrich | S2889 | Chemical |
| Chicken Egg White Lysozyme | Sigma-Aldrich | L6876 | Lyophilized protein powder |
| Dialysis Membrane Discs 6-8 kDa MWCO | Spectrum | 132478 | Dialysis membrane |
| Dialysis Membrane Tubing 6-8 kDa MWCO | Spectrum | 132650T | Dialysis membrane |
| Microcentrifuge | Eppendorf | Minispin | Bench-top centrifuge |
| Flow Unit | FLUIGENT | FLU-XL | Flow meter |
| Flowboard | FLUIGENT | FLB | Flowboard |
| Microfluidic Flow Control System EZ | FLUIGENT | EZ-01000002 | Pressure/vacuum controller |
| MilliporeSigma 0.22 µm syringe Filters | Millipore | GSWP04700 | 0.22 μm pore size filter |
| M-Switch | FLUIGENT | MSW002 | Rotary valve |
| Opticrys | NatX-ray | PRT008 | Crystallization bench |
| Siliconized circle cover slides | Hampton Research | HR3-231 | Glass slides |
| Sodium Chloride ≥ 99% | Sigma-Aldrich | 746398 | Chemical |
| Switchboard | FLUIGENT | SWB002 | Switchboard |
| Thermoregulated incubator | Memmert | IPP30 | Thermoregulated incubator |
Ссылки
- Blakeley, M. P., Langan, P., Niimura, N., Podjarny, A. Neutron crystallography: opportunities, challenges, and limitations. Current Opinion in Structural Biology. 18 (5), 593-600 (2008).
- Snell, E. H., Van Der Woerd, M. J., Damon, M., Judge, R. A., Myles, D. A. A., Meilleur, F. Optimizing crystal volume for neutron diffraction: D-xylose isomerase. European Biophysics Journal. 35 (7), 621-632 (2006).
- Ng, J. D., Baird, J. K., Coates, L., Garcia-Ruiz, J. M., Hodge, T. A., Huang, S. Large-volume protein crystal growth for neutron macromolecular crystallography. Acta Crystallographica Section F:Structural Biology Communications. 71, 358-370 (2015).
- O'Dell, W. B., Bodenheimer, A. M., Meilleur, F. Neutron protein crystallography: A complementary tool for locating hydrogens in proteins. Archives of Biochemistry and Biophysics. 602, 48-60 (2016).
- Oksanen, E., Blakeley, M. P., Bonneté, F., Dauvergne, M. T., Dauvergne, F., Budayova-Spano, M. Large crystal growth by thermal control allows combined X-ray and neutron crystallographic studies to elucidate the protonation states in Aspergillus flavus urate oxidase. Journal of the Royal Society Interface. 6, (2009).
- Krauss, I. R., Merlino, A., Vergara, A., Sica, F. An overview of biological macromolecule crystallization. International Journal of Molecular Sciences. 14 (6), 11643-11691 (2013).
- Chayen, N. E. Comparative Studies of Protein Crystallization by Vapour-Diffusion and Microbatch Techniques. REVIEW Acta Cryst. , (1998).
- Junius, N., Oksanen, E., Terrien, M., Berzin, C., Ferrer, J. L., Budayova-Spano, M. A crystallization apparatus for temperaturecontrolled flow-cell dialysis with real-time visualization. Journal of Applied Crystallography. 49, 806-813 (2016).
- Salemme, F. R. A free interface diffusion technique for the crystallization of proteins for X-ray crystallography. Archives of Biochemistry and Biophysics. 151 (2), 533-539 (1972).
- Chayen, N. E., Saridakis, E. Protein crystallization: From purified protein to diffraction-quality crystal. Nature Methods. 5 (2), 147-153 (2008).
- Otálora, F., Gavira, J. A., Ng, J. D., García-Ruiz, J. M. Counterdiffusion methods applied to protein crystallization. Progress in Biophysics and Molecular Biology. 101 (1-3), 26-37 (2009).
- Garciá-Ruiz, J. M. Counterdiffusion Methods for Macromolecular Crystallization. Methods in Enzymology. 368, 130-154 (2003).
- Budayova-Spano, M., Koruza, K., Fisher, Z. Large crystal growth for neutron protein crystallography. Methods in Enzymology. 634, 21-46 (2020).
- Budayova-Spano, M., Dauvergne, F., Audiffren, M., Bactivelane, T., Cusack, S. A methodology and an instrument for the temperature-controlled optimization of crystal growth. Acta Crystallographica Section D: Biological Crystallography. 63 (3), 339-347 (2007).
- Asherie, N. Protein crystallization and phase diagrams. Methods. 34 (3), 266-272 (2004).
- Astier, J. P., Veesler, S. Using temperature to crystallize proteins: A mini-review. Crystal Growth and Design. 8 (12), 4215-4219 (2008).
- Budayova-Spano, M., et al. A preliminary neutron diffraction study of rasburicase, a recombinant urate oxidase enzyme, complexed with 8-azaxanthin. Acta Crystallographica Section F: Structural Biology and Crystallization Communications. 62 (3), 306-309 (2006).
- Junius, N., Vahdatahar, E., Oksanen, E., Ferrer, J. L., Budayova-Spano, M. Optimization of crystallization of biological macromolecules using dialysis combined with temperature control. Journal of Applied Crystallography. 53 (3), (2020).
- Grimsley, G. R., Pace, C. N. Spectrophotometric Determination of Protein Concentration. Current Protocols in Protein Science. 33 (1), 1-9 (2003).
- McPherson, A., Gavira, J. A. Introduction to protein crystallization. Acta Crystallographica Section F:Structural Biology Communications. 70 (1), 2-20 (2014).
- McPherson, A. Introduction to protein crystallization. Methods. 34 (3), 254-265 (2004).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены