Method Article
Otimização do Crescimento de Cristal para Cristalização Macromolecular de Nêutrons
Neste Artigo
Resumo
Estudos estruturais de biomacromolecules por cristalografia requerem cristais de alta qualidade. Aqui demonstramos um protocolo que pode ser usado pelo OptiCrys (um instrumento totalmente automatizado desenvolvido em nosso laboratório) e/ou botões de microdiálise para o crescimento de grandes cristais de alta qualidade com base no conhecimento do diagrama de fase de cristalização.
Resumo
O uso da cristalografia macromolecular de nêutrons (NMX) está se expandindo rapidamente com a maioria das estruturas determinadas na última década graças à construção de novas linhas de vigas NMX e ao aumento da disponibilidade de software de refinamento de estrutura. No entanto, as fontes de nêutrons atualmente disponíveis para NMX são significativamente mais fracas do que fontes equivalentes para cristalografia de raios-X. Apesar dos avanços neste campo, cristais significativamente maiores sempre serão necessários para estudos de difração de nêutrons, particularmente com a tendência de estudar macromoléculas e complexos cada vez maiores. Melhorias adicionais nos métodos e instrumentação adequados ao cultivo de cristais maiores são, portanto, necessárias para o uso do NMX para expandir.
Neste trabalho, introduzimos estratégias racionais e um banco de crescimento cristalino (OptiCrys) desenvolvido em nosso laboratório que combina observação em tempo real através de uma câmera de vídeo montada em microscópio com controle automatizado preciso de soluções de cristalização (por exemplo, concentração precipitante, pH, aditivo, temperatura). Em seguida, demonstramos como esse controle da temperatura e da composição química facilita a busca por condições ideais de cristalização usando proteínas solúveis do modelo. O conhecimento completo do diagrama da fase de cristalização é crucial para a seleção da posição inicial e do caminho cinético para qualquer experimento de cristalização. Mostramos como uma abordagem racional pode controlar o tamanho e o número de cristais gerados com base no conhecimento de diagramas de fase multidimensional.
Introdução
Compreender a relação estrutura-função das proteínas e o mecanismo das vias fisiológicas muitas vezes depende de conhecer as posições dos átomos de hidrogênio (H) e como a carga é transferida dentro de uma proteína1,2. Uma vez que os átomos de hidrogênio dispersam os raios-X fracamente, suas posições só podem ser determinadas com dados de difração de raios-X de alta resolução (>1 Å)3,4. Por outro lado, a cristalografia de nêutrons pode ser usada para obter uma posição precisa dos átomos de hidrogênio em macromoléculas biológicas como hidrogênio e deutério (H2, isótopo de hidrogênio) os átomos têm comprimentos de dispersão de magnitude aproximadamente igual como oxigênio, nitrogênio e carbono5. No entanto, o fluxo de nêutrons de fontes de nêutrons disponíveis é mais fraco que o dos feixes de raios-X, por isso isso deve ser compensado muitas vezes por2,3. Isso pode ser conseguido trocando H por H2 e/ou aumentando o volume de cristais para reduzir a dispersão incoerente de hidrogênios e aumentar a relação sinal-ruído de imagens de difração.
Existem várias abordagens de cristalização (o diagrama de fase esquemática correspondente é mostrado na Figura 1) para a obtenção de cristais de grande e alta qualidade tanto para a cristalografia biomolecular de raios-X quanto para o biomolecular de nêutrons6. Na difusão de vapor, uma gotícula preparada a partir de uma mistura de uma proteína e uma solução de cristalização é equilibrada ao longo do tempo, através da evaporação de água ou outras espécies voláteis, contra um reservatório contendo uma maior concentração de precipitante da mesma solução de cristalização. O aumento da concentração de proteína e precipitante na gotícula leva à supersaturação necessária para a nucleação espontânea, seguida pelo crescimento cristalino nesses núcleos6,7. Embora a difusão de vapor seja a técnica mais utilizada para o cultivo de cristais4,o processo de cristalização não pode ser precisamente controlado8. No método de difusão de interface livre, a solução de cristalização se divide em uma solução proteica concentrada, direcionando lentamente o sistema para a supersaturação. Este método pode ser considerado como um método de lote com uma taxa de mistura lenta6,9,10,11,12. No método do lote, a proteína é rapidamente misturada com uma solução de cristalização que leva à supersaturação rápida e, por sua vez, nucleação uniforme com muitos cristais3,7. Este método representa aproximadamente um terço de todas as estruturas atualmente depositadas no Protein Data Bank. O método de diálise também é usado para o cultivo de cristais proteicos de alta qualidade e bem difração. No método de diálise, moléculas de precipitantes difusam de um reservatório através de uma membrana semi-permeável em uma câmara separada com a solução proteica. A cinética do equilíbrio depende de vários fatores, como temperatura, tamanho dos poros de membrana, e o volume e concentração de amostras de proteínas e agentes de cristalização6.
Diagramas de fase de cristalização podem ser usados para descrever diferentes estados de uma proteína em função de diferentes variáveis físicas ou químicas3. Conforme ilustrado na Figura 1,cada técnica de cristalização pode ser visualizada como utilizando uma trajetória cinética diferente para alcançar a nucleação e zonas metastáveis de tal diagrama6,10,13. Isso fornece informações sobre a solubilidade da proteína e a concentração proteica na qual se observa um equilíbrio termodinâmico entre cristal e solução, encontrando assim as condições ideais para a nucleação e o crescimento3,14. Em um diagrama de fase bidimensional, a concentração proteica é traçada em função de uma variável e as outras variáveis são mantidas constantes15. Em tal diagrama de fase, quando a concentração proteica está abaixo da curva de solubilidade, a solução está na região subsaturada e não ocorre nucleação ou crescimento cristalino. Acima desta curva está a zona de supersaturação onde a concentração proteica é maior do que o limite de solubilidade3,14. Isso é ainda dividido em três regiões: a zona metastável, a zona de nucleação espontânea e a zona de precipitação. Na zona metastável, a supersaturação não é suficiente para que a nucleação ocorra dentro de um tempo razoável, mas o crescimento de cristais semeados pode ocorrer. A agregação e precipitação são favorecidas na zona de precipitação, onde a supersaturação é muito alta14,15.
Quando a supersaturação suficiente para a nucleação espontânea for alcançada, os primeiros núcleos aparecerão10. O crescimento dos cristais leva a uma redução na concentração proteica até que o limite de solubilidade seja atingido. Enquanto a supersaturação permanecer nas proximidades da curva de solubilidade, não haverá mudança significativa no tamanho dos cristais. No entanto, tem-se demonstrado que as variações na temperatura e na composição química da solução de cristalização (por exemplo, a concentração de precipitantes) afetarão a solubilidade proteica e podem levar ao início de um crescimento cristalino adicional8,13,16.
Como a diálise é vantajosa para o crescimento de cristal de boa qualidade, o banco de cristalização OptiCrys ilustrado na Figura 2,foi projetado e desenvolvido em nosso laboratório para controlar a cristalização de forma totalmente automatizada8. Para isso, foi escrito um software com o LabVIEW que permite o controle e o monitoramento da temperatura de uma instalação de diálise de reservatórios em contato com elementos Peltier, através de um controlador eletrônico e um refrigerador. O mesmo software também regula automaticamente a composição química da solução de cristalização (por exemplo, a troca de agentes de cristalização) utilizando um sistema fluido multicanal. Além disso, uma câmera digital e um microscópio invertido são usados para visualizar e registrar o processo de cristalização. Duas câmaras de cristalização com volumes de 15 μL e 250 μL estão disponíveis para o cultivo de cristais para diferentes propósitos. Como o processo de cristalização é reversível, a triagem para diferentes condições é possível com apenas alguns microliters da solução proteica, desde que a amostra não seja danificada8. Como resultado, o uso deste método minimiza a quantidade de material proteico utilizado.
A partir do trabalho anterior8,é evidente que durante o processo de crescimento do cristal, observações in situ precisam ser realizadas em intervalos de tempo regulares. Estes podem variar de alguns segundos a vários dias, dependendo do evento sob observação (precipitação, nucleação ou crescimento cristalino).
A otimização do crescimento de cristal com OptiCrys é baseada em diagramas de fase de concentração precipitantes de temperatura. No caso de proteínas com solubilidade como função direta da temperatura, é possível fazer uso do regime de salgadinho18. É aí que o aumento da força iônica da solução, que pode ser visualizada usando diagramas de fase proteica-precipitante, diminui a solubilidade da proteína. Da mesma forma, proteínas com solubilidade inversa podem fazer uso do regime de salgagem18. A nucleação ocorre na zona de nucleação, nas proximidades da zona metastável, e o crescimento cristalino ocorre então na zona metastável do diagrama de fase até que a concentração proteica atinja o limite de solubilidade. Como mostrado na Figura 3A,com temperatura constante de composição química pode ser diminuída para manter a solução de cristalização na zona metastável para evitar novas nucleações. Os cristais crescem até que o segundo equilíbrio cristal/solução seja alcançado e, depois disso, não se observa mais aumento no tamanho dos cristais. A temperatura é diminuída várias vezes até que os cristais atinjam o tamanho desejado. Na Figura 3B,em temperatura constante, o aumento da concentração precipitante mantém a solução na zona metastável. Este processo pode então ser repetido várias vezes para obter cristais grandes. Alterar a temperatura e manipular as condições da solução de cristalização, controlando os níveis de supersaturação, são duas ferramentas poderosas para separar a nucleação e o crescimento de cristais controlados com precisão e automaticamente pelo OptiCrys5,8,14.
Exemplos de cristais proteicos cultivados pela cristalização controlada pela temperatura, ou cristalização controlada pela temperatura e precipitação, bem como dados relativos de difração obtidos estão disponíveis na literatura e PDB. Entre eles estão γ-cristalina humana E, lectina PA-IIL, pirofosfatase inorgânica da levedura, oxidase útero, anidratose carbonic humana II, YchB quinasase e lactato desidrogenase5,14,17,18.
Embora o OptiCrys tenha sido comercializado pelo NatX-ray, existem muitos laboratórios que não têm acesso a este instrumento ou à abordagem serial que oferece. A alternativa para esta técnica é usar botões de microdiálise plástica disponíveis comercialmente com vários volumes. Utilizando estes, a temperatura e a composição química podem ser ajustadas e variadas manualmente. A inspeção de botões de microdiálise não pode ser feita in situ e deve ser feita manualmente com um microscópio óptico. O controle de temperatura pode ser alcançado mantendo a amostra em uma incubadora controlada pela temperatura livre de vibração. É essencial manter a temperatura constante para garantir que os experimentos de cristalização sejam reprodutíveis. Variação significativa na temperatura também pode levar a danos ou destruição de cristais5.
Aqui fornecemos um protocolo detalhado descrevendo a preparação da amostra e o uso de software de controle para o crescimento de cristais grandes e de alta qualidade adequados para cristalografia de proteína de nêutrons. Este procedimento passo a passo foi projetado para aproveitar o diagrama de fase de cristalização, a fim de selecionar uma posição inicial e caminho cinético para controlar o tamanho e a qualidade dos cristais gerados. Além disso, é apresentado um protocolo detalhado para o cultivo de cristais com botões de microdiálise que usa a mesma lógica para obter cristais grandes e de alta qualidade.
Protocolo
1. Método de diálise com botões de microdiálise
- Preparação da amostra
- Prepare a solução proteica dissolvendo 30 mg de lisezina branca de frango como pó liofilizado em 1 mL de tampão CH3COONa (acetato de sódio de 100 mM, pH 4) a fim de obter uma solução com uma concentração final de 30 mg·mL-1.
- Centrifugar a amostra nos 13.000 × g por 10 min a 277 K. Esse processo ajuda a remover quaisquer agregados antes de iniciar o processo de cristalização.
- Verifique a absorvência da amostra em 280 nm e calcule a concentração de proteína usando a equação beer-lambert (A= εcl).
NOTA: De acordo com a equação beer-lambert, a absorvância eletrônica (A) é diretamente proporcional à concentração (c, mg·mL-1) de uma espécie absorvente dada uma constante comprimento óptico (l, cm). O gradiente dessa relação linear é o coeficiente de extinção molar (ε, para lisozima a 280 nm é de 2,64 mL·mg−1·cm−1)19. As sidechains de aminoácidos aromáticos (tyrosina, triptofano e fenilalanina) e ligações de dissulfeto entre resíduos de cisteína têm forte absorção a ~280 nm decorrentes de transições espectroscopicamente permitidas π – π*. Como a maioria das proteínas contêm esses resíduos, a concentração de proteínas pode normalmente ser calculada facilmente medindo a absorvância em 280 nm, dado o conhecimento do coeficiente de extinção. - Preparar soluções de cristalização como mostrado na Figura 4. Filtre todas as soluções de estoque com filtros Millipore de 0,22 μm antes de preparar a solução de cristalização.
- Crescimento de cristal
- Corte uma membrana de diálise de celulose com corte de peso molecular apropriado (6-8 kDa) e mergulhe-a em água destilada.
NOTA: Os discos de membrana de diálise estão disponíveis comercialmente para botões de microdiálise, mas se o tubo de diálise for usado, não se esqueça de cortar as bordas para separar as duas camadas de membrana do tubo para ter apenas membranas de camada única. - Encha os poços de uma bandeja de 24 poços com 2 mL de solução de cristalização na mesma ordem mostrada na Figura 4.
NOTA: Se forem utilizados botões com volumes maiores (por exemplo, 200 μL), encha tubos de 50 mL com uma solução de cristalização mínima de 5 mL, a fim de garantir uma troca eficiente. - Adicionar/Pipeta 35 μL de solução de lise à câmara do botão de microdiálise como ilustrado na Figura 5A.
NOTA: Para evitar a formação de bolhas de ar em um botão de diálise de 30 μL quando estiver fechada, deve-se adicionar um volume extra (volume morto) de 5 μL de proteína adicional, o que significa um total de 35 μL de amostra de proteína. Esta amostra de proteína adicional cria uma forma ligeiramente domada no topo da câmara, como mostrado na Figura 5B,que impede a formação de bolhas de ar. - Pegue um aplicador do tamanho apropriado e coloque o elástico O-ring em sua extremidade (Figura 5C). Em seguida, coloque a membrana, antes levemente limpa/drenada usando um pedaço de papel livre de fibras, em cima da câmara do botão de diálise. Tenha cuidado para não colocar poeira na câmara ao aplicar o papel. Coloque a membrana de diálise no lugar transferindo o anel O elástico do aplicador para o sulco do botão de diálise(Figura 5C).
NOTA: O momento crítico do manuseio é fixar a membrana de diálise no topo da câmara, transferindo o elástico O-ring do aplicador para o sulco do botão de diálise. Todos os movimentos devem ser perfeitamente sincronizados para evitar o envolção de bolhas de ar com a amostra na câmara de proteínas. É útil praticar o alongamento do elástico O-ring antes de sua aplicação para saber sua rigidez, usar pinças para segurar parte da membrana durante sua aplicação e realizar os primeiros experimentos de teste com uma proteína modelo. - Transfira o botão para o poço ou para o tubo de 50 mL usando pinças(Figura 5D).
- Cubra o poço com uma mancha de cobertura, pressionando-o suavemente sobre a graxa para selar o poço(Figura 5E).
NOTA: Se não houver graxa em cima dos poços, certifique-se de adicionar isso antes de iniciar o experimento ou usar um pedaço de fita em vez de tampa de vidro. O princípio da cristalização proteica utilizando botões de microdiálise é ilustrado na Figura 5. - Mantenha a amostra em 293 K em uma incubadora termoregulada. Diferentes temperaturas podem ser necessárias de acordo com as condições de proteína e cristalização utilizadas.
NOTA: A mesma grade de condições de cristalização mostrada na Figura 4 (permitindo que a concentração de precipitante seja variada) pode ser rastreada em função da temperatura. Nesse caso, a mesma placa de cristalização deve ser reproduzida e cada cópia deve ser colocada em uma incubadora regulada a uma temperatura diferente. Isso requer ter várias incubadoras termoreguladas sem vibração disponíveis. - Verifique a bandeja ou tubos em busca de cristais(Figura 4) e tome notas regularmente, normalmente diariamente, para distinguir o que está em cada bandeja. Boas notas são essenciais para evitar resultados falsos positivos e discriminar a poeira dos cristais.
- Corte uma membrana de diálise de celulose com corte de peso molecular apropriado (6-8 kDa) e mergulhe-a em água destilada.
2. Processo de crescimento de cristal usando OptiCrys
- Preparação da amostra
- Prepare uma solução proteica e uma membrana de diálise conforme descrito na seção 1.1.
- Prepare as soluções de estoque de NaCl (4 M) e de CH3COONa pH 4 (1 M) e filtre-as em tubos de 50 mL.
- Adicione a solução proteica (15 μL de lysozyme com 30 mg·mL-1) à câmara de diálise da configuração de diálise do reservatório de fluxo controlado pela temperatura. Consulte a Figura 6 para obter detalhes sobre a configuração da diálise do reservatório de fluxo controlado pela temperatura. O OptiCrys possui duas câmaras de diálise, o volume mínimo é de 15 μL e o volume máximo é de 250 μL.
- Cubra a sobrecâmara com uma membrana de diálise e fixe a membrana com o elástico O-ring(Figura 6B).
NOTA: Esta configuração é diferente dos botões de microdiálise onde cada câmara é selada diretamente por uma membrana de diálise. Na célula de fluxo, a membrana de diálise é fixada à caixa de câmara permitindo a montagem de cristais sem sua remoção. Para isso, a supercâmara pode simplesmente ser desparafusada do reservatório. - Vire a câmara e coloque-a em cima da câmara de diálise. Pressione-o lentamente e suavemente para remover todo o ar preso entre as duas peças e evitar bolhas na câmara(Figura 6C). A prática com uma proteína modelo pode ser vantajosa ao treinar para evitar bolhas de ar e perda de amostras.
- Fixar o reservatório em sua posição, aparafusando-o suavemente em cima da câmara, novamente sendo consciente para evitar prender bolhas de ar. O excesso de aperto do reservatório também pode formar bolhas na câmara de cristalização(Figura 6D).
- Adicione a solução de cristalização e cubra a câmara do reservatório com a tampa hermética. (Figura 6G). O volume máximo do reservatório é de 1 mL.
- Transfira esta montagem e insira-a no suporte de latão. Este suporte está em contato com elementos Peltier que são usados para controlar a temperatura.
- Conforme ilustrado na Figura 6,a tampa hermética é equipada com uma janela óptica para permitir a iluminação superior da câmara de diálise. Coloque a fonte de luz(Figura 2)na janela permitindo que a luz passe pela câmara.
- A câmara do reservatório pode ser conectada a uma bomba para permitir que funcione como uma célula de fluxo contínuo. Conecte a tubulação em cima dos tubos de 50 mL que contêm as soluções de estoque e água destilada à válvula rotativa, conforme ilustrado na Figura 7.
NOTA: Se a preparação automática e a troca de soluções de cristalização não forem desejadas durante o experimento, omiti a etapa 2.1.10. Nesse caso, a solução de cristalização deve ser preparada e o reservatório pré-preenchido manualmente.
- Software
- Ligue o computador e inicie o software Croissance cristalline [Crescimento de cristal]. Este software de controle é escrito com o LabVIEW (http://www.ni.com/labview/) e oferece uma interface gráfica amigável. Inclui 4 interfaces gráficas diferentes (Accueil [Bem-vindo], Paramétrage [Configuração], Essai [Teste], e Manutenção [Manutenção](Figura 8).
NOTA: As traduções do francês estão entre parênteses. - Selecione a exibição manutenção clicando no botão como ilustrado na Figura 8. Esta visão é atualmente a mais usada e permite que os usuários controlem a maioria dos parâmetros durante o experimento.
NOTA: Depois de clicar na exibição Manutenção, uma nova janela com diferentes seções para controlar parâmetros como temperatura ou luz aparecerá. Na Figura 8 diferentes partes desta vista são mostradas com setas e quadros. Nas etapas seguintes, demonstramos como cada parâmetro é controlado usando o software. - A seção Régulateur de température [controlador de temperatura] permite o controle e o monitoramento da temperatura. Clique no botão, número um (1) na Figura 8, para ligá-lo.
NOTA: A faixa de temperatura no OptiCrys é de 233,0 – 353,0 ± 0,1 K. - Defina a temperatura na seção consigne [setpoint] e pressione enter(Figura 8(2)). Abaixo deste botão, há um gráfico com 2 traços (vermelho e amarelo). O traço vermelho mostra a temperatura final (ordenada) e o traço amarelo mostra a temperatura atual. Como mostrado na Figura 8(2), a temperatura é fixada em 20 °C.
NOTA: Para cultivar um cristal, como explicado na seção de crescimento de cristais, muitas temperaturas precisarão ser escolhidas. Para alterar a temperatura, adicione cada nova temperatura na seção consignar [setpoint] e pressione o botão Enter no teclado. - Acenda a luz aumentando a luminosidade da seção Lumières [Luzes] na Figura 8. Luminosidade varia de 0 a 100, "0" indica que a luz está desligada e em "100" a luz é definida para o máximo de intensidade e brilho. Aumentando a luz, na seção microscópio, pode-se ver dentro da câmara de diálise. Durante o experimento, o brilho na célula pode variar; ajustar os parâmetros para visualizar claramente dentro da câmara de diálise. A ampliação também pode ser aumentada ou diminuída usando os + e – botões na frente do "zoom" para melhor visualização.
- No lado direito da seção Microscópio, existem várias seções para armazenar informações relevantes para cada experimento de cristalização. Cada usuário pode criar uma pasta para armazenar informações sobre condições de cristalização, nomes de proteínas e o corte de peso molecular da membrana de diálise utilizada(Figura 8(3)).
- O usuário pode definir um nome para o experimento simplesmente digitando-o no Dossiê Nom [nome da pasta]. Clicar no dossiê [botão Pasta] (mostrado com um quadro verde na Figura 8) abre uma nova janela. Nesta janela, haverá um arquivo de texto que contém todas as informações definidas para o experimento. Além disso, imagens carimbadas por tempo são salvas nesta pasta para processamento futuro.
- Na seção NB Images, selecione o número de imagens que devem ser tiradas durante o experimento. Especifique o número das imagens no painel direito, juntamente com o intervalo de tempo desejado entre elas (por exemplo, min, hora, dia). A Figura 8 mostra a configuração do software para gravar zero imagens em um minuto.
NOTA: Use a seção Pompe [Bomba] para misturar soluções de estoque e injetar solução de cristalização na câmara do reservatório. Consulte a seção 2.1.10 e a Figura 7 para uma explicação do princípio do sistema de mistura de fluidos. - Concentrações de insumos das soluções de estoque em Etape 1 [Passo 1]: estoques de soluções. Para o experimento de cristalização na próxima seção, serão utilizados NaCl 4 M e CH3COONa 1 M pH 4.
NOTA: As concentrações de soluções de estoque estão em unidades molares. - Defina a concentração final de cada solução. Por exemplo, 0,75 M para NaCl e 0,1 M para CH3COONa pH 4. Insira-os na seção de concentração final (Figura 8) no Etape 2 [Passo 2]: solução à préparer [solução para preparar]. Pressione o botão Cálculo [Computação], que é mostrado com um quadro vermelho na Figura 8. O volume final de cada solução de estoque que será usada na mistura será exibido no painel de volume em frente a cada painel de concentração.
- Pressione o botão Lancer préparation [Preparação de lançamento] (Figura 8). Conforme ilustrado na Figura 7,a válvula rotativa pega cada solução de estoque e as injeta no tubo de mistura através de um interruptor.
- Após a solução de cristalização ter sido preparada, clique no botão Entrada [Entrada de Solução] na Etape 3 [Passo 3]: Fluxo da seção da bomba (quadro amarelo na Figura 8). O interruptor muda para injetar a nova solução de cristalização da mistura do tubo na câmara do reservatório. Para interromper o processo de troca, pressione o botão Arrêt distribuição [Distribution Stop].
NOTA: Observe o processo de cristalização durante o experimento e modifique parâmetros como temperatura, solução de cristalização e zoom, na interface gráfica correspondente do software de supervisão. Ao usar o software não há necessidade de remover a tampa hermética ou a célula de fluxo durante o experimento, de modo que a única variável será a que o usuário muda através do software.
- Ligue o computador e inicie o software Croissance cristalline [Crescimento de cristal]. Este software de controle é escrito com o LabVIEW (http://www.ni.com/labview/) e oferece uma interface gráfica amigável. Inclui 4 interfaces gráficas diferentes (Accueil [Bem-vindo], Paramétrage [Configuração], Essai [Teste], e Manutenção [Manutenção](Figura 8).
- Grande crescimento de cristais
- Adicione 15 μL de lise com concentração de 30 mg·mL-1 à câmara de diálise(Figura 6A).
NOTA: Prepare a amostra de proteínas conforme descrito na seção 1.1. - Monte a configuração de diálise do reservatório de fluxo controlado pela temperatura, conforme descrito nas seções 2.1 e Figura 6.
- Prepare a solução de cristalização. Não se esqueça de filtrar todas as soluções de estoque antes da preparação da amostra com filtros de 0,22 μm. Para este experimento, a solução de cristalização contém 0,75 M NaCl e 0,1 M CH3COONa pH 4. Isso pode ser adicionado manualmente ou usando a câmara do reservatório e o sistema de bombeamento, conforme descrito nas seções 2.2.10 a 2.2.12.
- Defina a temperatura para 295 K conforme explicado nas seções 2.2.3 e 2.2.4 e mostrada na Imagem 8. Em condições iniciais, o equilíbrio entre a câmara de diálise e o reservatório será atingido após aproximadamente 90 minutos e os primeiros núcleos visíveis aparecerão após 22 horas.
- Permitir que os cristais cresçam até que não sejam observadas alterações mais visíveis no tamanho dos cristais(Figura 9, painel 1).
NOTA: Para determinar o tempo de nucleação e medir a variação do tamanho dos cristais, grave imagens a cada 15 ou 20 minutos, que são respectivamente 4 ou 3 imagens por hora na seção NB Images. Para observação in situ de desnaturação de proteínas, agregação e precipitação ou dissolução ou nucleação de cristal, normalmente entre alguns segundos a algumas dezenas de minutos são necessários. No entanto, para o crescimento do cristal, este intervalo é entre alguns minutos a algumas horas. - Depois de três dias, reduza a temperatura para 291 K para reiniciar o crescimento do cristal. Mantenha a temperatura constante e deixe o cristal se desenvolver(Figura 9, painel 2). Para esta etapa do experimento, será suficiente gravar imagens a cada 2 horas e verificar a cada 10 a 12 horas qualquer alteração no tamanho dos cristais. O experimento pode ser continuado se nenhuma alteração no tamanho dos cristais for observada.
NOTA: Dependendo das concentrações proteicas e precipitantes na solução de cristalização e dos volumes de proteínas utilizadas, o tempo necessário para alcançar o equilíbrio para cada etapa pode variar. - Diminua a temperatura para 288 K para reiniciar o crescimento do cristal. Na condição experimental do caso aqui apresentado, um dia é suficiente para alcançar o equilíbrio (Figura 9, painel 3).
- Verifique o tamanho dos cristais e mantenha uma temperatura constante enquanto o cristal continuar a crescer.
- Após 4 dias, diminua a temperatura para 275 K para reiniciar o crescimento do cristal(Figura 9, painel 4).
– Nas condições experimentais do caso apresentado, após cerca de 10 dias será obtido um cristal de 500 μm em uma dimensão (Figura 9).
- Adicione 15 μL de lise com concentração de 30 mg·mL-1 à câmara de diálise(Figura 6A).
- Controlando o tamanho do cristal
- Prepare uma solução proteica e a diálise do reservatório de fluxo controlado pela temperatura, configurada como descrito nas seções 2.3.1 e 2.3.2.
- Prepare soluções de cristalização com 0,9 M NaCl e 0,1 M CH3COONa pH 4.
- Coloque a temperatura em 291 K e permita que os cristais cresçam. Em condições iniciais, o primeiro evento de nucleação começará após cerca de uma hora e inúmeros cristais crescerão na câmara de diálise por três horas(Figura 10, passos: 1 e 2). Grave imagens a cada 20 minutos para verificar o tamanho dos cristais durante o processo de crescimento.
NOTA: A otimização das condições de cristalização é crucial para controlar a maioria das propriedades finais dos cristais gerados. A temperatura e a composição química das soluções de cristalização podem ser alteradas para dissolver e reesculir cristais de tamanho uniforme. Deve-se notar também que uma amostra de proteína não é consumida em tal experimento, pois as condições podem ser revertidas para re dissolver a amostra desde que não seja desnaturada. Ao dissolver cristais alterando a temperatura e mantendo a composição química constante, continue o experimento da seguinte forma: - Uma vez que os cristais tenham crescido a 291 K, estes podem ser dissolvidos para reesculirem menos cristais maiores. Aumente a temperatura gradualmente acima de 20 minutos para chegar a 313 K. Leva cerca de uma hora para dissolver todos os cristais dentro da câmara de diálise(Figura 10, passos: 3-5). Grave imagens a cada 5 a 15 minutos para monitorar o processo de dissolução.
NOTA: Muitas proteínas são sensíveis a altas temperaturas. Certifique-se de trabalhar dentro da faixa de temperatura onde a proteína é estável para evitar qualquer dano/desnaturação. Além da solubilidade da proteína, a temperatura também afeta a solução tampão. Por exemplo, o pH do buffer pode mudar com a temperatura, especialmente no buffer Tris. Nesse caso, é crucial definir o pH de acordo com a temperatura em que o experimento é realizado18. Deve-se notar também que a dissolução de proteínas leva significativamente menos tempo (de alguns minutos a algumas horas) em comparação com o crescimento de cristais proteicos (de algumas horas a poucos dias). Em geral, durante a dissolução dos cristais, a temperatura aumenta gradual e lentamente (respeitando o curto tempo de dissolução total), principalmente no caso de dissolução parcial dos cristais para evitar o aumento da mosaico cristalina. Quando os cristais estão crescendo, a temperatura pode diminuir rapidamente (em menos de um minuto) até a temperatura definida (respeitando o longo tempo de crescimento total). O monitoramento regular da câmara de cristalização por meio da gravação de imagens é aconselhável para evitar danos à proteína e ajudar a definir o momento ideal para dissolução ou crescimento de cristais para cada proteína estudada. - Afinal, os cristais se dissolveram, a temperatura é de 295 K para iniciar um segundo evento de nucleação(Figura 10, passos: 6,7). Grave imagens a cada 5 minutos para monitorar o segundo processo de nucleação. Nesta etapa, os primeiros núcleos aparecem após cerca de 18 minutos.
NOTA: Nesta temperatura, a solução estará na zona de nucleação, nas proximidades da zona metastável. Como resultado, apenas alguns núcleos aparecerão na câmara de cristalização. - Continue o experimento repetindo o fluxo de trabalho de otimização descrito na seção 2.3 para o cultivo de cristais maiores. A duração total do experimento representado na Figura 10 é de apenas alguns dias.
NOTA: Se durante a fase de nucleação os cristais aparecerem em momentos diferentes, cristais de diferentes tamanhos são obtidos na câmara de cristalização. Nesse caso, o aumento da temperatura (no caso de proteínas com solubilidade direta) resultará em dissolução mais rápida dos cristais menores. Dependendo do efeito de amadurecimento cinético, a proteína extra (adquirida com a dissolução) pode então ser usada para o crescimento dos cristais maiores.
Ao dissolver cristais em temperatura constante alterando a composição química da solução de cristalização, continue o experimento da seguinte forma:
Também é possível dissolver cristais cultivados anteriormente alterando a composição química da solução de cristalização durante o experimento para reesculir uma população de cristais de tamanho uniforme sob novas condições. - Prepare a solução proteica (2.3.1), a configuração de diálise do reservatório de fluxo controlado pela temperatura (2.1) e a solução de cristalização (2.4.2) conforme descrito acima. Em condições iniciais na zona de nucleação longe da zona metastável, numerosos cristais pequenos aparecerão na câmara de cristalização e começarão a crescer (Figura 11, passos: 1,2).
- Após três horas, quando muitos cristais de tamanho médio são visíveis na câmara de cristalização(Figura 11, passo: 3), diminuem gradualmente a concentração de NaCl (0,9 M) para atingir zero. Para isso, prepare uma nova solução de cristalização contendo apenas solução tampão com 0,1 M CH3COONa pH 4. Use o sistema de bombeamento para trocá-lo com a solução de cristalização na câmara do reservatório. Siga os passos 2.2.10 a 2.2.12 para a preparação e injeção de uma nova solução na câmara do reservatório. Com esta nova solução, quando as soluções são trocadas a concentração de NaCl diminui na câmara até que a solução final na câmara do reservatório contenha não mais do que 0,1 M de CH3COONa pH 4 e sem NaCl. Capture imagens a cada 10 minutos para registrar o processo de dissolução.
- Deixe os cristais dissolverem completamente(Figura 11, passos: 4,5). O tempo de dissolução é de cerca de duas horas para este experimento. Como mencionado anteriormente, o tempo de dissolução depende do sistema proteico, das condições de cristalização e do volume da câmara de diálise utilizada. A observação regular da câmara de cristalização (ver seção microscópio) e a gravação de imagens e notas durante o experimento são essenciais.
- Quando todos os cristais dentro da câmara forem dissolvidos(Figura 11, passo: 5), use novamente o sistema de bombeamento para preparar uma nova solução de cristalização injetando NaCl em uma concentração menor do que a anterior (0,75 M NaCl em 0,1 M CH3COONa pH 4).
- Injete a nova solução na câmara do reservatório (Figura 11, etapas: 6,7) e repita o fluxo de trabalho de otimização do crescimento da cristalização, conforme descrito na seção 2.3. Uma população uniforme de cristais maiores será gerada. Os resultados apresentados na Figura 11 foram obtidos após alguns dias.
Resultados
Nas Seções 2.3 e 2.4, são apresentados três exemplos de crescimento otimizado de cristais, mostrando uso do instrumento e um design experimental para o cultivo de cristais grandes. Para esta demonstração, temos usado a lysozyme como uma proteína modelo, embora experimentos de crescimento de cristais tenham sido realizados com sucesso com muitos outros sistemas proteicos usando este método (ver acima). Usando e dominando o protocolo aqui apresentado pode-se adaptá-lo para outros candidatos à proteína.
Na seção 2.3 demonstramos que estratégias de cristalização racional estabelecidas poderiam ser benéficas no cultivo de cristais com volumes suficientes de dispersão para cristalografia de proteínas de nêutrons. Aqui, demonstramos que as estratégias racionais de otimização propostas também permitem a geração de uma população uniforme de cristais de qualquer tamanho específico necessário para abordagens de determinação da estrutura a jusante.
Esses dois experimentos são projetados para enfatizar a importância dos diagramas de fase no controle da nucleação e crescimento de cristais. Aqui, o controle da temperatura e da composição química das soluções de cristalização em combinação com o monitoramento do processo de cristalização em tempo real são utilizados para estudar o diagrama de fase qualitativa. Usando este método, a nucleação e o crescimento cristalino podem ser otimizados racionalmente de forma reversível. O uso de tal abordagem serial também reduz a quantidade de proteína e o tempo necessário para controlar o tamanho e a qualidade dos cristais.
No método de diálise, uma solução proteica é separada de uma solução de cristalização por uma membrana semi-permeável6 (Figura 5). Essa membrana de diálise permite que pequenas moléculas como aditivos, tampão e íons passem pela membrana, mas não macromoléculas como as proteínas6,20. Este recurso permite que a solução de cristalização seja modificada durante o curso do experimento6. A troca da solução pode ser feita manualmente, por exemplo, em botões de microdiálise, ou de forma automatizada usando um instrumento desenvolvido para este fim, OptiCrys8.
No primeiro conjunto de experimentos, botões de microdiálise foram usados para a cristalização da lise branca de ovo de galinha. Os botões de microdiálise foram imersos em soluções de cristalização com diferentes concentrações de sal. Neste simples experimento de rede de cristalização, a única variável é a concentração precipitante, enquanto a temperatura é mantida constante (293 K). Como mostrado na Figura 4,pequenas variações na concentração de sal induzem uma mudança no tamanho e número de cristais observados, permitindo a investigação do diagrama da fase de cristalização. Na Figura 4, painel 1, a solução de cristalização contém 0,7 M NaCl e um número limitado de cristais maiores apareceram nos botões. Ao aumentar a concentração de sal de 0,7 para 1,2 M, a supersaturação aumenta e a solução na zona de nucleação se afasta da zona metastável(Figura 4, painéis 1 a 6). Como resultado, o número de cristais aumenta e seu tamanho diminui.
No primeiro experimento com um instrumento totalmente automatizado que permite a cristalização da diálise controlada pela temperatura, OptiCrys (Figura 9), o experimento de crescimento de cristal foi adaptado para gerar um grande crescimento de cristal. O experimento foi lançado a uma temperatura inicial de 295 K com uma solução de cristalização contendo 0,75 M NaCl e 0,1 M Na acetato tampão pH 4. Nessas condições experimentais, a solução de cristalização atingiu a zona de nucleação nas proximidades da zona metastável do diagrama de fase(Figura 9, seta 1). Como resultado, apenas alguns núcleos foram gerados durante a primeira fase do experimento. Para crescer ainda mais os cristais selecionados (mostrados na Figura 9),o fluxo de trabalho de otimização do crescimento cristalino foi impulsionado para a zona metastável por uma temperatura variada assim que o equilíbrio da solução cristalina foi atingido.
Cada vez que o equilíbrio entre cristal e solução era atingido, a temperatura era reduzida, primeiro para 291 K, depois para 288 K e finalmente para 275 K, para manter a solução de cristalização na zona metastável. O resultado deste experimento é um único cristal grande adequado tanto para raios-X macromoleculares quanto para cristalografia de nêutrons.
Para a maioria das proteínas, o diagrama de fase quantitativa precisa (ou apenas um diagrama qualitativo) ainda não foi obtido devido à falta de dispositivos experimentais capazes de medir com precisão a concentração proteica (ou apenas de observar/detectar o processo de cristalização em tempo real) durante os experimentos de cristalização18. Como resultado, muitas vezes não é possível projetar o experimento de tal forma que a cristalização começa na área ideal do diagrama de fase, nas proximidades da zona metastável.
Portanto, um estudo de otimização de cristalização deve ocorrer antes que o experimento dedicado ao crescimento de um cristal de grande volume seja realizado. Neste estudo, utilizando variações de temperatura (em composição química constante) por um lado e variações na composição química (em temperatura constante) por outro, são necessárias para identificar a zona metastível e delinear as condições ideais para iniciar um grande experimento de crescimento cristalino.
Para isso, dois outros experimentos são apresentados que foram adaptados para demonstrar a reversibilidade dos experimentos de cristalização de diálise controlados pela temperatura com optiCrys para nucleação, crescimento de cristais, dissolução e re-crescimento. O fluxo de trabalho de otimização do crescimento cristalino foi controlado para que uma população uniforme de menos cristais de lisezina maiores fosse cultivada, utilizando variação de temperatura ou concentração precipitada.
No segundo experimento com optiCrys, a composição química da solução de cristalização foi mantida constante durante todo o experimento (0,9 M NaCl em 0,1 M CH3COONa pH 4) com temperatura variável. A temperatura inicial foi fixada em 291 K. Os resultados deste experimento são resumidos na Figura 10. Devido à alta supersaturação, um grande número de cristais pequenos apareceu na câmara de cristalização(Figura 10, painéis 1 e 2). De acordo com o conceito de solubilidade proteica direta, aumentando gradualmente a temperatura para 313 K, todos os cristais foram dissolvidos(Figura 10, painéis 3, 4 e 5). Finalmente, ao baixar a temperatura para 295 K, a segunda nucleação foi iniciada nas proximidades da zona metastável e permitiu a formação controlada de um menor número de núcleos. Um crescimento ainda mais cristalino resultou na geração uniforme de uma população de cristais maiores (Figura 10, painel 7).
Como mostrado na Figura 11, a variação da composição química da solução de cristalização, a uma temperatura constante de 291 K, também pode ser usada para obter uma população uniforme de cristais maiores. Semelhante ao experimento anterior, a condição inicial era de 0,9 M NaCl em 0,1 M CH3COONa pH 4. A concentração de NaCl foi então reduzida gradualmente de 0,9 M para zero para dissolver os cristais (Figura 11, painéis 4 e 5). Neste ponto, o NaCl foi completamente substituído por uma solução tampão de 0,1 M CH3COONa pH 4. A redução da concentração de sal mantém a solução na zona subsaturada do diagrama de fase, o que leva à dissolução dos cristais. Em seguida, uma nova solução de cristalização com menor resistência iônica, a 0,75 M NaCl em 0,1 M CH3COONa pH 4, foi injetada na câmara do reservatório. Nesta concentração precipitante, os primeiros núcleos apareceram(Figura 11, painel 6) após 90 minutos. O número de cristais gerados foi menor e os cristais atingem um volume maior(Figura 11, painel 7) do que antes.
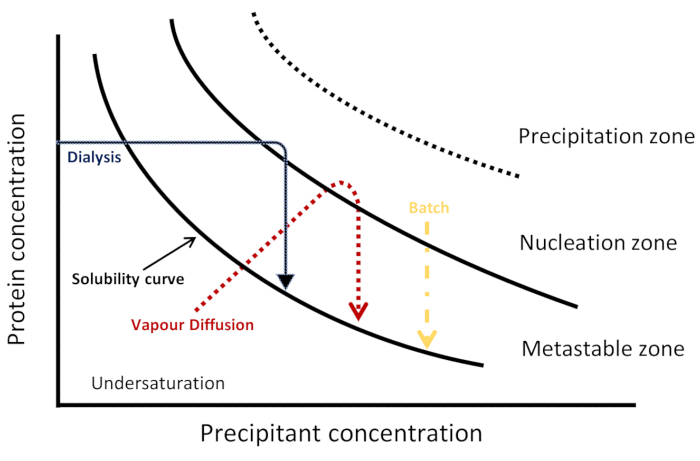
Figura 1: Diagrama de fase esquemática. Trajetórias cinéticas para três técnicas de cristalização são representadas em um regime de salga. Cada método alcança nucleação e cristalização de forma diferente, visualizado por uma via cinética diferente através do diagrama de fase para alcançar a nucleação e zonas metastáveis. A curva de solubilidade separa regiões de subsaturação e supersaturação. A supersaturação é dividida em três zonas: metastável, nucleação e precipitação. Na zona de nucleação, a nucleação espontânea ocorre enquanto na zona metastável ocorre o crescimento do cristal. Esta Figura é adaptada de Junius et al. 8Clique aqui para ver uma versão maior desta figura.
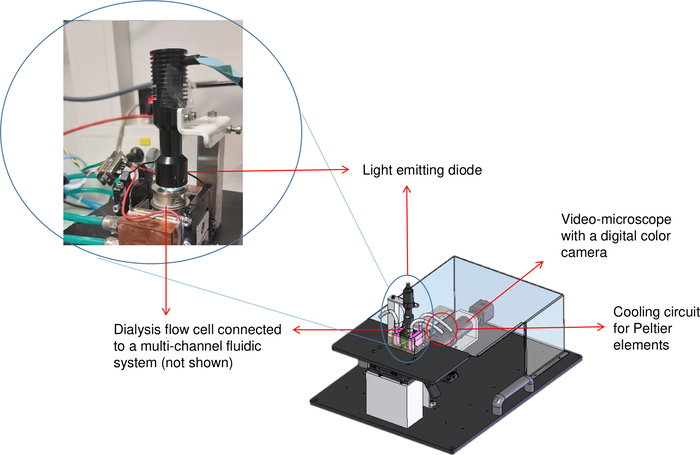
Figura 2: Representação esquemática do banco de cristalização (OptiCrys). A fonte de luz LED está localizada em cima da célula de fluxo de diálise controlada pela temperatura. Um microscópio invertido e a câmera digital são mostrados no canto superior direito da imagem com a seta vermelha. O círculo vermelho representa a localização da tubulação do refrigerador. Clique aqui para ver uma versão maior desta figura.

Figura 3: Diagrama de fase de cristalização de proteínas bidimensionais esquemática em função da temperatura (A) e concentração precipitante (B). (A) No caso de uma proteína com solubilidade direta, a diminuição da temperatura mantém a solução de cristalização na zona metastável. A variação da temperatura pode ser repetida várias vezes para controlar o processo de crescimento do cristal até que sejam obtidos cristais com o volume desejado. (B) Alterar a concentração da solução precipitante também pode ser usada para manter a solução de cristalização na zona metastável para o cultivo de cristais. Esta Figura é adaptada de Junius et al. 8Clique aqui para ver uma versão maior desta figura.

Figura 4: Cristais de lise obtidos utilizando o método de diálise. Este experimento foi realizado a uma temperatura constante de 293 K em 0,1 M de tampão de acetato de sódio pH 4. O aumento da concentração de NaCl de 0,7 M para 1,2 M aumenta a taxa de nucleação e resulta em um número maior de cristais. Clique aqui para ver uma versão maior desta figura.
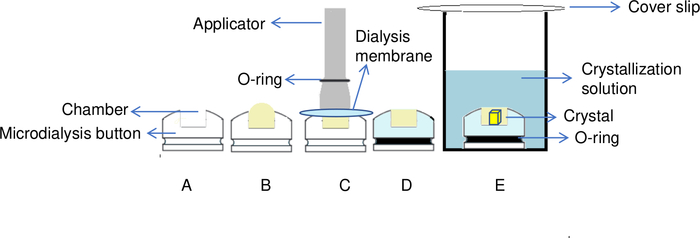
Figura 5: Visão geral do processo de cristalização da proteína pelo método de diálise. (A) Adicionando a proteína à câmara do botão de diálise, (B) uma forma de cúpula é criada na parte superior da câmara. (C) Um aplicador é usado para transferir o o-anel para o sulco do botão de diálise, a fim de fixar a membrana de diálise no lugar. (D) O botão de diálise está pronto para imersão na solução do reservatório. (E) A solução de cristalização passa pela membrana semipermeável e os cristais começam a se formar dentro da câmara. Clique aqui para ver uma versão maior desta figura.
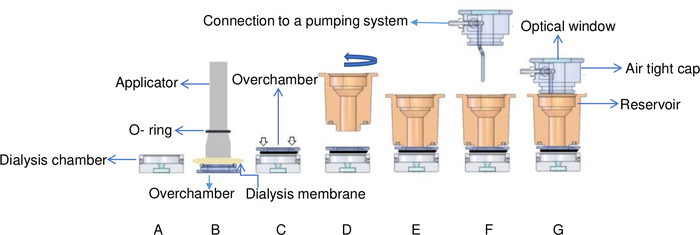
Figura 6: Visão esquemática da configuração de diálise fluindo controlada pela temperatura. (A) A amostra de proteína é adicionada à câmara de diálise. (B) A membrana de diálise é fixada na caixa de dormir com um anel O usando um aplicador. (C) A câmara de ultracâmara é virada e fixada no topo da câmara de diálise. As setas brancas indicam onde os parafusos são colocados na caixa. (D) A câmara do reservatório é virada no sentido horário (E) e fixada em cima da câmara. (F) A câmara do reservatório é coberta por uma tampa hermética com conectores para um sistema de bombeamento e (G) a célula de fluxo é colocada no suporte de latão. Esta Figura é adaptada de Junius et al. 8Clique aqui para ver uma versão maior desta figura.
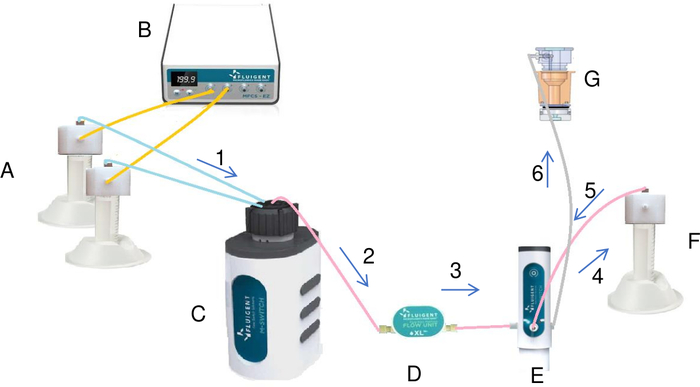
Figura 7: Preparação e injeção da solução de cristalização no reservatório pelo sistema fluido (A). Os tubos que contêm sal e água estão conectados ao controlador de pressão/vácuo (B) e à válvula rotativa (C). Usando a pressão, o controlador de pressão/vácuo cria um fluxo constante dos líquidos dos tubos para a válvula rotativa. Cada líquido que passa pelo medidor de fluxo (D) e o interruptor é injetado no tubo de mistura (F). Uma vez que todos os líquidos tenham sido adicionados ao tubo de mistura, o interruptor por algumas modificações injeta a solução final do tubo de mistura para o reservatório (G). O líquido flui através do sistema na direção das setas no diagrama marcado em ordem ascendente (de 1 a 6). Clique aqui para ver uma versão maior desta figura.

Figura 8: Visão de manutenção do software de supervisão. Esta visão é usada para controlar diferentes parâmetros como temperatura, luz, solução de cristalização e zoom. Clique aqui para ver uma versão maior desta figura.
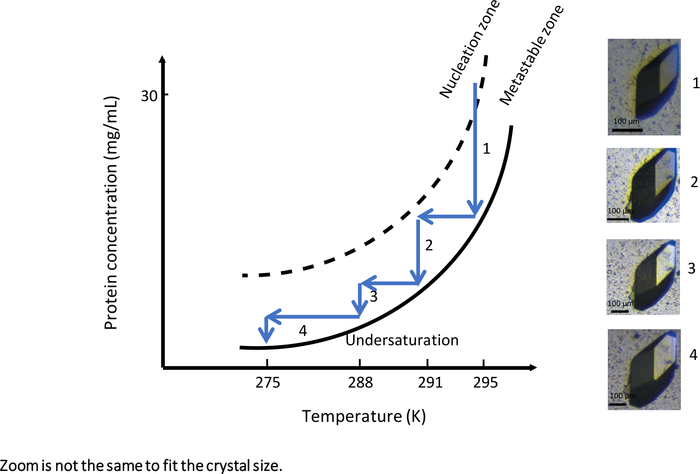
Figura 9: O diagrama de fase em função da temperatura (as imagens selecionadas devem ser rastreadas em ordem ascendente). Um único cristal de lysozyme grande é obtido alterando sistematicamente a temperatura de 295 K para 275 K. A cada passo, o crescimento do cristal é interrompido ao atingir a curva de solubilidade. Reduzir a temperatura mantendo a solução na zona metastável reinicia o crescimento do cristal. As imagens têm diferentes níveis de ampliação. Esta Figura é adaptada de Junius et al. 8,18Clique aqui para ver uma versão maior desta figura.
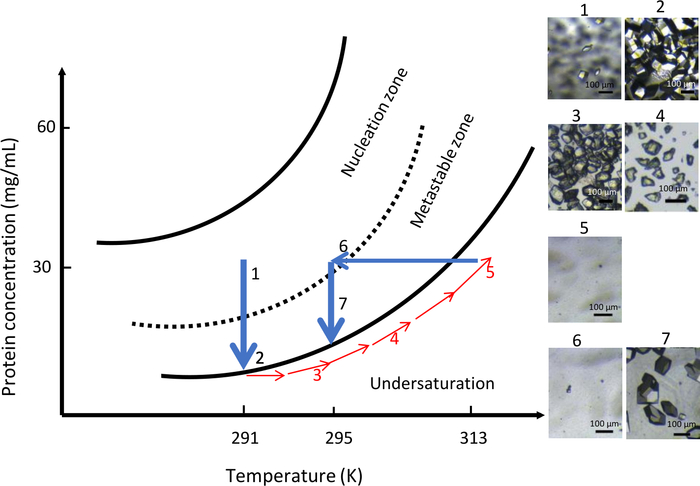
Figura 10: Otimização do crescimento do cristal na composição química constante usando controle de temperatura (imagens selecionadas devem ser rastreadas em ordem ascendente). Iniciar o processo de nucleação na zona de nucleação a 291 K, longe da zona metastável, resulta na formação de inúmeros cristais. Aumentar a temperatura para 313 K, em seguida, dissolve os cristais até que nenhum núcleo visível seja visto na câmara de diálise. Finalmente, a diminuição da temperatura para 295 K reinicia o processo de nucleação pela segunda vez levando a um número limitado de cristais maiores. Esta Figura é adaptada de Junius et al. 8,18Clique aqui para ver uma versão maior desta figura.
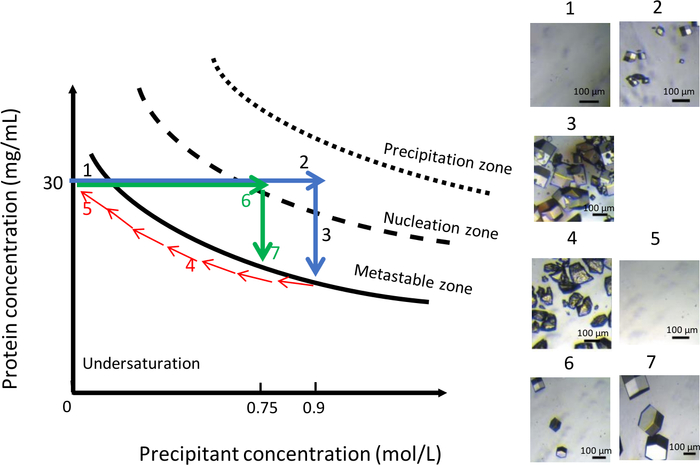
Figura 11: Otimização do crescimento do cristal à temperatura constante usando variações na concentração precipitante (imagens selecionadas devem ser rastreadas em ordem ascendente). A diminuição da concentração precipitada de 0,9 M para 0 M dissolve os cristais obtidos durante o primeiro evento de nucleação. O processo de cristalização é reiniciado pela injeção do mesmo precipitante, mas com menor resistência iônica, 0,75 M, o que leva à formação de alguns cristais maiores. Esta Figura é adaptada de Junius et al. 8,18Clique aqui para ver uma versão maior desta figura.
Discussão
Diferentes variáveis físicas, químicas e biológicas influenciam a cristalização proteica, afetando a solubilidade da proteína21. Entre essas variáveis, a temperatura e a composição química da solução de cristalização são utilizadas aqui em combinação com a técnica de diálise para melhorar e cultivar grandes cristais de alta qualidade de biomacromléculas para estudos de difração de nêutrons. Usando o conhecimento de diagramas de fase, a cristalização torna-se mais previsível. Embora a triagem de diferentes condições de cristalização em uma abordagem serial também seja possível, o principal objetivo do uso das abordagens racionais apresentadas é separar e controlar a cinética da nucleação e crescimento cristalino.
Semelhante a todos os estudos de cristalização, amostras de proteína pura e homogênea de alta qualidade e soluções de cristalização sem poeira aumentam a taxa de sucesso do experimento. Filtração e centrifugação de soluções são etapas essenciais nos protocolos descritos. Conhecendo as propriedades fisicoquímicas das proteínas estudadas, como o peso molecular (para escolher a membrana de diálise apropriada), o ponto isoelétrico e a solubilidade proteica são cruciais para o projeto de um experimento de crescimento cristalino ideal. Além disso, deve-se considerar a estabilidade da proteína em diferentes temperaturas ou com diferentes produtos químicos para evitar a perda de amostras e aumentar a probabilidade de sucesso. Considerando a faixa de temperatura do OptiCrys (233,0-353,0 ± 0,1 K), uma ampla gama de proteínas pode ser cristalizada usando-a. Mas vale ressaltar que as proteínas que são principalmente termoestabilidade, como proteínas de fontes termofílicas, seriam as mais beneficiadas em experimentos de crescimento de cristais de grande volume controlados pela temperatura oferecidos por este instrumento.
Usando uma câmara de diálise de baixo volume (ao usar botões OptiCrys) ou microdiálise e triagem de várias temperaturas e condições de cristalização (por exemplo, grades de concentração precipitante ou pH), é possível obter informações sobre a localização do limite da zona metastável (equilíbrio cinético entre nucleação e zonas metastáveis). Isso é inestimável ao projetar um experimento de crescimento cristalino bem sucedido especialmente para novos candidatos a proteínas na cristalização. Sem essas informações, os experimentos podem começar a partir de uma área do diagrama de fase com alta supersaturação, muito longe do limite da zona metastável para controlar facilmente a nucleação cristalina. Embora a dissolução do precipitado proteico possa ser tentada, por exemplo, aumentando a temperatura no caso da solubilidade direta, para proteínas com termestabilidade reduzida, manter a amostra em alta temperatura por um período maior de tempo pode tornar a precipitação proteica irreversível. Assim, a melhor estratégia consiste em utilizar uma condição inicial com menor supersaturação localizada perto do limite de metaestabilidade, onde a nucleação pode ser controlada e a precipitação proteica evitada. Em consonância com isso, a cristalização pré-triagem diminui a chance de ter uma proteína precipitada na câmara de diálise e aumenta a taxa de sucesso do experimento.
Depois de projetar um experimento, preparar câmaras de diálise (OptiCrys) ou botões de microdiálise é outro passo importante. Impedir a formação de bolhas de ar na câmara/botão de diálise aumenta a chance de cristalização bem sucedida, especialmente quando pequenos volumes são usados. A presença de bolhas de ar na câmara de diálise também pode alterar a cinética do processo de cristalização e reduzir a reprodutibilidade do experimento (porque a superfície de contato proteína/solução foi modificada). Não só a solução de cristalização de proteínas, mas também a solução de cristalização pode afetar o sucesso do experimento. Usando novos tubos de 50 mL para o sistema de bombeamento cada vez que se quer iniciar um novo experimento e lavar tubos após cada experimento diminui a chance de contaminação e evita a criação de cristais de sal no aparelho.
O uso de botões de microdiálise é uma alternativa quando o OptiCrys não está disponível. As estratégias de otimização da cristalização e monitoramento do crescimento cristalino mencionados acima, devem ser realizadas manualmente. Normalmente, isso requer estar fora de uma incubadora termoregulada, o que pode ser problemático quando a regulação da temperatura é um passo crítico na metodologia descrita. Isso não facilita a alteração da composição química das soluções de cristalização, nem o monitoramento do crescimento de cristais por imagem, de modo que o processo de crescimento de cristais não pode ser controlado em tempo real.
O conhecimento do diagrama de fase é a base do uso do banco de cristalização, OptiCrys, para cultivar sistematicamente cristais grandes e de alta qualidade de forma automatizada. O controle de parâmetros físico-químicos como temperatura, concentração precipitante e pH durante a cristalização move o equilíbrio proteína-solução em uma trajetória cinética bem definida ao longo do diagrama de fase. Isso é complementado pelo uso de uma membrana de diálise para ajustar o transporte de massa e criar um gradiente controlado na câmara de cristalização que afeta o tamanho e a qualidade dos cristais. Portanto, o uso de dados termodinâmicos e trajetórias cinéticas é essencial para controlar o processo de cristalização para cultivar cristais de alta qualidade. Graças ao OptiCrys, diagramas de fase sistemáticas em um espaço multidimensional podem ser estudados com uma abordagem serial usando significativamente menos material do que antes. Para demonstrar essa metodologia, fornecemos aqui um estudo de caso com uma proteína modelo, a lise de ovo de galinha branca. Utilizando e dominando o protocolo aqui apresentado pode-se adaptá-lo para sistemas de proteínas reais5,14,17,18.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
A MBS reconhece o suporte do LABEX VALO GRAL no âmbito do contrato 2015. NJ reconhece o Programa Internacional de Pesquisa de Doutorado (Irtelis) do CEA para a Bolsa de Doutorado. Os autores reconhecem o financiamento do Programa de Pesquisa e Inovação Horizon 2020 da União Europeia sob o acordo de subvenção de Marie Skłodowska-Curie número 722687. Os autores também são gratos ao Dr. Esko Oksanen (ESS, Lund) e ao Dr. Jean-Luc Ferrer (IBS, Grenoble) por conversas e insights úteis. O IBS reconhece a integração ao Instituto de Pesquisa Interdisciplinar de Grenoble (IRIG, CEA).
Materiais
| Name | Company | Catalog Number | Comments |
| 200 µl Dialysis Button | Hampton Research | HR3-330 | Dialysis button |
| 24 well plates | Jena Bioscience | CPL-132 | Crystallization plate |
| 2-Switch | FLUIGENT | 2SW001 | Switch |
| 30 μl Dialysis Button | Hampton Research | HR3-324 | Dialysis button |
| 50 mL Corning Centrifuge tubes | Sigma-Aldrich | CLS430828-500EA | Centrifuge tubes |
| Acetic acid | Sigma-Aldrich | S2889 | Chemical |
| Chicken Egg White Lysozyme | Sigma-Aldrich | L6876 | Lyophilized protein powder |
| Dialysis Membrane Discs 6-8 kDa MWCO | Spectrum | 132478 | Dialysis membrane |
| Dialysis Membrane Tubing 6-8 kDa MWCO | Spectrum | 132650T | Dialysis membrane |
| Microcentrifuge | Eppendorf | Minispin | Bench-top centrifuge |
| Flow Unit | FLUIGENT | FLU-XL | Flow meter |
| Flowboard | FLUIGENT | FLB | Flowboard |
| Microfluidic Flow Control System EZ | FLUIGENT | EZ-01000002 | Pressure/vacuum controller |
| MilliporeSigma 0.22 µm syringe Filters | Millipore | GSWP04700 | 0.22 μm pore size filter |
| M-Switch | FLUIGENT | MSW002 | Rotary valve |
| Opticrys | NatX-ray | PRT008 | Crystallization bench |
| Siliconized circle cover slides | Hampton Research | HR3-231 | Glass slides |
| Sodium Chloride ≥ 99% | Sigma-Aldrich | 746398 | Chemical |
| Switchboard | FLUIGENT | SWB002 | Switchboard |
| Thermoregulated incubator | Memmert | IPP30 | Thermoregulated incubator |
Referências
- Blakeley, M. P., Langan, P., Niimura, N., Podjarny, A. Neutron crystallography: opportunities, challenges, and limitations. Current Opinion in Structural Biology. 18 (5), 593-600 (2008).
- Snell, E. H., Van Der Woerd, M. J., Damon, M., Judge, R. A., Myles, D. A. A., Meilleur, F. Optimizing crystal volume for neutron diffraction: D-xylose isomerase. European Biophysics Journal. 35 (7), 621-632 (2006).
- Ng, J. D., Baird, J. K., Coates, L., Garcia-Ruiz, J. M., Hodge, T. A., Huang, S. Large-volume protein crystal growth for neutron macromolecular crystallography. Acta Crystallographica Section F:Structural Biology Communications. 71, 358-370 (2015).
- O'Dell, W. B., Bodenheimer, A. M., Meilleur, F. Neutron protein crystallography: A complementary tool for locating hydrogens in proteins. Archives of Biochemistry and Biophysics. 602, 48-60 (2016).
- Oksanen, E., Blakeley, M. P., Bonneté, F., Dauvergne, M. T., Dauvergne, F., Budayova-Spano, M. Large crystal growth by thermal control allows combined X-ray and neutron crystallographic studies to elucidate the protonation states in Aspergillus flavus urate oxidase. Journal of the Royal Society Interface. 6, (2009).
- Krauss, I. R., Merlino, A., Vergara, A., Sica, F. An overview of biological macromolecule crystallization. International Journal of Molecular Sciences. 14 (6), 11643-11691 (2013).
- Chayen, N. E. Comparative Studies of Protein Crystallization by Vapour-Diffusion and Microbatch Techniques. REVIEW Acta Cryst. , (1998).
- Junius, N., Oksanen, E., Terrien, M., Berzin, C., Ferrer, J. L., Budayova-Spano, M. A crystallization apparatus for temperaturecontrolled flow-cell dialysis with real-time visualization. Journal of Applied Crystallography. 49, 806-813 (2016).
- Salemme, F. R. A free interface diffusion technique for the crystallization of proteins for X-ray crystallography. Archives of Biochemistry and Biophysics. 151 (2), 533-539 (1972).
- Chayen, N. E., Saridakis, E. Protein crystallization: From purified protein to diffraction-quality crystal. Nature Methods. 5 (2), 147-153 (2008).
- Otálora, F., Gavira, J. A., Ng, J. D., García-Ruiz, J. M. Counterdiffusion methods applied to protein crystallization. Progress in Biophysics and Molecular Biology. 101 (1-3), 26-37 (2009).
- Garciá-Ruiz, J. M. Counterdiffusion Methods for Macromolecular Crystallization. Methods in Enzymology. 368, 130-154 (2003).
- Budayova-Spano, M., Koruza, K., Fisher, Z. Large crystal growth for neutron protein crystallography. Methods in Enzymology. 634, 21-46 (2020).
- Budayova-Spano, M., Dauvergne, F., Audiffren, M., Bactivelane, T., Cusack, S. A methodology and an instrument for the temperature-controlled optimization of crystal growth. Acta Crystallographica Section D: Biological Crystallography. 63 (3), 339-347 (2007).
- Asherie, N. Protein crystallization and phase diagrams. Methods. 34 (3), 266-272 (2004).
- Astier, J. P., Veesler, S. Using temperature to crystallize proteins: A mini-review. Crystal Growth and Design. 8 (12), 4215-4219 (2008).
- Budayova-Spano, M., et al. A preliminary neutron diffraction study of rasburicase, a recombinant urate oxidase enzyme, complexed with 8-azaxanthin. Acta Crystallographica Section F: Structural Biology and Crystallization Communications. 62 (3), 306-309 (2006).
- Junius, N., Vahdatahar, E., Oksanen, E., Ferrer, J. L., Budayova-Spano, M. Optimization of crystallization of biological macromolecules using dialysis combined with temperature control. Journal of Applied Crystallography. 53 (3), (2020).
- Grimsley, G. R., Pace, C. N. Spectrophotometric Determination of Protein Concentration. Current Protocols in Protein Science. 33 (1), 1-9 (2003).
- McPherson, A., Gavira, J. A. Introduction to protein crystallization. Acta Crystallographica Section F:Structural Biology Communications. 70 (1), 2-20 (2014).
- McPherson, A. Introduction to protein crystallization. Methods. 34 (3), 254-265 (2004).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados