Method Article
جمع بيانات البلورات النيوترونية ومعالجتها لنمذجة ذرات الهيدروجين في هياكل البروتين
In This Article
Summary
البلورات البروتين النيوتروني هو تقنية الهيكلية التي تسمح توطين ذرات الهيدروجين، وبالتالي توفير تفاصيل ميكانيكية هامة من وظيفة البروتين. نقدم هنا سير العمل لتركيب بلورة البروتين، وجمع بيانات الحيود النيوتروني، وصقل الهيكل وتحليل خرائط كثافة طول النيوترون المتناثرة.
Abstract
علم البلورات النيوتروني هو تقنية هيكلية تسمح بتحديد مواقع ذرة الهيدروجين داخل الجزيئات البيولوجية ، مما ينتج معلومات مهمة ميكانيكيا حول حالات البروتونات والترطيب مع عدم إحداث ضرر إشعاعي. وعلى النقيض من ذلك، لا يوفر حيود الأشعة السينية سوى معلومات محدودة عن موقع ذرات الضوء، كما أن شعاع الأشعة السينية يؤدي بسرعة إلى تلف الإشعاع من العوامل المساعدة الحساسة للضوء والمراكز المعدنية. يعرض هنا سير العمل المستخدم لخطوط الشعاع IMAGINE و MaNDi في مختبر أوك ريدج الوطني (ORNL) للحصول على هيكل حيود نيوتروني بمجرد زراعة بلورة بروتينية ذات حجم مناسب (> 0.1 مم3). نحن نظهر تصاعد بلورات البروتين المهدرجة في الشعيرات الدموية الكوارتز لجمع بيانات الحيود النيوتروني. كما يتم عرض عملية تبادل البخار من بلورات محمولة مع العازلة التي تحتوي على D2O لضمان استبدال ذرات الهيدروجين في مواقع قابلة للتبادل مع الديوتريوم. ويقلل دمج الديوتريوم من الخلفية الناشئة عن التشتت غير المتماسك لذرات الهيدروجين ويمنع إلغاء الكثافة الناجم عن طول التشتت المتماسك السلبي. يتم توضيح استراتيجيات محاذاة العينات وجمع بيانات درجة حرارة الغرفة باستخدام جمع بيانات شبه لاو في IMAGINE في مفاعل نظائر التدفق العالي (HFIR). وعلاوة على ذلك، يظهر تصاعد الكريستال وتجميد سريع في النيتروجين السائل لجمع البيانات المبردة لاعتراض وسيطة رد فعل اللبن في أداة MaNDi وقت الطيران في مصدر النيوترون Spallation (SNS). كما سيتم تناول إعداد ملفات بيانات التنسيق والحيود النموذجية وتصور خرائط كثافة طول النيوترونات المتناثرة. وسوف تناقش أخيرا صقل الهيكل ضد البيانات النيوترونية فقط أو ضد بيانات الأشعة السينية/النيوترونات المشتركة للحصول على بنية من كل الذرات للبروتين المثير للاهتمام. سيتم إثبات عملية تحديد بنية نيوترونية باستخدام بلورات من البولي السكريد الليكاريدي أحادي الأكسجين العصبي crassa LPMO9D ، وهو ميتالوبروتين يحتوي على النحاس يشارك في تدهور السكريات البولية المتمردة عن طريق الانقسام التأكسدي للسند الجليكوسيديك.
Introduction
البلورات الجزيئية النيوترونية هي تقنية توفر نافذة فريدة من نوعها في هيكل والكيمياء الكامنة وراء البروتينات. من الناحية المفاهيمية مماثلة للانعراج الأشعة السينية، الحيود النيوتروني يوفر تفاصيل ذرية من الهيكل الجزيئي الكلي، ومع ذلك، فإن التفاعل بين النيوترونات مع النواة تمكن توطين ذرات الضوء، وغالبا ما يصعب الكشف عن مع الحيود الأشعة السينية1. أثناء حيود الأشعة السينية، تنتشر الأشعة السينية من سحابة الإلكترون، مما يجعل ذرات الضوء مثل الهيدروجين (H) غير مرئية بشكل جيد في خرائط كثافة الإلكترون التي ليس لديها دقة قريبة من Ångström الفرعية2. وعلى النقيض من ذلك، تعتمد كثافة تشتت النيوترونات على التفاعلات المعقدة مع النواة، حيث تظهر النظائر من نفس العنصر أطوالا متناثرة مختلفة. لذلك، فإن ذرات الضوء ونظائرها، مثل الهيدروجين (1H) والديوتريوم (2H أو D)، لديها رؤية مماثلة لذرات الكربون والنيتروجين والأوكسجين العمود الفقري في خرائط كثافة طول النيوترونات المتناثرة (SLD). وعلاوة على ذلك، وبما أن حجم تشتت النيوترونات مستقل عن عدد الإلكترونات، فإن التشتت من العناصر الخفيفة لا تحجبه العناصر الثقيلة عندما تكون قريبة من بعضها البعض، كما يلاحظ في تشتت الأشعة السينية. إن الرؤية المعززة ل H ونظائرها D عند استخدام الحيود النيوتروني توفر معلومات قيمة حول حالة بروتونات المخلفات والعوامل المساعدة والليجاندات المهمة الحفازة ويساعد على توجيه جزيئات الماء ، مما يكشف عن معلومات مهمة حول الآليات الحفازة وكيمياء البروتين3. كما يوفر الحيود النيوتروني ميزة كونه تقنية غير مدمرة ، تناسب بشكل خاص العينات البيولوجية الحساسة للتأين مثل البروتينات ذات المراكز المعدنية أو العوامل المساعدة للأكسدة الحساسة للضوء2. التركيز الأساسي لهذه المادة هو تقديم لمحة عامة عن سير العمل للحصول على بنية بلورية عالية الجودة البروتين النيوتروني. نحيل القارئ المهتم إلى بودجارني وآخرون.4، بليكلي5، بليكلي وآخرون.6 وO'Dell et al.3 للحصول على نظرة عامة ممتازة على حيود البروتين النيوتروني وأشر وآخرون.7 لمزيد من التطبيقات من تشتت النيوترونات.
يتم توليد النيوترونات في المقام الأول أثناء التفاعلات النووية باستخدام أي من عمليتين: الانشطار النووي في مصادر المفاعل أو التشنج في مصادر قائمة على المسرع8. وتوفر مصادر المفاعل شعاعا نيوترونيا مستمرا باستخدام الانشطار النووي للنظائر 235U بينما تنتج مصادر النيوترونات النابضة شعاعا نيوترونيا نابضا بقصف هدف، على سبيل المثال معدن سائل مثل الزئبق، بالبروتونات9. يستضيف مختبر أوك ريدج الوطني (ORNL) في أوك ريدج بولاية تينيسي مصدر نيوتروني ثابت الحالة في مفاعل نظائر التدفق العالي (HFIR) ومصدر نبضي 60 هرتز في مصدر نيوترون سباليشن (SNS). خط شعاع IMAGINE، الموجود في HFIR، هو مقياس نيوتروني للنافرات الأمثل للجزيئات الكلية البيولوجية (الشكل التكميلي 1)10. تستخدم IMAGINE كاشف لوحة صورة نيوترونية لقياس بيانات شبه Laue باستخدام ممر ضيق في نطاق 2.8 - 4.5 Å من بلورات مفردة مع حواف خلايا وحدة <150 Å. مقياس النيوترونات الجزيئي الكلي Diffractometer (MaNDi)، الموجود في SNS، هو مقياس نيوتروني لاوي (TOF) مزود بإطار صفيف كاشف كروي (DAF) (الشكل التكميلي 2)11. MaNDi يقيس البيانات من بلورات واحدة مع حواف الخلية وحدة في نطاق 10 - 300 Å عن طريق توظيف عرض النطاق الترددي 2 Å-الطول الموجي غير قادر بين 2.0 - 6.0 Å12.
عملية توليد النيوترونات كثيفة الطاقة للغاية، مما يؤدي إلى تدفقات شعاع نيوترونية ضعيفة نسبيا عندما تتناقض مع تدفقات شعاع الأشعة السينية في مصادر السنكروترون13. لضمان نسب كافية من الإشارة إلى الضوضاء أثناء جمع البيانات، من الضروري زراعة بلورات ذات حجم وجودة مناسبين14. عادة، هناك حاجة إلى بلورات ذات أحجام > 0.1 مم3 لجمع البيانات مع إحصاءات كافية15. بالإضافة إلى انخفاض التدفقات ، يجب أن تؤخذ الخصائص المتأصلة للتفاعل بين النيوترونات ونوى العينة في الاعتبار16. يختلف طول النيوترونات المتناثر بالنسبة للنظائر من نفس العنصر، وهي خاصية يمكن استغلالها بشكل مفيد في تشتت النيوترونات بزاوية صغيرة (SANS) لإخفاء أو تسليط الضوء على مناطق عينة - وهي عملية تعرف باسم مطابقة التباين17. في تجارب الحيود، يمكن أن يؤدي طول نثر النيوترونات المتماسك السلبي H (-3.741 fm ل 1H) إلى إلغاء معالم خريطة كثافة التشتت النيوتروني منذ أطوال التشتت النيوترونية المتماسكة للذرات الأخرى ذات الصلة بيولوجيا ، بما في ذلك الكربون (6.6511 fm ل 12C) ، النيتروجين (9.37 fm ل 14N) ، الأكسجين (5.803 fm ل 16O) ، الفوسفور (5.13 fm ل31P) والكبريت (2.804 fm ل 32S), إيجابية (الجدول 1)12,14. وعلاوة على ذلك، فإن طول التشتت الكبير غير المتماسك ل H (25.274 fm)، يزيد من الخلفية أثناء جمع البيانات، مما يعوق جودة مجموعة البيانات ويضر بدقة البيانات7. وللتحايل على هذه القيود التي أدخلها H، من الضروري، بالنسبة للانعراج النيوتروني، أن يقايض H بنظائره الديوتريوم، 2H (D)، التي لها طول نثر نيوتروني متماسك إيجابي (6.671 fm) وطول تشتت غير متماسك بشكل ملحوظ (4.04 fm)19. ويمكن تحقيق ذلك عن طريق التحلل، وهي عملية يتم فيها التعبير عن البروتين من قبل الكائنات الحية التي تزرع في وسائل الإعلام deuterated تماما ضمان الإدماج الكامل للD في المواقع H20. ومن الممكن أيضا إزالة البروتين جزئيا عن طريق استبدال H ب D فقط في المواقع القابلة للتبادل (المجموعات القابلة للترقات) في حين تظل المواقع غير القابلة للتبادل المرتبطة بالكربون مهدرجة21. ويمكن تحقيق ذلك من خلال نمو بلورات البروتين المهدرجة في الخمور الأم deuterated22. ومع ذلك، الأكثر شيوعا، يتم إجراء تبادل H / D من البروتينات المهدرجة عن طريق تبادل البخار بعد نمو بلورات كبيرة بشكل مناسب في العازلة القائمة على H2O23. في مثل هذه الحالات، يتم تركيب البلورات في الشعيرات الدموية الكوارتز وبخار متساوية مع الخمور الأم D20 مقرها.
تؤدي التدفقات النيوترونية المحدودة في المصادر النيوترونية إلى أوقات أطول لجمع البيانات، تتراوح بين أيام وعدة أسابيع24. في ORNL، يستخدم كل من IMAGINE و MaNDi ممرا ضيقا للطول الموجي في نطاق 2-6 Å لتحسين جمع البيانات25. يمكن جمع البيانات في درجة حرارة الغرفة أو في درجة حرارة التبريد. يمكن لجمع بيانات Cryo تحسين جودة البيانات ويفتح إمكانية وسيطات تحفيزية محاصرة التجميد. بعد جمع بيانات حيود النيوترون، يتم جمع مجموعة بيانات الأشعة السينية عادة على نفس الكريستالة بنفس درجة الحرارة أو على بلورة تزرع في ظل ظروف مماثلة26. ويسمح جمع البيانات في نفس درجة الحرارة بإجراء تحسين الهيكل مقابل بيانات الأشعة السينية والنيوترونات على حد سواء، مما يمنع أي قطع أثرية محتملة ناجمة عن درجة الحرارة مثل التغيرات في الرؤية وموقع المياه أو إشغال المخلفات ذات التركيبات البديلة27. ويزيد تحسين بيانات النيوترونات بالأشعة السينية المشتركة من نسبة البيانات إلى المعلمة ويوفر ميزة السماح بتنقيح إحداثيات العمود الفقري للبروتين مقابل بيانات الأشعة السينية، في حين تستخدم بيانات الحيود النيوتروني لصقل موضع ذرات H/D28. وهذا مفيد بشكل خاص عند استخدام عينات مقلية جزئيا، حيث يكون إلغاء الكثافة بسبب ذرات H في مواقع غير قابلة للتبادل على البروتين موجودا. وعلى الرغم من أن عدد هياكل الأشعة السينية يتجاوز بكثير عدد الهياكل النيوترونية المودعة في مصرف بيانات البروتين، فقد تم توسيع مجموعات البرامج المصممة في البداية لتحسين بيانات الأشعة السينية لتشمل بيانات النيوترونات فضلا عن 30 29 3. بعد جمع البيانات، يمكن تحسين النماذج باستخدام حزم التحسين مثل phenix.refine، CNSsolve (nCNS) أو SHELXL28،31،32،33. خلال عملية الصقل، يمكن تصور خرائط كثافة النيوترونات للتركيب اليدوي باستخدام COOT34. ويمكن تقديم الإحداثيات وملفات بيانات الحيود النيوترونية و/أو الأشعة السينية إلى مصرف التنمية للبلدان الأمريكية، الذي سيتحقق من صحة النموذج ويودعه، مما يجعله متاحا للجمهور 18,29,30.
التحليل الهيكلي للبروتينات هو نهج متعدد الأوجه حيث يتم استخدام العديد من التقنيات للتحقيق في وظيفتها وآلية35. يوفر علم بلورات البروتين النيوتروني رؤى كيميائية قيمة للتوسع في نتائج الدراسات الإضافية مثل حيود الأشعة السينية أو التحليل الطيفي أو الرنين المغناطيسي النووي (NMR) أو حيود الإلكترون الكريستالي الدقيق (microED)36 واستكمالها. يتم وضع حيود البروتين النيوتروني بشكل فريد لتوفير رؤى حول الآليات الأنزيمية ، لأن ذرات H أساسية لكيمياءها. عدم وجود ضرر الإشعاع الناجم عن النيوترونات جعلها التحقيق مناسبة بشكل استثنائي لدراسة metalloproteins37. ونعرض هنا مثالا تمثيليا لعملية حيود البروتين النيوتروني من إعداد العينات إلى جمع البيانات وتحسينها وتحليلها (الشكل 1). وقد نمت بلورات من حجم كاف لتجارب الحيود النيوتروني من metalloprotein Neurospora crassa LPMO9D (NcLPMO9D). Nc LPMO9D هو metalloprotein النحاس التي تحتوي على المشاركة في تدهور السليلوز المتمردة عن طريق إدراج ذرة الأكسجين في bond38,39 الجليكوسيدية. يحتوي الموقع النشط NcLPMO9D على مركز نحاسي أحادي نووي ضمن "دعامة هيستيدين" مميزة تتكون من الهستيدين N-terminal وهستيدين محافظ عليه ثاني (الشكل التكميلي 3)40. يتم ميثيل N-المحطة الطرفية من LPMOs الفطرية ولكن التعديل بعد الانتقالية لا يحدث أثناء التعبير المؤتلف في الخميرة. في حالة الراحة NcLPMO9D ، يكون مركز النحاس موجودا في حالة أكسدة Cu2 + ويتم تنشيطه عن طريق تقليل إلكترون واحد إلى Cu1 + ، مما يسمح للأوكسجين الجزيئي بربط وتنشيطه عن طريق تقليله بسرعة إلى نوع فائق 4142. يتطلب التفاعل العام NcLPMO9D إضافة أخرى من إلكترون واحد وبروتونين لتشكيل منتج السكريات البولية الهيدروكسيلات43. ولم يتم تحديد هوية أنواع الأكسجين المنشطة المسؤولة عن تجريد ذرة الهيدروجين (HAA) من ركيزة البوليساكريد، ولا تزال الدراسات الهيكلية والحسابية المكثفة جارية حاليا 44,45. وبالنظر إلى كيمياء الأكسدة في الموقع النشط NcLPMO9D، فإن التخفيف من الأضرار الإشعاعية وثيق الصلة بشكل خاص. نوضح هنا درجة حرارة الغرفة وجمع البيانات درجة حرارة التبريد على بلورات NcLPMO9D لتحديد هيكل NcLPMO9D في حالة الراحة وفي شكل مخفض تنشيط، على التوالي46. وسيتم التركيز على تركيب بلورة البروتين، وإعداد أداة الحزم لجمع البيانات، وإعداد البيانات وتنسيق الملفات وخطوات التحسين اللازمة لنمذجة بنية نيوترونية من جميع الذرات.
Protocol
1. كريستال حجم التقييم
- قياس حجم البلورات باستخدام المجهر مجهزة ضوء العادي والاستقطاب. حدد بلورات بحجم لا يقل عن ~ 0.1 مم3 (الشكل التكميلي 4).
- تسمية الآبار مع بلورات كبيرة بما فيه الكفاية ونلاحظ ظروف التبلور المستخدمة لتوليد هذه البلورات.
2. إعداد العازلة تبلور deuterated
- حل مكونات المخزن المؤقت تبلور في D2O لتوليد المخزن المؤقت تبلور deuterated.
- ضبط درجة الحموضة من المخزن المؤقت عن طريق حساب pD الحل باستخدام المعادلة التالية:
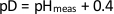 (1)
(1)
حيث pHmeas هو رقم الهيدروجيني قياس مع قطب الزجاج القياسية. كان pH الأصلي من المخزن المؤقت تبلور NcLPMO9D 6.0، لذلك سوف نستخدم pHmeas من 5.6 للتخزين المؤقت تبلور deuterated في PD 6.0. - تزج قطب متر الرقم الهيدروجيني في D2O لمدة عشر دقائق قبل الاستخدام (الشكل التكميلي 5).
- ضبط الأسهمية إلى 5.6 باستخدام NaOD قاعدة أو حمض DCl.
3. حصاد الكريستال
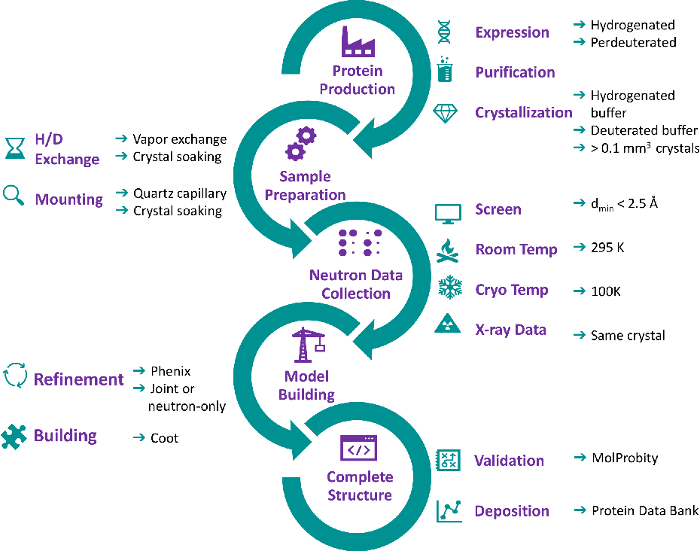
- ضع شرائح زجاجية مستديرة سيليكونية مقاس 22 مم بجوار صينية التبلور التي سيتم حصاد البلورات منها. استخدام شريحة زجاجية نظيفة لكل الكريستال (الشكل 2A).
- افتح صندوق الساندويتشات المغلق الذي يحتوي على بلورات البروتين في لوحة الزجاج السيليكوني ذات الحجم الكبير 9.
- إزالة 10-20 ميكرولتر من محلول خزان تبلور مع micropipette ووضع الحل على الشريحة الزجاجية (الشكل 2B).
- حصاد الكريستال باستخدام microloop من الحجم المناسب ووضع الكريستال في محلول الخزان قطرة على الشريحة الزجاجية لإزالة الحطام التي غالبا ما يتم حصادها جنبا إلى جنب مع الكريستال (الشكل 2C والشكل 2D).
ملاحظة: سيكون من الضروري العمل بسرعة لأن قطرات صغيرة الحجم قد تتبخر. كما أن البلورات المحصودة معرضة لخطر الجفاف عند تعرضها للغلاف الجوي. قد يكون من الضروري إضافة بعض محلول الخزان إلى انخفاض البروتين لمنع البلورات من الجفاف في أحجام انخفاض التبلور الصغيرة.
4. كريستال تصاعد
ملاحظة: تختلف بروتوكولات التركيب الشعري باختلاف التفضيلات التجريبية. لمنع الضرر الذي يلحق بلورات، يجب أن يسجل الشعيرات الدموية التي تحتاج إلى تقصير مع حجر القطع أو الصنفرة لضمان كسر سلس.
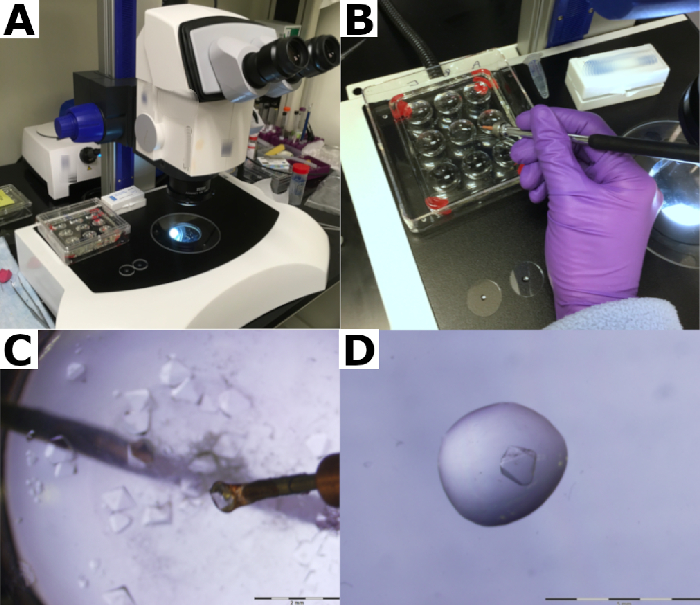
- ملء نهاية واحدة من قطر 2 مم 50 ملم طول الكوارتز الشعرية مع المخزن المؤقت الخزان عن طريق العمل الشعرية أو عن طريق الأنابيب مباشرة ~ 10 ميكرولتر من المخزن المؤقت للخزان في الشعيرات الدموية (الشكل 3A).
ملاحظة: يتم تشجيع المستخدمين على الاستفادة من أنابيب الكوارتز الشعرية لأنه ، بالإضافة إلى قوتها الميكانيكية ، من الضروري الحد من امتصاص شعاع النيوترون ومساهمات الخلفية المنخفضة من الشعرية. الشعيرات الدموية الزجاجية إدخال خلفية عالية وامتصاص النيوترونات، مما يعرض للخطر جودة البيانات. - ضع الكريستال برفق في المخزن المؤقت للخزان في الشعيرات الدموية الكوارتز باستخدام حلقة التركيب (الشكل 3B والشكل 3C).
- اضغط بلطف على الأنبوب لتحريك المخزن المؤقت للخزان والكريستال المغمور فيه أسفل الشعرية (الشكل 3D).
- وضع الكريستال لا أقرب من 13.5 ملم وليس 27.5 ملم أخرى من نهاية واحدة من الشعرية. وستكون هذه هي النهاية المتصاعدة (الشكل التكميلي 6).
- يستنشق محلول العازلة حول الكريستال باستخدام طرف ماصة رقيقة طويلة، وترك الكريستال الرطب قليلا. لا تلمس الكريستال (الشكل التكميلي 7A).
- جفف الجدران الشعرية مع فتيل ورقي رفيع (الشكل التكميلي 7B).
- ماصة 20-50 ميكرولتر من محلول العازلة deuterated في نهاية الشعرية مقابل نهاية تصاعد (الشكل 4A).
- تذوب شمع النحل مع الحرارة "عصا" وإدراج بلطف الشعرية في هذا شمع النحل الذائب. كرر حتى تتشكل ختم محكم (الشكل 4B والشكل 4C).
- ماصة كمية صغيرة جدا من العازلة deuterated، ما يقرب من 5 ميكرولتر في نهاية تصاعد الشعرية لتكون بمثابة "بالوعة الحرارة" لم شمع النحل الساخن. تراجع هذه النهاية في شمع النحل الذائب لتوليد ختم محكم كما هو موضح سابقا لتشكيل الشعرية مختومة على كلا الطرفين (الشكل 4D).
- فحص الكريستال المركبة باستخدام المجهر بعد تصاعد لضمان محكم (الشكل 4E).
- تأمين بعناية بلورات محمولة مع كيم مناديل في حاوية مثل أنبوب فالكون 15 مل أو طبق بيتري وتخزين أفقيا في درجة الحرارة التي نمت بلورات (الشكل 4F).
5. تبادل بخار
- استبدال المخزن المؤقت deuterated مع المخزن المؤقت الطازج بعد يومين من تصاعد الكريستال.
- تذوب ختم الشمع أبعد من الكريستال مع حلقة التدفئة، واستخدام ماصة وويك الورق لإزالة العازلة.
- إعادة ملء الشعرية مع 20-50 ميكرولتر من محلول العازلة deuterated وختم مع الشمع.
- كرر استبدال العازلة deuterated مرتين أكثر في فترات أربعة أيام لضمان أن تبادل بخار العازلة deuterated كاملة والسماح لتبادل بخار لمدة أسبوعين على الأقل.
6. حيود البروتين النيوتروني
ملاحظة: يتم تشجيع القراء المهتمين بتفاصيل خط شعاع IMAGINE على استشارة Meilleur وآخرون 2013 و Meilleur وآخرون 201810,47.
- جمع بيانات درجة حرارة الغرفة في خط شعاع IMAGINE في HFIR
- تركيب العينة
- تأمين الكريستال التي شنت على الشعرية على مقياس ال غونيمتر مع المعجون.
- جبل goniometer على عصا العينة ومركز الكريستال في شعاع باستخدام محطة المحاذاة خارج الخط.
- تأمين عصا العينة على مرحلة عينة الصك (الشكل التكميلي 1B).
- تأكد من إخلاء الكوخ التجريبي وفتح مصراع الحزم لجمع البيانات النيوترونية.
- جمع البيانات
- افتح برنامج الحصول على البيانات على الكمبيوتر التحكم في الحزمة وانقر فوق علامة التبويب إعداد لإعداد استراتيجية جمع البيانات. ضمن معلمات التجربة اكتب اسم العينة بجوار اسم العينة ثم أدخل رقم العرض بجوار الاقتراح. ضمن تسمية الصورة حدد قالب المجلد وعين وجهة البيانات المكتسبة ليتم حفظها وحدد بادئة الصورة واكتب اسم الإطار ذي الصلة (الشكل التكميلي 8).
- فتح واجهة المستخدم الرسومية البصريات وانقر على 2.78 لλmin و 4.78 لeαmax لتعيين نطاق شبه لاو لجمع البيانات (الشكل التكميلي 9).
- قم بالتبديل إلى علامة التبويب تجميع وتحت معلمات المسح التالي إدراج وقت التعرض في ثوان تحت التعرض، وعدد الإطارات تحت إطارات N والزوايا لجمع البيانات تحت Δ φ/ الإطار. قم بتسمية الإطار الذي سيتم تجميعه ضمن بادئة الصورة وابدأ عملية جمع البيانات بالنقر فوق الزر "بدء المسح الضوئي" (الشكل التكميلي 10).
- سيتم الكشف عن النيوترونات المنتشرة بواسطة كاشف لوحة الصورة. في نهاية كل تعرض، سيتم قراءة لوحة الصورة وعرض النمط على واجهة المستخدم الرسومية لاكتساب البيانات (الشكل التكميلي 11).
- يتم فهرسة الإطارات ودمجها وتطبيع الطول الموجي وتوسيع نطاقها باستخدام Lauegen و Lscale50 و Scala من قبل عالم الحزم المسؤول ، الذي سيوفر للمستخدم ملف الانعكاس المدمج بعد جمع البيانات (الشكل التكميلي 12).
ملاحظة: سيتم جمع البيانات في كل من IMAGINE و MaNDi في وضع شبه Laue، باستخدام المنهجية والبرامج التي تم تطويرها لجمع بيانات حيود Laue كما طورتها Helliwell et al.48 و Nieh et al.49. - جمع مجموعة بيانات الأشعة السينية المقابلة على نفس الكريستال في نفس درجة الحرارة بعد جمع بيانات حيود النيوترون (الشكل التكميلي 13).
ملاحظة: يمكن أيضا استخدام بلورة نمت من نفس القطرة أو تحت نفس ظروف التبلور لجمع بيانات حيود الأشعة السينية لصقل النيوترون المشترك / الأشعة السينية.
- تركيب العينة
- جمع بيانات كريو في خط الحزمة MaNDi في SNS
ملاحظة: يتم تشجيع القراء المهتمين بتفاصيل خط الحزمة على استشارة كوتس وآخرين (2015) و Meilleur وآخرون 201810,11.- تركيب العينة
- إعداد محلول نقع الأسكوربات deuterated للحد من بلورات و cryoprotectant deuterated. ضع 20 ميكرولتر قطرات من كل من هذه الحلول في الجلوس إسقاط الآبار في لوحة تبلور.
ملاحظة: الحل cryoprotectant عادة ما يكون cryoprotectant التي أثبتت فعاليتها لجمع بيانات حيود الأشعة السينية درجة حرارة التبريد أعدت في D2O. ويمكن تحسين هذا البروتين المبرد (مثل التركيز) لجمع بيانات النيوترون إذا لزم الأمر. - حدد الحلقات لتركيب العينة وأرفقها بقاعدة التبريد المغناطيسية باتباع إرشادات MaNDi (الشكل التكميلي 14).
- ملء رغوة cryo-Dewar مع النيتروجين السائل. ضع كم معدني لحماية التبريد داخل النيتروجين السائل لتبرد (الشكل التكميلي 15A).
- قم بإزالة شمع المقابس من طرفي الشعرية واضغط على الشعيرات الدموية لتحريك قابس العازلة بحيث يتم غمر الكريستال المثبت في المخزن المؤقت. اغسل البلورة في قطرة محلول الخزان 20 ميكرولتر في بئر الهبوط الجالس (الشكل التكميلي 15B والشكل التكميلي 15C).
ملاحظة: هذه الخطوة غير مطلوبة إذا تم تنفيذ تبادل H/D بواسطة توازن قطرات التبلور مقابل المخزن المؤقت deuterated أو عن طريق نقع مباشرة من الكريستال في المخزن المؤقت deuterated. - تزج الكريستال في محلول نقع الأسكوربات لمدة ساعتين. جبل الكريستال في microloop تعلق على قاعدة التبريد المغناطيسي. تزج الكريستال شنت في cryoprotectant لمدة 10 ثانية ويغرق الكريستال والتبريد جبل في النيتروجين السائل لتجميد (الشكل التكميلي 15D).
- بمجرد تجميد الكريستال، استخدم دبوس التبريد المبرد مسبقا ونغ وجبل الكريستال على مرحلة عينة MaNDi مزودة بتيار التبريد. فتح بلطف تونغ دبوس cryo وضمان أن الكريستال لا يزال في تيار التبريد (الشكل التكميلي 2C).
- إعداد محلول نقع الأسكوربات deuterated للحد من بلورات و cryoprotectant deuterated. ضع 20 ميكرولتر قطرات من كل من هذه الحلول في الجلوس إسقاط الآبار في لوحة تبلور.
- جمع البيانات
- افتح برنامج تجميع البيانات الذي سيتم فيه ملء معلومات التجربة تلقائيا.
- انقر على مركز الكريستال لمركز مع goniometer الكمبيوتر التي تسيطر عليها (الشكل التكميلي 16).
- في إطار الجدول، قم بإعداد استراتيجية جمع البيانات عن طريق إدخال زوايا جمع البيانات تحت "phi" وكذلك إجمالي التعرض للشعاع النيوتروني لكل إطار تحت القيمة (الشكل التكميلي 17).
- انقر على إرسال لبدء جمع البيانات.
- ومع جمع البيانات، سيكون النيوترون المنتشر مرئيا (الشكل التكميلي 17). وستصبح بقع الحيود أكثر وضوحا مع زيادة وقت التعرض، مما يحسن نسبة الإشارة إلى الضوضاء (الشكل 5).
- سيتم فهرسة الإطارات ودمجها وتطبيع الطول الموجي وتوسيع نطاقها باستخدام Mantid و Lauenorm من قبل عالم الحزم المسؤول ، الذي سيوفر للمستخدم ملف الكثافة المدمجة بعد جمع البيانات51.
- تركيب العينة
7. تحسين الهيكل
- تحسين بيانات الأشعة السينية والنيوترونات المشتركة
- إعداد الهيكل
- صقل بيانات الأشعة السينية للحصول على بنية البروتين باستخدام حزمة البرمجيات phenix.refine وكوت لبناء دليل للحصول على هيكل الانتهاء.
- افتح CCP4 وحدد برنامج تحويل/تعديل/توسيع MTZ لمطابقة إشارات البيانات الخالية من R للبيانات النيوترونية مع إشارات بيانات الأشعة السينية. حدد لاستيراد ملف الانعكاس بتنسيق MTZ . تحت في تحميل الملف MTZ النيوترونية التي تم الحصول عليها وتحميل ملف MTZ الأشعة السينية تحت استيراد MTZ فرير (الشكل التكميلي 18). إعطاء اسم لملف MTZ الجديد ضمن خارج ثم انقر فوق تشغيل.
- افتح حزمة برامج فينيكس وانقر على ReadySet تحت أدوات التحسين. بجانب ملف PDB تحميل ملف تنسيق PDB المكرر مقابل بيانات الأشعة السينية. حدد لإضافة الهيدروجين إلى النموذج إذا كان غائبا وحدد H / D في مواقع قابلة للتبادل، H في مكان آخر من القائمة المنسدلة. حدد إضافة الديوتريوم إلى جزيئات المذيبات وترك الخيارات المتبقية على قيمها الافتراضية (الشكل التكميلي 19A).
ملاحظة: إذا تم استخدام بروتين perdeuterated حدد الخيار إضافة الهيدروجين إلى النموذج إذا كان غائبا وحدد H/D في مواقع قابلة للتبادل، D في مكان آخر.
- تحسين الهيكل
- افتح برنامج phenix.refine تحت علامة التبويب التحسين لإعداد التحسين باستخدام كل من الأشعة السينية وبيانات النيوترون. في التبويب تكوين في إدخال ملفات الإدخال ملف PDB من بنية الأشعة السينية التي تمت معالجتها مع ReadySet وملف تقييد CIF الضرورية لأي ligands ذات الصلة. قم بتحميل ملف MTZ من البيانات النيوترونية باستخدام إشارات Rfree المعينة باستخدام CCP4 وعين هذا ك "بيانات نيوترونية" و"نيوترون R-free" تحت عنوان نوع البيانات. قم بتحميل ملف MTZ من بيانات الأشعة السينية وعين هذا ك "بيانات الأشعة السينية" و "الأشعة السينية خالية من الأشعة السينية" تحت عنوان نوع البيانات. سيتم ملء مجموعات Space وتسميات البيانات تلقائيا بمجرد تحميل البيانات (الشكل التكميلي 19B).
ملاحظة: عند تنفيذ التحسين وإدخال معلومات بلورية، استخدم خلية الوحدة المحددة من بيانات الأشعة السينية. - ضمن علامة التبويب تكوين في إعدادات التحسين الاحتفاظ استراتيجية التحسين القياسية. زيادة عدد الدورات إلى خمس دورات (الشكل التكميلي 20)
- حدد جميع المعلمات، انقر على متقدمة وحدد الهيدروجين.... تغيير نموذج تحسين الهيدروجين إلى فرد وإيقاف تشغيل قوة ركوب adp (الشكل التكميلي 20).
- حدد كافة المعلمات وافتح خيار معلمات البحث . البحث عن كلمة النووية واختيار لاستخدام المسافات النووية لX-H/D (الشكل التكميلي 20).
- حدد تشغيل لبدء عملية التحسين.
- افتح برنامج phenix.refine تحت علامة التبويب التحسين لإعداد التحسين باستخدام كل من الأشعة السينية وبيانات النيوترون. في التبويب تكوين في إدخال ملفات الإدخال ملف PDB من بنية الأشعة السينية التي تمت معالجتها مع ReadySet وملف تقييد CIF الضرورية لأي ligands ذات الصلة. قم بتحميل ملف MTZ من البيانات النيوترونية باستخدام إشارات Rfree المعينة باستخدام CCP4 وعين هذا ك "بيانات نيوترونية" و"نيوترون R-free" تحت عنوان نوع البيانات. قم بتحميل ملف MTZ من بيانات الأشعة السينية وعين هذا ك "بيانات الأشعة السينية" و "الأشعة السينية خالية من الأشعة السينية" تحت عنوان نوع البيانات. سيتم ملء مجموعات Space وتسميات البيانات تلقائيا بمجرد تحميل البيانات (الشكل التكميلي 19B).
- مبنى نموذجي
- بعد الصقل في فينيكس، انقر على فتح في كوت في علامة التبويب النتائج لتصور كثافة الإلكترون الأشعة السينية وخرائط SLD النيوترونية. انقر على علامة التبويب مدير العرض وتحت خرائط انقر على حذف خريطة بجوار خرائط _neutron لإزالة الخرائط النيوترونية (الشكل التكميلي 21). انقر على ملف > MTZ المفتوحة، mmCIF fcf أو phs.... حدد ملفات التحسين الحالية وافتح الملف .mtz. بالنسبة لكل من خيار السعة والمراحل حدد بيانات 2FOFC WT_no_fill_neutron من القائمة المنسدلة. كرر هذا وفتح FOFC WT_neutron البيانات. افتح مدير العرض ثم قم بالتبديل إلى التمرير لكل من خرائط النيوترون والأشعة السينية 2FOFCWT ثم قم بالتمرير لتقليل rmsd من خرائط 2FOFCWT إلى 1.00 (الشكل التكميلي 21). قم بالتبديل إلى التمرير لكل من خرائط FOFCWT النيوترونية والأشعة السينية والتمرير لتقليل rmsd لخرائط FOFCWT إلى 3.00.
- إجراء فحص مرئي للمخلفات لتحديد ما إذا كان النموذج يناسب البيانات. تحديد الاتجاه الصحيح والإشغال H/D لجميع المواقع القابلة للتبادل من خلال تحليل قمم خريطة كثافة الفرق. وهذا يشمل مجموعات الهيدروكسيل من السرينات والثريونين والتيروزينات. النيتروجين من الهستيدين, الجلوتامين, الهليون واليوزين; سلفهيدريل السيستين. مجموعات الكربوكسيل من الأسبارتات والغلوتامات; العمود الفقري وسط المجموعات; ليغاندس; العوامل المساعدة وأي مخلفات وظيفية محتملة (الشكل 6).
- إعادة توجيه جزيئات الماء وفقا لكثافة النيوترونات وتفاعلات رابطة الهيدروجين عن طريق تدويرها باستخدام ميزة تدوير منطقة الترجمة / السلسلة / الجزيء (الشكل التكميلي 22A والشكل التكميلي 22B). ضبط مواقع بقايا البروتين H / D مواقع قابلة للتبادل باستخدام أداة تحرير زوايا تشي وتناوب ترجمة المنطقة / سلسلة / جزيء ميزة (الشكل التكميلي 22C والشكل التكميلي 22D).
- إعداد الهيكل
- تحسين الهيكل – تحسين البيانات النيوترونية فقط
- إعداد الهيكل
- فتح Phenix واختيار "الاستبدال الجزيئي" واختيار "Phaser-MR (كامل المميز)" لاشتقاق مرحلة من الكثافة المتدرج التي يقدمها عالم الصك عن طريق الاستبدال الجزيئي لتوليد ملف تنسيقي البداية في شكل pdb. إدخال بنية pdb البداية في علامة التبويب "الإدخال والخيارات العامة وإكمال Ensembles، محتويات ASU وخيارات إجراء البحث .
- فتح أدوات النموذج وحدد أدوات PDB. إدراج الملف pdb كملف الإدخال. انتقل إلى علامة التبويب خيارات وتحت إزالة تحديد الذرة حدد أسماء المذيبات، و ليغاندس، والعوامل المساعدة والمعادن. هذا يزيل جميع جزيئات الماء، والعوامل المساعدة، ليغاند والأيونات المعدنية لتوليد نموذج الحد الأدنى. بالإضافة إلى ذلك، حدد لإزالة التوافقات البديلة من النموذج (الشكل التكميلي 23).
- حدد التحسين في فينيكس وافتح ReadySet. إدخال ملف تنسيق pdb المحرر بجوار ملف PDB. حدد لإضافة الهيدروجين إلى النموذج إذا كان غائبا وحدد H / D في مواقع قابلة للتبادل، H في مكان آخر من القائمة المنسدلة من خيارات صقل النيوترون (الشكل التكميلي 23).
- تحسين الهيكل
- افتح برنامج phenix.refine تحت علامة التبويب الصقل في فينيكس. في إدخال علامة التبويب تكوين ملف PDB الذي تمت معالجته مع ReadySet ضمن مربع ملفات الإدخال . في مربع ملفات الإدخال قم بتحميل ملف MTZ من بيانات النيوترون وعين هذا كبيانات الأشعة السينية والأشعة السينية خالية من الأشعة تحت عمود نوع البيانات على الرغم من أنها بيانات نيوترونية. سيتم استخدام تكوين التحسين الذي تم إعداده في الخطوة التالية للتعامل مع ملف الانعكاس كبيانات نيوترونية. ستقوم مجموعة Space وتسميات البيانات بملء البيانات تلقائيا بمجرد تحميل البيانات (الشكل التكميلي 24A).
- ضمن علامة التبويب تكوين في إعدادات التحسين الاحتفاظ استراتيجية التحسين القياسية. زيادة عدد الدورات إلى خمس دورات. ضمن خيارات أخرى حدد النيوترون من القائمة المنسدلة جدول التشتت . إلغاء تحديد خيار تحديث المياه (الشكل التكميلي 24B).
- حدد كافة المعلمات>مضاد> هيدروجين. في إطار جديد حدد الفرد من القائمة المنسدلة نموذج تحسين الهيدروجين وإيقاف تشغيل قوة ركوب adp (الشكل التكميلي 20).
- حدد كافة المعلمات > معلمات البحث... خيار. البحث عن كلمة النووية واختيار لاستخدام المسافات النووية لX-H/D (الشكل التكميلي 20).
- حدد لتشغيل لبدء التحسين.
ملاحظة: بعد الصقل الأولي، سيكون من الضروري فحص خرائط SLD النيوترونية بصريا وتنفيذ بناء نموذج يدوي في كوت. قد يكون من الضروري إدراج ليغاندس / العوامل المساعدة الموجودة في النموذج. سوف تتطلب التحسينات اللاحقة ملف قيود CIF الضروري لأية ليغاندس ذات صلة ويجب تحميلها في علامة التبويب تكوين phenix.refine.
- مبنى نموذجي
- بعد الصقل في فينيكس، انقر على فتح في كوت في علامة التبويب النتائج لتصور خرائط SLD النيوترونية وهيكلها. انقر على علامة التبويب إدارة العرض وتحت خرائط انقر على حذف الخريطة لحذف كل من الخرائط 2FOFCWT و FOFCWT (الشكل التكميلي 25). انقر على ملف > MTZ المفتوحة، mmCIF fcf أو phs.... حدد مجلد التحسين الحالي وحدد الملف .mtz. بالنسبة لكل من خيار السعة والمراحل حدد بيانات 2FOFC WT_no_fill من القائمة المنسدلة. كرر عن طريق النقر على ملف > MTZ فتح، mmCIF fcf أو phs... وحدد البيانات FOFCWT من القائمة المنسدلة لكل من السعة والمراحل الخيار. افتح إدارة العرض وقم بالتبديل إلى التمرير للخريطة 2FOFC WT_no_fill ثم قم بالتمرير لتقليل rmsd من البيانات WT_no_fill 2FOFC إلى 1.00 (الشكل التكميلي 25). قم بالتبديل إلى التمرير للخريطة FOFCWT ثم قم بالتمرير لتقليل rmsd من FOFCWT البيانات إلى 3.00.
- إجراء الفحص البصري لهيكل البروتين لتحديد ما إذا كان النموذج يناسب خريطة SLD النيوترونية.
- 10- كما هو موضح في 7-1-3-2، حدد الاتجاه الصحيح وشغل المخلفات والمجموعات ذات المواقع القابلة للتبادل H/D. ضبط أوضاع المخلفات باستخدام أداة تدوير الترجمة وتحرير زوايا Chi (الشكل 6). إذا لزم الأمر، يمكن استخدام منطقة تحسين المساحة الحقيقية . إصلاح ذرات D explode من بقايا يدويا باستخدام محرر النص لإدراج إحداثيات الذرة الصحيحة
ملاحظة: لا يتم تحسين منطقة تحسين المساحة الحقيقية لخرائط SLD النيوترونية في كوت وقد تؤدي إلى أطوال غير منتظمة للذرات المرتبطة بال D، و يطلق عليها بقايا تنفجر (الشكل التكميلي 26). فمن الأفضل لتحرير يدويا الإحداثيات الذرية اللازمة وتجنب استخدام منطقة صقل الفضاء الحقيقي. - إدراج وإعادة توجيه جزيئات الماء وفقا لكثافة النيوترون. لإضافة المياه في كوت حدد ذرة مكان في رمز المؤشر وحدد لإدراج جزيء الماء (الشكل التكميلي 27A). Coot سيتم إدراج ذرة O في هذا الموضع بشكل افتراضي.
- لإضافة ذرات D إلى ذرات O من المياه المدرجة في كوت استخدام Phenix. افتح قائمة التحسين وانقر على ReadySet. بجانب خيارات تحسين النيوترون حدد فقط خيار إضافة الديوتريوم إلى جزيئات المذيبات. إلغاء تحديد إضافة الهيدروجين إلى النموذج إذا كان غائبا (الشكل التكميلي 27B والشكل التكميلي 27C).
ملاحظة: يختلف بناء النموذج باستخدام بيانات النيوترون فقط عن البناء النموذجي لهيكل مشترك للأشعة السينية/النيوترونات لأنه لا توجد بيانات بالأشعة السينية للمساهمة في تحسين إحداثيات العمود الفقري والذرات الأثقل. في تحسين المفصل، يتم استخدام خريطة كثافة الإلكترون في البداية لتحديد العمود الفقري للبروتين وإحداثيات الشاين الجانبي. ويستخدم هذا النموذج فيما بعد في تحسين بيانات الأشعة السينية/النيوترونات المشتركة التي يستمد فيها اتجاه وإشغال ذرات H/D من خريطة SLD النيوترونية. في الصقل النيوتروني فقط ، يتم اشتقاق الهيكل بأكمله من تحليل خرائط SLD النيوترونية ، مما يتطلب بناء جزيئات الماء والعمود الفقري والسلاسل الجانبية والليجاند بالإضافة إلى ذرات H / D (الشكل 6). ونسبة البيانات إلى المعلمات منخفضة في التحسينات مقابل البيانات النيوترونية وحدها، وينبغي توخي الحذر من الإفراط في تجهيز البيانات.
- إعداد الهيكل
النتائج
تم جمع بيانات الحيود النيوتروني على بلورات أحادي الأكسجين البولي السكريد الليكتري من Neurospora crassa (NcLPMO9D) على IMAGINE في HFIR في درجة حرارة الغرفة وعلى MaNDi في SNS في ظل ظروف التبريد بعد البروتوكول الموصوف أعلاه. واستخدمت بلورات البروتين المهدرجة التي تزرع في العازلة القائمة على H2O مع حجم أكبر من 0.1 مم3 (يظهر مثال توضيحي من بلورات كبيرة في الشكل التكميلي 4 والأرقام بعد ذلك). تم تركيب البلورات في الشعيرات الدموية الكوارتز وتم إجراء تبادل البخار مع العازلة المستندة إلى D2O لمدة ثلاثة أسابيع قبل جمع البيانات (الشكل 4).
تم إجراء جمع بيانات درجة حرارة الغرفة على خط شعاع IMAGINE (الشكل 1). أدى اختبار الحزمة البيضاء لمدة أربع ساعات إلى حيود عالي الدقة يشير إلى أن الكريستالة كانت ذات حجم وجودة مناسبين لمجموعة بيانات كاملة ليتم جمعها. بالإضافة إلى توفير معلومات أولية عن جودة الحيود من الكريستال، يمكن استخدام التعرض النطاق العريض الأولي لمؤشر نمط الحيود وتحديد مصفوفة اتجاه الكريستال. ونظرا للمجموعة الفضائية P21 من الكريستالة، نفذت استراتيجية لجمع البيانات من 18 إطارا مع وقت جمع قدره 20 ساعة لكل إطار. وكما هو الحال مع جمع بيانات حيود الأشعة السينية، تتطلب مجموعات الفضاء ذات التماثل الأعلى إطارات أقل (أي تغطية زاوية أقل) لجمع مجموعة بيانات كاملة. تم جمع البيانات في وضع شبه لو باستخدام نطاق الطول الموجي من 2.8 - 4.0 Å. وبعد جمع البيانات، تمت فهرسة البيانات وتحجيمها ودمجها لإعطاء ملف SLD نيوتروني بتنسيق MTZ بدقة 2.14 Å. تم تقييم البيانات لتكون ذات جودة كافية باتباع إرشادات مماثلة لتحليل بيانات الأشعة السينية ، على الرغم من أن اكتمال 80 ٪ وCC1 /2 من 0.3 على الأقل اعتبر مقبولا لأن حيود البروتين النيوتروني هو تقنية محدودة التدفق.
بعد جمع بيانات حيود النيوترون في درجة حرارة الغرفة، تم استخدام نفس البلورة لجمع مجموعة بيانات حيود الأشعة السينية لدرجة حرارة الغرفة بدقة 1.90 Å (الشكل التكميلي 13). واستخدمت بيانات الأشعة السينية لتحديد مواقع الذرات "الأثقل" بما في ذلك C وN وO و S. ثم استخدم الهيكل المكرر مقابل بيانات الأشعة السينية وحدها كنموذج للبدء في إجراء تحسين مشترك ضد بيانات الأشعة السينية والنيوترون. تم استخدام Phenix ReadySet لإضافة ذرات H في مواقع غير قابلة للتبادل ، وذرات H و D في مواقع قابلة للتبادل وذرات D إلى جزيئات الماء من نموذج الأشعة السينية الأولي. وعقب إعداد هذا النموذج، أجريت تحسينات متكررة على كل من مجموعتي البيانات (الشكل التكميلي 19 والشكل التكميلي 20). تم تنفيذ بناء نموذج تفاعلي في كوت من خلال فحص بصريا خرائط الكثافة لتوجيه السلاسل الجانبية وجزيئات الماء وفقا لذلك (الشكل التكميلي 22). واستخدمت البيانات النيوترونية في المقام الأول لتحديد حالات البروتونات وتوجهات جزيء الماء. وتوضح مقارنة خريطة كثافة الإلكترون للمخلفات مثل سيرين والتربتوفان وخريطة SLD النيوترونية المقابلة المعلومات التي يمكن الحصول عليها على حالات البروتونات في المواقع القابلة للتبادل H/D من حيود البروتين النيوتروني (الشكل 7). كما يشير تراكب خريطة لخرائط الإلكترون والنيوترونات SLD لجزيئات الماء إلى أنه في حين يمكن استنتاج تفاعلات رابطة الهيدروجين من بيانات الأشعة السينية، فإن النيوترونات توفر معلومات واضحة بشأن اتجاه هذه الروابط الهيدروجينية (الشكل 8). تم إنشاء خرائط حذف النيوترونات SLD FO-FC لتحديد حالات البروتونات واتجاه H /D للسلاسل الجانبية. ويتضح من ذلك خرائط SLD النيوترونية التي تم الحصول عليها لمخلفات التيروزين والثريونين، حيث تشير خرائط Fo-FC النيوترونية بوضوح إلى قمم إيجابية تدل على وجود H/D (الشكل 9). كما وفرت بيانات الحيود النيوتروني التي تم جمعها معلومات قيمة حول حالات البروتونات المتعددة، مثل مجموعة -ND3+ من Lys (الشكل 10). تم رصد إحصاءات الصقل (Rwork و Rfree) عن كثب أثناء تحسين النموذج لمنع الإفراط في التركيب. أعطت الإحصاءات النهائية الأشعة السينية Rwork من 12.77 ٪ وRfree من 18.21 ٪، وRwork النيوترون من 14.48 ٪ وRfree من 21.41 ٪ مع وجود 389 جزيئات الماء (الشكل التكميلي 28).
تم جمع بيانات درجة حرارة التبريد على NcLPMO9D بعد نقع الأسكوربات لتقليل الموقع النشط للنحاس من CuII إلى CuI على خط الحزم MaNDi (الشكل التكميلي 2 والشكل التكميلي 15)45. تم جمع البيانات باستخدام وضع TOF Laue بعد اختبار الحيود النيوتروني باستخدام التعرض لمدة 4 ساعات للتحقق من جودة الحيود. وبالنظر إلى المجموعة الفضائية للبلورة، وضعت استراتيجية لجمع البيانات من 18 إطارا بجرعة جمع تبلغ 80 كولومبا لكل إطار. تم جمع البيانات في وضع TOF-Laue على نطاق طول موجي من 2.0 إلى 4.0 Å. وبعد جمع البيانات، تمت فهرسة البيانات ودمجها وتحجيمها ودمجها لإعطاء ملف انعكاس بتنسيق MTZ بدقة 2.40 Å51,52.
بعد جمع البيانات، تم استخدام مجموعة بيانات حيود النيوترونات NcLPMO9D ذات درجة حرارة التبريد 2.40 في تحسين البيانات النيوترونية فقط. تم تنفيذ البيانات النيوترونية على مراحل عن طريق الاستبدال الجزيئي باستخدام PDB 5TKH كنموذج البداية. تم استخدام Phenix ReadySet لإضافة ذرات H في مواقع غير قابلة للتبادل وذرات H / D مع إشغال جزئي في مواقع قابلة للتبادل. تمت إزالة جزيئات الماء من نموذج البداية باستخدام أدوات PDB (الشكل التكميلي 23). وأعقب إعداد النموذج صقل باستخدام phenix.refine باستخدام جدول التناثر النيوتروني (الشكل التكميلي 24). تم تنفيذ بناء نموذج تفاعلي في كوت، مع إضافة جزيئات الماء باستخدام القمم الإيجابية لخريطة FO-Fc ووضعها وفقا لتفاعلات السندات الهيدروجينية المحتملة (الشكل 11A والشكل 11B). عند تحليل خرائط SLD النيوترونية ، تكون جزيئات الماء مرئية بوضوح إذا كانت مرتبة بشكل كبير ، ولكن كثافتها قد تكون كروية أو بيضاوية إذا لم تكن مرتبة بشكل جيد (الشكل 11C-E). واستخدمت خرائط النيوترونات SLD لتوفير معلومات قيمة عن اتجاه المخلفات مثل الهليون، حيث يمكن أن يكون التمييز بين مجموعات الكربونيل والأحماض الأمينية تحديا عند استخدام بيانات حيود الأشعة السينية وحدها (الشكل 12A والشكل 12B). وكانت القمم في FO-FC النيوترونية SLD حذف الخرائط أيضا مفيدة جدا في تحديد حالات بروتونات بقايا الهستيدين في N δ- أو N ε الموقف (الشكل 12C والشكل 12D). كما يمكن تحديد حالة البروتونات للمخلفات ذات المواقع المتعددة القابلة للتبادل H/D باستخدام خرائط SLD النيوترونية. وقد تجلى ذلك بوضوح مع خريطة SLD النيوترونية FO-FC من الأرجينين، والتي من المعروف أن لها شحنة إيجابية (الشكل 12E والشكل 12F). كما كان الحال من قبل ، تم منع الإفراط في المناسب من خلال مراقبة Rwork و Rfree. وأعطت الإحصاءات النهائية نسبة Rwork 22.58 في المائة وRfree 30.84 في المائة (الشكل التكميلي 29). وبالنظر إلى أن حيود البروتين النيوتروني هو تقنية محدودة التدفق يجب أن يؤخذ فيها طول التشتت السلبي وعامل التشتت الكبير غير المتماسك H في الاعتبار، يمكن توقع أن يكون لصقل بيانات النيوترون فقط إحصاءات أضعف من تحسين بيانات الأشعة السينية/النيوترونات المشتركة مع جزيئات مياه مرئية أقل (الشكل التكميلي 28 والشكل التكميلي 29).
عند تحليل خرائط SLD النيوترونية ، سيصبح من الواضح أن إلغاء الكثافة بسبب طول التشتت النيوتروني السلبي ل H سيحدث للبروتينات المهدرجة التي تعرضت لتبادل البخار مع حاجز التبلور المحتوي على D2O. ولهذا السبب، تبدو خرائط SLD النيوترونية التي يتم فيها ربط ذرات H غير القابلة للتبادل بالكربون غير مكتملة بالمقارنة مع نظيرتها في خريطة كثافة الإلكترون (الشكل 13A). وغالبا ما يكون تأثير الإلغاء أكثر وضوحا في القرارات الأكثر فقرا، مما يجعل من الضروري الحصول على بلورات بروتين ذات جودة عالية. ولذلك فمن الأفضل إجراء عملية تحسين مشتركة لعينة مع كل من الأشعة السينية وبيانات النيوترونات التي يمكن فيها استخدام بيانات الأشعة السينية لتحديد موضع العمود الفقري للبروتين (الشكل 13B). وعلاوة على ذلك، قد تكون ذرات الكبريت في السيستين والميثيونين غير مرئية بشكل كبير، مما يتطلب بيانات الأشعة السينية لوضع الذرة بدقة (الشكل 13C والشكل 13D). قد تكون المعادن ذات أطوال التشتت النيوترونية الضعيفة صعبة أيضا في النموذج في خرائط SLD النيوترونية ، كما هو واضح في خرائط LPMO9D الخاصة بنا. ولذلك فإن جمع مجموعة بيانات الأشعة السينية ذات الجرعة المنخفضة (الخالية من الضرر الإشعاعي) على نفس البلورة مفيد، لأنه يسمح بتحديد مواقع الذرة المعدنية باستخدام خرائط كثافة الإلكترون (الشكل 13E والشكل 13F).
الشكل 1: مخطط تدفق سير عمل بلورات البروتين النيوتروني. إنتاج البروتين. من أجل الحصول على بنية نيوترونية ، يتم التعبير عن البروتين لأول مرة. عادة ما يستخدم التعبير البكتيري في الوسائط القائمة على H2O أو D2O لإنتاج غلة عالية من البروتين المهدرجة أو المبرومة، على التوالي. يتم تنقية البروتين في العازلة القائمة على H2O ثم تبلور إما في العازلة التبلور H2O أو D2O على أساس لتنمو بلورات إلى الحد الأدنى لحجم 0.1 mm3. إعداد العينة: قبل جمع بيانات حيود النيوترون، تخضع البلورات المزروعة H2O لتبادل H/D لتبادل ذرات H القابلة للتكرار البروتيني مع تبادل D. H/D يمكن القيام به عن طريق النقع المباشر للبلورات في حاجز التبلور المذاب، أو توازن قطرة التبلور مع خزان قائم على D2O، أو عن طريق تركيب البلورات في الشعيرات الدموية الكوارتز لتبادل البخار مع عازل التبلور المتبلور. جمع البيانات النيوترونية: بعد تبادل H / D ، يتم فحص البلورات المحتملة لتحديد جودة الحيود. تعتبر البلورات ذات الدقة الدنيا 2.5 Å مناسبة لمجموعة بيانات كاملة ليتم جمعها. يتم تركيب البلورات في الشعيرات الدموية الكوارتز لجمع البيانات في درجة حرارة الغرفة أو فلاش المجمدة في حلقة التبريد لجمع البيانات في درجة حرارة المبردة. يتم جمع مجموعة بيانات الأشعة السينية على نفس الكريستال (أو مماثلة) في نفس درجة الحرارة. مبنى نموذجي: يتم إجراء الصقل باستخدام phenix.refine ضد كل من بيانات النيوترون والأشعة السينية أو ضد بيانات النيوترون فقط. يتم تنفيذ بناء نموذج يدوي لهيكل البروتين في كوت باستخدام خرائط SLD النيوترونية. الهيكل الكامل: بعد الانتهاء من هيكل البروتين، يتم التحقق من صحة نموذج التنسيق وإيداعه في بنك بيانات البروتين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 2: حصاد بلورات البروتين. (أ) يتم التعامل مع البلورات تحت المجهر. (ب) يتم فتح مربع شطيرة مختومة تحتوي على لوحة زجاجية السيليكون. يتم أنابيب المخزن المؤقت للخزان على الشرائح الزجاجية السيليكونية. (ج) يتم حصاد الكريستال مع microloop. (د) يتم وضع الكريستال في قطرة من الخمور الأم لغسل أي الحطام التي غالبا ما يتم حصادها جنبا إلى جنب مع الكريستال. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
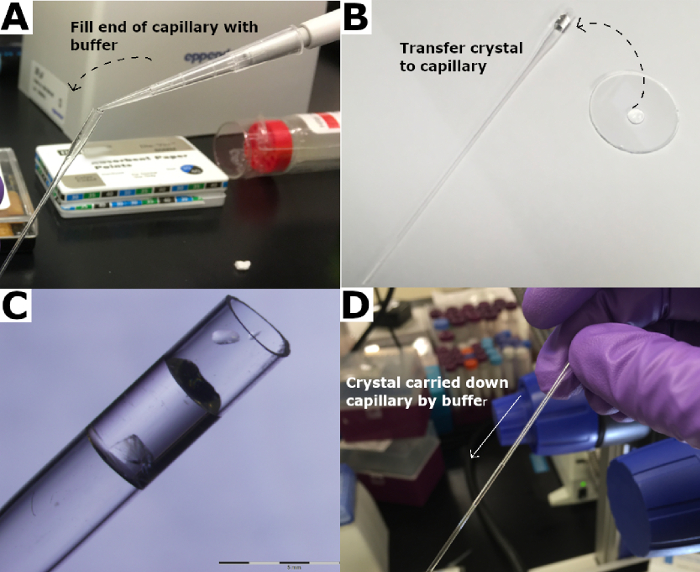
الشكل 3: نقل الكريستال إلى الكوارتز الشعرية. (أ) تمتلئ نهاية الشعيرات الدموية الكوارتز مع المخزن المؤقت للخزان. (ب) يتم نقل الكريستال إلى الشعيرات الدموية الكوارتز و (C) مغمورة في المخزن المؤقت للخزان. (د) يتم حمل الكريستال إلى أسفل الشعرية باستخدام العازلة الخزان. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
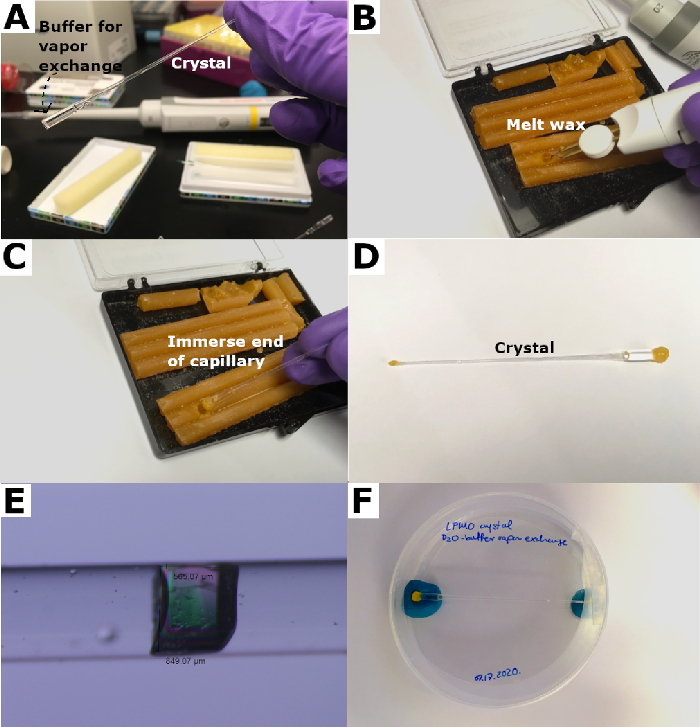
الشكل 4: ختم الشعرية الكوارتز. (أ) يضاف العازلة deuterated في نهاية الشعرية لتشكيل "المكونات". (ب) ذاب الشمع مع "عصا". (ج) يتم وضع الشعرية في الشمع الذائب لختم. (د) تتشكل شمع المقابس على كلا الطرفين لختم الشعرية. (ه) الكريستال بعد تصاعد. (F) يتم وضع الشعرية مختومة في طبق بيتري وعقد في مكان مع المعجون. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: زيادة الإشارة إلى الضوضاء في نمط الحيود النيوتروني. ومع استمرار جمع البيانات، تصبح البقع المنتشرة أكثر كثافة. (ملاحظة: صور الحيود الحية المعروضة هنا هي للتوضيح، وقد اتخذت من بلورات مختلفة.) يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
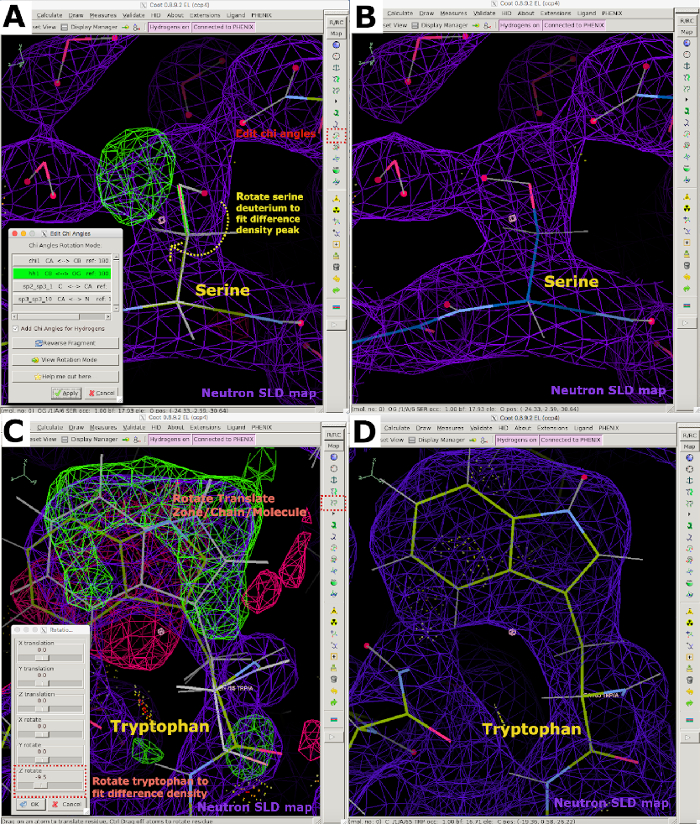
الشكل 6: بناء نموذج تفاعلي باستخدام بيانات النيوترونات في كوت. (أ) يجب إعادة توجيه ذروة كثافة النيوترونات FO-FC SLD الإيجابية (الخضراء) التي تشير إلى سيرين عن طريق تحرير زوايا تشي. يتم عرض خريطة SLD النيوترونية 2FO-FC باللون الأرجواني ويتم عرض خريطة كثافة الإلكترون 2FO-FC باللون الأزرق. (ب) وضع سيرين بشكل صحيح. (ج) إيجابية وسلبية FO-FC النيوترونية SLD قمم الكثافة (الأخضر والأحمر، على التوالي) مما يدل على أنه يجب أن تكون استدارة التربتوفان / ترجمتها لتتناسب مع ذروة كثافة الفرق. (د) التربتوفان الموجهة بشكل صحيح. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
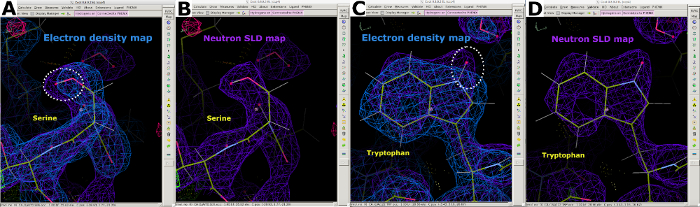
الشكل 7: معلومات إضافية من خرائط SLD النيوترونية. (أ) خريطة كثافة الإلكترون 2FO-FC (الأزرق) يعرض مواقف الذرات "أثقل" في سيرين. (ب) 2FO-FC النيوترونية SLD خريطة (الأرجواني) يعرض بوضوح موقف "أخف" ذرة D في سيرين. (C) 2FO-FC خريطة كثافة الإلكترون (الأزرق) يعرض مواقف الذرات "أثقل" في التربتوفان. (D) 2FO-FC النيوترونية SLD خريطة (الأرجواني) يعرض بوضوح موقف "أخف" ذرة D في التربتوفان. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
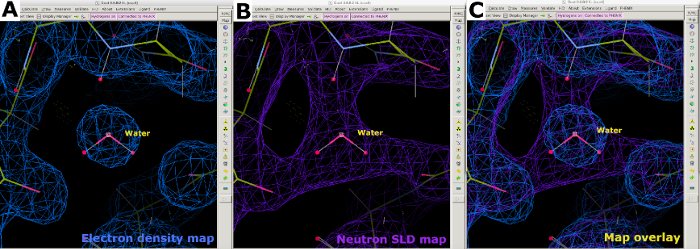
الشكل 8: تحديد موقع جزيء الماء. (أ) الشكل الكروي لخريطة كثافة الإلكترون 2FO-FC (الأزرق) للماء. (ب) توفر خريطة SLD النيوترونية 2FO-FC (الأرجواني) معلومات حول اتجاه المياه وتفاعل رابطة الهيدروجين. (ج) خريطة تراكب الإلكترون والنيوترونات SLD خرائط المياه. يتم عرض خريطة SLD النيوترونية 2FO-FC باللون الأرجواني ويتم عرض خريطة كثافة الإلكترون 2FO-FC باللون الأزرق. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
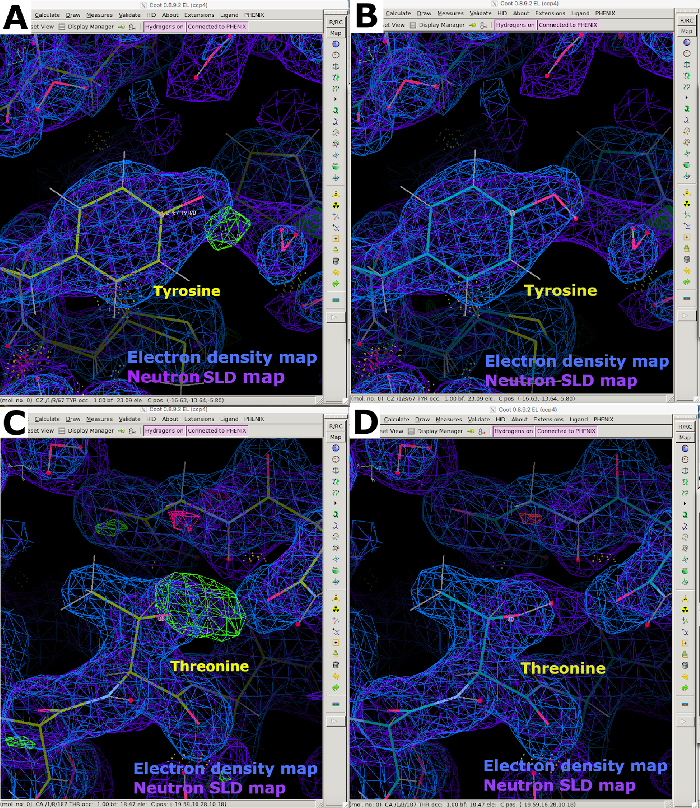
الشكل 9: خرائط SLD FO-FComit النيوترونية النيوترونية (A) توفر خريطة SLD النيوترونية FO-FC (خضراء) معلومات واضحة عن اتجاه H/D لمخلفات التيروزين. يتم عرض خريطة SLD النيوترونية 2FO-FC باللون الأرجواني ويتم عرض خريطة كثافة الإلكترون 2FO-FC باللون الأزرق. (ب) بقايا التيروزين مع اتجاه H / D الصحيح. (ج) توفر خريطة SLD النيوترونية FO-FC (الخضراء) معلومات واضحة عن اتجاه H/D لمخلفات الثريونين. (د) بقايا ثريونين مع اتجاه H / D الصحيح. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
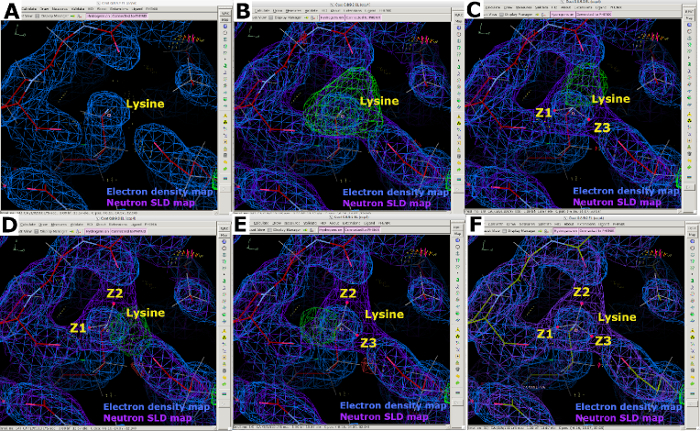
الشكل 10: حالات بروتون متعددة معروضة بخرائط SLD النيوترونية. (أ) خريطة كثافة الإلكترون 2FO-FC (الأزرق) يوفر فقط موقف ذرة N من ليسين ε-الأمونيوم المجموعة. (B-E) وFO-FC النيوترونية SLD حذف الخريطة (الأخضر) يوضح بوضوح مجموعة مشحونة إيجابيا -NH3. يتم عرض خريطة SLD النيوترونية 2FO-FC باللون الأرجواني ويتم عرض خريطة كثافة الإلكترون 2FO-FC باللون الأزرق. (F) تراكب كثافة الإلكترون وخرائط SLD النيوترونية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 11: ظهور جزيئات الماء في خرائط SLD النيوترونية. (أ) يتم وضع جزيئات الماء وفقا لخرائط SLD النيوترونية FO-FC (الخضراء) والروابط الهيدروجينية المحتملة. يتم عرض خريطة SLD النيوترونية 2FO-FC باللون الأرجواني. (ب) جزيء الماء وضعه بشكل صحيح. (C-E) الأشكال المختلفة لخرائط SLD النيوترونية لجزيئات الماء اعتمادا على العوامل B وتفاعلات السندات الهيدروجينية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
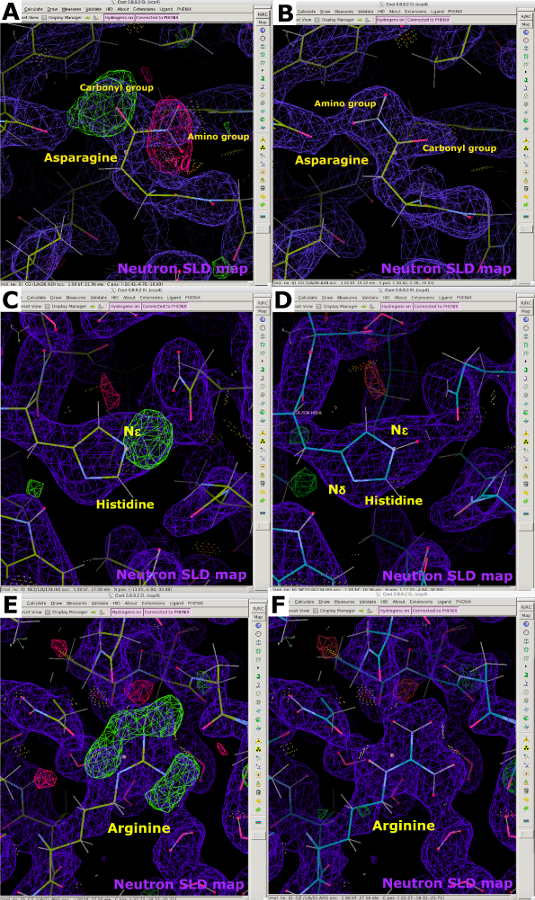
الشكل 12: معلومات عن اتجاه الأحماض الأمينية والبروتونات التي توفرها خرائط SLD النيوترونية. (أ) تشير قمم خريطة SLD FO-FC النيوترونية (الخضراء) إلى اتجاه غير صحيح لبقايا الهليون. يتم عرض خريطة SLD النيوترونية 2FO-FC باللون الأرجواني ويتم عرض خريطة كثافة الإلكترون 2FO-FC باللون الأزرق. (ب) خريطة SLD النيوترونية 2FO-FC (أرجواني) للتوجيه الهليون الصحيح. (ج) تشير قمة خريطة SLD FO-FC النيوترونية (الخضراء) إلى بروتون وحيد للهستيدين عند N ε. (D) 2FO-FC النيوترونية SLD خريطة (الأرجواني) من الهستيدين N ε-بروتون. (ه) النيوترون SLD FO-FC حذف قمم الخريطة (الأخضر) تأكيد الشحنة الإيجابية من أرجينين. (F) 2FO-FC النيوترونية SLD خريطة (الأرجواني) من أرجينين مشحونة إيجابيا. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
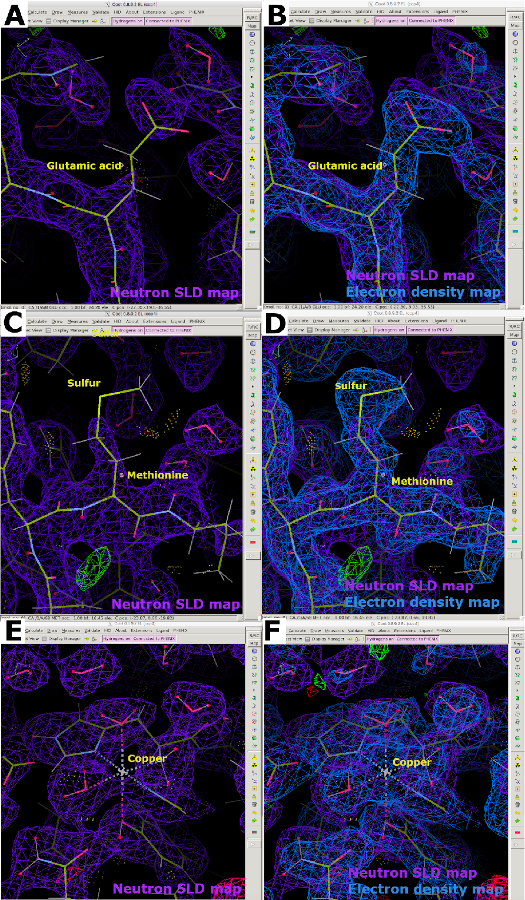
الشكل 13: خرائط SLD النيوترونية المتقطعة. (أ) خريطة SLD النيوترونية 2FO-FC (أرجوانية) لبروتين مهدرجة وبخار H/D متبادلة. يعرض حمض الغلوتاميك إلغاء خريطة SLD النيوترونية بسبب طول التشتت السلبي لذرات H غير القابلة للتبادل. (ب) خريطة كثافة الإلكترون 2FO-FC المتراكبة (زرقاء) تعرض بوضوح كثافة حمض الغلوتاميك. (ج) ذرة الكبريت في الميثيونين غير مرئية بشكل كبير في خرائط SLD النيوترونية 2FO-FC (أرجواني). (د) خريطة كثافة الإلكترون المتراكبة تعرض بوضوح كثافة الميثيونين. (ه) الذرات المعدنية، وهنا النحاس، غير مرئية بشكل سيئ في خرائط 2FO-FC SLD النيوترونية (الأرجواني). (F) خريطة كثافة الإلكترون 2FO-FC المتراكبة (زرقاء) تعرض بوضوح كثافة ذرة النحاس المنسقة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| النظائر | طول التشتت المتماسك (fm) | طول التشتت غير المتماسك (fm) |
| 1H | -3.741 | 25.274 |
| 2H | 6.671 | 4.04 |
| 12C | 6.6511 | 0 |
| 14N | 9.37 | 2 |
| 16O | 5.803 | 0 |
| 23نا | 3.63 | 3.59 |
| 24 ملغ | 5.66 | 0 |
| 31P | 5.13 | 0.2 |
| 32S | 2.804 | 0 |
| 35Cl | 11.65 | 6.1 |
| 39 ألف | 3.74 | 1.4 |
| 40Ca | 4.8 | 0 |
| 55 مليون طن | -3.73 | 1.79 |
| 56في | 9.94 | 0 |
| 63Cu | 6.43 | 0.22 |
| 64زن | 5.22 | 0 |
الجدول 1: أطوال التشتت النيوتروني وقيم التشتت غير المتماسكة. مقتبس من سيرز، 199216.
الشكل التكميلي 1: أداة IMAGINE في مفاعل النظائر عالية التدفق. (أ) أداة IMAGINE في قاعة دليل النيوترون البارد. (ب) عينة في شنت في شعرية الكوارتز تعلق مع المعجون إلى goniometer. ويغلق جدول العينة والكاشف لوضع الكريستال ولوحة الصورة الأسطوانية في شعاع النيوترون. تم تعديله بإذن من الاتحاد الدولي للبلورات53. الصور المقدمة بإذن من جينيفيف مارتن، مختبر أوك ريدج الوطني. يرجى الضغط هنا لتحميل هذا الرقم.
الشكل التكميلي 2: أداة MaNDi في مصدر نيوترون التشنج. (أ) مجموعة كاشف كاميرا الغضب MaNDi. مستنسخ بإذن من الاتحاد الدولي للبلورات11. (ب) مرحلة عينة MaNDi القابلة للتحرك. (ج) عينة مثبتة في الشعيرات الدموية الكوارتز محمولة على مقياس اليونيمتر في MaNDi لجمع بيانات درجة حرارة الغرفة. الصور المقدمة بإذن من جينيفيف مارتن، مختبر أوك ريدج الوطني. يرجى الضغط هنا لتحميل هذا الرقم.
الشكل التكميلي 3: هيكل أحادي الأكسجين السكري السكري الليكتيكي NcLPMO9D. يقع موقع NcLPMO9D النحاس النشط على سطح ربط متعدد الشاريد المسطح. يتم تنسيق النحاس من قبل اثنين من بقايا الهستيدين في "دعامة الهستيدين" الكلاسيكية، فضلا عن بقايا التيروزين المحوري. يرجى الضغط هنا لتحميل هذا الرقم.
الشكل التكميلي 4: كريستال مع حجم كاف في الجلوس قطرة تبلور صينية. (أ) تزرع بلورات كبيرة في قطرات الجلوس التي أنشئت في لوحات زجاجية سيليكون 9 جيدا. (B و C) يتم قياس البلورات لتحديد تلك التي > حجم 0.1 mm3. يرجى الضغط هنا لتحميل هذا الرقم.
الشكل التكميلي 5: مقياس الرقم القياسي الذي تم إعداده لقراءات المخزن المؤقت المقترة. يتم نقع القطب رقم الهيدروجيني في D2O قبل الاستخدام. يتم استخدام NaOD و DCl لضبط درجة الحموضة للمخازن المؤقتة deuterated. يرجى الضغط هنا لتحميل هذا الرقم.
الشكل التكميلي 6: عينة MaNDi تصاعد المبادئ التوجيهية. الأبعاد القصوى لوضع الشعيرات الدموية وعينة الكوارتز لجمع بيانات درجة حرارة الغرفة.
مستنسخة من: https://neutrons.ornl.gov/mandi/sample-environment الرجاء الضغط هنا لتحميل هذا الرقم.
الشكل التكميلي 7: إزالة العازلة الزائدة. (أ) يستنشق العازلة الزائدة من الشعيرات الدموية الكوارتز مع نصائح صغيرة. (ب) تتم إزالة العازلة المتبقية مع فتيلة ورقية رقيقة لتجفيف الشعرية تماما. يرجى الضغط هنا لتحميل هذا الرقم.
الشكل التكميلي 8: واجهة المستخدم الرسومية لاقتناء البيانات. إطار الإدخال الخاص ب "معلمات التجربة" لجمع البيانات. يرجى الضغط هنا لتحميل هذا الرقم.
الشكل التكميلي 9: واجهة المستخدم الرسومية البصريات. اختيار النطاق شبه الروى لجمع البيانات ورصد معدل تعداد النيوترونات. يرجى الضغط هنا لتحميل هذا الرقم.
الشكل التكميلي 10: جمع البيانات في واجهة المستخدم الرسومية لاكتساب البيانات. يتم تحديد وقت التعرض وعدد الإطارات والزوايا لجمع البيانات في علامة التبويب "تجميع". ثم يتم بدء جمع البيانات باستخدام "بدء المسح الضوئي". يرجى الضغط هنا لتحميل هذا الرقم.
الشكل التكميلي 11: النيوترونات المتفرقة المكتشفة والمعرضة. في نهاية وقت التعرض، تتم قراءة كاشف لوحة الصور الحساسة النيوترونية ويتم عرض نمط الحيود في واجهة المستخدم الرسومية لاكتساب البيانات. يرجى الضغط هنا لتحميل هذا الرقم.
الشكل التكميلي 12: معالجة البيانات بعد حيود النيوترون. يتم فهرسة الإطارات ودمجها وتطبيع الطول الموجي وتحجيمها باستخدام Lauegen و Lscale و Scala لإنشاء ملف انعكاس مدمج بعد جمع البيانات. يرجى الضغط هنا لتحميل هذا الرقم.
الشكل التكميلي 13: جمع بيانات الأشعة السينية. الرئيسية المصدر مولد الأشعة السينية التي أنشئت مع الكريستال الكوارتز الشعرية شنت لجمع البيانات درجة حرارة الغرفة. يرجى الضغط هنا لتحميل هذا الرقم.
الشكل التكميلي 14: المبادئ التوجيهية المتزايدة لجمع البيانات بالتبريد من MaNDi. أبعاد CrystalCaps وارتفاع الدبوس لجمع البيانات المبردة في MaNDi.
مستنسخة من: https://neutrons.ornl.gov/mandi/sample-environment الرجاء الضغط هنا لتحميل هذا الرقم.
الشكل التكميلي 15: تجميد الفلاش لجمع بيانات الحيود النيوتروني المبرد. (أ) إعداد لنقع الكريستال، والحصاد مع microloop وتجميد في النيتروجين السائل باستخدام حاوية متوافقة مع التبريد مثل ديوار رغوة. يتم نقل الكريستال المركبة مباشرة على مقياس ال مونيو cryo cryo باستخدام ملقط دبوس التبريد المبرد مسبقا. (B) يذوب ختم الشمع لإزالة الكريستال. (ج) يتم مسح الكريستال إلى نهاية الشعيرات الدموية الكوارتز للحصاد. (د) يتم نقع الكريستال بالتسلسل في المخزن المؤقت نقع الأسكوربات ومن ثم cryoprotectant تليها تجميد فلاش في النيتروجين السائل. يرجى الضغط هنا لتحميل هذا الرقم.
الشكل التكميلي 16: واجهة محاذاة العينة. تتم محاذاة الكريستال في شعاع النيوترون، ممثلة في الصليب الأزرق، عن طريق نقطة وانقر فوق توسيط. يرجى الضغط هنا لتحميل هذا الرقم.
الشكل التكميلي 17: واجهة المستخدم الرسومية CSS لجمع البيانات. يتم تحميل استراتيجية جمع البيانات، بما في ذلك جرعات التعرض والزوايا، في واجهة المستخدم الرسومية CSS. ومع استمرار جمع البيانات، سيتم عرض النيوترونات المنتشرة التي تم اكتشافها على الكاشف في الوقت الحقيقي في اللوحة العليا. يرجى الضغط هنا لتحميل هذا الرقم.
الشكل التكميلي 18: مطابقة الأعلام الخالية من R في CCP4. وتطابق الأعلام الخالية من R من البيانات النيوترونية مع الأعلام خالية من R من بيانات الأشعة السينية التي تم جمعها على نفس أو بلورة متطابقة لصقل المشتركة. يرجى الضغط هنا لتحميل هذا الرقم.
الشكل التكميلي 19: إعداد الهيكل وتحسينه. (أ) تستخدم أداة فينيكس ReadySet لإضافة إشغال مزدوج H/D في مواقع قابلة للتبادل. (ب) تستخدم بيانات النيوترون وبيانات الأشعة السينية في عملية تحسين مشتركة، بينما تم تنقيح نموذج الإدخال الأولي مقابل مجموعة بيانات الأشعة السينية التي جمعت على نفس البلورة أو بلورة متطابقة. يرجى الضغط هنا لتحميل هذا الرقم.
الشكل التكميلي 20: تكوين إعدادات التحسين. يتم تكوين نموذج الصقل وكذلك المسافات النووية لصقل بيانات الأشعة السينية / النيوترونات المشتركة. يرجى الضغط هنا لتحميل هذا الرقم.
الشكل التكميلي 21: اختيار البيانات لمبنى نموذج كوت. يتم فتح إخراج ملف PHENIX MTZ الذي يحتوي على الأشعة السينية وبيانات النيوترونات غير المعبأة في Coot لتوليد خرائط SLD الإلكترونية والنيوترونية لبناء نموذج تفاعلي. يرجى الضغط هنا لتحميل هذا الرقم.
الشكل التكميلي 22: بناء نموذج تفاعلي في كوت خلال عملية صقل مشتركة. (أ) ذروة كثافة النيوترونات FO-FC SLD الإيجابية والسلبية (الأخضر والأحمر على التوالي) تشير إلى أنه يجب إعادة توجيه المياه عن طريق الدوران/الترجمة. يتم عرض خريطة SLD النيوترونية 2FO-FC باللون الأرجواني ويتم عرض خريطة كثافة الإلكترون 2FO-FC باللون الأزرق. (ب) المياه في وضع صحيح. (ج) تشير ذروة خريطة SLD النيوترونية FO-FC الإيجابية (الخضراء) إلى أنه يجب تدوير الثريونين لمطابقة ذروة كثافة الفرق عن طريق تحرير زوايا تشي. (د) ثريونين موجهة بشكل صحيح. يرجى الضغط هنا لتحميل هذا الرقم.
الشكل التكميلي 23: إعداد الهيكل من أجل تحسين البيانات النيوترونية فقط. يتم إعداد ملف تنسيق البدء للصقل عن طريق إزالة ذرة الماء في PDBTools وإضافة إشغال H / D المزدوج في مواقع قابلة للتبادل. يرجى الضغط هنا لتحميل هذا الرقم.
الشكل التكميلي 24: تحسين البيانات النيوترونية فقط. (أ) يتم تحميل البيانات النيوترونية وكذلك نموذج البداية المعد. (ب) تستخدم إعدادات تحسين البيانات النيوترونية جدول نثر النيوترونات.
الشكل التكميلي 25: اختيار البيانات لمبنى نموذج كوت. يتم فتح البيانات النيوترونية غير المعبأة في كوت لبناء نموذج تفاعلي. يرجى الضغط هنا لتحميل هذا الرقم.
الشكل التكميلي 26: تحسين الحيز الحقيقي في كوت للمخلفات المذابة. (أ) قمم كثافة النيوترونات FO-FC الإيجابية والسلبية (الأخضر والأحمر على التوالي) مما يشير إلى أنه يجب نقل بقايا الأرجينين لتناسب ذروة كثافة FO-FC. يتم عرض خريطة SLD النيوترونية 2FO-FC باللون الأرجواني ويتم عرض خريطة كثافة الإلكترون 2FO-FC باللون الأزرق. (ب) استخدام الفضاء الحقيقي صقل النتائج في "انفجار" ذرات D بسبب المفقودين مكتبات ضبط النفس هندسة كوت. (ج) لا تتحرك الذرات D مع بقية ذرات البقايا. (D) يمكن إصلاح موضع ذرة D يدويا باستخدام محرر نصوص. يرجى الضغط هنا لتحميل هذا الرقم.
الشكل التكميلي 27: إضافة جزيئات الماء. (أ) يمكن إضافة جزيئات الماء يدويا إلى قمم كثافة خريطة SLD النيوترونية FO-FC الإيجابية (خضراء). سيتم تمثيل جزيئات الماء المدرجة في البداية بذرة O في كوت. (ب) يستخدم فينيكس ReadySet لإضافة ذرات D إلى ذرات O لجزيئات الماء. (ج) يتم إضافة جزيء الماء deuterated بنجاح. يرجى الضغط هنا لتحميل هذا الرقم.
الشكل التكميلي 28: إحصاءات الصقل. إحصاءات تحسين البيانات النهائية بعد تحسين الأشعة السينية/النيوترونات المشتركة. يرجى الضغط هنا لتحميل هذا الرقم.
الشكل التكميلي 29: إحصاءات التحسين. إحصاءات تحسين البيانات النهائية بعد تحسين البيانات النيوترونية فقط. يرجى الضغط هنا لتحميل هذا الرقم.
Discussion
البلورات البروتين النيوتروني هو تقنية حساسة للغاية للتحقيق حالات البروتونات واتجاه جزيء الماء في البروتينات. تلقي هذه المعلومات الضوء على آليات تحفيز البروتين لأن التغيرات في تفاعلات البروتونات والترابط الهيدروجيني غالبا ما تكون مركزية لكيمياء الإنزيم10. إن البلورات البروتينية النيوترونية، وإن كانت تقنية مفيدة، لها عدد من العوامل التي ينبغي أخذها في الاعتبار قبل التخطيط لإجراء تجربة حيود نيوتروني، وهي:
- الحاجة إلى بلورات بروتين كبيرة لجمع البيانات.
- خصائص متناثرة من الهيدروجين وعناصر أخرى، مثل الأيونات المعدنية.
- القيود المفروضة على هيكل الصقل ونموذج بناء البرمجيات عند العمل مع عينات deuterated.
البلورات البروتين النيوتروني هو تقنية تدفق محدودة. وعلى النقيض من مجموعات بيانات حيود الأشعة السينية، يتوقع أن تكون عوامل R الأعلى والاكتمال المنخفض والتكرار ونسب الإشارة إلى الضوضاء لمجموعات البيانات النيوترونية بسبب القيود المتأصلة في التقنية (التدفق المحدود وشبه الو والأطوال الموجية الأطول). جمع البيانات من إطار واحد عادة 12 -18 ساعة. نجاح تجربة تعتمد اعتمادا كبيرا على حجم العينة والجودة مع بلورات من 0.1 mm3 غالبا ما يكون الحد الأدنى requirement3. يتطلب الحيود النيوتروني إنتاج كميات كبيرة من البروتين لإعداد قطرات تبلور تتراوح بين 10 إلى 800 ميكرولتر. يمكن تقدير الحجم الأدنى لنمو بلورات كبيرة بما فيه الكفاية باستخدام حاسبة الحجم نظرا لمعلمات الكريستال والعينة (https://neutrons.ornl.gov/imagine). وقد تم تحقيق نمو بلورات كبيرة الأكثر انتشارا من خلال نشر بخار3. شنقا قطرة بلورة يسمح نمو بلورات في قطرات كبيرة تتراوح بين 10-25 ميكرولتر، في حين يمكن إعداد قطرات أكبر تتراوح بين ~ 50 ميكرولتر باستخدام المتاحة تجاريا يجلس إسقاط equipment14،54. يمكن استخدام ألواح زجاجية من تسع آبار السيليكون لإعداد قطرات كبيرة جدا ، مع أحجام تصل إلى 800 ميكرولتر. يتم وضع هذه الألواح الزجاجية في "صناديق ساندويتش" متاحة تجاريا من أبحاث هامبتون. وتشمل تقنيات التبلور الأخرى تبلور الدفعة ، حيث يتم إملاء حد حجم القطرة من قبل السفينة. يمكن أن تتراوح تجربة تبلور الدفعات التي تم إعدادها من الميكرويلترات إلى ملليلتر55. يمكن أيضا إجراء التبلور باستخدام تقنية غسيل الكلى التي يتم فيها توازن البروتين مع المتعجل عن طريق غشاء غسيل الكلى أو عن طريق الانتشار المضاد على طول تدرج تركيز متسرعة أو من خلال قابس مسامي مثل agarose56,57. البذر يقدم بديلا آخر للحصول على بلورات من الحجم المطلوب. وقد تم استخدام الميكرو والتكروسيد الكلي بنجاح لنمو الكريستال الكبير، بما في ذلك الكريستال الكبير من NcLPMO9D45. بعض المعرفة من الرسم البياني مرحلة البروتين، بما في ذلك تأثير درجة الحرارة على الذوبان، والمساعدة في نمو الكريستال كبيرة.
عند التخطيط لتجربة حيود نيوتروني، يعد تحسين إعداد البروتين لزيادة نسبة الإشارة إلى الضوضاء أثناء جمع بيانات الحيود أمرا ضروريا7. وللتحايل على إلغاء الكثافة والتشتت غير المتماسك العالي الناجم عن ذرات H، يمكن تحسين خرائط SLD النيوترونية عن طريق تبادل ذرات H نظيرتها D، التي تمتلك طولا إيجابيا متماسكا للتشتت وطولا منخفضا غير متماسك للتشتت. لتحقيق ذلك ، يتم تنفيذ تبادل بخار بلورة البروتين المهدرجة ضد حاجز التبلور deuterated. وهذا يضمن تبادل H / D من جزيئات المذيبات والبروتين labile، titratable H atoms23. يتم تنفيذ تبادل بخار عن طريق تركيب الكريستال المهدرجة في الشعيرات الدموية الكوارتز مع D2O المستندة إلى, deuterated تبلور العازلة "المقابس" ويمثل فعالة, تقنية لطيف الذي يتم تطبيقه في معظم الأحيان14,23,35. يمكن أن يستغرق التبادل عدة أسابيع ويفضل أن يتطلب المخزن المؤقت deuterated لتغييرها بشكل متكرر لضمان تبادل H/D الأقصى. ويمكن أيضا أن يتم تبادل H / D عن طريق نقع مباشرة الكريستال في العازلة deuterated. لتجنب وضع الكريستال تحت الضغط بسبب التعرض D2O، ينبغي أن يتم تنفيذ عملية نقع تدريجيا عن طريق زيادة تدريجية في نسبة D2O:H2O58. بالإضافة إلى ذلك، يمكن أيضا تبلور البروتين المهدرجة يمكن القيام به في العازلة deuterated لتبادل H / D في مواقع labile H22,59. ومع ذلك، تجدر الإشارة إلى أن العازلة القائمة على D2O لها تأثير على قابلية الذوبان البروتين تتطلب المزيد من التكيف من الظروف المعروفة القائمة على H2O3،59. كما لوحظ أن المخازن المؤقتة القائمة على D2O تؤدي إلى بلورات أصغر في بعض الحالات59. ويمكن تحقيق التبادل الكامل لذرات H القابلة للتكرار والمرتبطة بالكربون إلى D من خلال التعبير عن البروتينات في الوسائط المشوهة لتوليد عينة من المواد ثنائية التحلل20. وسيتم تحسين خرائط SLD النيوترونية الناتجة عن العينة المتحللة بشكل كبير، ولن تعرض بعد الآن إلغاء كثافة نظير العينة المهدرجة. وهذا مفيد عند توصيف H / D ملزمة في مواقع غير قابلة للتبادل في البروتين أو عامل مساعد. ومع ذلك، فإن التعبير عن البروتين ثنائي البروتينات مرتفع التكلفة ومنخفض في الغلة60. يقدم مركز مختبر أوك ريدج الوطني (ORNL) للبيولوجيا الجزيئية الهيكلية (CSMB) منشأة للديوتر للمستخدمين الذين يسعون إلى توليد عينة متحللة (https://www.ornl.gov/facility/csmb). عادة ما يتم تنفيذ التعبير perdeuterated في مفاعل حيوي على مقياس 1 لتر تسفر عن ~ 50 ملغ من البروتين النقي61.
بعد جمع بيانات الحيود النيوتروني، يتم إجراء الصقل وبناء نموذج تفاعلي. يمكن تشغيل التحسين باستخدام مجموعات برامج متعددة بما في ذلك phenix.refine أو nCNS أو SHELXL28،31،32،33. جناح فينيكس هو البرنامج الأكثر استخداما لصقل بيانات الحيود النيوتروني بالتزامن مع كوت الذي يستخدم لبناء النموذج يدويا من خرائط SLD النيوترونية34. على الرغم من أن كلا من فينيكس وكوت تسمح لمعالجة بيانات حيود النيوترون، فإنها قد تفتقر إلى بعض الميزات اللازمة لمعالجة الخصوصيات المرتبطة ببيانات النيوترونات والعينات deuterated. فعلى سبيل المثال، لا يحتوي Coot على تحسين هندسي للمخلفات التي تم إزالة الكوليسترول منها، مما قد يؤدي إلى مضاعفات أثناء بناء النموذج نظرا لأن ميزة "تحسين المساحة الحقيقية" تؤدي إلى بقايا "متفجرة" (الشكل التكميلي 26)62. ويمكن حل هذا عن طريق إنشاء ملفات ضبط النفس لجميع المخلفات deuterated. ومع ذلك، هذه عملية مكثفة وهذه المكتبات غير متاحة للجمهور حاليا. عند إجراء التحسينات في فينيكس، سيتم تعيين مواقع H/D القابلة للتبادل في البداية إلى 0.50 إشغال H و D. ومع إجراء التحسينات، سيتم تنقيح إشغال H و D وفقا لخرائط SLD النيوترونية. خلال بناء نموذج تفاعلي، وخرائط Fo-FC كثافة الفرق هي مفيدة جدا في تقييم الإشغالات H / D. يمكن استخدام الخرائط لتحديد المواقع التي تمتلك إشغال D عالية ، وهو مفيد بشكل خاص في الموقع النشط حيث تكون حالات البروتونات ذات صلة تحفيزيا63. حالات غامضة لا تنشأ ، ومع ذلك ، عندما H: D الإشغال قريب من 0.70:0.30 مما يؤدي إلى إلغاء إشارة كاملة في خرائط SLD النيوترونية64. وينبغي أيضا أن يؤخذ في الاعتبار أن مجموعات البيانات النيوترونية شبه لاو غالبا ما يكون اكتمال حوالي 80٪، وهو أقل من ≥ 98٪ لوحظ بشكل روتيني لبيانات الحيود الأشعة السينية. عند تكرير بيانات الحيود النيوتروني في فينيكس، يتم حساب السعة الملاحظة المفقودة (Fo) من النموذج لإكمال قائمة الانعكاس، وبالتالي إدخال تحيز النموذج. ولحصر هذا التحيز المحتمل، ينبغي فحص خرائط "no_fill" أثناء بناء نموذج تفاعلي بدلا من الخرائط "المعبأة".
يمكن للمستخدمين اختيار إجراء تحسين بيانات الأشعة السينية / النيوترون المشترك لهيكلها ، أو تحسين بيانات النيوترون فقط. قد يكون تصور خرائط SLD النيوترونية ، خاصة بدقة أقل ، مقلقا في البداية خاصة بالنسبة للبروتين المهدرجة التي لا يزال H موجودا فيها في مواقع غير قابلة للتبادل على الرغم من تبادل بخار H / D. ويؤدي ذلك إلى إلغاء خريطة كثافة النيوترونات، مما يعطي انطباعا بوجود خرائط متقطعة65,66. ويكمل جمع مجموعة بيانات الأشعة السينية المقابلة هذه الإلغاءات بشكل مفيد في عملية تنقيح مشتركة (الشكل 13A والشكل 13B). وعادة ما تنطوي استراتيجية التحسين المشترك على تكرير إحداثيات العمود الفقري للبروتين مقابل بيانات الأشعة السينية، في حين تستخدم بيانات الحيود النيوتروني لصقل موضع وإشغال ذرات H/D في المواقع القابلة للتبادل28. وبما أن إدخال الإشغال المشترك ل H/D في المواقع القابلة للتبادل يزيد من عدد البارامترات التي يجري تنقيحها، فإن التحسين المشترك مع بيانات الأشعة السينية يزيد أيضا من نسبة البيانات إلى المعلمات. يتطلب تحسين المفصل مجموعة بيانات الأشعة السينية المقابلة التي سيتم جمعها بنفس درجة الحرارة على نفس الكريستال أو الكريستال الذي يزرع في نفس الظروف. بالنسبة لبيانات حيود النيوترون التي يتم جمعها في درجة حرارة الغرفة (300 كيلوبايت)، ينبغي جمع مجموعة بيانات الأشعة السينية المقابلة في درجة حرارة الغرفة باستخدام استراتيجية لجمع البيانات بجرعة منخفضة للحد من تلف الإشعاع. وعلى النقيض من ذلك، توفر العينات المتحللة خرائط محسنة ومستمرة للنيوترونات SLD لأنها لا تملك نفس حجم إلغاء إشارة H/D. ومع ذلك، فإن طول النيوترون المتناثر لبعض العناصر بما في ذلك المعادن والكبريت يجعلها غير مرئية بشكل جيد في خرائط SLD النيوترونية، حتى لو كان البروتين قد تم تخديره (الشكل 13C-F)18. إذا كان المعدن يحتاج إلى أن يتميز، فمن الأفضل للاستفادة من الحيود الأشعة السينية في صقل مشترك أو تطبيق تقنيات التحليل الطيفي لاستكمال تجارب الحيود. غالبا ما يتم إجراء تحسينات البيانات النيوترونية فقط عندما يكون لمجموعة البيانات النيوترونية دقة عالية أو إذا تم استخدام بروتين ثنائي البروتينات. وبالإضافة إلى ذلك، فإن تحسين البيانات بالنيوترونات فقط مفيد بشكل خاص إذا كان يجري دراسة بروتين شديد الحساسية للضرر الإشعاعي، لأن الهيكل المشتق من الأشعة السينية قد يمتلك قطعا أثرية مستحثة بالإشعاع. وإذا كان لا بد من إجراء عملية صقل للبيانات النيوترونية فقط، يجب التأكد مما إذا كانت مجموعة البيانات النيوترونية المقابلة لها اكتمال ودقة كافيان.
تقدم ORNL مرفقين لجمع بيانات حيود النيوترون: خط شعاع IMAGINE في HFIR وكذلك خط الحزم MaNDi في SNS36,67. وفي حين أن كلا الجهازين يوفران وسائل فعالة لجمع مجموعة بيانات حيود نيوترونية تستخدم مبادئ مماثلة، فإن لكل أداة مواصفات فريدة ينبغي أن تؤخذ في الاعتبار عند التقدم بطلب للحصول على وقت الحزمة. تجمع IMAGINE بيانات شبه Laue وتم تحسينها لجمع بيانات درجة حرارة الغرفة على البلورات مع خلايا وحدة تصل إلى ~ 100 Å. يمكن استخدام MaNDi لجمع بيانات درجة حرارة الغرفة ودرجة حرارة التبريد التي تستخدم مجموعة TOF-Laue على بلورات مع خلايا وحدة تصل إلى ~ 300 Å. قبل جمع مجموعة بيانات كاملة، يتم إجراء اختبار على البلورة لتقييم جودة نمط الحيود الذي تم الحصول عليه والذي تتعرض فيه البلورة للشعاع النيوتروني لإطار واحد. وإذا كانت البلورة ذات جودة كافية، سيتم جمع مجموعة بيانات كاملة عن حيود النيوترونات وفهرستها ودمجها وتحجيمها ودمجها في عملية مماثلة لمعالجة بيانات الأشعة السينية. تخيل يجعل من استخدام Lauegen وLscale وMaNDi يستخدم حزمة Mantid ويستخدم ملف تعريف ثلاثي الأبعاد fitting48,50,51,68,69,70. وسيتم تزويد العلماء الذين يصبحون مستخدمين في أي من هذه المرافق بمجموعة بيانات في شكل MTZ أو HKL لمزيد من التحليل.
الحيود النيوتروني هو تقنية غير مدمرة وحساسة للغاية للتحقيق في حالة البروتونات وتفاعلات رابطة الهيدروجين للجزيئات الكبيرة البيولوجية. وهو مفيد بشكل خاص للبروتينات الحساسة للصور والبروتينات المعدنية. يجب أخذ العديد من الاعتبارات المتعلقة بهذه التقنية وكذلك معالجة البيانات في الاعتبار قبل إجراء تجربة ، ولكن النتائج تسفر عن نتائج قد تعطي فكرة قيمة عن الآلية الحفازة للبروتين ذي الاهتمام. يكمل علم بلورات البروتين النيوتروني الدراسات الحسابية والهيكلية والبيوكيميائية والمطيافية، مما يجعله أداة قيمة في مجموعة أدوات البيولوجيا من التقنيات المستخدمة لتوصيف الجزيئات البيولوجية.
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
أجريت تجارب التعبير عن البروتين وتنقية وبلورة في مركز البيولوجيا الجزيئية الهيكلية (CSMB)، وهو مرفق مستخدم للبحوث البيولوجية والبيئية تابع لوزارة الطاقة الأميركية في مختبر أوك ريدج الوطني. تم جمع بيانات حيود النيوترون في BL-11B MaNDi في مصدر نيوترون سباليشن (SNS) في ORNL الذي ترعاه شعبة مرافق المستخدمين العلميين، مكتب علوم الطاقة الأساسية، وزارة الطاقة الأمريكية. يشكر المؤلفون بريندان سوليفان على المساعدة في الحد من البيانات. تم جمع بيانات حيود الأشعة السينية في مرافق مركز التعليم الجزيئي والتكنولوجيا والابتكار البحثي (METRIC) في جامعة ولاية كارولينا الشمالية، والتي تدعمها ولاية كارولينا الشمالية. تعترف GCS بالدعم جزئيا من المؤسسة الوطنية للأبحاث (NRF) وجنوب أفريقيا وبرنامج فرص الدراسات العليا (GO!) في ORNL. FM يعترف بدعم من وزارة الزراعة الأميركية نيفا هاتش 211001.
Materials
| Name | Company | Catalog Number | Comments |
| Absorbent Paper Points Size #30-#40, 60 mm length | DiaDent/DiaVet | 218-292 | |
| Capillary wax | Hampton | HR4-328 | |
| CCP4 | Version 7.0.077 | ||
| Conical Centrifuge Tubes (15 mL) | Corning | CLS430790 | |
| Conical Centrifuge Tubes (50mL) | Corning | CLS430828 | |
| Coot | Version 0.8.9.2 | ||
| CrystalCap ALS | Hampton | HR4-779 | |
| Curved-Tip Forceps | Mitegen | TW-CTF-1 | |
| Deuterium chloride solution, 35 wt. % in D2O, ≥99 atom % D | Sigma-Aldrich | 543047 | |
| Deuterium oxide 99.9 atom % D | Sigma-Aldrich | 151882 | |
| Dual Thickness MicroLoops 1000 µm | Mitegen | M5-L18SP-1000 | |
| FiveEasy pH meter F20-Std-Kit | Mettler Toledo | 30266626 | |
| Foam Dewars Standard Vessel 800 ml | Spearlab | M-FD-800 | |
| Four Color Mounting Clay | Hampton | HR4-326 | |
| HEPES, BioUltra, for molecular biology, ≥99.5% (T), | Sigma-Aldrich | 54457 | |
| High flux rotating anode X-ray diffractomemeter with EIGER 4M detector | Rigaku, Oxford Cryostream and Dectris | XtaLAB Synergy-R | Home source X-ray diffractometer |
| Magnetic Wand Straight | Mitegen | M-R-1013198 | |
| Microloader, tip for filling Femtotips and other glass microcapillaries (for research use only), 0.5 – 20 µL, 100 mm, light gray, 192 pcs. (2 racks × 96 pcs.) | Eppendorf | 930001007 | |
| Microtubes volume 1.5 mL | Eppendorf | Z606340 | |
| Petri Dishes with Clear Lid 100 mm diameter | Fischerbrand | FB0875713 | |
| Phenix | Version 1.14-3260 | ||
| Pin Tong 18 mm | Mitegen | M-R-1013196 | |
| Pipette Volume 0.1-2.5 μL | Eppendorf Research | Z683779 | |
| Pipette Volume 100-1000 μL | Eppendorf Research | Z683825 | |
| Pipette Volume 10-100 μL | Eppendorf Research | Z683809 | |
| Pipette Volume 20-200 μL | Eppendorf Research | Z683817 | |
| Poly(ethylene glycol) BioXtra, average mol wt 3,350, powder | Sigma-Aldrich | P4338 | |
| Quartz Capillary , 1.00 mm inner diameter, 80 mm length | Hampton | HR6-146 | Thin-walled capillary |
| Research Stereomicroscope System | Olympus | SZX16 | |
| Reusable B3 (SSRL/SAM Style) Goniometer Bases | Mitegen | GB-B3-R | |
| Round - Miniature Hollow Glass Tubing (VitroTubes) Clear Fused Quartz / 1.00 mm inner diameter, 100 mm length | VitroCom | CV1012 | Thick-walled capillary |
| Sandwich Box with cover | Hampton | HR3-132 | |
| Siliconized 9 Well Glass Plate | Hampton | HR3-134 | |
| Sitting Drop Crystallization Plate (24 Big Well) | Mitegen | XQ-P-24S-A | |
| Sodium deuteroxide solution, 40 wt. % in D2O, 99 atom % D | Sigma-Aldrich | 176788 | |
| Thick Siliconized circle cover slides (22 mm x 0.96 mm) | Hampton | HR3-247 | |
| Universal Pipet Tips, 0.1 - 10 µL | VWR | 76322-528 | |
| Universal Pipet Tips, 1 - 100 µL | VWR | 76322-136 | |
| Universal Pipet Tips, 100 - 1000 µL | VWR | 76322-154 | |
| Universal Pipet Tips, 20 - 200 µL | VWR | 76322-150 | |
| Universal Pipet Tips, 1 - 20 µL | VWR | 76322-134 | |
| Wax pen | Hampton | HR4-342 |
References
- Neumann, P., Tittmann, K. Marvels of enzyme catalysis at true atomic resolution: distortions, bond elongations, hidden flips, protonation states and atom identities. Current Opinion in Structural Biology. 29, 122-133 (2014).
- Pynn, R. Neutron Scattering-A Non-destructive Microscope for Seeing Inside Matter. Neutron Applications in Earth, Energy and Environmental Sciences. , 15-36 (2009).
- O'Dell, W. B., Bodenheimer, A. M., Meilleur, F. Neutron protein crystallography: A complementary tool for locating hydrogens in proteins. Archives of Biochemistry and Biophysics. 602, 48-60 (2016).
- Niimura, N., Podjarny, A. . Neutron Protein Crystallography: Hydrogen, Protons, and Hydration in Bio-macromolecules. , (2011).
- Blakeley, M. P. P. Neutron macromolecular crystallography. Crystallography Reviews. 15 (3), 157-218 (2009).
- Blakeley, M. P., Cianci, M., Helliwell, J. R., Rizkallah, P. J. Synchrotron and neutron techniques in biological crystallography. Chemical Society Reviews. 33 (8), 548-557 (2004).
- Ashkar, R., et al. Neutron scattering in the biological sciences: progress and prospects. Acta Crystallographica Section D: Structural Biology. 74 (12), (2018).
- Teixeira, S. C. M., et al. New sources and instrumentation for neutrons in biology. Chemical Physics. 345 (2-3), 133-151 (2008).
- Furrer, A., Mesot, J., Strässle, T. . Neutron Scattering in Condensed Matter Physics. , (2009).
- Meilleur, F., Coates, L., Cuneo, M. J., Kovalevsky, A., Myles, D. A. A. The neutron macromolecular crystallography instruments at Oak Ridge national laboratory: Advances, challenges, and opportunities. Crystals. 8 (10), 1-10 (2018).
- Coates, L., et al. The Macromolecular Neutron Diffractometer MaNDi at the Spallation Neutron Source. Journal of Applied Crystallography. 48, 1302-1306 (2015).
- Coates, L., Stoica, A. D., Hoffmann, C., Richards, J., Cooper, R. The macromolecular neutron diffractometer (MaNDi) at the Spallation Neutron Source, Oak Ridge: enhanced optics design, high-resolution neutron detectors and simulated diffraction. Journal of Applied Crystallography. 43 (3), 570-577 (2010).
- Koetzle, T. F., Piccoli, P. M. B., Schultz, A. J. Single-crystal neutron diffraction studies of hydrogen-bonded systems: Two recent examples from IPNS. Nuclear Instruments and Methods in Physics Research, Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 600 (1), 260-262 (2009).
- Ng, J. D., et al. Large-volume protein crystal growth for neutron macromolecular crystallography. Acta Crystallographica Section F:Structural Biology Communications. 71, 358-370 (2015).
- Blakeley, M. P., Langan, P., Niimura, N., Podjarny, A. Neutron crystallography: opportunities, challenges, and limitations. Current Opinion in Structural Biology. 18 (5), 593-600 (2008).
- Sears, V. F. Neutron scattering lengths and cross sections. Neutron News. 3 (3), 26-37 (1992).
- Weik, M., Patzelt, H., Zaccai, G., Oesterhelt, D. Localization of glycolipids in membranes by in vivo labeling and neutron diffraction. Molecular Cell. 1 (3), 411-419 (1998).
- Helliwell, J. R. Fundamentals of neutron crystallography in structural biology. Methods in Enzymology. 634, (2020).
- Niimura, N., Bau, R. Neutron protein crystallography: Beyond the folding structure of biological macromolecules. Acta Crystallographica Section A: Foundations of Crystallography. 64 (1), 12-22 (2008).
- Hazemann, I., et al. High-resolution neutron protein crystallography with radically small crystal volumes: Application of perdeuteration to human aldose reductase. Acta Crystallographica Section D: Biological Crystallography. 61 (10), 1413-1417 (2005).
- Niimura, N., Chatake, T., Ostermann, A., Kurihara, K., Tanaka, I. High resolution neutron protein crystallography. Hydrogen and hydration in proteins. Zeitschrift für Kristallographie - Crystalline Materials. 218 (2), (2003).
- Meilleur, F., Contzen, J., Myles, D. A. A., Jung, C. Structural stability and dynamics of hydrogenated and perdeuterated cytochrome P450cam (CYP101). Biochemistry. 43 (27), 8744-8753 (2004).
- Bennett, B. C., Gardberg, A. S., Blair, M. D., Dealwis, C. G. On the determinants of amide backbone exchange in proteins: A neutron crystallographic comparative study. Acta Crystallographica Section D: Biological Crystallography. 64 (7), 764-783 (2008).
- Meilleur, F., Kovalevsky, A., Myles, D. A. A. IMAGINE: The neutron protein crystallography beamline at the high flux isotope reactor. Methods in Enzymology. 634, (2020).
- Wang, X. P., et al. A suite-level review of the neutron single-crystal diffraction instruments at Oak Ridge National Laboratory. Review of Scientific Instruments. 89 (9), 092802 (2018).
- Wlodawer, A., Hendrickson, W. A. A procedure for joint refinement of macromolecular structures with X-ray and neutron diffraction data from single crystals. Acta Crystallographica Section A. 38 (2), 239-247 (1982).
- Halle, B. Biomolecular cryocrystallography: Structural changes during flash-cooling. Proceedings of the National Academy of Sciences of the United States of America. 101 (14), 4793-4798 (2004).
- Adams, P. D., Mustyakimov, M., Afonine, P. V., Langan, P. Generalized X-ray and neutron crystallographic analysis: More accurate and complete structures for biological macromolecules. Acta Crystallographica Section D: Biological Crystallography. 65 (6), 567-573 (2009).
- Berman, H. M., et al. The Protein Data Bank. Acta Crystallographica Section D Biological Crystallography. 58 (6), 899-907 (2002).
- Liebschner, D., Afonine, P. V., Moriarty, N. W., Langan, P., Adams, P. D. Evaluation of models determined by neutron diffraction and proposed improvements to their validation and deposition. Acta Crystallographica Section D: Structural Biology. 74, 800-813 (2018).
- Afonine, P. V., Mustyakimov, M., Grosse-Kunstleve, R. W., Moriarty, N. W., Langan, P., Adams, P. D. Joint X-ray and neutron refinement with phenix.refine. Acta Crystallographica Section D: Biological Crystallography. 66 (11), 1153-1163 (2010).
- Brünger, A. T., et al. Crystallography & NMR system: A new software suite for macromolecular structure determination. Acta Crystallographica Section D: Biological Crystallography. 54 (5), 905-921 (1998).
- Gruene, T., Hahn, H. W., Luebben, A. V., Meilleur, F., Sheldrick, G. M. Refinement of macromolecular structures against neutron data with SHELXL2013. Journal of Applied Crystallography. 47 (1), 462-466 (2014).
- Emsley, P., Lohkamp, B., Scott, W. G., Cowtan, K. Features and development of Coot. Acta Crystallographica Section D Biological Crystallography. 66 (4), 486-501 (2010).
- Lakey, J. H. Neutrons for biologists: A beginner's guide, or why you should consider using neutrons. Journal of the Royal Society Interface. 6, (2009).
- Schröder, G. C., O'Dell, W. B., Myles, D. A. A., Kovalevsky, A., Meilleur, F. IMAGINE: Neutrons reveal enzyme chemistry. Acta Crystallographica Section D: Structural Biology. 74, 778-786 (2018).
- Halsted, T. P., et al. Catalytically important damage-free structures of a copper nitrite reductase obtained by femtosecond X-ray laser and room-temperature neutron crystallography. IUCrJ. 6, 761-772 (2019).
- Meier, K. K., et al. Oxygen Activation by Cu LPMOs in Recalcitrant Carbohydrate Polysaccharide Conversion to Monomer Sugars. Chemical Reviews. 118 (5), 2593-2635 (2018).
- Beeson, W. T., Vu, V. V., Span, E. A., Phillips, C. M., Marletta, M. A. Cellulose Degradation by Polysaccharide Monooxygenases. Annual Review of Biochemistry. 84 (1), 923-946 (2015).
- Walton, P. H., Davies, G. J. On the catalytic mechanisms of lytic polysaccharide monooxygenases. Current Opinion in Chemical Biology. 31, 195-207 (2016).
- Bertini, L., et al. Catalytic Mechanism of Fungal Lytic Polysaccharide Monooxygenases Investigated by First-Principles Calculations. Inorganic Chemistry. 57 (1), 86-97 (2018).
- Hedegård, E. D., Ryde, U. Molecular mechanism of lytic polysaccharide monooxygenases. Chemical Science. 9 (15), 3866-3880 (2018).
- Hangasky, J. A., Detomasi, T. C., Marletta, M. A. Glycosidic Bond Hydroxylation by Polysaccharide Monooxygenases. Trends in Chemistry. 1 (2), 198-209 (2019).
- Bacik, J. P., et al. Neutron and Atomic Resolution X-ray Structures of a Lytic Polysaccharide Monooxygenase Reveal Copper-Mediated Dioxygen Binding and Evidence for N-Terminal Deprotonation. Biochemistry. 56 (20), 2529-2532 (2017).
- O'Dell, W. B., Agarwal, P. K., Meilleur, F. Oxygen Activation at the Active Site of a Fungal Lytic Polysaccharide Monooxygenase. Angewandte Chemie - International Edition. 56 (3), 767-770 (2017).
- O'Dell, W. B., Swartz, P. D., Weiss, K. L., Meilleur, F. Crystallization of a fungal lytic polysaccharide monooxygenase expressed from glycoengineered Pichia pastoris for X-ray and neutron diffraction. Acta Crystallographica Section:F Structural Biology Communications. 73 (2), 70-78 (2017).
- Meilleur, F., et al. The IMAGINE instrument: First neutron protein structure and new capabilities for neutron macromolecular crystallography. Acta Crystallographica Section D: Biological Crystallography. 69 (10), 2157-2160 (2013).
- Helliwell, J. R., et al. The recording and analysis of synchrotron X-radiation Laue diffraction photographs. Journal of Applied Crystallography. 22 (5), 483-497 (1989).
- Nieh, Y. P., et al. Accurate and highly complete synchrotron protein crystal Laue diffraction data using the ESRF CCD and the Daresbury Laue software. Journal of Synchrotron Radiation. 6 (5), 995-1006 (1999).
- Arzt, S., Campbell, J. W., Harding, M. M., Hao, Q., Helliwell, J. R. LSCALE - The new normalization, scaling and absorption correction program in the Daresbury Laue software suite. Journal of Applied Crystallography. 32 (3), 554-562 (1999).
- Sullivan, B., et al. Improving the accuracy and resolution of neutron crystallographic data by three-dimensional profile fitting of Bragg peaks in reciprocal space. Acta Crystallographica Section D: Structural Biology. 74 (11), 1085-1095 (2018).
- Sullivan, B., et al. BraggNet: integrating Bragg peaks using neural networks. Journal of Applied Crystallography. 52 (4), 854-863 (2019).
- Schröder, G. C., O'Dell, W. B., Myles, D. A. A., Kovalevsky, A., Meilleur, F. IMAGINE: Neutrons reveal enzyme chemistry. Acta Crystallographica Section D: Structural Biology. 74, (2018).
- Blum, M. M., et al. Preliminary time-of-flight neutron diffraction study on diisopropyl fluorophosphatase (DFPase) from Loligo vulgaris. Acta Crystallographica Section F: Structural Biology and Crystallization Communications. 63 (1), 42-45 (2007).
- Tomanicek, S. J., et al. Neutron and X-ray crystal structures of a perdeuterated enzyme inhibitor complex reveal the catalytic proton network of the Toho-1 β-lactamase for the acylation reaction. Journal of Biological Chemistry. 288 (7), 4715-4722 (2013).
- Metcalfe, C., et al. The tuberculosis prodrug isoniazid bound to activating peroxidases. Journal of Biological Chemistry. 283 (10), 6193-6200 (2008).
- Hughes, R. C., et al. Inorganic pyrophosphatase crystals from Thermococcus thioreducens for X-ray and neutron diffraction. Acta Crystallographica Section F: Structural Biology and Crystallization Communications. 68 (12), 1482-1487 (2012).
- Bennett, B. C., Meilleur, F., Myles, D. A. A., Howell, E. E., Dealwis, C. G. Preliminary neutron diffraction studies of Escherichia coli dihydrofolate reductase bound to the anticancer drug methotrexate. Acta Crystallographica Section D: Biological Crystallography. 61 (5), 574-579 (2005).
- Snell, E. H., et al. Optimizing crystal volume for neutron diffraction: D-xylose isomerase. European Biophysics Journal. 35 (7), 621-632 (2006).
- Golden, E., Attwood, P. V., Duff, A. P., Meilleur, F., Vrielink, A. Production and characterization of recombinant perdeuterated cholesterol oxidase. Analytical Biochemistry. 485, 102-108 (2015).
- Munshi, P., et al. Rapid visualization of hydrogen positions in protein neutron crystallographic structures. Acta Crystallographica Section D: Biological Crystallography. 68 (1), 35-41 (2012).
- Logan, D. T. Interactive model building in neutron macromolecular crystallography. Methods in Enzymology. 634, (2020).
- Koruza, K., Lafumat, B., Végvári, W., Knecht, S. Z., Fisher, Deuteration of human carbonic anhydrase for neutron crystallography: Cell culture media, protein thermostability, and crystallization behavior. Archives of Biochemistry and Biophysics. 645, 26-33 (2018).
- Fisher, S. J., et al. Perdeuteration: Improved visualization of solvent structure in neutron macromolecular crystallography. Acta Crystallographica Section D: Biological Crystallography. 70 (12), 3266-3272 (2014).
- Chen, J. C. H., Hanson, B. L., Fisher, S. Z., Langan, P., Kovalevsky, a. Y. Direct observation of hydrogen atom dynamics and interactions by ultrahigh resolution neutron protein crystallography. Proceedings of the National Academy of Sciences. 109 (38), 15301-15306 (2012).
- Cuypers, M. G., et al. Near-atomic resolution neutron crystallography on perdeuterated Pyrococcus furiosus rubredoxin: Implication of hydronium ions and protonation state equilibria in redox changes. Angewandte Chemie - International Edition. 52 (3), 1022-1025 (2013).
- Coates, L., Sullivan, B. The macromolecular neutron diffractometer at the spallation neutron source. Methods in Enzymology. 634, (2020).
- Ren, Z., Kingman, N. G., Borgstahl, G. E. O., Getzoff, E. D., Moffat, K. Quantitative Analysis of Time-Resolved Laue Diffraction Patterns. Journal of Applied Crystallography. 29 (3), 246-260 (1996).
- Campbell, J. W., Hao, Q., Harding, M. M., Nguti, N. D., Wilkinson, C. LAUEGEN version 6.0 and INTLDM. Journal of Applied Crystallography. 31 (3), 496-502 (1998).
- Arnold, O., et al. Mantid - Data analysis and visualization package for neutron scattering and μ SR experiments. Nuclear Instruments and Methods in Physics Research, Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 764, 156-166 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved