Method Article
中性子結晶学データの収集とタンパク質構造における水素原子のモデリング処理
要約
中性子タンパク質結晶学は、水素原子の局在化を可能にする構造技術であり、タンパク質機能の重要な機械的な詳細を提供します。ここでは、タンパク質結晶の実装、中性子回折データの収集、構造の微細化、中性子散乱長密度マップの解析のワークフローを紹介します。
要約
中性子晶出学は、生体高分子内の水素原子位置を決定し、放射線損傷を誘発しない一方で、プロトン化と水和状態に関する重要な情報を生み出す構造技術です。対照的に、X線回折は光原子の位置に関する限られた情報しか提供せず、X線ビームは感光性補因子および金属中心の放射線損傷を急速に誘発する。ここでは、オークリッジ国立研究所(ORNL)のIMAGINEとMaNDiビームラインに採用され、適当なサイズ(>0.1mm3)のタンパク質結晶が成長した後に中性子回折構造を得るためのワークフローを紹介します。中性子回折データ収集のための石英毛細血管中の水素化タンパク質結晶の取り付けについて実証する。また、重水素を交換可能な場所で水素原子の交換を確実にするために、D2O含有バッファーを有するマウントされた結晶の蒸気交換プロセスも提示される。重水素の組み込みは、水素原子の支離滅裂な散乱に起因する背景を減少させ、負のコヒーレント散乱長に起因する密度の取り消しを防ぎます。サンプルアライメントおよび室温データ収集戦略は、高磁束同位体反応器(HFIR)でのIMAGINEでの準ラウデータ収集を使用して示されています。さらに、水晶体の取り付けと液体窒素中の急速凍結、凍結データ収集用の不安定反応中間体をトラップする場合は、SNS(スマレーション中性子源)のMaNDi飛行時間計で実証されています。モデル座標と回折データファイルの作成と中性子散乱長密度(SLD)マップの可視化も行います。対象となるタンパク質の全原子構造を得るために、中性子データのみのデータや共同X線/中性子データに対する構造の微細化が最終的に議論される。中性子構造を決定するプロセスは、グリコシド結合の酸化的切断を介した再焼結合性多糖類の分解に関与する銅含有メタロタンパク質である、単糖多糖類の単糖類の結晶を用いて実証される。
概要
中性子高分子結晶学は、タンパク質の構造と基礎となる化学に独特の窓を提供する技術です。概念的にはX線回折と同様に、中性子回折は高分子構造の原子論的詳細を提供するが、中性子と核の相互作用は光原子の局在化を可能にし、しばしばX線回折1で検出することが困難である。X線回折の間、X線は電子雲から散乱し、水素(H)などの光原子が、近くにある電子密度マップでは見え難く、サブオーングストローム解像度2に近い。対照的に、中性子の散乱強度は、同じ元素の同位体が異なる散乱長さを示す、核との複雑な相互作用に依存する。したがって、水素(1H)や重水素(2HまたはD)などの光原子とその同位体は、中性子散乱長さ密度(SLD)マップにおける骨格炭素、窒素および酸素原子と同等の視認性を有する。さらに、中性子散乱の大きさは電子の数とは無関係であるため、X線散乱で観測されるように、重元素から散乱しても重元素が近くにある場合には、重元素によって散乱が隠れつづけない。中性子回折を採用する際のHとその同位体Dの視認性の向上は、触媒的に重要な残基、補因子および配位子の原発状態に関する貴重な情報を提供し、水分子の配向を助け、触媒機構およびタンパク質化学3に関する重要な情報を明らかにする。中性子回折は、特に金属中心や感光性の酸化還元剤2を有するタンパク質などのイオン化に敏感な生体試料に特に適した非破壊技術であるという利点を提供する。本稿の主な焦点は、高品質の中性子タンパク質結晶構造を得るためのワークフローの概要を提供することです。中性子散乱のさらなる応用については、関心のある読者をPodjarny et al.4、Blakeley5、Blakeleyらら、O'Dellら3に紹介し、中性子タンパク質回折とアシュカーらの優れた概要を紹介します。
中性子は主に、原子炉源での核分裂または加速器ベースのソースでのスフレ化の2つのプロセスのいずれかを採用した核反応中に生成されます8。原子炉源は 235U同位体の核分裂を採用して連続的な中性子ビームを提供し、スマレーション中性子源はターゲット(例えば水銀などの液体金属)をprotons9で爆撃してパルス中性子ビームを生成する。テネシー州オークリッジにあるオークリッジ国立研究所(ORNL)は、高磁束同位体原子炉(HFIR)の定常中性子源と、スマレーション中性子源(SNS)で60Hzパルス源の両方をホストしています。イマジンビームラインは、HFIRに位置し、生体高分子用に最適化された中性子回折計です(補足図1)10。IMAGINEは、中性子画像プレート検出器を採用し、ユニットセルエッジ<150 Åの単結晶から2.8~4.5Åの狭いバンドパスを使用して、準ラウエのデータを測定します。SNSに位置する高分子中性子回折計(MaNDi)は、球状検出器アレイフレーム(DAF)を搭載した飛行時間(TOF)ラウエ中性子回折計です(補足図2)11。MaNDiは、2.0~6.0 Å12の間で調整可能な2 Å波長帯域幅を採用することにより、ユニットセルエッジが10~300 Åの範囲にある単結晶からのデータを測定します。
中性子の生成過程はエネルギー集約性が高く、放射光源13でのX線ビームフラックスと対比すると、比較的弱い中性子ビームフラックスが生じる。データ収集中に十分な信号対雑音比を確保するためには、適切なサイズと品質14の結晶を成長させる必要があります。通常、ボリューム>0.1 mm3の結晶は、適切な統計15でデータを収集するために必要です。より低い流束に加えて、中性子とサンプル核の間の相互作用の固有の特性を考慮する必要があります16。中性子の散乱長は、同じ元素の同位体では異なり、小さな角度中性子散乱(SANS)で有利に利用され、サンプルの領域をマスクまたはハイライトする特性である-コントラストマッチング17と呼ばれるプロセス。回折実験では、H(-3.741 fm for 1H)の負のコヒーレント中性子散乱長は、炭素(12Cの6.6511fm)、窒素(14Nの場合は9.37 fm)、酸素(14Nのための9.37 fm)を含む他の生物学的に関連する原子の一貫した中性子散乱長さから、中性子散乱密度マップの特徴を取り消す可能性があります(5.803fmOの場合は5.803fmO)。 リン(31Pの場合は5.13fm)および硫黄(32Sの場合は2.804 fm)は、正(表1)12,14である。さらに、H (25.274 fm) の大きな支離滅裂な散乱の長さは、データ収集中に背景を増加させ、データセットの品質を妨げ、データ解像度を損なう7。Hによってもたらされるこれらの制限を回避するには、中性子回折のために、正のコヒーレント中性子散乱長(6.671fm)と離離滅裂散乱長(4.04fm)19を有する同位体重水素とHを交換する必要がある。 これは、H部位20におけるDの完全な組み込みを保証する完全に重い培地で増殖した生物によってタンパク質が発現するプロセスであるパーデレートによって達成することができる。また、交換可能な部位(titraable基)のみでHをDに置換することによってタンパク質を部分的に重水素化することも可能であり、非交換可能な炭素結合部位は水素化21のままである。これは、重水素化母液22中の水素化タンパク質結晶の成長によって達成することができる。しかし、最も一般的には、水素化タンパク質のH/D交換は、H2Oベースのbuffer23における適切に大きな結晶の成長後の蒸気交換によって行われる。このような場合、結晶は水晶キャピラリーに取り付けられ、D20系の母液で気相を平化する。
中性子源の限られた中性子フラックスは、数日から数週間まで、より長いデータ収集時間をもたらす24。ORNLでは、IMAGINEとMaNDiの両方が2-6 Å範囲の狭波長バンドパスを使用してデータ収集25を最適化しています。データは室温または低温で収集することができます。Cryo-dataコレクションはデータ品質を向上させる可能性があり、凍結トラップ触媒中間体の可能性を開くことができます。中性子回折データ収集後、X線データセットは通常、同じ温度または同じ条件下で成長した結晶上の同じ結晶上で収集されます26。同じ温度でのデータ収集により、X線と中性子の両方のデータに対して構造の改良が行われ、水の可視性や位置の変化、または代替立体構造を持つ残留物の占有など、温度誘発の可能性のあるアーティファクトを防ぐことができます。ジョイントX線中性子データの精製は、データ対パラメータ比を増加させ、タンパク質バックボーン座標をX線データに対して改良できる利点を提供し、中性子回折データを使用してH/D原子28の位置を調整します。これは、タンパク質上の非交換可能な部位におけるH原子による密度の取り消しが存在する部分的に重水素化されたサンプルを使用する場合に特に有用である。X線構造の数はタンパク質データバンク(PDB)に堆積する中性子構造の数をはるかに上回っていますが、X線データの改良のために最初に設計されたソフトウェアパッケージは、中性子データだけでなく、3,29,30を包含するように拡張されました。データ収集後、モデルは、phenix.refine、CNSsolve (nCNS) または SHELXL28,31,32,33 などの絞り込みパッケージを使用して改良できます。改良プロセス中に、中性子散乱密度マップを、COOT34を使用して手動フィッティングのために視覚化することができます。構造解に続いて、座標および中性子および/またはX線回折データファイルをPDBに提出し、モデルを検証して堆積させ、公開アクセス18,29,30に利用できるようにする。
タンパク質の構造解析は、多くの手法を用いてその機能とメカニズム35を探る多面的アプローチです。中性子タンパク質結晶学は、X線回折、分光法、核磁気共鳴(NMR)またはマイクロ結晶電子回折(microED)36などの追加研究からの知見を拡大し、補完するための貴重な化学的洞察を提供します。中性子タンパク質回折は、H原子が化学の中心であるため、酵素メカニズムに関する洞察を提供するためにユニークに配置されています。中性子によって誘発される放射線損傷の欠如は、メタロタンパク質37の研究に非常に適したプローブを作る。ここでは、サンプル調製からデータ収集、精製、解析までの中性子タンパク質回折のプロセスの代表的な例を紹介します(図1)。中性子回折実験に十分な大きさの結晶が、金属蛋白質ニューロスポラ・クラッサLPMO9D(NcLPMO9D)の成長を行っている。NcLPMO9Dは、グリコシド結合38,39における酸素原子挿入によるレカルシラントセルロースの分解に関与する銅含有メタロタンパク質である。NcLPMO9D活性部位は、N末端ヒスチジンと第2の保存ヒスチジンで構成される特徴的な「ヒスチジンブレース」内の単核銅中心を含む(補足図3)40。真菌性LPMのN末端はメチル化されるが、移行後の修飾は酵母における組換え発現中には起こらない。NcLPMO9D静止状態では、銅中心はCu2+酸化状態で存在し、Cu1+への単一電子還元によって活性化され、分子酸素が結合し、急速にスーパーオキシド種41,42に還元されることによって活性化される。全体的なNcLPMO9D反応は、ヒドロキシル化多糖生成物を形成するために1つの電子と2つの陽子をさらに添加する必要があります。多糖基質からの水素原子アブストラクション(HAA)を担う活性酸素種の同一性は特定されておらず、構造研究や計算研究の集中が現在進行中である。NcLPMO9D活性部位における酸化還元化学を考えると、放射線損傷の軽減は特に関連する。ここでは、NcLPMO9D結晶上の室温および低温データ収集を図示し、それぞれ46の静止状態および活性化還元型でNcLPMO9D構造を決定する。タンパク質結晶実装、データ収集用ビームライン機器の設定、データと座標ファイルの準備、全原子中性子構造をモデル化するために必要な改良ステップに重点が置かれる。
プロトコル
1. 結晶サイズ評価
- 通常光と偏光を搭載した顕微鏡を用いて結晶の大きさを測定します。最小体積が0.1mm3の結晶を選択します(補足図4)。
- 十分に大きな結晶でウェルをラベル付けし、これらの結晶を生成するために使用される結晶化条件に注意してください。
2. 重水素化結晶化バッファーの調製
- D2Oで結晶化緩衝液成分を溶解し、重結晶化緩衝液を生成する。
- 次の式を使用して、解の pD を計算してバッファーの pH を調整します。
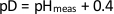 (1)
(1)
ここでpHmeasは標準的なガラス電極で測定されたpHである。NcLPMO9D結晶化バッファーの元のpHは6.0であったため、pD 6.0での重水素化結晶化バッファーに 5.6 の pHmea を使用します。 - pHメーター電極を使用前に10分間D2Oに浸します(補足図5)。
- ベースNaODまたは酸DClを使用して、pHmeas を5.6に調整します。
3. クリスタルハーベスティング
- 結晶が収穫される結晶化トレイの横にシリコン化された22mmの丸いガラススライドを置きます。水晶当たりのきれいなガラススライドを使用してください(図2A)。
- タンパク質結晶を含む密閉サンドイッチボックスを9ウェル大ボリュームシリコンガラス板に開きます。
- 結晶化貯留液からマイクロピペットで10~20μLを取り出し、ガラススライドに置きます(図2B)。
- 適切なサイズのマイクロループを使用して結晶を収穫し、ガラススライド上のリザーバー溶液ドロップに結晶を置き、結晶と一緒に収穫されることが多い破片を取り除きます(図2C および 図2D)。
注:少量の液滴が蒸発する可能性があるため、迅速に作業する必要があります。収穫された結晶は、大気にさらされると乾燥する危険性もあります。結晶が小さな結晶化液の滴量で乾燥するのを防ぐために、タンパク質の滴に貯蔵液を加える必要があるかもしれません。
4. クリスタルマウント
注: キャピラリー取り付けプロトコルは、実験者の好みによって異なります。結晶の損傷を防ぐために、短くする必要がある毛細血管は、滑らかな破断を確実にするために切削石またはサンドペーパーで採点する必要があります。
- 直径50mmの石英キャピラリーの一端を、キャピラリー作用により、または貯留槽バッファーの約10μLをキャピラリーに直接ピペットで入れます(図3A)。
注:ユーザーは、その機械的強度に加えて、中性子ビーム吸収を制限し、毛細血管からの低い背景の貢献を制限することが不可欠であるため、石英キャピラリーチューブを使用することをお勧めします。ガラスの毛細血管は高い背景を導入し、中性子を吸収し、データ品質を損なう。 - 取り付けループを使用して、水晶キャピラリー内のリザーバーバッファーにクリスタルを静かに入れます(図3B および 図3C)。
- チューブを軽くタップしてリザーバーバッファーを移動し、その中に浸漬した結晶をキャピラリー下に移動します(図3D)。
- 結晶を13.5mm以下に近づけ、キャピラリーの一端からさらに27.5mmを置きます。これが取り付けエンドになります(補足図6)。
- 長い薄いピペットチップを使用して結晶の周りの緩衝液を吸引し、結晶をわずかに濡れたままにする。結晶に触れないでください(補助図7A)。
- 細い紙の芯で毛細血管壁を乾かします(補助図7B)。
- ピペット20〜50μLの重水素化緩衝液は、取り付け端の反対側のキャピラリーの端に入る(図4A)。
- 熱「杖」で蜜蝋を溶かし、溶かした蜜蝋に毛細管をそっと挿入します。気密シールが形成されるまで繰り返します(図4B および 図4C)。
- ピペットは非常に少量の重水素化緩衝液を、毛細管の取り付け端に約5μL、ホットミツロウの「ヒートシンク」として機能させる。この端を溶かした蜜蝋に浸して、前述のように気密シールを生成し、両端に密閉された毛細管を形成する(図4D)。
- 取り付け後の顕微鏡で取り付けた結晶を点検し、気密性を確認します(図4E)。
- 15mlファルコンチューブやペトリ皿などの容器にキムワイプで取り付けた結晶を慎重に固定し、結晶が成長した温度で水平に保管します(図4F)。
5. 蒸気交換
- 重水素化されたバッファーを、結晶取り付けの 2 日後にフレッシュ バッファーに交換します。
- 加熱ループで結晶から最も遠いワックスシールを溶かし、ピペットと紙の芯を使用してバッファを取り外します。
- 重水素化緩衝液20~50μLでキャピラリーを補充し、ワックスでシールします。
- 重水素化バッファー交換を 4 日間隔でさらに 2 回繰り返して、重水素バッファー蒸気交換が完了し、少なくとも 2 週間の蒸気交換ができるようにします。
6. 中性子タンパク質回折
注:IMAGINEビームラインの詳細に興味がある読者は、Meilleurら2013年、Meilleurら201810,47に相談することをお勧めます。
- HFIRのIMAGINEビームラインでの室温データ収集
- サンプル取り付け
- パテでゴニオメーターにキャピラリーマウントクリスタルを固定します。
- サンプルスティックにゴニオメータを取り付け、オフラインアライメントステーションを使用して、ビーム内の結晶を中央に配置します。
- サンプルスティックを器具のサンプルステージに固定します(補足図1B)。
- 実験ハッチが空いていることを確認し、中性子データ収集のためにビームラインシャッターを開きます。
- データ収集
- ビームライン制御コンピュータでデータ収集プログラムを開き、[設定]タブをクリックしてデータ収集戦略を設定します。[実験パラメータ] で、[サンプル名] の横にサンプル名を入力し、[提案] の横に提案番号を入力します。[イメージの名前付け] で、[フォルダ テンプレート] を選択し、保存する取得データの保存先を設定し、[イメージ プレフィックス] を選択し、関連するフレーム名を入力します (補助図 8)。
- Optics GUIを開き、λminの場合は2.78、λmaxの場合は4.78をクリックして、データ収集の準ラウ範囲を設定します(補足図9)。
- [ 収集 ]タブに切り替え、[ 次のスキャン パラメータ] で[ 露出]の下に露出時間を秒単位で挿入し、[ N フレーム ]の下のフレーム数と、データ収集の角度を [δ φ/Frame]に挿入します。 [イメージ プレフィックス] の下で収集するフレームに名前を付け、[ スキャンの開始 ] ボタンをクリックしてデータ収集を開始します (補足図 10)。
- 回折中性子はイメージプレート検出器によって検出されます。露光の終わりに、画像プレートが読み取られ、データ取得GUIに表示されるパターンが表示されます(補足図11)。
- フレームは、担当のビームライン科学者によってLauegen、Lscale50 、Scalaを使用してインデックス化、統合、波長正規化、スケーリングされ、データ収集に続いてマージされた反射ファイルをユーザーに提供します(補足図12)。
注:IMAGINEとMaNDiの両方でのデータ収集は、Helliwellら.48およびNieh et 49が開発したラウ回折データ収集のために開発された方法論とソフトウェアを使用して、準ラウモードで行われます。 - 中性子回折データ収集後の同じ温度で同じ結晶上に対応するX線データセットを収集します(補足図13)。
注:同じ落下から、または同じ結晶化条件下で成長した結晶は、関節中性子/X線の精緻化のためのX線回折データを収集するためにも使用できます。
- サンプル取り付け
- SNSのMaNDiビームラインでのクライオデータ収集
注:ビームラインの詳細に興味を持っている読者は、コーツら(2015)、Meilleurら201810,11に相談することをお勧めます。- サンプル取り付け
- 結晶と重水素凍結保護剤の減少のための重水素化アスコルビンス浸漬溶液を準備します。これらの溶液の20μL滴を結晶板に座るドロップウェルに入れる。
注:凍結保護剤は通常、D2Oで作製されたクライオ温度X線回折データ収集に有効であることが証明された凍結保護剤です。この凍結保護剤は、必要に応じて中性子データ収集のためにさらに最適化(濃度など)することができます。 - サンプル取り付け用のループを選択し、MaNDi ガイドラインに従って磁気クライオベースに取り付けます(補足図 14)。
- 泡のクライオデュワーに液体窒素を充填します。液体窒素の中に金属の凍結防止スリーブを入れ、冷却します(補足図15A)。
- キャピラリーの両端からワックスプラグを取り外し、キャピラリーをタップしてバッファプラグを移動し、マウントされたクリスタルがバッファに浸るようにします。20 μL リザーバー溶液の落としによく座っているドロップに結晶を洗い出します(補足図 15B および 補助図 15C)。
注意:このステップは、H/D交換が重水素化緩衝液に対する結晶化滴の平衡化または重水素化緩衝液中の結晶の直接浸漬によって行われた場合には必要ない。 - アスコルビンス浸漬溶液に2時間浸漬します。磁気クライオベースに取り付けられたマイクロループに結晶を取り付ける。マウントした結晶を凍結保護剤に10秒間浸し、水晶とクライオマウントを液体窒素に突っ込んで凍結します(補足図15D)。
- 結晶が凍結したら、あらかじめ冷却されたクライオピントンを使用し、クライオストリームを取り付けたMaNDiサンプルステージに結晶を取り付けます。クライオピントングをそっと開き、結晶がクライオストリームに残っていることを確認します(補助図2C)。
- 結晶と重水素凍結保護剤の減少のための重水素化アスコルビンス浸漬溶液を準備します。これらの溶液の20μL滴を結晶板に座るドロップウェルに入れる。
- データ収集
- 実験情報が自動入力されるデータ収集ソフトウェアを開きます。
- 結晶の中央をクリックして、コンピュータ制御のゴニオメーターで中央に配置します(補足図16)。
- 表の下で、データ収集の角度を「phi」に入力し、値(補足図17)のフレームあたりの全中性子ビーム露光を入力して、データ収集戦略を設定します。
- [ 送信] をクリックしてデータ収集を開始します。
- データが収集されると、回折中性子が見えるようになります(補足図17)。露光時間が長くなるほど回折スポットが鮮明になり、信号対雑音比が向上します(図5)。
- フレームは、責任者ビームライン科学者によってMantidとLauenormを使用してインデックス化、統合、波長正規化、スケーリングされ、データcollection51に続いてマージされた強度ファイルをユーザーに提供します。
- サンプル取り付け
7. 構造の改良
- ジョイントX線・中性子のデータ精製
- 構造準備
- X線データを精緻化して 、phenix.refine ソフトウェアパッケージと手動構築用のクートを使用してタンパク質構造を得て、完成した構造を得ます。
- CCP4を開き、中性子データのRフリーデータフラグをX線データのフラグに合わせるために 、MTZへの変換/修正/拡張 プログラムを選択します。 MTZ 形式でリフレクション ファイルをインポートする場合に選択します。 [アップロードで 取得した中性子 MTZ ファイルをアップロードし、 インポート FreeR MTZ 下の X 線 mtz ファイルをアップロードします (補足図 18)。[ Out ] の下に新しい MTZ ファイルの名前を付けて、[ 実行] をクリックします。
- Phenix ソフトウェア パッケージを開き、[絞り込みツール] の下の [ReadySet ] をクリックします。 PDB ファイル の横に X 線データに対して洗練された PDB 座標ファイルをアップロードします。 [存在しない場合はモデルに水素を追加する ] を選択し、 交換可能な場所で H/D を 選択し、ドロップダウン メニューから [H] を選択します。「 溶媒分子に重水素を追加」 を選択し、残りのオプションはデフォルト値のままにします(補足図 19A)。
注:透過性タンパク質を使用する場合は、[ 存在しない場合はモデリングに水素を追加する ]オプションを選択し 、交換可能な場所でH/ Dを選択し、Dを別の場所で選択します。
- 構造の改良
- [リファインメント]タブで phenix.refine プログラムを開き、X 線と中性子の両方のデータを使用してリファインメントを設定します。入力ファイルの[設定]タブでは、ReadySet で処理されたX線構造のPDBファイルを入力し、関連するリガンドに必要なCIF拘束ファイルを入力します。CCP4を使用して割り当てられたRfreeフラグを使用して中性子データからMTZファイルをアップロードし、データタイプ見出しの下に「中性子データ」と「中性子Rフリー」として割り当てます。X線データからMTZファイルをアップロードし、データタイプ見出しの下に「X線データ」と「X線Rフリー」として割り当てます。データがアップロードされると、[スペース] グループと [データ] ラベルが自動的に入力されます (補助図 19B)。
注:細分化を行う際、結晶情報を入力する場合は、X線データから決定した単位セルを使用してください。 - 絞り込み設定の [構成] タブでは、標準の絞り込み方法を維持します。サイクル数を 5 に増やす (補足図 20)
- [すべてのパラメータ]を選択し、[高度]をクリックして[水素..]を選択します。水素精製モデルを個別に変更し、フォースライディング adp をオフにします(補足図 20)。
- [すべてのパラメーター] を選択し、[パラメーターの検索] オプションを開きます。「核」という単語を検索し、「X-H/D の核距離を使用する」を選択します(補足図 20)。
- [ 実行] を選択して絞り込みを開始します。
- [リファインメント]タブで phenix.refine プログラムを開き、X 線と中性子の両方のデータを使用してリファインメントを設定します。入力ファイルの[設定]タブでは、ReadySet で処理されたX線構造のPDBファイルを入力し、関連するリガンドに必要なCIF拘束ファイルを入力します。CCP4を使用して割り当てられたRfreeフラグを使用して中性子データからMTZファイルをアップロードし、データタイプ見出しの下に「中性子データ」と「中性子Rフリー」として割り当てます。X線データからMTZファイルをアップロードし、データタイプ見出しの下に「X線データ」と「X線Rフリー」として割り当てます。データがアップロードされると、[スペース] グループと [データ] ラベルが自動的に入力されます (補助図 19B)。
- モデル構築
- Phenix の改良に続いて、[結果] タブの [Coot で開く] をクリックして、X 線電子密度と中性子 SLD マップを視覚化します。[表示マネージャ]タブをクリックし、[マップ]で_neutronマップの横にある[マップの削除]をクリックして中性子マップを削除します(図 21)。ファイル>オープンMTZ、mmCIF fcfまたはphs.をクリックします。現在の絞り込みファイルを選択し、.mtz ファイルを開きます。[振幅]と[位相]オプションの両方で、ドロップダウンメニューから2FOFC WT_no_fill_neutronデータを選択します。これを繰り返して、FOFC WT_neutronデータを開きます。表示マネージャを開き、中性子とX線2FOFCWTマップのスクロールを切り替えて、スクロールして2FOFCWTマップのrmsdを1.00に減らします(補足図21)。中性子とX線FOFCWTマップの両方をスクロールに切り替え、FOFCWTマップのrmsdを3.00に減らすにはスクロールします。
- 残渣の目視検査を実行して、モデルがデータに適合するかどうかを判断します。差分密度マップのピークを解析して、交換可能なすべてのサイトの正しい方向と H/D 占有率を決定します。これには、セリン、スレオンニンおよびチロシンのヒドロキシル基が含まれます。ヒスチジンの窒素, グルタミン, アスパラギンとリジン;システインのスルフヒドリル;アスパラギン酸およびグルタミン酸のカルボキシル基;バックボーンアミドグループ;リガンド;補因子および潜在的な機能的な残基(図6)。
- 回転 移動ゾーン/鎖/分子 機能を使用して回転させることにより、中性子密度と水素結合相互作用に応じて水分子の方向を変える(補足図22A および 補足図22B)。 編集カイアングル ツールと回転 移動ゾーン/チェーン/分子 機能を使用して、タンパク質残留物H/D交換可能部位の位置を調整します(補足図22C および 補足図22D)。
- 構造準備
- 構造の改良 – 中性子データのみの精製
- 構造準備
- Phenixを開いて「分子置換」を選択し、分子置換によって機器科学者が提供するスケール強度の位相を導き出す「Phaser-MR(フル機能)」を選択し、pdb形式で開始座標ファイルを生成します。「入力および一般オプション 」タブで開始pdb構造を入力し、 アンサンブル、 ASUの内容 、 検索手順 のオプションを完了します。
- モデル ツールを開き、PDB ツールを選択します。pdb ファイルを入力ファイルとして挿入します。[オプション]タブに移動し、[原子選択を除去]で、溶媒、リガンド、補因子、金属の名前を選択します。これは、最小限のモデルを生成するすべての水分子、補因子、配位子および金属イオンを除去する。さらに、モデルから代替適合器を除去するを選択します(補足図23)。
- フェニックスで 絞り込みを 選択し、 ReadySet を開きます。PDB ファイルの横に編集した pdb 座標ファイルを入力します。[ 存在しない場合はモデルに水素を追加 する] を選択し 、交換可能な場所で H/D を 選択し、 中性子精製オプション のドロップダウン メニューから [H] を選択します (補足図 23)。
- 構造の改良
- Phenix の [改良] タブで、phenix.refine プログラムを開きます。[構成] タブで、[入力ファイル] ボックスの下に ReadySet で処理された PDB ファイルを入力します。[入力ファイル] ボックスに中性子データから MTZ ファイルをアップロードし、中性子データであっても[データ型]列の下に X 線データと X 線 R フリーとして割り当てます。次のステップで設定される細分化構成は、反射ファイルを中性子データとして扱うために使用されます。データがアップロードされると、[スペース] グループと [データ] ラベルが自動的に入力されます (補足図 24A)。
- 絞り込み設定の [構成] タブでは、標準の絞り込み方法を維持します。サイクル数を 5 に増やします。[その他のオプション] で、[拡散テーブル] ドロップダウン メニューから中性子を選択します。[水を更新する]オプションの選択を解除します(補足図24B)。
- すべてのパラメーター>高度>水素を選択します。新しいウィンドウで、水素精製モデルドロップダウンメニューから「個別」を選択し、「フォースライディング adp」(補足図 20) をオフにします。
- [すべてのパラメーター] > [検索パラメーター] を選択します。オプション。「核」という単語を検索し、「X-H/D の核距離を使用する」を選択します(補足図 20)。
- 絞り込みを開始するには、[ 実行 ] を選択します。
注: 初期改良に続いて、中性子 SLD マップを視覚的に検査し、クートで手動モデル構築を行う必要があります。モデルに存在するリガンド/補因子を挿入する必要があるかもしれません。その後の改良には、関連するリガンドに必要な CIF 拘束ファイルが必要であり、phenix.refine の [構成] タブにアップロードする必要があります。
- モデル構築
- Phenix の改良に続いて、[結果] タブの [Coot で開く] をクリックして、中性子 SLD マップと構造を視覚化します。[表示マネージャ]タブをクリックし、[マップ]の下で[マップの削除]をクリックして、2FOFCWTマップとFOFCWTマップの両方を削除します(補足図25)。ファイル>オープンMTZ、mmCIF fcfまたはphs..をクリックしてください。現在の絞り込みフォルダを選択し、.mtz ファイルを選択します。[振幅]と[位相]オプションの両方で、ドロップダウンメニューから2FOFC WT_no_fillデータを選択します。ファイル>開く MTZ、mmCIF fcf または phs.. をクリックして繰り返し、[振幅] オプションと [位相] オプションのドロップダウン メニューから FOFCWT データを選択します。ディスプレイ マネージャを開き、2FOFC のスクロールWT_no_fillマップをスクロールしてスクロールし、2FOFC WT_no_fill データの rmsd を 1.00 に減らします (補足図 25)。FOFCWT マップのスクロールに切り替えて、FOFCWT データの rmsd を 3.00 に減らすにはスクロールします。
- タンパク質構造の目視検査を行い、モデルが中性子SLDマップに適合するかどうかを判断します。
- 7.1.3.2で説明したように、H/D交換可能部位を有する残基および基の正しい向きとH/D占有率を決定する。[移動を回転]ツールと[カイ角度を編集](図6)を使用して、残基の位置を調整します。必要に応じて、実際空間リファインゾーンを使用できます。テキストエディタを使用して正しい原子座標を挿入することで、残渣から手動で分解するD原子を修正
注意: リアルスペースリファインゾーン は、クートの中性子SLDマップには最適化されておらず、Dに結合した原子の不規則な結合長、つまり爆発残基と呼ばれます(補足図26)。必要なアトミック座標を手動で編集し、 実際空間リファインゾーンの使用を避けることをお勧めします。 - 中性子密度に応じて水分子を挿入し、向きを変えます。クートに水を追加するには、[ ポインタに原子を配置 ]アイコンを選択し、水分子を挿入することを選択します(補足図27A)。クートはデフォルトでこの位置にO原子を挿入します。
- クートに挿入された水のO原子にD原子を追加するには、フェニックスを使用します。 絞り込み メニューを開き、[ ReadySet] をクリックします。 [中性子の改良オプション]の 横にある[ 溶媒分子に重水素を追加する]オプションのみを選択します。[存在 しない場合は、モデルに水素を追加する ]を選択解除します(補足図27B および 補足図27C)。
注: 中性子のみのデータを使用したモデル構築は、バックボーンの座標の改良に寄与するX線データがないため、ジョイントX線/中性子構造のモデル構築とは異なります。関節の改良では、電子密度マップは、最初はタンパク質のバックボーンとサイドチェーン座標を決定するために使用されます。このモデルは、その後、H/D原子の向きと占有率が中性子SLDマップから導出される、ジョイントX線/中性子データの精製で使用されます。中性子のみの精製では、構造全体が中性子SLDマップの解析に由来し、H/D原子に加えて水分子、骨格、側鎖、配位子の構築が必要です(図6)。データ対パラメータ比は、中性子データに対する細分化だけでは低く、データをオーバーフィットしないように注意する必要があります。
- 構造準備
結果
ニューロスポラ・クラッサ(NcLPMO9D)のリティック多糖モノオキシゲナーゼの結晶に関する中性子回折データを、上記のプロトコルに従ってクライオ条件下で室温でHFIRで、MaNDiでIMAGINE上で収集した。0.1mm3を超える体積を有するH2O系緩衝液で成長した水素化タンパク質の結晶が使用された(例示例は、補足図4及びその後の図に示されている)。結晶は、水晶キャピラに取り付けられ、D2Oベースのバッファとの蒸気交換を、データ収集前に3週間行った(図4)。
室温データ収集は、IMAGINEビームライン上で行った(図1)。4時間の白線試験は、結晶が収集される完全なデータセットに適したサイズと品質であることを示唆する高解像度回折につながった。結晶の回折品質に関する予備的な情報を提供することに加えて、初期の広帯域帯通過露光は、回折パターンをインデックス化し、結晶方位マトリックスを決定するために使用することができる。結晶のP21 空間群を考えると、1フレームあたり20時間の収集時間を持つ18フレームのデータ収集戦略が実施された。X線回折データ収集と同様に、対称空間グループを高くすると、完全なデータセットを収集するために必要なフレームが少なくなります(つまり、角度カバレッジが少なくなります)。データは、2.8 ~ 4.0 Å の波長範囲を使用して、準ラウ・モードで収集されました。データ収集後、データはインデックス化され、スケーリングされ、マージされ、MTZ形式の中性子SLDファイルを2.14Åの解像度で提供しました。データはX線データ分析のための同様のガイドラインに従って十分な品質であると評価されたが、中性子タンパク質回折はフラックス制限技術であるため、80%の完全性と少なくとも0.3のCC1/2 は許容可能であると考えられた。
室温中性子回折データ収集後、同じ結晶を使用して、1.90Å分解能で室温X線回折データセットを収集しました(補足図13)。X線データは、C、N、O、Sを含む「重い」原子の位置を決定するために使用された。その後、X線データに対して精製された構造を、X線および中性子データに対して関節改良を行う開始モデルとして使用した。フェニックスReadySetは、交換可能な部位でH原子、交換可能な部位でHおよびD原子、および開始X線モデルの水分子にD原子を加えるために使用された。このモデルの準備に続いて、両方のデータセットに対して反復的な改良が行われました (補足図 19 および補足図 20)。インタラクティブモデル構築は、それに応じて側鎖および水分子を配向する密度マップを視覚的に検査することによってクートで行われた(補足図22)。中性子データは主に原色状態と水分子の配向を決定するために使用された。セリンやトリプトファンなどの残基の電子密度マップと、それに対応する中性子SLDマップを比較すると、中性子タンパク質回折からH/D交換可能部位の原発状態で得ることができる情報を示しています(図7)。水分子用電子・中性子SLDマップの地図オーバーレイは、X線データから水素結合相互作用を推測できる一方で、中性子がこれらの水素結合の向きに関する明確な情報を提供することを示しています(図8)。Neutron SLD FO-FC省略マップは、側鎖の原型状態とH/D方向を決定するために生成された。図示は、チロシンおよびスレオニン残基について得られた中性子SLDマップであり、中性子Fo-FCマップはH/Dの存在を示す正のピークを明確に示している(図9)。収集された中性子回折データは、Lysの-ND3+グループなど、複数の原型状態に関する貴重な情報も提供しました(図10)。絞り込み統計(Rwork と Rfree)は、モデルの最適化中に注意深く監視され、オーバーフィットを防いだ。最終統計では、X線Rworkは12.77%、Rfreeは18.21%、中性子Rworkは14.48%、Rfreeは21.41%で、389個の水分子が存在しました(補足図28)。
銅活性部位をCuIIからCuIにMaNDiビームライン上で減少させるためにアスコルビント浸漬後のNcLPMO9D上でクライオ温度データを収集した(補足図2および補足図15)45。データは、回折の質を検証するために4時間露光を用いた中性子回折試験の後、TOF Laueモードを使用して収集した。結晶の空間群を考えると、フレームあたり80クーロンのコレクション線量を持つ18フレームのデータ収集戦略が考案された。データは2.0 ~4.0 Åの波長範囲でTOF-Laueモードで収集されました。データ収集後、データはインデックス化、統合、スケーリング、マージされ、MTZ形式のリフレクションファイルを2.40 Å51,52の解像度で提供しました。
データ収集後、2.40Åのクライオ温度NcLPMO9D中性子回折データセットを中性子のみのデータ絞め込みのために使用しました。中性子データを、PDB5TKHを出発モデルとして用いた分子置換によって段階的に行った。Phenix ReadySetは、交換不可能なサイトでH原子を追加し、交換可能なサイトで部分的な占有を伴うH/ D原子を追加するために使用されました。PDBツールを用いて、水分子を開始モデルから除去した(補足図23)。モデル調製後、中性子散乱テーブルを用いてphenix.refineを用いて改良を行った(補足図24)。インタラクティブモデル構築はクートで行われ、FO-Fcマップの正のピークを使用して水分子が添加され、潜在的な水素結合相互作用に応じて配置されました(図11Aおよび図11B)。中性子SLDマップを解析する場合、水分子は高度に秩序化されている場合ははっきりと見えますが、順序がよくなければ、その密度は球状または楕円体である可能性があります(図11C-E)。中性子SLDマップは、X線回折データを単独で使用する場合にカルボニル基とアミノ基の区別が困難なアスパラギンなどの残基の向きに関する貴重な情報を提供するために使用されました(図12Aおよび図12B)。FO-FC中性子SLD省略マップのピークは、N δ位またはN ε位におけるヒスチジン残基の原発状態を決定する上でも非常に有益であった(図12Cおよび図12D)。複数のH/D交換可能部位を有する残基の原始状態は、中性子SLDマップを用いても決定することができる。これは、正電荷を有することが知られているアルギニンのFO-FC中性子SLD省略マップで明確に示された(図12Eおよび図12F)。以前と同様に、Rwork と Rfree を監視することでオーバーフィッティングを防ぎました。最終統計量は22.58%、Rfreeは30.84%でした(補足図29)。中性子タンパク質回折は、負の散乱長とHの大きな支離滅裂散乱因子を考慮に入れなければならないフラックス制限技術であることを考えると、中性子のデータのみの精製は、目に見える水分子が少ない関節X線/中性子データ精製よりも統計が悪いことが期待できます(補足図28および補足図29)。
中性子SLDマップを解析する際に、D2O含有結晶化緩衝液との蒸気交換を行った水素化タンパク質に対してHの負の中性子散乱長による密度の欠損が起こることが明らかになります。このため、電子密度マップと比較すると、交換不可能なH原子が炭素に結合する中性子SLDマップが不完全に見える(図13A)。キャンセルの効果は、解像度が悪い場合に顕著になることが多く、高品質のタンパク質結晶を得ることが不可欠です。したがって、X線データと中性子データの両方を用いて試料の関節改良を行い、タンパク質骨格の位置を決定することが可能である(図13B)。さらに、システインおよびメチオニン中の硫黄原子は、見えにくく、正確な原子配置のためにX線データを必要とすることがある(図13C および 図13D)。中性子散乱の長さが弱い金属は、LPMO9Dマップで明らかなように、中性子SLDマップでのモデル化にも困難である可能性があります。したがって、同じ結晶上の低線量(放射線損傷のない)X線データセットの収集は、電子密度マップを用いて金属原子の位置決めが可能であるため、有用である(図13E および 図13F)。
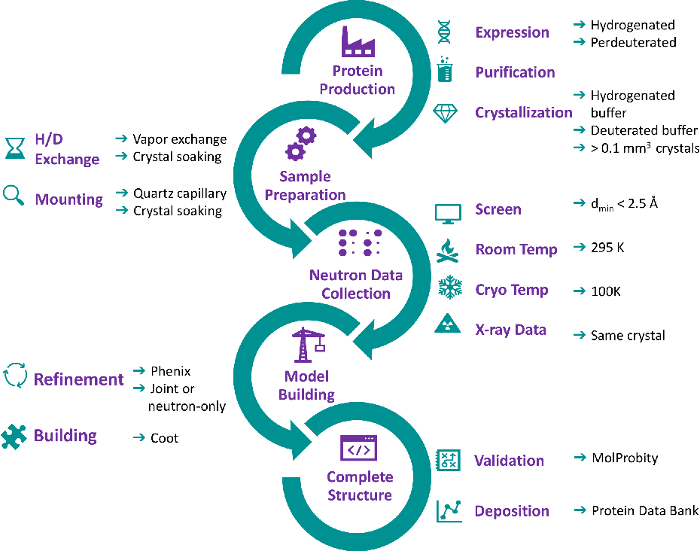
図1:中性子タンパク質結晶学ワークフローのフローチャートタンパク質の生産.中性子構造を得るためには、タンパク質が最初に発現する。H2O-またはD2O系培地における細菌発現は、通常、それぞれ、水素化または透過性の組換えタンパク質の高収率を生成するために使用される。タンパク質はH2Oベースの緩衝液で精製され、H2OまたはD2Oベースの結晶化バッファーで結晶化され、結晶を最小サイズの0.1 mm3まで成長させる。サンプルの準備:中性子回折データ収集の前に、H2O成長結晶はH/D交換を受け、タンパク質のTitratable H原子をD.H/D交換と交換し、重水素化結晶化緩衝液に結晶を直接浸すか、D2Oベースの貯留層と結晶の平衡化を行うことができる。中性子データ収集:H/D交換後、電晶は回折品質を決定するためにスクリーニングされる。最小解像度が 2.5 Å の結晶は、完全なデータセットを収集するのに適していると考えられます。結晶は、室温でデータ収集のために石英毛細血管に取り付けられ、極低温でのデータ収集のためのクライオループで凍結フラッシュ。X 線データセットは、同じ (または同一の) 結晶上で同じ温度で収集されます。モデル構築:改良は、中性子とX線の両方のデータに対して、または中性子データのみに対して、phenix.refineを使用して行われます。タンパク質構造の手動モデル構築は、中性子SLDマップを用いてクートで行われる。完全な構造:タンパク質構造の完成後、座標モデルが検証され、タンパク質データバンクに堆積します。この図の大きなバージョンを表示するには、ここをクリックしてください。
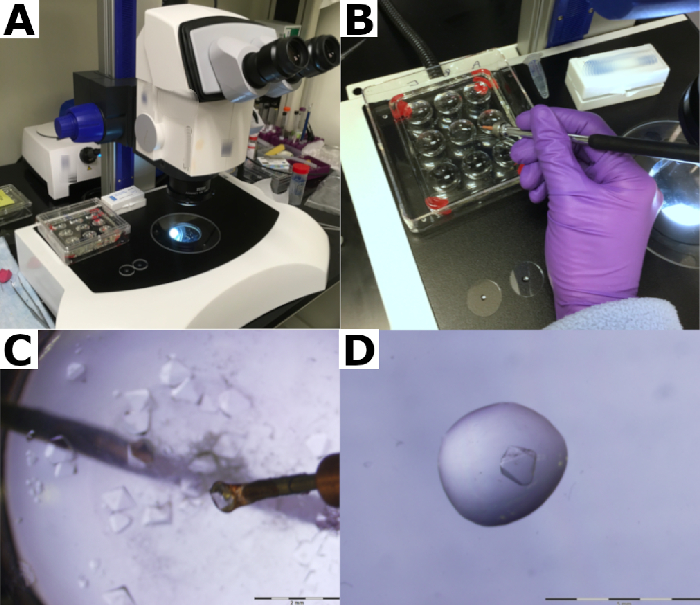
図2:タンパク質結晶の収穫 (A)結晶は顕微鏡で取り扱う。(B)シリコンガラス板を含む密閉サンドイッチボックスが開きます。リザーバーバッファーは、シリコン化ガラススライドにピペット処理されます。(C)結晶はマイクロループで収穫される。(D)結晶は、しばしば結晶と一緒に収穫される破片を洗い流すために母液の滴に置かれます。 この図の大きなバージョンを表示するには、ここをクリックしてください。
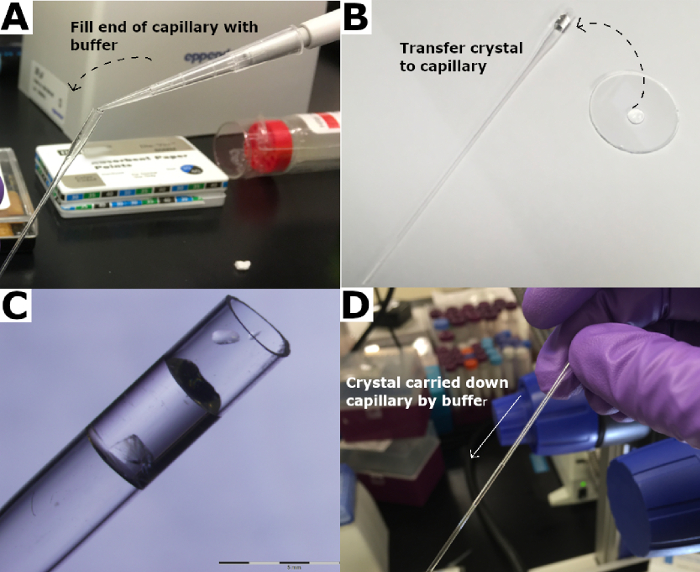
図3:水晶のキャピラリーへの結晶の移動。 (A)石英キャピラリーの端部は、リザーバーバッファーで満たされます。(B)水晶は、水晶キャピラリーに移され、(C)リザーバーバッファーに浸漬される。(D)結晶は貯留緩衝液を用いて毛細管を下に運ばれる。 この図の大きなバージョンを表示するには、ここをクリックしてください。
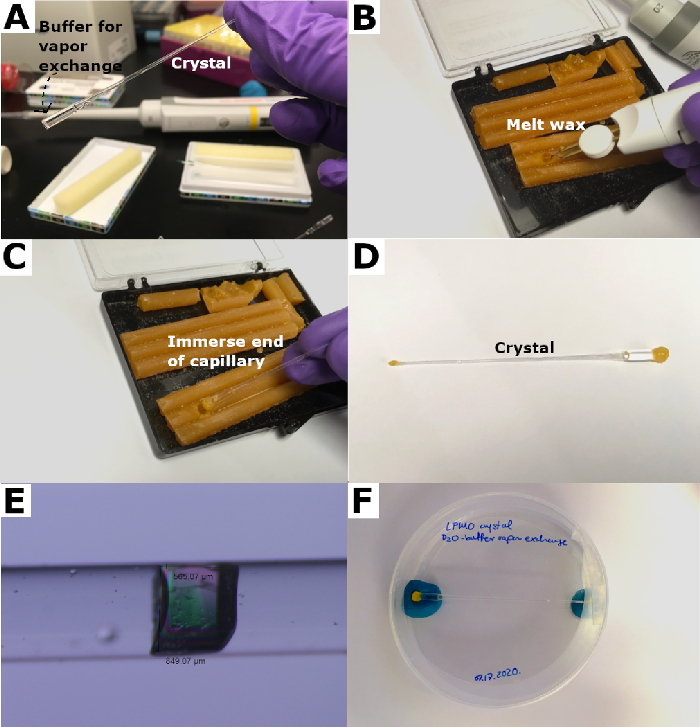
図4:石英毛管の密閉。 (A) 重症化緩衝液は、毛細管の端部に加わり、「プラグ」を形成する。(B)ワックスを「杖」で溶かします。(C)毛細管を溶かしたワックスに入れ、密封する。(D)ワックスプラグは、毛細管を密封するために両端に形成されています。(E)取り付け後の結晶。(F)密閉された毛細管はペトリ皿に入れられ、パテで所定の位置に保持される。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図5 中性子回折パターンの信号対雑音の増加 データ収集が進むにつれて、回折したスポットはより激しくなります。(注:ここで紹介するライブ回折画像は、例示のためであり、異なる結晶から撮影されました。 この図の大きなバージョンを表示するには、ここをクリックしてください。
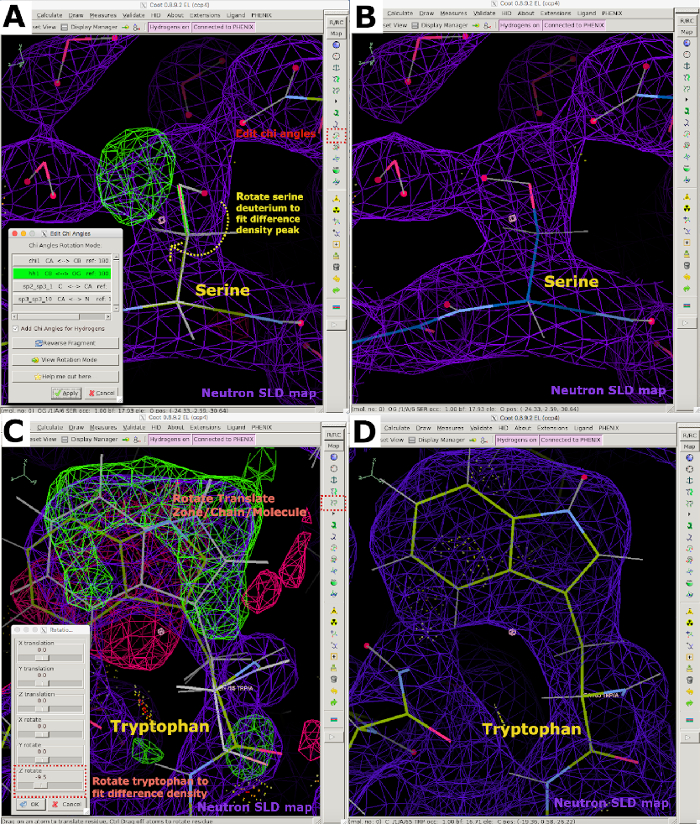
図6 クートで中性子データを使用したインタラクティブモデル構築 (A) 正のFO-FC中性子SLD密度ピーク(緑色)は、カイ角度を編集してセリンの向きを変える必要があることを示す。2FO-FC中性子SLDマップは紫色で表示され、2FO-FC電子密度マップは青色で表示されます。(B) 正しく配置されたセリン。(C) 正および負のFO-FC中性子SLD密度ピーク(それぞれ緑と赤)は、トリプトファンを回転/変換して差分密度ピークに変換しなければならないことを示す。(D) 正しい配向トリプトファン。この図の大きなバージョンを表示するには、ここをクリックしてください。
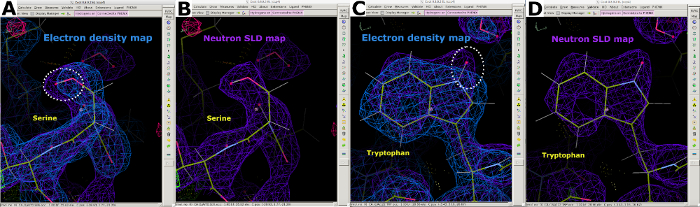
図 7: 中性子 SLD マップからの追加情報 (A)2FO-FC電子密度マップ(青)は、セリン中の「重い」原子の位置を表示する。(B) 2FO-FC中性子SLDマップ(紫色)は、セリン中の「軽い」D原子の位置を明確に表示する。(C)2FO-FC電子密度マップ(青)はトリプトファンにおける「重い」原子の位置を表示する。(D) 2FO-FC中性子SLDマップ(紫色)はトリプトファンの「軽い」D原子の位置を明確に表示する。この図の大きなバージョンを表示するには、ここをクリックしてください。
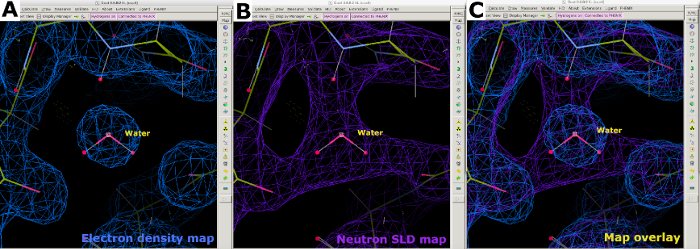
図8:水分子の位置決め。 (A) 水の2FO-FC電子密度マップ(青)の球形状。(B) 2FO-FC中性子SLDマップ(紫色)は、水の向きと水素結合の相互作用に関する情報を提供します。(C)電子と中性子SLDの水の地図のオーバーレイを地図。2FO-FC中性子SLDマップは紫色で表示され、2FO-FC電子密度マップは青色で表示されます。この図の大きなバージョンを表示するには、ここをクリックしてください。
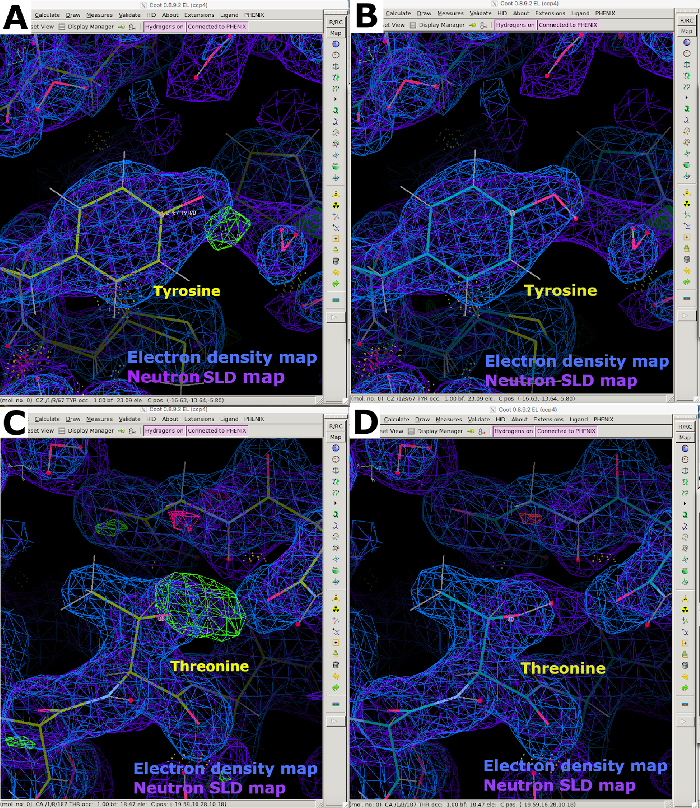
図9:中性子SLD FO-FCの地図(A) FO-FC中性子SLDマップ(緑)はチロシン残基のH/D方向に関する明確な情報を提供する。2FO-FC中性子SLDマップは紫色で表示され、2FO-FC電子密度マップは青色で表示されます。(B)正しいH/D配向を有するチロシン残基。(C) FO-FC中性子SLDマップ(緑色)は、スレオニン残基のH/D方向に関する明確な情報を提供する。(D) 正しいH/D配向を有するスレオンニン残基。この図の大きなバージョンを表示するには、ここをクリックしてください。
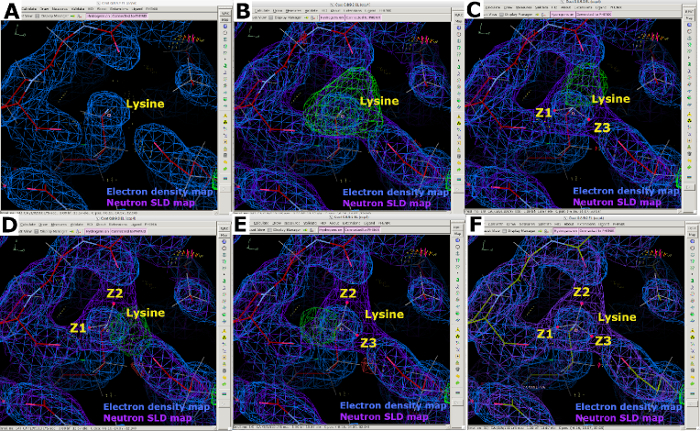
図 10: 中性子 SLD マップで表示される複数のプロトネーション状態。 (A)2FO-FC電子密度マップ(青)はリジンεアンモニウム基のN原子の位置のみを提供する。(B-E)FO-FC中性子SLD省略マップ(緑色)は、正に帯電した-NH3基を明確に示す。2FO-FC中性子SLDマップは紫色で表示され、2FO-FC電子密度マップは青色で表示されます。(F)電子密度と中性子SLDマップのオーバーレイ。この図の大きなバージョンを表示するには、ここをクリックしてください。

図11 中性子SLDマップにおける水分子の外観 (A) 水分子は、FO-FC中性子SLDマップ(緑色)と潜在的な水素結合に従って位置付けられています。2FO-FC中性子SLDマップは紫色で表示されます。(B)水分子を正しく配置する。(C-E)B因子や水素結合の相互作用に応じて、水分子の中性子SLDの様々な形状がマッピングされます。この図の大きなバージョンを表示するには、ここをクリックしてください。
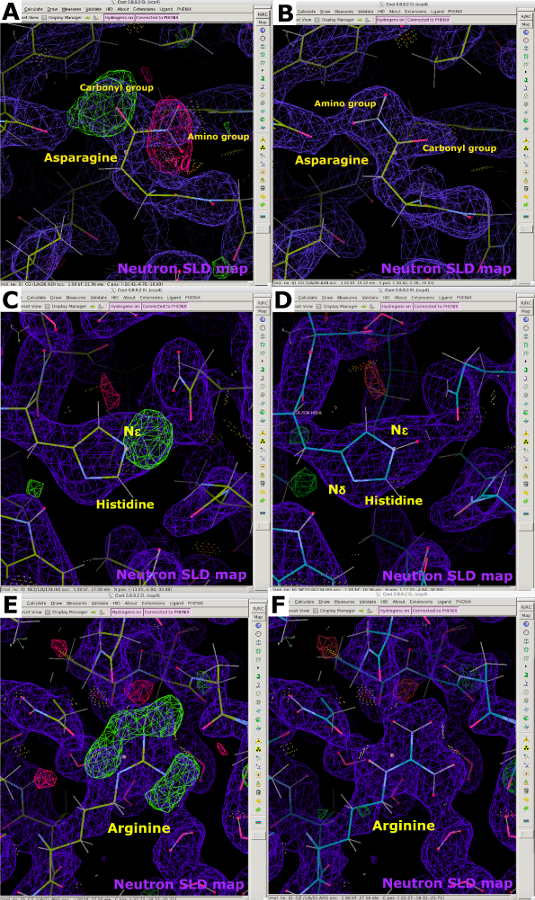
図12:中性子SLDマップで提供されるアミノ酸の配向とプロトネーションに関する情報。 (A) 中性子SLD FO-FCマップのピーク(緑色)は、アスパラギン残基の正しい向きを示します。2FO-FC中性子SLDマップは紫色で表示され、2FO-FC電子密度マップは青色で表示されます。(B) 2FO-FC 中性子SLDマップ(紫色)の正しいアスパラギン配向。(C)中性子SLD FO-FCマップピーク(緑色)は、N εでヒスチジンの単一のプロトネーションを示す。(D) ヒスチジンN ε-プロトネーションの2FO-FC中性子SLDマップ(紫色)。(E) 中性子SLD FO-FCは地図のピークを省略(緑色)アルギニンの正電荷を確認する。(F) 2FO-FC 中性子SLDマップ(紫色)の正に帯電したアルギニン。この図の大きなバージョンを表示するには、ここをクリックしてください。
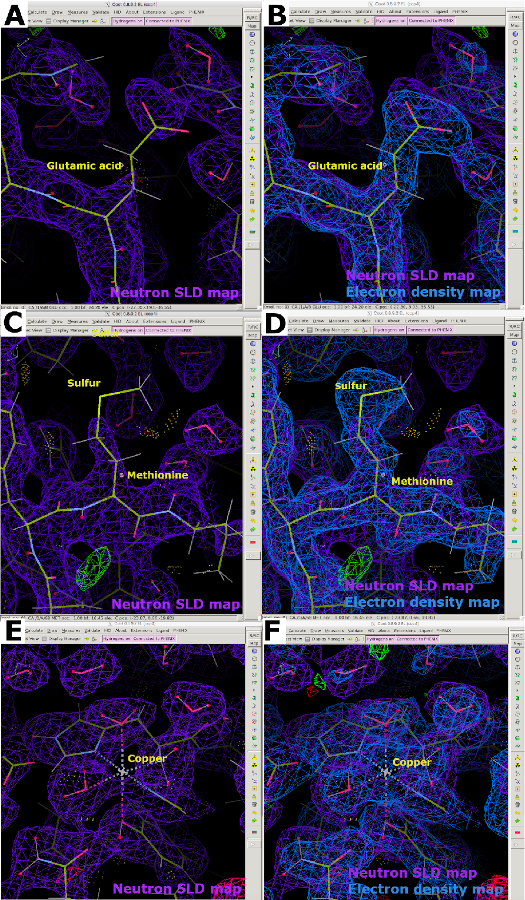
図 13: 不連続中性子 SLD マップ (A) 水素化された蒸気H/D交換タンパク質の2FO-FC中性子SLDマップ(紫色)。グルタミン酸は、非交換可能H原子の負の散乱長による中性子SLDマップのキャンセルを表示します。(B)重ね合わされた2FO-FC電子密度マップ(青)はグルタミン酸の密度を明確に示す。(C) メチオニン中の硫黄原子は、2FO-FC中性子SLDマップ(紫)では見えない。(D)重ね合わせた電子密度マップは、メチオニンの密度を明確に表示します。(E)金属原子は、ここで銅、中性子2FO-FC SLDマップ(紫色)で見えにくい。(F) 2FO-FC電子密度マップ(青)を重ね合わせ、座標銅原子の密度を明瞭に表示します。この図の大きなバージョンを表示するには、ここをクリックしてください。
| 同位元素 | コヒーレント散乱長さ (fm) | 支離滅裂散乱長(fm) |
| 1H | -3.741 | 25.274 |
| 2H | 6.671 | 4.04 |
| 12C | 6.6511 | 0 |
| 14N | 9.37 | 2 |
| 16O | 5.803 | 0 |
| 23Na | 3.63 | 3.59 |
| 24Mg | 5.66 | 0 |
| 31P | 5.13 | 0.2 |
| 32S | 2.804 | 0 |
| 35Cl | 11.65 | 6.1 |
| 39K | 3.74 | 1.4 |
| 40Ca | 4.8 | 0 |
| 55Mn | -3.73 | 1.79 |
| 56Fe | 9.94 | 0 |
| 63Cu | 6.43 | 0.22 |
| 64Zn | 5.22 | 0 |
表1:中性子散乱長と支離滅裂散乱値 シアーズから適応、199216。
補足図1:高磁束同位体反応器におけるIMAGINE装置 (A) 冷中性子ガイドホールのIMAGINE装置。(B)ゴニオメータにパテを取り付けた石英キャピラリーに取り付けられたサンプル。試料と検出器テーブルは、結晶と円筒形の画像プレートを中性子ビームに配置するために閉じます。国際結晶学連合の許可を得て変更ジュネーブ・マーティン、オークリッジ国立研究所の許可を得た画像。 こちらをクリックして、この図をダウンロードしてください。
補足図2:スマレーション中性子源におけるMaNDi計器 (A) MaNDiアンガーカメラ検出器アレイ。国際結晶学連合11の許可を得て再現。(B) MaNDi移動可能サンプルステージ。(C) 室温データ収集のためにMaNDiのゴニオメーターに取り付けられた石英キャピラリーに取り付けられたサンプル。ジュネーブ・マーティン、オークリッジ国立研究所の許可を得た画像。 こちらをクリックして、この図をダウンロードしてください。
補足図3:単糖類の単糖類の構造 NcLPMO9D. NcLPMO9D銅活性部位は平らな多糖結合面に位置する。銅は、古典的な「ヒスチジンブレース」の2つのヒスチジン残基と軸性チロシン残基によって調整される。こちらをクリックして、この図をダウンロードしてください。
補助図4:座り込み結晶化トレイに十分な体積を有する結晶。(A)9ウェルシリコンガラスプレートに設置されたシッティングドロップで大きな結晶を成長させます。(BおよびC)結晶は、体積が0.1mm3>を有するものを識別するために測定される。こちらをクリックして、この図をダウンロードしてください。
補足図5:重水素化緩衝読出量に対して設定されたpHメーター。 pH電極は、使用前にD2Oに浸漬される。NaODおよびDClは、重水素化されたバッファーのpHを調整するために使用される。 こちらをクリックして、この図をダウンロードしてください。
補足図 6: MaNDi サンプル取り付けガイドライン 室温データ収集のための石英キャピラリーおよびサンプル位置の最大寸法。
再現:https://neutrons.ornl.gov/mandi/sample-environment こちらをクリックしてこの図をダウンロードしてください。
補助図7:過剰なバッファの除去 (A)過剰な緩衝液は、マイクロキャピラリー先端を有する石英毛管から吸引される。(B)残りの緩衝液を薄い紙芯で取り出し、毛細管を完全に乾燥させる。 こちらをクリックして、この図をダウンロードしてください。
補足図 8: データ取得 GUI データ収集のための「実験パラメータ」の入力ウィンドウ。 こちらをクリックして、この図をダウンロードしてください。
補足図 9: 光学 GUI. 中性子数率のデータ収集とモニタリングのための準ラウの範囲の選択。 こちらをクリックして、この図をダウンロードしてください。
補足図 10: データ収集 GUI でのデータ収集 データ収集の露出時間、フレーム数、角度は「収集」タブで指定します。その後、データ収集は「スキャン開始」を使用して開始されます。 こちらをクリックして、この図をダウンロードしてください。
補足図11:回折中性子検出・表示 露光時間の終わりに、 中性子感受性画像板検出器が読み出され、回折パターンがデータ取得GUIに表示されます。 こちらをクリックして、この図をダウンロードしてください。
補助図12:中性子回折後のデータ処理 フレームは、データ収集に続いてマージされた反射ファイルを生成するために、Lauegen、Lscale、Scalaを使用して、インデックス、統合、波長正規化、スケーリングされます。 こちらをクリックして、この図をダウンロードしてください。
補足図13:X線データ収集。 室温データ収集用の石英キャピラリーマウント結晶を設置したホームソースX線発生装置。 こちらをクリックして、この図をダウンロードしてください。
補足図 14: MaNDi クライオ データ収集の取り付けガイドライン MaNDiでのクライオデータ収集のためのクリスタルキャップとピンの高さの寸法。
再現:https://neutrons.ornl.gov/mandi/sample-environment こちらをクリックしてこの図をダウンロードしてください。
補助図15:クライオ中性子回折データ収集用フラッシュ凍結(A)発泡デュワーなどのクライオ対応容器を用いて、水晶浸漬、マイクロループでの収穫、液体窒素中の凍結をセットアップする。取り付けられた結晶は、あらかじめ冷却されたクライオピントングを使用してビームラインクライオゴニオメータに直接転送されます。(C)結晶は収穫のために石英毛管の端まで洗い流される。(D)結晶をアスコルビンス浸漬緩衝液に順次浸漬し、次に凍結保護剤に続いて液体窒素中でフラッシュ凍結する。こちらをクリックして、この図をダウンロードしてください。
補助図 16: サンプルアライメントインタフェース 青い十字で表される中性子ビームの結晶の位置合わせは、点とクリックの中心によって行われます。 こちらをクリックして、この図をダウンロードしてください。
補足図 17: データ収集用の CSS GUI。データ収集戦略は、露出量や角度を含め、CSS GUIでアップロードされます。データ収集が進むに従って、リアルタイム検出器で検出された回折中性子が上部パネルに表示されます。 こちらをクリックして、この図をダウンロードしてください。
補足図 18: CCP4 の R フリー・フラグのマッチング 中性子データのRフリーフラグは、関節の改良のために同じまたは同一の結晶で収集されたX線データのRフリーフラグと一致しています。 こちらをクリックして、この図をダウンロードしてください。
補足図19:構造の調製と改良 (A) Phenix ReadySet ツールは交換可能なサイトでのデュアル H/D 占有率を追加するために使用されます。(B) 中性子データとX線データの両方が関節の改良に使用され、初期入力モデルは同じ結晶または同一の結晶上で収集されたX線データセットに対して改良されました。 こちらをクリックして、この図をダウンロードしてください。
補足図 20: 絞り込み設定の構成 精製モデルと核距離は、ジョイント X 線/中性子データのリファインメント用に構成されています。 こちらをクリックして、この図をダウンロードしてください。
補足図 21: クート モデル構築のデータ選択 X線と未充填中性子データを含むフェニックスMTZファイル出力をクートに開き、インタラクティブモデル構築のための電子および中性子SLDマップを生成します。 こちらをクリックして、この図をダウンロードしてください。
補足図 22: ジョイントの改良中にクートでインタラクティブモデル構築(A) 正と負のFO-FC中性子SLD密度ピーク(それぞれ緑と赤)は、水が回転/平行移動によって再配向しなければならないことを示す。2FO-FC中性子SLDマップは紫色で表示され、2FO-FC電子密度マップは青色で表示されます。(B) 正しく配置された水。(C) 正の FO-FC 中性子 SLD マップピーク(緑)は、カイ角度を編集して、差密度ピークに合わせてスレオニンを回転する必要があることを示します。(D) 正しい配向スレロニン。こちらをクリックして、この図をダウンロードしてください。
補助図23:中性子のみのデータ精製のための構造調製開始座標ファイルは、PDBToolsの水原子除去によって、交換可能なサイトでのデュアルH / D占有率の追加によって精製のために用意されています。 こちらをクリックして、この図をダウンロードしてください。
補足図 24: 中性子データのみの改良(A) 中性子データは、準備された開始モデルと同様にアップロードされます。(B) 中性子データの微細化の設定は中性子散乱表を使います。
補足図 25: クート モデル構築のデータ選択 未充填中性子データは、インタラクティブなモデル構築のためにクートで開かれます。 こちらをクリックして、この図をダウンロードしてください。
補足図26:重水素残基に対するクートにおける実際の空間の改良(A)正および負のFO-FC中性子SLD密度ピーク(それぞれ緑と赤)は、アルギニン残基をFO-FC密度ピークに合わせて移動しなければならないことを示す。2FO-FC中性子SLDマップは紫色で表示され、2FO-FC電子密度マップは青色で表示されます。(B) 実際の空間リファインを利用すると、クートジオメトリ拘束ライブラリが欠落しているため、D原子が「爆発」します。(C)D原子は残りの残余原子と一緒に移動しない。(D) D アトム位置は、テキストエディタを使用して手動で修正できます。こちらをクリックして、この図をダウンロードしてください。
補足図27:水分子の添加(A)水分子は、正のFO-FC中性子SLDマップ密度ピーク(緑色)に手動で添加することができます。挿入された水分子は、最初はクートのO原子によって表されます。(B) フェニックス ReadySet は、水分子の O 原子に D 原子を加えるために使用されます。(C)重水素化水分子が正常に添加される。こちらをクリックして、この図をダウンロードしてください。
補足図 28: 絞り込み統計 関節X線/中性子の精緻化に続く最終データ精製統計。 こちらをクリックして、この図をダウンロードしてください。
補足図 29: 絞り込み統計 中性子データのみの改良に続く最終的なデータ精製統計。 こちらをクリックして、この図をダウンロードしてください。
ディスカッション
中性子タンパク質結晶学は、タンパク質におけるプロトネーション状態と水分子の配向をプローブする高感度技術です。この情報は、プロトン化と水素結合相互作用の変化がしばしば酵素化学10の中心であるため、タンパク質触媒機構に光を当てます。中性子タンパク質結晶学は、有益な技術であるにもかかわらず、中性子回折実験を計画する前に考慮すべき多くの要因を有する。
- データ収集のための大きなタンパク質結晶の要件。
- 水素や金属イオンなどの他の元素の散乱特性。
- 重なったサンプルを扱う場合の構造の改良およびモデル構築ソフトウェアの制限。
中性子タンパク質結晶学は、フラックス限定の技術です。X線回折データセットとは対照的に、Rファクターが高く、完全性が低く、中性子データセットの冗長性と信号対雑音比が期待されています。1 つのフレームのデータ収集は、通常 12 ~ 18 時間です。実験の成功は、サンプルのサイズと0.1 mm3の結晶を使用した品質に大きく依存します。中性子回折では、10~800μLの結晶化液を設定するために大量のタンパク質を生産する必要があります。十分に大きな結晶を成長するための最小体積は、結晶とサンプルパラメータ(https://neutrons.ornl.gov/imagine)を与えられたボリューム計算機を使用して推定することができます。大きな結晶の成長は、蒸気拡散3によって最も一般的に達成されている。吊り落としの結晶化により、10~25μLの大きな滴で結晶の成長が可能となり、市販のシッティングドロップ装置14,54を使用して、最大~50μLまでの大きな滴を設定できます。シリコン化された9ウェルガラスプレートは、最大800 μLの体積で非常に大きな滴をセットするために使用できます。これらのガラス板はハンプトンリサーチから市販されている「サンドイッチボックス」に入れられます。さらなる結晶化技術は、容器によって滴径の限界が決まるバッチ結晶化を含む。バッチ結晶化実験をセットアップすると、マイクロリットルからミリリットル55までの範囲が可能です。また、透析は、透析膜を介して沈殿物と平衡化される透析技術を用いて、あるいは沈殿物濃度勾配に沿った逆拡散またはアガロース56,57などの多孔質プラグを介して行うこともできます。シードは、所望の体積の結晶を得るための別の代替手段を提供する。NcLPMO9D45の大結晶を含む、大結晶成長のためにマイクロおよびマクロシードがうまく採用されている。溶解度に対する温度の影響を含むタンパク質相図の知識は、大きな結晶成長に役立つ。
中性子回折実験を計画する際には、回折データ収集中のシグナル対ノイズ比を最大化するタンパク質調製の最適化が不可欠である7。H原子による密度の取り消しと高い支離滅裂散乱を回避するために、正のコヒーレント散乱長と低い支離滅裂散乱長を有する同位体DのH原子を交換することで、中性子SLDマップを改善することができます。これを達成するために、重水素化結晶化緩衝液に対する水素化タンパク質結晶の蒸気交換が行われる。これにより、溶媒分子と不安定でtitratableタンパク質H atoms23のH/D交換が保証されます。蒸気交換は、水素化結晶をD2O系の重水素化結晶化バッファー「プラグ」を用いて石英キャピラリーに取り付けることによって行われ、最も頻繁に適用される効果的で穏やかな技術を表します14,23,35。交換には数週間かかる場合があり、最大H/D交換を確実にするために、重水素化バッファーを頻繁に変更する必要があります。H/D交換は、重水素化緩衝液中に結晶を直接浸すことによっても行うことができる。D2O露光によるストレス下に結晶を配置することを避けるために、D2O:H2O比58を段階的に増加させることによって、浸漬プロセスを徐々に行う必要があります。これに加えて、水素化タンパク質の結晶化は、不安定性H部位22,59でのH/D交換用の重水素化緩衝液でも行うことができる。ただし、D2O系緩衝液は、公知のH2O系条件の更なる調整を必要とするタンパク質溶解度に影響を及ぼす3,59である。D2O系バッファーは、場合によっては小さい結晶につながることも観測されています59。Titratableと炭素結合H原子をDに完全に交換するには、重膜媒体中のタンパク質を発現させて透過サンプル20を生成する。透過サンプルの結果として得られる中性子SLDマップは大幅に改善され、水素化されたサンプルの密度キャンセルが表示されなくなりました。これは、タンパク質または補因子において交換不可能な部位で結合したH/Dを特徴付けると効果的である。しかし、透過タンパク質の発現は、コストが高く、かつyield60では低い。オークリッジ国立研究所(ORNL)構造分子生物学センター(CSMB)は、透過サンプル(https://www.ornl.gov/facility/csmb)を生成しようとするユーザーのための重水素化施設を提供しています。透過化発現は、典型的には、精製タンパク質61の〜50mgの収量を1Lスケールでバイオリアクターで行う。
中性子回折データの収集に続いて、洗練とインタラクティブモデル構築が行われます。改良は、phenix.refine、nCNS、またはSHELXL28、31、32、33を含む複数のソフトウェアスイートを使用して実行できます。Phenixスイートは、中性子SLD map34からモデルを手動で構築するために使用されるクートと組み合わせて中性子回折データを改良するために最も一般的に利用されるソフトウェアです。フェニックスとクートの両方が中性子回折データの処理を可能にするが、中性子データおよび重水素化されたサンプルに関連する特異性を処理するために必要な特定の特徴を欠いている可能性がある。例えば、Cootは重水素化残基のジオメトリ最適化を含まないため、「リアルスペースリファイン」機能は「爆発」残基を生じるため、モデル構築中に複雑化を招く可能性があります(補足図26)62。これは、すべての重水素残基の拘束ファイルを生成することによって解決することができます。ただし、これは集中的なプロセスであり、そのようなライブラリは現在一般に公開されていません。Phenix で改良を行う場合、交換可能な H/D サイトは、最初は H および D の占有率 0.50 に設定されます。改良が行われると、HとDの占有率は中性子SLDマップに従って洗練されます。インタラクティブモデル構築中、差分密度 Fo-Fc マップは、H/D 占有を評価する上で非常に有益です。マップを使用して、どのサイトが高 D 占有率を持っているのかを判断できます。ただし、H:D占有率は0.70:0.30に近く、中性子SLDマップ64で完全な信号キャンセルが発生します。また、準ラウエ中性子データセットは、多くの場合、X線回折データの98%≥日常的に観測されるよりも低い80%の完全性を有することを考慮する必要があります。Phenixで中性子回折データをリファインする場合、欠落している観測振幅(Fo)がモデルから計算されて反射リストが完成し、モデルバイアスが導入されます。この潜在的なバイアスを考慮するには、「no_fill」マップではなく、インタラクティブモデルの構築中に検討する必要があります。
ユーザーは、構造の共同X線/中性子データの洗練、または中性子データのみの改良を実行することができます。中性子SLDマップの視覚化は、特に低解像度で、特にH/D蒸気交換にもかかわらず交換不可能な部位にHがまだ存在する水素化タンパク質に対して、特に混乱している可能性があります。これにより、中性子密度マップのキャンセルが発生し、不連続マップの印象を与える65,66。対応する X 線データセットを収集すると、これらの取り消しを共同絞り込みで補完できます (図 13A および図 13B)。関節改良戦略では、通常、X線データに対してタンパク質骨格座標を改良し、中性子回折データを使用して交換可能な部位28におけるH/D原子の位置と占有率を改良する。交換可能な場所でのジョイント H/D 占有率の導入により、洗練されるパラメータの数が増えるため、X線データによるジョイントの絞り込みによって、データ対パラメータ比も増加します。関節の改良には、同じ結晶または同じ条件で成長した結晶上の同じ温度で、対応する X 線データセットを収集する必要があります。室温(300K)で収集された中性子回折データの場合、放射線損傷を制限するために低線量のデータ収集戦略を用いて、対応するX線データセットを室温で収集する必要があります。対照的に、透過サンプルは、H/D信号のキャンセルの同じ大きさを持たないので、改善された、連続的な中性子SLDマップを提供する。しかし、金属や硫黄を含む特定の元素の中性子散乱の長さは、たとえタンパク質が透過化されていても、中性子SLDマップでは見えにくい(図13C-F)18。金属を特徴付ける必要がある場合は、関節の細分化でX線回折を利用するか、分光技術を適用して回折実験を補完するのが最善です。中性子のみのデータの改良は、中性子データセットが高解像度の場合や、透過性タンパク質を使用した場合に行われることがよくあります。また、X線由来の構造が放射線誘発物を保有する可能性があるため、放射線損傷に対して高感度なタンパク質が研究されている場合は、中性子のみのデータ精製が特に有用です。中性子データのみの改良を行う場合は、対応する中性子データセットに十分な完全性と解像度があるかどうかを確認する必要があります。
ORNLは、HFIRのIMAGINEビームラインとSNS36,67のMaNDiビームラインの2つの中性子回折データを収集するための2つの施設を提供しています。どちらの装置も同様の原理を用いた中性子回折データセットを収集する有効な手段を提供しますが、各機器にはビーム時間を適用する際に考慮すべき固有の仕様があります。IMAGINEは、準ラウデータを収集し、単位セルを持つ結晶上の室温データ収集に最適化されています。.MaNDiは、~300Åまでのユニットセルを持つ結晶上のTOF-Laueコレクションを用いた室温および低温データの収集に使用できます。完全なデータセットを収集する前に、結晶に対してテストを行い、結晶が単一フレームの中性子ビームに露出する回折パターンの品質を評価します。結晶が十分な品質の場合、完全な中性子回折データセットが収集され、インデックス化され、統合され、スケーリングされ、X線データ処理に類似したプロセスにマージされます。IMAGINEはラウエゲンとLscaleを利用し、MaNDiはマンティッドパッケージを利用し、3次元プロファイルフィッティング48、50、51、68、69,70を採用しています。これらの施設のいずれかでユーザーになる科学者は、さらなる分析のためにMTZまたはHKL形式のデータセットを提供されます。
中性子回折は、生体高分子のプロトネーション状態と水素結合相互作用を調査するための非破壊性、高感度の技術です。特に光感受性タンパク質やメタロタンパク質に有用です。実験を行う前に、この技術とデータの処理に関するいくつかの考慮事項を考慮する必要がありますが、結果は結果をもたらし、目的のタンパク質の触媒メカニズムに関する貴重な洞察を与える可能性があります。中性子タンパク質結晶学は、計算、構造、生化学的、分光学的研究を補完し、生物学者の生物学的高分子を特徴付けるために使用される技術の貴重なツールとなっています。
開示事項
著者らは開示するものは何もない。
謝辞
タンパク質発現、精製、結晶化実験は、オークリッジ国立研究所の米国エネルギー環境研究局の構造分子生物学センター(CSMB)で行われました。中性子回折データは、米国エネルギー省エネルギー省基礎エネルギー科学局の科学ユーザー施設部門が後援するORNLのスマレーション中性子源(SNS)のBL-11B MaNDiで収集されました。著者らはブレンダン・サリバンに対し、データ削減に関する支援に感謝している。X線回折データは、ノースカロライナ州が支援するノースカロライナ州立大学の分子教育・技術・研究イノベーションセンター(METRIC)施設で収集されました。GCSは、国立研究財団(NRF)、南アフリカ、およびORNLの大学院機会(GO!)プログラムからの支援を認めています。FMは、USDA NIFAハッチ211001からのサポートを認めています。
資料
| Name | Company | Catalog Number | Comments |
| Absorbent Paper Points Size #30-#40, 60 mm length | DiaDent/DiaVet | 218-292 | |
| Capillary wax | Hampton | HR4-328 | |
| CCP4 | Version 7.0.077 | ||
| Conical Centrifuge Tubes (15 mL) | Corning | CLS430790 | |
| Conical Centrifuge Tubes (50mL) | Corning | CLS430828 | |
| Coot | Version 0.8.9.2 | ||
| CrystalCap ALS | Hampton | HR4-779 | |
| Curved-Tip Forceps | Mitegen | TW-CTF-1 | |
| Deuterium chloride solution, 35 wt. % in D2O, ≥99 atom % D | Sigma-Aldrich | 543047 | |
| Deuterium oxide 99.9 atom % D | Sigma-Aldrich | 151882 | |
| Dual Thickness MicroLoops 1000 µm | Mitegen | M5-L18SP-1000 | |
| FiveEasy pH meter F20-Std-Kit | Mettler Toledo | 30266626 | |
| Foam Dewars Standard Vessel 800 ml | Spearlab | M-FD-800 | |
| Four Color Mounting Clay | Hampton | HR4-326 | |
| HEPES, BioUltra, for molecular biology, ≥99.5% (T), | Sigma-Aldrich | 54457 | |
| High flux rotating anode X-ray diffractomemeter with EIGER 4M detector | Rigaku, Oxford Cryostream and Dectris | XtaLAB Synergy-R | Home source X-ray diffractometer |
| Magnetic Wand Straight | Mitegen | M-R-1013198 | |
| Microloader, tip for filling Femtotips and other glass microcapillaries (for research use only), 0.5 – 20 µL, 100 mm, light gray, 192 pcs. (2 racks × 96 pcs.) | Eppendorf | 930001007 | |
| Microtubes volume 1.5 mL | Eppendorf | Z606340 | |
| Petri Dishes with Clear Lid 100 mm diameter | Fischerbrand | FB0875713 | |
| Phenix | Version 1.14-3260 | ||
| Pin Tong 18 mm | Mitegen | M-R-1013196 | |
| Pipette Volume 0.1-2.5 μL | Eppendorf Research | Z683779 | |
| Pipette Volume 100-1000 μL | Eppendorf Research | Z683825 | |
| Pipette Volume 10-100 μL | Eppendorf Research | Z683809 | |
| Pipette Volume 20-200 μL | Eppendorf Research | Z683817 | |
| Poly(ethylene glycol) BioXtra, average mol wt 3,350, powder | Sigma-Aldrich | P4338 | |
| Quartz Capillary , 1.00 mm inner diameter, 80 mm length | Hampton | HR6-146 | Thin-walled capillary |
| Research Stereomicroscope System | Olympus | SZX16 | |
| Reusable B3 (SSRL/SAM Style) Goniometer Bases | Mitegen | GB-B3-R | |
| Round - Miniature Hollow Glass Tubing (VitroTubes) Clear Fused Quartz / 1.00 mm inner diameter, 100 mm length | VitroCom | CV1012 | Thick-walled capillary |
| Sandwich Box with cover | Hampton | HR3-132 | |
| Siliconized 9 Well Glass Plate | Hampton | HR3-134 | |
| Sitting Drop Crystallization Plate (24 Big Well) | Mitegen | XQ-P-24S-A | |
| Sodium deuteroxide solution, 40 wt. % in D2O, 99 atom % D | Sigma-Aldrich | 176788 | |
| Thick Siliconized circle cover slides (22 mm x 0.96 mm) | Hampton | HR3-247 | |
| Universal Pipet Tips, 0.1 - 10 µL | VWR | 76322-528 | |
| Universal Pipet Tips, 1 - 100 µL | VWR | 76322-136 | |
| Universal Pipet Tips, 100 - 1000 µL | VWR | 76322-154 | |
| Universal Pipet Tips, 20 - 200 µL | VWR | 76322-150 | |
| Universal Pipet Tips, 1 - 20 µL | VWR | 76322-134 | |
| Wax pen | Hampton | HR4-342 |
参考文献
- Neumann, P., Tittmann, K. Marvels of enzyme catalysis at true atomic resolution: distortions, bond elongations, hidden flips, protonation states and atom identities. Current Opinion in Structural Biology. 29, 122-133 (2014).
- Pynn, R. Neutron Scattering-A Non-destructive Microscope for Seeing Inside Matter. Neutron Applications in Earth, Energy and Environmental Sciences. , 15-36 (2009).
- O'Dell, W. B., Bodenheimer, A. M., Meilleur, F. Neutron protein crystallography: A complementary tool for locating hydrogens in proteins. Archives of Biochemistry and Biophysics. 602, 48-60 (2016).
- Niimura, N., Podjarny, A. . Neutron Protein Crystallography: Hydrogen, Protons, and Hydration in Bio-macromolecules. , (2011).
- Blakeley, M. P. P. Neutron macromolecular crystallography. Crystallography Reviews. 15 (3), 157-218 (2009).
- Blakeley, M. P., Cianci, M., Helliwell, J. R., Rizkallah, P. J. Synchrotron and neutron techniques in biological crystallography. Chemical Society Reviews. 33 (8), 548-557 (2004).
- Ashkar, R., et al. Neutron scattering in the biological sciences: progress and prospects. Acta Crystallographica Section D: Structural Biology. 74 (12), (2018).
- Teixeira, S. C. M., et al. New sources and instrumentation for neutrons in biology. Chemical Physics. 345 (2-3), 133-151 (2008).
- Furrer, A., Mesot, J., Strässle, T. . Neutron Scattering in Condensed Matter Physics. , (2009).
- Meilleur, F., Coates, L., Cuneo, M. J., Kovalevsky, A., Myles, D. A. A. The neutron macromolecular crystallography instruments at Oak Ridge national laboratory: Advances, challenges, and opportunities. Crystals. 8 (10), 1-10 (2018).
- Coates, L., et al. The Macromolecular Neutron Diffractometer MaNDi at the Spallation Neutron Source. Journal of Applied Crystallography. 48, 1302-1306 (2015).
- Coates, L., Stoica, A. D., Hoffmann, C., Richards, J., Cooper, R. The macromolecular neutron diffractometer (MaNDi) at the Spallation Neutron Source, Oak Ridge: enhanced optics design, high-resolution neutron detectors and simulated diffraction. Journal of Applied Crystallography. 43 (3), 570-577 (2010).
- Koetzle, T. F., Piccoli, P. M. B., Schultz, A. J. Single-crystal neutron diffraction studies of hydrogen-bonded systems: Two recent examples from IPNS. Nuclear Instruments and Methods in Physics Research, Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 600 (1), 260-262 (2009).
- Ng, J. D., et al. Large-volume protein crystal growth for neutron macromolecular crystallography. Acta Crystallographica Section F:Structural Biology Communications. 71, 358-370 (2015).
- Blakeley, M. P., Langan, P., Niimura, N., Podjarny, A. Neutron crystallography: opportunities, challenges, and limitations. Current Opinion in Structural Biology. 18 (5), 593-600 (2008).
- Sears, V. F. Neutron scattering lengths and cross sections. Neutron News. 3 (3), 26-37 (1992).
- Weik, M., Patzelt, H., Zaccai, G., Oesterhelt, D. Localization of glycolipids in membranes by in vivo labeling and neutron diffraction. Molecular Cell. 1 (3), 411-419 (1998).
- Helliwell, J. R. Fundamentals of neutron crystallography in structural biology. Methods in Enzymology. 634, (2020).
- Niimura, N., Bau, R. Neutron protein crystallography: Beyond the folding structure of biological macromolecules. Acta Crystallographica Section A: Foundations of Crystallography. 64 (1), 12-22 (2008).
- Hazemann, I., et al. High-resolution neutron protein crystallography with radically small crystal volumes: Application of perdeuteration to human aldose reductase. Acta Crystallographica Section D: Biological Crystallography. 61 (10), 1413-1417 (2005).
- Niimura, N., Chatake, T., Ostermann, A., Kurihara, K., Tanaka, I. High resolution neutron protein crystallography. Hydrogen and hydration in proteins. Zeitschrift für Kristallographie - Crystalline Materials. 218 (2), (2003).
- Meilleur, F., Contzen, J., Myles, D. A. A., Jung, C. Structural stability and dynamics of hydrogenated and perdeuterated cytochrome P450cam (CYP101). Biochemistry. 43 (27), 8744-8753 (2004).
- Bennett, B. C., Gardberg, A. S., Blair, M. D., Dealwis, C. G. On the determinants of amide backbone exchange in proteins: A neutron crystallographic comparative study. Acta Crystallographica Section D: Biological Crystallography. 64 (7), 764-783 (2008).
- Meilleur, F., Kovalevsky, A., Myles, D. A. A. IMAGINE: The neutron protein crystallography beamline at the high flux isotope reactor. Methods in Enzymology. 634, (2020).
- Wang, X. P., et al. A suite-level review of the neutron single-crystal diffraction instruments at Oak Ridge National Laboratory. Review of Scientific Instruments. 89 (9), 092802 (2018).
- Wlodawer, A., Hendrickson, W. A. A procedure for joint refinement of macromolecular structures with X-ray and neutron diffraction data from single crystals. Acta Crystallographica Section A. 38 (2), 239-247 (1982).
- Halle, B. Biomolecular cryocrystallography: Structural changes during flash-cooling. Proceedings of the National Academy of Sciences of the United States of America. 101 (14), 4793-4798 (2004).
- Adams, P. D., Mustyakimov, M., Afonine, P. V., Langan, P. Generalized X-ray and neutron crystallographic analysis: More accurate and complete structures for biological macromolecules. Acta Crystallographica Section D: Biological Crystallography. 65 (6), 567-573 (2009).
- Berman, H. M., et al. The Protein Data Bank. Acta Crystallographica Section D Biological Crystallography. 58 (6), 899-907 (2002).
- Liebschner, D., Afonine, P. V., Moriarty, N. W., Langan, P., Adams, P. D. Evaluation of models determined by neutron diffraction and proposed improvements to their validation and deposition. Acta Crystallographica Section D: Structural Biology. 74, 800-813 (2018).
- Afonine, P. V., Mustyakimov, M., Grosse-Kunstleve, R. W., Moriarty, N. W., Langan, P., Adams, P. D. Joint X-ray and neutron refinement with phenix.refine. Acta Crystallographica Section D: Biological Crystallography. 66 (11), 1153-1163 (2010).
- Brünger, A. T., et al. Crystallography & NMR system: A new software suite for macromolecular structure determination. Acta Crystallographica Section D: Biological Crystallography. 54 (5), 905-921 (1998).
- Gruene, T., Hahn, H. W., Luebben, A. V., Meilleur, F., Sheldrick, G. M. Refinement of macromolecular structures against neutron data with SHELXL2013. Journal of Applied Crystallography. 47 (1), 462-466 (2014).
- Emsley, P., Lohkamp, B., Scott, W. G., Cowtan, K. Features and development of Coot. Acta Crystallographica Section D Biological Crystallography. 66 (4), 486-501 (2010).
- Lakey, J. H. Neutrons for biologists: A beginner's guide, or why you should consider using neutrons. Journal of the Royal Society Interface. 6, (2009).
- Schröder, G. C., O'Dell, W. B., Myles, D. A. A., Kovalevsky, A., Meilleur, F. IMAGINE: Neutrons reveal enzyme chemistry. Acta Crystallographica Section D: Structural Biology. 74, 778-786 (2018).
- Halsted, T. P., et al. Catalytically important damage-free structures of a copper nitrite reductase obtained by femtosecond X-ray laser and room-temperature neutron crystallography. IUCrJ. 6, 761-772 (2019).
- Meier, K. K., et al. Oxygen Activation by Cu LPMOs in Recalcitrant Carbohydrate Polysaccharide Conversion to Monomer Sugars. Chemical Reviews. 118 (5), 2593-2635 (2018).
- Beeson, W. T., Vu, V. V., Span, E. A., Phillips, C. M., Marletta, M. A. Cellulose Degradation by Polysaccharide Monooxygenases. Annual Review of Biochemistry. 84 (1), 923-946 (2015).
- Walton, P. H., Davies, G. J. On the catalytic mechanisms of lytic polysaccharide monooxygenases. Current Opinion in Chemical Biology. 31, 195-207 (2016).
- Bertini, L., et al. Catalytic Mechanism of Fungal Lytic Polysaccharide Monooxygenases Investigated by First-Principles Calculations. Inorganic Chemistry. 57 (1), 86-97 (2018).
- Hedegård, E. D., Ryde, U. Molecular mechanism of lytic polysaccharide monooxygenases. Chemical Science. 9 (15), 3866-3880 (2018).
- Hangasky, J. A., Detomasi, T. C., Marletta, M. A. Glycosidic Bond Hydroxylation by Polysaccharide Monooxygenases. Trends in Chemistry. 1 (2), 198-209 (2019).
- Bacik, J. P., et al. Neutron and Atomic Resolution X-ray Structures of a Lytic Polysaccharide Monooxygenase Reveal Copper-Mediated Dioxygen Binding and Evidence for N-Terminal Deprotonation. Biochemistry. 56 (20), 2529-2532 (2017).
- O'Dell, W. B., Agarwal, P. K., Meilleur, F. Oxygen Activation at the Active Site of a Fungal Lytic Polysaccharide Monooxygenase. Angewandte Chemie - International Edition. 56 (3), 767-770 (2017).
- O'Dell, W. B., Swartz, P. D., Weiss, K. L., Meilleur, F. Crystallization of a fungal lytic polysaccharide monooxygenase expressed from glycoengineered Pichia pastoris for X-ray and neutron diffraction. Acta Crystallographica Section:F Structural Biology Communications. 73 (2), 70-78 (2017).
- Meilleur, F., et al. The IMAGINE instrument: First neutron protein structure and new capabilities for neutron macromolecular crystallography. Acta Crystallographica Section D: Biological Crystallography. 69 (10), 2157-2160 (2013).
- Helliwell, J. R., et al. The recording and analysis of synchrotron X-radiation Laue diffraction photographs. Journal of Applied Crystallography. 22 (5), 483-497 (1989).
- Nieh, Y. P., et al. Accurate and highly complete synchrotron protein crystal Laue diffraction data using the ESRF CCD and the Daresbury Laue software. Journal of Synchrotron Radiation. 6 (5), 995-1006 (1999).
- Arzt, S., Campbell, J. W., Harding, M. M., Hao, Q., Helliwell, J. R. LSCALE - The new normalization, scaling and absorption correction program in the Daresbury Laue software suite. Journal of Applied Crystallography. 32 (3), 554-562 (1999).
- Sullivan, B., et al. Improving the accuracy and resolution of neutron crystallographic data by three-dimensional profile fitting of Bragg peaks in reciprocal space. Acta Crystallographica Section D: Structural Biology. 74 (11), 1085-1095 (2018).
- Sullivan, B., et al. BraggNet: integrating Bragg peaks using neural networks. Journal of Applied Crystallography. 52 (4), 854-863 (2019).
- Schröder, G. C., O'Dell, W. B., Myles, D. A. A., Kovalevsky, A., Meilleur, F. IMAGINE: Neutrons reveal enzyme chemistry. Acta Crystallographica Section D: Structural Biology. 74, (2018).
- Blum, M. M., et al. Preliminary time-of-flight neutron diffraction study on diisopropyl fluorophosphatase (DFPase) from Loligo vulgaris. Acta Crystallographica Section F: Structural Biology and Crystallization Communications. 63 (1), 42-45 (2007).
- Tomanicek, S. J., et al. Neutron and X-ray crystal structures of a perdeuterated enzyme inhibitor complex reveal the catalytic proton network of the Toho-1 β-lactamase for the acylation reaction. Journal of Biological Chemistry. 288 (7), 4715-4722 (2013).
- Metcalfe, C., et al. The tuberculosis prodrug isoniazid bound to activating peroxidases. Journal of Biological Chemistry. 283 (10), 6193-6200 (2008).
- Hughes, R. C., et al. Inorganic pyrophosphatase crystals from Thermococcus thioreducens for X-ray and neutron diffraction. Acta Crystallographica Section F: Structural Biology and Crystallization Communications. 68 (12), 1482-1487 (2012).
- Bennett, B. C., Meilleur, F., Myles, D. A. A., Howell, E. E., Dealwis, C. G. Preliminary neutron diffraction studies of Escherichia coli dihydrofolate reductase bound to the anticancer drug methotrexate. Acta Crystallographica Section D: Biological Crystallography. 61 (5), 574-579 (2005).
- Snell, E. H., et al. Optimizing crystal volume for neutron diffraction: D-xylose isomerase. European Biophysics Journal. 35 (7), 621-632 (2006).
- Golden, E., Attwood, P. V., Duff, A. P., Meilleur, F., Vrielink, A. Production and characterization of recombinant perdeuterated cholesterol oxidase. Analytical Biochemistry. 485, 102-108 (2015).
- Munshi, P., et al. Rapid visualization of hydrogen positions in protein neutron crystallographic structures. Acta Crystallographica Section D: Biological Crystallography. 68 (1), 35-41 (2012).
- Logan, D. T. Interactive model building in neutron macromolecular crystallography. Methods in Enzymology. 634, (2020).
- Koruza, K., Lafumat, B., Végvári, W., Knecht, S. Z., Fisher, Deuteration of human carbonic anhydrase for neutron crystallography: Cell culture media, protein thermostability, and crystallization behavior. Archives of Biochemistry and Biophysics. 645, 26-33 (2018).
- Fisher, S. J., et al. Perdeuteration: Improved visualization of solvent structure in neutron macromolecular crystallography. Acta Crystallographica Section D: Biological Crystallography. 70 (12), 3266-3272 (2014).
- Chen, J. C. H., Hanson, B. L., Fisher, S. Z., Langan, P., Kovalevsky, a. Y. Direct observation of hydrogen atom dynamics and interactions by ultrahigh resolution neutron protein crystallography. Proceedings of the National Academy of Sciences. 109 (38), 15301-15306 (2012).
- Cuypers, M. G., et al. Near-atomic resolution neutron crystallography on perdeuterated Pyrococcus furiosus rubredoxin: Implication of hydronium ions and protonation state equilibria in redox changes. Angewandte Chemie - International Edition. 52 (3), 1022-1025 (2013).
- Coates, L., Sullivan, B. The macromolecular neutron diffractometer at the spallation neutron source. Methods in Enzymology. 634, (2020).
- Ren, Z., Kingman, N. G., Borgstahl, G. E. O., Getzoff, E. D., Moffat, K. Quantitative Analysis of Time-Resolved Laue Diffraction Patterns. Journal of Applied Crystallography. 29 (3), 246-260 (1996).
- Campbell, J. W., Hao, Q., Harding, M. M., Nguti, N. D., Wilkinson, C. LAUEGEN version 6.0 and INTLDM. Journal of Applied Crystallography. 31 (3), 496-502 (1998).
- Arnold, O., et al. Mantid - Data analysis and visualization package for neutron scattering and μ SR experiments. Nuclear Instruments and Methods in Physics Research, Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 764, 156-166 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved