Method Article
단백질 구조에서 수소 원자 모델링을 위한 중성자 결정학 데이터 수집 및 처리
요약
중성자 단백질 결정학은 수소 원자의 국소화화를 허용하여 단백질 기능의 중요한 기계학적 세부 사항을 제공하는 구조 기술입니다. 우리는 여기에 단백질 결정, 중성자 회절 데이터 수집, 구조 미세 조정 및 중성자 산란 길이 밀도 지도의 분석을 장착하기위한 워크플로우를 제시한다.
초록
중성자 결정예학은 생물학적 거대 분자 내에서 수소 원자 위치를 측정할 수 있는 구조 기술로, 방사선 손상을 유도하지 는 않지만 프로토네이션 및 수화 상태에 대한 기계적으로 중요한 정보를 산출합니다. 반면 X선 회절은 광 원자의 위치에 대한 제한된 정보만 제공하며 X선 빔은 감광성 보조인 및 금속 센터의 방사선 손상을 빠르게 유도합니다. 여기에 제시된 오크 리지 국립 연구소(ORNL)의 IMAGINE 및 MaNDi 빔라인에 사용되는 워크플로우가 적절한 크기의 단백질 결정이 커지면 중성자 회절 구조를 얻습니다(> 0.1 mm3). 중성자 회절 데이터 수집을 위해 석영 모세혈관에 수소화 단백질 결정의 장착을 시연합니다. 또한 중수소가 있는 교환 가능한 현장에서 수소 원자의 교체를 보장하기 위해 D2O 함유 버퍼를 장착한 결정의 증기 교환 공정도 제시된다. 중수소의 통합은 수소 원자의 일관되지 않은 산란으로 인한 배경을 줄이고 부정적인 일관된 산란 길이로 인한 밀도 취소를 방지합니다. 샘플 정렬 및 실온 데이터 수집 전략은 높은 플럭스 동위원소 반응기(HFIR)에서 IMAGINE에서 준 Laue 데이터 수집을 사용하여 설명됩니다. 또한, 황량한 반응 중간체를 트랩하기 위해 극저온 데이터 수집을 위한 액체 질소의 결정 장착 및 신속한 동결은 스발레이션 중성자 소스(SNS)의 MaNDi 비행 시간 계측기에서 입증된다. 모델 좌표 및 회절 데이터 파일 및 중성자 산란 길이 밀도(SLD) 맵의 시각화준비도 해결됩니다. 중성자 데이터 전용 또는 관심 있는 단백질의 모든 원자 구조를 얻기 위한 관절 X선/중성자 데이터에 대한 구조 개선이 마침내 논의될 것이다. 중성자 구조를 결정하는 과정은 글리코시딕 본드의 산화 분열을 통해 반발성 다당류의 분해에 관여하는 구리 함유 금속 단백질인 리시성 다당류 단산소효소 단산소효소 의 결정으로 입증될 것이다.
서문
중성자 대분자 결정학은 단백질의 구조와 근본적인 화학에 독특한 창을 제공하는 기술입니다. 개념적으로 X선 회절과 유사하게 중성자 회절은 거세 분자 구조의 원자학적 세부 사항을 제공하지만, 중성자와 핵의 상호 작용은 종종 X 선 회절로 감지하기 어려운 빛 원자의 국소화를 가능하게합니다. X선 회절 동안 X선은 전자 구름에서 흩어져 있어 수소(H)와 같은 가벼운 원자가 서브-Ångström 해상도2 근처에 없는 전자 밀도 맵에서 제대로 보이지 않게 됩니다. 대조적으로, 중성자의 산란 강도는 다른 산란 길이를 표시하는 동일한 요소의 동위원소와 핵과의 복잡한 상호 작용에 따라 달라집니다. 따라서, 수소(1H) 및 중수소(2H 또는 D)와 같은 가벼운 원자와 동위원소는 중성자 산란 길이 밀도(SLD) 맵에서 중추 탄소, 질소 및 산소 원자에 대한 유사한 가시성을 갖습니다. 더욱이, 중성자 산란의 크기는 전자의 수와 무관하기 때문에, 광원으로부터 산란하는 것은 X선 산란에서 관찰되는 바와 같이, 서로 가까이에 있을 때 무거운 원소에 의해 가려지지 않는다. 중성자 회절을 사용할 때 H와 동위원소 D의 향상된 가시성은 촉매적으로 중요한 잔류물, 공동 요소 및 리간드의 프로토네이션 상태에 대한 귀중한 정보를 제공하고 물 분자의 방향을 돕고 촉매 메커니즘 및 단백질 화학에 대한 중요한 정보를 드러냅니다3. 중성자 회절은 또한 비파괴 적 기술인 이점을 제공하며, 특히 금속 센터 또는 감광성 Redox cofactors2를 가진 단백질과 같은 이온화에 민감한 생물학적 샘플에 특히 적합하다는 이점을 제공합니다. 이 문서의 주요 초점은 고품질 중성자 단백질 결정 구조를 얻기 위해 워크플로우에 대한 개요를 제공하는 것입니다. 우리는 중성자 단백질 회절및 Ashkar 등 al.7의 훌륭한 개요를 위해 Podjarny 외.4, 블레이클리 5, 블레이클리 외.6 및 O'Dell 외.3에 관심있는 독자를 참조합니다.
중성자는 주로 원자로 원천의 핵 분열 또는 가속기 기반 소스8의 접합이라는 두 가지 공정 중 하나를 사용하는 핵 반응 중에 생성됩니다. 원자로 공급원은 235U 동위원소의 핵핵을 채택하여 연속 중성자 빔을 제공하며, 스환화 중성자 소스는 대상, 예를 들어 수은과 같은 액체 금속, 양성자9를 통해 표적을 포격하여 펄스 중성자 빔을 생성한다. 테네시 주 오크 리지에 있는 오크 리지 국립 연구소(ORNL)는 하이 플럭스 동위원소 원자로(HFIR)와 60Hz 펄스 소스에서 안정된 상태 중성자 소스를 모두 보유하고 있습니다(SNS). HFIR에 위치한 IMAGINE 빔라인은 생물학적 거대 분자에 최적화된 중성자 디프라토계(보충 도 1)10입니다. IMAGINE은 중성자 이미지 플레이트 검출기를 사용하여 단위 셀 가장자리가 있는 단일 결정에서 2.8 - 4.5 Å 범위의 좁은 밴드패스를 사용하여 준 라우 데이터를 측정합니다 <150 Å. SNS에 위치한 거대 분자 중성자 디프라토미터(MaNDi)는 구형 검출기 어레이 프레임(DAF)(보충 도 2)11을 장착한 비행 시간(TOF) 라우중성자 디프라토계이다. MaNDi는 2.0 ~ 6.0 Å12 사이의 튜닝 가능한 2 Å 파장 대역폭을 사용하여 10 - 300 Å 범위의 단위 셀 가장자리가있는 단일 결정의 데이터를 측정합니다.
중성자를 생성하는 과정은 에너지 집약성이 높으며, 싱크로트론 소스13에서 X선 빔 플럭스와 대조될 때 상대적으로 약한 중성자 빔 플럭스를 생성합니다. 데이터 수집 중에 충분한 신호 대 잡음 비율을 보장하기 위해 적절한 크기와 품질의 결정을 키워야 합니다14. 일반적으로 0.1 mm3의 부피가 > 있는 결정은 적절한 통계15로 데이터를 수집하는 데 필요합니다. 낮은 유동성 이외에, 중성자와 시료 핵 사이의 상호 작용의 고유 한 특성을 고려해야합니다16. 중성자의 산란 길이는 동일한 요소의 동위원소에 대해 다르며, 작은 각도 중성자 산란(SANS)에서 유리하게 활용될 수 있는 특성으로 시료의 영역을 마스크하거나 강조하여 대조 매칭17로 알려져 있다. 회절 실험에서, 음의 일관된 중성자 산란 길이 H(-3.741 fm for 1H)는 탄소(6.6511 fm), 질소(14N 산소용 9.37fm), 질소(9.37 fm) 등 생물학적으로 관련된 원자의 일관된 중성자 산란 길이 이후 중성자 산란 밀도 맵 기능의 취소로 이어질 수 있다. 인(31P용 5.13 fm)과 유황(32S용 2.804 fm)은 양성(표 1)12,14이다. 또한 H(25.274 fm)의 큰 분산 길이는 데이터 수집 중 배경을 증가시켜 데이터 집합의 품질을 저해하고 데이터 해상도7을 손상시킵니다. H에 의해 도입 된 이러한 한계를 회피하기 위해, 중성자 회절에 대한 H를 교환할 필요가, 2H (D), 이는 긍정적 인 일관된 중성자 산란 길이 (6.671 fm) 상당히 낮은 일관성 산란 길이 (4.04 fm)19. 이는 H 사이트20에서 D의 완전한 통합을 보장하는 완전히 유족 매체에서 자란 유기체에 의해 단백질이 발현되는 과정인 감쇠에 의해 달성될 수 있다20. 또한 교환 가능한 부위(titratable groups)에서만 H를 D로 교체하여 단백질을 부분적으로 중음화할 수 있으며, 교환가능한 탄소바운드 부위는 수소화21을 유지한다. 이것은 중음 어머니에게 수소화한 단백질 결정의 성장에 의해 달성될 수 있습니다22. 그러나 가장 일반적으로, 수소화 단백질의 H/D 교환은 H2O 기반 완충23에서 적당하게 큰 결정의 성장에 따라 증기 교환에 의해 수행된다. 이러한 경우, 결정은 석영 모세관에 장착되고 D20 기반의 어머니 술과 함께 증기로 평형화됩니다.
중성자 소스의 제한된 중성자 플럭스는 며칠에서 몇 주에 이르기까지 더 긴 데이터 수집 시간을 초래합니다24. ORNL에서는 IMAGINE과 MaNDi모두 2-6 Å 범위에서 좁은 파장 밴드패스를 사용하여 데이터 수집25를 최적화합니다. 데이터는 실온 또는 극저온에서 수집할 수 있습니다. Cryo 데이터 수집은 잠재적으로 데이터 품질을 개선하고 동결 트래핑 촉매 중간체의 가능성을 열어줍니다. 중성자 회절 데이터 수집에 이어, X선 데이터 세트는 전형적으로 동일한 온도또는 동일한 조건에서 재배된 결정에서 동일한 결정으로 수집됩니다26. 동일한 온도에서의 데이터 수집을 통해 X선 및 중성자 데이터 모두에 대해 구조 개선이 수행될 수 있으므로 물의 가시성 및 위치 변경 또는 대체 적합성을 가진 잔류물의 점유 와 같은 잠재적인 온도 유발 유물을 방지할 수 있습니다27. 조인트 X-ray 중성자 데이터 정제는 데이터 대 파라미터 비율을 증가시키고 단백질 백본 좌표를 X선 데이터에 대해 정제할 수 있도록 하는 이점을 제공하며, 중성자 회절 데이터는 H/D 원자28의 위치를 구체화하는 데 사용된다. 이것은 단백질에 교환할 수 없는 사이트에 H 원자로 인한 밀도 취소가 존재하는 부분적으로 유족 시료를 사용할 때 특히 유용합니다. 단백질 데이터 뱅크(PDB)에 증착된 중성자 구조의 수를 훨씬 초과하지만, X선 데이터의 정제를 위해 처음 설계된 소프트웨어 패키지는 중성자 데이터를 포괄하도록 확장되었습니다3,29,30. 데이터 수집에 따라 페닉스.refine, CNSsolve(nCNS) 또는 SHELXL28,31,32,33과 같은 정제 패키지를 사용하여 모델을 구체화할 수 있습니다. 정제 과정에서 중성자 산란 밀도 맵은 COOT34를 사용하여 수동 피팅을 위해 시각화할 수 있습니다. 구조 솔루션에 따라 좌표 및 중성자 및/또는 X선 회절 데이터 파일을 PDB에 제출할 수 있으며, PDB는 모델을 검증하고 입금하여 공용 access18,29,30에 사용할 수 있습니다.
단백질의 구조적 분석은 수많은 기술이 그들의 기능 및 기계장치를 조사하는 데 사용되는 다각적인 접근 방식입니다35. 중성자 단백질 결정학은 X 선 회절, 분광법, 핵 자기 공명 (NMR) 또는 마이크로 결정 전자 회절 (microED)36과 같은 추가 연구에서 결과를 확장하고 보완하기 위해 귀중한 화학 적 통찰력을 제공합니다. H 원자가 화학의 중심이기 때문에 중성자 단백질 회절은 효소 메커니즘에 대한 통찰력을 제공하기 위해 독특하게 배치됩니다. 중성자에 의해 유도된 방사선 손상의 부재는 그(것)들에게 금속로단백질37의 연구 결과에 예외적으로 적합한 프로브를 만듭니다. 여기서는 시료 제제에서 데이터 수집, 정제 및 분석에 이르기까지 중성자 단백질 회절 과정의 대표적인 예를 제시한다(도 1). 중성자 회절 실험을 위한 충분한 크기의 결정은 금속 단백질 Neurospora crassa LPMO9D (NcLPMO9D)의 성장되었습니다. 노스캐롤라이나 LPMO9D는 글리코시딕 본드38,39에서 산소 원자 삽입에 의한 재발성 셀룰로오스의 분해에 관여하는 구리 함유 금속 단백질이다. NcLPMO9D 활성 부위에는 N단 히스티딘과 제2 보존 히스티딘(보충 도 3)40으로 구성된 특징적인 "히스티딘 브레이스"내에 단핵 구리 센터가 포함되어 있습니다. 곰팡이 LPMOs의 N 단말은 메틸화되지만 효모에서 재조합 식 중에 전환 후 수정이 발생하지 않습니다. NcLPMO9D 휴게 상태에서 구리 센터는 Cu2+ 산화 상태로 존재하며 단일 전자 감소에 의해 Cu1+로 활성화되어 분자 산소가 결합되어 슈퍼옥사이드 종41,42로 빠르게 감소하여 활성화될 수 있습니다. 전반적인 NcLPMO9D 반응은 하이드록실화 다당류 생성물43을 형성하기 위해 전자 1개와 양성자 2개를 추가해야 한다. 다당류 기판으로부터 수소 원자 추상화(HAA)를 담당하는 활성 산소 종의 정체가 확인되지 않았으며 집중적인 구조 및 계산 연구가 현재 진행 중이다44,45. NcLPMO9D 활성 부위의 레독스 화학을 감안할 때, 방사선 손상의 완화는 특히 관련이 있습니다. NcLPMO9D 결정에 대한 실온 및 극저온 데이터 수집을 여기서 설명하여 휴식 상태 및 활성화된 감소 형태로 NcLPMO9D 구조를 결정한다46. 단백질 결정 마운팅, 데이터 수집을 위한 빔라인 계측기 설치, 데이터 준비 및 좌표 파일 및 모든 원자 중성자 구조를 모델링하는 데 필요한 미세 조정 단계에 중점을 둡니다.
프로토콜
1. 크리스탈 크기 평가
- 정상 및 편광 광이 장착된 현미경을 사용하여 결정의 크기를 측정합니다. 최소 부피가 ~0.1mm3인 크리스탈을 선택합니다(추가 도 4).
- 충분히 큰 결정으로 우물을 라벨과 이러한 결정을 생성하는 데 사용되는 결정화 조건을 주의하십시오.
2. 유정 결정화 버퍼 준비
- 결정화 버퍼 부품을 D2O로 분해하여 결정화 버퍼를 생성합니다.
- 다음 방정식을 사용하여 솔루션의 pD를 계산하여 버퍼의 pH를 조정합니다.
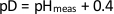 (1)
(1)
여기서 pHmeas는 표준 유리 전극으로 측정된 pH입니다. NcLPMO9D 결정화 버퍼의 원래 pH는 6.0이었기 때문에 pD 6.0에서 결정화 버퍼에 대해 5.6의 pHmeas를 사용합니다. - 사용 전 10분 동안 PH 미터 전극을 D2O에 담가 두면(보조 도 5).
- 염기 NaOD 또는 산 DCl을 사용하여 pHmeas 를 5.6으로 조정합니다.
3. 크리스탈 수확
- 결정화 트레이 옆에 실리콘22mm 원형 유리 슬라이드를 놓습니다. 크리스탈 당 깨끗한 유리 슬라이드를 사용합니다 (그림 2A).
- 9웰 양대형 실리콘 유리 플레이트에 단백질 결정이 들어있는 밀봉 된 샌드위치 상자를 엽니 다.
- 마이크로피펫으로 결정화 저수지 용액에서 10-20 μL을 제거하고 용액을 유리 슬라이드에 놓습니다(도 2B).
- 적절한 크기의 마이크로루프를 사용하여 크리스탈을 수확하고 크리스탈과 함께 자주 수확되는 이물질을 제거하기 위해 유리 슬라이드에 저수지 용액 드롭에 결정을 놓습니다(도 2C 및 도 2D).
참고: 소량 의 물방울이 증발 할 수 있으므로 신속하게 작업해야합니다. 수확된 결정은 대기권에 노출되었을 때 건조될 위험이 있습니다. 작은 결정화 낙하 부적에서 결정이 건조되는 것을 방지하기 위해 단백질 강하에 일부 저수지 용액을 추가해야 할 수도 있습니다.
4. 크리스탈 마운팅
참고: 모세관 장착 프로토콜은 실험주의 선호도에 따라 다릅니다. 결정의 손상을 방지하기 위해, 짧아야 하는 모세혈관은 매끄러운 휴식을 보장하기 위해 절단 석또는 사포로 득점해야 합니다.
- 모세관 작용에 의한 저수지 버퍼로 2mm 직경 50mm 길이석영모세관의 한쪽 끝을 채우거나, 저수지 버퍼의 ~10 μL을 모세관으로 직접 피포팅하여(도 3A).
참고: 사용자는 기계적 강도 외에도 중성자 빔 흡수를 제한하고 모세관에서 낮은 배경 기여를 제한하는 것이 필수적이기 때문에 석영 모세관 튜브를 사용하는 것이 좋습니다. 유리 모세혈관은 높은 배경을 도입하고 중성자를 흡수하여 데이터 품질을 저하시니다. - 마운팅 루프를 사용하여 쿼츠 모세관의 저수지 버퍼에 크리스탈을 부드럽게 놓습니다(도 3B 및 도 3C).
- 튜브를 부드럽게 탭하여 저수지 버퍼를 이동하고 그 안에 침수 된 결정체 (도 3D).
- 크리스탈을 13.5 mm 이하로 더 가깝게 두지 않고 모세관의 한쪽 끝에서 27.5mm를 더 이상 놓지 마십시오. 이것은 장착 끝입니다 (보충 도 6).
- 긴 얇은 파이펫 팁을 사용하여 크리스탈 주위의 버퍼 용액을 흡인하여 크리스탈을 약간 젖게 합니다. 크리스탈을 만지지 마십시오 (보충 도 7A).
- 얇은 종이 심지로 모세관 벽을 건조시다(보조 도7B).
- 피펫 20-50 μL의 중음 버퍼 용액은 마운팅 끝 맞은편에 있는 모세관의 끝으로 들어갑니다(도 4A).
- 밀랍을 열 "지팡이"로 녹여 이 녹은 밀랍에 모세관을 부드럽게 삽입합니다. 밀폐 씰이 형성될 때까지 반복합니다(그림 4B 및 그림 4C).
- 피펫은 매우 적은 양의 중수소 버퍼, 모세관의 장착 끝에 약 5 μL을 가하여 뜨거운 밀랍에 대한 "방열판"역할을 한다. 이 끝을 녹인 밀랍에 담그고 양끝에 밀봉된 모세관을 형성하기 위해 이전에 설명한 바와 같이 밀폐 씰을 생성합니다(그림 4D).
- 장착 후 현미경을 사용하여 장착된 크리스탈을 검사하여 밀폐성을 보장합니다(그림 4E).
- 15ml 팔콘 튜브 또는 페트리 디쉬와 같은 용기에 김 와이프로 장착 된 크리스탈을 조심스럽게 고정하고 결정이 재배된 온도에서 수평으로 보관하십시오 (그림 4F).
5. 증기 교환
- 결정 장착 후 이틀 후에 유정 버퍼를 신선한 버퍼로 교체하십시오.
- 가열 루프로 크리스탈에서 가장 먼 왁스 씰을 녹이고 파이펫과 종이 심지를 사용하여 버퍼를 제거합니다.
- 모세관을 20-50 μL의 중음 버퍼 용액으로 리필하고 왁스로 밀봉합니다.
- 4일 간격으로 단호한 버퍼 교체를 두 번 더 반복하여 단호화 된 완충 증기 교환이 완료되고 적어도 2 주 동안 증기 교환을 허용하십시오.
6. 중성자 단백질 회절
참고: IMAGINE 빔 라인 에 관심이 있는 독자는 Meilleur 외. 2013, Meilleur 외. 201810,47참조하는 것이 좋습니다.
- HFIR의 IMAGINE 빔라인의 실온 데이터 수집
- 샘플 마운팅
- 퍼티로 고니오미터에 모세관 장착 크리스탈을 고정합니다.
- 샘플 스틱에 고니오미터를 장착하고 오프 라인 정렬 스테이션을 사용하여 빔의 결정을 중심으로 합니다.
- 계측기 샘플 스테이지(보충 도 1B)에서 샘플 스틱을 고정합니다.
- 실험적인 허치가 비워지고 중성자 데이터 수집을 위한 빔라인 셔터를 엽니다.
- 데이터 수집
- 빔라인 제어 컴퓨터에서 데이터 수집 프로그램을 열고 설치 탭을 클릭하여 데이터 수집 전략을 설정합니다. 실험 매개 변수에서 샘플 이름을 샘플 이름 옆에 입력하고 제안서 옆에 제안 번호를 입력합니다. 이미지 이름 지정 에서 폴더 템플릿 을 선택하고 획득한 데이터에 대한 대상을 저장하고 이미지 접두사를 선택하고 관련 프레임 이름(보충 그림 8)을 입력하도록 설정합니다.
- 광학 GUI를 열고 λmin에 대한 2.78 및 λmax에 대한 4.78을 클릭하여 데이터 수집을위한 준 Laue 범위를 설정합니다 (보충 도 9).
- 수집 탭과 다음 스캔 매개 변수 에서 열화 시간 노출 시간, N 프레임 아래의 프레임 수 및 Δ φ/프레임 아래데이터 수집 각도를 삽입합니다. 이미지 접두사 아래에 수집할 프레임의 이름을 지정하고 시작 검사 버튼(추가 그림 10)을 클릭하여 데이터 수집을 시작합니다.
- 확산 중성자는 이미지 플레이트 검출기에 의해 검출됩니다. 각 노출의 끝에서, 이미지 플레이트는 판독되고 데이터 수집 GUI에 표시되는 패턴(보충 도 11).
- 프레임은 책임있는 빔 라인 과학자에 의해 Lauegen, Lscale50 및 스칼라를 사용하여 인덱싱, 통합, 파장 정규화 및 스케일링되며, 이들은 데이터 수집 에 따른 병합 반사 파일을 사용자에게 제공합니다(보충 도 12).
참고: IMAGINE과 MaNDi의 데이터 수집은 헬리웰 외.48 및 Nieh et al.49에서 개발한 라우 회절 데이터 수집을 위해 개발된 방법론과 소프트웨어를 사용하여 준 라우 모드에서 수행됩니다. - 중성자 회절 데이터 수집 다음과 동일한 온도에서 동일한 결정에서 해당 X선 데이터 집합을 수집합니다(보충 도 13).
참고: 동일한 낙하 또는 동일한 결정화 조건 하에서 재배된 결정은 관절 중성자/X선 정제를 위한 X선 회절 데이터를 수집하는 데도 사용할 수 있습니다.
- 샘플 마운팅
- SNS의 마엔디 빔라인의 극저온 데이터 수집
참고: 빔 라인 에 관심이 있는 독자는 코트 외(2015), Meilleur 외. 201810,11에 문의하는 것이 좋습니다.- 샘플 마운팅
- 결정과 유족 극저온 보호제의 감소를 위해 유족 아스코르바테 담그고 용액을 준비합니다. 각 솔루션의 20 μL 방울을 결정화 플레이트에 앉는 드롭 웰에 넣습니다.
참고: 냉동 보호용 솔루션은 일반적으로 D2O에서 제조된 극저온 X선 회절 데이터 수집에 효과적인 것으로 입증된 냉동 보호제입니다. 이 냉동 보호제는 필요한 경우 중성자 데이터 수집을 위해 추가로 최적화 (예 : 농도)할 수 있습니다. - 샘플 장착루프를 선택하고 MaNDi 지침(보충 도 14)에 따라 자기 저온베이스에 부착합니다.
- 액체 질소거품 극저온-드와르를 채웁니다. 액체 질소 내에 금속 냉동 보호 슬리브를 놓습니다(보충 도 15A).
- 모세관의 양쪽 끝에서 왁스 플러그를 제거하고 모세관을 눌러 버퍼 플러그를 움직이면 장착 된 결정이 버퍼에 침지되도록합니다. 착액을 20 μL 저수지 용액 드롭으로 잘 씻어 주세요(보조 도 15B 및 보충 도 15C).
참고: H/D 교환이 결정화 방울의 평형에 의해 또는 결정화 버퍼에 대한 결정화 방울을 직접 흡수하여 수행된 경우에는 이 단계가 필요하지 않습니다. - 아스코르바테 담그용 액트에 2시간 동안 크리스탈을 담그세요. 마그네틱 저온베이스에 부착된 마이크로루프에 크리스탈을 장착합니다. 장착된 결정을 냉동 보호제에 10초 간 담그고 크리스탈과 냉동고 마운트를 액체 질소에 떨어져 동결시합니다(추가 도 15D).
- 크리스탈이 얼어 붙으면 미리 냉각된 냉동 고리 핀 통을 사용하고 저온 스트림이 장착된 MaNDi 샘플 스테이지에 크리스탈을 장착합니다. 냉동 핀 통을 부드럽게 열고 크리스탈이 냉동스트림에 남아 있는지 확인합니다(보조 도 2C).
- 결정과 유족 극저온 보호제의 감소를 위해 유족 아스코르바테 담그고 용액을 준비합니다. 각 솔루션의 20 μL 방울을 결정화 플레이트에 앉는 드롭 웰에 넣습니다.
- 데이터 수집
- 실험 정보가 자동으로 채워지는 데이터 수집 소프트웨어를 엽니다.
- 크리스탈 의 중심을 클릭하여 컴퓨터 제어 곤니오미터(보충 도 16)로 중앙을 연결합니다.
- 표 아래, 값 아래 프레임당 총 중성자 빔 노출뿐만 아니라 "phi"에서 데이터 수집에 대한 각도를 입력하여 데이터 수집 전략을 설정합니다(보충 도 17).
- 데이터 수집을 시작하려면 제출 을 클릭합니다.
- 데이터가 수집되면 분산 된 중성자가 표시됩니다 (보충 도 17). 노출 시간이 증가함에 따라 회절 반점이 명확해지므로 신호 대 잡음 비율이 향상됩니다(그림 5).
- 프레임은 책임있는 빔 라인 과학자에 의해 Mantid 및 Lauenorm을 사용하여 인덱싱, 통합, 파장 정규화 및 배율화되며, 사용자는 데이터 수집51에 따라 병합 된 강도 파일을 제공합니다.
- 샘플 마운팅
7. 구조 개선
- 조인트 엑스레이 및 중성자 데이터 개선
- 구조 준비
- X선 데이터를 정제하여 phenix.refine 소프트웨어 패키지 및 쿠트(Coot)를 사용하여 완성된 구조를 획득한다.
- CCP4를 열고 중성자 데이터의 R-프리 데이터 플래그와 X선 데이터의 R-없는 데이터 플래그와 일치하도록 MTZ 로 변환/수정/확장 프로그램을 선택합니다. MTZ 형식으로 반사 파일을 가져오도록 선택합니다. 아래에서 얻은 중성자 MTZ 파일을 업로드하고 Import FreeR MTZ (보충 도 18)에서 X 선 mtz 파일을 업로드합니다. 아래에서 새 MTZ 파일의 이름을 지정하고 실행을 클릭합니다.
- Phenix 소프트웨어 패키지를 열고 개선 도구에서 ReadySet 을 클릭합니다. PDB 파일 옆에 는 X 선 데이터에 대해 구체화된 PDB 좌표 파일을 업로드합니다. 부재 중 인지 모형에 수소를 추가하려면 선택할 수 있으며, 드롭다운 메뉴에서 다른 곳에서 H/D 를 선택합니다. 용매 분자에 대두 증관을 선택하고 기본 값에 나머지 옵션을 둡니다(보충 도 19A).
참고: 변성 단백질을 사용하는 경우, 수 소를 추가하여 결석한 경우 모델화하고 교환 가능한 사이트D에서 H/D를 선택합니다.
- 구조 개선
- 개선 탭 에서 phenix.refine 프로그램을 열어 X 선 및 중성자 데이터를 모두 사용하여 구체화를 설정합니다. 입력 파일의 구성 탭에서 ReadySet으로 처리된 X-ray 구조에서 PDB 파일을 입력하고 관련 리간드에 대해 필요한 CIF가 파일을 억제합니다. 중성자 데이터에서 CCP4를 사용하여 할당된 Rfree 플래그로 MTZ 파일을 업로드하고 데이터 유형 제목 아래에 "중성자 데이터"와 "중성자 R-free"로 할당합니다. X선 데이터에서 MTZ 파일을 업로드하고 데이터 유형 제목 아래에 "X선 데이터" 및 "X-ray R-free"로 할당합니다. 데이터가 업로드되면 공간 그룹 및 데이터 레이블이 자동으로 채워집니다(추가 그림 19B).
참고: 수정 정보를 구체화하고 입력할 때 X선 데이터에서 결정된 단위 셀을 사용합니다. - 구체화 설정의 구성 탭에서 표준 구체화 전략을 유지합니다. 사이클 수를 5개로 늘립니다(추가 그림 20)
- 모든 매개 변수를 선택하고 고급 을 클릭하고 수소를 선택합니다. 수소 정제 모델을 개별적으로 변경하고 힘 승마 애드프를 끕니다(보충 도 20).
- 모든 매개 변수를 선택하고 검색 매개 변수 옵션을 엽니다. 핵이라는 단어를 검색하고 X-H/D의 핵 거리를 사용하도록 선택합니다(추가 그림 20).
- 실행을 선택하여 구체화를 시작합니다.
- 개선 탭 에서 phenix.refine 프로그램을 열어 X 선 및 중성자 데이터를 모두 사용하여 구체화를 설정합니다. 입력 파일의 구성 탭에서 ReadySet으로 처리된 X-ray 구조에서 PDB 파일을 입력하고 관련 리간드에 대해 필요한 CIF가 파일을 억제합니다. 중성자 데이터에서 CCP4를 사용하여 할당된 Rfree 플래그로 MTZ 파일을 업로드하고 데이터 유형 제목 아래에 "중성자 데이터"와 "중성자 R-free"로 할당합니다. X선 데이터에서 MTZ 파일을 업로드하고 데이터 유형 제목 아래에 "X선 데이터" 및 "X-ray R-free"로 할당합니다. 데이터가 업로드되면 공간 그룹 및 데이터 레이블이 자동으로 채워집니다(추가 그림 19B).
- 모델 빌딩
- Phenix의 세련미에 따라 결과 탭에서 쿠트에서 열기를 클릭하여 X 선 전자 밀도 및 중성자 SLD 맵을 시각화합니다. 디스플레이 관리자 탭을 클릭하고지도 에서 중성자지도를 제거하기 위해 _neutron 지도 옆의 지도 삭제를 클릭합니다(보조 그림 21). 파일을 클릭 > 오픈 MTZ, mmCIF fcf 또는 phs .... 현재 구체화 파일을 선택하고 .mtz 파일을 엽니다. 진폭및 위상 옵션 모두의 경우 드롭다운 메뉴에서 2FOFC WT_no_fill_neutron 데이터를 선택합니다. 이 것을 반복하고 FOFC WT_neutron 데이터를 엽니다. 디스플레이 관리자를 열고 중성자 및 X선 2FOFCWT 맵을 스크롤하여 2FOFCWT 맵의 rmsd를 1.00으로 줄입니다(추가 그림 21). 중성자와 X선 FOFCWT 맵을 스크롤하고 스크롤하여 FOFCWT 맵의 rmsd를 3.00으로 줄입니다.
- 잔류물의 육안으로 검사를 수행하여 모델이 데이터에 적합한지 여부를 결정합니다. 차이 밀도 맵 피크를 분석하여 모든 교환 가능한 사이트의 올바른 방향 및 H/D 점유율을 결정합니다. 여기에는 세린, 스로닌 및 티로신의 하이드록실 그룹이 포함됩니다. 히스티딘, 글루타민, 아스파라진 및 리신의 질소; 시스테인의 설피드릴; 아스파타테와 글루타민의 카복틸 그룹; 백본 아미드 그룹; 리간드; 보조 인자 및 잠재적 인 기능화 잔기 (그림 6).
- 중성자 밀도 및 수소 결합 상호 작용에 따라 회전 변환 영역/사슬/분자 기능(보충 도 22A 및 보충 도 22B)을 사용하여 이를 회전시킴으로써 물 분자를 리디렉션합니다. 편집 치 앵글 도구와 회전 번역 영역/사슬/분자 기능(보조 도 22C 및 보충 도 22D)을 사용하여 단백질 잔여물 H/D 교환 가능한 부위의 위치를 조정합니다.
- 구조 준비
- 구조 개선 – 중성자 데이터 전용 정제
- 구조 준비
- 페닉스를 열고 "분자 교체"를 선택하고 "Phaser-MR(전체 특징)"을 선택하여 분자 대체에 의해 계측기 과학자가 제공하는 스케일링된 강도의 위상을 도출하여 pdb 형식으로 시동 좌표 파일을 생성한다. 시작 pdb 구조를 "입력 및 일반 옵션 탭에 입력하고 앙상블, ASU 내용 및 검색 절차 옵션을 완료합니다.
- 모델 도구를 열고 PDB 도구를 선택합니다. pDB 파일을 입력 파일로 삽입합니다. 옵션 탭으로 이동하여 원자 제거 선택 에서 용매, 리간드, 보조 인자 및 금속의 이름을 선택합니다. 이렇게 하면 모든 물 분자, 보조 인자, 리간드 및 금속 이온이 제거되어 최소한의 모델을 생성합니다. 또한 모델에서 대체 순응자를 제거하도록 선택합니다(추가 그림 23).
- 페닉스에서 구체화를 선택하고 ReadySet을 엽니다. PDB 파일 옆에 편집된 pDB 좌표 파일을 입력합니다. 부재 중성자 정제 옵션의 드롭다운 메뉴에서 다른 곳에서 H/D를 선택하여 모델할 수 있는 수소 추가를 선택합니다(보조 그림 23).
- 구조 개선
- 페닉스의 구체화 탭 아래 페닉스.refine 프로그램을 엽니다. 구성 탭에서 입력 파일 상자 에서 ReadySet으로 처리 된 PDB 파일을 입력합니다. 입력 파일 상자에서 중성자 데이터에서 MTZ 파일을 업로드하고 중성자 데이터임에도 불구하고 데이터 유형 열 아래에 X선 데이터 및 X선 R-free로 할당합니다. 다음 단계에서 설정된 구체화 구성은 반사 파일을 중성자 데이터로 처리하는 데 사용됩니다. 데이터가 업로드되면 공간 그룹 및 데이터 레이블이 자동으로 채워집니다(추가 그림 24A).
- 구체화 설정의 구성 탭에서 표준 구체화 전략을 유지합니다. 사이클 수를 5개로 늘립니다. 다른 옵션에서 산란 테이블 드롭다운 메뉴에서 중성자를 선택합니다. 물 업데이트 옵션을 선택 해제합니다(보조 그림 24B).
- 모든 매개 변수>고급>수소를 선택합니다. 새 창에서 수소 정제 모델 드롭다운 메뉴에서 개별을 선택하고 힘 승마 애드프를 끕니다(보충 도 20).
- 검색 매개 변수를 > 모든 매개 변수를 선택합니다... 선택. 핵이라는 단어를 검색하고 X-H/D의 핵 거리를 사용하도록 선택합니다(추가 그림 20).
- 실행을 선택하여 구체화를 시작합니다.
참고: 초기 개선 에 따라 중성자 SLD 지도를 시각적으로 검사하고 Coot에서 수동 모델 건물을 수행해야합니다. 모델에 존재하는 리간드/공동 인자를 삽입해야 할 수도 있습니다. 후속 구체화에는 관련 리간드에 필요한 CIF 구속 파일이 필요하며 phenix.refine의 구성 탭에 업로드해야 합니다.
- 모델 빌딩
- Phenix의 세련미에 따라 결과 탭에서 쿠트에서 열기를 클릭하여 중성자 SLD 맵과 구조를 시각화합니다. 디스플레이 관리자 탭을 클릭하고지도 에서 2FOFCCWT 및 FOFCCWT 지도 (보충 그림 25)를 모두 삭제하려면 지도 삭제지도를 클릭합니다. 파일 > 오픈 MTZ, mmCIF fcf 또는 phs를 클릭하십시오... 현재 구체화 폴더를 선택하고 .mtz 파일을 선택합니다. 진폭 및 위상 옵션 모두 드롭다운 메뉴에서 2FOFC WT_no_fill 데이터를 선택합니다. 파일 > 열린 MTZ, mmCIF fcf 또는 phs를 클릭하여 반복하고 진폭 및 위상 옵션 모두에 대한 드롭다운 메뉴에서 FOFCWT 데이터를 선택합니다. 디스플레이 관리자를 열고 2FOFC WT_no_fill 맵을 스크롤하려면 스크롤하여 2FOFC WT_no_fill 데이터의 rmsd를 1.00(보충 도 25)로 줄입니다. FOFCWT 맵을 스크롤하고 스크롤하여 FOFCWT 데이터의 rmsd를 3.00으로 줄입니다.
- 단백질 구조의 육안 검사를 수행하여 모델이 중성자 SLD 맵에 맞는지 여부를 결정합니다.
- 7.1.3.2에 설명된 바와 같이, H/D 교환 가능한 사이트가 있는 잔류물 및 그룹의 올바른 방향 및 H/D 점유율을 결정합니다. 회전 변환 도구를 사용하여 잔류 위치를 조정하고 치 앵글 편집(그림 6). 필요한 경우 실제 공간 정제 영역을 사용할 수 있습니다. 텍스트 편집기를 사용하여 올바른 원자 좌표를 삽입하여 잔여물에서 수동으로 폭발하는 D 원자수정
참고: 실제 공간 정제 영역 은 쿠트의 중성자 SLD 맵에 최적화되지 않으며 D로 향하는 원자에 대한 불규칙한 결합 길이가 발생할 수 있으며 폭발잔류라고 불규칙할 수 있습니다(보충 도 26). 필요한 원자 좌표를 수동으로 편집하고 실제 공간 정제 영역의 사용을 피하는 것이 바람직하다. - 중성자 밀도에 따라 물 분자를 삽입하고 방향을 조정합니다. 쿠트에 물을 추가하려면 포인터 아이콘 에서 원자 배치 를 선택하고 물 분자를 삽입하도록 선택합니다(보조 도 27A). Coot는 기본적으로 이 위치에 O 원자를 삽입합니다.
- 쿠트에 삽입 된 물의 O 원자에 D 원자를 추가하려면 Phenix를 사용합니다. 구체화 메뉴를 열고 ReadySet을 클릭합니다. 중성자 정제 옵션 옆에는 용매 분자에 중테리움을 추가하는 옵션만 선택합니다. 부재 중일 경우 모델에 수소 추가 를 선택 해제합니다(보조 도 27B 및 보충 도 27C).
참고: 중성자 전용 데이터를 사용하는 모델 건물은 백본및 무거운 원자의 좌표의 정제에 기여할 X선 데이터가 없기 때문에 조인트 X 선/중성자 구조의 모델 빌드와 다릅니다. 관절 정제에서 전자 밀도 맵은 처음에 단백질 백본 및 사이드 체인 좌표를 결정하는 데 사용됩니다. 이 모델은 H/D 원자의 방향과 점유가 중성자 SLD 맵에서 파생되는 조인트 X 선/중성자 데이터 개선에 나중에 사용됩니다. 중성자 전용 정제에서, 전체 구조는 H/D 원자(그림 6)이외에 물 분자, 백본, 사이드 체인 및 리간드의 구축을 요구하는 중성자 SLD 맵의 분석에서 파생됩니다. 데이터 대 매개 변수 비율은 중성자 데이터에 대한 개선도가 낮으며 데이터를 과도하게 적합하지 않도록 주의해야 합니다.
- 구조 준비
결과
Neurospora crassa (NcLPMO9D)에서 라이틱 다당류 단산소제의 결정에 대한 중성자 회절 데이터는 상온에서 HFIR에서 IMAGINE에서 수집되었으며, 위에서 설명한 프로토콜에 따라 SNS에서 MaNDi에서 MaNDi에서 수집하였다. 0.1 mm3 이상의 부피를 가진 H2O 기반 완충에서 자란 수소화 단백질의 결정이 사용되었습니다(큰 결정의 예는 보충도 4 및 그 후 수치에 도시됨). 결정은 데이터 수집 전에 3주 동안 D2O 기반 버퍼를 가진 석영 모세혈관 및 증기 교환에 장착되었다(그림 4).
실온 데이터 수집은 IMAGINE 빔라인(그림 1)에서 수행되었다. 4시간 의 백색 빔 테스트를 통해 크리스탈이 전체 데이터 집합을 수집할 수 있도록 적합한 크기와 품질임을 시사하는 고해상도 회절이 있었습니다. 결정의 회절 품질에 대한 예비 정보를 제공하는 것 외에도, 초기 광대역 패스 노출을 사용하여 회절 패턴을 인덱싱하고 결정 방향 매트릭스를 결정할 수 있습니다. 크리스탈의 P21 스페이스 그룹을 감안할 때, 프레임당 20시간의 수집 시간을 가진 18프레임의 데이터 수집 전략이 구현되었다. X-ray 회절 데이터 수집과 마찬가지로 대칭 공간 그룹이 높을수록 전체 데이터 집합을 수집하려면 프레임(예: 각도 커버리지 감소)이 줄어듭니다. 데이터는 2.8 – 4.0 Å의 파장 범위를 사용하여 준 라우 모드에서 수집되었다. 데이터 수집 후 데이터는 2.14 Å의 해상도로 MTZ 형식으로 중성자 SLD 파일을 제공하기 위해 인덱싱, 통합 및 병합되었습니다. 데이터는 X선 데이터 분석을 위한 유사한 지침에 따라 충분한 품질로 평가되었지만, 중성자 단백질 회절은 플럭스 제한 기법이기 때문에 80%와 CC1/2 이상의 완전성이 허용가능한 것으로 간주되었다.
실온 중성자 회절 데이터 수집에 이어, 동일한 결정이 1.90 Å 해상도에서 실온 X선 회절 데이터 집합을 수집하는 데 사용되었다(보충 도 13). X선 데이터는 C, N, O 및 S를 포함한 "무거운" 원자의 위치를 결정하는 데 사용되었습니다. X선 데이터에 대해단독으로 정제된 구조는 X선 및 중성자 데이터에 대한 조인트 정제를 수행하기 위한 시작 모델로 사용되었다. Phenix ReadySet은 교환 가능한 부위에 H 원자, H 및 D 원자를 교환 가능한 부위에 추가하고 D 원자를 시작 X선 모델의 물 분자에 추가하는 데 사용되었습니다. 이 모델 준비 에 따라 두 데이터 집합(보충 도 19 및 보충 도 20)에 대해 반복적 개선이 수행되었습니다. 인터랙티브 모델 건물은 쿠트에서 측면 사슬 및 물 분자를 이에 따라 방향을 지정하기 위해 밀도 맵을 육안으로 검사하여 수행하였다(보충 도 22). 중성자 데이터는 주로 프로토네이션 상태와 물 분자 방향을 결정하는 데 사용되었습니다. 세린 및 트립토판 과 같은 잔류물의 전자 밀도 맵과 해당 중성자 SLD 맵의 비교는 중성자 단백질 회절으로부터 H/D 교환 가능한 부위에서 프로토네이션 상태에서 얻을 수 있는 정보를 도시한다(도 7). 물 분자용 전자 및 중성자 SLD 맵의 맵 오버레이는 또한 수소 결합 상호 작용이 X 선 데이터에서 유추될 수 있지만 중성자는 이러한 수소 결합의 방향에 관한 명확한 정보를 제공한다는 것을 나타냅니다(그림 8). 중성자 SLD FO-FC 생략 맵은 측면 체인의 프로토네이션 상태 및 H/D 방향을 결정하기 위해 생성되었다. 중성자 Fo-FC 맵이 H/D의 존재를 나타내는 긍정적인 피크를 명확하게 나타내는 티로신 및 티로닌 잔류물을 위해 획득한 중성자 SLD 맵이 도시되어 있습니다(그림 9). 수집된 중성자 회절 데이터는 또한 -ND3+ Lys 그룹과 같은 다중 프로토네이션 상태에 대한 귀중한 정보를 제공하였다(그림 10). 모델 최적화 중에 개선 통계(Rwork 및 Rfree)를 면밀히 모니터링하여 과다 피팅을 방지했습니다. 최종 통계는 X선 Rwork를 12.77%와 18.21%의 Rfree, 중성자 Rwork14.48%,물 분자 389개(보충 수치 28)로 21.41%의 Rfree를 제공했습니다.
극저온 데이터는 CNDi 빔라인(보충도 2 및 보충도 도 15)45에서 CuII에서 CuI로 구리 활성 부위를 줄이기 위해 아스코르바테 담그후 NcLPMO9D에서 수집하였다. 데이터는 4시간 노출을 사용하여 중성자 회절 테스트를 거쳐 TOF Laue 모드를 사용하여 수집하여 회절의 품질을 확인하였다. 크리스탈의 공간 그룹을 감안할 때, 프레임 당 80 Coulombs의 수집 용량18 프레임의 데이터 수집 전략이 고안되었다. 데이터는 2.0 - 4.0 Å의 파장 범위에서 TOF-Laue 모드에서 수집되었습니다. 데이터 수집 후 데이터는 2.40 Å51,52의 해상도로 MTZ 형식으로 반사 파일을 제공하기 위해 인덱싱, 통합, 확장 및 병합되었습니다.
데이터 수집 에 이어 2.40 Å 극저온 NcLPMO9D 중성자 회절 데이터 집합이 중성자 전용 데이터 개선에 사용되었습니다. 중성자 데이터는 PDB 5TKH를 사용하여 분자 대체에 의해 단계화되었다. Phenix ReadySet은 교환 할 수없는 사이트에 H 원자와 교환 가능한 사이트에서 부분 점유가있는 H / D 원자에 H 원자를 추가하는 데 사용되었습니다. 물 분자는 PDB 도구를 사용하여 시작 모델에서 제거되었다(보충 도 23). 모델 제제는 중성자 산란테이블을 이용한 페닉스.세련미(보충도 24)로 세련되었다. 인터랙티브 모델 건물은 쿠트에서 수행되었으며, 물 분자는 FO-Fc 맵의 양수 피크를 사용하여 첨가되고 잠재적인 수소 결합 상호 작용에 따라 위치하였다(도 11A 및 도 11B). 중성자 SLD 지도를 분석할 때, 물 분자는 높게 정렬되는 경우에 명확하게 보입니다, 그러나 그들의 조밀도는 잘 정렬되지 않는 경우에 구형 또는 타원일지도 일 지도 모릅니다 (그림 11C-E). 중성자 SLD 맵은 아스파라진과 같은 잔류물의 방향에 대한 귀중한 정보를 제공하는 데 사용되었으며, 이는 X선 회절 데이터만을 사용할 때 카보닐과 아미노 그룹 간의 차별화가 어려울 수 있다(도 12A 및 도 12B). FO-FC 중성자 SLD 생략 지도의 피크는 N δ 또는 N ε 위치(도 12C 및 도 12D)에서 히스티딘 잔류물의 프로토네이션 상태를 결정하는 데 매우 유익했습니다. 여러 H/D 교환 가능한 사이트가 있는 잔류물의 프로토네이션 상태도 중성자 SLD 맵을 사용하여 결정할 수 있습니다. 이것은 명확하게 양성 전하를 갖는 것으로 알려진 아르기닌의 FO-FC 중성자 SLD 생략지도로 설명되었다 (도 12E 및 도 12F). 이전과 마찬가지로 Rwork 및 Rfree를 모니터링하여 오버 피팅을 방지했습니다. 최종 통계는 22.58 %와 30.84 %의 Rfree (보충 그림 29)를 주었습니다. 중성자 단백질 회절은 H의 음수 산란 길이와 큰 일관성 있는 산란 계수를 고려해야 하는 유류 제한 기법이라는 점을 감안할 때, 중성자 데이터 전용 정제는 가시적인 물 분자(보충 도 28 및 보충 도 29)를 갖는 관절 X선/중성자 데이터 정제보다 더 나쁜 통계를 가질 것으로 예상될 수 있다.
중성자 SLD 지도를 분석할 때, D2O 함유 결정화 버퍼와 증기 교환을 실시한 수소화 단백질에 대해 H의 음의 중성자 산란 길이로 인한 밀도 취소가 발생할 것이 명백해질 것이다. 이러한 이유로, 교환 할 수없는 H 원자가 탄소에 부착되는 중성자 SLD지도는 전자 밀도맵 대응에 비해 불완전하게 나타납니다 (그림 13A). 취소의 효과는 종종 더 가난한 해상도에서 더 명백, 높은 품질의 단백질 결정을 얻기 위해 필수적 만들기. 따라서 X선 데이터가 단백질 백본의 위치를 결정하는 데 사용될 수 있는 X선 및 중성자 데이터를 모두 사용하여 시료의 관절 정제를 수행하는 것이 바람직하다(도 13B). 더욱이, 시스테인과 메티오닌의 황 원자는 제대로 보이지 않을 수 있으며, 정확한 원자 배치를 위한 X선 데이터가 필요할 수 있다(그림 13C 및 도 13D). 약한 중성자 산란 길이금속은 LPMO9D 맵에서 볼 수 있듯이 중성자 SLD 맵에서 모델링하는 데 어려울 수 있습니다. 저용량(방사선 손상이 없는) X선 데이터 세트는 전자 밀도 맵을 사용하여 금속 원자 포지셔닝을 허용하기 때문에 유용하다(도 13E 및 도 13F).
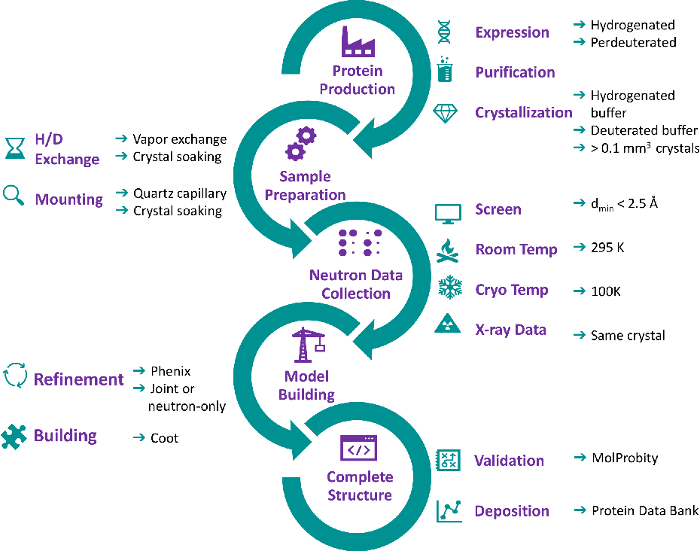
그림 1: 중성자 단백질 결정학 워크플로우의 흐름 차트. 단백질 생산. 중성자 구조를 얻기 위해 단백질이 먼저 발현됩니다. H2O-또는 D2O 기반 매체에서세균발현은 전형적으로 각각 수소 또는 perdeuteed 또는 perdeuteed 재조합 단백질의 높은 수율을 생성하는 데 사용된다. 단백질은 H2O 기반 완충제에서 정제된 다음 H2O-또는 D2O 계 결정화 버퍼에서 결정화되어 최소 크기인 0.1 mm3로 결정됩니다. 샘플 준비: 중성자 회절 데이터 수집에 앞서, H2O 성장 한 결정은 D. H/D 교환과 단백질 titratable H 원자를 교환하기 위해 H/D 교환을 거치며, 결정화 버퍼, 결정화 낙하의 균형을 직접 흡수하거나 결정화 하강의 균형을 이루거나 결정체 분리된 증기로 결정화를 장착함으로써 이루어질 수 있다. 중성자 데이터 수집: H/D 교환 후 잠재적인 결정이 스크리딩되어 회절 품질을 결정합니다. 최소 해상도가 2.5Å인 크리스탈은 전체 데이터 집합을 수집하기에 적합한 것으로 간주됩니다. 크리스탈은 상온에서 데이터 수집을 위해 쿼츠 모세혈관에 장착되거나 극저온 온도에서 데이터 수집을 위해 극저온 루프에서 동결된 플래시를 장착합니다. X선 데이터 집합은 동일한 온도에서 동일한(또는 동일한) 결정에서 수집됩니다. 모델 빌딩: 정제는 중성자 및 X선 데이터 또는 중성자 데이터에 대해서만 phenix.refine 를 사용하여 수행됩니다. 단백질 구조의 수동 모델 건물은 중성자 SLD 지도를 사용하여 쿠트에서 수행됩니다. 전체 구조: 단백질 구조의 완성 후, 좌표 모형은 단백질 데이터 뱅크에서 검증되고 증착된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
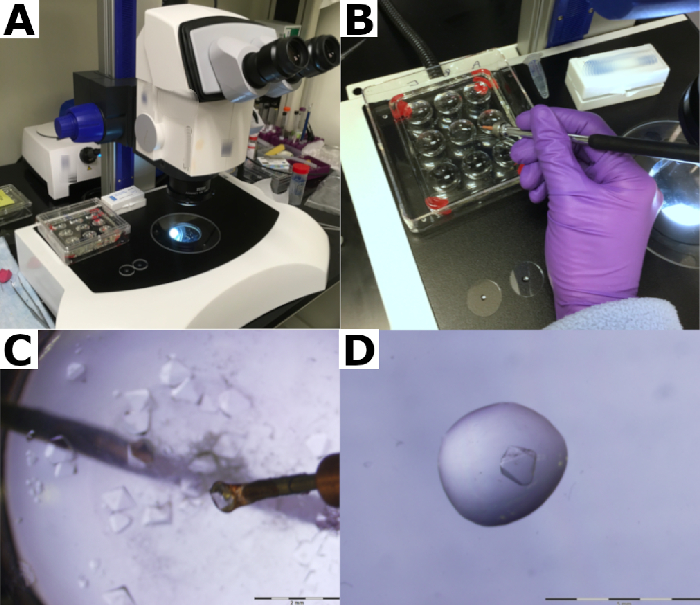
그림 2: 단백질 결정 수확. (A) 결정은 현미경으로 처리됩니다. (B) 실리콘 유리판을 포함하는 밀봉 샌드위치 상자가 열립니다. 저수지 버퍼는 실리콘 유리 슬라이드에 파이프화됩니다. (C) 결정은 마이크로루프로 수확된다. (D) 크리스탈은 크리스탈과 함께 수확되는 파편을 씻어내는 어머니 술 한 방울에 넣습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
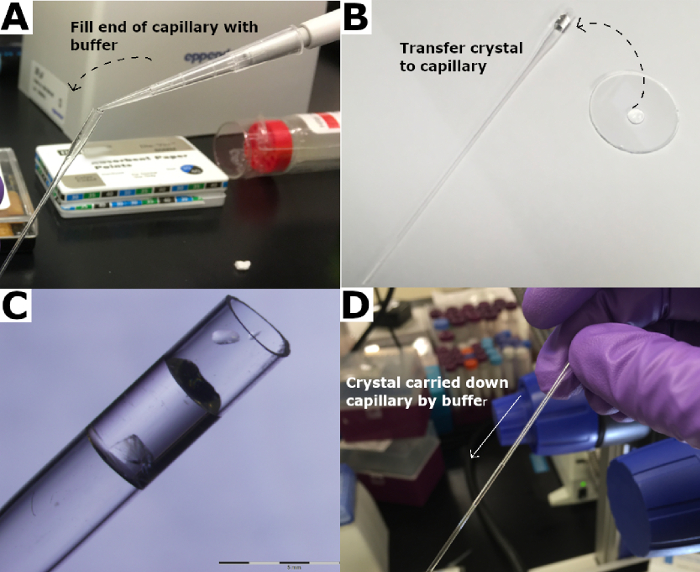
그림 3: 크리스탈을 석영 모세관으로 옮는다. (A) 석영 모세관의 끝은 저수지 버퍼로 채워져 있다. (B) 결정은 석영 모세관으로 옮겨지고 (C) 저수지 버퍼에 침지된다. (D) 결정은 저수지 버퍼를 사용하여 모세관을 수행한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
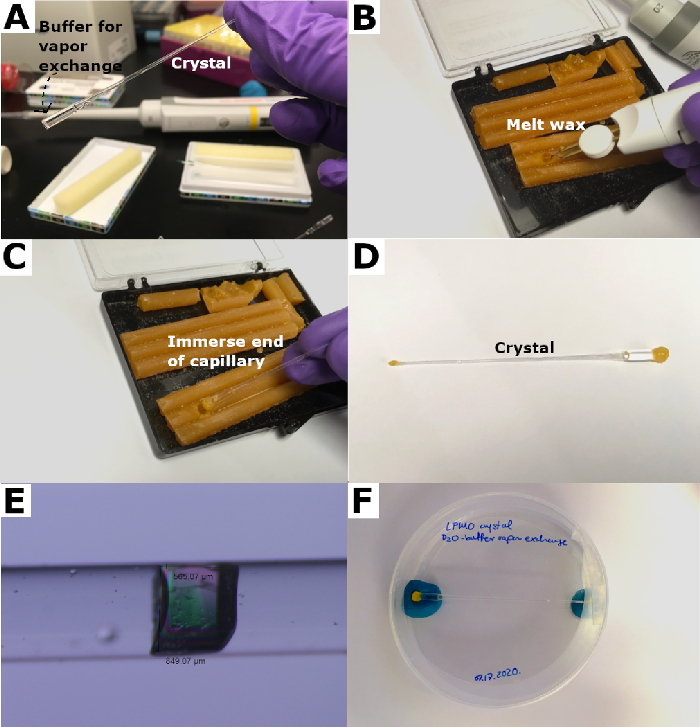
그림 4: 석영 모세관의 밀봉. (A) "플러그"를 형성하기 위해 모세관 끝에 유족 버퍼가 추가됩니다. (B) 왁스는 "지팡이"로 녹입니다. (C) 모세관은 밀봉용 왁스에 넣습니다. (D) 왁스 플러그는 모세관을 밀봉하기 위해 양쪽 끝에 형성된다. (E) 장착 후 의 결정. (F) 밀봉 된 모세관은 페트리 접시에 넣고 퍼티로 제자리에 보관됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 중성자 회절 패턴의 신호 대 잡음 증가. 데이터 수집이 진행됨에 따라 분산 된 반점이 더욱 강렬해집니다. (참고: 여기에 제시된 라이브 회절 이미지는 일러스트레이션용이며 다른 결정에서 찍은 것입니다.) 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
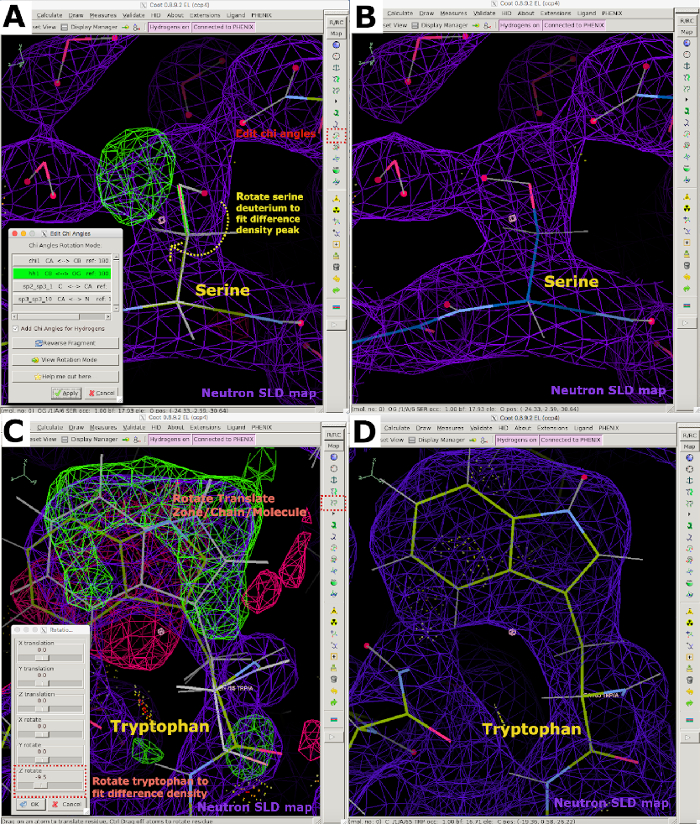
그림 6: 쿠트에서 중성자 데이터를 사용하는 대화형 모델 빌드입니다. (A) 세린을 나타내는 양성 FO-FC 중성자 SLD 밀도 피크(녹색)는 치앵글을 편집하여 방향을 바봐야 한다. 2FO-FC 중성자 SLD 맵은 보라색으로 표시되고 2FO-FC 전자 밀도 맵이 파란색으로 표시됩니다. (B) 올바르게 세린을 배치. (C) 양극포및 음극형 FO-FC 중성자 SLD 밀도 피크(각각 녹색과 빨간색)는 트립토판을 회전/변환하여 차이 밀도 피크와 일치해야 한다는 것을 나타낸다. (D) 올바르게 지향 트립토판. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
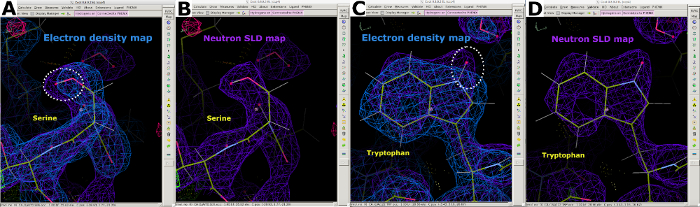
그림 7: 중성자 SLD 맵의 추가 정보입니다. (A) 2FO-FC 전자 밀도 맵(파란색)은 세린내의 "무거운" 원자의 위치를 표시합니다. (B) 2FO-FC 중성자 SLD 맵(보라색)은 세린에 "라이터" D 원자의 위치를 명확하게 표시한다. (C) 2FO-FC 전자 밀도 맵(blue)은 트립토판에서 "무거운" 원자의 위치를 표시합니다. (D) 2FO-FC 중성자 SLD 맵(보라색)은 트립토판에서 "라이터" D 원자의 위치를 명확하게 표시한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
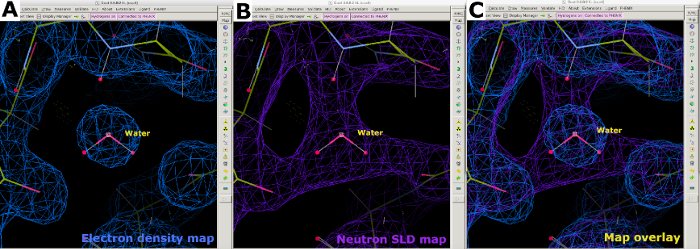
그림 8: 물 분자 위치 지정. (A) 물에 대한 2FO-FC 전자 밀도 맵(blue)의 구형 형상. (B) 2FO-FC 중성자 SLD 맵(보라색)은 물 방향 및 수소 결합 상호 작용에 대한 정보를 제공한다. (C) 전자 및 중성자 SLD 지도의 물 오버레이를 매핑합니다. 2FO-FC 중성자 SLD 맵은 보라색으로 표시되고 2FO-FC 전자 밀도 맵이 파란색으로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
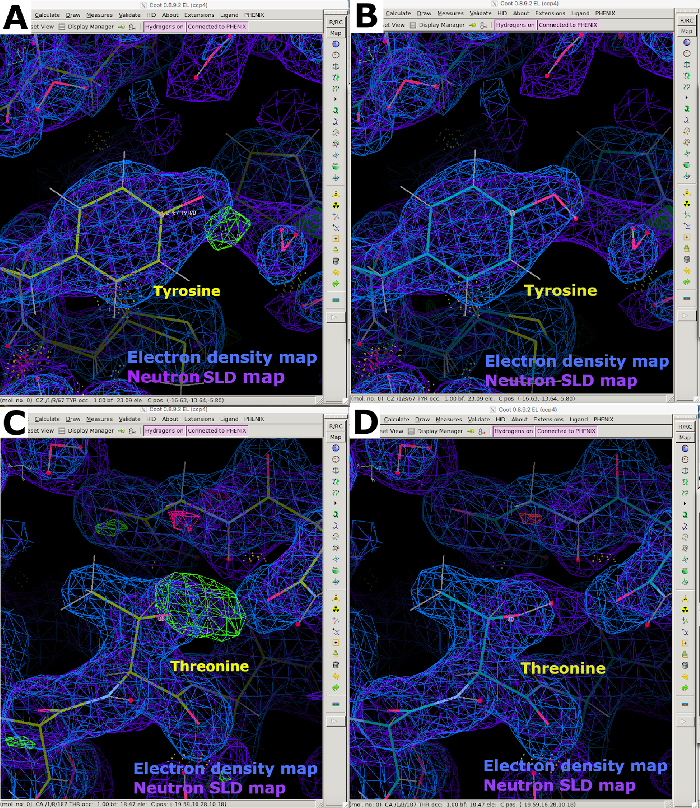
그림 9: 중성자 SLD FO-FComit 지도. (A) FO-FC 중성자 SLD 지도(녹색)는 티로신 잔류물의 H/D 방향에 대한 명확한 정보를 제공합니다. 2FO-FC 중성자 SLD 맵은 보라색으로 표시되고 2FO-FC 전자 밀도 맵이 파란색으로 표시됩니다. (B) 정확한 H/D 방향의 티로신 잔류물. (C) FO-FC 중성자 SLD 맵(녹색)은 테레오닌 잔류물의 H/D 방향에 대한 명확한 정보를 제공한다. (D) 정확한 H/D 방향이 있는 트레오닌 잔류물. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
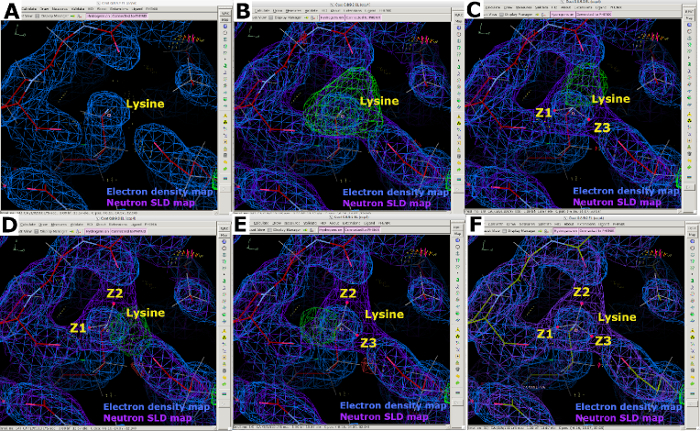
그림 10: 중성자 SLD 맵으로 표시되는 여러 프로토네이션 상태입니다. (A) 2FO-FC 전자 밀도 맵(blue)은 리신 ε 암모늄 군의 N 원자의 위치만 을 제공한다. (B-E) FO-FC 중성자 SLD 생략지도(green)는 양하전하-NH3 군을 명확하게 보여준다. 2FO-FC 중성자 SLD 맵은 보라색으로 표시되고 2FO-FC 전자 밀도 맵이 파란색으로 표시됩니다. (F) 전자 밀도 및 중성자 SLD 지도의 오버레이. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 11: 중성자 SLD 맵에서 물 분자의 출현. (A) 물 분자는 FO-FC 중성자 SLD 지도(녹색) 및 잠재적수소 결합에 따라 배치됩니다. 2FO-FC 중성자 SLD 맵이 보라색으로 표시됩니다. (B) 올바르게 배치된 물 분자. (C-E) B-요인 및 수소 결합 상호 작용에 따라 물 분자에 대 한 중성자 SLD지도의 다양 한 모양. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
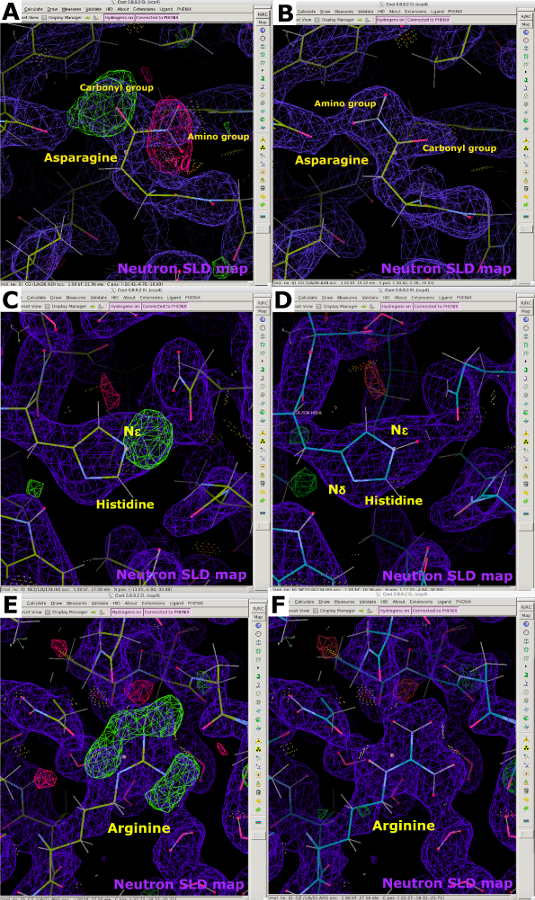
그림 12: 중성자 SLD 맵에서 제공하는 아미노산 방향 및 프로토네이션에 대한 정보입니다. (A) 중성자 SLD FO-FC 맵 피크(녹색)는 아스파라진 잔류물의 잘못된 방향을 나타낸다. 2FO-FC 중성자 SLD 맵은 보라색으로 표시되고 2FO-FC 전자 밀도 맵이 파란색으로 표시됩니다. (B) 올바른 아스파라진 방향의 2FO-FC 중성자 SLD 맵(보라색). (C) 중성자 SLD FO-FC 맵 피크(녹색)는 N ε에서 히스티딘의 단일 프로토네이션을 나타낸다. (D) 히스티딘 N ε -프로토네이션의 2FO-FC 중성자 SLD 맵(보라색) (E) 중성자 SLD FO-FC생략 맵 피크(녹색)는 아르기닌의 양전하를 확인한다. (F) 2FO-FC 중성자 SLD 맵(보라색) 양전하 아르기닌. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
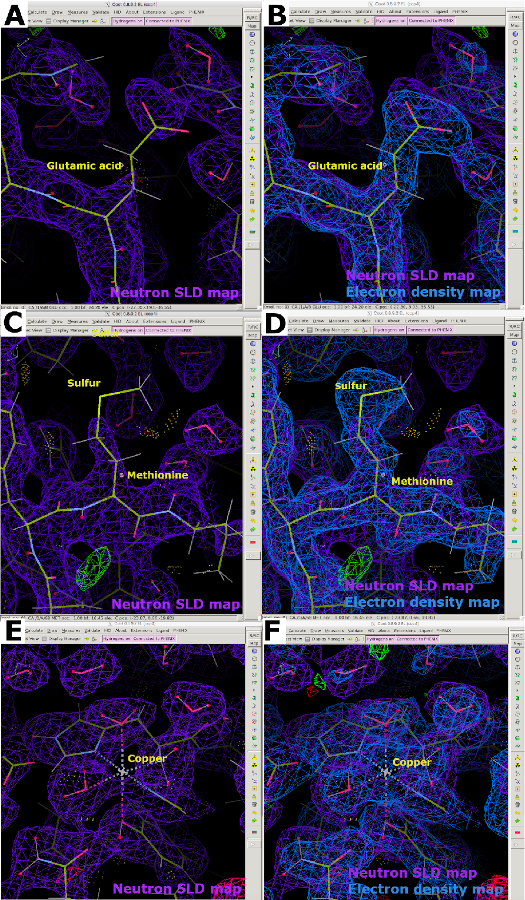
그림 13: 불연속 중성자 SLD 지도. (A) 2FO-FC 중성자 SLD 맵(보라색)의 수소화, 증기 H/D 교환 단백질. 글루타믹산은 비교환 가능한 H 원자의 음수 산란 길이로 인해 중성자 SLD 맵 취소를 표시합니다. (B) 오버레이 2FO-FC 전자 밀도 맵(blue)은 글루타믹산의 밀도를 명확하게 표시한다. (C) 메티오닌의 유황 원자는 2FO-FC 중성자 SLD 맵(보라색)에서 잘 보이지 않습니다. (D) 오버레이 전자 밀도 맵은 메티오닌의 밀도를 명확하게 표시합니다. (E) 금속 원자, 여기에 구리, 중성자 2FO-FC SLD지도 (보라색)에서 제대로 볼 수 있습니다. (F) 오버레이 2FO-FC 전자 밀도 맵(파란색)은 조정된 구리 원자의 밀도를 명확하게 표시합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 동위 원소 | 일관된 산란 길이(fm) | 일관되지 않은 산란 길이(fm) |
| 1H | -3.741 | 25.274 |
| 2H | 6.671 | 4.04 |
| 12C | 6.6511 | 0 |
| 14N | 9.37 | 2 |
| 16O | 5.803 | 0 |
| 23Na | 3.63 | 3.59 |
| 24Mg | 5.66 | 0 |
| 31P | 5.13 | 0.2 |
| 32S | 2.804 | 0 |
| 35Cl | 11.65 | 6.1 |
| 39K | 3.74 | 1.4 |
| 40Ca | 4.8 | 0 |
| 55Mn | -3.73 | 1.79 |
| 56Fe | 9.94 | 0 |
| 63Cu | 6.43 | 0.22 |
| 64Zn | 5.22 | 0 |
표 1: 중성자 산란 길이와 일관되지 않은 산란 값. 시어스에서 적응, 199216.
보충 도 1: 높은 플럭스 동위원소 반응기의 IMAGINE 기기. (A) 차가운 중성자 안내관의 IMAGINE 악기. (B) 고니미터에 퍼티가 부착된 석영 모세관에 장착된 샘플. 시료 및 검출기 테이블은 중성자 빔에 결정및 원통형 이미지 플레이트를 배치하기 위해 닫힙니다. 국제 결정학 53 연맹의 허가하에 수정되었습니다. 제네비브 마틴, 오크 리지 국립 연구소의 허가와 함께 제공 된 이미지. 이 그림을 다운로드하려면 여기를 클릭하십시오.
보충 그림 2: 스발레이션 중성자 소스의 MaNDi 악기. (A) MaNDi Anger 카메라 감지기 배열. 국제 결정학 연맹의 허가하에 재현11. (B) MaNDi 이동식 샘플 스테이지. (C) 실온 데이터 수집을 위해 MaNDi의 곤니오미터에 장착된 석영 모세관에 장착된 샘플. 제네비브 마틴, 오크 리지 국립 연구소의 허가와 함께 제공 된 이미지. 이 그림을 다운로드하려면 여기를 클릭하십시오.
보충 도 3: 용액 다당류 단산소제 NCLP9D의 구조. NcLPMO9D 구리 활성 사이트는 평평한 다당류 결합 표면에 위치하고 있습니다. 구리는 고전적인 "히스티딘 중괄호"뿐만 아니라 축 티로신 잔류물에서 두 개의 히스티딘 잔류물으로 조정됩니다. 이 그림을 다운로드하려면 여기를 클릭하십시오.
보조 도4: 착석 결정 트레이에 충분한 부피를 가진 크리스탈. (A) 9웰 실리콘 유리 플레이트에 세팅된 착석 방울에서 큰 결정이 재배됩니다. (B 및 C) 크리스탈은 0.1 mm3의 부피를 가진 것을 식별하기 > 측정됩니다. 이 그림을 다운로드하려면 여기를 클릭하십시오.
보조 도 5: pH 미터는 단호한 버퍼 판독값을 설정합니다. pH 전극은 사용하기 전에 D2O에 담가 됩니다. NaOD 및 DCl은 중음 버퍼의 pH를 조정하는 데 사용됩니다. 이 그림을 다운로드하려면 여기를 클릭하십시오.
보충 도 6: MaNDi 샘플 장착 지침. 실온 데이터 수집을 위한 석영 모세관 및 샘플 위치의 최대 치수.
에서 재현 : https://neutrons.ornl.gov/mandi/sample-environment 이 그림을 다운로드하려면 여기를 클릭하십시오.
보충 도 7: 초과 버퍼 제거. (A) 과잉 버퍼는 미세 모세관 팁으로 석영 모세관에서 흡입됩니다. (B) 나머지 버퍼는 모세관을 완전히 건조하기 위해 얇은 종이 심지로 제거됩니다. 이 그림을 다운로드하려면 여기를 클릭하십시오.
보충 그림 8: 데이터 수집 GUI. 데이터 수집을 위한 "실험 매개 변수"의 입력 창입니다. 이 그림을 다운로드하려면 여기를 클릭하십시오.
보조 도9: 광학 GUI. 중성자 수율의 데이터 수집 및 모니터링을 위한 준-라우 범위 선택. 이 그림을 다운로드하려면 여기를 클릭하십시오.
추가 그림 10: 데이터 수집 GUI의 데이터 수집. 데이터 수집에 대한 노출 시간, 프레임 수 및 각도는 "수집" 탭에 지정됩니다. 그런 다음 "시작 검사"를 사용하여 데이터 수집이 시작됩니다. 이 그림을 다운로드하려면 여기를 클릭하십시오.
보충 도 11: 디프로저검출 및 표시. 노출 시간이 끝나면 중 성자 민감한 이미지 플레이트 검출기가 판독되고 회절 패턴이 데이터 수집 GUI에 표시됩니다. 이 그림을 다운로드하려면 여기를 클릭하십시오.
보충 도 12: 중성자 회절 다음 데이터 처리. 프레임은 Lauegen, Lscale 및 Scala를 사용하여 인덱싱, 통합, 파장 정규화 및 배율조정되어 데이터 수집 에 따라 병합된 반사 파일을 생성합니다. 이 그림을 다운로드하려면 여기를 클릭하십시오.
보충 도 13: X 선 데이터 수집. 실온 데이터 수집을 위한 석영 모세관 장착 크리스탈로 설정된 홈 소스 X선 발전기. 이 그림을 다운로드하려면 여기를 클릭하십시오.
보충 그림 14: MaNDi 저온 데이터 수집에 대한 장착 지침. MaNDi에서 저온 데이터 수집을 위한 CrystalCaps 및 핀 높이의 치수.
에서 재현 : https://neutrons.ornl.gov/mandi/sample-environment 이 그림을 다운로드하려면 여기를 클릭하십시오.
보충 도 15: 저온 중성자 회절 데이터 수집을 위한 플래시 동결. (A) 제분용 과르와 같은 극저온 호환 용기를 사용하여 마이크로루프로 수확하고 액체 질소로 동결하기 위한 설정. 장착된 크리스탈은 미리 냉각된 저저온 핀 집게를 사용하여 빔라인 저온 고니오계로 직접 전달됩니다. (B) 왁스 씰은 크리스탈 제거를 위해 용융된다. (C) 결정은 수확을 위해 석영 모세관의 끝으로 플러시된다. (D) 결정은 아스코르바테 흡수 버퍼에 순차적으로 담근 다음 냉동 보호제다음에 액체 질소에서 플래시 동결된다. 이 그림을 다운로드하려면 여기를 클릭하십시오.
보조 도 16: 샘플 정렬 인터페이스. 파란색 십자가로 표현되는 중성자 빔의 결정 정렬은 점 및 클릭 중심으로 수행됩니다. 이 그림을 다운로드하려면 여기를 클릭하십시오.
추가 그림 17: 데이터 수집을 위한 CSS GUI입니다. 노출 량 및 각도를 포함한 데이터 수집 전략은 CSS GUI에 업로드됩니다. 데이터 수집이 진행됨에 따라 실시간 검출기에서 검출된 확산 중성자가 상부 패널에 표시됩니다. 이 그림을 다운로드하려면 여기를 클릭하십시오.
보충 도 18: CCP4에서 R-프리 플래그 일치. 중성자 데이터의 R-프리 플래그는 관절 개선을 위해 동일하거나 동일한 결정으로 수집된 X선 데이터의 R-프리 플래그와 일치합니다. 이 그림을 다운로드하려면 여기를 클릭하십시오.
보충 도 19: 구조 준비 및 세련미. (A) Phenix ReadySet 도구는 교환 가능한 사이트에서 듀얼 H/D 점유율을 추가하는 데 사용됩니다. (B) 중성자 데이터와 X선 데이터는 모두 조인트 개선에 사용되며, 초기 입력 모델은 동일한 결정 또는 동일한 결정에서 수집된 X선 데이터 집합에 대해 정제되었다. 이 그림을 다운로드하려면 여기를 클릭하십시오.
보충 그림 20: 미세 조정 설정의 구성. 핵 거리뿐만 아니라 정제 모델은 조인트 X 선/중성자 데이터 개선을 위해 구성됩니다. 이 그림을 다운로드하려면 여기를 클릭하십시오.
보충 그림 21: Coot 모델 구축에 대한 데이터 선택. X선 및 채워지지 않은 중성자 데이터를 포함하는 페닉스 MTZ 파일 출력이 쿠트에서 열리면 대화형 모델 구축을 위한 전자 및 중성자 SLD 맵을 생성합니다. 이 그림을 다운로드하려면 여기를 클릭하십시오.
보조 그림 22: 공동 세련미 동안 쿠트의 인터랙티브 모델 건물. (A) 양극및 음의 FO-FC 중성자 SLD 밀도 피크(각각 녹색과 빨간색)는 물이 회전/변환에 의해 방향을 바봐야 한다는 것을 나타낸다. 2FO-FC 중성자 SLD 맵은 보라색으로 표시되고 2FO-FC 전자 밀도 맵이 파란색으로 표시됩니다. (B) 올바르게 배치된 물을 제공합니다. (C) 양성 FO-FC 중성자 SLD 맵 피크(녹색)는 치앵글을 편집하여 차이 밀도 피크에 맞게 티레오닌을 회전해야 함을 나타냅니다. (D) 올바르게 지향 하는 threonine. 이 그림을 다운로드하려면 여기를 클릭하십시오.
보조 도 23: 중성자 전용 데이터 개선을 위한 구조 준비. 시작 좌표 파일은 PDBTools의 물 원자 제거및 교환 가능한 사이트에서 듀얼 H/D 점유율을 추가하여 개선할 수 있습니다. 이 그림을 다운로드하려면 여기를 클릭하십시오.
보조 도 24: 중성자 데이터 전용 정제. (A) 중성자 데이터는 준비된 시작 모델뿐만 아니라 업로드됩니다. (B) 중성자 데이터 구체화에 대한 설정은 중성자 산란 테이블을 사용합니다.
보충 그림 25: Coot 모델 구축에 대한 데이터 선택. 채워지지 않은 중성자 데이터는 대화형 모델 구축을 위해 Coot에서 열립니다. 이 그림을 다운로드하려면 여기를 클릭하십시오.
보충 그림 26: 중음 잔류물을 위한 쿠트의 실제 공간 개선. (A) 양성 및 음수 FO-FC 중성자 SLD 밀도 피크(녹색 및 빨간색) 이는 아르기닌 잔류물이 FO-FC 밀도 피크에 맞게 이동되어야 한다는 것을 나타낸다. 2FO-FC 중성자 SLD 맵은 보라색으로 표시되고 2FO-FC 전자 밀도 맵이 파란색으로 표시됩니다. (B) 실제 공간 정제를 활용하면 Coot 형상 구속 라이브러리가 누락되어 "폭발" D 원자가 생성됩니다. (C) D 원자는 잔류물 원자의 나머지 부분과 함께 움직이지 않습니다. (D) 텍스트 편집기에서 D 원자 위치를 수동으로 수정할 수 있습니다. 이 그림을 다운로드하려면 여기를 클릭하십시오.
보충 도 27: 물 분자의 추가. (A) 물 분자는 양성 FO-FC 중성자 SLD 맵 밀도 피크(녹색)에 수동으로 첨가될 수 있다. 삽입된 물 분자는 처음에 Coot에 있는 O 원자에 의해 표현될 것입니다. (B) Phenix ReadySet은 물 분자에 대한 O 원자에 D 원자를 추가하는 데 사용됩니다. (C) 유족 수분 분자가 성공적으로 첨가된다. 이 그림을 다운로드하려면 여기를 클릭하십시오.
보충 그림 28: 개선 통계. 관절 X 선 / 중성자 정제 다음 최종 데이터 개선 통계. 이 그림을 다운로드하려면 여기를 클릭하십시오.
보충 그림 29: 개선 통계. 중성자 데이터 전용 구체화에 따른 최종 데이터 구체화 통계. 이 그림을 다운로드하려면 여기를 클릭하십시오.
토론
중성자 단백질 결정학은 단백질에서 프로토네이션 상태와 물 분자 방향을 조사하는 매우 민감한 기술입니다. 이 정보는 프로토네이션과 수소 결합 상호 작용의 변화가 종종 효소 화학10의 중심이기 때문에 단백질 촉매 메커니즘에 빛을 비추는 경우가 많습니다. 중성자 단백질 결정학은 유익한 기술이기는 하지만 중성자 회절 실험을 수행하기 전에 고려해야 할 여러 가지 요인이 있습니다.
- 데이터 수집을 위한 대형 단백질 결정의 요구 사항입니다.
- 수소 및 금속 이온과 같은 기타 원소의 산란 특성.
- 단정된 샘플로 작업할 때 구조 개선 및 모델 구축 소프트웨어의 제한사항입니다.
중성자 단백질 결정학은 플럭스 한정 기술이다. X선 회절 데이터 집합과 는 달리, R-팩터가 높고 완전도가 낮으며, 중복성 및 신호 대 잡음 비율은 고유한 제한(플럭스 제한, 준 라우, 긴 파장)으로 인해 중성자 데이터 집합에 대해 예상됩니다. 단일 프레임의 데이터 수집은 일반적으로 12 - 18 시간입니다. 실험의 성공은 샘플 크기와 품질에 크게 좌우되며, 크리스탈은 0.1 mm3의 경우가 종종 최소 요구 사항3입니다. 중성자 회절은 10에서 800 μL에 이르는 결정화 방울을 설정하기 위해 다량의 단백질생산을 요구합니다. 충분히 큰 결정을 성장하기위한 최소 부피는 결정 및 샘플 매개 변수 (https://neutrons.ornl.gov/imagine)를 감안할 때 볼륨 계산기를 사용하여 추정 될 수있다. 큰 결정의 성장은 가장 널리 증기 확산에 의해 달성되었다3. 매달려 있는 낙하 결정화는 10-25 μL에 이르는 큰 방울에서 결정의 성장을 허용하며, 최대 ~ 50 μL에 이르는 더 큰 방울은 시판 가능한 착하 장비14,54를 사용하여 설정할 수 있습니다. 실리콘 9웰 유리 플레이트는 최대 800μL의 부피를 사용하여 매우 큰 방울을 설정하는 데 사용할 수 있습니다. 이 유리 판은 햄프턴 연구에서 시판되는 "샌드위치 상자"에 배치됩니다. 추가 결정화 기술은 배용기에 의해 낙하 크기의 한계가 결정되는 배치 결정화를 포함한다. 배치 결정화 실험은 마이크로리터에서 밀리리터55까지 다양할 수 있습니다. 결정화는 또한 단백질이 투석막을 통해 침전제와 평형되는 투석 기술을 사용하거나 침전성 농도 그라데이션을 따라 또는 아가로오스56,57과 같은 다공성 플러그를 통해 역확산에 의해 수행될 수 있다. 시드는 원하는 부피의 결정을 얻기 위한 또 다른 대안을 제공합니다. 마이크로 및 매크로 시드는 NcLPMO9D45의 큰 크리스탈을 포함하여 큰 결정 성장을 위해 성공적으로 채택되었습니다. 용해도에 대한 온도의 영향을 포함하여 단백질 상 다이어그램에 대한 일부 지식은 큰 결정 성장에 도움이 됩니다.
중성자 회절 실험을 계획할 때, 회절 데이터 수집 시 신호 대 잡음 비율을 최대화하기 위한 단백질 제제의 최적화가 필수적이다7. H 원자에 의한 밀도 취소및 높은 일관성 있는 산란을 우회하기 위해, 중성자 SLD 지도는 양극성 산란 길이와 낮은 일관성 산란 길이를 가진 동위원소 D에 H 원자를 교환하여 개선될 수 있습니다. 이를 달성하기 위해, 중수소 결정화 완충제에 대한 수소단백질 결정의 증기교환이 수행된다. 이를 통해 용매 분자와 비열성, 틸트라테이블 단백질 H 원자23의 H/D 교환을 보장합니다. 증기 교환은 D2O 기반의 결정화 버퍼 "플러그"를 사용하여 석영 모세관에 수소화 결정을 장착하여 수행되며 가장 자주 적용되는 효과적이고 부드러운 기술을 나타냅니다14,23,35. 교환은 몇 주가 걸릴 수 있으며 바람직하게는 최대 H/D 교환을 보장하기 위해 중음 버퍼를 자주 변경해야합니다. H/D 교환은 또한 결정화 된 버퍼에 직접 침전시킴으로써 수행 될 수있다. D2O 노출로 인한 응력 하에 결정을 두지 않으려면 D2O:H2O 비율을 점진적으로 증가시킴으로써 침을 흡수 공정을 점진적으로 수행해야 합니다58. 이 외에도, 수소화 단백질의 결정화는 또한 음순 H 사이트에서 H/D 교환을 위한 유정완에서 수행될 수 있다22,59. 그러나 D2O 기반 완충은 알려진 H2O 기반 조건3,59의 추가 조정을 요구하는 단백질 용해도에 영향을 미친다는 점에 유의해야 한다. D2O 기반 버퍼는 또한 어떤 경우에는 더 작은 결정으로 이끌어 내는 관찰되었습니다59. 정족성 및 탄소바운드 H 원자를 D로 완전히 교환하면 유족 매체에서 단백질을 발현하여 정해각된 시료20을 생성함으로써 달성될 수 있다. 결과 중성자 SLD 맵은 감전된 시료의 크게 향상되고, 더 이상 수소화시 샘플의 밀도 취소를 표시하지 않는다. 이것은 단백질 또는 공동 인자에 있는 교환할 수 없는 사이트에 H/D 바인딩을 특성화할 때 유익합니다. 그러나, 변성 단백질의 발현은 비용이 높고 수율60이 낮다. 오크 리지 국립 연구소 (ORNL) 구조 분자 생물학 센터 (CSMB) perdeuterated 샘플을 생성 하고자 하는 사용자를 위한 중성 시설 (https://www.ornl.gov/facility/csmb). 전형화된 발현은 전형적으로 정제된 단백질61의 50 mg을 산출하는 1 L 스케일에 대한 생물 반응기에서 수행됩니다.
중성자 회절 데이터의 수집에 따라 개선 및 대화형 모델 구성이 수행됩니다. 페닉스.refine, nCNS 또는 SHELXL28,31,32,33을 포함한 여러 소프트웨어 제품군을 사용하여 개선이 실행될 수 있습니다. Phenix 제품군은 중성자 SLD maps34에서 모델을 수동으로 빌드하는 데 사용되는 Coot와 함께 중성자 회절 데이터를 구체화하는 데 가장 일반적으로 사용되는 소프트웨어입니다. Phenix와 Coot 모두 중성자 회절 데이터의 처리를 허용하지만 중성자 데이터 및 증식 샘플과 관련된 특이성을 처리하는 데 필요한 특정 기능이 부족할 수 있습니다. 예를 들어, Coot는 "실제 공간 정제"기능은 "폭발"잔류물 (보충 도 26)62결과 때문에 모델 빌드 중에 합병증으로 이어질 수있는 미결 잔류물에 대한 기하학적 최적화를 포함하지 않습니다. 이 문제는 모든 증단된 잔류물에 대한 구속 파일을 생성하여 해결할 수 있습니다. 그러나 이것은 집중적인 프로세스이며 이러한 라이브러리는 현재 공개적으로 사용할 수 없습니다. Phenix에서 세련미를 수행할 때 교환 가능한 H/D 사이트는 처음에는 H 및 D의 0.50 점유율로 설정됩니다. 정교함이 수행됨에 따라 H와 D의 점유율은 중성자 SLD 맵에 따라 개선됩니다. 대화형 모델 구축 중에 차이 밀도 Fo-Fc 맵은 H/D 점유율을 평가하는 데 매우 유익합니다. 지도는 높은 D 점유율을 가진 사이트를 결정하는 데 사용할 수 있습니다, 이는 프로토 네이션 상태가 촉매 적으로 관련되는 활성 사이트에서 특히 유익하다63. 그러나 H:D가 모호한 상황이 발생합니다. 점유율은 0.70:0.30에 가까우며 중성자 SLD 맵64에서 완전한 신호 가취소됩니다. 또한 준 라우에 중성자 데이터 세트는 종종 약 80 %의 완전성을 가지고 있다는 것을 고려해야하며, 이는 X 선 회절 데이터에 대해 일상적으로 관찰 된 ≥ 98 %보다 낮습니다. Phenix에서 중성자 회절 데이터를 정제할 때 누락된 관찰된 진폭(Fo)은 모델에서 계산되어 반사 목록을 완료하여 모델 바이어스를 도입합니다. 이러한 잠재적 편향 "no_fill" 맵을 고려하려면 대화형 모델 빌드 중에 "채워진" 맵이 아닌 검사해야 합니다.
사용자는 구조의 조인트 X 선/중성자 데이터 구체화 또는 중성자 데이터만 구체화하도록 선택할 수 있습니다. 특히 낮은 해상도의 중성자 SLD 맵을 시각화하는 것은 H/D 증기 교환에도 불구하고 교환할 수 없는 사이트에 H가 여전히 존재하는 수소 단백질에 대해 특히 당황스러울 수 있습니다. 이로 인해 중성자 밀도 맵이 취소되어 불연속 맵65,66의 인상을 줍니다. 해당 X선 데이터 집합을 수집하는 것은 공동 개선에서 이러한 취소를 유리하게 보완합니다(그림 13A 및 도 13B). 관절 정제 전략은 일반적으로 X 선 데이터에 대한 단백질 백본 좌표를 정제하는 것을 포함하며 중성자 회절 데이터는 교환 가능한 사이트에서 H/D 원자의 위치와 점유율을 구체화하는 데 사용됩니다28. 교환 가능한 사이트에 조인트 H/D 점유율을 도입하면 구체화되는 매개 변수의 수가 증가하므로 X선 데이터와의 관절 개선도 데이터 대 매개 변수 비율을 증가시킵니다. 조인트 정제는 동일한 결정 또는 동일한 조건하에서 자라는 결정에서 동일한 온도로 수집되는 해당 X선 데이터 집합을 필요로 합니다. 실온(300K)에서 수집된 중성자 회절 데이터의 경우, 해당 X선 데이터 세트는 방사선 손상을 제한하기 위해 저용량 데이터 수집 전략을 사용하여 실온에서 수집되어야 합니다. 반면, Perdeuterated 샘플은 H/D 신호 취소의 동일한 크기를 가지고 있지 않기 때문에 개선되고 연속적인 중성자 SLD 맵을 제공합니다. 그러나, 금속과 황을 포함한 특정 원소의 중성자 산란 길이는 단백질이 멸폐된 경우에도 중성자 SLD 맵에서 제대로 보이지 않게 만든다(도 13C-F)18. 금속을 특성화해야 하는 경우, 관절 미세 조정에서 X선 회절을 활용하거나 회절 실험을 보완하기 위해 분광 기술을 적용하는 것이 가장 좋습니다. 중성자 전용 데이터 정제는 중성자 데이터 세트가 고해상도를 가지고 있거나 perdeuterated 단백질을 사용할 때 종종 수행됩니다. 또한, 중성자 전용 데이터 정제는 방사선 손상에 매우 민감한 단백질이 연구되고 있는 경우 특히 유용하며, X선 유래 구조는 방사선 유발 유물을 보유할 수 있기 때문입니다. 중성자 데이터 전용 구체화를 수행하려면 해당 중성자 데이터 집합에 충분한 완전성과 해상도가 있는지 확인해야 합니다.
ORNL은 중성자 회절 데이터 수집을 위한 두 가지 시설을 제공합니다: HFIR의 IMAGINE 빔라인과 SNS36,67의 MaNDi 빔라인. 두 계측기 모두 유사한 원리를 사용하는 중성자 회절 데이터 집합을 수집하는 효과적인 수단을 제공하지만, 각 계측기는 빔 시간을 신청할 때 고려해야 할 고유한 사양을 가지고 있습니다. IMAGINE은 준 Laue 데이터를 수집하고 최대 ~ 100 Å의 단위 셀로 결정의 실온 데이터 수집에 최적화되어 있습니다. MaNDi는 최대 ~ 300 Å의 단위 셀이있는 결정에 TOF-Laue 컬렉션을 사용하는 실온 및 극저온 데이터의 수집에 사용할 수 있습니다. 완전한 데이터 집합을 수집하기 전에, 결정이 단일 프레임에 대한 중성자 빔에 노출되는 얻어진 회절 패턴의 품질을 평가하기 위해 크리스탈에서 시험이 수행됩니다. 결정이 충분한 품질인 경우, X선 데이터 처리와 유사한 공정에서 전체 중성자 회절 데이터 집합을 수집, 인덱싱, 통합, 스케일링 및 병합합니다. IMAGINE은 라우에겐과 Lscale 및 MaNDi를 사용하여 맨티드 패키지를 사용하고 3차원 프로파일 피팅48,50,51,68,69,70을 사용합니다. 이러한 시설 중 하나에서 사용자가 되는 과학자는 추가 분석을 위해 MTZ 또는 HKL 형식으로 데이터 집합을 제공합니다.
중성자 회절은 생물학적 거대 분자의 대영 상태 및 수소 결합 상호 작용을 조사하기위한 비 파괴적이고 매우 민감한 기술입니다. 그것은 특히 사진에 민감한 단백질과 금속 단백질에 대 한 유용. 실험을 수행하기 전에 기술및 데이터 처리에 관한 몇 가지 고려 사항을 고려해야하지만, 결과는 관심있는 단백질의 촉매 메커니즘에 대한 귀중한 통찰력을 줄 수있는 결과를 산출합니다. 중성자 단백질 결정예학은 전산, 구조, 생화학 및 분광 연구를 보완하여 생물학적 거대 분자를 특성화하는 데 사용되는 생물학자의 도구 상자에서 귀중한 도구입니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
단백질 발현, 정제 및 결정화 실험은 오크 리지 국립 연구소의 미국 에너지 생물 및 환경 연구 사용자 시설인 구조 분자 생물학 센터(CSMB)에서 수행되었습니다. 중성자 회절 데이터는 미국 에너지부 기초에너지과학부 과학사용자시설부(ORNL)의 스Pallation 중성자 출처(SNS)에서 BL-11B MaNDi에서 수집되었습니다. 저자는 데이터 감소에 대한 도움을 브렌던 설리반 감사합니다. X선 회절 데이터는 노스캐롤라이나 주에서 지원하는 노스캐롤라이나 주립 대학의 분자 교육, 기술 및 연구 혁신 센터(METRIC) 시설에서 수집되었습니다. GCS는 ORNL에서 국립 연구 재단 (NRF), 남아프리카 공화국 및 대학원 기회 (GO!) 프로그램에서 부분적으로 지원을 인정합니다. FM은 USDA NIFA 해치 211001 지원을 인정합니다.
자료
| Name | Company | Catalog Number | Comments |
| Absorbent Paper Points Size #30-#40, 60 mm length | DiaDent/DiaVet | 218-292 | |
| Capillary wax | Hampton | HR4-328 | |
| CCP4 | Version 7.0.077 | ||
| Conical Centrifuge Tubes (15 mL) | Corning | CLS430790 | |
| Conical Centrifuge Tubes (50mL) | Corning | CLS430828 | |
| Coot | Version 0.8.9.2 | ||
| CrystalCap ALS | Hampton | HR4-779 | |
| Curved-Tip Forceps | Mitegen | TW-CTF-1 | |
| Deuterium chloride solution, 35 wt. % in D2O, ≥99 atom % D | Sigma-Aldrich | 543047 | |
| Deuterium oxide 99.9 atom % D | Sigma-Aldrich | 151882 | |
| Dual Thickness MicroLoops 1000 µm | Mitegen | M5-L18SP-1000 | |
| FiveEasy pH meter F20-Std-Kit | Mettler Toledo | 30266626 | |
| Foam Dewars Standard Vessel 800 ml | Spearlab | M-FD-800 | |
| Four Color Mounting Clay | Hampton | HR4-326 | |
| HEPES, BioUltra, for molecular biology, ≥99.5% (T), | Sigma-Aldrich | 54457 | |
| High flux rotating anode X-ray diffractomemeter with EIGER 4M detector | Rigaku, Oxford Cryostream and Dectris | XtaLAB Synergy-R | Home source X-ray diffractometer |
| Magnetic Wand Straight | Mitegen | M-R-1013198 | |
| Microloader, tip for filling Femtotips and other glass microcapillaries (for research use only), 0.5 – 20 µL, 100 mm, light gray, 192 pcs. (2 racks × 96 pcs.) | Eppendorf | 930001007 | |
| Microtubes volume 1.5 mL | Eppendorf | Z606340 | |
| Petri Dishes with Clear Lid 100 mm diameter | Fischerbrand | FB0875713 | |
| Phenix | Version 1.14-3260 | ||
| Pin Tong 18 mm | Mitegen | M-R-1013196 | |
| Pipette Volume 0.1-2.5 μL | Eppendorf Research | Z683779 | |
| Pipette Volume 100-1000 μL | Eppendorf Research | Z683825 | |
| Pipette Volume 10-100 μL | Eppendorf Research | Z683809 | |
| Pipette Volume 20-200 μL | Eppendorf Research | Z683817 | |
| Poly(ethylene glycol) BioXtra, average mol wt 3,350, powder | Sigma-Aldrich | P4338 | |
| Quartz Capillary , 1.00 mm inner diameter, 80 mm length | Hampton | HR6-146 | Thin-walled capillary |
| Research Stereomicroscope System | Olympus | SZX16 | |
| Reusable B3 (SSRL/SAM Style) Goniometer Bases | Mitegen | GB-B3-R | |
| Round - Miniature Hollow Glass Tubing (VitroTubes) Clear Fused Quartz / 1.00 mm inner diameter, 100 mm length | VitroCom | CV1012 | Thick-walled capillary |
| Sandwich Box with cover | Hampton | HR3-132 | |
| Siliconized 9 Well Glass Plate | Hampton | HR3-134 | |
| Sitting Drop Crystallization Plate (24 Big Well) | Mitegen | XQ-P-24S-A | |
| Sodium deuteroxide solution, 40 wt. % in D2O, 99 atom % D | Sigma-Aldrich | 176788 | |
| Thick Siliconized circle cover slides (22 mm x 0.96 mm) | Hampton | HR3-247 | |
| Universal Pipet Tips, 0.1 - 10 µL | VWR | 76322-528 | |
| Universal Pipet Tips, 1 - 100 µL | VWR | 76322-136 | |
| Universal Pipet Tips, 100 - 1000 µL | VWR | 76322-154 | |
| Universal Pipet Tips, 20 - 200 µL | VWR | 76322-150 | |
| Universal Pipet Tips, 1 - 20 µL | VWR | 76322-134 | |
| Wax pen | Hampton | HR4-342 |
참고문헌
- Neumann, P., Tittmann, K. Marvels of enzyme catalysis at true atomic resolution: distortions, bond elongations, hidden flips, protonation states and atom identities. Current Opinion in Structural Biology. 29, 122-133 (2014).
- Pynn, R. Neutron Scattering-A Non-destructive Microscope for Seeing Inside Matter. Neutron Applications in Earth, Energy and Environmental Sciences. , 15-36 (2009).
- O'Dell, W. B., Bodenheimer, A. M., Meilleur, F. Neutron protein crystallography: A complementary tool for locating hydrogens in proteins. Archives of Biochemistry and Biophysics. 602, 48-60 (2016).
- Niimura, N., Podjarny, A. . Neutron Protein Crystallography: Hydrogen, Protons, and Hydration in Bio-macromolecules. , (2011).
- Blakeley, M. P. P. Neutron macromolecular crystallography. Crystallography Reviews. 15 (3), 157-218 (2009).
- Blakeley, M. P., Cianci, M., Helliwell, J. R., Rizkallah, P. J. Synchrotron and neutron techniques in biological crystallography. Chemical Society Reviews. 33 (8), 548-557 (2004).
- Ashkar, R., et al. Neutron scattering in the biological sciences: progress and prospects. Acta Crystallographica Section D: Structural Biology. 74 (12), (2018).
- Teixeira, S. C. M., et al. New sources and instrumentation for neutrons in biology. Chemical Physics. 345 (2-3), 133-151 (2008).
- Furrer, A., Mesot, J., Strässle, T. . Neutron Scattering in Condensed Matter Physics. , (2009).
- Meilleur, F., Coates, L., Cuneo, M. J., Kovalevsky, A., Myles, D. A. A. The neutron macromolecular crystallography instruments at Oak Ridge national laboratory: Advances, challenges, and opportunities. Crystals. 8 (10), 1-10 (2018).
- Coates, L., et al. The Macromolecular Neutron Diffractometer MaNDi at the Spallation Neutron Source. Journal of Applied Crystallography. 48, 1302-1306 (2015).
- Coates, L., Stoica, A. D., Hoffmann, C., Richards, J., Cooper, R. The macromolecular neutron diffractometer (MaNDi) at the Spallation Neutron Source, Oak Ridge: enhanced optics design, high-resolution neutron detectors and simulated diffraction. Journal of Applied Crystallography. 43 (3), 570-577 (2010).
- Koetzle, T. F., Piccoli, P. M. B., Schultz, A. J. Single-crystal neutron diffraction studies of hydrogen-bonded systems: Two recent examples from IPNS. Nuclear Instruments and Methods in Physics Research, Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 600 (1), 260-262 (2009).
- Ng, J. D., et al. Large-volume protein crystal growth for neutron macromolecular crystallography. Acta Crystallographica Section F:Structural Biology Communications. 71, 358-370 (2015).
- Blakeley, M. P., Langan, P., Niimura, N., Podjarny, A. Neutron crystallography: opportunities, challenges, and limitations. Current Opinion in Structural Biology. 18 (5), 593-600 (2008).
- Sears, V. F. Neutron scattering lengths and cross sections. Neutron News. 3 (3), 26-37 (1992).
- Weik, M., Patzelt, H., Zaccai, G., Oesterhelt, D. Localization of glycolipids in membranes by in vivo labeling and neutron diffraction. Molecular Cell. 1 (3), 411-419 (1998).
- Helliwell, J. R. Fundamentals of neutron crystallography in structural biology. Methods in Enzymology. 634, (2020).
- Niimura, N., Bau, R. Neutron protein crystallography: Beyond the folding structure of biological macromolecules. Acta Crystallographica Section A: Foundations of Crystallography. 64 (1), 12-22 (2008).
- Hazemann, I., et al. High-resolution neutron protein crystallography with radically small crystal volumes: Application of perdeuteration to human aldose reductase. Acta Crystallographica Section D: Biological Crystallography. 61 (10), 1413-1417 (2005).
- Niimura, N., Chatake, T., Ostermann, A., Kurihara, K., Tanaka, I. High resolution neutron protein crystallography. Hydrogen and hydration in proteins. Zeitschrift für Kristallographie - Crystalline Materials. 218 (2), (2003).
- Meilleur, F., Contzen, J., Myles, D. A. A., Jung, C. Structural stability and dynamics of hydrogenated and perdeuterated cytochrome P450cam (CYP101). Biochemistry. 43 (27), 8744-8753 (2004).
- Bennett, B. C., Gardberg, A. S., Blair, M. D., Dealwis, C. G. On the determinants of amide backbone exchange in proteins: A neutron crystallographic comparative study. Acta Crystallographica Section D: Biological Crystallography. 64 (7), 764-783 (2008).
- Meilleur, F., Kovalevsky, A., Myles, D. A. A. IMAGINE: The neutron protein crystallography beamline at the high flux isotope reactor. Methods in Enzymology. 634, (2020).
- Wang, X. P., et al. A suite-level review of the neutron single-crystal diffraction instruments at Oak Ridge National Laboratory. Review of Scientific Instruments. 89 (9), 092802 (2018).
- Wlodawer, A., Hendrickson, W. A. A procedure for joint refinement of macromolecular structures with X-ray and neutron diffraction data from single crystals. Acta Crystallographica Section A. 38 (2), 239-247 (1982).
- Halle, B. Biomolecular cryocrystallography: Structural changes during flash-cooling. Proceedings of the National Academy of Sciences of the United States of America. 101 (14), 4793-4798 (2004).
- Adams, P. D., Mustyakimov, M., Afonine, P. V., Langan, P. Generalized X-ray and neutron crystallographic analysis: More accurate and complete structures for biological macromolecules. Acta Crystallographica Section D: Biological Crystallography. 65 (6), 567-573 (2009).
- Berman, H. M., et al. The Protein Data Bank. Acta Crystallographica Section D Biological Crystallography. 58 (6), 899-907 (2002).
- Liebschner, D., Afonine, P. V., Moriarty, N. W., Langan, P., Adams, P. D. Evaluation of models determined by neutron diffraction and proposed improvements to their validation and deposition. Acta Crystallographica Section D: Structural Biology. 74, 800-813 (2018).
- Afonine, P. V., Mustyakimov, M., Grosse-Kunstleve, R. W., Moriarty, N. W., Langan, P., Adams, P. D. Joint X-ray and neutron refinement with phenix.refine. Acta Crystallographica Section D: Biological Crystallography. 66 (11), 1153-1163 (2010).
- Brünger, A. T., et al. Crystallography & NMR system: A new software suite for macromolecular structure determination. Acta Crystallographica Section D: Biological Crystallography. 54 (5), 905-921 (1998).
- Gruene, T., Hahn, H. W., Luebben, A. V., Meilleur, F., Sheldrick, G. M. Refinement of macromolecular structures against neutron data with SHELXL2013. Journal of Applied Crystallography. 47 (1), 462-466 (2014).
- Emsley, P., Lohkamp, B., Scott, W. G., Cowtan, K. Features and development of Coot. Acta Crystallographica Section D Biological Crystallography. 66 (4), 486-501 (2010).
- Lakey, J. H. Neutrons for biologists: A beginner's guide, or why you should consider using neutrons. Journal of the Royal Society Interface. 6, (2009).
- Schröder, G. C., O'Dell, W. B., Myles, D. A. A., Kovalevsky, A., Meilleur, F. IMAGINE: Neutrons reveal enzyme chemistry. Acta Crystallographica Section D: Structural Biology. 74, 778-786 (2018).
- Halsted, T. P., et al. Catalytically important damage-free structures of a copper nitrite reductase obtained by femtosecond X-ray laser and room-temperature neutron crystallography. IUCrJ. 6, 761-772 (2019).
- Meier, K. K., et al. Oxygen Activation by Cu LPMOs in Recalcitrant Carbohydrate Polysaccharide Conversion to Monomer Sugars. Chemical Reviews. 118 (5), 2593-2635 (2018).
- Beeson, W. T., Vu, V. V., Span, E. A., Phillips, C. M., Marletta, M. A. Cellulose Degradation by Polysaccharide Monooxygenases. Annual Review of Biochemistry. 84 (1), 923-946 (2015).
- Walton, P. H., Davies, G. J. On the catalytic mechanisms of lytic polysaccharide monooxygenases. Current Opinion in Chemical Biology. 31, 195-207 (2016).
- Bertini, L., et al. Catalytic Mechanism of Fungal Lytic Polysaccharide Monooxygenases Investigated by First-Principles Calculations. Inorganic Chemistry. 57 (1), 86-97 (2018).
- Hedegård, E. D., Ryde, U. Molecular mechanism of lytic polysaccharide monooxygenases. Chemical Science. 9 (15), 3866-3880 (2018).
- Hangasky, J. A., Detomasi, T. C., Marletta, M. A. Glycosidic Bond Hydroxylation by Polysaccharide Monooxygenases. Trends in Chemistry. 1 (2), 198-209 (2019).
- Bacik, J. P., et al. Neutron and Atomic Resolution X-ray Structures of a Lytic Polysaccharide Monooxygenase Reveal Copper-Mediated Dioxygen Binding and Evidence for N-Terminal Deprotonation. Biochemistry. 56 (20), 2529-2532 (2017).
- O'Dell, W. B., Agarwal, P. K., Meilleur, F. Oxygen Activation at the Active Site of a Fungal Lytic Polysaccharide Monooxygenase. Angewandte Chemie - International Edition. 56 (3), 767-770 (2017).
- O'Dell, W. B., Swartz, P. D., Weiss, K. L., Meilleur, F. Crystallization of a fungal lytic polysaccharide monooxygenase expressed from glycoengineered Pichia pastoris for X-ray and neutron diffraction. Acta Crystallographica Section:F Structural Biology Communications. 73 (2), 70-78 (2017).
- Meilleur, F., et al. The IMAGINE instrument: First neutron protein structure and new capabilities for neutron macromolecular crystallography. Acta Crystallographica Section D: Biological Crystallography. 69 (10), 2157-2160 (2013).
- Helliwell, J. R., et al. The recording and analysis of synchrotron X-radiation Laue diffraction photographs. Journal of Applied Crystallography. 22 (5), 483-497 (1989).
- Nieh, Y. P., et al. Accurate and highly complete synchrotron protein crystal Laue diffraction data using the ESRF CCD and the Daresbury Laue software. Journal of Synchrotron Radiation. 6 (5), 995-1006 (1999).
- Arzt, S., Campbell, J. W., Harding, M. M., Hao, Q., Helliwell, J. R. LSCALE - The new normalization, scaling and absorption correction program in the Daresbury Laue software suite. Journal of Applied Crystallography. 32 (3), 554-562 (1999).
- Sullivan, B., et al. Improving the accuracy and resolution of neutron crystallographic data by three-dimensional profile fitting of Bragg peaks in reciprocal space. Acta Crystallographica Section D: Structural Biology. 74 (11), 1085-1095 (2018).
- Sullivan, B., et al. BraggNet: integrating Bragg peaks using neural networks. Journal of Applied Crystallography. 52 (4), 854-863 (2019).
- Schröder, G. C., O'Dell, W. B., Myles, D. A. A., Kovalevsky, A., Meilleur, F. IMAGINE: Neutrons reveal enzyme chemistry. Acta Crystallographica Section D: Structural Biology. 74, (2018).
- Blum, M. M., et al. Preliminary time-of-flight neutron diffraction study on diisopropyl fluorophosphatase (DFPase) from Loligo vulgaris. Acta Crystallographica Section F: Structural Biology and Crystallization Communications. 63 (1), 42-45 (2007).
- Tomanicek, S. J., et al. Neutron and X-ray crystal structures of a perdeuterated enzyme inhibitor complex reveal the catalytic proton network of the Toho-1 β-lactamase for the acylation reaction. Journal of Biological Chemistry. 288 (7), 4715-4722 (2013).
- Metcalfe, C., et al. The tuberculosis prodrug isoniazid bound to activating peroxidases. Journal of Biological Chemistry. 283 (10), 6193-6200 (2008).
- Hughes, R. C., et al. Inorganic pyrophosphatase crystals from Thermococcus thioreducens for X-ray and neutron diffraction. Acta Crystallographica Section F: Structural Biology and Crystallization Communications. 68 (12), 1482-1487 (2012).
- Bennett, B. C., Meilleur, F., Myles, D. A. A., Howell, E. E., Dealwis, C. G. Preliminary neutron diffraction studies of Escherichia coli dihydrofolate reductase bound to the anticancer drug methotrexate. Acta Crystallographica Section D: Biological Crystallography. 61 (5), 574-579 (2005).
- Snell, E. H., et al. Optimizing crystal volume for neutron diffraction: D-xylose isomerase. European Biophysics Journal. 35 (7), 621-632 (2006).
- Golden, E., Attwood, P. V., Duff, A. P., Meilleur, F., Vrielink, A. Production and characterization of recombinant perdeuterated cholesterol oxidase. Analytical Biochemistry. 485, 102-108 (2015).
- Munshi, P., et al. Rapid visualization of hydrogen positions in protein neutron crystallographic structures. Acta Crystallographica Section D: Biological Crystallography. 68 (1), 35-41 (2012).
- Logan, D. T. Interactive model building in neutron macromolecular crystallography. Methods in Enzymology. 634, (2020).
- Koruza, K., Lafumat, B., Végvári, W., Knecht, S. Z., Fisher, Deuteration of human carbonic anhydrase for neutron crystallography: Cell culture media, protein thermostability, and crystallization behavior. Archives of Biochemistry and Biophysics. 645, 26-33 (2018).
- Fisher, S. J., et al. Perdeuteration: Improved visualization of solvent structure in neutron macromolecular crystallography. Acta Crystallographica Section D: Biological Crystallography. 70 (12), 3266-3272 (2014).
- Chen, J. C. H., Hanson, B. L., Fisher, S. Z., Langan, P., Kovalevsky, a. Y. Direct observation of hydrogen atom dynamics and interactions by ultrahigh resolution neutron protein crystallography. Proceedings of the National Academy of Sciences. 109 (38), 15301-15306 (2012).
- Cuypers, M. G., et al. Near-atomic resolution neutron crystallography on perdeuterated Pyrococcus furiosus rubredoxin: Implication of hydronium ions and protonation state equilibria in redox changes. Angewandte Chemie - International Edition. 52 (3), 1022-1025 (2013).
- Coates, L., Sullivan, B. The macromolecular neutron diffractometer at the spallation neutron source. Methods in Enzymology. 634, (2020).
- Ren, Z., Kingman, N. G., Borgstahl, G. E. O., Getzoff, E. D., Moffat, K. Quantitative Analysis of Time-Resolved Laue Diffraction Patterns. Journal of Applied Crystallography. 29 (3), 246-260 (1996).
- Campbell, J. W., Hao, Q., Harding, M. M., Nguti, N. D., Wilkinson, C. LAUEGEN version 6.0 and INTLDM. Journal of Applied Crystallography. 31 (3), 496-502 (1998).
- Arnold, O., et al. Mantid - Data analysis and visualization package for neutron scattering and μ SR experiments. Nuclear Instruments and Methods in Physics Research, Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 764, 156-166 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유