Method Article
إجراء قياسات دقيقة ودقيقة أحادية الجزيء FRET باستخدام smfBox مفتوح المصدر
In This Article
Summary
توفر هذه المقالة إرشادات خطوة بخطوة لإجراء قياسات FRET دقيقة تم تصحيحها بالكامل على الجزيئات الحيوية الفردية المنتشرة بحرية باستخدام smfBox مفتوح المصدر وغير مكلف ، من التبديل ، من خلال المحاذاة والتركيز ، إلى جمع البيانات وتحليلها.
Abstract
وsmfBox هو أداة فعالة من حيث التكلفة ومفتوحة المصدر تم تطويرها مؤخرا لنقل الطاقة بالرنين Förster أحادي الجزيء (smFRET) ، مما يجعل القياسات على الجزيئات الحيوية المنتشرة بحرية أكثر سهولة. تتضمن هذه النظرة العامة بروتوكولا خطوة بخطوة لاستخدام هذا الجهاز لإجراء قياسات لكفاءات FRET الدقيقة في عينات الحمض النووي المزدوجة ، بما في ذلك تفاصيل إعداد العينة وإعداد الأجهزة ومحاذاتها ، واكتساب البيانات ، وروتين التحليل الكامل. ويستند النهج المقدم، الذي يتضمن كيفية تحديد جميع عوامل التصحيح اللازمة لقياسات دقيقة للمسافة المستمدة من FRET، إلى مجموعة كبيرة من الأعمال التعاونية التي أجريت مؤخرا عبر مجتمع فريت، والتي تهدف إلى وضع بروتوكولات موحدة ونهج تحليل. هذا البروتوكول، الذي يمكن تكييفه بسهولة مع مجموعة من النظم الجزيئية الحيوية، يضيف إلى الجهود المتزايدة في إضفاء الطابع الديمقراطي على smFRET للمجتمع العلمي الأوسع.
Introduction
جزيء واحد Förster نقل الطاقة الرنين (smFRET) هو الأسلوب الذي يقيس كفاءة FRET بين اثنين من الأصباغ المانحة والمقبل على مستوى الجزيئات الفردية. FRET هي عملية فيزيائية ضوئية ناشئة عن أطياف الطاقة المتداخلة لصبغتين: المتبرع متحمس بسبب ضوء طول موجي محدد وينقل الطاقة غير الإشعاعية إلى المقبول ، مما يؤدي إلى انبعاث من المقبول. كفاءة هذا النقل يتناسب عكسيا مع القوة السادسة للمسافة بين الأصباغ اثنين، وبالتالي فإن كفاءة نقل يختلف مع distance1. وهكذا، يمكن استخدام هذه الكفاءة FRET لتحديد المعلومات المكانية حول جزيء (ق)2 التي تعلق الأصباغ، في نطاق 3-10 نانومتر. هذا المقياس ، وحقيقة أن التغيرات في كفاءة FRET حساسة للحركات الجزيئية Angstrom3 ، يجعل هذه التقنية مناسبة تماما للتحقيق في المعلومات الهيكلية حول الجزيئات الحيوية - مثل الأحماض النووية والبروتينات دون مضاعفات الفرقة في المتوسط 4،5،6. في حين يمكن استخدام التغيرات في كفاءات FRET النسبية لمراقبة التفاعلات الجزيئية الحيوية والديناميكيات التركيبية ، وتسليط الضوء على العمليات الخلوية الرئيسية مثل طي البروتين (un) والنسخ وتكرار الحمض النووي وإصلاحه ، فقد تم استخدام كفاءات FRET المطلقة لتحديد المسافات الدقيقة لتحديد الهيكل الجزيئي الحيوي7،8،9،10،11 ، والتغلب على الحاجة إلى التبلور أو التجميد كما هو مطلوب لبعض الطرق الهيكلية الأخرى4،12.
تجارب smFRET الأكثر شيوعا تأخذ شكلين، كونفوج أو الكلي انعكاس الداخلية مضان (TIRF) المجهر. بين كلا النهجين يمكن عادة التحقيق في الديناميات الجزيئية للجزيئات الحيوية على الجداول الزمنية من بيكو إلى مللي ثانية (جزيئات كونفوكوكال، نشر بحرية) تصل إلى مللي ثانية إلى ساعات (TIRF، جزيئات سطح مشلولة). ويرجع ذلك إلى الاجهزة المختلفة المشاركة في كل تقنية. في المجهر TIRF، يتم شل حركة الجزيئات على سطح الشريحة ومتحمس من قبل موجة مبشرة (الشكل 1A). هنا ، ومع ذلك ، فإن التركيز على المجهر confocal لأن هذا هو شكل smfBox. في المجهر confocal ، لا يتم شل حركة الجزيئات وبدلا من ذلك تنتشر بحرية عبر الحركة البراونية من خلال حجم confocal (~ 1 fL) ، التي شكلتها تركيز شعاع ليزر من خلال عدسة فتحة رقمية عالية في بقعة في بعض العمق المعين داخل الحل (الشكل 1B). ويتركز الانبعاث الناتج مرة أخرى من خلال نفس الفتحة وتصفيتها من خلال مرآة ديكهروبيك (الشكل 1C لتخطيطي كامل). ثم يتم التركيز عليه من خلال ثقب من أجل إزالة أي ضوء خارج التركيز وعلى الصمام الثنائي الجليدي (APD). عندما يكشف APD فوتون، فإنه يخرج نبض TTL، وتوقيت الذي يمكن تسجيله مع ما يصل إلى دقة picosecond. وقت المراقبة لهذه الجزيئات نشر بحرية داخل محيط حجم الكونفوجال هو عادة في حدود ميلي ثانية.
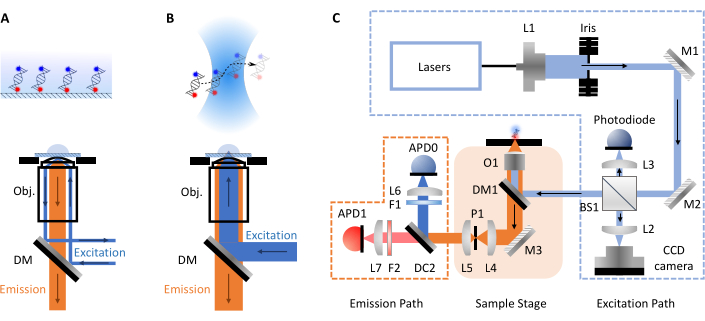
الشكل 1: التخطيطات التي تظهر مبادئ المجهر والإعداد smfBox. (أ) مجموع انعكاس داخلي مضان (TIRF) مبدأ المجهر: يتم توجيه ضوء الإثارة إلى حافة الهدف (Obj.) ويخضع للتفكير الداخلي الكلي في واجهة عازلة coverslip توليد حقل التبشير المتحللة أضعافا مضاعفة لإثارة الجزيئات المرفقة السطح. (ب) المجهر الكونفوجكال: الجزيئات المنتشرة بحرية متحمسة لبقعة شبه محدودة الحيود تركز على العينة. (ج) إعداد smfBox المستخدمة في هذا البروتوكول، والتي تبين جميع المكونات الرئيسية: الثنائيات الضوئية الانهيار الجليدي (APD)، مقسم شعاع (BS)، والمرايا ديكهروبيك (DM)، والمرشحات (F)، والمرايا (M)، والهدف (O) والثقب (P). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
في الآونة الأخيرة ، أدرجت تقنيات smFRET اثنين من الإثارة اللونية ، حيث يتم تناوب أشعة الليزر المطابقة للأطوال الموجية للمتبرعين والمتقبلين. ويمكن القيام بذلك بإحدى طريقتين، الأولى عن طريق تحوير أشعة الليزر المستمرة على مقياس KHz الزمني، والذي يعرف باسم الإثارة الليزرية بالتناوب (ALEX)13,14. الأسلوب الثاني interleaves نبضات سريعة على مقياس الوقت MHz; هذا هو نانو ثانية-ALEX15 أو الإثارة النبضية بين الشقوق (PIE)16. في كل هذه النهج ، تؤدي المعلومات من ليزر المقبول إلى حساب ما يسمى قياس الستويتشوميتري ، الذي يمكن أن يميز بين الجزيئات ذات الكفاءة المنخفضة FRET وتلك التي تفتقر إلى مقبول (إما من خلال وضع العلامات غير الكاملة أو photobleaching). باستخدام PIE / ns- ALEX بالإضافة إلى ذلك يعطي الوصول إلى عمر الفلورسنت على مستوى جزيء واحد، ويمكن قياس anisotropies عندما يقترن البصريات الاستقطاب. ويعرف هذا المزيج من القياسات باسم الكشف عن الفلورسينسين متعدد البارامترات (MFD)9.
على الرغم من العديد من مزايا smFRET ، فإنه لا يستخدم على نطاق واسع خارج مختبرات متخصصة بسبب ارتفاع تكاليف الأدوات التجارية وعدم وجود بدائل بسيطة وذاتية البناء. وهناك اتجاه متزايد نحو تطوير المجهر منخفضة التكلفة مفتوحة المصدر يحدث وظهرت مؤخرا منصات أخرى، بما في ذلك العوالق17، OpenFlexure Microscope18، Flexiscope19، miCube20، liteTIRF21، وSwedy22. هنا تصف الدراسة بروتوكول استخدام smfBox ، وهو إعداد كونفوكوكال فعال من حيث التكلفة تم تطويره مؤخرا وقادر على قياس كفاءة FRET بين صبغتين على جزيئات واحدة تنتشر بحرية. تعليمات بناء مفصلة وجميع البرامج التشغيلية اللازمة متاحة مجانا في: https://craggslab.github.io/smfBox/ 23. يتم تجميع الترتيب البصري للsmfBox من المكونات المتاحة بسهولة التي تم شراؤها من الشركات المصنعة بأسعار معقولة ويمكن الوصول إليها على نطاق واسع، في حين تم استبدال هيئة المجهر (المسؤولة عن معظم النفقات في إعداد confocal القياسية) من قبل مربع مخصص من الألومنيوم أنودود ضيق الضوء (السماح بإجراء القياسات في ظل ظروف الإضاءة المحيطة). يضم هذا الصندوق المكونات البصرية الرئيسية، بما في ذلك الإثارة، والهدف، والثقب، وتشابك الليزر الميكانيكي، مما يتيح تشغيله الآمن كمنتج ليزر من الفئة الأولى (انظر الشكل 1C للحصول على تخطيطي كامل). يستخدم smfBox ALEX للتحقق من صحة قياس ستويتشوميتري الصبغي وتحديد عوامل تصحيح FRET الدقيقة. يتم تشغيله باستخدام برنامج مفتوح المصدر مكتوب خصيصا (smOTTER) ، والذي يتحكم في جميع جوانب الحصول على البيانات ويخرج البيانات بتنسيق فوتون HDF5 مفتوح المصدر24 ، متوافق مع العديد من أدوات تحليل الجهات الخارجية. تم اختبار بروتوكولات smfBox والحصول وتحليل البيانات مؤخرا مقابل >20 أداة أخرى (سواء confocal و TIRF) في دراسة عمياء متعددة المختبرات25. وكانت الكفاءات FRET التي تم الحصول عليها في اتفاق ممتاز مع جميع الصكوك الأخرى، على الرغم من smfBox تكلف سوى جزء صغير من سعر الاجهزة المتاحة تجاريا.
هنا ، يتم تحديد بروتوكول خطوة بخطوة للحصول على وتحليل كفاءات FRET دقيقة ومطلقة على دوبلس الحمض النووي النشر بحرية باستخدام smfBox ، على طول الطريق من التبديل ، من خلال المحاذاة والتركيز ، إلى جمع البيانات وتحليلها. والعينات المستخدمة هنا هي ثلاث العينات المزدوجة (التي تظهر كفاءات عالية ومتوسطة ومنخفضة، انظر الجدول 1) التي تم تقييمها في الدراسة المكفوفين على نطاق العالم25؛ ومع ذلك ، فإن الطريقة قابلة للتكيف مع العديد من الأنظمة الجزيئية ، بما في ذلك البروتينات والأحماض النووية الأخرى. والأمل مع ذلك هو أن مثل هذا البروتوكول التفصيلي ، جنبا إلى جنب مع تعليمات البناء الموجودة بالفعل لsmfBox23 ، سيساعد على جعل هذه التقنية القوية أكثر سهولة لمجموعة واسعة من المختبرات.
Protocol
1. مكونات الطاقة على
- الطاقة على المقابس الستة (لا يوجد ترتيب معين): Piezoconcept (z-focus)، APD0، APD1، ليزر أخضر، ليزر أحمر وفوتوديكتكتور.
2. برنامج 1-الإعداد التجريبي
- أطلق مركز التحكم بالليزر.
- ضمان الموجة المستمرة - يتم تحديد وضع التيار الثابت (CW-ACC).
- الطاقة على كل من الليزر.
- تحقق / تعيين القوى الليزر.
ملاحظة: سوف تحتاج إلى تعديل طاقة الليزر كما تقاس قبل الإثارة، كما مرشحات ND وشعاع الانقسامات في مسار الإثارة سوف تقلل من قوة الليزر من العدد المعطى على لوحة التحكم بالليزر. الأرقام المعطاة هنا هي القوة في الإثارة ديكهروبيك، ولكن السلطة على التحكم بالليزر الذي يتوافق مع هذا سوف تحتاج إلى العمل بها.- ليزر أخضر 220 ميكرو واط (515 نانومتر، 40 كيلوواط)
- μ70 واط لليزر الأحمر (638 نانومتر، 10 كيلوواط)
- smOTTER برامج الاستحواذ
- قم بتوصيل الليزر، وأجهزة الكشف، وz-المرحلة، والكاميرا. تكوينها بشكل صحيح (قد تختلف تبعا لإعداد بطاقة NI معينة).
3. محاذاة مسار الانبعاثات (غير مطلوب بشكل روتيني)
- إعداد المحاذاة
- Pipette 10 μL من صبغة Cy3B الحرة (~ 100 nM) على المجهر والتركيز على النحو المبين في الخطوات 4.3-4.5 أدناه.
ملاحظة: صبغة مانح آخر مع بعض التسرب إلى قناة المقبول ستعمل أيضا. - افتح علامة التبويب المحاذاة في smOTTER، وخفض طاقة الليزر، وتغيير مقياس المحور ص حتى يتم رؤية القراءة من أجهزة الكشف.
ملاحظة: الهدف هنا هو زيادة الإشارة، لذلك قد تحتاج إلى تغيير المقياس مرة أخرى بعد زيادة الإشارة. - فك البراغي الأربعة في الجزء الأمامي من smfBox وإزالة اللوحة الأمامية.
- Pipette 10 μL من صبغة Cy3B الحرة (~ 100 nM) على المجهر والتركيز على النحو المبين في الخطوات 4.3-4.5 أدناه.
- محاذاة الثقب
- قم بتشغيل مقبض x على موضع الثقب أثناء مشاهدة الإشارة على علامة التبويب المحاذاة، في محاولة لزيادة الإشارة باللونين الأخضر والأحمر.
- الآن بدوره مقبض y لمحاذاة الثقب في الاتجاه الآخر.
- العودة إلى مقبض الباب العاشر للتحقق من أي زيادة أخرى في إشارة.
- محاذاة عدسة الثقب
- بدوره عدسة x مقبض الباب في اتجاه واحد، وهذا سوف يقلل من الإشارة.
- بدوره مقبض الباب x الثقب في نفس الاتجاه لزيادة الإشارة مرة أخرى.
- إذا كانت إشارة الحد الأقصى الجديدة أعلى من ذي قبل، استمر في تحريك الثقب والعدسة بشكل متكرر في هذا الاتجاه. إذا كان أقل من ذي قبل، تتحرك تكراريا في الاتجاه المعاكس.
- كرر أعلاه لy.
- محاذاة عدسة APD
- بدءا من APD الخضراء، حرك مقبض x حتى تكون الإشارة الخضراء في الحد الأقصى.
- كرر لمقبض y.
- العودة إلى مقبض الباب x، والتحرك ذهابا وإيابا للعثور على نقاط عتبة حيث تبدأ إشارة في الانخفاض، وترك الأمر في موقف في منتصف الطريق بين هاتين النقطتين.
- كرر لمقبض x.
- كرر الخطوات المذكورة أعلاه للعدسة APD الحمراء، ومشاهدة الإشارة الحمراء.
- ضع اللوحة الأمامية مرة أخرى على smfBox واستبدل البراغي.
ملاحظة: تنفيذ الشهر المحاذاة أعلاه، وكتدبير وقائي إذا كان يشتبه في أن المجهر قد وضعت خطأ المحاذاة بين القياسات.
4. قياس البيانات اكتساب
- للعينة الأولى، تنظيف المرحلة مع عدسة تنظيف الأنسجة غارقة في الميثانول. مسح بلطف عبر الهدف من نهاية واحدة إلى أخرى.
- تطبيق 3-4 قطرات من زيت الغمر للفحص المجهري على مركز الهدف؛ تجديد حسب الحاجة بين العينات.
- إعداد العينة
- ماصة 10 ميكرولتر من العينة (أول استخدام نوع I المياه فائقة البور) على وسط الزجاج غطاء نظيف.
- ضع زجاج الغطاء بعناية على العدسة الموضوعية لخفضه بزاوية إلى الزيت لمنع محاصرة فقاعات الهواء بين زجاج الغطاء والهدف.
ملاحظة: إذا لزم الأمر، الشريحة غطاء الزجاج حول لدفع فقاعات الهواء في النفط بعيدا عن نقطة محورية.
- لإجراء تجارب الإثارة بالتناوب الليزر (ALEX) تكوين الليزر في لوحة دورات واجب الليزر على النحو التالي.
- المانحة (ليزر أخضر) 0 قبالة، 45 على، 55 قبالة
- مقبول (ليزر أحمر) 50 قبالة، 45 على، 5 قبالة
- ALEX الفترة (ميكروس): 100
- انقر على علامة التبويب التركيز Z في الشريط. في لوحة الاستحواذ، قم بتبديل الليزر إلى Live وابدأ تشغيل الكاميرا؛ ضبط التعرض بحيث تظهر نقطة مضيئة محاطة مركزيا بالأسود.
ملاحظة: تلتقط الكاميرا الضوء الذي تعكسه واجهة الزجاج/الماء بين الغطاء والعينة، بينما تكون الدائرة المرئية للضوء في أصغر قطر لها عندما تكون النقطة المحورية في هذه الواجهة. ولذلك فمن الضروري أن تبدأ تحت هذه الواجهة، وزيادة z-الارتفاع إلى واجهة، ومن ثم أبعد قليلا للتركيز فوق coverslip وفي العينة التي يجري قياسها.- بدءا من وضع Z منخفض، قم بزيادة الارتفاع حتى تصل النقطة المضيئة إلى الحد الأدنى من الحجم، ثم ارفع الارتفاع بمقدار يصل إلى 20 ميكرومتر لتركيز الليزر فوق الزيت وزجاج الغطاء وفي العينة.
- أوقف الكاميرا مرة واحدة في التركيز.
- للتأكد من أن الإعداد قد تم تنفيذه بشكل مناسب، قم بمراقبة أثر المياه فائقة التفريغ من النوع الأول لترى عدم وجود إشارات مضانة؛ تكرار تأكيد نقاء المخازن المؤقتة التي يتم فيها إعداد العينات.
- إزالة بعناية الزجاج غطاء مع ملاقط المطاط انتهت لتجنب الهدف الضارة، ثم وضع عينة من الاهتمام أعدت على النحو الوارد أعلاه على الهدف. تجديد زيت الغمر حسب الضرورة للحفاظ على منطقة اتصال موحدة بين زجاج الغطاء والهدف (إيلاء اهتمام خاص لمنطقة اتصال العينة على زجاج الغطاء والمنطقة المحورية للهدف)
- تركيز بنغو
- ولضمان الحصول على بيانات جزيء واحد، يجب أن تكون العينات بتركيز تلاحظ فيه رشقات نارية من 1 إلى 5 رشقات في الثانية في لوحة التتبع الحية للسموتر (وهذا يقلل من فرصة وجود أكثر من جزيء واحد في حجم الكشف في وقت واحد). خذ القياسات عندما يتم تحديد التركيز المناسب.
- لمنع التبخر خلال التجارب الطويلة، قم بإعداد غرفة عينة محكمة الإغلاق. اضغط على معزل السيليكون (ثقب قطره 8-9 ملم) لأسفل على مركز زجاج الغطاء (ملون مع طرف ماصة). ثم، ماصة بعناية عينة في المركز، وتجنب أي اتصال مع السيليكون. ثم ضع زجاج غطاء ثاني على القمة واضغط لتشكيل ختم.
- تحقق من الرسم البياني الحي لقياس الاستواء مقابل كفاءة FRET (ES) لمعرفة ما إذا كانت العينة تتصرف كما هو متوقع ، أي كفاءة FRET المتوقعة وقياس ستويتشوميتري معقول (~ 0.5).
- عندما تكون العينة جاهزة، أدخل تفاصيل التجربة في لوحة حفظ الإعدادات. اختر الدليل المناسب واسم الملف بالنقر على رمز القطع الناقص (الملفات المحفوظة بتنسيق hdf5/h5) في لوحة حفظ الإعدادات.
- أدخل معلومات عن اسم العينة وتفاصيل العينة وملصقات المتبرع والمقبيل والأطوال الموجية للمتبرعين والمقبلين وأطوال الموجات الكشفية وطاقة الليزر وانتماء المستخدم والمستخدم.
- العودة إلى علامة التبويب تتبع العيش في الشريط، وفي لوحة الاستحواذ إدخال طول التجربة (في دقائق)، حدد فاصل حفظ مناسب للتخفيف من احتمال فقدان البيانات في حالة حدوث خطأ. حدد حفظ قوى الليزر، إذا لزم الأمر.
- اضغط على بدء لالتقاط البيانات.
ملاحظة: لتمكين تحديد FRET دقيقة، سوف تحتاج إلى قياس اثنين على الأقل من العينات التي تحتوي على نفس المانحة والأصباغ المقبولة، ولكن مع كفاءة FRET مختلفة بما فيه الكفاية.
5. تحليل / البرمجيات 2
- إطلاق Jupyter دفتر مع حزمة بيثون FRETBursts (تعليمات الإعداد يمكن العثور عليها هنا: https://craggslab.github.io/smfBox/anasoftware.html)
- إذا لم تكن هناك حاجة لتصحيح الكفاءة المطلقة FRET (أي، فقط التغييرات النسبية في FRET كافية للقياس) إطلاق Jupyter دفتر FRET التحليل 1.4 Uncorrected.ipynb. استخدم هذا لتصدير الأرقام أو البيانات كملفات csv لمزيد من التحليل أو التآمر في برامج أخرى.
ملاحظة: يحتوي كل دفتر ملاحظات على إرشادات مفصلة لتوجيه المستخدم خلال إجراءات التحليل. للحصول على مناقشة أكثر تفصيلا لإجراءات التحليل، بما في ذلك خوارزميات البحث الاندفاع، وتصحيح الخلفية، وجميع المعلمات التصحيح انظر23،25. - إذا كانت هناك حاجة لتصحيح الكفاءة المطلقة FRET، تبدأ بحساب المعلمات تبادل ألفا (تسرب انبعاثات المانحين في قناة القبول) ودلتا (نسبة الإثارة المباشرة للمقبل تحت الإثارة المانحة).
- إطلاق أول Jupyter دفتر الملاحظات عامل تصحيح الباحث ألفا-Delta.ipynb وتحديد المعلمات ألفا ودلتا.
ملاحظة: إذا كانت هذه غير متناسقة بين العينات، قد يكون المجهر قد وضعت مشكلة محاذاة بين القياسات أو أطياف الأصباغ يختلف بين العينات. - إذا كانت المعلمات ألفا ودلتا متسقة، إطلاق Jupyter دفتر الملاحظات عامل تصحيح الباحث غاما Beta.ipynb لتحديد المعلمات غاما وبيتا (التي تمثل الاختلافات في كفاءة الإثارة والكشف بين الأصباغ).
ملاحظة: إذا كانت مؤامرة غاما وبيتا لا تناسب بشكل جيد، قد يكون المجهر قد وضعت مشكلة المحاذاة بين القياسات، أو غلة الكم، أو معاملات الانقراض من الأصباغ يختلف بين العينات. - مع تحديد معلمات التحدث المتبادل الأربعة، يمكن استخدام هذه العوامل في دفتر ملاحظات FRET Analysis 1.4 Corrected.ipynb Jupyter لتحديد كفاءات FRET المطلقة.
- إطلاق أول Jupyter دفتر الملاحظات عامل تصحيح الباحث ألفا-Delta.ipynb وتحديد المعلمات ألفا ودلتا.
6. استكشاف الأخطاء وإصلاحها
- إذا كانت جميع الإشارات منخفضة أو العد لكل انفجار أقل من المتوقع (وهذا هو صبغة تعتمد ولكن ل ATTO-550 و ATTO-647N على القيم النموذجية smfBox هي بين 50 و 100 التهم لكل مللي ثانية خلال انفجار جزيء واحد)، إعادة تنظيم smfBox.
- جسر بين المجموعات السكانية المسماة بشكل مضاعف ومصنفة بشكل مهزوز على الرسم البياني ل ES.
ملاحظة: يمكن أن يكون سبب ذلك إما عن طريق العمل بتركيز عالي جدا (علاج هذا عن طريق تمييع العينة) ، أو عن طريق photobleaching ، والتي يمكن أن تحدث باستخدام طاقة ليزر عالية جدا (علاج هذا عن طريق تقليل طاقة الليزر). - إذا انخفض معدل الانفجار طوال التجربة (من المرجح أن تلتزم الجزيئات المسماة بالفلورسنت بزلة الغطاء الزجاجية) ، فاستخدم تركيزا متزايدا من BSA لتصحيح ذلك.
- إذا زاد معدل الانفجار طوال التجربة (من المرجح أن تتبخر العينة)، فعد غرفة عينة محكمة الهواء كما هو موضح أعلاه.
- إذا تعطلت الإشارة إلى الصفر أثناء المحاذاة (من المحتمل أن يكون البرنامج مغمورا بإشارة من أجهزة الكشف) ، فخفض طاقة الليزر أو استخدم عينة محاذاة أكثر تمييعا.
- إذا كان التركيز Z يظهر حلقات متحدة المركز (يمكن أن يحدث إذا تم وضع عدة coverlips على الهدف)، تحقق من وجود coverlips متعددة على الهدف.
- إذا كانت العينة تحتوي على رشقات نارية ساطعة وطويلة من الستويتشيومتريات المتوسطة (الناجمة عن جزيئات مجمعة)، استخدم المنظفات أو تعديل بروتوكولات تنقية العينة.
ملاحظة: الحصول على المخزن مؤقت نظيفة يمكن أن يكون مشكلة، كما أن بعض مكونات المخزن المؤقت غالبا ما تحتوي على كميات صغيرة جدا من الملوثات الفلورية المعتدلة التي تكفي لتقديم رشقات نارية لون واحد على تتبع الوقت. إذا كان هناك الكثير من هذا في المخزن المؤقت، ثم يمكن أن تتزامن مع رشقات نارية عينة وتغيير كفاءة FRET أو قياس قياس الاستواء. يمكن أن يكون BSA على وجه الخصوص مشكلة في كثير من الأحيان في هذا الصدد ، لذلك من المفيد تعريض محلول BSA للمخزون لمصدر ضوء قوي لphotobleach الملوثات.
النتائج
ويستلزم البروتوكول إجراء تقييم نقدي للظروف التجريبية أثناء الإعداد (انظر الخطوة 4-8 من البروتوكول). وتتحقق في هذه المرحلة النتائج الأولى التي تحدد نجاح أو فشل التجربة. والنتيجة الإيجابية هي أن يكون هناك ما بين خمس رشقات نارية وواحدة في الثانية (انظر الشكل 2B، جيم). والنتيجة السلبية هي وجود عدد كبير جدا (الشكل 2A) أو رشقات نارية قليلة جدا (الشكل 2D) في غضون هذا الإطار الزمني. ويبقى من الممكن في هذه المرحلة تصحيح هذه الأخطاء: فالعينات ذات التركيز العالي جدا تحتاج ببساطة إلى تخفيفها؛ ولكن إذا كان التركيز منخفضا جدا، فقد يلزم إعداد عينة جديدة (المحدد هو ما إذا كان من الممكن في هذا التركيز المنخفض جمع البيانات في إطار زمني معقول).
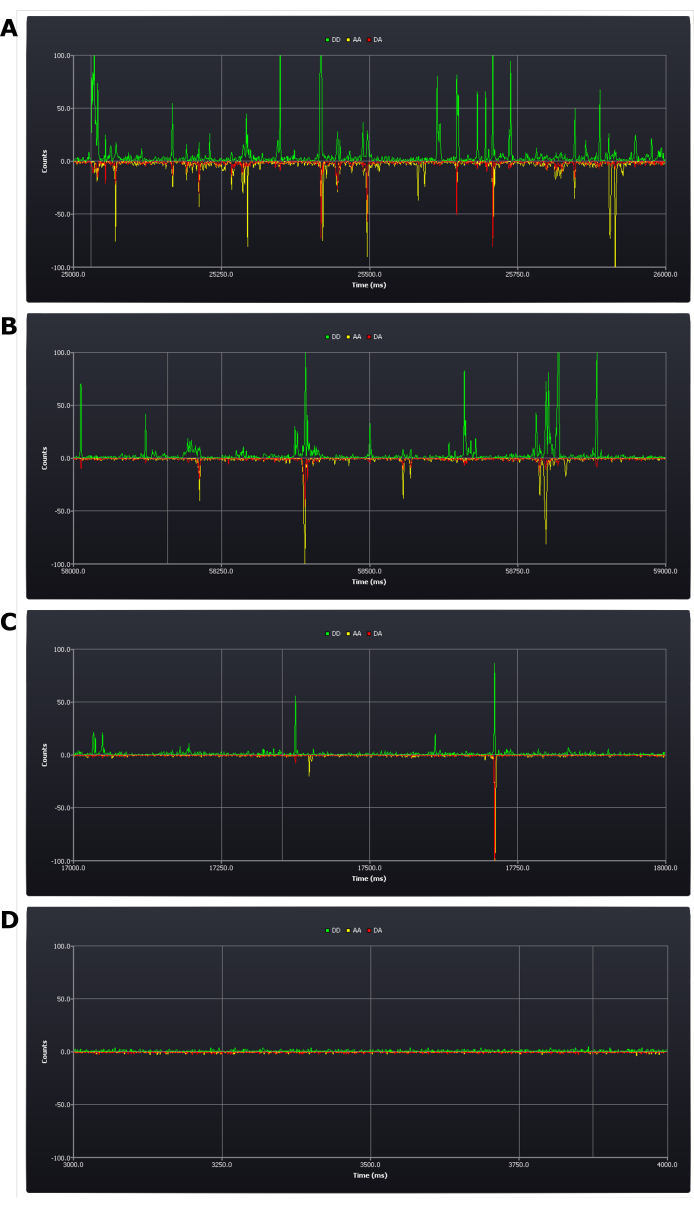
الشكل 2: لقطات الشاشة من التتبع الحي أثناء الإعداد التجريبي تظهر تركيزات مختلفة من عينات الحمض النووي المزدوجة المسماة بشكل مضاعف. (A) عالية جدا، (B) الحد المقبول الأعلى، (C) تركيز الهدف، (D) منخفضة جدا. يتم عرض عدد فوتون (1 مللي ثانية صناديق) في قنوات الكشف الثلاث; انبعاث المانحة بعد الإثارة المانحة (DD)، انبعاث القبول بعد الإثارة المانحة (DA)، وانبعاثات القبول بعد الإثارة المقبولة (AA). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
وعادة ما يتطلب نظام ثابت من نوع واحد 30 إلى 60 دقيقة من القياس للحصول على ما يلزم من رشقات نارية ~ 1000 اللازمة لتحليل البيانات قوية. وسوف تزيد مدة وعدد رشقات نارية المطلوبة مع أنواع متعددة أو أنظمة ديناميكية. بعد جمع البيانات وتحليلها باستخدام أرقام البروتوكول يتم تصديرها من دفاتر Jupyter. يجب أن تتطابق مؤامرة التناوب (الشكل 3A) مع فترة ALEX من الإعداد التجريبي. ويستخدم أثر الوقت (الشكل 3B) لتقييم أن تركيز العينة معقول نوعيا. تظهر مؤامرة الخلفية (الشكل 3C) توزيع فترات التأخير بين فوتونات مع تناسب خطي إلى أوقات أطول لتقدير معدل الخلفية26. يمكن أن يحدد أثر الخلفية (الشكل 3D) ما إذا كانت هناك تغييرات في العينة خلال مدة التجربة؛ في المقام الأول هذا سيكون بسبب التبخر خلال فترات اقتناء أطول. يتم إنشاء مخططات ES لجميع فوتونات (الشكل 3E) والأنواع المسماة بشكل مضاعف (الشكل 3F). وأخيرا، يتم إنشاء مخطط بياني E 1D (الشكل 3G) مع تركيب الغاوسية للبيانات انفجار.
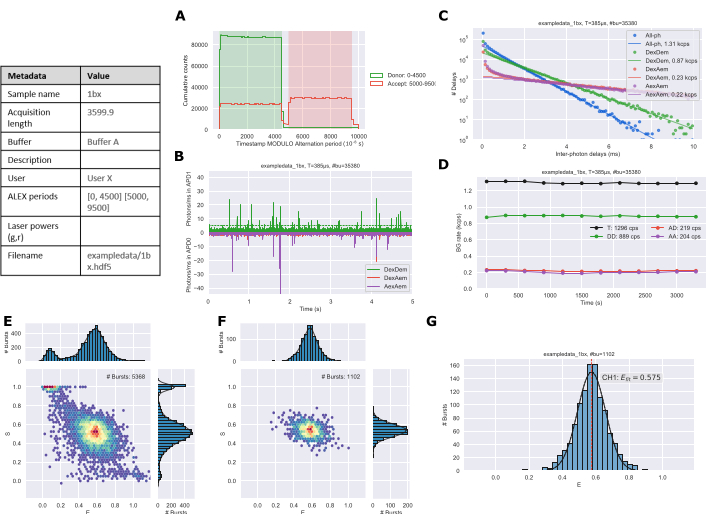
الشكل 3: مثال على إخراج الشكل للبيانات المحللة التي تم إنشاؤها بواسطة دفاتر Jupyter. (A) مؤامرة الالتناوب، (ب) تتبع الوقت، (C) تحديد الخلفية، (D) معدلات الخلفية، (E) جميع المدرج التكراري فوتون ES، (F) الرسم البياني المزدوج قناة ES، و (G) 1D E الرسم البياني. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| اسم | تسلسل |
| 1a | 5'- GAG CTG AAA GTG TCG AGT TTG TTT GAG TGT TTG TCT GG - 3' |
| 3'- لجنة مكافحة الإرهاب GAC TTT CAC AGC TCA AAC AAA CTC ACA AAC AGA CC - 5 ' | |
| 1ب | 5'- GAG CTG AAA GTG TCG AGT TTG TTT GAG TGT TTG TCT GG - 3' |
| 3'- لجنة مكافحة الإرهاب GAC TTT CAC AGC TCA AAC AAA CTC ACA AAC AGA CC - 5 ' | |
| 1c | 5'- GAG CTG AAA GTG TCG AGT TTG TTT GAG TGT TTG TCT GG - 3' |
| 3'- لجنة مكافحة الإرهاب GAC TTT CAC AGC TCA AAC AAA CTC ACA AAC AGA CC - 5 ' |
الجدول 1: تسلسل الحمض النووي المستخدم في البروتوكول. يتم تمييز النيوكليوتيدات باللونين الأزرق والأحمر الذي يمثل بقايا الثيمين المعدلة الأمينية C2 المسماة بأتو-550 وأتو-647N على التوالي.
تصحيح عامل الباحث ألفا دلتا: الرجاء انقر هنا لتحميل هذا الملف.
تصحيح عامل الباحث غاما بيتا: الرجاء انقر هنا لتحميل هذا الملف.
FRET Analysis 1.4 تصحيح: الرجاء الضغط هنا لتحميل هذا الملف.
FRET Analysis 1.4 غير مصحح: الرجاء الضغط هنا لتحميل هذا الملف.
Discussion
أهم الخطوات في البروتوكول هي محاذاة المجهر وضبط تركيز العينة إلى التخفيف الصحيح. إذا كان المحاذاة خارج، ثم قد يكون هناك إشارة غير كافية لتحديد رشقات نارية ورسم المدرجات التكرارية، وإذا حدث اختلال بين العينات ثم تصحيح FRET دقيقة قد تفشل بسبب التغيرات في التسرب والكشف / كفاءة الإثارة. استخدام تركيز مناسب مهم أيضا، تركيز عال جدا سوف تعطي رشقات نارية تزامنية، تحتوي على جزيئات متعددة مع كفاءات FRET مختلفة محتملة أو وضع العلامات stoichiometries. تركيز منخفض جدا سيعطي رشقات نارية قليلة جدا لتحليل البيانات قوية.
البروتوكول الموصوف هنا هو لقياس المسافات في أنواع FRET واحدة ثابتة. إذا كان للعينة أكثر من ذروة واحدة في الرسم البياني كفاءة FRET، أو قمم تبدو واسعة (وهو ما يمكن أن يحدث مع الأنواع الديناميكية)، ثم قد تكون هناك حاجة إلى مزيد من رشقات نارية لتناسب المدرجات التكرارية لنفس الدرجة من الدقة. وبالنسبة للقممتين المنفصلتين جيدا، ستكون هناك حاجة إلى ضعف البيانات تقريبا، ولكن إذا تداخلت المجموعات السكانية قليلا، فعندئذ يلزم المزيد من البيانات.
وإذا تداخلت المجموعتان السكانيتان على النطاق الزمني للتجربة، يمكن تحديد ديناميات النظام وحركياته. ويمكن لاختبارات مثل BVA27 و 2CDE28 أن تؤكد أن الرشقات الوسيطة ديناميكية في طبيعتها، في حين أن التحليلات بما في ذلك dPDA29,30 أو H2MM31 يمكن أن تحدد معدلات الانعكاس. تتوفر دفاتر Jupyter ل BVA و 2CDE على موقع FRETBursts26 ، ويمكن لبرنامج MATLab المستند إلى PAM32 تشغيل تحليلات BVA و 2CDE و PDA.
Confocal واحد جزيء FRET يمكن بسهولة مراقبة الدول أكثر من ذلك بكثير لم يدم طويلا (~ 1 مللي ثانية) من TIRF; ومع ذلك ، فإن أوقات المراقبة القصيرة ، المحدودة بالانتشار ، لا تعطي تاريخا جزيئيا ، وبالتالي لا يمكنها تحديد أوقات الإقامة الأطول ، أو شبكات الانتقال المعقدة بالطريقة التي يمكن بها للتجارب السطحية المشلودة.
كما يقيس البروتوكول بحرية نشر الجزيئات بتركيز منخفض جدا، فإنه يعمل بشكل أفضل عند قياس المسافات داخل الجزيئية على نفس الجزيء. يمكن قياس المسافات بين الجزيئيات بين الجزيئات المربوطة بشكل عابر شريطة أن يكون KD من الجزيئين منخفضا بما يكفي بحيث يوجد المجمع بكمية كبيرة بتركيز العمل المنخفض الذي تتطلبه التجربة (~ 100 pM). إذا كان KD أعلى بكثير من هذا ، ثم سيتم رؤية جزيئات وصفت بشكل مثير للنغر فقط. ويمكن التغلب على هذه المشكلة باستخدام microfluidics لخلط اثنين من المكونات المسماة معا في تركيز عال ومن ثم تمييع بسرعة وتتدفق على الهدف قبل dissociates3334 معقدة.
قياس كفاءة FRET على مستوى جزيء واحد له ميزة كبيرة على تقنيات الفرقة ، كما أنه يعلم عن الخلايا الفرعية غير المتجانسة ، والتي في تجربة الفرقة سيتم متوسطها. وعلاوة على ذلك، فإن FRET أحادي الجزيء مع ALEX يتيح الوصول إلى كفاءات FRET دقيقة، والتي يمكن تحويلها إلى مسافات دقيقة. وهذا يمكن من تحديد معلومات هيكلية أكثر تفصيلا بدلا من مجرد التحقيق في التغيرات النسبية في المسافة. يحمل smfBox كل هذه الفوائد والقدرات ولكن يمكن بناؤه بميزانية أقل بكثير من المجاهر المتاحة تجاريا القابلة للمقارنة القادرة على smFRET23 confocal.
يمثل smfBox حاجزا أقل بكثير أمام دخول تقنيات smFRET ، مما يسمح للباحثين بقياس التغيرات التوافقية ، والمسافات الدقيقة داخل وبين البروتينات والأحماض النووية7،8،9،10،11،35.
Disclosures
ولا يعلن صاحبا البلاغ عن وجود مصالح متنافسة.
Acknowledgements
ويقر المؤلفان بامتنان بمصادر التمويل التالية: BBSRC (BB/T008032/1)؛ و BBSRC (BB/T008032/1)؛ و BBSRC (BB/T008032/1)؛ و BBSRC (BB/T008032/1)؛ و BBSRC ( EPSRC (فترة البقاء في كلية البكالوريوس) وMRC (الطالب إلى A. R.T.).
Materials
| Name | Company | Catalog Number | Comments |
| Amino modified oligonucleotide | Eurogentec | N/A | May be ordered from various suppliers or synthesised; amino modification enables labeling with NHS-ester modified dyes |
| Avalanche photodiode (APD) | Excelitas | SPCM-AQRH-14 | Two APDs are required for the smfBox setup |
| Bovine Serum Albumin (BSA) | Merck | A2153 | System dependant; imaging buffer component (0.1 mg/mL in buffer) |
| Compact Laser Combiner | OMICRON | LightHUB-2 | 515 nm (80 mW) and 638 nm (100 mW) lasers |
| Coverglass | VWR | 630-2742 | Thickness: 0.17 ± 0.01 mm, LxW: 22x22 mm |
| Cy3B | Cytiva | PA63101 | 1 mg, PA63100 (5 mg), PA96106 (25 mg) |
| FRETBursts Python Package | N/A | N/A | Open-source python package for burst analysis of freely-diffusing single-molecule FRET data: https://fretbursts.readthedocs.io |
| Imaging Buffer | N/A | System dependant; 5 mM NaCl, 20 mM MgCl2, 5 mM Tris pH 7.5 and 0.1 mg/mL BSA | |
| Immersion Oil | Olympus | IMMOIL-F30CC | |
| Jupyter notebooks | Project Jupyter | N/A | Open-source web application to create and share documents that contain live code, equations, visualizations and text; data analysis notebooks for smfBox can be found in the SI |
| Lens Tissue | ThorLabs | MC-5 | MC-50E is same item in bulk |
| Magnesium Chloride | Merck | M2670 | System dependant; imaging buffer component (20 mM in buffer) |
| MilliQ/Ultrapure water | N/A | ||
| Nanopoistioner | Piezoconcept | FOC300 | Nanopositioner for accurate positioning of microscope objective |
| NHS-ester modified ATTO-550 | ATTO-TEC | AD 550-31 | 1 mg, AD 550-35 (5 mg) |
| NHS-ester modified ATTO-647N | ATTO-TEC | AD 647N-31 | 1 mg, AD 647N-35 (5 mg) |
| Objective lens | Olympus | N1480700 | Olympus objective series from orignal smfBox discontinued; replaced by N5702300 |
| OMICRON Control Center (OCC)- laser control center | OMICRON | N/A | v3.5.34 - OMICRON laser driver software |
| Press-To-Seal silicone isolator | Grace Bio-Labs | 664201 | 8-9 mm Diameter x 1.7 mm Depth |
| smOTTER | N/A | N/A | Open-source acquisition software for the Craggs Lab smfBox: https://github.com/craggslab/smOTTER |
| Sodium Chloride | Merck | S7653 | System dependant; imaging buffer component (5 mM in buffer) |
| Tris base | Merck | 93362 | System dependant; imaging buffer component (5 mM, pH 7.5 in buffer) |
| Type I ultrapure water | Merck | ZIQ7000T0 | Milli-Q® IQ 7000 Ultrapure Water System |
References
- Forster, T. Intermolecular energy migration and fluorescence. Annals of Physics. 437 (1-2), 55-75 (1948).
- Stryer, L., Haugland, R. P. Energy transfer: a spectroscopic ruler. Proceedings of the National Academy of Sciences. 58 (2), 719-726 (1967).
- Hohlbein, J., et al. Conformational landscapes of DNA polymerase I and mutator derivatives establish fidelity checkpoints for nucleotide insertion. Nature Communications. 4 (1), 2131 (2013).
- Lerner, E., et al. Toward dynamic structural biology: Two decades of single-molecule Förster resonance energy transfer. Science. 359 (6373), (2018).
- Hohlbein, J., Craggs, T. D., Cordes, T. Alternating-laser excitation: single-molecule FRET and beyond. Chemical Society Reviews. 43 (4), 1156-1171 (2014).
- Lerner, E., et al. The FRET-based structural dynamics challenge -- community contributions to consistent and open science practices. arXiv. , (2020).
- Hellenkamp, B., Wortmann, P., Kandzia, F., Zacharias, M., Hugel, T. Multidomain structure and correlated dynamics determined by self-consistent FRET networks. Nature Methods. 14 (2), 174-180 (2017).
- Craggs, T. D., et al. Substrate conformational dynamics facilitate structure-specific recognition of gapped DNA by DNA polymerase. Nucleic Acids Research. 47 (20), 10788-10800 (2019).
- Tsytlonok, M., et al. Dynamic anticipation by Cdk2/Cyclin A-bound p27 mediates signal integration in cell cycle regulation. Nature Communications. 10 (1), 1676 (2019).
- Nagy, J., et al. Complete architecture of the archaeal RNA polymerase open complex from single-molecule FRET and NPS. Nature Communications. 6 (1), 6161 (2015).
- LeBlanc, S. J., et al. Coordinated protein and DNA conformational changes govern mismatch repair initiation by MutS. Nucleic Acids Research. 46 (20), 10782-10795 (2018).
- Segal, M., et al. High-throughput smFRET analysis of freely diffusing nucleic acid molecules and associated proteins. Methods. 169, 21-45 (2019).
- Kapanidis, A. N., et al. Fluorescence-aided molecule sorting: Analysis of structure and interactions by alternating-laser excitation of single molecules. Proceedings of the National Academy of Sciences. 101 (24), 8936-8941 (2004).
- Kapanidis, A. N., et al. Alternating-laser excitation of single molecules. Accounts of Chemical Research. 38 (7), 523-533 (2005).
- Müller, B. K., Zaychikov, E., Brauchle, C., Lamb, D. C. Pulsed interleaved excitation. Biophysical Journal. 89 (5), 3508-3522 (2005).
- Laurence, T. A., Kong, X., Jager, M., Weiss, S. Probing structural heterogeneities and fluctuations of nucleic acids and denatured proteins. Proceedings of the National Academy of Sciences of the United States of America. 102 (48), 17348-17353 (2005).
- Pollina, T., et al. PlanktonScope: Affordable modular imaging platform for citizen oceanography. bioRxiv. , 056978 (2020).
- Collins, J. T., et al. Robotic microscopy for everyone: the OpenFlexure microscope. Biomedical Optics Express. 11 (5), 2447-2460 (2020).
- Courtney, A., Alvey, L. M., Merces, G. O. T., Burke, N., Pickering, M. The Flexiscope: a low cost, flexible, convertible and modular microscope with automated scanning and micromanipulation. Royal Society Open Science. 7 (3), 191949 (2020).
- Martens, K. J. A., et al. Visualisation of dCas9 target search in vivo using an open-microscopy framework. Nature Communications. 10 (1), 3552 (2019).
- Auer, A., et al. Nanometer-scale multiplexed super-resolution imaging with an economic 3D-DNA-PAINT microscope. ChemPhysChem. 19 (22), 3024-3034 (2018).
- Li, H., et al. Squid: Simplifying quantitative imaging platform development and deployment. bioRxiv. , 424613 (2020).
- Ambrose, B., et al. The smfBox is an open-source platform for single-molecule FRET. Nature Communications. 11 (1), 5641 (2020).
- Ingargiola, A., Laurence, T., Boutelle, R., Weiss, S., Michalet, X. Photon-HDF5: An open file format for timestamp-based single-molecule fluorescence experiments. Biophysical Journal. 110 (1), 26-33 (2016).
- Hellenkamp, B., et al. Precision and accuracy of single-molecule FRET measurements-a multi-laboratory benchmark study. Nature Methods. 15 (9), 669-676 (2018).
- Ingargiola, A., Lerner, E., Chung, S., Weiss, S., Michalet, X. FRETBursts: An open source toolkit for analysis of freely-diffusing single-molecule FRET. PLOS One. 11 (8), 0160716 (2016).
- Torella, J. P., Holden, S. J., Santoso, Y., Hohlbein, J., Kapanidis, A. N. Identifying molecular dynamics in single-molecule FRET experiments with burst variance analysis. Biophysical Journal. 100 (6), 1568-1577 (2011).
- Tomov, T. E., et al. Disentangling subpopulations in single-molecule FRET and ALEX experiments with photon distribution analysis. Biophysical Journal. 102 (5), 1163-1173 (2012).
- Santoso, Y., Torella, J. P., Kapanidis, A. N. Characterizing single-molecule FRET dynamics with probability distribution analysis. ChemPhysChem. 11 (10), 2209-2219 (2010).
- Kalinin, S., Valeri, A., Antonik, M., Felekyan, S., Seidel, C. A. M. Detection of structural dynamics by FRET: A photon distribution and fluorescence lifetime analysis of systems with multiple states. The Journal of Physical Chemistry B. 114 (23), 7983-7995 (2010).
- Pirchi, M., et al. Photon-by-photon hidden Markov model analysis for microsecond single-molecule FRET kinetics. The Journal of Physical Chemistry B. 120 (51), 13065-13075 (2016).
- Schrimpf, W., Barth, A., Hendrix, J., Lamb, D. C. PAM: A framework for integrated analysis of imaging, single-molecule, and ensemble fluorescence data. Biophysical Journal. 114 (7), 1518-1528 (2018).
- Zijlstra, N., et al. Rapid microfluidic dilution for single-molecule spectroscopy of low-affinity biomolecular complexes. Angewandte Chemie International Edition. 56 (25), 7126-7129 (2017).
- Hellenkamp, B., Thurn, J., Stadlmeier, M., Hugel, T. Kinetics of transient protein complexes determined via diffusion-independent microfluidic mixing and fluorescence stoichiometry. The Journal of Physical Chemistry B. 122 (49), 11554-11560 (2018).
- Bennet, I. A., et al. Regional conformational flexibility couples substrate specificity and scissile phosphate diester selectivity in human flap endonuclease 1. Nucleic Acids Research. 46 (11), 5618-5633 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved