Method Article
Açık Kaynaklı smfBox kullanarak Hassas ve Doğru Tek Moleküllü FRET Ölçümleri Yapma
Bu Makalede
Özet
Bu makalede, açık kaynaklı, ucuz smfBox'ı kullanarak biyomolekülleri serbestçe dağıtarak, açmadan hizalamaya ve odaklanmaya, veri toplama ve analize kadar, bireysel olarak tam olarak düzeltilmiş doğru FRET ölçümleri yapmak için adım adım yönergeler sağlanır.
Özet
smfBox, biyomolekülleri serbestçe dağıtma ölçümlerini daha erişilebilir hale getiren tek moleküllü Förster Rezonans Enerji Transferi (smFRET) için yakın zamanda geliştirilmiş uygun maliyetli, açık kaynaklı bir cihazdır. Bu genel bakış, örnek hazırlama, cihaz kurulumu ve hizalama, veri toplama ve eksiksiz analiz rutinlerinin ayrıntıları da dahil olmak üzere çift yönlü DNA örneklerinde hassas FRET verimliliklerinin ölçümlerini yapmak için bu cihazı kullanmak için adım adım bir protokol içerir. Doğru FRET türevi mesafe ölçümleri için gerekli tüm düzeltme faktörlerinin nasıl belirlendiğini içeren sunulan yaklaşım, standart protokoller ve analiz yaklaşımları oluşturmayı amaçlayan FRET Topluluğu genelinde son zamanlarda yapılan işbirlikçi çalışmaların büyük bir gövdesi üzerine inşa edilir. Bir dizi biyomoleküler sisteme kolayca uyarlanabilen bu protokol, smFRET'in daha geniş bilim topluluğu için demokratikleştirilmesinde artan çabalara katkıda bulunmaktadır.
Giriş
Tek moleküllü Förster rezonans enerji transferi (smFRET), iki boya-bir donör ve bir alıcı arasındaki FRET verimliliğini tek tek moleküller düzeyinde ölçen bir tekniktir. FRET, iki boyanın üst üste binen enerji spektrumundan kaynaklanan fotofiziksel bir süreçtir: donör belirli bir dalga boyunun ışığıyla heyecanlanır ve enerjiyi alıcıya radyal olmayan bir şekilde aktarır ve bu da alıcıdan emisyonla sonuçlanır. Bu aktarımın verimliliği, iki boya arasındaki mesafenin altıncı gücüyle ters orantılıdır, bu nedenle transfer verimliliği mesafeye göre değişir1. Bu nedenle, bu FRET verimliliği, boyaların bağlı olduğu molekül(ler)2 hakkında 3-10 nm aralığında mekansal bilgileri belirlemek için kullanılabilir. Bu ölçek ve FRET verimliliğindeki değişikliklerin Angstrom moleküler hareketlerine duyarlı olması3, tekniği, nükleik asitler ve proteinler gibi biyomoleküller hakkında yapısal bilgileri araştırmaya çok uygun hale getirir- ortalama 4,5,6 topluluk komplikasyonları olmadan. Biyomoleküler etkileşimleri ve konformasyonsal dinamikleri izlemek için göreceli FRET verimliliklerindeki değişiklikler kullanılabilirken, protein (un) katlama, transkripsiyon ve DNA replikasyonu ve onarımı gibi temel hücresel süreçlere ışık tutan mutlak FRET verimlilikleri biyomoleküler yapı belirleme için kesin mesafeleri belirlemek için kullanılmıştır7,8,9,10,11 , diğer bazı yapısal yöntemler için gerekli olduğu gibi kristalizasyon veya donma ihtiyacının üstesinden gelmek4,12.
smFRET deneyleri en sık konfokal veya total iç yansıma floresan (TIRF) mikroskopisi olmak üzere iki form alır. Her iki yaklaşım arasında biyomoleküllerin moleküler dinamikleri tipik olarak pitodan milisaniyeye (konfokal, serbestçe dağan moleküller) milisaniyeden saatlere kadar (TIRF, yüzey hareketsiz moleküller) zaman ölçeklerinde araştırılabilir. Bunun nedeni, her teknikte yer alan farklı kurulumlardır. TIRF mikroskopisinde moleküller bir slaytın yüzeyinde hareketsiz hale getirilir ve bir evanescent dalgası tarafından heyecanlanır (Şekil 1A). Ancak burada, smfBox'ın formatı olduğu için konfokal mikroskopiye odaklanın. Konfokal mikroskopide moleküller hareketsizleştirilmez ve bunun yerine yüksek sayısal diyaframlı bir lensten lazer ışınını çözelti içinde belirlenen bir derinlikte bir noktaya odaklayarak oluşturulan konfokal hacim (~1 fL) aracılığıyla Brownian hareketi ile serbestçe yayılır (Şekil 1B). Elde edilen emisyon aynı diyafram açıklığından geriye odaklanır ve dikroik bir aynadan süzilir (tam şematik için Şekil 1C ). Daha sonra odak dışı ışığı çıkarmak için bir iğne deliğinden ve bir çığ fotodiyotuna (APD) odaklanır. APD bir foton algıladığında, zamanlaması picosecond çözünürlüğe kadar kaydedilebilen bir TTL darbesi çıkışı sağlar. Konfokal hacmin çevresindeki bu serbestçe dağılan moleküllerin gözlem süresi genellikle milisaniyeler içindedir.
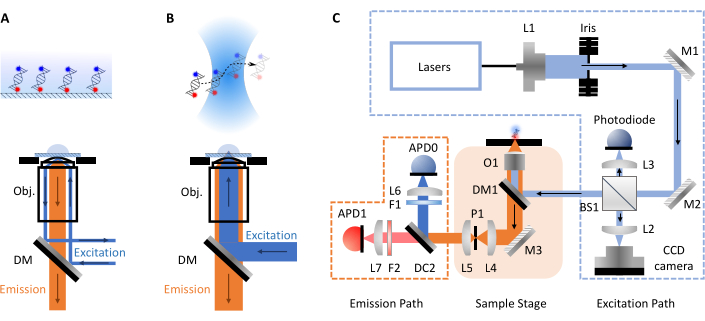
Şekil 1: Mikroskopi ve smfBox kurulumu prensiplerini gösteren şemalar. (A) Total Internal Reflection Fluorescence (TIRF) Mikroskopi prensibi: eksitasyon ışığı hedefin kenarına yönlendirilir (Obj.) ve yüzeye bağlı molekülleri heyecanlandırmak için katlanarak çürüyen bir evanescence alanı oluşturan kapak tamponu arayüzünde toplam iç yansımaya maruz kalan. (B) Konfokal Mikroskopi: Serbestçe difüzyon molekülleri, numuneye odaklanan neredeyse kırınım sınırlı bir nokta ile heyecanlanır. (C) Bu protokolde kullanılan ve tüm önemli bileşenleri gösteren smfBox kurulumu: çığ fotodiyotları (APD), ışın ayırıcı (BS), dikroik aynalar (DM), filtreler (F), aynalar (M), nesnel (O) ve iğne deliği (P). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Daha yakın zamanda, smFRET teknikleri, donör ve alıcı ekscitasyon dalga boylarıyla eşleşen lazerlerin değiştirildiği iki renk ekscitasyonunu içeriyordu5. Bu, ilki alternatif lazer uyarlama (ALEX)13,14 olarak bilinen KHz zaman ölçeğinde sürekli dalga lazerlerini modüle ederek iki yoldan biriyle yapılabilir. İkinci yöntem, MHz zaman ölçeğinde hızlı darbeleri aralar; Bu nanosaniye-ALEX15 veya darbeli interleaved excitation (PIE)16'dır. Tüm bu yaklaşımlarda, kabul eden lazerden gelen bilgiler, düşük FRET verimliliğine sahip moleküller ile kabul edenlerden yoksun olanlar arasında ayrım yapabilen stoichiometry olarak adlandırılan hesaplamaya yol açar (eksik etiketleme veya fotobleaching yoluyla). PIE/ns-ALEX kullanımı ayrıca tek molekül seviyesinde floresan ömürlere erişim sağlar ve polarize edici optiklerle birleştiğinde anizotroplar ölçülebilir. Bu ölçüm kombinasyonu multiparametre floresan algılama (MFD)9 olarak bilinir.
SmFRET'in birçok avantajına rağmen, ticari aletlerin yüksek maliyetleri ve basit, kendi kendine inşa edilen alternatiflerin eksikliği nedeniyle uzman laboratuvarlar dışında yaygın olarak kullanılmamaktadır. Düşük maliyetli açık kaynak mikroskopisinin geliştirilmesine yönelik artan bir eğilim gerçekleşiyor ve son zamanlarda Planktonscope17, OpenFlexure Microscope18, Flexiscope19, miCube20, liteTIRF21 ve Squid22 dahil olmak üzere diğer platformlar ortaya çıktı. Burada çalışma, tek molekülleri serbestçe dağıtarak iki boya arasındaki FRET verimliliğini ölçebilen yakın zamanda geliştirilmiş uygun maliyetli bir konfokal kurulum olan smfBox'ı kullanma protokolünü açıklar. Ayrıntılı derleme talimatları ve gerekli tüm operasyonel yazılımlar şu https://craggslab.github.io/smfBox/ 23 adresinde serbestçe kullanılabilir. SmfBox'ın optik düzenlemesi, uygun fiyatlı ve yaygın olarak erişilebilen üreticilerden satın alınan hazır bileşenlerden monte edilirken, mikroskop gövdesi (standart bir konfokal kurulumda masrafın çoğundan sorumludur) özel bir ışık sıkı eloksal-alüminyum kutu ile değiştirilmiştir (ölçümlerin ortam ışığı koşullarında yapılmasına izin verir). Bu kutu, heyecan dikroik, nesnel ve iğne deliği ve mekanik lazer kilidi de dahil olmak üzere önemli optik bileşenlere ev sahipliği yaparak Sınıf I lazer ürünü olarak güvenli çalışmasını sağlar (tam şematik için Şekil 1C'ye bakın). smfBox, boya stoichiometry doğrulamak ve doğru FRET düzeltme faktörlerini belirlemek için ALEX kullanır. Veri toplamanın tüm yönlerini kontrol eden ve verileri birçok üçüncü taraf analiz aracıyla uyumlu açık kaynaklı foton-HDF5 format24'te çıkaran özel yazılı, açık kaynaklı yazılım (smOTTER) kullanılarak işletilmektedir. SmfBox ve satın alma ve veri analizi protokolleri yakın zamanda çok laboratuvarlı kör bir çalışmada >20 diğer araçlara (hem konfokal hem de TIRF) karşı test edilmiştir25. Elde edilen FRET verimlilikleri, smfBox'ın ticari olarak mevcut kurulumların fiyatının sadece bir kısmına mal olan diğer tüm araçlarla mükemmel bir şekilde uyuşmuş durumdaydı.
Burada, smfBox'ı kullanarak DNA dublekslerini serbestçe dağıtma konusunda doğru, mutlak FRET verimliliklerini elde etmek ve analiz etmek için adım adım bir protokol özetlenmiştir, açmadan hizalamaya ve odaklanmaya, veri toplama ve analize kadar. Burada kullanılan örnekler, dünya çapındaki kör çalışmada değerlendirilen üç dubleks DNA'dır (yüksek, orta ve düşük FRET verimlilikleri sergileyen, bkz. Tablo 1); bununla birlikte, yöntem proteinler ve diğer nükleik asitler de dahil olmak üzere birçok moleküler sisteme uyarlanabilir. Umut, smfBox23 için zaten mevcut olan yapı talimatlarıyla birlikte bu kadar ayrıntılı bir protokolün, bu güçlü tekniği çok çeşitli laboratuvarlar için daha da erişilebilir hale getirmeye yardımcı olmasıdır.
Protokol
1. Açma bileşenleri
- Altı fişte güç (belirli bir sıra yok): Piezoconcept (z-focus), APD0, APD1, yeşil lazer, kırmızı lazer ve fotodetector.
2. Yazılım 1-Deneysel kurulum
- Lazer kontrol merkezini başlatın.
- Sürekli Dalga - Alternatif Sabit Akım (CW-ACC) modunun seçili olduğundan emin olun.
- her iki lazeri de çalıştır.
- Lazer güçlerini kontrol edin/ayarlayın.
NOT: ND filtreleri ve eksitasyon yolundaki ışın ayırıcılar lazer kontrol panelinde verilen sayıdan lazer gücünü azaltacağından, lazer gücünün ekscitasyon dikroiklinden hemen önce ölçüldüğü gibi ayarlanması gerekecektir. Burada verilen sayılar ekscitasyon dikroik gücü, ancak lazer kontrolü üzerinde buna karşılık gelen gücün üzerinde çalışılması gerekecektir.- 220 μW yeşil lazer (515 nm, 40 mW)
- Kırmızı lazer için μ70 W (638 nm, 10 mW)
- smOTTER satın alma yazılımı
- Lazerleri, dedektörleri, z-stage'i ve kamerayı bağlayın. Bunları doğru yapılandırın (belirli NI kart kurulumunun ayarlarına bağlı olarak değişebilir).
3. Emisyon yolunun hizalanması (rutin olarak gerekli değildir)
- Hizalamayı ayarlama
- Pipet 10 μL serbest Cy3B boyası (~100 nM) mikroskopa ve aşağıdaki 4.3-4.5 adımlarında açıklandığı gibi odaklanın.
NOT: Kabul eden kanala biraz sızıntı olan başka bir donör boyası da işe yarar. - Hizalama sekmesini smOTTER'da açın, lazer gücünü düşürün ve dedektörlerden okuma görülene kadar y ekseni ölçeğini değiştirin.
NOT: Buradaki amaç sinyali artırmaktır, bu nedenle sinyal arttıktan sonra ölçeğin tekrar değiştirilmesi gerekebilir. - SmfBox'ın önündeki dört vidayı sökün ve ön paneli çıkarın.
- Pipet 10 μL serbest Cy3B boyası (~100 nM) mikroskopa ve aşağıdaki 4.3-4.5 adımlarında açıklandığı gibi odaklanın.
- İğne deliği hizalaması
- Hizalama sekmesindeki sinyali izlerken, sinyali yeşil ve kırmızı olarak artırmaya çalışırken iğne deliği konumlandırıcısındaki x düğmesini çevirin.
- Şimdi iğne deliğini diğer yöne hizalamak için y düğmesini çevirin.
- Sinyalde daha fazla artış olup olmadığını kontrol etmek için x düğmesine dönün.
- Iğne deliği-lens hizalaması
- Lens x düğmesini bir yönde çevirin, bu sinyali azaltacaktır.
- Sinyali tekrar artırmak için iğne deliği x düğmesini aynı yönde çevirin.
- Yeni maksimum sinyal öncekinden daha yüksekse, hem iğne deliğini hem de lensi bu yönde yinelemeli olarak hareket ettirmeye devam edin. Öncekinden daha düşükse, yinelemeli olarak ters yönde hareket edin.
- y için yukarıda tekrarlayın.
- APD lens hizalaması
- Yeşil APD'den başlayarak, yeşil sinyal maksimumda olana kadar x düğmesini hareket ettinin.
- y düğmesi için tekrarlayın.
- x düğmesine dönün, sinyalin düşmeye başladığı eşik noktalarını bulmak için ileri geri hareket edin ve bu iki noktanın ortasında bir konumda bırakın.
- x düğmesi için tekrarlayın.
- Kırmızı APD lens için yukarıdaki adımları tekrarlayın, kırmızı sinyali izleyin.
- Ön paneli smfBox'a geri yerleştirin ve vidaları değiştirin.
NOT: Yukarıdaki hizalama ayilini gerçekleştirin ve mikroskopun ölçümler arasında bir hizalama hatası geliştirdiğinden şüphelenilirse ihtiyati bir önlem olarak.
4. Ölçüm-veri toplama
- İlk örnek için, metanol içine batırılmış lens temizleme dokusu ile sahneyi temizleyin; bir uçtan diğer uca nesnel boyunca hafifçe silin.
- Hedefin merkezine mikroskopi için 3-4 damla daldırma yağı uygulayın; numuneler arasında gerektiği gibi yenilenin.
- Numune hazırlama
- Pipet 10 μL numune (ilk kullanım Tip I ultra saf su) temiz bir kapak camının ortasına.
- Kapak camı ile amaç arasında hava kabarcıklarının sıkışmasını önlemek için kapak camını yağa bir açıyla indirerek objektif lense dikkatlice yerleştirin.
NOT: Gerekirse, yağdaki hava kabarcıklarını odak noktasından uzaklaştırmak için kapak camını kaydırın.
- Alternatif lazer uyarlama (ALEX) deneyleri yapmak için lazer görev döngüleri panelindeki lazeri aşağıdaki gibi yapılandırın.
- Donör (yeşil lazer) 0 kapalı, 45 açık, 55 kapalı
- Acceptor (kırmızı lazer) 50 kapalı, 45 açık, 5 kapalı
- ALEX dönemi (μs): 100
- Şeritteki Z odağı sekmesine tıklayın; alım panelinde lazerleri Canlı olarak değiştirin ve kamerayı başlatın; pozlamayı, parlak bir noktanın merkezi olarak siyahla çevrili görünecek şekilde ayarlayın.
NOT: Kamera, kapak ve numune arasındaki cam/su arayüzü tarafından yansıtılan ışığı yakalar ve odak noktası bu arayüzdeyken görünür ışık çemberi en küçük çapındadır. Bu nedenle, bu arayüzün altından başlamak, arayüze z yüksekliğini artırmak ve daha sonra kapak kapağının üzerinde ve ölçülen örnekte odaklanmak için biraz daha ileri gitmek gerekir.- Düşük Z konumundan başlayarak, parlak nokta minimum boyutuna ulaşana kadar yüksekliği artırın, ardından lazeri yağ ve kapak camının üzerine ve numuneye odaklamak için yüksekliği 20 μm'ye kadar yükseltin.
- Kamerayı netlemede durdurun.
- Kurulumun uygun şekilde gerçekleştirildiğini onaylamak için, floresan sinyali görmek için Tip I ultra saf suyun izini izleyin; numunelerin hazırlandığı tamponlar için saflık onayını tekrarlayın.
- Hedefe zarar vermemek için kapak camını kauçuk uçlu cımbızla dikkatlice çıkarın, ardından yukarıdaki gibi hazırlanan ilgi örneğini hedefe yerleştirin. Kapak camı ve amaç arasında eşit bir temas alanı sağlamak için daldırma yağını gerektiği gibi yenileyin (numunenin kapak camı ve nesnel odak alanındaki temas alanına özel dikkat)
- Konsantrasyon bingo
- Tek moleküllü verilerin elde edildiğinden emin olmak için, örneklerin smOTTER'ın canlı izleme panelinde saniyede 1-5 patlamanın gözlendiği bir konsantrasyonda olması gerekir (bu, algılama hacminde aynı anda birden fazla molekülün bulunma olasılığını en aza indirir). Uygun konsantrasyon belirlendiğinde ölçümleri alın.
- Uzun deneyler sırasında buharlaşmayı önlemek için hava geçirmez bir numune odası hazırlayın. Silikon izolatörleri (8-9 mm çapında delik) bir kapak camının ortasına bastırın (pipet ucuyla renkli). Daha sonra, silikonla herhangi bir temastan kaçınarak bir örneği dikkatlice merkeze pipetleyin. Ardından, üzerine ikinci bir kapak camı yerleştirin ve bir mühür oluşturmak için bastırın.
- Numunenin beklendiği gibi davranıp davranmadiğini, yani beklenen FRET verimliliğini ve makul stoichiometriyi (~0.5) görmek için canlı stoichiometry vs FRET verimliliği (ES) histogramını kontrol edin.
- Örnek hazır olduğunda, denemenin ayrıntılarını kaydetme ayarları paneline girin. Ayarları kaydet panelinde üç nokta simgesine (hdf5/h5 formatında kaydedilen dosyalar) tıklayarak uygun bir dizin ve dosya adı seçin.
- Örnek adı, örnek ayrıntıları, donör ve alıcı etiketleri, tampon, donör ve alıcı heyecan dalga boyları, algılama dalga boyları ve lazer gücü ile kullanıcı ve kullanıcı bağlantısı için bilgi girin.
- Şeritteki canlı izleme sekmesine dönün ve alım panelinde deneme uzunluğunu girin (dakika cinsinden), bir hata durumunda olası veri kaybını azaltmak için uygun bir kaydetme aralığı seçin. Gerekirse Lazer Güçlerini Kaydet'i seçin.
- Verileri almak için Başlat'a basın.
NOT: Doğru FRET tayini sağlamak için, aynı donör ve alıcı boyaları içeren, ancak yeterince farklı FRET verimliliğine sahip en az iki numunenin ölçülebilmesi gerekir.
5. Analiz/yazılım 2
- Jupyter dizüstü bilgisayarını FRETBursts python paketiyle başlatın (kurulum talimatlarını burada bulabilirsiniz: https://craggslab.github.io/smfBox/anasoftware.html)
- Mutlak FRET verimlilikleri için düzeltme gerekli değilse (yani, ölçüm için yalnızca FRET'teki göreceli değişiklikler yeterlidir) Jupyter dizüstü bilgisayar FRET Analizi 1.4 Düzeltilmemiş.ipynb'yi başlatın. Diğer yazılımlarda daha fazla analiz veya çizim için rakamları veya verileri csv dosyaları olarak dışa vermek için bunu kullanın.
NOT: Her not defteri, kullanıcıya analiz prosedürlerinde rehberlik etmek için ayrıntılı talimatlar içerir. Seri arama algoritmaları, arka plan düzeltme ve tüm düzeltme parametreleri de dahil olmak üzere analiz yordamlarının daha ayrıntılı bir tartışması için bkz. - Mutlak FRET verimlilikleri için düzeltme gerekiyorsa, çapraz konuşma parametrelerini alfa (donör emisyonunun alıcı kanala sızması) ve deltayı (bağışçının donör uyarımı altında doğrudan uyarılma oranı) hesaplayarak başlayın.
- İlk olarak Jupyter dizüstü bilgisayar Düzeltme Faktörü Bulucu Alpha-Delta.ipynb'yi başlatın ve alfa ve delta parametrelerini belirleyin.
NOT: Bunlar numuneler arasında tutarsızsa, mikroskop ölçümler arasında bir hizalama sorunu geliştirmiş olabilir veya boyaların spektrumu numuneler arasında farklılık gösterir. - Alfa ve delta parametreleri tutarlıysa, gama ve beta parametrelerini (boyalar arasındaki heyecan ve algılama verimliliği farklılıklarını hesaba katan) belirlemek için Jupyter dizüstü bilgisayar Düzeltme Faktörü Bulucu Gama-Beta.ipynb'yi başlatın.
NOT: Gama ve beta grafiği iyi uymuyorsa, mikroskop ölçümler veya kuantum verimleri arasında bir hizalama sorunu geliştirmiş olabilir veya boyaların yok olma katsayıları örnekler arasında farklılık gösterir. - Belirlenen dört çapraz konuşma parametresi ile bu faktörler, mutlak FRET verimliliklerini belirlemek için FRET Analizi 1.4 Corrected.ipynb Jupyter not defterinde kullanılabilir.
- İlk olarak Jupyter dizüstü bilgisayar Düzeltme Faktörü Bulucu Alpha-Delta.ipynb'yi başlatın ve alfa ve delta parametrelerini belirleyin.
6. Sorun Giderme
- Tüm sinyaller düşükse veya patlama başına sayımlar beklenenden düşükse (bu boya bağımlıdır-ancak smfBox'taki ATTO-550 ve ATTO-647N için tipik değerler tek moleküllü bir patlama sırasında ms başına 50 ila 100 sayım arasındadır), smfBox'ı yeniden hizalayın.
- ES histogramında iki kat ve tek etiketli popülasyonlar arasında köprü.
NOT: Bu, çok yüksek bir konsantrasyonda çalışmaktan (numuneyi seyrelterek bunu düzeltin) veya çok yüksek bir lazer gücü kullanılmasından kaynaklanabilecek fotobleachingden kaynaklanabilir (lazer gücünü azaltarak bunu düzeltin). - Patlama hızı deney boyunca düşerse (floresan etiketli moleküller muhtemelen cam kapak kapağına yapışıyor), düzeltmek için daha fazla BSA konsantrasyonu kullanın.
- Deneme boyunca patlama hızı artarsa (numune muhtemelen buharlaşıyorsa), yukarıda açıklandığı gibi hava geçirmez bir numune odası hazırlayın.
- Hizalama sırasında sinyal sıfıra düşerse (yazılım muhtemelen dedektörlerden gelen sinyalle boğulmaktadır), lazer gücünü düşürün veya daha seyreltik bir hizalama örneği kullanın.
- Z-focus eşmerkezli halkalar gösteriyorsa (hedefe birden fazla kapak yerleştirilmişse gerçekleşebilir), hedefte birden fazla kapak kılıfı olup olmadığını kontrol edin.
- Numune parlak, uzun ara stoichiometries patlamaları içeriyorsa (agrega moleküllerinden kaynaklanır), deterjan kullanın veya numune saflaştırma protokollerini değiştirin.
NOT: Temiz bir arabellek almak bir sorun olabilir, çünkü bazı tampon bileşenleri genellikle zaman izlemede tek renk patlamaları olarak sunmak için yeterli olan çok az miktarda orta derecede floresan kirleticiler içerecektir. Tamponda bundan çok fazla varsa, numune patlamalarıyla çakışabilir ve ölçülen FRET verimliliğini veya stoichiometry'yi değiştirebilir. Özellikle BSA bu konuda genellikle sorunlu olabilir, bu nedenle kirleticileri fotobleach etmek için güçlü bir ışık kaynağına stok BSA çözeltisi maruz bırakmak yararlıdır.
Sonuçlar
Protokol, kurulum sırasında deneysel koşulların kritik bir şekilde değerlendirilmesini gerektirir (bkz. protokol adımı 4.8). Deneyin başarısını veya başarısızlığını belirleyen ilk sonuçlar bu aşamada elde edilir. Olumlu bir sonuç, saniyede beş ila bir patlama olmasıdır (bkz. Şekil 2B,C). Olumsuz bir sonuç, bu zaman diliminde çok fazla (Şekil 2A) veya çok az patlama (Şekil 2D) olmasıdır. Bu hataları düzeltmek bu aşamada mümkün olmaya devam eder: çok yüksek konsantrasyona sahip bir numunenin seyreltilmesi gerekir; ancak konsantrasyon çok düşükse, yeni bir numunenin hazırlanması gerekebilir (belirleyici, makul bir zaman diliminde veri toplamanın bu düşük konsantrasyonda mümkün olup olmadığıdır).
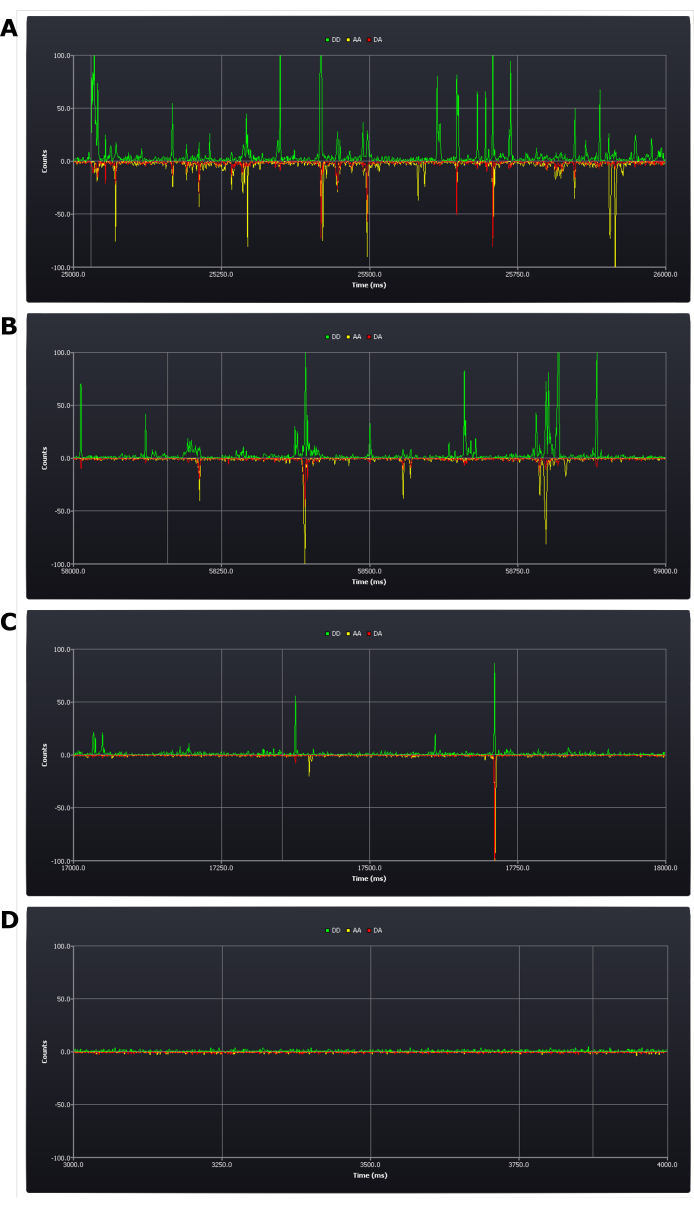
Şekil 2: Deneysel kurulum sırasında canlı izlemeden elde edilen ekran görüntüleri, iki kat etiketli çift yönlü DNA örneklerinin farklı konsantrasyonlarını gösterir. (A) çok yüksek, (B) üst kabul edilebilir sınır, (C) hedef konsantrasyon, (D) çok düşük. Foton sayıları (1 ms kutular) üç algılama kanalında gösterilir; donör ekscitasyonundan sonra donör emisyonu (DD), donör ekscitasyonundan sonra kabul eden emisyon (DA) ve kabul edenin çıkarılmasından sonra kabul eden emisyon (AA). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Statik tek türlü bir sistem, sağlam veri analizi için gereken ~1.000 patlamayı elde etmek için genellikle 30 ila 60 dakikalık ölçüm gerektirir. Birden fazla tür veya dinamik sistemle gereken patlama süresi ve sayısı artacaktır. Protokol rakamları kullanılarak veri toplama ve analiz edildi mi Jupyter not defterlerinden dışa aktarılıyor. Değişim grafiği (Şekil 3A) deneysel kurulumun ALEX dönemiyle eşleşmelidir. Numune konsantrasyonu makul olduğunu nitel olarak değerlendirmek için zaman izleme (Şekil 3B) kullanılır. Arka plan çizimi (Şekil 3C), arka plan oranını tahmin etmek için daha uzun sürelere doğrusal bir uyumla fotonlar arası gecikme sürelerinin dağılımını gösterir26. Arka plan izlemesi (Şekil 3D), deneme süresi boyunca örnekte değişiklik olup olmadığını belirleyebilir; öncelikle bu, daha uzun alım süreleri sırasında buharlaşmadan kaynaklanacaktır. ES histogramları tüm fotonlar (Şekil 3E) ve iki kat etiketli türler için oluşturulur (Şekil 3F). Son olarak, patlama verilerinin gauss montajı ile bir 1D E histogramı (Şekil 3G) oluşturulur.
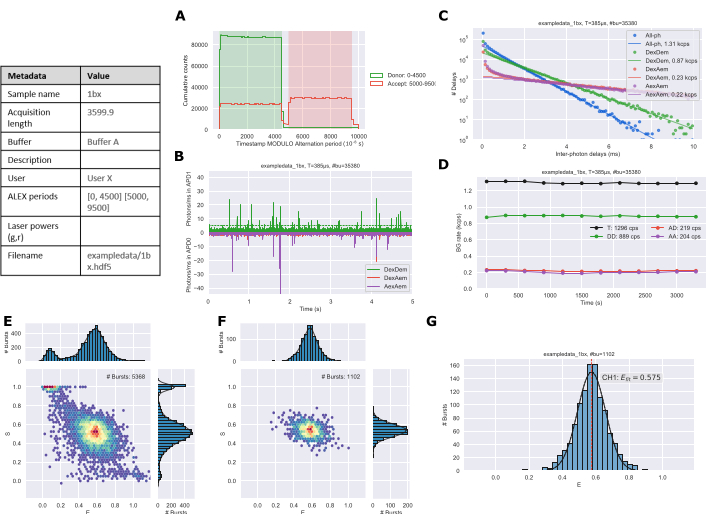
Şekil 3: Jupyter Not Defterleri tarafından oluşturulan analiz edilmiş verilerin örnek şekil çıktısı. (A) Değişim grafiği, (B) Zaman izleme, (C) Arka plan belirleme, (D) Arka plan oranları, (E) Tüm foton ES histogramı, (F) Çift kanallı ES histogramı ve (G) 1D E histogramı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Ad | Sıra |
| 1a | 5'- GAG CTG AAA GTG TCG AGT TTG TTT GAG TGT TTG TCT GG - 3' |
| 3'- CTC GAC TTT CAC AGC TCA AAC AAA CTC ACA AAC AGA CC - 5' | |
| 1b | 5'- GAG CTG AAA GTG TCG AGT TTG TTT GAG TGT TTG TCT GG - 3' |
| 3'- CTC GAC TTT CAC AGC TCA AAC AAA CTC ACA AAC AGA CC - 5' | |
| 1c | 5'- GAG CTG AAA GTG TCG AGT TTG TTT GAG TGT TTG TCT GG - 3' |
| 3'- CTC GAC TTT CAC AGC TCA AAC AAA CTC ACA AAC AGA CC - 5' |
Tablo 1: Protokolde kullanılan DNA dizileri. Nükleotidler sırasıyla Atto-550 ve Atto-647N ile etiketlenmiş C2 amino modifiye timin kalıntılarını temsil eden mavi ve kırmızı ile vurgulanır.
Düzeltme Faktörü Bulucu Alfa-Delta: Bu Dosyayı indirmek için lütfen buraya tıklayın.
Düzeltme Faktörü Bulucu Gama-Beta: Bu Dosyayı indirmek için lütfen buraya tıklayın.
FRET Analizi 1.4 Düzeltildi: Bu Dosyayı indirmek için lütfen tıklayınız.
FRET Analizi 1.4 Düzeltilmemiş: Bu Dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Protokoldeki en kritik adımlar mikroskobun hizalanması ve numune konsantrasyonunun doğru seyreltmeye ayarlanmasıdır. Hizalama kapalıysa, patlamaları tanımlamak ve histogramları çizmek için yeterli sinyal olmayabilir ve numuneler arasında yanlış hizalama meydana gelirse, sızıntı ve algılama / uyarı verimliliğindeki değişiklikler nedeniyle doğru FRET düzeltmesi başarısız olabilir. Uygun bir konsantrasyonun kullanımı da önemlidir, çok yüksek bir konsantrasyon, potansiyel olarak farklı FRET verimliliklerine sahip veya stoichiometries etiketlemeye sahip birden fazla molekül içeren tesadüfi patlamalar verecektir. Çok düşük bir konsantrasyon, sağlam veri analizi için çok az patlama verir.
Burada açıklanan protokol statik tek FRET türlerindeki mesafeleri ölçmek içindir. Örnek, FRET verimlilik histogramında birden fazla tepeye sahipse veya tepeler geniş görünüyorsa (dinamik türlerde olabilir), histogramları aynı hassasiyet derecesine sığdırmak için daha fazla patlama gerekebilir. İki iyi ayrılmış tepe için yaklaşık iki kat daha fazla veriye ihtiyaç duyulacaktır, ancak popülasyonlar biraz üst üste gelirse daha fazla veri gerekir.
İki popülasyon deneyin zaman ölçeğinde birbiriyle kesişen sistemin dinamikleri ve kinetiği potansiyel olarak belirlenebilir. BVA27 ve 2CDE28 gibi testler ara patlamaların doğada dinamik olduğunu doğrularken, dPDA29,30 veya H2MM31 gibi analizler interkonversiyon oranlarını belirleyebilir. BVA ve 2CDE için Jupyter dizüstü bilgisayarlar FRETBursts26 web sitesinde mevcuttur ve MATLab tabanlı PAM32 yazılımı BVA, 2CDE ve PDA analizlerini çalıştırabilir.
Konfokal tek moleküllü FRET, TIRF'den çok daha kısa ömürlü (~1 ms) durumları kolayca gözlemleyebilir; bununla birlikte, difüzyonla sınırlı olan kısa gözlem süreleri moleküler tarih vermez ve bu nedenle daha uzun bekleme sürelerini veya yüzey hareketsiz deneylerin yapabileceği şekilde karmaşık geçiş ağlarını belirleyemez.
Protokol molekülleri çok düşük bir konsantrasyonda serbestçe dağıtarak ölçtüğü için, aynı molekül üzerindeki intramoleküler mesafeleri ölçerken en iyi şekilde çalışır. Geçici olarak bağlı moleküller arasındaki intermoleküler mesafeler, iki molekülün Kd'sının, kompleksin deneyin gerektirdiği düşük çalışma konsantrasyonunda (~100 pM) önemli miktarda var olacak kadar düşük olması koşuluyla ölçülebilir. Kd bundan çok daha yüksekse, sadece tek tek etiketli moleküller görülecektir. Bu sorun, iki etiketli bileşeni yüksek konsantrasyonda karıştırmak için mikroakışkanlar kullanılarak ve daha sonra kompleks ayrışmadan önce hedefin üzerinde hızla seyreltilerek ve akarak aşılabilir33,34.
FRET verimliliklerinin tek moleküllü düzeyde ölçülmesi, bir topluluk deneyinde ortalama alınacak heterojen alt nüfuslar hakkında bilgi verdiği için topluluk tekniklerine göre önemli bir avantaja sahiptir. Ayrıca, ALEX ile tek moleküllü FRET, doğru mesafelere dönüştürülebilen doğru FRET verimliliklerine erişim sağlar. Bu, yalnızca göreli mesafe değişikliklerini yoklamaktan ziyade daha ayrıntılı yapısal bilgilerin belirlenmesini sağlar. smfBox tüm bu avantajları ve yetenekleri taşır, ancak konfokal smFRET23 yapabilen benzer ticari mikroskoplardan çok daha düşük bir bütçeyle oluşturulabilir.
SmfBox, araştırmacıların konformasyon değişikliklerini ve proteinler ile nükleik asitler içindeki ve arasındaki doğru mesafeleri ölçmelerine izin vererek smFRET teknikleri için girişe çok daha düşük bir engeli temsil eder7,8,9,10,11,35.
Açıklamalar
Yazarlar rakip çıkarlar beyan etmemektedir.
Teşekkürler
Yazarlar aşağıdaki finansman kaynaklarını minnetle kabul ederler: BBSRC (BB/T008032/1); EPSRC (B.A.'ya Öğrencilik) ve MRC (Öğrencilik ila A. R.-T.).
Malzemeler
| Name | Company | Catalog Number | Comments |
| Amino modified oligonucleotide | Eurogentec | N/A | May be ordered from various suppliers or synthesised; amino modification enables labeling with NHS-ester modified dyes |
| Avalanche photodiode (APD) | Excelitas | SPCM-AQRH-14 | Two APDs are required for the smfBox setup |
| Bovine Serum Albumin (BSA) | Merck | A2153 | System dependant; imaging buffer component (0.1 mg/mL in buffer) |
| Compact Laser Combiner | OMICRON | LightHUB-2 | 515 nm (80 mW) and 638 nm (100 mW) lasers |
| Coverglass | VWR | 630-2742 | Thickness: 0.17 ± 0.01 mm, LxW: 22x22 mm |
| Cy3B | Cytiva | PA63101 | 1 mg, PA63100 (5 mg), PA96106 (25 mg) |
| FRETBursts Python Package | N/A | N/A | Open-source python package for burst analysis of freely-diffusing single-molecule FRET data: https://fretbursts.readthedocs.io |
| Imaging Buffer | N/A | System dependant; 5 mM NaCl, 20 mM MgCl2, 5 mM Tris pH 7.5 and 0.1 mg/mL BSA | |
| Immersion Oil | Olympus | IMMOIL-F30CC | |
| Jupyter notebooks | Project Jupyter | N/A | Open-source web application to create and share documents that contain live code, equations, visualizations and text; data analysis notebooks for smfBox can be found in the SI |
| Lens Tissue | ThorLabs | MC-5 | MC-50E is same item in bulk |
| Magnesium Chloride | Merck | M2670 | System dependant; imaging buffer component (20 mM in buffer) |
| MilliQ/Ultrapure water | N/A | ||
| Nanopoistioner | Piezoconcept | FOC300 | Nanopositioner for accurate positioning of microscope objective |
| NHS-ester modified ATTO-550 | ATTO-TEC | AD 550-31 | 1 mg, AD 550-35 (5 mg) |
| NHS-ester modified ATTO-647N | ATTO-TEC | AD 647N-31 | 1 mg, AD 647N-35 (5 mg) |
| Objective lens | Olympus | N1480700 | Olympus objective series from orignal smfBox discontinued; replaced by N5702300 |
| OMICRON Control Center (OCC)- laser control center | OMICRON | N/A | v3.5.34 - OMICRON laser driver software |
| Press-To-Seal silicone isolator | Grace Bio-Labs | 664201 | 8-9 mm Diameter x 1.7 mm Depth |
| smOTTER | N/A | N/A | Open-source acquisition software for the Craggs Lab smfBox: https://github.com/craggslab/smOTTER |
| Sodium Chloride | Merck | S7653 | System dependant; imaging buffer component (5 mM in buffer) |
| Tris base | Merck | 93362 | System dependant; imaging buffer component (5 mM, pH 7.5 in buffer) |
| Type I ultrapure water | Merck | ZIQ7000T0 | Milli-Q® IQ 7000 Ultrapure Water System |
Referanslar
- Forster, T. Intermolecular energy migration and fluorescence. Annals of Physics. 437 (1-2), 55-75 (1948).
- Stryer, L., Haugland, R. P. Energy transfer: a spectroscopic ruler. Proceedings of the National Academy of Sciences. 58 (2), 719-726 (1967).
- Hohlbein, J., et al. Conformational landscapes of DNA polymerase I and mutator derivatives establish fidelity checkpoints for nucleotide insertion. Nature Communications. 4 (1), 2131(2013).
- Lerner, E., et al. Toward dynamic structural biology: Two decades of single-molecule Förster resonance energy transfer. Science. 359 (6373), (2018).
- Hohlbein, J., Craggs, T. D., Cordes, T. Alternating-laser excitation: single-molecule FRET and beyond. Chemical Society Reviews. 43 (4), 1156-1171 (2014).
- Lerner, E., et al. The FRET-based structural dynamics challenge -- community contributions to consistent and open science practices. arXiv. , (2020).
- Hellenkamp, B., Wortmann, P., Kandzia, F., Zacharias, M., Hugel, T. Multidomain structure and correlated dynamics determined by self-consistent FRET networks. Nature Methods. 14 (2), 174-180 (2017).
- Craggs, T. D., et al. Substrate conformational dynamics facilitate structure-specific recognition of gapped DNA by DNA polymerase. Nucleic Acids Research. 47 (20), 10788-10800 (2019).
- Tsytlonok, M., et al. Dynamic anticipation by Cdk2/Cyclin A-bound p27 mediates signal integration in cell cycle regulation. Nature Communications. 10 (1), 1676(2019).
- Nagy, J., et al. Complete architecture of the archaeal RNA polymerase open complex from single-molecule FRET and NPS. Nature Communications. 6 (1), 6161(2015).
- LeBlanc, S. J., et al. Coordinated protein and DNA conformational changes govern mismatch repair initiation by MutS. Nucleic Acids Research. 46 (20), 10782-10795 (2018).
- Segal, M., et al. High-throughput smFRET analysis of freely diffusing nucleic acid molecules and associated proteins. Methods. 169, 21-45 (2019).
- Kapanidis, A. N., et al. Fluorescence-aided molecule sorting: Analysis of structure and interactions by alternating-laser excitation of single molecules. Proceedings of the National Academy of Sciences. 101 (24), 8936-8941 (2004).
- Kapanidis, A. N., et al. Alternating-laser excitation of single molecules. Accounts of Chemical Research. 38 (7), 523-533 (2005).
- Müller, B. K., Zaychikov, E., Brauchle, C., Lamb, D. C. Pulsed interleaved excitation. Biophysical Journal. 89 (5), 3508-3522 (2005).
- Laurence, T. A., Kong, X., Jager, M., Weiss, S. Probing structural heterogeneities and fluctuations of nucleic acids and denatured proteins. Proceedings of the National Academy of Sciences of the United States of America. 102 (48), 17348-17353 (2005).
- Pollina, T., et al. PlanktonScope: Affordable modular imaging platform for citizen oceanography. bioRxiv. , 056978(2020).
- Collins, J. T., et al. Robotic microscopy for everyone: the OpenFlexure microscope. Biomedical Optics Express. 11 (5), 2447-2460 (2020).
- Courtney, A., Alvey, L. M., Merces, G. O. T., Burke, N., Pickering, M. The Flexiscope: a low cost, flexible, convertible and modular microscope with automated scanning and micromanipulation. Royal Society Open Science. 7 (3), 191949(2020).
- Martens, K. J. A., et al. Visualisation of dCas9 target search in vivo using an open-microscopy framework. Nature Communications. 10 (1), 3552(2019).
- Auer, A., et al. Nanometer-scale multiplexed super-resolution imaging with an economic 3D-DNA-PAINT microscope. ChemPhysChem. 19 (22), 3024-3034 (2018).
- Li, H., et al. Squid: Simplifying quantitative imaging platform development and deployment. bioRxiv. , 424613(2020).
- Ambrose, B., et al. The smfBox is an open-source platform for single-molecule FRET. Nature Communications. 11 (1), 5641(2020).
- Ingargiola, A., Laurence, T., Boutelle, R., Weiss, S., Michalet, X. Photon-HDF5: An open file format for timestamp-based single-molecule fluorescence experiments. Biophysical Journal. 110 (1), 26-33 (2016).
- Hellenkamp, B., et al. Precision and accuracy of single-molecule FRET measurements-a multi-laboratory benchmark study. Nature Methods. 15 (9), 669-676 (2018).
- Ingargiola, A., Lerner, E., Chung, S., Weiss, S., Michalet, X. FRETBursts: An open source toolkit for analysis of freely-diffusing single-molecule FRET. PLOS One. 11 (8), 0160716(2016).
- Torella, J. P., Holden, S. J., Santoso, Y., Hohlbein, J., Kapanidis, A. N. Identifying molecular dynamics in single-molecule FRET experiments with burst variance analysis. Biophysical Journal. 100 (6), 1568-1577 (2011).
- Tomov, T. E., et al. Disentangling subpopulations in single-molecule FRET and ALEX experiments with photon distribution analysis. Biophysical Journal. 102 (5), 1163-1173 (2012).
- Santoso, Y., Torella, J. P., Kapanidis, A. N. Characterizing single-molecule FRET dynamics with probability distribution analysis. ChemPhysChem. 11 (10), 2209-2219 (2010).
- Kalinin, S., Valeri, A., Antonik, M., Felekyan, S., Seidel, C. A. M. Detection of structural dynamics by FRET: A photon distribution and fluorescence lifetime analysis of systems with multiple states. The Journal of Physical Chemistry B. 114 (23), 7983-7995 (2010).
- Pirchi, M., et al. Photon-by-photon hidden Markov model analysis for microsecond single-molecule FRET kinetics. The Journal of Physical Chemistry B. 120 (51), 13065-13075 (2016).
- Schrimpf, W., Barth, A., Hendrix, J., Lamb, D. C. PAM: A framework for integrated analysis of imaging, single-molecule, and ensemble fluorescence data. Biophysical Journal. 114 (7), 1518-1528 (2018).
- Zijlstra, N., et al. Rapid microfluidic dilution for single-molecule spectroscopy of low-affinity biomolecular complexes. Angewandte Chemie International Edition. 56 (25), 7126-7129 (2017).
- Hellenkamp, B., Thurn, J., Stadlmeier, M., Hugel, T. Kinetics of transient protein complexes determined via diffusion-independent microfluidic mixing and fluorescence stoichiometry. The Journal of Physical Chemistry B. 122 (49), 11554-11560 (2018).
- Bennet, I. A., et al. Regional conformational flexibility couples substrate specificity and scissile phosphate diester selectivity in human flap endonuclease 1. Nucleic Acids Research. 46 (11), 5618-5633 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır