Method Article
في فيفو قياس عزم الدوران متساوي القياس Hindlimb Dorsiflexor من Pig
In This Article
Summary
يصف هذا البروتوكول تفاصيل تجريبية موجزة عن تقييم وتفسير بيانات عزم الدوران في الجسم الحي التي تم الحصول عليها عن طريق التحفيز الكهربائي للعصب الشظوي المشترك في الخنازير المخدرة.
Abstract
يمكن القول إن التقييم الموثوق به لقوة العضلات الهيكلية هو أهم مقياس للنتائج في دراسات الأمراض العصبية العضلية والعضلية الهيكلية والإصابات ، خاصة عند تقييم فعالية العلاجات التجديدية. بالإضافة إلى ذلك ، فإن أحد الجوانب الحاسمة لترجمة العديد من العلاجات التجديدية هو إظهار قابلية التوسع والفعالية في نموذج حيواني كبير. تم إنشاء العديد من الاستعدادات الفسيولوجية لتقييم خصائص وظيفة العضلات الجوهرية في الدراسات العلمية الأساسية ، في المقام الأول في النماذج الحيوانية الصغيرة. يمكن تصنيف الممارسات على النحو التالي: في المختبر (الألياف المعزولة أو حزم الألياف أو العضلات بأكملها) ، في الموقع (العضلات ذات الأوعية الدموية السليمة والتعصيب ولكن الوتر البعيد المرتبط بمحول القوة) ، وفي الجسم الحي (تظل هياكل العضلات أو وحدة العضلات سليمة). هناك نقاط قوة وضعف لكل من هذه التحضيرات. ومع ذلك ، فإن الميزة الواضحة لاختبار القوة في الجسم الحي هي القدرة على إجراء قياسات متكررة في نفس الحيوان. هنا ، يتم تقديم المواد والطرق اللازمة لتقييم عزم الدوران متساوي القياس الذي تنتجه عضلات الظهرية الخلفية في الجسم الحي استجابة للتحفيز الكهربائي الشظوي القياسي في الخنازير المخدرة.
Introduction
تتمثل الوظيفة الأساسية للعضلات الهيكلية في إنتاج القوة ، مما يجعل في النهاية أنشطة مثل التنفس والأكل والإسعاف ممكنة. يمكن أن تؤدي الحالات التي تقلل من القدرة الوظيفية للعضلات الهيكلية إلى انخفاض الأداء (المهني أو الرياضي) أو الإعاقة أو الوفاة. على سبيل المثال ، يرتبط الحفاظ على كتلة العضلات ووظيفتها في السكان المسنين ارتباطا إيجابيا بنوعية الحياة والقدرة على أداء الأنشطة الأساسية والفعالة للحياة اليومية 1,2. ويؤدي انخفاض قوة العضلات لدى مرضى ضمور العضلات في دوشين إلى عدم القدرة على التجول وفشل الجهاز التنفسي ، مما يساهم في النهاية في الوفيات المبكرة3،4،5. وبالتالي ، فإن قياس قوة العضلات هو مقياس نتائج حرج في الدراسات التي تنطوي على مرض عصبي عضلي أو إصابة.
غالبا ما يستخدم عزم الدوران المتماثل أو الأيزوكيني الطوعي الأقصى (و / أو مؤشر التعب) كمؤشر للقدرة الوظيفية في الدراسات السريرية6. في الدراسات التي أجريت على الحيوانات ، يمكن إجراء قياسات مماثلة في الجسم الحي باستخدام تحفيز الأعصاب الكهربائية أثناء التخدير. والجدير بالذكر أن الاستعدادات في الجسم الحي طفيفة التوغل مع بقاء العضلات والأوتار والأوعية الدموية والتعصيب سليمة وبالتالي تسمح بإجراء تقييمات وظيفية متكررة7،8،9،10،11. يستخدم هذا المستحضر عادة في نماذج القوارض الصغيرة وإلى حد أقل في النماذج الحيوانية الكبيرة مثل الأرانب 12 والكلاب13,14 والأغنام 15 والخنازير16,17. يمكن أن يكون الاستخدام العام لهذه المنهجية مؤثرا على العديد من الدراسات البحثية الانتقالية ، كما هو الحال في نماذج الخنازير (الخنزير) المهندسة وراثيا لضمور العضلات الشوكي (SMA)18. هنا ، يتم تقديم طرق لتقييم عزم الدوران متساوي القياس الأقصى الناجم عن تحفيز الأعصاب لمجموعة العضلات الظهرية الخنازير في الجسم الحي. تم تكييف التقنيات المقدمة في البداية من تلك التي تم تطويرها في الأصل لتقييم عزم دوران عضلات الفأر الأمامية19,20 وتم تحسينها لاحقا من خلال تجربة التحقيق في القدرة الإنتاجية لعزم الدوران بعد الإصابة 17,21,22,23,24,25,26,27,28 وأثناء التطوير16 في نماذج مختلفة من الخنزير.
يسلط هذا البروتوكول الضوء على قياس عزم الدوران متساوي القياس في الجسم الحي باستخدام منهجية تتطلب جهاز كمبيوتر متكامل مع خلية تحميل ومحفز كهربائي. تستخدم الطرق المعروضة هنا جهاز اختبار لوحة قدم متكامل متكامل متاح تجاريا ، وجهاز منصة ، وبرامج مقابلة (انظر جدول المواد). ومع ذلك، يمكن تكييف المنهجية لاستخدام البرامج الأخرى المتاحة تجاريا أو حسب الطلب، وأجهزة الحصول على البيانات، وأجهزة التحفيز. هذه الطرق مخصصة للاستخدام في جناح جراحي كبير مخصص للحيوانات مليء بالمعدات القياسية مثل: طاولة جراحية مقفلة ، طاولة قفل ثانية متساوية الارتفاع لمنصة الاختبار ، جهاز تهوية وأجهزة مراقبة ، وحصيرة تدفئة أو أجهزة أخرى للحفاظ على درجة حرارة الجسم.
هناك حاجة إلى أعضاء الفريق التالية أسماؤهم لإجراء هذه الأساليب: فني تخدير ماهر واحد واثنين من موظفي الدراسة لإجراء الاختبار الوظيفي. سيعمل هؤلاء الأشخاص معا من أجل التثبيت الأولي للطرف على جهاز المنصة. بعد ذلك ، سيكون أحد الشخصين مسؤولا عن وضع / تحديد موضع القطب والآخر عن تطبيقات الكمبيوتر أثناء الاختبار.
Protocol
وأجريت جميع التجارب على الحيوانات وفقا لقانون رعاية الحيوان، وتنفيذ لوائح رعاية الحيوان، ومبادئ دليل رعاية واستخدام المختبر. وقد أظهرت الاختبارات السابقة أن هذه الطرق موثوقة26 وليس لها أي آثار ضارة على صحة أو وظيفة الأطراف للخنزير. تم إجراء الاختبار في كثير من الأحيان أسبوعيا دون أي أحداث سلبية23. بالإضافة إلى ذلك ، يمكن إجراء اختبار التدخلات قبل وبعد الجراحة خلال نفس اليوم دون وضع ضغط غير مرغوب فيه على الحيوان أو التسبب في خلل وظيفي عصبي عضلي.
1. إعداد الكمبيوتر
- تأكد من إجراء المجموعة الأولية ومعايرة الجهاز والمكونات وفقا لمواصفات التصنيع (انظر جدول المواد). يقترح المعايرة باستخدام مجموعة من الأوزان من 0.2-2.5 كجم.
ملاحظة: يتم قياس عزم الدوران بواسطة دواسة قدم (0.14 م) مقاس 140 مم متصلة بمستشعر عزم دوران خطي بسعة 50 نيوتن متر (N·m). ومن المقرر أن يصل مكاسب الأداة إلى 25 نيوتن متر بشكل افتراضي لتتناسب بشكل أفضل مع إنتاج عزم الدوران المتوقع. يتم إجراء المعايرة عن طريق تطبيق كتلة معروفة (على سبيل المثال ، 1 كجم) على دواسة القدم على مسافة معروفة (على سبيل المثال ، 100 مم من محور الدوران) وحساب عزم الدوران. على سبيل المثال، 1 كجم يساوي 9.806 N المطبق عند 0.1 m يساوي 0.9806 N·m عزم الدوران. يمكن بعد ذلك إنشاء علاقة بين عزم الدوران المطبق على مستشعر عزم الدوران وخرج الجهد المقابل بواسطة مستشعر عزم الدوران. أكدت مستشعرات عزم الدوران الخاصة بالمؤلف خطية هذه العلاقة من 0.2 إلى 20 كجم مطبقة على لوحة معايرة معينة مقاس 40 سم. نظرا لطول الدواسة القياسية ، يوصى بنطاق معايرة يتراوح بين 0.2 و 2.5 كجم. ينتج هذا إشارة كافية لحساب عامل المقياس عن طريق الانحدار الخطي. - قم بتشغيل الكمبيوتر والمحفز ونظام محول الطاقة والواجهة التناظرية الرقمية قبل حوالي 30 دقيقة من الاختبار للسماح باستقرار تغيرات المواد المرتبطة بالحرارة التي يمكن أن تؤثر على الخصائص الكهربائية. حدد جهاز الحصول على البيانات (DAQ) المناسب والمتصل.
- إعداد المعلمات التجريبية في البرنامج حسب الحاجة ؛ البرنامج يسمح لقالب الدراسة المحفوظة. استعد لإعداد التجربة (أي قالب الدراسة) لإنشاء دراسة جديدة باستخدام الخيار إنشاء مصنف دراسة جديدة .
ملاحظة: يمكن تحميل المعلمات التجريبية مسبقا قبل بدء الدراسة ، مما سيؤدي إلى مطالبات بتضمين معلومات تجربة محددة إضافية مثل الجنس أو كتلة الجسم أو تاريخ الميلاد أو النقطة الزمنية للاختبار أو مجموعة العلاج أو متغيرات مماثلة حسب الحاجة. يمكن حفظ معلمات إعداد الدراسة واستخدامها عبر التجربة. - حدد الدراسة التي تم إنشاؤها مسبقا في بداية كل تقييم. أضف حيوانا جديدا إذا كان هذا هو الاختبار الأول للخنزير الذي سيتم اختباره واتبع المطالبة بإدخال المتغيرات في الدراسة.
- انقر فوق إعداد التجربة بمجرد الاستعداد لبدء الدراسة ، والتي ستكون مطلوبة لتحسين وضع القطب الكهربائي. قم بتوصيل التشنجات المتكررة إلى العصب مع تحديد الموضع الأمثل بمجرد وضع الأقطاب الكهربائية (انظر الخطوة 3.6).
- انقر فوق تكوين Instant Stim أولا ، ثم اضبط تردد النبضة وعرض النبضة وعدد النبضات وتردد القطار ووقت التشغيل.
- ثم انقر فوق Instant Sim لتقديم التشنجات المتكررة. بدلا من ذلك ، اضغط على زر الزناد اليدوي على وحدة المحفز لإعطاء ارتعاش واحد يدويا.
- افتح مراقب البيانات الحية أثناء بروتوكول الدراسة عندما تكون مستعدا لبدء التجربة بأكملها للسماح بالتحقيق / التصور في الوقت الفعلي للتقلصات. انقر فوق تشغيل التجربة عند الاستعداد لبدء التجربة (بعد إعداد الحيوان ، راجع الخطوة 2).
2. إعداد التخدير وصيانته
- الخنازير السريعة من الذكور أو الإناث ، 40-90 كجم ، بين عشية وضحاها قبل حدث التخدير ، تسمح بالماء ad libitum. الحصول على وتسجيل وزن الجسم الصحيح للخنزير في يوم الإجراء.
- التخدير المحفز بالحقن العضلي للتيلتامين / زولزيبام (تيلازول ، 4-6 مجم / كجم) ، زيلازين (1-3 مجم / كجم) ، وبروبوفول (2.6 مجم / كجم). الحفاظ في البداية مع 5٪ من الأيزوفلوران عن طريق قناع الوجه.
- تنبيب الخنزير بأنبوب القصبة الهوائية ووضعه على جهاز التنفس الصناعي التلقائي. حافظ على الخنزير على ضغط الذروة عند 20 سم H2O ، وحجم المد والجزر الأولي من 10 مل / كجم ، ومعدلات التنفس في 8-12 نفسا / دقيقة.
- اضبط إعداد جهاز التنفس الصناعي للحفاظ على PCO2 في نهاية المد والجزر من 40 ± 5 مم زئبق. الحفاظ على التخدير مع 1٪ -3٪ أيسوفلوران في 30٪ -37٪ O2.
- الحفاظ على درجة حرارة جسم الخنزير عند 37 درجة مئوية طوال مدة البروتوكول. أدخل وريد الأذن وقسطرة فولي لتوصيل السوائل وجمع البول، حسب الحاجة.
ملاحظة: استخدام التخدير الجراحي بالطائرة سيمنع الانقباضات الثانوية أثناء الاختبار، وخاصة من عضلات الألوية. - راقب عمق التخدير عن طريق منعكس العين ووضعها ، أو عدم وجود نغمة الفك ، أو معدل ضربات القلب (يتراوح بين 80-150 نبضة في الدقيقة) ، أو ضغط الدم الانقباضي (النطاق 120-70 مم زئبق) ، أو مزيج من كل هذه العلامات.
- قم بإعداد كل من الأطراف الخلفية اليمنى واليسرى بمجرد تخدير الخنزير بالكامل واستقراره عن طريق تنظيف الأطراف أولا بالماء والصابون لإزالة أي حطام ثم حلق الشعر من الجلد. انتبه جيدا لمنطقة الركبة الجانبية ، والتي سيتم استخدامها لوضع القطب الكهربائي لاحقا.
- انقل الخنزير إلى طاولة جراحية وضعه بأمان في وضع ضعيف. ضع الخنزير نحو سفح الطاولة مع عضلات الألوية في نهاية الطاولة أو فوقها بقليل.
ملاحظة: سيسمح ذلك للطاولة الجراحية والطاولة التي تحمل جهاز الاختبار بالتباعد. - قم بإخراج الخنزير بعد الاختبار واسمح له بالتعافي. يجب استبدال طعام الخنزير القياسي والماء بمجرد استعادة الخنزير بالكامل ويمكنه التنقل بحرية داخل القفص.
ملاحظة: التسكين بعد الإجراء غير ضروري للاختبار في الجسم الحي وحده. ومع ذلك ، يمكن توفير كاربروفين و / أو البوبرينورفين SR لكل توصية بيطرية. يتم تشجيع التشاور مع طبيب بيطري محلي. التخدير والأدوية المدرجة هنا هي للإرشاد فقط وهي معتمدة حاليا في جامعة مينيسوتا. تم اختيار صيانة التخدير مع الأيزوفلوران بناء على بدايته السريعة وتعويضه وتأثيره الضئيل على تحفيز العصب في الجسم الحي أثار عزم الدوران29. احرص على أن يكون لديك اتساق في معلمات التخدير عبر الدراسات. خلال البروتوكول ، يتم إجراء تقييم التخدير وتسجيله على فترات 15 دقيقة ؛ يتم التسجيل بناء على إرشادات ومتطلبات اللجنة المؤسسية المحلية لرعاية الحيوانات واستخدامها (IACUC) ووزارة الزراعة الأمريكية (USDA).
3. تقييم عزم الدوران متساوي القياس في الجسم الحي
- ضع القدم على صفيحة القدم الخاصة بمحول القوة. استخدم ضمادة مرنة متماسكة لربط القدم بصفيحة القدم.
ملاحظة: من الضروري القيام بدور كامل لكل قدم. من الناحية المثالية ، يكون دور 4 بوصة × 5 ياردة كافيا. - امسك القدم في موضعها على صفيحة القدم مع الكاحل عند المحايد (A) وثبت القدم على اللوحة عن طريق لف الضمادة المتماسكة حول القدم ولوحة القدم على غرار شريط الكاحل النسج المغلق للسلة (B).
ملاحظة: سيطلب من موظفي الدراسة أداء المهام الفردية (أ) و (ب) في وقت واحد. - ضع الكاحل بزاوية قائمة بمجرد تثبيت القدم على صفيحة القدم ، والتي تعرف بأنها 0 درجة أو محايدة للإشارة إلى درجات الانثناء الأخمصي أو الظهري.
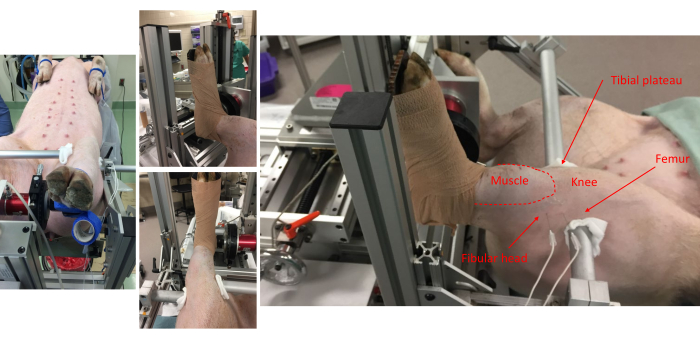
الشكل 1: تظهر الصور من نقاط المراقبة المختلفة ارتباط الخنزير بصفيحة القدم والمحاذاة التشريحية على الإطار. ويلاحظ المعالم التشريحية لعضلات المقصورة الأمامية والرأس الشظوي والركبة وهضبة الظنبوب وعظم الفخذ. لاحظ وضع أزواج الأقطاب الكهربائية تحت الجلد على الجانب الجانبي من الساق .
- تثبيت الركبة والكاحل في الزوايا اليمنى.
- أولا ، ضع قضبان تثبيت الأطراف بالقرب من المواقع المطلوبة. عندما تكون جاهزا ، بدءا من الجانب الإنسي للطرف ، قم بمحاذاة شريط تثبيت الطرف عند حوالي هضبة الظنبوب.
- ثم قم بمحاذاة شريط تثبيت الطرف الجانبي عند الرأس البعيد لعظم الفخذ.
ملاحظة: بين نهاية كل طرف، يستخدم شريط التثبيت وسادة شاش مطوية 4 × 4 لحماية الجلد المجاور للقضيب. - قم بتثبيت القضبان بإحكام باستخدام مسامير إبهام القفل.
ملاحظة: لن تكون قضبان تثبيت الأطراف متوافقة مع بعضها البعض ولكنها ستتماشى مع تشريح الخنزير. - نظف الجلد حول رأس الشظية عن طريق تطبيق 70٪ من الكحول عبر شاش نظيف في دوائر متحدة المركز تبدأ من وسط وضع القطب الكهربائي المقصود وتتحرك إلى الخارج. ضع الإبرة المعقمة عن طريق الجلد (50 مم، 26 جم أحادية القطب) والأقطاب الكهربائية (EMG) على غرار تخطيط كهربية العضل (انظر جدول المواد) عبر العصب الشظوي. زرع الأقطاب الكهربائية تحت الجلد ، حوالي 5-10 ملم.
- قم بتحسين موضع القطب باستخدام السعة الحالية المتزايدة ، كما تم ضبطها على المحفز. ابدأ من 100 مللي أمبير وقم بزيادته حسب الحاجة.
ملاحظة: عادة ما يكون 300-500 مللي أمبير مطلوبا لعزم الدوران الارتعاش الأقصى. - تصور حجم عزم الدوران النشل على عرض البيانات الحية وفوق المقصورة الأمامية للخنزير ؛ قد تنطلق الحوافر وتتحرك لأعلى أيضا.
- تأكد من عدم تنشيط المقصورة الخلفية ، أو عصب الساق ، أثناء التحفيز. فحص بصري وجس تقلص المقصورة الخلفية والحركة الهبوطية للحوافر أثناء التحفيز.
- افحص منطقة هضبة تقلص الكزاز من تتبع وقت عزم الدوران الحي في الخطوات التالية لعدم وجود تجنيد العضلات المضادة (أي الانثناء الأخمصي لهذا البروتوكول).
- احصل على أقصى عزم دوران تيتانيك متساوي القياس باستخدام معلمات التحفيز التالية: 100 هرتز ، عرض نبضة 0.1 مللي ثانية ، أكثر من قطار 800 مللي ثانية17 ، بمجرد تحسين موضع القطب الكهربائي وسعات التحفيز.
ملاحظة: يمكن استخدام هذه المعلمات لمختلف التقييمات الانقباضية.
4. بروتوكول لتحليل زاوية عزم الدوران المشترك
- قم بقياس أقصى عزم دوران كزازي متساوي القياس عبر مجموعة من مواضع الكاحل التي تتراوح من المحايدة إلى نطاقات النهاية القريبة من الانثناء الأخمصي ، أو 0-50 درجة من الانثناء الأخمصي.
ملاحظة: سيتطلب استخدام زيادات 10 درجات ستة تقلصات ، ويمكن تعديل التغيير التدريجي لأسئلة تجريبية محددة. - ابدأ في فك كل من مسامير القفل في مرحلة مقياس التوليد للتنقل بين زوايا المفصل. تأكد من تشديد كل من مسامير القفل قبل الانقباض التالي.
ملاحظة: تم كتابة مقياس التوليد مع علامات درجة للسماح بالمحاذاة الدقيقة. من المحتمل أن يكون 0 درجة من الانثناء الأخمصي ، والذي يقابله 180 درجة على مقياس الجونيومتر. توخي الحذر لضمان تحديد المواقع المقصود. - تحديد الوقت بين الانقباضات تجريبيا ؛ ومع ذلك ، 2 دقيقة كافية لتجنب التعب.
ملاحظة: مع تغيير زاوية مفصل الكاحل تدريجيا، قد تتغير أقطاب الإبرة. قد يكون من الضروري تأكيد وضع الأقطاب الكهربائية مع تقلصات الارتعاش ، كما هو مذكور أعلاه (انظر الخطوة 3.8).
5. بروتوكول لتحليل عزم الدوران والتردد
- ضع الكاحل في زاوية المفصل المطلوبة. احرص ، تجريبيا ، على إجراء الاختبار بنفس زاوية المفصل في كل مرة.
ملاحظة: عادة ما يتم إجراء تحليلات تردد عزم الدوران بزاوية مشتركة واحدة تتوافق مع عزم الدوران متساوي القياس الأقصى المستمد من تحليل زاوية عزم الدوران والمفصل. يتم إنتاج عزم الدوران الأقصى عند ~ 30-35 درجة من الانثناء الأخمصي. - قم بقياس أقصى عزم دوران متساوي القياس على مجموعة من ترددات التحفيز التي تحفز القطارات غير المنصهرة من التشنجات حتى تلك التي تحفز الكعكة المنصهرة بالكامل.
ملاحظة: يمكن تحقيق ذلك عن طريق التحفيز عند 10 و 20 و 40 و 60 و 100 هرتز (عرض نبضة 0.1 مللي ثانية ؛ قطار 800 مللي ثانية) مع دقيقتين بين كل انكماش لتجنب التعب. اعتمادا على الأسئلة التجريبية الدقيقة ونماذج الخنازير المحددة ، يمكن تكييف الترددات. الركيزة الحيوية التي تستخدم على الأرجح أثناء تقلص 800 مللي ثانية للحفاظ على ATP داخل الخلايا هي الفوسفوكرياتين30 ، وتعتمد إعادة تخليق الفوسفوكرياتين على مكوك الفوسفوكرياتين31. تشير حركية استرداد الفوسفوكرياتين إلى انتعاش ملحوظ بنسبة 90٪ أو أكثر بين 90-120 ثانية بعد انتهاء الانكماش30. لذلك ، فإن فترات الراحة الموصى بها بين الانقباضات هي 90-120 ثانية. على الرغم من أن هذا قد يتأثر بالتصاميم التجريبية ، بما في ذلك أمراض العضلات والإصابات و / أو الشيخوخة.
6. تحليل البيانات
- انقر فوق تحليل النتائج إذا كنت لا تزال في البرنامج لفتح نافذة التحليل. بدلا من ذلك، افتح برنامج التحليل مباشرة.
- سواء كنت تستخدم منصة بيانات آلية أو تحليلا يدويا ، احسب المتغيرات المختلفة في تحليل الأشكال الموجية الفردية متساوي القياس.
ملاحظة: تشمل هذه المتغيرات: عزم الدوران الأقصى للارتعاش، وعزم الدوران الكزازي الأقصى، والخصائص الانقباضية المتعلقة بالتشنجات والكزاز، على سبيل المثال، الوقت حتى الذروة ونصف الاسترخاء. يمكن للعديد من المتغيرات التجريبية تطبيع القوة ، على سبيل المثال ، وزن الجسم ، أو حجم العضلات المحدد من التصوير بالرنين المغناطيسي (MRI) أو CT (التصوير المقطعي المحوسب) ، أو وزن العضلات الطرفي. يتم تقديم كل من عزم الدوران المطلق (N·m) وعزم الدوران الطبيعي لكتلة الجسم (N·m / kg). سيختلف عزم الدوران أثناء الراحة الموجود على لوحة القدم عبر التجارب. يجب تطبيق تصحيح خط الأساس لعزم الدوران أثناء الراحة لضمان تسجيل أقصى قدر حقيقي من الارتعاش وعزم الدوران الكزازي. يتم تسجيل عزم الدوران الأساسي في كل زاوية مشتركة ويمكن أن يشير إلى التغيرات في عزم الدوران السلبي.
النتائج
تم الإبلاغ سابقا عن موثوقية وتحسين معلمات الاختبار في الجسم الحي للمقصورة الأمامية للخنزير26. كما تم الإبلاغ عن بيانات مقارنة عبر القوارض والخنازير لتردد عزم الدوران27.
أثناء التقييم في الجسم الحي ، هناك حاجة إلى تصور الشكل الموجي لعزم الدوران في الوقت الفعلي لضمان تنشيط المقصورة الأمامية المناسبة. يجب أن تعكس الأشكال الموجية الانثناء الظهري فقط. يجب أن يكون للأشكال الموجية مظهر سلس ومستدير وهضبة كزازية واضحة (الشكل 2A). تشير التناقضات أو الاضطرابات في الشكل الموجي إلى قيود تجريبية مختلفة ، مثل عدم كفاية التحفيز ، أو وضع القطب الكهربائي بشكل غير صحيح ، أو عدم كفاية عمق التخدير (الشكل 2 ب).
الشكل 3A هو تتبع وقت عزم الدوران النشل مع سهم يشير إلى عزم دوران أقصى بنسبة 50٪. يجب أن يبدأ الانكماش من الوقت إلى الذروة عند بدء المحفز وينتهي عند تحقيق أقصى عزم دوران للارتعاش (تظهر أشرطة زمنية تمثيلية أسفل التتبع). يجب أن يبدأ نصف الاسترخاء للارتعاش عند عزم دوران الارتعاش الأقصى وينتهي عند عزم دوران الارتعاش الأقصى بنسبة 50٪ (تظهر أشرطة الوقت التمثيلية أسفل التتبع). الشكل 3B هو تتبع وقت عزم الدوران الكزازي مع سهم يشير إلى عزم دوران أقصى بنسبة 50٪. على عكس التشنجات المثالية من حيث عزم الدوران الأقصى النهائي وفي الوقت المناسب ، فإن الانقباضات الكزازية لها تباين أكبر في توقيت عزم الدوران الأقصى فيما يتعلق بموعد بدء المحفز وانتهائه ، مما يتطلب نهجا أكثر دقة لتحليل الممتلكات الانقباضية. يجب أن يبدأ الانكماش من الوقت إلى الذروة ببدء تشغيل المحفز ويتوقف في مكان ما بين 90٪ -100٪ من عزم الدوران الأقصى. تظهر أشرطة الوقت في الشكل 3B قطعا بنسبة 95٪ من عزم الدوران الأقصى. هذا مفيد في حالات مثل البيانات التمثيلية المحددة لأنه لا يتم الوصول إلى عزم الدوران الأقصى حتى وقت متأخر من مرحلة الهضبة. التحليل التكميلي للوقت حتى الذروة هو متوسط معدل الانكماش. تمثل القضبان المتقطعة على الطرف الصاعد لتتبع عزم الدوران نطاقا يتراوح بين 30٪ و 70٪ من عزم الدوران الأقصى. يجب أن يبدأ متوسط معدل الانكماش في بداية التحفيز والتقاط متوسط تغير المعدل بين 30٪ -70٪ من عزم الدوران الأقصى. هذه نطاقات موصى بها ، ويمكن لمجموعات البحث الفردية تحديد النطاق المثالي حوالي 50٪ (على سبيل المثال ، ±10٪). الجزء المهم هو أن تكون متسقة داخل وعبر الدراسات. على النقيض من الارتعاش ، يجب أن يبدأ نصف الاسترخاء في تقلص الكزاز في نهاية التحفيز بدلا من عزم الدوران الأقصى لنفس السبب المذكور أعلاه مع الوقت حتى الذروة. تمثل أشرطة الوقت في الشكل 3B الوقت بين نهاية التحفيز والوصول إلى الاسترخاء بنسبة 50٪. التحليل التكميلي لنصف الاسترخاء هو متوسط معدل الاسترخاء. تمثل القضبان المتقطعة الموجودة على الطرف الهابط لتتبع عزم الدوران نفس نطاق عزم الدوران الأقصى بنسبة 30٪ -70٪ مثل الطرف الصاعد. يجب أن يبدأ متوسط معدل الاسترخاء في نهاية التحفيز والتقاط متوسط معدل التغير بين 30٪ -70٪ من عزم الدوران الأقصى. مرة أخرى ، هذه هي النطاقات الموصى بها. ملاحظة حرجة واحدة: لا تخلط بين متوسط معدل الانقباض / الاسترخاء والحد الأقصى لمعدل الانقباض / الاسترخاء. يمثل المعدل الأقصى التغير الوحيد الأكثر بروزا في المعدل بين نقطتي بيانات متجاورين ويمكن أن يكون متغيرا على نطاق واسع.
يمكن تحليل العديد من خصائص الارتعاش والانقباض لاكتساب نظرة ثاقبة على نوع الألياف وسمات اقتران الإثارة والانكماش للعضلات الهيكلية10,32. يتم التحذير من الإفراط في تفسير خصائص الارتعاش والانقباض ؛ وهي تمثل اقتراحات ومبررات لمزيد من الاستجواب على المستوى الخلوي وليست بالضرورة إرشادية. بشكل عام ، يمكن أن تعكس معدلات الانقباض إطلاق الكالسيوم الشبكي الساركوبلازمي ومعدل إنزيمي متساوي الشكل ثقيل السلسلة الميوسين. في المقابل ، يمكن أن تعكس معدلات الاسترخاء ساركو (إندو) البلازما شبكة الكالسيوم ATPase معدل الإنزيم و isoform. يمكن أن تتأثر هذه الخصائص بالتعب وتلف العضلات والتدريب على التمارين الرياضية والعديد من الأمراض (على سبيل المثال ، ضمور عدم الاستخدام).
ويصور الشكل 4 قيما تمثيلية لعلاقات عزم الدوران والتردد وعزم الدوران وزاوية المفصل للأطراف غير المصابة. هذه البيانات تمثل مجموعة واسعة من أحجام الخنازير.
تم إجراء تحليل تجريبي تمثيلي لتخطيط كهربية العضل السطحي أثناء تحليل العضلات في الجسم الحي (الشكل 5) لإثبات التحكم التجريبي في ترميز المعدل والنشاط الكلي للعضلات. تم وضع أقطاب EMG اللاصقة في منتصف بطن peroneus tertius. تم وضع قطب أرضي على الركبة لتقليل قطعة التحفيز ، وتم وضع إبر قطب التحفيز حول العصب الشظوي القريب من موقع العضلات. تم إجراء تسجيلات عزم الدوران و EMG في وقت واحد عند ترددات تحفيز 20 و 60 و 100 هرتز. يعكس عدد نبضات المحفز (الأشرطة الحمراء في الشكل 5) حاصل مدة التحفيز والوقت بين النبضات. على سبيل المثال ، يعني تردد التحفيز 20 هرتز نبضة كل 50 مللي ثانية. لذلك ، فإن مدة التحفيز 400 مللي ثانية مقسومة على 50 مللي ثانية بين النبضات تساوي ثماني نبضات يتم تسليمها (الشكل 5A). يتم توصيل نبضات المحفز إلى المحور العصبي عبر وضع قطب الإبرة عن طريق الجلد وتنتج عددا مماثلا من نبضات العضلات الكهربائية (أي 20 هرتز يساوي 8 تسجيلات EMG) ، مما يدل على التحكم التجريبي في تردد العمل المحتمل لمجموعة العضلات ذات الاهتمام. يمكن تحويل تسجيلات EMG الخام عبر تحليل الجذر المتوسط المربع (EMG RMS) لتصور نشاط العضلات الكلي مع زيادة تردد التحفيز. يعد تحليل المنطقة تحت المنحنى (AUC) إحدى الطرق لتحديد كمية EMG RMS لتحديد التغيرات في نشاط العضلات بالكامل. يتم توفير AUCs تمثيلية لكل تردد تحفيز EMG RMS (الشكل 5A-C).
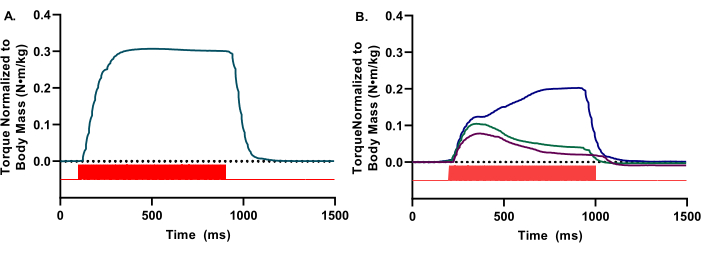
الشكل 2: الأشكال الموجية التمثيلية عالية ومنخفضة الجودة. (أ) الأشكال الموجية متساوي القياس الموجودة في مظهر موجة مربعة ، مع هضبة سائلة ملحوظة. (ب) يمكن أن تكون الأشكال الموجية منخفضة الجودة ناتجة عن عدم كفاية التحفيز أو وضع القطب الكهربائي بشكل غير صحيح. في هذه الحالات ، هناك حاجة إلى إعادة وضع الأقطاب الكهربائية. بالنسبة لكل من A و B ، يشار إلى نبضات المحفز (الأشرطة الحمراء). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
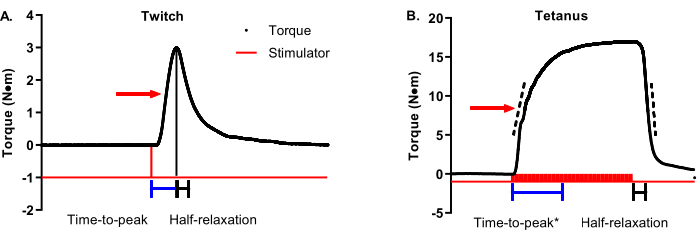
الشكل 3: تحليل خصائص الانقباض النشل والكزاز. (أ) يتم تعديل الارتعاش التمثيلي (1 هرتز) و (ب) الكزاز (100 هرتز) تتبع وقت عزم الدوران لتفصيل خصائص الانقباض. يظهر السهم الأحمر على كل رسم بياني عزم دوران أقصى بنسبة 50٪. تظهر الأشرطة الزرقاء والسوداء أسفل عمليات التتبع فترات زمنية من وقت الذروة ونصف الاسترخاء ، على التوالي. تمثل القضبان المتقطعة على الأطراف الصاعدة والهابطة لتتبع عزم الدوران الكزازي نطاقا يتراوح بين 30٪ و 70٪ من عزم الدوران الأقصى الذي يمكن استخدامه لتحديد متوسط معدل الانكماش أو الاسترخاء. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
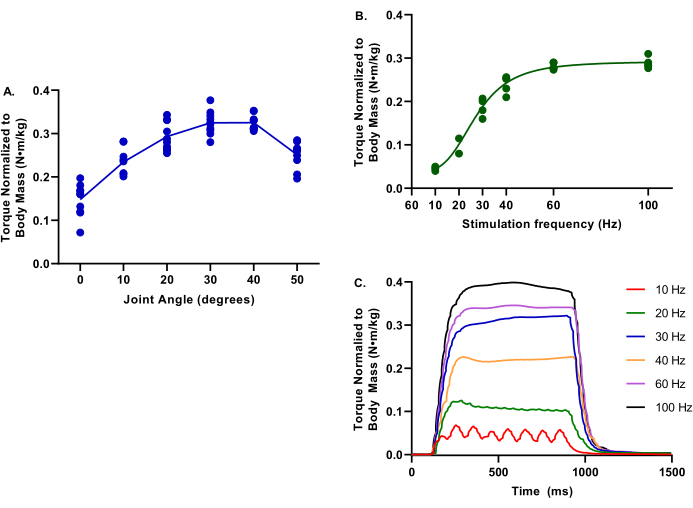
الشكل 4: مثال على بيانات زاوية عزم الدوران ومفصل وتردد عزم الدوران. البيانات المقدمة هي من مجموعة من إناث خنازير يوركشاير كروس في 2.9-6.3 أشهر. 39.4-75.4 كجم كتلة الجسم ؛ جميعهم اعتبروا السيطرة الصحية في وقت التقييم. خلال جميع الاختبارات ، تم الحفاظ على درجة حرارة الجسم الأساسية عند 37 درجة مئوية. (A) يتم تقييم عزم الدوران الطبيعي لكتلة الجسم عند مفاصل الكاحل من 0-50 درجة من الانثناء الأخمصي ؛ لاحظ أن عزم الدوران الأقصى محدد عند 30 درجة. (ب) يتم تقييم عزم الدوران الطبيعي لكتلة الجسم عند ترددات تحفيز مختلفة من 10-100 هرتز؛ لاحظ أن هذه التقييمات أجريت مع مفصل الكاحل عند 30 درجة من الانثناء الأخمصي. (ج) تم تقييم عمليات تتبع عزم الدوران الفردية لكل تردد من ترددات التحفيز. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
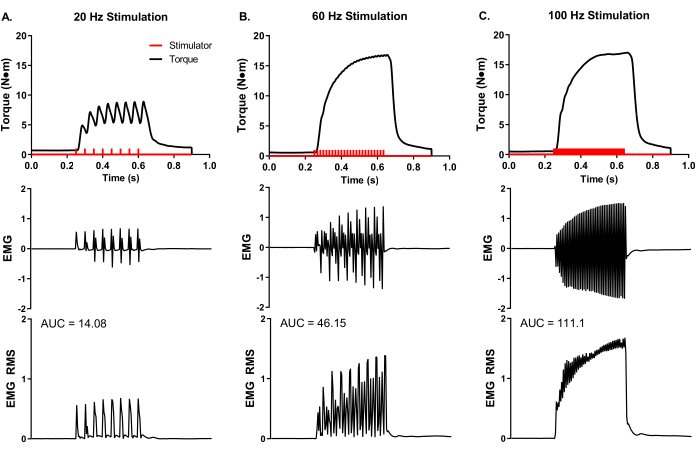
الشكل 5: عزم الدوران متساوي القياس المتزامن في الجسم الحي وقياسات EMG. تسجيلات EMG وعزم الدوران في وقت واحد عند ترددات تحفيز تمثيلية تبلغ (A) 20 و (B) 60 و (C) 100 هرتز تم جمعها من خنزير يوركشاير أنثى (~ 90 كجم كتلة الجسم). تم تسليم نبضات المحفز (الأشرطة الحمراء) وفقا لتردد التحفيز المحدد. تم تحويل تسجيلات EMG الخام إلى الجذر المتوسط المربع (EMG RMS) لتصور إجمالي نشاط العضلات مع زيادة تردد التحفيز. تم تحليل منحنيات EMG RMS التمثيلية للمنطقة تحت المنحنى (AUC) ، ويتم توفير AUCs لكل تردد تحفيز. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
الخطوات الهامة والتعديلات واستكشاف الأخطاء وإصلاحها
لتقليل تباين البيانات إلى الحد الأدنى وزيادة نجاح النهج إلى أقصى حد ، يتم تسليط الضوء على الخطوات الحاسمة التالية.
التحفيز الأمثل للأعصاب
يبدأ هذا النهج التجريبي بإزالة الاستقطاب العصبي ويعتمد على وضع القطب الكهربائي الصحيح والتحفيز الكهربائي الأمثل. يمكن أن يساعد تحليل تشريح الأعصاب المرتبط بالمعالم العظمية بعد الوفاة في تصور موضع القطب الكهربائي المناسب أثناء الاختبار. يساعد الحصول على أقصى عزم دوران للارتعاش على تحديد التيار المناسب (بالمللي أمبير ؛ mA) الذي يتم توصيله إلى المحور العصبي. هناك قيمتان يجب مراعاتهما عند تحسين تحفيز الأعصاب في بداية الاختبار: (1) نسبة الارتعاش إلى الكزاز هي ~ 1: 5 ، على سبيل المثال ، ~ 2 نيوتن متر عزم الدوران النشل يتوافق مع عزم دوران الكزاز 10 نيوتن متر (الشكل 3) ؛ و (2) عزم الدوران النموذجي لكتلة الجسم هو ~ 0.3 نيوتن متر لكل كجم كتلة الجسم (الشكل 4). إذا ظهرت ذروة عزم الدوران النشل منخفضة ، فقم بإزالة الأقطاب الكهربائية وحاول وضع آخر. تأكد من التحقق من إعدادات المحفز واتصالات BNC واتصالات القطب الكهربائي. قد تكون هناك حاجة إلى إعادة وضع القطب الكهربائي بين الانقباضات إذا كان هناك الكثير من الحركة أثناء وضع الطرف بين زوايا المفصل ، كما هو مذكور أعلاه (الشكل 2). يرجى ملاحظة أن النهج التجريبية والتداخلية يمكن أن تؤثر على هذه القيم.
المحاذاة الميكانيكية الحيوية المناسبة
يؤثر بدء طول العضلات على قوة انقباض العضلات (علاقة الطول والتوتر) ، ويمكن أن يتغير طول العضلات بناء على محاذاة مفصل الورك والركبة والكاحل. يجب توحيد زوايا المفصل بين الأطراف وبين الخنازير. يوصى بشدة بزاوية مفصل الكاحل 90 درجة للورك والركبة. يعد وضع الكاحل المثني قليلا (~ 30 درجة من زاوية مفصل الكاحل المحايدة 0 درجة) مثاليا لقوة الذروة. وهو يعكس الوضع التشريحي الطبيعي لمفصل الكاحل في كل من الخنازير والكلاب أثناء الوقوف. يجب أن تكون جميع المفاصل موازية أيضا لدواسة القدم ومحولات عزم الدوران لتجنب فقدان عزم الدوران القابل للقياس بسبب مساهمة متجه عزم الدوران العمودي. يوصى بشدة بفحص زوايا مفصل الورك والركبة والكاحل ومحاذاة مفصل القدم ودواسة القدم بعد تثبيت القدم على دواسة القدم وتأمين مفصل الركبة بقضبان تثبيت الأطراف (الشكل 1). إذا كان هناك اختلال في المحاذاة ، فقم بفتح القضبان وإزالتها وإعادة وضع الخنزير على الطاولة الجراحية. في حين أن توحيد الزوايا المشتركة عبر الدراسات أمر بالغ الأهمية لتقليل تباين البيانات ، إلا أن هناك قيودا على المحاذاة الميكانيكية الحيوية جديرة بالملاحظة ، والتي نوقشت أدناه.
الأهمية فيما يتعلق بالأساليب القائمة أو البديلة
تشمل الأمثلة البديلة للتقييمات ذات الصلة سريريا وغير الغازية لوظيفة العضلات التي يمكن استخدامها لنماذج الخنازير مسافة المشي على جهاز المشي ، وتخطيط كهربية العضل ، والتصوير الكهربائي لموجة قص العضلات النشطة. كاختبار المشي لمدة 6 دقائق في البشر ، يمكن لاختبار المشي على جهاز المشي تقييم تطور المرض ونجاح التدخل في الحيوانات الكبيرة33،34،35. عادة ، بعد فترة التأقلم ، يتم المشي على الحيوانات حتى نهاية الامتثال بسرعات مختلفة من جهاز المشي و / أو مستويات الانحدار. غالبا ما تكون المكافآت الغذائية ضرورية لتحقيق أقصى قدر من التحفيز. ومع ذلك ، فإن نتائج المشي على جهاز المشي لا تقدم سوى تفسيرات غير مباشرة لوظيفة انقباض العضلات بسبب القيود مثل الدافع الموضوعي ، وتوظيف الوحدة الحركية غير القصوى ، والاعتماد المشترك المتأصل على أنظمة الجسم الأخرى مثل القلب والأوعية الدموية والهيكل العظمي والجهاز التنفسي.
من ناحية أخرى ، يقدم EMG تقييما مباشرا أفضل قليلا لنظام العضلات الهيكلية ، حيث يتم وضع أقطاب EMG مباشرة على مجموعة العضلات ذات الاهتمام36،37،38. ثم تقيس أقطاب EMG نشاط العضلات الجماعي (ألياف العضلات غير المستقطبة). يعتمد هذا النشاط العضلي على توظيف الوحدة الحركية وترميز المعدل (تواتر إمكانات العمل المرسلة إلى الوحدات الحركية المعينة). ومع ذلك ، فإن فصل المساهمات النسبية لتوظيف الوحدات الحركية مقابل ترميز المعدل أمر مستحيل مع EMG السطحي. علاوة على ذلك ، يعتمد EMG على استعداد الموضوع لتوليد أقصى قدر من الانقباضات ، وهذا المستوى من التعاون غير مرجح في النماذج الحيوانية الكبيرة. في حين أنه قد يكون من المفيد تقييم التغيرات في EMG خلال دورة المشي ، فإن هذه البيانات لا تمثل قدرة وظيفية قصوى لمجموعة العضلات الهيكلية المثيرة للاهتمام. التصوير القائم على الموجات فوق الصوتية باستخدام الوضع B والتصوير المطاطي لموجة القص هو طريقة أخرى غير جراحية تستخدم لتقييم وظيفة العضلات. هناك علاقة جيدة بين معامل يونغ الذي تم قياسه بواسطة التصوير المطاطي وزيادة أحمال العضلات39,40. تم التحقق من صحة التصوير المطاطي لموجة القص واستخدامه كمقياس كمي لتصلب الأنسجة السلبية41،42،43،44،45 ، بما في ذلك في نموذج إصابة فقدان العضلات الحجميالخنازير 23. ويمكن أيضا أن تستخدم كقياس غير مباشر لإنتاج قوة العضلات النشطة39. ومع ذلك ، لا تزال هناك قيود تشبه EMG لاستعداد الموضوع والتعاون في أداء الانقباضات.
يوفر بروتوكول في الجسم الحي الموصوف هنا ، على النقيض من مسافة المشي على جهاز المشي و EMG ، تقييما موثوقا به وقابلا للتكرار وأقصى قدر من وظيفة العضلات. يستحضر هذا البروتوكول تقلصات العضلات بطريقة خاضعة للرقابة وقابلة للقياس الكمي ومستقلة عن الدافع. على وجه التحديد ، يتم استخدام الأقطاب الكهربائية عن طريق الجلد لتحفيز محاور الأعصاب التي تتجاوز الجهاز العصبي المركزي. يؤدي إزالة الاستقطاب من المحاور العصبية إلى إشراك جميع الوحدات الحركية مما يلغي التباين المرتبط بتوظيف الوحدات الحركية. بالإضافة إلى ذلك ، يتحكم المحقق في ترميز المعدل (تردد التحفيز). يبدأ علم وظائف الأعضاء العصبية العضلية الناتج الذي ينطبق على هذا النهج بتنشيط قناة الصوديوم ذات بوابات الجهد في عقد رانفييه. يتم إشراك جميع الفسيولوجيا اللاحقة (أو في اتجاه المصب) ، بما في ذلك اقتران الإثارة والانكماش وركوب الدراجات عبر الجسور. ميزة كبيرة لتحليل العضلات غير الغازية في الجسم الحي هي أنه يمكن قياس وظيفة العضلات المقلصة بشكل متكرر ، على سبيل المثال ، أسبوعيا ، لمراقبة قوة العضلات بعد الإصابة أو التدخل أو تطور المرض.
قيود الطريقة
تسمح المعدات الموجودة في الجسم الحي الموصوفة في هذا البروتوكول بعزم الدوران متساوي القياس السلبي والنشط كدالة لزاوية المفصل وتردد التحفيز. لا يدعم جهاز الاختبار المستخدم قياس الانقباضات الديناميكية (على سبيل المثال ، الانقباضات الغريبة الأطوار أو متحدة المركز). يسمح الجهاز بنطاق حركة 105 درجة لتوصيف علاقة زاوية عزم الدوران والمفصل ويستخدم خلية تحميل بنطاق عزم دوران أقصى يبلغ ~ 50 نيوتن متر. قد تتطلب أسئلة تجريبية محددة خصائص أداء خارج هذه المواصفات. ومن الجدير بالذكر أنه يمكن استبدال خلية التحميل الموجودة على هذا الجهاز الموصوف بنطاقات عزم دوران أكبر إذا لزم الأمر.
البروتوكول الموصوف هنا لقياس القوة العصبية العضلية القصوى في الجسم الحي له قيود ملحوظة. أولا ، تتطلب هذه الطريقة التخدير ، والذي يمكن إجراؤه بشكل مختلف وفقا لبروتوكولات وموارد المرافق الحيوانية. من المعروف أن التخدير له تأثيرات متفاوتة على الوظيفة العصبية العضلية وقد ثبت أنه يغير الفأر في إنتاج عزم الدوران الظهري في الجسم الحي بطريقة مخدرة وتعتمد على الجرعة29. الآثار التفاضلية للتخدير على الحيوان الكبير في عزم الدوران الحي غير واضحة. لذلك ، يجب أن يكون لدى المجموعات الضابطة والتجريبية نفس عوامل التخدير (على سبيل المثال ، جميع المجموعات التي تدار الكيتامين) للتحكم في هذا التباين. ثانيا، يحد الاعتماد على أنماط الانتشار في الجسم الحي من استكشاف الآليات الخلوية للخلل الوظيفي الانقباضي والسمية الحادة للأدوية. على سبيل المثال ، يمكن استخدام الكافيين أثناء اختبار حمام العضو في المختبر لعضلة معزولة لتحفيز إطلاق الكالسيوم الشبكي الساركوبلازمي ، متجاوزا اقتران الإثارة والانكماش46 مباشرة. كمية الكافيين للحث على هذا التأثير (mM) قاتلة في بيئة في الجسم الحي . يجب النظر في تأثيرات المخدرات على الجسم كله (على سبيل المثال ، إجهاد الكلى / الكبد) والعوامل اللاحقة التي تفرز في الدورة الدموية إذا تم استخدام هذا النهج لفحص المخدرات على قوة العضلات الحادة23. ثالثا ، ينحرف استخدام التحفيز الأقصى للعصب الكهربائي عن استراتيجيات التوظيف الطوعي ، كما نوقش أعلاه ، وبالتالي لا يعكس التغيرات في القوة التي قد تكون ناتجة عن تكيفات التوظيف العصبي العضلي.
وقد تكون قياسات عزم الدوران في الجسم الحي محدودة أيضا فيما يتعلق بإنشاء آلية محددة للملاحظات التجريبية. على سبيل المثال ، لا يعتمد عزم الدوران حول مفصل الكاحل على إنتاج قوة العضلات فحسب ، بل يعتمد أيضا على خصائص الأوتار والمفاصل والنسيج الضام. علاوة على ذلك ، يتم توليد القوة بواسطة مجموعات من العضلات ، وتحديدا المثنيات الأخمصية (عضلات gastrocnemius و solus و plantaris) و dorsiflexors (peroneus tertius و tibialis و digitorum muscles) في الخنازير. لذلك ، تتطلب تفسيرات بيانات عزم الدوران الأقصى في الجسم الحي النظر في التغيرات العضلية والتشريحية المحتملة وتقتصر على مجموعات العضلات ، وليس العضلات الفردية. وفي سياق متصل، غالبا ما تتكون مجموعات العضلات من مزيج من الألياف العضلية السريعة والبطيئة في الغالب، مثل العضلة المعدية والعضلات الوحيدة، على التوالي، من الثنيات الأخمصية. خصائص الانقباض مثل معدل الانقباض والاسترخاء (أو الانقباض من الوقت إلى الذروة ووقت نصف الاسترخاء) ليست مؤشرات موثوقة لفسيولوجيا نوع الألياف المستخدمة في الجسم الحي مقابل مستحضرات العضلات المعزولة ، مثل بروتوكولات الاختبار في المختبر أو في الموقع 47. الاستعدادات العضلية المعزولة متفوقة أيضا في فهم تأثير المعلمات الميكانيكية الحيوية على وظيفة العضلات لأنه يمكن التحكم بدقة في خصائص مثل طول العضلات. من المهم التأكيد على أن العلاقة بين زاوية المفصل وعزم الدوران ليست مكافئة مباشرة للعلاقة بين طول العضلات وقوتها ، حيث أن خصائص الأوتار (على سبيل المثال ، الركود) ، والعضلات (على سبيل المثال ، زاوية القلم ، تداخل الساركومير) ، والمفصل (على سبيل المثال ، ذراع اللحظة) التي تساهم في إنتاج عزم الدوران تعتمد على زاوية المفصل. وتحقيقا لهذه الغاية ، يمكن أن يكون الاختبار الوظيفي للحيوانات الكبيرة في الموقع48 إضافة قيمة إلى الاختبار في الجسم الحي ، مع الأخذ في الاعتبار أن الاختبار في الموقع هو تجربة نهائية. وتشمل التطورات الأخرى في البروتوكول الحالي التي يمكن استكشافها في المستقبل لتحسين الرؤية الميكانيكية للنتائج التجريبية استخدام التصوير بالموجات فوق الصوتية B-mode لقياس الخصائص المعمارية للعضلات والأوتار وزرع محول قوة الأوتار لقياس قوة العضلات أثناء الانقباضات الطوعية والمحفزة كهربائيا49.
أهمية والتطبيقات المحتملة للطريقة
يقيم هذا البروتوكول في الجسم الحي القدرة على إنتاج عزم الدوران لمجموعة العضلات الظهرية الخنازير ، مما يدل على طريقة غير جراحية لتقييم اكتساب أو فقدان وظيفة العضلات في بيئة فسيولوجية. نظرا لأن المنهجية ليست نهائية للخنزير ، يمكن استخدامها أيضا لتقييم وظيفة العضلات في نفس الموضوعات طوليا أثناء تطور المرض ، أو قبل وأثناء واتباع استراتيجية العلاج. على هذا النحو ، قد يسمح التصميم التجريبي للمقاييس المتكررة بإجراء مقارنات إحصائية قوية مع قوة أكبر وعدد أقل من الحيوانات مقارنة بالمقاييس المستقلة. بالإضافة إلى ذلك ، يعد خلل العضلات الهيكلية مكونا بارزا في مختلف عمليات وحالات المرض ، مثل هزال العضلات المرتبط بالأمراض المزمنة (على سبيل المثال ، فشل القلب ، الفشل الكلوي ، الإيدز ، السرطان ، إلخ) ، ضمور العضلات ، الأمراض العصبية التنكسية (على سبيل المثال ، SMA أو التصلب الجانبي الضموري. ALS) ، والشيخوخة (أي ساركوبينيا) ، وسمية المخدرات. تعد القدرة الوظيفية للعضلات الهيكلية مقياسا حاسما للنتائج الأولية للتدخلات مثل التمارين الرياضية والتغذية والعلاجات الدوائية والتجديدية. وبالتالي ، يمكن استخدام البروتوكول الموصوف هنا لتقييم قدرة إنتاج عزم دوران الخنزير في الجسم الحي بشكل موثوق عبر العديد من تطبيقات الدراسة. قد يكون مفيدا في الحصول على بيانات حيوانية واسعة النطاق لترجمة العلاجات النامية.
Disclosures
الآراء أو التأكيدات الواردة هنا هي وجهات النظر الخاصة للمؤلفين. ولا ينبغي تفسيرها على أنها رسمية أو تعكس آراء وزارة الجيش أو وزارة الدفاع أو حكومة الولايات المتحدة.
تم إنتاج مقالة الفيديو وتوافر الوصول المفتوح برعاية Aurora Scientific ، Inc. يعمل ماثيو بوركوفسكي من قبل شركة Aurora Scientific Inc. قد تستفيد هذه الشركة من نتائج البحث.
Acknowledgements
تم دعم العمل والبيانات المقدمة على نطاق واسع من قبل قيادة البحوث الطبية والمواد في الجيش الأمريكي إلى BTC و SMG (#MR140099 ؛ #C_003_2015_USAISR ؛ #C_001_2018_USAISR) ؛ وإدارة شؤون المحاربين القدامى ، إدارة صحة المحاربين القدامى ، مكتب البحث والتطوير (I21 RX003188) إلى JAC والدكتور لوك بروستر. يعترف المؤلفون بامتنان بفروع الخدمة البيطرية وعلم الأمراض المقارن في USAISR ومركز التصوير قبل السريري المتقدم UMN للمساعدة الفنية في إكمال هذه الدراسات.
Materials
| Name | Company | Catalog Number | Comments |
| 615A Dynamic Muscle Control LabBook and Analysis Software Suite | Aurora Scientific Inc. | 615A | Compatible Win Vista/7/10 |
| 892A Swine Isometric Footplate Test Apparatus | Aurora Scientific Inc. | 892A | Includes Isometric Load Cell, Pig Footplate, Goniometer stage and positioners |
| Calibration Weights | Ohaus or similar | 80850116 | |
| Computer | Aurora Scientific or any vendor | 601A | Computer must include data acquisition card and interface for software |
| Gauze pad | Various vendors | 4 by 4 squares or similar | |
| Monopolar Needle Electrodes | Chalgren, Electrode Store, or similar vendor | 242-550-24TP, or DTM-2.00SAF | |
| Non-adhesive Flexiable Tape | 3M, Coflex, or similar | 4 inch by 5 yard role | |
| Stimulator | Aurora Scientific or comparable | 701C | Must include constant current stimulation mode |
References
- Verlaan, S., et al. Nutritional status, body composition, and quality of life in community-dwelling sarcopenic and non-sarcopenic older adults: A case-control study. Clinical Nutrition. 36 (1), 267-274 (2017).
- Wang, D. X. M., Yao, J., Zirek, Y., Reijnierse, E. M., Maier, A. B. Muscle mass, strength, and physical performance predicting activities of daily living: a meta-analysis. Journal of Cachexia, Sarcopenia and Muscle. 11 (1), 3-25 (2020).
- Ishikawa, Y., et al. Duchenne muscular dystrophy: survival by cardio-respiratory interventions. Neuromuscular Disorders. 21 (1), 47-51 (2011).
- Khirani, S., et al. Respiratory muscle decline in Duchenne muscular dystrophy. Pediatric Pulmonology. 49 (5), 473-481 (2014).
- Ziter, F. A., Allsop, K. G., Tyler, F. H. Assessment of muscle strength in Duchenne muscular dystrophy. Neurology. 27 (10), 981-984 (1977).
- Garg, K., et al. Volumetric muscle loss: persistent functional deficits beyond frank loss of tissue. Journal of Orthopaedic Research. 33 (1), 40-46 (2015).
- Lovering, R. M., Roche, J. A., Goodall, M. H., Clark, B. B., McMillan, A. An in vivo rodent model of contraction-induced injury and non-invasive monitoring of recovery. Journal of Visualized Experiments: JoVE. (51), e2782(2011).
- Mintz, E. L., Passipieri, J. A., Lovell, D. Y., Christ, G. J. Applications of in vivo functional testing of the rat tibialis anterior for evaluating tissue engineered skeletal muscle repair. Journal of Visualized Experiments: JoVE. (116), e54487(2016).
- Call, J. A., Warren, G. L., Verma, M., Lowe, D. A. Acute failure of action potential conduction in mdx muscle reveals new mechanism of contraction-induced force loss. The Journal of Physiology. 591, Pt 15 3765-3776 (2013).
- Call, J. A., Eckhoff, M. D., Baltgalvis, K. A., Warren, G. L., Lowe, D. A. Adaptive strength gains in dystrophic muscle exposed to repeated bouts of eccentric contraction. The Journal of Physiology. 111 (6), 1768-1777 (2011).
- Ingalls, C. P., Wenke, J. C., Nofal, T., Armstrong, R. B. Adaptation to lengthening contraction-induced injury in mouse muscle. The Journal of Physiology. 97 (3), 1067-1076 (2004).
- Hyman, S. A., et al. In vivo supraspinatus muscle contractility and architecture in rabbit. The Journal of Physiology. 129 (6), 1405-1412 (2020).
- Childers, M. K., Grange, R. W., Kornegay, J. N. In vivo canine muscle function assay. Journal of Visualized Experiments: JoVE. (50), e2623(2011).
- Grange, R. W., et al. Muscle function in a canine model of X-linked myotubular myopathy. Muscle & Nerve. 46 (4), 588-591 (2012).
- Novakova, S. S., et al. Repairing volumetric muscle loss in the ovine peroneus tertius following a 3-month recovery. Tissue Engineering Part A. , (2020).
- Maeng, G., et al. Humanized skeletal muscle in MYF5/MYOD/MYF6-null pig embryos. Nature Biomedical Engineering. , (2021).
- Ward, C. L., et al. Autologous minced muscle grafts improve muscle strength in a porcine model of volumetric muscle loss injury. Journal of Orthopaedic Trauma. 30 (12), 396-402 (2016).
- Prather, R. S., Lorson, M., Ross, J. W., Whyte, J. J., Walters, E. Genetically engineered pig models for human diseases. Annual Review of Animal Biosciences. 1, 203-219 (2013).
- Lowe, D. A., Warren, G. L., Ingalls, C. P., Boorstein, D. B., Armstrong, R. B. Muscle function and protein metabolism after initiation of eccentric contraction-induced injury. Journal of Applied Physiology. 79 (4), 1260-1270 (1995).
- Ashton-Miller, J. A., He, Y., Kadhiresan, V. A., McCubbrey, D. A., Faulkner, J. A. An apparatus to measure in vivo biomechanical behavior of dorsi- and plantarflexors of mouse ankle. Journal of Applied Physiology. 72 (3), 1205-1211 (1992).
- Chao, T., Burmeister, D. M., Corona, B. T., Greising, S. M. Oxidative pathophysiology following volumetric muscle loss injury in a porcine model. Journal of Applied Physiology. 126 (6), 1541-1549 (2019).
- Corona, B. T., Greising, S. M. Challenges to acellular biological scaffold mediated skeletal muscle tissue regeneration. Biomaterials. 104, 238-246 (2016).
- Corona, B. T., Rivera, J. C., Dalske, K. A., Wenke, J. C., Greising, S. M. Pharmacological Mitigation of Fibrosis in a Porcine Model of Volumetric Muscle Loss Injury. Tissue Engineering Part A. , (2020).
- Corona, B. T., Rivera, J. C., Greising, S. M. Inflammatory and physiological consequences of debridement of fibrous tissue after volumetric muscle loss injury. Clinical and Translational Science. 11 (2), 208-217 (2018).
- Corona, B. T., Rivera, J. C., Wenke, J. C., Greising, S. M. Tacrolimus as an adjunct to autologus minced muscle grafts for the repair of a volumetric muscle loss injury. Journal of Experimental Orthopaedics. 4 (1), 36(2017).
- Greising, S. M., et al. Unwavering pathobiology of volumetric muscle loss injury. Scientific Reports. 7 (1), 13179(2017).
- Pollot, B. E., Corona, B. T. Volumetric muscle loss. Methods in Molecular Biology. 1460, 19-31 (2016).
- Kheirabadi, B. S., et al. Long-term effects of Combat Ready Clamp application to control junctional hemorrhage in swine. The Journal of Trauma and Acute Care Surgery. 77 (3), Suppl 2 101-108 (2014).
- Ingalls, C. P., Warren, G. L., Lowe, D. A., Boorstein, D. B., Armstrong, R. B. Differential effects of anesthetics on in vivo skeletal muscle contractile function in the mouse. Journal of Applied Physiology. 80 (1), 332-340 (1996).
- Forbes, S. C., Paganini, A. T., Slade, J. M., Towse, T. F., Meyer, R. A. Phosphocreatine recovery kinetics following low- and high-intensity exercise in human triceps surae and rat posterior hindlimb muscles. American Journal of Physiology. Regulatory, Integrative and Comparative Physiology. 296 (1), 161-170 (2009).
- Meyer, R. A., Sweeney, H. L., Kushmerick, M. J. A simple analysis of the "phosphocreatine shuttle.". American Journal of Physiology. 246 (5), Pt 1 365-377 (1984).
- McKeehen, J. N., et al. Adaptations of mouse skeletal muscle to low-intensity vibration training. Medicine & Science in Sports & Exercise. 45 (6), 1051-1059 (2013).
- Boakye, M., et al. Treadmill-based gait kinematics in the yucatan mini pig. Journal of Neurotrauma. 37 (21), 2277-2291 (2020).
- Woodman, C. R., Muller, J. M., Laughlin, M. H., Price, E. M. Induction of nitric oxide synthase mRNA in coronary resistance arteries isolated from exercise-trained pigs. American Journal of Physiology. 273 (6), 2575-2579 (1997).
- Boddy, K. N., Roche, B. M., Schwartz, D. S., Nakayama, T., Hamlin, R. L. Evaluation of the six-minute walk test in dogs. American Journal of Veterinary Research. 65 (3), 311-313 (2004).
- Valentin, S., Zsoldos, R. R. Surface electromyography in animal biomechanics: A systematic review. Journal of Electromyography & Kinesiology. 28, 167-183 (2016).
- Stegeman, D. F., Blok, J. H., Hermens, H. J., Roeleveld, K. Surface EMG models: properties and applications. Journal of Electromyography & Kinesiology. 10 (5), 313-326 (2000).
- Zwarts, M. J., Stegeman, D. F. Multichannel surface EMG: basic aspects and clinical utility. Muscle Nerve. 28 (1), 1-17 (2003).
- Liu, J., et al. Non-invasive quantitative assessment of muscle force based on ultrasonic shear wave elastography. Ultrasound in Medicine and Biology. 45 (2), 440-451 (2019).
- Wang, A. B., Perreault, E. J., Royston, T. J., Lee, S. S. M. Changes in shear wave propagation within skeletal muscle during active and passive force generation. Journal of Applied Biomechanics. 94, 115-122 (2019).
- Brandenburg, J. E., et al. Quantifying passive muscle stiffness in children with and without cerebral palsy using ultrasound shear wave elastography. Developmental Medicine & Child Neurology. 58 (12), 1288-1294 (2016).
- Brandenburg, J. E., et al. Ultrasound elastography: the new frontier in direct measurement of muscle stiffness. Archives of Physical Medicine and Rehabilitation. 95 (11), 2207-2219 (2014).
- Brandenburg, J. E., et al. Feasibility and reliability of quantifying passive muscle stiffness in young children by using shear wave ultrasound elastography. Journal of Ultrasound in Medicine. 34 (4), 663-670 (2015).
- Eby, S. F., et al. Shear wave elastography of passive skeletal muscle stiffness: influences of sex and age throughout adulthood. Clinical Biomechanics. 30 (1), Bristol, Avon. 22-27 (2015).
- Eby, S. F., et al. Validation of shear wave elastography in skeletal muscle. Journal of Biomechanics. 46 (14), 2381-2387 (2013).
- Ingalls, C. P., Warren, G. L., Williams, J. H., Ward, C. W., Armstrong, R. B. E-C coupling failure in mouse EDL muscle after in vivo eccentric contractions. Journal of Applied Physiology. 85 (1), 58-67 (1998).
- Warren, G. L., Lowe, D. A., Armstrong, R. B. Measurement tools used in the study of eccentric contraction-induced injury. Sports Medicine. 27 (1), 43-59 (1999).
- Dobson, J. L., Gladden, L. B. Effect of rhythmic tetanic skeletal muscle contractions on peak muscle perfusion. Journal of Applied Physiology. 94 (1), 11-19 (2003).
- Fleming, B. C., Beynnon, B. D. In vivo measurement of ligament/tendon strains and forces: a review. Annals of Biomedical Engineering. 32 (3), 318-328 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved