Method Article
In vivo Medición del par isométrico del dorsiflexor de las extremidades posteriores de Pig
En este artículo
Resumen
El presente protocolo describe detalles experimentales concisos sobre la evaluación e interpretación de los datos de par in vivo obtenidos a través de la estimulación eléctrica del nervio peroneo común en cerdos anestesiados.
Resumen
La evaluación confiable de la fuerza del músculo esquelético es posiblemente la medida de resultado más importante en los estudios de enfermedades y lesiones neuromusculares y musculoesqueléticas, particularmente cuando se evalúa la eficacia de las terapias regenerativas. Además, un aspecto crítico de la traducción de muchas terapias regenerativas es la demostración de escalabilidad y efectividad en un modelo animal grande. Se han establecido varias preparaciones fisiológicas para evaluar las propiedades intrínsecas de la función muscular en estudios de ciencias básicas, principalmente en modelos de animales pequeños. Las prácticas se pueden clasificar en: in vitro (fibras aisladas, haces de fibras o músculo entero), in situ (músculo con vascularización e inervación intactas pero tendón distal unido a un transductor de fuerza) e in vivo (las estructuras del músculo o unidad muscular permanecen intactas). Hay fortalezas y debilidades en cada uno de estos preparativos; sin embargo, una clara ventaja de las pruebas de resistencia in vivo es la capacidad de realizar mediciones repetidas en el mismo animal. Aquí, se presentan los materiales y métodos para evaluar de manera confiable el par isométrico producido por los músculos dorsiflexores de las extremidades posteriores in vivo en respuesta a la estimulación eléctrica peronea estándar en cerdos anestesiados.
Introducción
La función principal del músculo esquelético es producir fuerza, lo que en última instancia hace posible actividades como respirar, comer y deambular. Las condiciones que reducen la capacidad funcional del músculo esquelético pueden conducir a una disminución del rendimiento (ocupacional o deportivo), discapacidad o muerte. Por ejemplo, el mantenimiento de la masa muscular y la función en poblaciones envejecidas se asocia positivamente con la calidad de vida y la capacidad de realizar actividades básicas e instrumentales de la vida diaria 1,2. Y, la disminución de la fuerza muscular en pacientes con distrofia muscular de Duchenne resulta en la incapacidad de deambular e insuficiencia respiratoria, lo que en última instancia contribuye a la mortalidad prematura 3,4,5. Por lo tanto, la medición de la fuerza muscular es una medida de resultado crítica en estudios que involucran enfermedades o lesiones neuromusculares.
El par isométrico o isocinético voluntario máximo (y/o índice de fatiga) se utiliza a menudo como índice de capacidad funcional en estudios clínicos6. En estudios con animales, las mediciones análogas se pueden hacer in vivo utilizando estimulación nerviosa eléctrica mientras se está bajo anestesia. En particular, las preparaciones in vivo son mínimamente invasivas con musculatura, tendones, vasculatura e inervación que permanecen intactos y, por lo tanto, permiten evaluaciones funcionales repetidas 7,8,9,10,11. Esta preparación se usa comúnmente en modelos de roedores pequeños y, en menor medida, en modelos animales más grandes como conejos12, perros 13,14, ovejas15 y cerdos16,17. El uso general de dicha metodología podría ser impactante para muchos estudios de investigación traslacional, como en modelos porcinos (cerdos) genéticamente modificados de atrofia muscular espinal (AME)18. Aquí se presentan métodos para evaluar el par isométrico máximo inducido por estimulación nerviosa del grupo muscular dorsiflexor porcino in vivo. Las técnicas presentadas se adaptaron inicialmente de las desarrolladas originalmente para evaluar el par muscular crural anterior del ratón19,20 y posteriormente se refinaron a través de la experiencia investigando la capacidad de producción de par después de una lesión 17,21,22,23,24,25,26,27,28 y durante el desarrollo16 en varios modelos porcinos.
Este protocolo destaca la medición isométrica de par in vivo mediante una metodología que requiere un ordenador integrado con una célula de carga y un estimulador eléctrico. Los métodos presentados aquí utilizan un aparato de prueba de placa de pie isométrica porcina integrado disponible comercialmente, un aparato de plataforma y el software correspondiente (consulte la Tabla de materiales). Sin embargo, la metodología se puede adaptar para utilizar otro software disponible comercialmente o hecho a medida, dispositivos de adquisición de datos y estimuladores. Estos métodos están diseñados para su uso en una sala quirúrgica dedicada a animales grandes repleta de equipos estándar, tales como: mesa quirúrgica de bloqueo, segunda mesa de bloqueo de igual altura para la plataforma de prueba, ventilador y dispositivos de monitoreo, y estera de calefacción u otros dispositivos para mantener la temperatura corporal.
Se necesitan los siguientes miembros del equipo para llevar a cabo estos métodos: un técnico de anestesia calificado y dos miembros del personal del estudio para realizar las pruebas funcionales. Estas personas trabajarán juntas para la estabilización inicial de la extremidad en el aparato de la plataforma. Luego, uno de los dos miembros del personal será responsable de la colocación / posicionamiento del electrodo y el otro de las aplicaciones informáticas durante las pruebas.
Protocolo
Todos los experimentos con animales se llevaron a cabo de conformidad con la Ley de Bienestar Animal, el Reglamento de Bienestar Animal de aplicación y los principios de la Guía para el Cuidado y Uso de Animales de Laboratorio. Las pruebas anteriores han demostrado que estos métodos son confiables26 y no tienen efectos adversos sobre la salud o la función de las extremidades del cerdo. Las pruebas se han realizado con una frecuencia tan frecuente como semanal sin ningún evento adverso23. Además, las intervenciones prequirúrgicas y postquirúrgicas durante el mismo día se pueden realizar sin ejercer un estrés adverso en el animal o inducir una disfunción neuromuscular.
1. Configuración de la computadora
- Asegúrese de que el ajuste inicial y la calibración del aparato y los componentes se realicen según las especificaciones de fabricación (consulte la Tabla de materiales). Se sugiere la calibración utilizando un rango de pesos de 0.2-2.5 kg.
NOTA: El par se mide mediante un pedal de 140 mm (0,14 m) conectado a un sensor de par lineal con una capacidad de 50 Newton-metro (N·m). La ganancia del instrumento se establece para escalar a 25 N·m de capacidad de forma predeterminada para que coincida mejor con la producción de par anticipada. La calibración se realiza aplicando una masa conocida (por ejemplo, 1 kg) al pedal a una distancia conocida (por ejemplo, 100 mm del eje de rotación) y calculando el par. Por ejemplo, 1 kg equivale a 9.806 N aplicado a 0.1 m es 0.9806 N·m torque. A continuación, se puede establecer una relación entre el par aplicado al sensor de par y la salida de voltaje correspondiente por el sensor de par. Los sensores de par del autor han confirmado la linealidad de esta relación de 0,2-20 kg aplicados a una placa de calibración particular de 40 cm. Debido a la longitud del pedal estándar, se recomienda un rango de calibración de 0,2-2,5 kg. Esto produce suficiente señal para calcular el factor de escala por regresión lineal. - Encienda la computadora, el estimulador, el sistema de transductor y la interfaz analógico-digital unos 30 minutos antes de la prueba para permitir la estabilización de los cambios de material relacionados con el calor que pueden afectar las propiedades eléctricas. Seleccione el dispositivo de adquisición de datos (DAQ) adecuado y conectado.
- Configurar parámetros experimentales en el software según sea necesario; el software permite una plantilla de estudio guardada. Prepárese para configurar el experimento (es decir, la plantilla de estudio) para crear un nuevo estudio mediante la opción Crear un nuevo libro de estudio.
NOTA: Los parámetros experimentales se pueden precargar antes de comenzar el estudio, lo que dará como resultado indicaciones para incluir información específica adicional del experimento, como el sexo, la masa corporal, la fecha de nacimiento, el punto de tiempo de la prueba, el grupo de tratamiento o variables similares según sea necesario. Los parámetros de configuración del estudio se pueden guardar y utilizar en todo el experimento. - Seleccione el estudio creado previamente al comienzo de cada evaluación. Agregue un nuevo animal si esta es la primera prueba para que el cerdo se pruebe y siga el mensaje para las variables ingresadas en el estudio.
- Haga clic en Preparar experimento una vez que esté listo para comenzar el estudio, que será necesario para optimizar la colocación de los electrodos. Administre contracciones repetidas al nervio mientras determina la colocación óptima una vez que se colocan los electrodos (consulte el paso 3.6).
- Haga clic en Configurar Instant Stim primero y luego ajuste la frecuencia del pulso, el ancho del pulso, el número de pulsos, la frecuencia del tren y el tiempo de ejecución.
- Luego, haga clic en Instant Sim para entregar contracciones repetidas. Alternativamente, presione el botón disparador manual en la unidad estimuladora para dar una contracción manualmente.
- Abra el Monitor de datos en vivo durante el protocolo de estudio cuando esté listo para comenzar todo el experimento para permitir la investigación / visualización en tiempo real de las contracciones. Haga clic en Ejecutar experimento cuando esté preparado para comenzar el experimento (después de la preparación del animal, consulte el paso 2).
2. Preparación y mantenimiento de la anestesia
- Los cerdos machos o hembras rápidos, 40-90 kg, durante la noche antes del evento de anestesia, permiten agua ad libitum. Obtenga y registre el peso corporal correcto del cerdo el día del procedimiento.
- Inducir anestesia con inyecciones intramusculares de tiletamina/zolzepam (Telazol, 4-6 mg/kg), xilazina (1-3 mg/kg) y propofol (2,6 mg/kg). Inicialmente mantener con 5% de isoflurano a través de mascarilla.
- Intubar al cerdo con un tubo endotraqueal y colocarlo en un ventilador automático. Mantenga al cerdo en presión máxima a 20 cm H2O, un volumen corriente inicial de 10 ml / kg y tasas de respiración a 8-12 respiraciones / min.
- Ajuste la configuración del ventilador para mantener una PCO2 de marea final de 40 ± 5 mmHg. Mantener la anestesia con isoflurano al 1%-3% en 30%-37% O2.
- Mantenga la temperatura corporal del cerdo a 37 °C durante la duración del protocolo. Inserte catéteres de vena del oído y Foley para la administración de líquidos y la recolección de orina, según sea necesario.
NOTA: El uso de anestesia del plano quirúrgico evitará las contracciones secundarias durante la prueba, especialmente de los músculos glúteos. - Controle la profundidad de la anestesia a través del reflejo y la posición ocular, la falta de tono de la mandíbula, la frecuencia cardíaca (rango 80-150 lpm), la presión arterial sistólica (rango 120-70 mmHg) o una combinación de todos estos signos.
- Prepare las extremidades posteriores derecha e izquierda una vez que el cerdo esté completamente anestesiado y estable, limpiando primero las extremidades con agua y jabón para eliminar cualquier residuo y luego afeitar el pelo de la piel. Preste mucha atención al área lateral de la rodilla, que se utilizará para la colocación de electrodos más adelante.
- Transporte al cerdo a una mesa quirúrgica y colóquelo de forma segura en posición supina. Coloque al cerdo hacia el pie de la mesa con los músculos glúteos en o ligeramente sobre el extremo de la mesa.
NOTA: Esto permitirá que la mesa quirúrgica y la mesa que sostiene el aparato de prueba se acompañen. - Extubar al cerdo después de la prueba y permitir que se recupere. La comida y el agua estándar para cerdos deben reemplazarse una vez que el cerdo esté completamente recuperado y pueda deambular libremente dentro de la jaula.
NOTA: La analgesia posterior al procedimiento es innecesaria solo para las pruebas in vivo ; sin embargo, carprofeno y/o buprenorfina SR se pueden proporcionar según recomendación veterinaria. Se recomienda consultar con un veterinario local. La anestesia y los medicamentos enumerados aquí son solo orientativos y actualmente están aprobados en la Universidad de Minnesota. El mantenimiento de la anestesia con isoflurano se eligió en función de su rápido inicio y compensación y su impacto mínimo en la estimulación nerviosa in vivo evocó el par29. Tenga cuidado de tener consistencia en los parámetros de anestesia en todos los estudios. Durante el protocolo, la evaluación y el registro de la anestesia se realizan a intervalos de 15 minutos; El registro se lleva a cabo sobre la base de las pautas y requisitos locales del Comité Institucional de Cuidado y Uso de Animales (IACUC) y el Departamento de Agricultura de los Estados Unidos (USDA).
3. Evaluación del par isométrico in vivo
- Coloque el pie en la placa del transductor de fuerza. Use un vendaje cohesivo flexible para unir el pie a la placa del pie.
NOTA: Es necesario un rol completo por pie; idealmente, el rol de 4 pulgadas x 5 yardas es adecuado. - Sostenga el pie en posición en la placa del pie con el tobillo en el neutro (A) y asegure el pie a la placa envolviendo el vendaje cohesivo alrededor del pie y la placa del pie al estilo de una cinta cerrada para tejer el tobillo (B).
NOTA: Se requerirá que los dos miembros del personal del estudio realicen simultáneamente las tareas individuales (A) y (B). - Coloque el tobillo en ángulo recto una vez que el pie esté asegurado a la placa del pie, definida como 0° o neutra para referencia de grados de plantar o dorsiflexión.
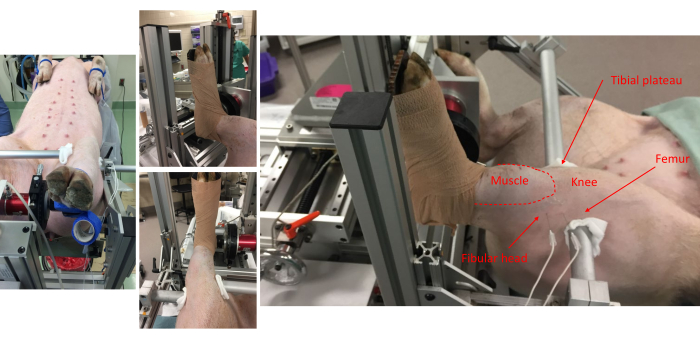
Figura 1: Las imágenes desde varios puntos de vista muestran la fijación del cerdo a la placa del pie y la alineación anatómica en el marco. Se observan puntos de referencia anatómicos para los músculos del compartimento anterior, la cabeza fibular, la rodilla, la meseta tibial y el fémur. Tenga en cuenta la colocación de pares de electrodos subdérmicos en el lado lateral de la pierna. Haga clic aquí para ver una versión más grande de esta figura.
- Estabilizar la rodilla y el tobillo en ángulo recto.
- Primero, coloque las barras de sujeción de las extremidades cerca de las ubicaciones necesarias. Cuando esté listo, comenzando en el aspecto medial de la extremidad, alinee la barra de sujeción de la extremidad aproximadamente en la meseta tibial.
- Luego, alinee la barra de sujeción de la extremidad lateral en la cabeza distal del fémur.
NOTA: Entre el extremo de cada extremidad, la barra de sujeción utiliza una gasa doblada de 4 x 4 para proteger la piel adyacente a la barra. - Estabilice las barras firmemente con los tornillos de bloqueo del pulgar.
NOTA: Las barras de sujeción de extremidades no estarán en línea entre sí, pero se alinearán con la anatomía del cerdo. - Limpie la piel alrededor de la cabeza del fibular aplicando alcohol al 70% a través de una gasa limpia en círculos concéntricos que comienzan en el centro de la colocación del electrodo previsto y se mueven hacia afuera. Coloque la aguja percutánea estéril (50 mm, 26 G monopolar) y los electrodos de estilo electromiográfico (EMG) (ver Tabla de materiales) a través del nervio peroneo. Electrodos de implante subdérmico, aproximadamente 5-10 mm.
- Optimice la colocación del electrodo utilizando amplitudes de corriente crecientes, según lo ajustado en el estimulador. Comience en 100 mA y aumente según sea necesario.
NOTA: Generalmente se requieren 300-500 mA para el par de contracción máximo. - Visualice la magnitud del par de contracción en la vista de datos en vivo y sobre el compartimiento anterior del cerdo; los cascos pueden jugar y moverse hacia arriba también.
- Asegúrese de que el compartimento posterior, o nervio tibial, no se active durante la estimulación. Inspeccione visualmente y palpe la contracción del compartimento posterior y el movimiento hacia abajo de los cascos durante la estimulación.
- Inspeccione la región de la meseta de la contracción tetánica a partir del rastreo de tiempo de par en vivo en los siguientes pasos para detectar la falta de reclutamiento muscular antagonista (es decir, la flexión plantar para este protocolo).
- Obtener un par tetánico isométrico máximo utilizando los siguientes parámetros de estimulación: 100 Hz, ancho de pulso de 0,1 ms, sobre un tren de 800 ms17, una vez optimizadas las amplitudes de colocación y estimulación del electrodo.
NOTA: Estos parámetros se pueden utilizar para diversas evaluaciones contráctiles.
4. Protocolo para el análisis del ángulo de la junta de par
- Mida el par tetánico isométrico máximo en un rango de posiciones del tobillo que van desde el neutro hasta los rangos extremos cercanos de la plantarflexión, o 0-50 ° de plantarflexión.
NOTA: El uso de incrementos de 10° requerirá seis contracciones, y el cambio incremental se puede ajustar para preguntas experimentales específicas. - Comience a aflojar ambos tornillos de bloqueo de la etapa del goniómetro para moverse entre los ángulos de la articulación. Asegúrese de que ambos tornillos de bloqueo estén apretados antes de la próxima contracción.
NOTA: El goniómetro está escrito con marcas de grado para permitir una alineación precisa. Es probable que sea 0° de flexión plantar, que se compensa con 180° en el goniómetro. Tenga cuidado para garantizar el posicionamiento previsto. - Determinar experimentalmente el tiempo entre las contracciones; sin embargo, 2 min es suficiente para evitar la fatiga.
NOTA: A medida que el ángulo de la articulación del tobillo cambia gradualmente, los electrodos de la aguja pueden cambiar. Puede ser necesario confirmar la colocación de los electrodos con contracciones de contracción, como se señaló anteriormente (ver paso 3.8).
5. Protocolo para el análisis de torque-frecuencia
- Coloque el tobillo en el ángulo articular deseado. Tenga cuidado, experimentalmente, de realizar pruebas en el mismo ángulo de articulación cada vez.
NOTA: Por lo general, los análisis de frecuencia de par se realizan en un solo ángulo de articulación correspondiente con el par isométrico máximo derivado del análisis de ángulo de par-articulación. El par máximo se produce a ~ 30-35 ° de plantarflexión. - Mida el par isométrico máximo en un rango de frecuencias de estimulación que inducen trenes de contracciones no fusionadas hasta y más allá de aquellos que inducen tetani completamente fusionados.
NOTA: Esto se puede lograr estimulando a 10, 20, 40, 60 y 100 Hz (ancho de pulso de 0.1 ms; tren de 800 ms) con 2 minutos entre cada contracción para evitar la fatiga. Dependiendo de las preguntas experimentales exactas y los modelos específicos de cerdos, las frecuencias pueden adaptarse. El sustrato bioenergético más probablemente utilizado durante una contracción de 800 ms para mantener el ATP intracelular es la fosfocreatina30, y la resíntesis de la fosfocreatina se basa en el transbordador de fosfocreatina31. La cinética de recuperación de fosfocreatina indica una recuperación notable del 90% o más entre 90-120 s después de que termina la contracción30. Por lo tanto, los intervalos de descanso recomendados entre las contracciones son de 90-120 s. Aunque, esto puede estar influenciado por diseños experimentales, incluyendo enfermedades musculares, lesiones y / o envejecimiento.
6. Análisis de datos
- Haga clic en Analizar resultados si todavía está en el software para abrir la ventana Análisis. Alternativamente, abra el programa análisis directamente.
- Ya sea utilizando una plataforma de datos automatizada o un análisis manual, calcule las diferentes variables en el análisis de formas de onda isométricas individuales.
NOTA: Estas variables incluyen: par de contracción máximo, par tetánico máximo y propiedades contráctiles relacionadas con contracciones y tetani, por ejemplo, tiempo hasta el pico y la relajación media. Muchas variables experimentales pueden normalizar la fuerza, por ejemplo, el peso corporal, el volumen muscular determinado a partir de resonancia magnética (imágenes por resonancia magnética) o TC (tomografía computarizada), o el peso muscular terminal. Se presentan tanto el par absoluto (N·m) como el par normalizado a la masa corporal (N·m/kg). El par de reposo colocado en la placa del pie diferirá entre los experimentos. Se debe aplicar una corrección de referencia para el par en reposo para garantizar que se registren la verdadera contracción máxima y los pares tetánicos. El par de referencia en cada ángulo de la articulación se registra y puede indicar cambios en el par pasivo.
Resultados
Anteriormente se ha informado de fiabilidad y optimización de los parámetros de ensayo in vivo del compartimento anterior del cerdo26. También se han reportado datos comparativos entre roedores y cerdos para la frecuencia de par27.
Durante la evaluación in vivo , se necesita la visualización de la forma de onda de par en tiempo real para garantizar la activación adecuada del compartimento anterior. Las formas de onda solo deben reflejar la dorsiflexión. Las formas de onda deben tener una apariencia lisa y redondeada y una meseta tetánica aparente (Figura 2A). Las inconsistencias o perturbaciones de la forma de onda indican varias limitaciones experimentales, como una estimulación inadecuada, una colocación inadecuada de electrodos o una profundidad inadecuada de la anestesia (Figura 2B).
La Figura 3A es un trazado de tiempo de par de contracción con una flecha que indica un par máximo del 50%. El tiempo hasta el pico de contracción debe comenzar al inicio del estimulador y terminar cuando se alcanza el par de contracción máximo (las barras de tiempo representativas se muestran debajo del trazado). La relajación media para una contracción debe comenzar en el par de contracción máximo y terminar en el par de contracción máximo del 50% (las barras de tiempo representativas se muestran debajo del trazado). La Figura 3B es un trazado tetánico de tiempo de par con una flecha que indica un par máximo del 50%. A diferencia de las contracciones que son ideales en términos de un par máximo definitivo y oportuno, las contracciones tetánicas tienen una mayor variabilidad en el momento del par máximo con respecto a cuándo comienza y termina el estimulador, lo que requiere un enfoque más matizado para el análisis de la propiedad contráctil. El tiempo hasta el pico de contracción debe comenzar con la iniciación del estimulador y detenerse en algún lugar entre el 90% y el 100% del par máximo. Las barras de tiempo de la Figura 3B muestran un corte del 95% de par máximo. Esto es útil en casos como los datos representativos seleccionados porque el par máximo no se alcanza hasta el final de la fase de meseta. Un análisis complementario al tiempo hasta el pico es la tasa promedio de contracción. Las barras discontinuas en la extremidad ascendente del trazado de tiempo de par representan un rango de 30% -70% de par máximo. La tasa promedio de contracción debe iniciarse al comienzo de la estimulación y capturar el cambio de tasa promedio entre el 30% y el 70% del par máximo. Estos son rangos recomendados, y los grupos de investigación individuales pueden determinar el rango ideal alrededor del 50% (por ejemplo, ±10%). La parte importante es ser consistente dentro y entre los estudios. En contraste con la contracción, la contracción tetánica de media relajación debe comenzar al final de la estimulación en lugar del par máximo por la misma razón mencionada anteriormente con el tiempo hasta el pico. Las barras de tiempo de la Figura 3B representan el tiempo transcurrido entre el final de la estimulación y alcanzar el 50% de relajación. Un análisis complementario a la relajación media es la tasa promedio de relajación. Las barras discontinuas en la extremidad descendente del trazado de par representan el mismo rango de par máximo del 30% al 70% que la extremidad ascendente. La tasa de relajación promedio debe comenzar al final de la estimulación y capturar la tasa promedio de cambio entre el 30% y el 70% del par máximo. Una vez más, estos son rangos recomendados. Una nota crítica: no confunda la tasa promedio de contracción/relajación con la tasa máxima de contracción/relajación. La tasa máxima representa el cambio de tasa más notable entre dos puntos de datos adyacentes y puede ser ampliamente variable.
Se pueden analizar varias propiedades de contracción y contráctil para obtener información sobre el tipo de fibra y los atributos de acoplamiento excitación-contracción de los músculos esqueléticos10,32. Se advierte sobreinterpretación de las propiedades de contracción y contráctil; representan sugerencias y razones para un mayor interrogatorio a nivel celular y no son necesariamente indicativos. En general, las tasas de contractilidad pueden reflejar la liberación de calcio del retículo sarcoplásmico y la tasa enzimática de la isoforma de cadena pesada de miosina. Por el contrario, las tasas de relajación pueden reflejar la tasa de enzima ATPasa de sarco(endo)plásmico retículo de calcio e isoforma. Estas propiedades pueden estar influenciadas por la fatiga, el daño muscular, el entrenamiento con ejercicios y numerosas patologías (por ejemplo, atrofia por desuso).
La Figura 4 muestra valores representativos para las relaciones de ángulo torque-frecuencia y torque-articulación para extremidades no lesionadas. Estos datos son representativos de una amplia gama de tamaños de cerdo.
Se realizó un análisis experimental representativo de la EMG de superficie durante el análisis muscular in vivo (Figura 5) para demostrar el control experimental de la codificación de la tasa y la actividad muscular total. Se colocaron electrodos adhesivos EMG en la mitad del vientre del peroneus tertius. Se colocó un electrodo de tierra en la rodilla para minimizar el artefacto de estimulación, y se colocaron agujas de electrodo de estimulación alrededor del nervio peroneo proximal a la ubicación muscular. Se realizaron grabaciones simultáneas de torque y EMG a frecuencias de estimulación de 20, 60 y 100 Hz. El número de pulsos estimuladores (barras rojas en la Figura 5) refleja el cociente de duración de la estimulación y el tiempo entre pulsos. Por ejemplo, una frecuencia de estimulación de 20 Hz significa un pulso cada 50 ms; por lo tanto, la duración de la estimulación de 400 ms dividida por 50 ms entre pulsos equivale a ocho pulsos entregados (Figura 5A). Los pulsos estimuladores se entregan al axón nervioso a través de la colocación de electrodos de aguja percutánea y producen un número similar de pulsos musculares eléctricos (es decir, 20 Hz equivale a 8 grabaciones EMG), lo que demuestra el control experimental de la frecuencia potencial de acción del grupo muscular de interés. Las grabaciones de EMG en bruto se pueden convertir a través del análisis raíz-media-cuadrado (EMG RMS) para visualizar la actividad muscular total con una frecuencia de estimulación creciente. El análisis del área bajo la curva (AUC) es una forma de cuantificar el EMG RMS para determinar los cambios en la actividad muscular total. Se proporcionan AUC representativas para cada frecuencia de estimulación EMG RMS (Figura 5A-C).
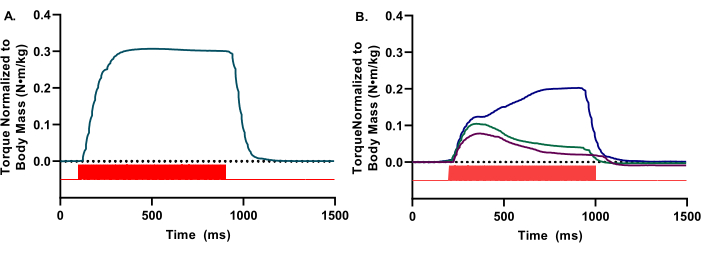
Figura 2: Formas de onda representativas de alta y baja calidad. (A) Formas de onda isométricas presentes en una apariencia de onda cuadrada, con una notable meseta fluida. (B) Las formas de onda de baja calidad pueden deberse a una estimulación inadecuada o a una colocación inadecuada de los electrodos. En estos casos, es necesario reposicionar los electrodos. Tanto para A como para B, se indican los pulsos estimuladores (barras rojas). Haga clic aquí para ver una versión más grande de esta figura.
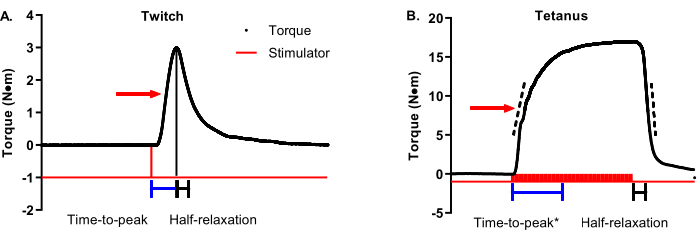
Figura 3: Contracción y análisis de la propiedad contráctil tetánica. (A) Los trazados de tiempo de torsión de contracción representativo (1 Hz) y (B) tetánico (100 Hz) se modifican para detallar las propiedades contráctiles. La flecha roja en cada gráfico muestra un par máximo del 50%. Las barras azules y negras debajo de los trazados muestran duraciones de tiempo de tiempo hasta el pico y medio tiempo de relajación, respectivamente. Las barras discontinuas en las extremidades ascendentes y descendentes del trazado tetánico de tiempo de par representan un rango de 30% -70% de par máximo que se puede utilizar para determinar la tasa promedio de contracción o relajación. Haga clic aquí para ver una versión más grande de esta figura.
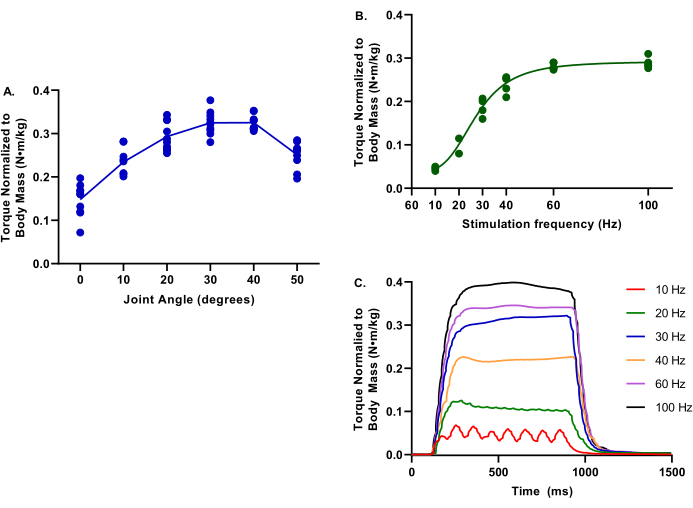
Figura 4: Datos de ejemplo de ángulo de par-articulación y torque-frecuencia. Los datos proporcionados provienen de una variedad de hembras de cerdos yorkshire cross a los 2,9-6,3 meses; 39,4-75,4 kg de masa corporal; todos considerados control saludable en el momento de la evaluación. Durante todas las pruebas, la temperatura corporal central se mantuvo a 37 °C. (A) El par normalizado a la masa corporal se evalúa en las articulaciones del tobillo de 0-50 ° de plantarflexión; tenga en cuenta que el par máximo está determinado a 30°. (B) El par normalizado a la masa corporal se evalúa en varias frecuencias de estimulación de 10-100 Hz; Nótese que estas evaluaciones se realizaron con la articulación del tobillo a 30° de plantarflexión. (C) Se evaluaron los trazados de par individuales para cada una de las frecuencias de estimulación. Haga clic aquí para ver una versión más grande de esta figura.
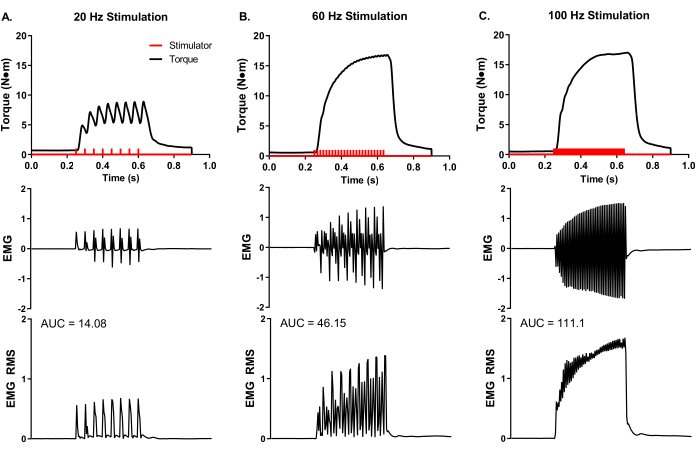
Figura 5: Mediciones simultáneas de par isométrico in vivo y EMG. Registros simultáneos de EMG y torque a frecuencias de estimulación representativas de (A) 20, (B) 60 y (C) 100 Hz recolectadas de un cerdo hembra de Yorkshire (~ 90 kg de masa corporal). Los pulsos estimuladores (barras rojas) se administraron de acuerdo con la frecuencia de estimulación establecida. Los registros de EMG en bruto se convirtieron a raíz-media-cuadrada (EMG RMS) para visualizar la actividad muscular total con una frecuencia de estimulación creciente. Se analizaron curvas EMG RMS representativas para el área bajo la curva (AUC), y se proporcionan AUC para cada frecuencia de estimulación. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Pasos críticos, modificaciones y solución de problemas
Para minimizar la variabilidad de los datos y maximizar el éxito del enfoque, se destacan los siguientes pasos críticos.
Estimulación nerviosa óptima
Este enfoque experimental comienza con la despolarización del axón nervioso y se basa en la colocación correcta de los electrodos y la estimulación eléctrica optimizada. Un análisis post mortem de la anatomía nerviosa relacionada con los puntos de referencia óseos puede ayudar a visualizar la colocación adecuada de los electrodos durante las pruebas. La adquisición del par de contracción máximo ayuda a determinar la corriente apropiada (en miliamperios; mA) entregada al axón nervioso. Hay dos valores a tener en cuenta al optimizar la estimulación nerviosa al inicio de las pruebas: (1) la relación contracción-tetánica es de ~1:5, por ejemplo, ~2 N·m de par de contracción corresponde a un par de contracción de 10 N·m (Figura 3); y (2) el par típico a la masa corporal es de ~0,3 N·m por kg de masa corporal (Figura 4). Si los pares de contracción máximos parecen bajos, retire los electrodos e intente otra colocación. Asegúrese de verificar la configuración del estimulador, las conexiones BNC y las conexiones de electrodos. La colocación del electrodo puede ser necesaria entre las contracciones si hay demasiado movimiento durante el posicionamiento de la extremidad entre los ángulos de las articulaciones, como se señaló anteriormente (Figura 2). Tenga en cuenta que los enfoques experimentales e intervencionistas podrían afectar estos valores.
Alineación biomecánica adecuada
La longitud del músculo inicial influye en la fuerza contráctil muscular (la relación longitud-tensión), y la longitud muscular puede cambiar según la alineación de la articulación de la cadera, la rodilla y el tobillo. Los ángulos articulares deben estandarizarse entre las extremidades y entre los cerdos. Se recomienda encarecidamente un ángulo de 90 ° de la articulación del tobillo para la cadera y la rodilla. Una posición de tobillo ligeramente plantarflexionada (~ 30 ° desde el ángulo neutro de la articulación del tobillo de 0 °) es óptima para la fuerza máxima. Refleja la posición anatómica natural de la articulación del tobillo tanto en cerdos como en perros mientras están de pie. Todas las uniones también deben ser paralelas con el pedal y los transductores de par para evitar la pérdida de par medible debido a la contribución de un vector de par perpendicular. Se recomienda encarecidamente inspeccionar los ángulos de la articulación cadera-rodilla-tobillo y la alineación de la articulación pie-pedal-articulación después de asegurar el pie al pedal y asegurar la articulación de la rodilla con las barras de sujeción de la extremidad (Figura 1). Si hay desalineación, desbloquee y retire las barras y vuelva a colocar al cerdo en la mesa quirúrgica. Si bien la estandarización de los ángulos conjuntos entre los estudios es fundamental para minimizar la varianza de los datos, existen limitaciones para la alineación biomecánica que son notables, que se analizan a continuación.
Importancia con respecto a los métodos existentes o alternativos
Los ejemplos alterativos de evaluaciones clínicamente relevantes y no invasivas de la función muscular que podrían usarse para modelos porcinos incluyen la distancia a pie en cinta de correr, la EMG y la electrografía de onda de cizallamiento muscular activa. Como la prueba de caminata de 6 minutos en humanos, una prueba de caminata en cinta puede evaluar la progresión de la enfermedad y el éxito de la intervención en animales grandes 33,34,35. Por lo general, después de un período de aclimatación, los animales se caminan hasta el final del cumplimiento a diferentes velocidades de cinta de correr y / o niveles de inclinación. Las recompensas alimentarias a menudo son necesarias para lograr la máxima motivación. Sin embargo, los resultados de caminar en cinta de correr ofrecen solo interpretaciones indirectas de la función contráctil muscular debido a limitaciones como la motivación del sujeto, el reclutamiento de unidades motoras no máximas y la codependencia inherente de otros sistemas corporales como los sistemas cardiovascular, esquelético y respiratorio.
Por otro lado, EMG ofrece una evaluación directa ligeramente mejor del sistema muscular esquelético, ya que los electrodos EMG se colocan directamente sobre el grupo muscular de interés 36,37,38. Los electrodos EMG luego miden la actividad muscular colectiva (fibras musculares despolarizadas). Esta actividad muscular se basa en el reclutamiento de unidades motoras y la codificación de la tasa (la frecuencia de los potenciales de acción enviados a las unidades motoras reclutadas). Sin embargo, separar las contribuciones relativas del reclutamiento de unidades motoras versus la codificación de tasas es imposible con EMG de superficie. Además, EMG se basa en la voluntad del sujeto para generar contracciones máximas, y este nivel de cooperación es poco probable en modelos de animales grandes. Si bien puede ser informativo evaluar los cambios en la EMG durante el ciclo de la marcha, estos datos no representan una capacidad funcional máxima del grupo muscular esquelético de interés. Las imágenes basadas en ultrasonido que utilizan el modo B y la elastografía de onda de corte es otra modalidad no invasiva utilizada para evaluar la función muscular. Existe una buena correlación entre el módulo de Young medido por elastografía y el aumento de las cargas musculares 39,40. La elastografía de onda de cizallamiento ha sido validada y utilizada como medida cuantitativa de la rigidez pasiva del tejido 41,42,43,44,45, incluso en un modelo de lesión por pérdida muscular volumétrica porcina23. También se puede utilizar como una medida indirecta de la producción de fuerza muscular activa39. Sin embargo, las limitaciones similares a EMG para la disposición del sujeto y la cooperación para realizar contracciones todavía están presentes.
El protocolo in vivo descrito aquí, en contraste con la distancia de caminata en cinta rodante y EMG, proporciona una evaluación confiable, reproducible y máxima de la función muscular. Este protocolo evoca las contracciones musculares de una manera controlada y cuantificable que es independiente de la motivación. Específicamente, los electrodos percutáneos se utilizan para estimular los axones nerviosos que evitan el sistema nervioso central. La despolarización de los axones nerviosos involucra a todas las unidades motoras eliminando la variabilidad asociada con el reclutamiento de unidades motoras. Además, el investigador controla la codificación de la tasa (frecuencia de estimulación). La fisiología neuromuscular resultante que se aplica a este enfoque comienza con la activación del canal de sodio dependiente de voltaje en los nodos de Ranvier. Toda la fisiología posterior (o aguas abajo) está comprometida, incluido el acoplamiento excitación-contracción y el ciclo de puente cruzado. Una ventaja significativa del análisis muscular no invasivo in vivo es que la función muscular contráctil se puede medir repetidamente, por ejemplo, semanalmente, para controlar la fuerza muscular después de una lesión, intervención o sobre la progresión de una enfermedad.
Limitaciones del método
El equipo in vivo descrito en este protocolo permite el par isométrico pasivo y activo en función del ángulo articular y la frecuencia de estimulación. El aparato de prueba utilizado no admite la medición de contracciones dinámicas (por ejemplo, contracciones isocinéticas excéntricas o concéntricas). El aparato permite un rango de movimiento de 105 ° para caracterizar la relación de ángulo de par-articulación y utiliza una célula de carga con un rango de par máximo de ~ 50 N·m. Las preguntas experimentales específicas pueden requerir características de rendimiento fuera de estas especificaciones. En particular, la célula de carga en este aparato descrito puede cambiarse por mayores rangos de par si es necesario.
El protocolo descrito aquí para medir la fuerza neuromuscular máxima in vivo tiene limitaciones notables. Primero, este método requiere anestesia, que puede llevarse a cabo de manera diferente según los protocolos y recursos de las instalaciones para animales. Se sabe que los anestésicos tienen efectos variables sobre la función neuromuscular y se ha demostrado que alteran la producción de par dorsiflexor in vivo del ratón de una manera anestésica y dependiente de la dosis29. Los efectos diferenciales de los anestésicos sobre el par in vivo de los animales grandes no están claros; por lo tanto, los grupos de control y experimentales deben tener los mismos agentes anestésicos (por ejemplo, todos los grupos a los que se les administró ketamina) para controlar esta variabilidad. En segundo lugar, la dependencia de los patrones de difusión in vivo limita la exploración de los mecanismos celulares de la disfunción contráctil y las toxicidades agudas de los medicamentos. Por ejemplo, la cafeína se puede utilizar durante las pruebas de baño de órganos in vitro de un músculo aislado para estimular la liberación de calcio del retículo sarcoplásmico, evitando el acoplamiento excitación-contracción46 directamente. La cantidad de cafeína para inducir este efecto (mM) es letal en un entorno in vivo . Las influencias de los medicamentos en todo el cuerpo (por ejemplo, el estrés renal / hepático) y los factores posteriores secretados en la circulación deberán considerarse si este enfoque se utiliza para la detección de drogas en la fuerza muscular aguda23. En tercer lugar, el uso de la estimulación nerviosa eléctrica máxima se desvía de las estrategias de reclutamiento voluntario, como se discutió anteriormente, y por lo tanto no refleja los cambios en la fuerza que pueden deberse a las adaptaciones de reclutamiento neuromuscular.
Las mediciones de par in vivo también pueden limitarse con respecto al establecimiento de un mecanismo específico para las observaciones experimentales. Por ejemplo, el torque alrededor de la articulación del tobillo depende no solo de la producción de fuerza muscular, sino también del tendón y las propiedades del tejido conectivo y articular. Además, la fuerza es generada por grupos de músculos, específicamente los flexores plantares (músculos gastrocnemio, sóleo y plantaris) y los dorsiflexores (músculos peroneus tertius, tibialis y digitorum) en cerdos. Por lo tanto, las interpretaciones de los datos de par máximo in vivo requieren la consideración de posibles cambios musculotendinosos y anatómicos y se limitan a los grupos musculares, no a los músculos individuales. Relacionadamente, los grupos musculares a menudo se componen de una mezcla de fibras musculares predominantemente rápidas y lentas, como el músculo gastrocnemio y el músculo sóleo, respectivamente, de los flexores plantares. Las propiedades contráctiles como la tasa de contracción y relajación (o el tiempo de contracción hasta el pico y el tiempo de relajación media) no son indicadores confiables de la fisiología del tipo de fibra que utiliza preparaciones musculares in vivo versus aisladas, como los protocolos de prueba in vitro o in situ 47. Las preparaciones musculares aisladas también son superiores en la comprensión de la influencia de los parámetros biomecánicos en la función muscular porque propiedades como la longitud muscular se pueden controlar con precisión; es importante enfatizar que la relación ángulo-par articular no es directamente equivalente a la relación longitud-fuerza muscular, ya que las propiedades del tendón (por ejemplo, holgura), músculo (por ejemplo, ángulo de pennación, superposición de sarcómeros) y articulación (por ejemplo, brazo de momento) que contribuyen a la producción de par dependen del ángulo de la articulación. Con ese fin, las pruebas funcionales in situ en animales grandes48 podrían ser una valiosa adición a las pruebas in vivo, teniendo en cuenta que las pruebas in situ son un experimento terminal. Otros avances al protocolo actual que pueden explorarse en el futuro para mejorar la comprensión mecanicista de los hallazgos experimentales incluyen el uso de imágenes de ultrasonido en modo B para medir las propiedades arquitectónicas musculares y tendinosas y la implantación de un transductor de fuerza tendinosa para medir la fuerza muscular durante las contracciones voluntarias y estimuladas eléctricamente49.
Importancia y aplicaciones potenciales del método
Este protocolo evalúa la capacidad de producción de par in vivo del grupo muscular dorsiflexor porcino, demostrando un método no invasivo para evaluar la ganancia o pérdida de la función muscular en un entorno fisiológico. Debido a que la metodología no es terminal para el cerdo, también se puede utilizar para evaluar la función muscular en los mismos sujetos longitudinalmente durante la progresión de una enfermedad, o antes, durante y siguiendo una estrategia de tratamiento. Como tal, un diseño experimental de medidas repetidas puede permitir comparaciones estadísticas robustas con mayor potencia y menos animales en comparación con medidas independientes. Además, la disfunción del músculo esquelético es un componente destacado de diversos procesos y afecciones de enfermedades, como el desgaste muscular asociado a enfermedades crónicas (por ejemplo, insuficiencia cardíaca, insuficiencia renal, SIDA, cáncer, etc.), distrofia muscular, enfermedades neurodegenerativas (por ejemplo, AME o esclerosis lateral amiotrófica; ELA), envejecimiento (es decir, sarcopenia) y toxicidades por drogas. La capacidad funcional del músculo esquelético es una medida de resultado primaria crítica para intervenciones como el ejercicio, la nutrición y las terapias farmacológicas y de medicina regenerativa. Por lo tanto, el protocolo descrito en este documento para evaluar de manera confiable la capacidad de producción de par porcino in vivo puede usarse en numerosas aplicaciones de estudio. Puede ser fundamental en la adquisición de datos extensos de animales para la traducción de terapias en desarrollo.
Divulgaciones
Las opiniones o afirmaciones contenidas aquí son los puntos de vista privados de los autores. No deben interpretarse como oficiales o como reflejo de las opiniones del Departamento del Ejército, el Departamento de Defensa o el Gobierno de los Estados Unidos.
La producción del artículo de video y la disponibilidad de acceso abierto fue patrocinada por Aurora Scientific, Inc. Matthew Borkowski es empleado de Aurora Scientific Inc. Esta empresa puede beneficiarse potencialmente de los resultados de la investigación.
Agradecimientos
El trabajo y los datos presentados fueron ampliamente respaldados por el Comando de Investigación Médica y Materiales del Ejército de los Estados Unidos a BTC y SMG (#MR140099; #C_003_2015_USAISR; #C_001_2018_USAISR); y el Departamento de Asuntos de Veteranos, Administración de Salud de Veteranos, Oficina de Investigación y Desarrollo (I21 RX003188) a JAC y al Dr. Luke Brewster. Los autores agradecen al Servicio Veterinario y a las Ramas de Patología Comparada del USAISR y al Centro de Imágenes Preclínicas Avanzadas de la UMN por la asistencia técnica para completar estos estudios.
Materiales
| Name | Company | Catalog Number | Comments |
| 615A Dynamic Muscle Control LabBook and Analysis Software Suite | Aurora Scientific Inc. | 615A | Compatible Win Vista/7/10 |
| 892A Swine Isometric Footplate Test Apparatus | Aurora Scientific Inc. | 892A | Includes Isometric Load Cell, Pig Footplate, Goniometer stage and positioners |
| Calibration Weights | Ohaus or similar | 80850116 | |
| Computer | Aurora Scientific or any vendor | 601A | Computer must include data acquisition card and interface for software |
| Gauze pad | Various vendors | 4 by 4 squares or similar | |
| Monopolar Needle Electrodes | Chalgren, Electrode Store, or similar vendor | 242-550-24TP, or DTM-2.00SAF | |
| Non-adhesive Flexiable Tape | 3M, Coflex, or similar | 4 inch by 5 yard role | |
| Stimulator | Aurora Scientific or comparable | 701C | Must include constant current stimulation mode |
Referencias
- Verlaan, S., et al. Nutritional status, body composition, and quality of life in community-dwelling sarcopenic and non-sarcopenic older adults: A case-control study. Clinical Nutrition. 36 (1), 267-274 (2017).
- Wang, D. X. M., Yao, J., Zirek, Y., Reijnierse, E. M., Maier, A. B. Muscle mass, strength, and physical performance predicting activities of daily living: a meta-analysis. Journal of Cachexia, Sarcopenia and Muscle. 11 (1), 3-25 (2020).
- Ishikawa, Y., et al. Duchenne muscular dystrophy: survival by cardio-respiratory interventions. Neuromuscular Disorders. 21 (1), 47-51 (2011).
- Khirani, S., et al. Respiratory muscle decline in Duchenne muscular dystrophy. Pediatric Pulmonology. 49 (5), 473-481 (2014).
- Ziter, F. A., Allsop, K. G., Tyler, F. H. Assessment of muscle strength in Duchenne muscular dystrophy. Neurology. 27 (10), 981-984 (1977).
- Garg, K., et al. Volumetric muscle loss: persistent functional deficits beyond frank loss of tissue. Journal of Orthopaedic Research. 33 (1), 40-46 (2015).
- Lovering, R. M., Roche, J. A., Goodall, M. H., Clark, B. B., McMillan, A. An in vivo rodent model of contraction-induced injury and non-invasive monitoring of recovery. Journal of Visualized Experiments: JoVE. (51), e2782 (2011).
- Mintz, E. L., Passipieri, J. A., Lovell, D. Y., Christ, G. J. Applications of in vivo functional testing of the rat tibialis anterior for evaluating tissue engineered skeletal muscle repair. Journal of Visualized Experiments: JoVE. (116), e54487 (2016).
- Call, J. A., Warren, G. L., Verma, M., Lowe, D. A. Acute failure of action potential conduction in mdx muscle reveals new mechanism of contraction-induced force loss. The Journal of Physiology. 591, 3765-3776 (2013).
- Call, J. A., Eckhoff, M. D., Baltgalvis, K. A., Warren, G. L., Lowe, D. A. Adaptive strength gains in dystrophic muscle exposed to repeated bouts of eccentric contraction. The Journal of Physiology. 111 (6), 1768-1777 (2011).
- Ingalls, C. P., Wenke, J. C., Nofal, T., Armstrong, R. B. Adaptation to lengthening contraction-induced injury in mouse muscle. The Journal of Physiology. 97 (3), 1067-1076 (2004).
- Hyman, S. A., et al. In vivo supraspinatus muscle contractility and architecture in rabbit. The Journal of Physiology. 129 (6), 1405-1412 (2020).
- Childers, M. K., Grange, R. W., Kornegay, J. N. In vivo canine muscle function assay. Journal of Visualized Experiments: JoVE. (50), e2623 (2011).
- Grange, R. W., et al. Muscle function in a canine model of X-linked myotubular myopathy. Muscle & Nerve. 46 (4), 588-591 (2012).
- Novakova, S. S., et al. Repairing volumetric muscle loss in the ovine peroneus tertius following a 3-month recovery. Tissue Engineering Part A. , (2020).
- Maeng, G., et al. Humanized skeletal muscle in MYF5/MYOD/MYF6-null pig embryos. Nature Biomedical Engineering. , (2021).
- Ward, C. L., et al. Autologous minced muscle grafts improve muscle strength in a porcine model of volumetric muscle loss injury. Journal of Orthopaedic Trauma. 30 (12), 396-402 (2016).
- Prather, R. S., Lorson, M., Ross, J. W., Whyte, J. J., Walters, E. Genetically engineered pig models for human diseases. Annual Review of Animal Biosciences. 1, 203-219 (2013).
- Lowe, D. A., Warren, G. L., Ingalls, C. P., Boorstein, D. B., Armstrong, R. B. Muscle function and protein metabolism after initiation of eccentric contraction-induced injury. Journal of Applied Physiology. 79 (4), 1260-1270 (1995).
- Ashton-Miller, J. A., He, Y., Kadhiresan, V. A., McCubbrey, D. A., Faulkner, J. A. An apparatus to measure in vivo biomechanical behavior of dorsi- and plantarflexors of mouse ankle. Journal of Applied Physiology. 72 (3), 1205-1211 (1992).
- Chao, T., Burmeister, D. M., Corona, B. T., Greising, S. M. Oxidative pathophysiology following volumetric muscle loss injury in a porcine model. Journal of Applied Physiology. 126 (6), 1541-1549 (2019).
- Corona, B. T., Greising, S. M. Challenges to acellular biological scaffold mediated skeletal muscle tissue regeneration. Biomaterials. 104, 238-246 (2016).
- Corona, B. T., Rivera, J. C., Dalske, K. A., Wenke, J. C., Greising, S. M. Pharmacological Mitigation of Fibrosis in a Porcine Model of Volumetric Muscle Loss Injury. Tissue Engineering Part A. , (2020).
- Corona, B. T., Rivera, J. C., Greising, S. M. Inflammatory and physiological consequences of debridement of fibrous tissue after volumetric muscle loss injury. Clinical and Translational Science. 11 (2), 208-217 (2018).
- Corona, B. T., Rivera, J. C., Wenke, J. C., Greising, S. M. Tacrolimus as an adjunct to autologus minced muscle grafts for the repair of a volumetric muscle loss injury. Journal of Experimental Orthopaedics. 4 (1), 36 (2017).
- Greising, S. M., et al. Unwavering pathobiology of volumetric muscle loss injury. Scientific Reports. 7 (1), 13179 (2017).
- Pollot, B. E., Corona, B. T. Volumetric muscle loss. Methods in Molecular Biology. 1460, 19-31 (2016).
- Kheirabadi, B. S., et al. Long-term effects of Combat Ready Clamp application to control junctional hemorrhage in swine. The Journal of Trauma and Acute Care Surgery. 77 (3), 101-108 (2014).
- Ingalls, C. P., Warren, G. L., Lowe, D. A., Boorstein, D. B., Armstrong, R. B. Differential effects of anesthetics on in vivo skeletal muscle contractile function in the mouse. Journal of Applied Physiology. 80 (1), 332-340 (1996).
- Forbes, S. C., Paganini, A. T., Slade, J. M., Towse, T. F., Meyer, R. A. Phosphocreatine recovery kinetics following low- and high-intensity exercise in human triceps surae and rat posterior hindlimb muscles. American Journal of Physiology. Regulatory, Integrative and Comparative Physiology. 296 (1), 161-170 (2009).
- Meyer, R. A., Sweeney, H. L., Kushmerick, M. J. A simple analysis of the "phosphocreatine shuttle.". American Journal of Physiology. 246 (5), 365-377 (1984).
- McKeehen, J. N., et al. Adaptations of mouse skeletal muscle to low-intensity vibration training. Medicine & Science in Sports & Exercise. 45 (6), 1051-1059 (2013).
- Boakye, M., et al. Treadmill-based gait kinematics in the yucatan mini pig. Journal of Neurotrauma. 37 (21), 2277-2291 (2020).
- Woodman, C. R., Muller, J. M., Laughlin, M. H., Price, E. M. Induction of nitric oxide synthase mRNA in coronary resistance arteries isolated from exercise-trained pigs. American Journal of Physiology. 273 (6), 2575-2579 (1997).
- Boddy, K. N., Roche, B. M., Schwartz, D. S., Nakayama, T., Hamlin, R. L. Evaluation of the six-minute walk test in dogs. American Journal of Veterinary Research. 65 (3), 311-313 (2004).
- Valentin, S., Zsoldos, R. R. Surface electromyography in animal biomechanics: A systematic review. Journal of Electromyography & Kinesiology. 28, 167-183 (2016).
- Stegeman, D. F., Blok, J. H., Hermens, H. J., Roeleveld, K. Surface EMG models: properties and applications. Journal of Electromyography & Kinesiology. 10 (5), 313-326 (2000).
- Zwarts, M. J., Stegeman, D. F. Multichannel surface EMG: basic aspects and clinical utility. Muscle Nerve. 28 (1), 1-17 (2003).
- Liu, J., et al. Non-invasive quantitative assessment of muscle force based on ultrasonic shear wave elastography. Ultrasound in Medicine and Biology. 45 (2), 440-451 (2019).
- Wang, A. B., Perreault, E. J., Royston, T. J., Lee, S. S. M. Changes in shear wave propagation within skeletal muscle during active and passive force generation. Journal of Applied Biomechanics. 94, 115-122 (2019).
- Brandenburg, J. E., et al. Quantifying passive muscle stiffness in children with and without cerebral palsy using ultrasound shear wave elastography. Developmental Medicine & Child Neurology. 58 (12), 1288-1294 (2016).
- Brandenburg, J. E., et al. Ultrasound elastography: the new frontier in direct measurement of muscle stiffness. Archives of Physical Medicine and Rehabilitation. 95 (11), 2207-2219 (2014).
- Brandenburg, J. E., et al. Feasibility and reliability of quantifying passive muscle stiffness in young children by using shear wave ultrasound elastography. Journal of Ultrasound in Medicine. 34 (4), 663-670 (2015).
- Eby, S. F., et al. Shear wave elastography of passive skeletal muscle stiffness: influences of sex and age throughout adulthood. Clinical Biomechanics. 30 (1), 22-27 (2015).
- Eby, S. F., et al. Validation of shear wave elastography in skeletal muscle. Journal of Biomechanics. 46 (14), 2381-2387 (2013).
- Ingalls, C. P., Warren, G. L., Williams, J. H., Ward, C. W., Armstrong, R. B. E-C coupling failure in mouse EDL muscle after in vivo eccentric contractions. Journal of Applied Physiology. 85 (1), 58-67 (1998).
- Warren, G. L., Lowe, D. A., Armstrong, R. B. Measurement tools used in the study of eccentric contraction-induced injury. Sports Medicine. 27 (1), 43-59 (1999).
- Dobson, J. L., Gladden, L. B. Effect of rhythmic tetanic skeletal muscle contractions on peak muscle perfusion. Journal of Applied Physiology. 94 (1), 11-19 (2003).
- Fleming, B. C., Beynnon, B. D. In vivo measurement of ligament/tendon strains and forces: a review. Annals of Biomedical Engineering. 32 (3), 318-328 (2004).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados