Method Article
In vivo Medição do Torque Isométrico Dorsiflexor Hindlimb do Porco
Neste Artigo
Resumo
O presente protocolo descreve detalhes experimentais concisos sobre a avaliação e interpretação dos dados de torque in vivo obtidos por estimulação elétrica do nervo peroneal comum em suínos anestesiados.
Resumo
A avaliação confiável da força muscular esquelética é, sem dúvida, a medida de desfecho mais importante nos estudos de doenças neuromusculares e musculoesqueléticas e lesões, particularmente quando se avalia a eficácia das terapias regenerativas. Além disso, um aspecto crítico da tradução de muitas terapias regenerativas é a demonstração de escalabilidade e eficácia em um grande modelo animal. Várias preparações fisiológicas foram estabelecidas para avaliar propriedades da função muscular intrínseca em estudos científicos básicos, principalmente em pequenos modelos animais. As práticas podem ser categorizadas como: in vitro (fibras isoladas, feixes de fibras ou músculo inteiro), in situ (músculo com vascularização intacta e inervação, mas tendão distal ligado a um transdutor de força) e in vivo (estruturas do músculo ou unidade muscular permanecem intactas). Há pontos fortes e fracos em cada uma dessas preparações; no entanto, uma clara vantagem dos testes de força in vivo é a capacidade de realizar medições repetidas no mesmo animal. Aqui, são apresentados os materiais e métodos para avaliar de forma confiável o torque isométrico produzido pelos músculos dorsiflexor de escalada traseira in vivo em resposta à estimulação elétrica peroneal padrão em suínos anestesiados.
Introdução
A função primária do músculo esquelético é produzir força, o que acaba por possibilitar atividades como respirar, comer e ambulação. Condições que reduzem a capacidade funcional do músculo esquelético podem levar à diminuição do desempenho (ocupacional ou esporte), incapacidade ou morte. Por exemplo, a manutenção da massa muscular e da função em populações envelhecidas está positivamente associada à qualidade de vida e à capacidade de realizar atividades básicas e instrumentais da vida diária 1,2. E, a diminuição da força muscular em pacientes com distrofia muscular de Duchenne resulta na incapacidade de ambulação e insuficiência respiratória, contribuindo para a mortalidade prematura 3,4,5. Assim, a medição da força muscular é uma medida de desfecho crítico em estudos envolvendo doença neuromuscular ou lesão.
O torque isométrico voluntário ou isozilítico máximo (e/ou índice de fadiga) é frequentemente usado como índice de capacidade funcional em estudos clínicos6. Em estudos em animais, medidas análogas podem ser feitas in vivo usando estimulação nervosa elétrica enquanto sob anestesia. Notavelmente, os preparativos in vivo são minimamente invasivos com musculatura, tendões, vasculatura e inervação permanecendo intactos e, portanto, permitem avaliações funcionais repetidas 7,8,9,10,11. Esta preparação é comumente usada em pequenos modelos de roedores e, em menor medida, em modelos animais maiores, como coelhos12, cães13,14, ovelhas15 e suínos16,17. O uso geral dessa metodologia pode ser impactante para muitos estudos de pesquisa translacional, como em modelos suínos geneticamente modificados (suínos) de atrofia muscular espinhal (SMA)18. Aqui, são apresentados métodos para avaliar o torque isométrico máximo induzido pela estimulação nervosa do grupo muscular dorsiflexor porcine in vivo. As técnicas apresentadas foram inicialmente adaptadas daquelas desenvolvidas originalmente para avaliar o torque muscular anterior do camundongo19,20 e posteriormente refinadas por experiência em investigação da capacidade de produção de torque após lesão 17,21,22,23,24,25,26,27,28 e durante o desenvolvimento16 em vários modelos suínos.
Este protocolo destaca a medição do torque isométrico in vivo utilizando uma metodologia que requer um computador integrado com uma célula de carga e estimulador elétrico. Os métodos aqui apresentados utilizam um aparelho de teste isométrico isométrico de suínos, aparelhos de plataforma e software correspondente (ver Tabela de Materiais). No entanto, a metodologia pode ser adaptada para usar outros softwares comercialmente disponíveis ou personalizados, dispositivos de aquisição de dados e estimuladores. Estes métodos destinam-se a ser utilizados em uma suíte cirúrgica de grande porte dedicada repleta de equipamentos padrão como: mesa cirúrgica de bloqueio, segunda mesa de bloqueio de altura igual para a plataforma de teste, respirador e dispositivos de monitoramento, e esteira de aquecimento ou outros dispositivos para manter a temperatura corporal.
São necessários os seguintes membros da equipe para conduzir esses métodos: um técnico de anestesia qualificado e dois funcionários de estudo para realizar o teste funcional. Essas pessoas trabalharão juntas para a estabilização inicial do membro no aparelho da plataforma. Em seguida, um dos dois funcionários será responsável pela colocação/posicionamento do eletrodo e o outro pelas aplicações do computador durante os testes.
Protocolo
Todos os experimentos em animais foram realizados em conformidade com a Lei de Bem-Estar Animal, a implementação do Regulamento de Bem-Estar Animal e os princípios do Guia de Cuidado e Uso de Animais de Laboratório. Testes anteriores demonstraram que esses métodos são confiáveis26 e não têm efeitos adversos na saúde ou função do membro do porco. Os testes têm sido realizados com tanta frequência quanto semanalmente sem quaisquer eventos adversos23. Além disso, o teste de intervenções pré e pós-cirúrgicas durante o mesmo dia pode ser realizado sem colocar estresse desagradável no animal ou induzir disfunção neuromuscular.
1. Configuração do computador
- Certifique-se de que o conjunto inicial e a calibração do aparelho e componentes sejam conduzidos sob especificações de fabricação (ver Tabela de Materiais). Sugere-se calibração utilizando uma faixa de pesos de 0,2-2,5 kg.
NOTA: O torque é medido por um pedal de 140 mm (0,14 m) ligado a um sensor de torque linear com capacidade de 50 newton-metros (N·m). O ganho do instrumento é definido para dimensionar para 25 N·m de capacidade por padrão para melhor corresponder à produção de torque prevista. A calibração é realizada aplicando uma massa conhecida (por exemplo, 1 kg) no pedal do pé a uma distância conhecida (por exemplo, 100 mm do eixo de rotação) e calculando o torque. Por exemplo, 1 kg equivale a 9,806 N aplicado a 0,1 m é 0,9806 N·m de torque. Uma relação pode então ser estabelecida entre o torque aplicado ao sensor de torque e a saída de tensão correspondente pelo sensor de torque. Os sensores de torque do autor confirmaram a linearidade dessa relação de 0,2-20 kg aplicada a uma placa de calibração de 40 cm. Devido ao comprimento do pedal padrão, recomenda-se uma faixa de calibração de 0,2-2,5 kg. Isso produz sinal suficiente para calcular o fator de escala por regressão linear. - Ligue o computador, o estimulador, o sistema transdutor e a interface analógica-digital cerca de 30 minutos antes de testar para permitir a estabilização de alterações de materiais relacionadas ao calor que podem impactar propriedades elétricas. Selecione o dispositivo da aquisição de dados apropriado e conectado (DAQ).
- Configurar parâmetros experimentais no software conforme necessário; o software permite um modelo de estudo salvo. Prepare-se para configurar o experimento (ou seja, modelo de estudo) para criar um novo estudo usando a opção Criar uma nova pasta de trabalho.
NOTA: Os parâmetros experimentais podem ser pré-carregados antes do início do estudo, o que resultará em solicitações para incluir informações específicas adicionais de experimentos, como sexo, massa corporal, data de nascimento, o ponto de tempo de teste, grupo de tratamento ou variáveis semelhantes, conforme necessário. Os parâmetros de configuração do estudo podem ser salvos e usados durante todo o experimento. - Selecione o estudo criado anteriormente no início de cada avaliação. Adicione um Novo Animal se este for o primeiro teste para que o suíno seja testado e siga o prompt para as variáveis de entrada no estudo.
- Clique em Preparar experimento uma vez pronto para iniciar o estudo, que será necessário para otimizar a colocação de eletrodos. Entregue repetidas contrações ao nervo, determinando a colocação ideal uma vez que os eletrodos são colocados (ver passo 3.6.).
- Clique em Configurar O Stim Instantâneo primeiro e, em seguida, ajuste a frequência de pulso, largura de pulso, número de pulsos, frequência do trem e tempo de execução.
- Em seguida, clique em Instant Sim para entregar repetidas contrações. Alternativamente, pressione o botão Gatilho Manual na unidade Estimulador para dar manualmente uma contração.
- Abra o Live Data Monitor durante o protocolo de estudo quando estiver pronto para iniciar todo o experimento para permitir a investigação/visualização em tempo real das contrações. Clique em Executar experimento quando estiver preparado para iniciar o experimento (seguindo a preparação do animal, veja o passo 2).
2. Preparação e manutenção da anestesia
- Porcos machos ou fêmeas rápidos, 40-90 kg, durante a noite antes do evento de anestesia, permitem o anúncio de água libitum. Obtenha e regisse o peso corporal correto do porco no dia do procedimento.
- Induzir anestesia com injeções intramusculares de tiletamina/zolzepam (Telazol, 4-6 mg/kg), xilazina (1-3 mg/kg) e propofol (2,6 mg/kg). Inicialmente manter com 5% de isoflurane via máscara facial.
- Entubar o porco com um tubo endotraqueal e colocá-lo em um ventilador automático. Mantenha o suíno na pressão máxima de 20 cm H2O, um volume inicial de maré de 10 mL/kg, e taxas de respiração a 8-12 respirações/min.
- Ajuste a configuração do ventilador para manter um PCOde 2 polegadas de 40 ± 5 mmHg. Manter a anestesia com isoflurane de 1%-3% em 30%-37% O2.
- Mantenha a temperatura corporal do porco a 37 °C durante o protocolo. Insira veias de ouvido e cateteres Foley para entrega de fluidos e coleta de urina, conforme necessário.
NOTA: O uso da anestesia do plano cirúrgico evitará contrações secundárias durante os testes, especialmente dos músculos glúteos. - Monitore a profundidade da anestesia através do reflexo e posição dos olhos, falta de tom de mandíbula, frequência cardíaca (faixa de 80-150 bpm), pressão arterial sistólica (faixa de 120-70 mmHg) ou uma combinação de todos esses sinais.
- Prepare as barras traseiras direita e esquerda uma vez que o porco esteja totalmente anestesiado e estável, primeiro limpando os membros com água e sabão para remover quaisquer detritos e, em seguida, raspar o cabelo da pele. Preste muita atenção à área lateral do joelho, que será usada para colocação de eletrodo mais tarde.
- Transporte o porco para uma mesa cirúrgica e coloque-o com segurança na posição supina. Posicione o porco em direção ao pé da mesa com os músculos glúteos na ou ligeiramente acima da extremidade da mesa.
NOTA: Isso permitirá que a mesa cirúrgica e a mesa que seguram o aparelho de teste abut. - Extubar o porco após o teste e permitir que eles se recuperem. Alimentos e água de porco padrão devem ser substituídos uma vez que o porco esteja totalmente recuperado e possa ambular livremente dentro da gaiola.
NOTA: A analgesia pós-procedimento é desnecessária apenas para os testes in vivo ; no entanto, carprofeno e/ou buprenorfina SR podem ser fornecidos por recomendação veterinária. A consulta com um veterinário local é incentivada. A anestesia e os medicamentos listados aqui são apenas para orientação e atualmente são aprovados na Universidade de Minnesota. A manutenção da anestesia com isoflurane foi escolhida com base em seu rápido início e deslocamento e seu impacto mínimo na estimulação nervosa in vivo evocava o torque29. Tome cuidado para ter consistência nos parâmetros de anestesia em todos os estudos. Durante o protocolo, a avaliação e gravação da anestesia é realizada em intervalos de 15 minutos; o registro é realizado com base nas diretrizes e exigências locais do Comitê De Cuidado e Uso de Animais Institucionais (IACUC) e do Departamento de Agricultura dos Estados Unidos (USDA).
3. Avaliação do torque isométrico in vivo
- Coloque o pé na placa do transdutor de força. Use um curativo coeso flexível para fixar o pé à placa do pé.
NOTA: É necessário um papel inteiro por pé; idealmente, o papel de 4 polegadas x 5 jardas é adequado. - Segure o pé na posição na placa do pé com o tornozelo no neutro (A) e fixe o pé na placa, envolvendo o curativo coeso ao redor do pé e da placa do pé no estilo de uma cesta fechada tecendo a torneira do tornozelo (B).
NOTA: Os dois funcionários do estudo serão obrigados a realizar simultaneamente as tarefas individuais (A) e (B). - Posicione o tornozelo em um ângulo reto uma vez que o pé esteja preso à placa do pé, definida como 0° ou neutra para referência de graus de plantar ou dorsiflexão.
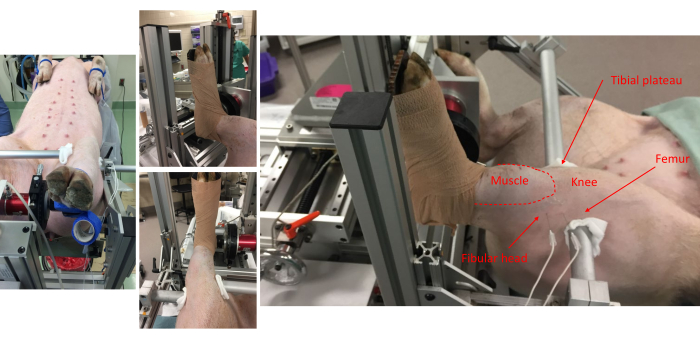
Figura 1: Imagens de vários pontos de vantagem mostram o acessório do porco à placa do pé e alinhamento anatômico na moldura. São observados marcos anatômicos para os músculos do compartimento anterior, cabeça fibular, joelho, platô tibial e fêmur. Observe a colocação de pares de eletrodos subdérmicos no lado lateral da perna. Clique aqui para ver uma versão maior desta figura.
- Estabilize o joelho e o tornozelo em ângulos retos.
- Primeiro, posicione as barras de fixação do membro perto dos locais necessários. Quando estiver pronto, começando pelo aspecto medial do membro, alinhe a barra de fixação do membro em cerca do platô tibial.
- Em seguida, alinhe a barra lateral de fixação do membro na cabeça distal do fêmur.
NOTA: Entre a extremidade de cada membro, a barra de fixação usa uma gaze dobrada 4 x 4 para proteger a pele adjacente à barra. - Estabilize bem as barras usando os parafusos de travamento.
NOTA: As barras de fixação do membro não estarão alinhadas entre si, mas se alinharão com a anatomia do porco. - Limpe a pele ao redor da cabeça fibular aplicando 70% de álcool através de gaze limpa em círculos concêntricos começando no centro da colocação pretendida do eletrodo e movendo-se para fora. Coloque a agulha percutânea estéril (50 mm, 26 G monopolar) e eletromípcros (EMG) no estilo (ver Tabela de Materiais) através do nervo peroneal. Implante eletrodos subdermicamente, aproximadamente 5-10 mm.
- Otimize a colocação do eletrodo utilizando amplitudes correntes crescentes, conforme ajustado no estimulador. Comece em 100 mA e aumente conforme necessário.
NOTA: 300-500 mA geralmente é necessário para o torque de contração máxima. - Visualize a magnitude do torque do contração na visualização de dados ao vivo e sobre o compartimento anterior do porco; os cascos podem jogar e mover-se para cima também.
- Certifique-se de que o compartimento posterior, ou nervo da tíbia, não seja ativado durante a estimulação. Inspecione visualmente e palpe a contração posterior do compartimento e o movimento descendente dos cascos durante a estimulação.
- Inspecione a região do planalto da contração tetanica a partir do rastreamento do tempo de torque ao vivo nas etapas seguintes por falta de recrutamento muscular antagonista (ou seja, plantarflexão para este protocolo).
- Torque tetanic isométrico máximo provocante utilizando os seguintes parâmetros de estimulação: 100 Hz, 0,1 ms de largura de pulso, sobre um trem de 800 ms17, uma vez que as amplitudes de colocação e estimulação do eletrodo são otimizadas.
NOTA: Esses parâmetros podem ser utilizados para várias avaliações contratuais.
4. Protocolo para análise de ângulo de torque-articulação
- Meça o binário tetanic isométrico máximo em uma gama de posições do tornozelo que vão desde neutras até as faixas próximas de rolagem plantar, ou 0-50° de plantarflexão.
NOTA: O uso de incrementos de 10° exigirá seis contrações, e a alteração incremental pode ser ajustada para questões experimentais específicas. - Comece a afrouxar os parafusos de bloqueio do estágio goniômetro para mover-se entre ângulos articulares. Certifique-se de que ambos os parafusos de bloqueio estejam apertados antes da próxima contração.
NOTA: O goniômetro está escrito com marcas de grau para permitir um alinhamento preciso. É provável que seja 0° de flexão plantar, que é compensada por 180° no goniômetro. Tome cuidado para garantir o posicionamento pretendido. - Determinar o tempo entre as contrações experimentalmente; no entanto, 2 min é suficiente para evitar a fadiga.
NOTA: À medida que o ângulo da articulação do tornozelo é alterado gradualmente, os eletrodos da agulha podem mudar. Pode ser necessário confirmar a colocação dos eletrodos com contrações de contração, conforme observado acima (ver passo 3.8).
5. Protocolo para análise de frequência de torque
- Posicione o tornozelo no ângulo articular desejado. Tome cuidado, experimentalmente, para realizar testes no mesmo ângulo articular cada vez.
NOTA: Normalmente, as análises de frequência de torque são realizadas em um único ângulo articular correspondente ao torque isométrico de pico derivado da análise do ângulo de torque-articulação. O torque máximo é produzido a ~30-35° deflexão plantar. - Meça o torque isométrico máximo sobre uma gama de frequências de estimulação que induzem trens não fundidos de contrações até e além daquelas que induzem tetani totalmente fundido.
NOTA: Isso pode ser conseguido estimulando a 10, 20, 40, 60 e 100 Hz (largura de pulso de 0,1 ms; trem de 800 ms) com 2 minutos entre cada contração para evitar a fadiga. Dependendo das perguntas experimentais exatas e modelos específicos de suínos, as frequências podem ser adaptadas. O substrato bioenergésico mais provável utilizado durante uma contração de 800 ms para manter o ATP intracelular é fosfocreatina30, e a ressíntese da fosforatina depende da nave fosfocreatina31. Cinética de recuperação fosfocreatina indicam uma recuperação 90% ou mais notável entre 90-120 s após a contração terminarem 30. Portanto, os intervalos de descanso recomendados entre as contrações são de 90 a 120 s. Embora isso possa ser influenciado por projetos experimentais, incluindo doença muscular, lesão e/ou envelhecimento.
6. Análise de dados
- Clique em Analisar resultados se ainda estiver no software para abrir a janela Análise. Alternativamente, abra diretamente o programa de Análise.
- Seja usando uma plataforma de dados automatizada ou análise manual, calcule as diferentes variáveis na análise de formas de onda isométricas individuais.
NOTA: Estas variáveis incluem: torque de contração máxima, torque tetanic máximo e propriedades contratuais relacionadas a contrações e tetani, por exemplo, tempo-a-pico e meio relaxamento. Muitas variáveis experimentais podem normalizar a força, por exemplo, o peso corporal, o volume muscular determinado a partir da ressonância magnética (ressonância magnética) ou tomografia computadorizada, ou peso muscular terminal. Tanto o torque absoluto (N·m) quanto o torque normalizado para a massa corporal (N·m/kg) são apresentados. O torque de descanso colocado na placa do pé difere entre os experimentos. Uma correção de linha de base para o binário de repouso deve ser aplicada para garantir que sejam registrados verdadeiros torques máximos e tetanic. O torque da linha de base em cada ângulo articular é registrado e pode indicar alterações no torque passivo.
Resultados
A confiabilidade e otimização dos parâmetros de teste in vivo do compartimento anterior do suíno foram previamente relatados26. Dados comparativos entre roedores e suínos para frequência de torque também foram relatados27.
Durante a avaliação in vivo , a visualização da forma de onda de torque é necessária em tempo real para garantir a ativação do compartimento anterior adequado. As formas de onda só devem refletir dorsiflexão. As formas de onda devem ter uma aparência lisa e arredondada e um planalto tetanic aparente (Figura 2A). Inconsistências ou perturbações da forma de onda indicam várias limitações experimentais, como estimulação inadequada, colocação inadequada de eletrodos ou profundidade inadequada da anestesia (Figura 2B).
Figura 3A é um traçado de tempo de torque de contração com uma seta indicando 50% de torque máximo. A contração de tempo para pico deve começar no início do estimulador e terminar quando o torque máximo do contração é alcançado (barras de tempo representativas são mostradas abaixo do traçado). O meio-relaxamento para uma contração deve começar no torque máximo da contração e terminar em 50% de torque máximo de contração (as barras de tempo representativas são mostradas abaixo do traçado). Figura 3B é um traçado tetanic torque-time com uma seta indicando 50% de torque máximo. Ao contrário das contrações ideais em termos de um torque máximo definitivo e oportuno, as contrações tetanicas têm maior variabilidade no tempo de torque máximo em relação ao momento em que o estimulador começa e termina, exigindo uma abordagem mais matizada para a análise da propriedade contraltil. A contração de tempo para pico deve começar com o início do estimulador e parar em algum lugar entre 90%-100% do torque máximo. As barras de tempo na Figura 3B mostram um corte de 95% de torque máximo. Isso é útil em casos como os dados representativos selecionados porque o torque máximo não é atingido até o final da fase do planalto. Uma análise complementar ao tempo-a-pico é a taxa média de contração. As barras tracejadas no membro ascendente do traçado do tempo de torque representam uma faixa de torque máximo de 30%-70%. A taxa média de contração deve ser iniciada no início da estimulação e capturar a variação média da taxa entre 30%-70% de torque máximo. São faixas recomendadas, e grupos de pesquisa individuais podem determinar a faixa ideal em torno de 50% (por exemplo, ±10%). A parte importante é ser consistente dentro e entre os estudos. Em contraste com a contração tetanic meia-relaxamento deve começar no final da estimulação em vez de torque máximo pela mesma razão mencionada acima com o tempo-para-pico. As barras de tempo na Figura 3B representam o tempo entre o fim da estimulação e chegando a 50% de relaxamento. Uma análise complementar para meia-descontração é a taxa média de relaxamento. As barras tracejadas no membro descendente do torque-tracing representam a mesma faixa de torque máximo de 30%-70% do membro ascendente. A taxa média de relaxamento deve começar no final da estimulação e capturar a taxa média de variação entre 30%-70% de torque máximo. Novamente, estes são intervalos recomendados. Uma nota crítica: não confunda a taxa média de contração/relaxamento com a taxa máxima de contração/relaxamento. A taxa máxima representa a variação de taxa mais notável entre dois pontos de dados adjacentes e pode ser amplamente variável.
Várias propriedades contratuais e contratuais podem ser analisadas para obter informações sobre o tipo de fibra e atributos de acoplamento de excitação-contração dos músculos esqueléticos10,32. A interpretação excessiva das propriedades contrativas e contratuais é advertida; eles representam sugestões e raciocínio para mais interrogatórios em nível celular e não são necessariamente indicativos. Em geral, as taxas de contração podem refletir a liberação de cálcio órticulum sarcoplasmático e a taxa enzimática da cadeia pesada de miosina. Em contraste, as taxas de relaxamento podem refletir a taxa de enzima esnzimática de cálcio reticúndico sarco(endo)plasmic ATPase e a taxa de enzima e isoforme. Essas propriedades podem ser influenciadas por fadiga, dano muscular, treinamento de exercícios e inúmeras patologias (por exemplo, atrofiar desuso).
A Figura 4 descreve valores representativos para as relações de torque-freqüência e ângulo de torque-articulação para membros não feridos. Esses dados são representativos de uma ampla gama de tamanhos de suínos.
Uma análise representativa e experimental do EMG superficial foi realizada durante a análise muscular in vivo (Figura 5) para demonstrar o controle experimental da codificação da taxa e da atividade muscular total. Eletrodos adesivos EMG foram colocados na barriga média do peroneus tertius. Um eletrodo moído foi colocado no joelho para minimizar o artefato de estimulação, e agulhas de eletrodos de estimulação foram colocadas ao redor do nervo peroneal proximal para a localização muscular. Foram feitas gravações simultâneas de torque e EMG em frequências de estimulação de 20, 60 e 100 Hz. O número de pulsos estimuladores (barras vermelhas na Figura 5) reflete o quociente da duração da estimulação e do tempo entre os pulsos. Por exemplo, uma frequência de estimulação de 20 Hz significa um pulso a cada 50 ms; portanto, a duração da estimulação de 400 ms dividida por 50 ms entre pulsos equivale a oito pulsos entregues (Figura 5A). Os pulsos estimuladores são entregues ao axônio nervoso através da colocação de eletrodos de agulha percutânea e produzem um número semelhante de pulsos musculares elétricos (ou seja, 20 Hz é igual a 8 gravações EMG), demonstrando o controle experimental da frequência potencial de ação do grupo muscular de interesse. As gravações emG brutas podem ser convertidas através da análise do quadrado-médio raiz (EMG RMS) para visualizar a atividade muscular total com crescente frequência de estimulação. A área sob a análise da curva (AUC) é uma maneira de quantificar o EMG RMS para determinar alterações em toda a atividade muscular. AUCs representativos para cada frequência de estimulação emg RMS são fornecidos (Figura 5A-C).
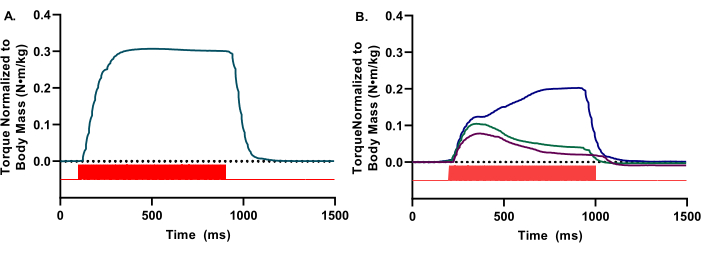
Figura 2: Formas de onda representativas de alta e baixa qualidade. (A) Formas de onda isométricas presentes em uma aparência de onda quadrada, com um notável platô fluido. (B) Formas de onda de baixa qualidade podem ser devido a estimulação inadequada ou colocação inadequada de eletrodos. Nestes casos, é necessário reposicionamento dos eletrodos. Para A e B, os pulsos estimuladores (barras vermelhas) são indicados. Clique aqui para ver uma versão maior desta figura.
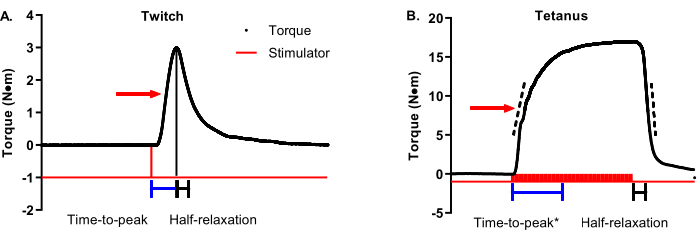
Figura 3: Análise de propriedade contratada do Twitch e tetanic. (A) Os traçados de torque de 100 Hz e (B) são modificados para detalhar as propriedades contratuais. A seta vermelha em cada gráfico mostra 50% de torque máximo. Barras azuis e pretas sob os traçadores mostram duraçãos de tempo a pico e meio-relaxamento, respectivamente. As barras tracejadas nos membros ascendentes e descendentes do traçado tetanic torque-time representam uma faixa de torque máximo de 30%-70% que pode ser usado para determinar a taxa média de contração ou relaxamento. Clique aqui para ver uma versão maior desta figura.
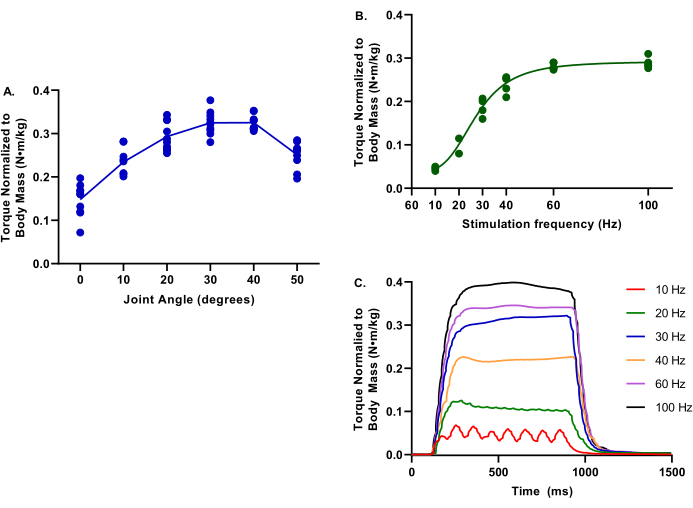
Figura 4: Exemplos de ângulo de torque-articulação e frequência de torque. Os dados fornecidos são de uma gama de porcos femininos da Yorkshire Cross em 2,9-6,3 meses; Massa corporal de 39,4-75,4 kg; todos considerados controle saudável no momento da avaliação. Durante todos os testes, a temperatura corporal do núcleo foi mantida a 37 °C. (A) O torque normalizado à massa corporal é avaliado nas articulações do tornozelo de 0-50° de flexão plantar; note que o torque máximo está determinado em 30°. (B) O torque normalizado à massa corporal é avaliado em várias frequências de estimulação de 10-100 Hz; note que essas avaliações foram realizadas com a articulação do tornozelo a 30° de rolação plantar. (C) Foram avaliados os traçados individuais de torque para cada uma das frequências de estimulação. Clique aqui para ver uma versão maior desta figura.
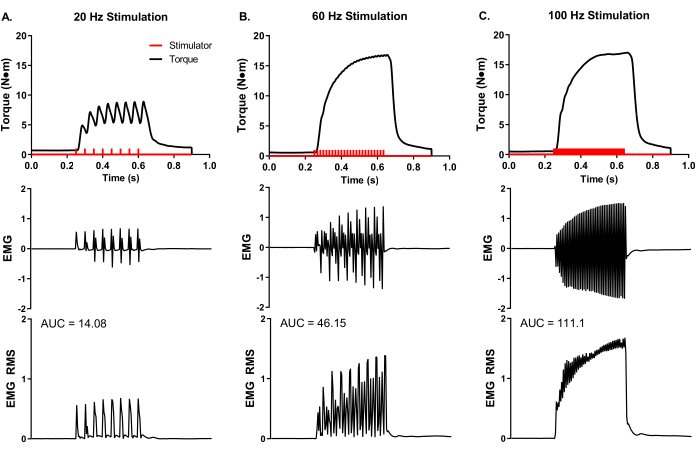
Figura 5: Torque isométrico in vivo simultâneo e medições EMG. Gravações simultâneas de EMG e torque em frequências representativas de estimulação de (A) 20, (B) 60 e (C) 100 Hz coletadas de uma fêmea de porco yorkshire (~90 kg de massa corporal). Pulsos estimuladores (barras vermelhas) foram entregues de acordo com a frequência de estimulação definida. As gravações emg brutas foram convertidas em raiz-média-quadrada (EMG RMS) para visualizar a atividade muscular total com crescente frequência de estimulação. Foram analisadas curvas representativas do EMG RMS para a área sob a curva (AUC) e as AUCs são fornecidas para cada frequência de estimulação. Clique aqui para ver uma versão maior desta figura.
Discussão
Etapas críticas, modificações e solução de problemas
Para minimizar a variabilidade dos dados e maximizar o sucesso da abordagem, destacam-se as seguintes etapas críticas.
Estimulação nervosa ideal
Esta abordagem experimental começa com a despolarização do axônio nervoso e conta com a colocação correta do eletrodo e estimulação elétrica otimizada. Uma análise pós-morte da anatomia nervosa relacionada a marcos ósseos pode ajudar a visualizar a colocação adequada de eletrodos durante os testes. A aquisição de torque máximo de contração ajuda a determinar a corrente apropriada (em miliamperes; mA) entregue ao axônio nervoso. Existem dois valores a serem mente ao otimizar a estimulação nervosa no início dos testes: (1) a relação twitch-tetanic é ~1:5, por exemplo, ~2 N·m de torque de contração corresponde a um torque tetanic de 10 N·m (Figura 3); e (2) o torque típico para a massa corporal é de ~0,3 N·m por kg de massa corporal (Figura 4). Se os torques de contração de pico aparecerem baixos, remova os eletrodos e tente outra colocação. Certifique-se de verificar as configurações do estimulador, conexões BNC e conexões de eletrodos. A re-colocação do eletrodo pode ser necessária entre as contrações se houver muito movimento durante o posicionamento do membro entre ângulos articulares, como observado acima (Figura 2). Observe que abordagens experimentais e intervencionistas podem impactar esses valores.
Alinhamento biomecânico adequado
A duração do músculo inicial influencia a força contratil muscular (a relação comprimento-tensão), e o comprimento muscular pode mudar com base no alinhamento do quadril, joelho e articulação do tornozelo. Os ângulos articulares devem ser padronizados entre membros e entre os suínos. Um ângulo articular do tornozelo de 90° é fortemente recomendado para o quadril e joelho. Uma posição ligeiramente plantarflexada do tornozelo (~30° do ângulo neutro da articulação do tornozelo 0°) é ideal para a força máxima. Reflete a posição anatômica natural da articulação do tornozelo em suínos e cães em pé. Todas as articulações também devem ser paralelas aos transdutores de pedal e torque para evitar a perda de torque mensurável devido à contribuição de um vetor de torque perpendicular. Inspecionar os ângulos articulares do quadril-joelho-tornozelo e o alinhamento pé-pedal-articulação é fortemente recomendado depois de fixar o pé no pé-pedal e fixar a articulação do joelho com as barras de fixação do membro (Figura 1). Se houver desalinhamento, desbloqueie e remova as barras e reposicione o porco na mesa cirúrgica. Embora a padronização de ângulos conjuntos entre os estudos seja fundamental para minimizar a variância de dados, há limitações ao alinhamento biomecânico que são notáveis, discutidas abaixo.
Significância em relação aos métodos existentes ou alternativos
Exemplos alterativos de avaliações clinicamente relevantes e não invasivas da função muscular que poderiam ser usadas para modelos suínos incluem distância de caminhada da esteira, EMG e eletrografia de onda muscular ativa. Como o teste de caminhada de 6 minutos em humanos, um teste de caminhada na esteira pode avaliar a progressão da doença e o sucesso da intervenção em animais de grande porte 33,34,35. Normalmente, após um período de aclimatação, os animais são caminhados até o fim da conformidade em diferentes velocidades de esteira e/ou níveis inclinados. Recompensas alimentares são muitas vezes necessárias para alcançar a motivação máxima. No entanto, os resultados da caminhada na esteira oferecem apenas interpretações indiretas da função contratil muscular devido a limitações como motivação do sujeito, recrutamento de unidades motoras não máximas e co-dependência inerente a outros sistemas corporais, como os sistemas cardiovascular, esquelético e respiratório.
Por outro lado, a EMG oferece uma avaliação direta ligeiramente melhor do sistema muscular esquelético, uma vez que os eletrodos EMG são colocados diretamente no grupo muscular de interesse 36,37,38. Emg eletrodos então medem a atividade muscular coletiva (fibras musculares despolarizadas). Esta atividade muscular é baseada no recrutamento de unidades motoras e codificação de taxas (a frequência de potenciais de ação enviados para unidades motoras recrutadas). No entanto, separar as contribuições relativas do recrutamento de unidades motoras versus codificação de taxas é impossível com o EMG de superfície. Além disso, a EMG se baseia na disposição do sujeito para gerar contrações máximas, e esse nível de cooperação é improvável em modelos de animais grandes. Embora possa ser informativo avaliar alterações no EMG durante o ciclo de marcha, esses dados não representam uma capacidade funcional máxima do grupo de interesse muscular esquelético. A imagem baseada em ultrassom utilizando o modo B e a elastografia de ondas de cisalhamento é outra modalidade não invasiva usada para avaliar a função muscular. Há uma boa correlação entre o módulo de Young medido pela elastografia e o aumento das cargas musculares 39,40. A elastografia cisalhamento-onda foi validada e utilizada como medida quantitativa da rigidez passiva do tecido 41,42,43,44,45, inclusive em uma lesão de perda muscular volumétrica porcina modelo 23. Também pode ser usado como uma medição indireta da produção de força muscular ativa39. No entanto, ainda existem limitações semelhantes à EMG para a disposição do sujeito e a cooperação para a realização de contrações.
O protocolo in vivo descrito aqui, em contraste com a distância de caminhada da esteira e o EMG, fornece uma avaliação confiável, reprodutível e máxima da função muscular. Este protocolo evoca contrações musculares de forma controlada e quantificável independente da motivação. Especificamente, eletrodos percutâneos são usados para estimular axônios nervosos contornando o sistema nervoso central. A despolarização dos axônios nervosos envolve todas as unidades motoras eliminando a variabilidade associada ao recrutamento de unidades motoras. Além disso, o investigador controla a codificação da taxa (frequência de estimulação). A fisiologia neuromuscular resultante que se aplica a esta abordagem começa com a ativação do canal de sódio fechado por tensão nos nódulos de Ranvier. Toda a fisiologia subsequente (ou a jusante) está engajada, incluindo acoplamento excitação-contração e ciclismo transfronteiriço. Uma vantagem significativa da análise muscular in vivo não invasiva é que a função muscular contratil pode ser medida repetidamente, por exemplo, semanalmente, para monitorar a força muscular após lesão, intervenção ou sobre uma progressão da doença.
Limitações do método
O equipamento in vivo descrito neste protocolo permite o torque isométrico passivo e ativo como função de ângulo articular e frequência de estimulação. O aparelho de teste utilizado não suporta a medição de contrações dinâmicas (por exemplo, contrações excêntricas ou concêntricas isozitinas). O aparelho permite uma faixa de movimento de 105° para caracterizar a relação ângulo de torque-articulação e usa uma célula de carga com uma faixa máxima de torque de ~50 N·m. Questões experimentais específicas podem exigir características de desempenho fora dessas especificações. Notavelmente, a célula de carga deste aparelho descrito pode ser trocada por maiores faixas de torque, se necessário.
O protocolo aqui descrito para medir a força neuromuscular máxima in vivo tem limitações notáveis. Em primeiro lugar, este método requer anestesia, que pode ser conduzida de forma diferente por protocolos e recursos de instalações animais. Os anestésicos são conhecidos por ter efeitos variados na função neuromuscular e têm sido mostrados para alterar a produção de torque do rato in vivo dorsiflexor de forma anestésico e dependente de dose29. Os efeitos diferenciais dos anestésicos no binário in vivo de animais grandes não são claros; portanto, os grupos de controle e experimentais devem ter os mesmos agentes de anestesia (por exemplo, todos os grupos administrados cetamina) para controlar essa variabilidade. Em segundo lugar, a dependência de padrões de difusão in vivo limita a exploração de mecanismos celulares de disfunção contratil e toxicidades agudas de drogas. Por exemplo, a cafeína pode ser usada durante testes in vitro de banho de órgãos de um músculo isolado para estimular a liberação de cálcio órticulo sarcoplasmático, contornando o acoplamento de excitação-contração46 diretamente. A quantidade de cafeína para induzir esse efeito (mM) é letal em um ambiente in vivo . Influências medicamentosas em todo o corpo (por exemplo, estresse renal/hepático) e fatores subsequentes secretados em circulação precisarão ser considerados se essa abordagem for usada para triagem de drogas na força muscular aguda23. Em terceiro lugar, o uso de estimulação máxima do nervo elétrico desvia-se das estratégias de recrutamento voluntário, como discutido acima, e, portanto, não reflete mudanças de força que podem ser decorrentes de adaptações de recrutamento neuromuscular.
As medições de torque in vivo também podem ser limitadas no que diz respeito ao estabelecimento de um mecanismo específico para observações experimentais. Por exemplo, o torque sobre a articulação do tornozelo depende não apenas da produção de força muscular, mas também das propriedades do tendão e da articulação e do tecido conjuntivo. Além disso, a força é gerada por grupos de músculos, especificamente os flexores plantares (músculos gastrocnemius, soleus e plantaris) e os dorsiflexores (peroneus tertius, tibialis e músculos de digitorum) em suínos. Portanto, interpretações de dados máximos de torque in vivo requerem consideração de possíveis alterações musculotensas e anatômicas e se limitam a grupos musculares, não músculos individuais. Relacionados, os grupos musculares são frequentemente compostos por uma mistura de fibras predominantemente rápidas e lentas musculares, como o músculo gastrocnemius e soleus, respectivamente, dos flexores plantar. Propriedades contratuais, como taxa de contração e relaxamento (ou contração de tempo para pico e tempo de meia-descontração) não são indicadores confiáveis de fisiologia do tipo fibra usando preparações musculares in vivo versus isoladas, como protocolos de teste in vitro ou in situ 47. Preparações musculares isoladas também são superiores na compreensão da influência dos parâmetros biomecânicos na função muscular, pois propriedades como o comprimento muscular podem ser precisamente controladas; é importante ressaltar que a relação ângulo-torque articular não é diretamente equivalente à relação comprimento-força muscular, pois as propriedades do tendão (por exemplo, folga), músculo (por exemplo, ângulo de pennation, sobreposição de sarcomere) e articulação (por exemplo, braço de momento) que contribuem para a produção de torque dependem do ângulo articular. Para isso, o teste funcional in situ 48 pode ser uma adição valiosa aos testes in vivo, tendo em vista que o teste in situ é um experimento terminal. Outros avanços ao protocolo atual que podem ser explorados no futuro para melhorar a visão mecanicista dos achados experimentais incluem o uso de imagens no modo B do ultrassom para medir propriedades arquitetônicas musculares e tendinosas e a implantação de um transdutor de força tendão para medir a força muscular durante contrações voluntárias e eletricamente estimuladas49.
Importância e aplicações potenciais do método
Este protocolo avalia a capacidade de produção de torque in vivo do grupo muscular dorsiflexor suíno, demonstrando um método não invasivo para avaliar o ganho ou perda da função muscular em um ambiente fisiológico. Como a metodologia não é terminal para o suíno, também pode ser usada para avaliar a função muscular nos mesmos sujeitos longitudinalmente durante a progressão de uma doença, ou antes, durante, e seguindo uma estratégia de tratamento. Como tal, um projeto experimental de medidas repetidas pode permitir comparações estatísticas robustas com maior potência e menos animais em comparação com medidas independentes. Além disso, a disfunção muscular esquelética é um componente saliente de diversos processos e condições da doença, como o perda muscular associado à doença crônica (por exemplo, insuficiência cardíaca, insuficiência renal, AIDS, câncer, etc.), distrofia muscular, doenças neurodegenerativas (por exemplo, Esclerose lateral Amiotrófica ou Amiotrófica; ELA), envelhecimento (ou seja, sarcopenia) e toxicidades medicamentosas. A capacidade funcional do músculo esquelético é uma medida crítica de desfecho primário para intervenções como exercícios, nutrição e terapias medicamentosas e medicina regenerativa. Assim, o protocolo aqui descrito para avaliar de forma confiável a capacidade de produção de torque suíno in vivo pode ser utilizado em inúmeras aplicações de estudo. Pode ser fundamental na aquisição de dados animais extensos para a tradução de terapias em desenvolvimento.
Divulgações
As opiniões ou afirmações aqui contidas são as opiniões privadas dos autores. Eles não devem ser interpretados como oficiais ou como refletir as opiniões do Departamento do Exército, do Departamento de Defesa ou do Governo dos Estados Unidos.
A produção do artigo de vídeo e a disponibilidade de Acesso Aberto foi patrocinada pela Aurora Scientific, Inc. Matthew Borkowski é empregado pela Aurora Scientific Inc. Esta empresa pode potencialmente se beneficiar dos resultados da pesquisa.
Agradecimentos
O trabalho e os dados apresentados foram amplamente apoiados pelo Comando de Pesquisa Médica e Material do Exército dos EUA para o BTC e SMG (#MR140099; #C_003_2015_USAISR; #C_001_2018_USAISR); e o Departamento de Assuntos de Veteranos, Administração de Saúde de Veteranos, Escritório de Pesquisa e Desenvolvimento (I21 RX003188) para JAC e Dr. Luke Brewster. Os autores reconhecem com gratidão o Serviço Veterinário USAISR e ramos de patologia comparativa e o Centro Avançado de Imagem Pré-Clínica umn para assistência técnica na conclusão desses estudos.
Materiais
| Name | Company | Catalog Number | Comments |
| 615A Dynamic Muscle Control LabBook and Analysis Software Suite | Aurora Scientific Inc. | 615A | Compatible Win Vista/7/10 |
| 892A Swine Isometric Footplate Test Apparatus | Aurora Scientific Inc. | 892A | Includes Isometric Load Cell, Pig Footplate, Goniometer stage and positioners |
| Calibration Weights | Ohaus or similar | 80850116 | |
| Computer | Aurora Scientific or any vendor | 601A | Computer must include data acquisition card and interface for software |
| Gauze pad | Various vendors | 4 by 4 squares or similar | |
| Monopolar Needle Electrodes | Chalgren, Electrode Store, or similar vendor | 242-550-24TP, or DTM-2.00SAF | |
| Non-adhesive Flexiable Tape | 3M, Coflex, or similar | 4 inch by 5 yard role | |
| Stimulator | Aurora Scientific or comparable | 701C | Must include constant current stimulation mode |
Referências
- Verlaan, S., et al. Nutritional status, body composition, and quality of life in community-dwelling sarcopenic and non-sarcopenic older adults: A case-control study. Clinical Nutrition. 36 (1), 267-274 (2017).
- Wang, D. X. M., Yao, J., Zirek, Y., Reijnierse, E. M., Maier, A. B. Muscle mass, strength, and physical performance predicting activities of daily living: a meta-analysis. Journal of Cachexia, Sarcopenia and Muscle. 11 (1), 3-25 (2020).
- Ishikawa, Y., et al. Duchenne muscular dystrophy: survival by cardio-respiratory interventions. Neuromuscular Disorders. 21 (1), 47-51 (2011).
- Khirani, S., et al. Respiratory muscle decline in Duchenne muscular dystrophy. Pediatric Pulmonology. 49 (5), 473-481 (2014).
- Ziter, F. A., Allsop, K. G., Tyler, F. H. Assessment of muscle strength in Duchenne muscular dystrophy. Neurology. 27 (10), 981-984 (1977).
- Garg, K., et al. Volumetric muscle loss: persistent functional deficits beyond frank loss of tissue. Journal of Orthopaedic Research. 33 (1), 40-46 (2015).
- Lovering, R. M., Roche, J. A., Goodall, M. H., Clark, B. B., McMillan, A. An in vivo rodent model of contraction-induced injury and non-invasive monitoring of recovery. Journal of Visualized Experiments: JoVE. (51), e2782(2011).
- Mintz, E. L., Passipieri, J. A., Lovell, D. Y., Christ, G. J. Applications of in vivo functional testing of the rat tibialis anterior for evaluating tissue engineered skeletal muscle repair. Journal of Visualized Experiments: JoVE. (116), e54487(2016).
- Call, J. A., Warren, G. L., Verma, M., Lowe, D. A. Acute failure of action potential conduction in mdx muscle reveals new mechanism of contraction-induced force loss. The Journal of Physiology. 591, Pt 15 3765-3776 (2013).
- Call, J. A., Eckhoff, M. D., Baltgalvis, K. A., Warren, G. L., Lowe, D. A. Adaptive strength gains in dystrophic muscle exposed to repeated bouts of eccentric contraction. The Journal of Physiology. 111 (6), 1768-1777 (2011).
- Ingalls, C. P., Wenke, J. C., Nofal, T., Armstrong, R. B. Adaptation to lengthening contraction-induced injury in mouse muscle. The Journal of Physiology. 97 (3), 1067-1076 (2004).
- Hyman, S. A., et al. In vivo supraspinatus muscle contractility and architecture in rabbit. The Journal of Physiology. 129 (6), 1405-1412 (2020).
- Childers, M. K., Grange, R. W., Kornegay, J. N. In vivo canine muscle function assay. Journal of Visualized Experiments: JoVE. (50), e2623(2011).
- Grange, R. W., et al. Muscle function in a canine model of X-linked myotubular myopathy. Muscle & Nerve. 46 (4), 588-591 (2012).
- Novakova, S. S., et al. Repairing volumetric muscle loss in the ovine peroneus tertius following a 3-month recovery. Tissue Engineering Part A. , (2020).
- Maeng, G., et al. Humanized skeletal muscle in MYF5/MYOD/MYF6-null pig embryos. Nature Biomedical Engineering. , (2021).
- Ward, C. L., et al. Autologous minced muscle grafts improve muscle strength in a porcine model of volumetric muscle loss injury. Journal of Orthopaedic Trauma. 30 (12), 396-402 (2016).
- Prather, R. S., Lorson, M., Ross, J. W., Whyte, J. J., Walters, E. Genetically engineered pig models for human diseases. Annual Review of Animal Biosciences. 1, 203-219 (2013).
- Lowe, D. A., Warren, G. L., Ingalls, C. P., Boorstein, D. B., Armstrong, R. B. Muscle function and protein metabolism after initiation of eccentric contraction-induced injury. Journal of Applied Physiology. 79 (4), 1260-1270 (1995).
- Ashton-Miller, J. A., He, Y., Kadhiresan, V. A., McCubbrey, D. A., Faulkner, J. A. An apparatus to measure in vivo biomechanical behavior of dorsi- and plantarflexors of mouse ankle. Journal of Applied Physiology. 72 (3), 1205-1211 (1992).
- Chao, T., Burmeister, D. M., Corona, B. T., Greising, S. M. Oxidative pathophysiology following volumetric muscle loss injury in a porcine model. Journal of Applied Physiology. 126 (6), 1541-1549 (2019).
- Corona, B. T., Greising, S. M. Challenges to acellular biological scaffold mediated skeletal muscle tissue regeneration. Biomaterials. 104, 238-246 (2016).
- Corona, B. T., Rivera, J. C., Dalske, K. A., Wenke, J. C., Greising, S. M. Pharmacological Mitigation of Fibrosis in a Porcine Model of Volumetric Muscle Loss Injury. Tissue Engineering Part A. , (2020).
- Corona, B. T., Rivera, J. C., Greising, S. M. Inflammatory and physiological consequences of debridement of fibrous tissue after volumetric muscle loss injury. Clinical and Translational Science. 11 (2), 208-217 (2018).
- Corona, B. T., Rivera, J. C., Wenke, J. C., Greising, S. M. Tacrolimus as an adjunct to autologus minced muscle grafts for the repair of a volumetric muscle loss injury. Journal of Experimental Orthopaedics. 4 (1), 36(2017).
- Greising, S. M., et al. Unwavering pathobiology of volumetric muscle loss injury. Scientific Reports. 7 (1), 13179(2017).
- Pollot, B. E., Corona, B. T. Volumetric muscle loss. Methods in Molecular Biology. 1460, 19-31 (2016).
- Kheirabadi, B. S., et al. Long-term effects of Combat Ready Clamp application to control junctional hemorrhage in swine. The Journal of Trauma and Acute Care Surgery. 77 (3), Suppl 2 101-108 (2014).
- Ingalls, C. P., Warren, G. L., Lowe, D. A., Boorstein, D. B., Armstrong, R. B. Differential effects of anesthetics on in vivo skeletal muscle contractile function in the mouse. Journal of Applied Physiology. 80 (1), 332-340 (1996).
- Forbes, S. C., Paganini, A. T., Slade, J. M., Towse, T. F., Meyer, R. A. Phosphocreatine recovery kinetics following low- and high-intensity exercise in human triceps surae and rat posterior hindlimb muscles. American Journal of Physiology. Regulatory, Integrative and Comparative Physiology. 296 (1), 161-170 (2009).
- Meyer, R. A., Sweeney, H. L., Kushmerick, M. J. A simple analysis of the "phosphocreatine shuttle.". American Journal of Physiology. 246 (5), Pt 1 365-377 (1984).
- McKeehen, J. N., et al. Adaptations of mouse skeletal muscle to low-intensity vibration training. Medicine & Science in Sports & Exercise. 45 (6), 1051-1059 (2013).
- Boakye, M., et al. Treadmill-based gait kinematics in the yucatan mini pig. Journal of Neurotrauma. 37 (21), 2277-2291 (2020).
- Woodman, C. R., Muller, J. M., Laughlin, M. H., Price, E. M. Induction of nitric oxide synthase mRNA in coronary resistance arteries isolated from exercise-trained pigs. American Journal of Physiology. 273 (6), 2575-2579 (1997).
- Boddy, K. N., Roche, B. M., Schwartz, D. S., Nakayama, T., Hamlin, R. L. Evaluation of the six-minute walk test in dogs. American Journal of Veterinary Research. 65 (3), 311-313 (2004).
- Valentin, S., Zsoldos, R. R. Surface electromyography in animal biomechanics: A systematic review. Journal of Electromyography & Kinesiology. 28, 167-183 (2016).
- Stegeman, D. F., Blok, J. H., Hermens, H. J., Roeleveld, K. Surface EMG models: properties and applications. Journal of Electromyography & Kinesiology. 10 (5), 313-326 (2000).
- Zwarts, M. J., Stegeman, D. F. Multichannel surface EMG: basic aspects and clinical utility. Muscle Nerve. 28 (1), 1-17 (2003).
- Liu, J., et al. Non-invasive quantitative assessment of muscle force based on ultrasonic shear wave elastography. Ultrasound in Medicine and Biology. 45 (2), 440-451 (2019).
- Wang, A. B., Perreault, E. J., Royston, T. J., Lee, S. S. M. Changes in shear wave propagation within skeletal muscle during active and passive force generation. Journal of Applied Biomechanics. 94, 115-122 (2019).
- Brandenburg, J. E., et al. Quantifying passive muscle stiffness in children with and without cerebral palsy using ultrasound shear wave elastography. Developmental Medicine & Child Neurology. 58 (12), 1288-1294 (2016).
- Brandenburg, J. E., et al. Ultrasound elastography: the new frontier in direct measurement of muscle stiffness. Archives of Physical Medicine and Rehabilitation. 95 (11), 2207-2219 (2014).
- Brandenburg, J. E., et al. Feasibility and reliability of quantifying passive muscle stiffness in young children by using shear wave ultrasound elastography. Journal of Ultrasound in Medicine. 34 (4), 663-670 (2015).
- Eby, S. F., et al. Shear wave elastography of passive skeletal muscle stiffness: influences of sex and age throughout adulthood. Clinical Biomechanics. 30 (1), Bristol, Avon. 22-27 (2015).
- Eby, S. F., et al. Validation of shear wave elastography in skeletal muscle. Journal of Biomechanics. 46 (14), 2381-2387 (2013).
- Ingalls, C. P., Warren, G. L., Williams, J. H., Ward, C. W., Armstrong, R. B. E-C coupling failure in mouse EDL muscle after in vivo eccentric contractions. Journal of Applied Physiology. 85 (1), 58-67 (1998).
- Warren, G. L., Lowe, D. A., Armstrong, R. B. Measurement tools used in the study of eccentric contraction-induced injury. Sports Medicine. 27 (1), 43-59 (1999).
- Dobson, J. L., Gladden, L. B. Effect of rhythmic tetanic skeletal muscle contractions on peak muscle perfusion. Journal of Applied Physiology. 94 (1), 11-19 (2003).
- Fleming, B. C., Beynnon, B. D. In vivo measurement of ligament/tendon strains and forces: a review. Annals of Biomedical Engineering. 32 (3), 318-328 (2004).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados