Method Article
インビボ ブタからの後肢背筋アイソメトリックトルクの測定
要約
本プロトコールは、麻酔ブタにおける一般的な腓骨神経の電気刺激を介して得られたin vivoトルクデータの評価および解釈に関する簡潔な実験的詳細を記載する。
要約
骨格筋力の信頼できる評価は、神経筋および筋骨格系疾患および傷害研究において、特に再生療法の有効性を評価する際に、おそらく最も重要な転帰尺度である。さらに、多くの再生療法を翻訳する上で重要な側面は、大型動物モデルにおけるスケーラビリティと有効性の実証です。基礎科学研究において、主に小動物モデルにおいて、内因性筋機能特性を評価するために、様々な生理学的調製物が確立されている。この慣行は、in vitro (孤立した繊維、繊維束、または筋肉全体)、 in situ (無傷の血管新生および神経支配を有するが、力伝達器に取り付けられた遠位腱を有する筋肉)、および in vivo (筋肉または筋肉単位の構造は無傷のままである)。これらの準備のそれぞれに長所と短所があります。しかし、 in vivo 強度試験の明確な利点は、同じ動物で繰り返し測定を行うことができることです。本明細書には、麻酔ブタにおける標準的な腓骨電気刺激に応答して インビボで 後肢背屈筋によって産生される等尺トルクを確実に評価するための材料および方法が提示される。
概要
骨格筋の主な機能は力を生み出すことであり、最終的には呼吸、食事、歩行などの活動が可能になります。骨格筋の機能能力を低下させる状態は、パフォーマンス(職業的またはスポーツ的)、障害、または死の低下につながる可能性があります。例えば、高齢化人口における筋肉量と機能の維持は、生活の質と日常生活の基本的および器械的活動を実行する能力と正の関連があります1,2。そして、デュシェンヌ型筋ジストロフィー患者の筋力低下は、歩行不能および呼吸不全をもたらし、最終的に早期死亡に寄与する3、4、5。したがって、筋力測定は、神経筋疾患または傷害を伴う研究において重要な転帰尺度である。
最大自主アイソメトリックトルクまたはアイソキネティックトルク(および/または疲労指数)は、臨床試験6において機能的能力の指標としてしばしば使用される。動物実験では、麻酔下で電気神経刺激を用いてインビボで同様の測定を行うことができる。特に、in vivo製剤は、筋肉組織、腱、血管系、および神経支配が無傷のままであり、したがって、反復的な機能評価を可能にする低侵襲性である7、8、9、10、11。この調製物は、小型げっ歯類モデルにおいて一般的に使用され、ウサギ12、イヌ13、14、ヒツジ15、およびブタ16、17などの大型動物モデルにおいてより少ない程度で使用される。このような方法論の一般的な使用は、脊髄性筋萎縮症(SMA)の遺伝子操作されたブタ(ブタ)モデルなど、多くのトランスレーショナルリサーチ研究に影響を与える可能性があります18。本明細書には、インビボでのブタ背筋群の神経刺激誘発最大等尺トルクを評価する方法が提示されている。提示された技術は、当初、マウス前部股関節筋トルク19,20を評価するために最初に開発されたものから適応され、その後、傷害後のトルク生成能力を調査する経験17,21,22,23,24,25,26,27,28を通じて改良された。そして開発中 様々なブタモデルで16。
このプロトコルは、ロードセルと電気刺激器と統合されたコンピュータを必要とする方法論を用いた インビボ アイソメトリックトルク測定を強調しています。ここで提示される方法は、市販の統合豚アイソメトリックフットプレート試験装置、プラットフォーム装置、および対応するソフトウェアを使用する( 材料表を参照)。しかしながら、この方法論は、他の市販またはカスタムメイドのソフトウェア、データ収集装置、および刺激器を使用するように適合させることができる。これらの方法は、手術テーブルのロック、試験プラットフォーム用の同じ高さの第2のロックテーブル、人工呼吸器および監視装置、および体温を維持するための加熱マットまたは他の装置などの標準機器を備えた専用の大型動物手術スイートでの使用を目的としています。
これらの方法を実施するには、1人の熟練した麻酔技術者と2人の研究担当者が機能テストを実行する必要があります。これらの人々は、プラットフォーム装置上の四肢の初期安定化のために一緒に働くでしょう。その後、2人の人員のうちの1人が電極の配置/位置決めを担当し、もう1人がテスト中のコンピュータアプリケーションを担当します。
プロトコル
すべての動物実験は、動物愛護法、実施動物福祉規則、および実験動物の世話と使用のためのガイドの原則に準拠して実施されました。以前の試験では、これらの方法が信頼性が高く26 、ブタの健康や四肢の機能に悪影響を及ぼさないことが実証されています。検査は毎週のように頻繁に行われており、有害事象は発生していない23。さらに、同じ日に手術前および手術後の介入を試験することは、動物に不快なストレスをかけたり、神経筋機能障害を誘発したりすることなく行うことができる。
1. コンピュータのセットアップ
- 装置およびコンポーネントの初期設定と校正が製造仕様に基づいて実施されていることを確認します( 材料表を参照)。0.2 ~ 2.5 kg の範囲の重量を使用した校正が推奨されます。
メモ:トルクは、50ニュートンメートル(N·m)の容量を持つリニアトルクセンサに取り付けられた140mmフットペダル(0.14m)によって測定されます。この装置のゲインは、予想されるトルク生産によりよく適合するように、デフォルトで25N·m容量にスケーリングするように設定されています。較正は、既知の距離(例えば、回転軸から100mm)でフットペダルに既知の質量(例えば、1kg)を適用し、トルクを計算することによって行われる。例えば、1kgで9.806Nが0.1mで印加され、トルクは0.9806N・mである。次に、トルクセンサに印加されるトルクと、トルクセンサによって出力される対応する電圧との間に関係を確立することができる。著者のトルクセンサは、特定の40cm校正プレートに適用された0.2〜20kgのこの関係の直線性を確認した。標準ペダルの長さのため、0.2〜2.5kgの校正範囲を推奨します。これにより、線形回帰によってスケール係数を計算するのに十分な信号が生成されます。 - 試験の約30分前にコンピュータ、刺激器、トランスデューサシステム、およびアナログ/デジタルインタフェースの電源を入れて、電気的特性に影響を与える可能性のある熱関連材料の変化を安定化させます。適切な接続されたデータ集録(DAQ)デバイスを選択します。
- 必要に応じてソフトウェアで実験パラメータを設定します。ソフトウェアは、保存された研究テンプレートを可能にします。[新しい試験ワークブック の作成] オプションを使用して新しい試験を作成するための実験(試験テンプレートなど)を設定する準備をします。
注: 実験パラメータは、試験を開始する前に事前にロードすることができ、その結果、性別、体重、生年月日、試験の時点、治療群、または必要に応じて同様の変数などの追加の特定の実験情報を含めるように求められます。試験設定パラメータは保存し、実験全体で使用できます。 - 各評価の開始時に以前に作成したスタディを選択します。これがテストされるブタの最初のテストである場合は、 新しい動物を追加し、 スタディへの変数入力のプロンプトに従います。
- 試験を開始する準備ができたら、[ 実験の準備 ]をクリックします。これは、電極の配置を最適化するために必要になります。電極が配置されたら最適な配置を決定しながら、神経に繰り返しけいれんを届けます(ステップ3.6を参照)。
- 最初に [インスタント スティムの設定 ]をクリックし、次にパルス周波数、パルス幅、パルス数、トレーニング周波数、およびランタイムを調整します。
- 次に、 インスタントシム をクリックして、繰り返しけいれんを配信します。または、刺激ユニットの 手動トリガー ボタンを押して、手動で1回のけいれんを与えます。
- 試験プロトコール中に ライブデータモニター を開き、実験全体を開始する準備ができたら、収縮のリアルタイム調査/視覚化を可能にします。実験を開始するには、準備が完了したら [ 実験の実行 ] をクリックします (動物の準備後、手順 2 を参照)。
2.麻酔の準備と維持
- 麻酔イベントの前に一晩、速い雄または雌豚、40-90 kg、水を 自由に許可します。処置の日にブタの正しい体重を取得して記録する。
- チレタミン/ゾルゼパム(テラゾール、4〜6mg / kg)、キシラジン(1〜3mg / kg)、およびプロポフォール(2.6mg / kg)の筋肉内注射で麻酔を誘発する。最初はフェイスマスク を介して 5%イソフルランで維持する。
- 気管内チューブでブタを挿管し、自動換気装置の上に置きます。ブタをピーク圧で20 cm H2O、初期一回換気量10 mL/kg、呼吸数を8〜12呼吸/分に保ちます。
- 換気装置の設定を調整して、潮汐終端 PCO2 を 40 ± 5 mmHg に維持します。30%〜37%O2中の1%〜3%イソフルランで麻酔を維持する。
- プロトコールの期間中、ブタの体温を37°Cに維持する。必要に応じて、耳静脈とフォーリーカテーテルを挿入して、体液送達と採尿を行います。
注:外科用平面麻酔を使用すると、検査中の二次収縮、特に臀部筋からの二次収縮を防ぐことができます。 - 眼の反射と位置、顎の緊張の欠如、心拍数(範囲80-150 bpm)、収縮期血圧(範囲120-70 mmHg)、またはこれらすべての徴候の組み合わせ を介して 麻酔の深さを監視します。
- 豚が完全に麻酔され、安定したら、まず石鹸と水で四肢をきれいにして破片を取り除き、次に皮膚から髪を剃ることによって、右と左の後肢の両方を準備します。後で電極の配置に使用される横の膝の領域に細心の注意を払ってください。
- 豚を手術台に運び、仰臥位にしっかりと置きます。ブタをテーブルの端またはわずかに上に臀部筋肉をつけて、ブタをテーブルの足の方に置きます。
注:これにより、手術台と検査装置を保持するテーブルが当接できるようになります。 - テスト後にブタを抜管し、それらが回復するのを許します。標準的な豚の食べ物と水は、豚が完全に回復し、ケージ内で自由に歩行できるようになったら交換する必要があります。
注:処置後の鎮痛は、 in vivo 試験のみには不要である。しかしながら、カルプロフェンおよび/またはブプレノルフィンSRは、獣医の勧告に従って提供することができる。地元の獣医師との相談が奨励されています。ここにリストされている麻酔と薬はガイダンスのみを目的としており、現在ミネソタ大学で承認されています。イソフルランによる麻酔の維持は、その急速な発症および相殺ならびに インビボ 神経刺激誘発トルク29に対するその最小の影響に基づいて選択された。研究間で麻酔パラメータに一貫性があるように注意してください。プロトコルの間、麻酔の評価および記録は15分間隔で実施される。記録は、地元の施設動物ケアおよび使用委員会(IACUC)および米国農務省(USDA)のガイドラインおよび要件に基づいて行われます。
3. 生体内 アイソメトリックトルクの評価
- 力変換器のフットプレートに足を置きます。柔軟な凝集性包帯を使用して、足をフットプレートに取り付けます。
注: 1 フィートあたりの役割全体が必要です。理想的には、4インチ x 5ヤードの役割で十分です。 - 足首をニュートラルにしてフットプレート(A)に足を所定の位置に保持し、閉じたバスケット織り足首テーピング(B)のスタイルで足とフットプレートの周りに凝集包帯を巻き付けて足をプレートに固定します。
注:2人の研究担当者は、個々の(A)と(B)のタスクを同時に実行する必要があります。 - 足が足のプレートに固定されたら、足底または背屈の程度を基準にするために0°またはニュートラルとして定義され、足首を直角に配置します。
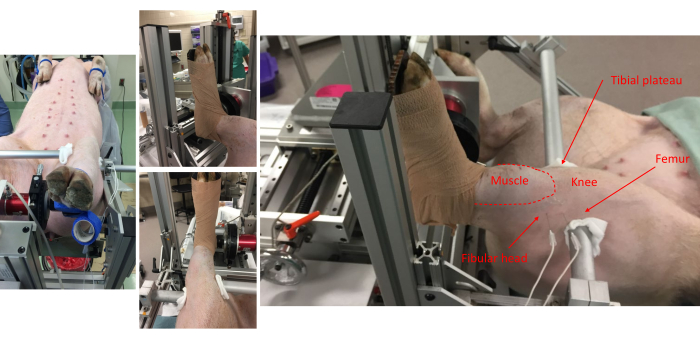
図1:さまざまな見晴らしの良い場所からの写真は、フットプレートへのブタの取り付けとフレームへの解剖学的位置合わせを示しています。 前部コンパートメント筋肉、腓骨頭、膝、脛骨高原、および大腿骨の解剖学的ランドマークが注目される。脚の側側に皮下電極対が配置されていることに注意してください。 この図の拡大版を表示するには、ここをクリックしてください。
- 膝と足首を直角に安定させます。
- まず、四肢クランプバーを必要な位置の近くに置きます。準備ができたら、四肢の内側の側面から始めて、四肢クランプバーを脛骨高原の周りに合わせます。
- 次に、外肢クランプバーを大腿骨の遠位頭部に合わせます。
メモ:各四肢の端の間にあるクランプバーは、折り畳まれた4 x 4ガーゼパッドを使用して、バーに隣接する皮膚を保護します。 - ロック蝶ネジを使用してバーをしっかりと安定させます。
注:四肢クランプバーは互いに一直線に並ぶことはありませんが、豚の解剖学的構造と一致します。 - 意図した電極配置の中心から始めて外側に移動する同心円のきれいなガーゼ を介して 70%アルコールを塗布することによって、腓骨頭部の周りの皮膚をきれいにする。滅菌経皮針(50 mm、26 G単極)および筋電図(EMG)スタイルの電極( 材料表を参照)を腓骨神経全体に置きます。皮下に電極を移植し、約5〜10mm。
- 刺激器で調整された電流振幅の増加を使用して、電極の配置を最適化します。100 mA から開始し、必要に応じて増やします。
注:ピークツイッチトルクには通常300~500mAが必要です。 - ライブデータビューとブタの前部コンパートメント上のけいれんトルクの大きさを視覚化します。ひづめはスプレイして上方に移動することもあります。
- 後部コンパートメント、または脛骨神経が刺激中に活性化されていないことを確認してください。刺激中の蹄の後部コンパートメントの収縮および下方への動きを視覚的に検査し、触診する。
- 次の手順で、生トルクタイムトレースから破傷風収縮のプラトー領域を検査し、アンタゴニスト筋動員の欠如(すなわち、このプロトコルに対する足底屈曲)について調べる。
- 電極の配置と刺激振幅が最適化されると、100 Hz、0.1 msのパルス幅、800 msの列17にわたって、次の刺激パラメータを使用して最大等尺破傷植物トルクを引き出す。
注: これらのパラメータは、さまざまな収縮性評価に使用できます。
4. トルクジョイント角度解析のプロトコル
- 中性から足底屈曲の近端範囲、または足底屈曲の0〜50°の範囲の足首位置にわたって最大等尺破傷植物トルクを測定します。
注:10°増分を使用するには6つの収縮が必要であり、増分変化は特定の実験問題に対して調整できます。 - ゴニオメーターステージの両方のロックネジを緩めて、関節角度間を移動します。次の収縮の前に、両方のロックネジが締め付けられていることを確認します。
注:ゴニオメーターには度数マーキングが刻まれており、正確な位置合わせが可能です。足底屈曲の可能性が高い0°であり、ゴニオメーターでは180°オフセットされています。意図した位置決めを確実に行うように注意してください。 - 実験的に収縮間の時間を決定します;しかし、疲労を避けるためには2分で十分です。
メモ:足首の関節角度が徐々に変化すると、針の電極がずれることがあります。上記のように、痙攣収縮を伴う電極の配置を確認する必要があるかもしれません(ステップ3.8を参照)。
5. トルク周波数解析のプロトコル
- 足首を所望の関節角度に位置決めする。実験的には、毎回同じ関節角度でテストを行うように注意してください。
メモ: 通常、トルク周波数解析は、トルク-ジョイント角度解析から派生したピークアイソメトリックトルクに対応する単一のジョイント角度で実行されます。ピークトルクは、約30〜35°の足底屈曲で生成されます。 - 完全に融合したテタニを誘発するものまで、およびそれを超える非融合痙攣の列を誘発する刺激周波数の範囲にわたって最大等尺トルクを測定する。
注: これは、疲労を避けるために、10、20、40、60、および 100 Hz (パルス幅 0.1 ミリ秒、800 ミリ秒の列) で各収縮の間に 2 分間で刺激することによって実現できます。正確な実験的質問と特定のブタモデルに応じて、頻度を適応させることができる。細胞内ATPを維持するために800msの収縮の間に利用される可能性が最も高い生体エネルギー基質はホスホクレアチン30であり、ホスホクレアチンの再合成はホスホクレアチンシャトル31に依存する。ホスホクレアチン回収動態は、収縮終了後30〜120秒の間に90%以上の顕著な回復を示す。したがって、収縮間の推奨される休息間隔は90〜120秒です。しかし、これは筋肉疾患、傷害、および/または老化を含む実験計画によって影響を受ける可能性がある。
6. データ解析
- ソフトウェアにまだある場合は、[ 結果の分析 ]をクリックして、[解析]ウィンドウを開きます。または、分析プログラムを直接開きます。
- 自動データプラットフォームを使用するか手動分析を使用するかにかかわらず、個々のアイソメトリック波形を分析する際にさまざまな変数を計算します。
注:これらの変数には、最大痙攣トルク、最大破傷風トルク、および痙攣およびテタニに関連する収縮特性(例えば、ピークまでの時間および半弛緩)が含まれる。多くの実験変数は、力、例えば、体重、MRI(磁気共鳴画像法)またはCT(コンピュータ断層撮影法)から決定された筋肉体積、または終末筋重量を正規化することができる。絶対トルク(N·m)とボディマスに正規化されたトルク(N·m/kg)の両方が表示されます。フットプレートに置かれた休息トルクは、実験によって異なる。休息トルクのベースライン補正を適用して、真の最大けいれんと破傷風トルクが記録されるようにする必要があります。各関節角度でのベースライントルクが記録され、受動トルクの変化を示すことができます。
結果
ブタの前区画の インビボ 試験パラメータの信頼性および最適化は、以前に報告されている26。トルク周波数に関するげっ歯類とブタの比較データも報告されている27。
in vivo評価では、適切な前部コンパートメントの活性化を確実にするために、トルク波形をリアルタイムで視覚化する必要があります。波形は背屈のみを反映する必要があります。波形は滑らかで丸みを帯びた外観で、破傷風のプラトーが明らかになっているはずです(図2A)。波形の不整合または摂動は、不十分な刺激、不適切な電極配置、または不十分な麻酔の深さなど、さまざまな実験上の限界を示しています(図2B)。
図3A は、最大トルク50%を示す矢印によるツイッチトルクタイムトレースである。ピークまでの時間収縮は、刺激装置の開始時に開始し、最大痙攣トルクが達成された時点で終了すべきである(代表的なタイムバーはトレースの下に示されている)。けいれんの半弛緩は、最大けいれんトルクで始まり、最大けいれんトルクの50%で終わる必要があります(代表的なタイムバーはトレースの下に表示されます)。 図3B は、最大トルク50%を示す矢印による破傷風トルクタイムトレースである。決定的でタイムリーな最大トルクの点で理想的なけいれんとは異なり、破傷風収縮は、刺激器の開始時と終了時に関する最大トルクのタイミングの変動性が大きく、収縮特性分析に対するより微妙なアプローチが必要です。ピークまでの収縮時間は、刺激装置の開始から始まり、最大トルクの90%〜100%の間のどこかで停止する必要があります。 図3B のタイムバーは、最大トルク95%のカットオフを示しています。これは、プラトーフェーズの後半まで最大トルクに達しないため、選択した代表データなどの場合に便利です。ピークまでの時間を補完する分析は、平均収縮率です。トルク タイム トレースの上向きの四肢の破線のバーは、最大トルク 30% ~ 70% の範囲を表します。平均収縮率は刺激の開始時に開始し、最大トルク30%〜70%の平均速度変化を捉える必要があります。これらは推奨範囲であり、個々の研究グループは、約50%(例えば、±10%)の理想的な範囲を決定することができる。重要な部分は、研究内および研究間で一貫していることです。けいれんとは対照的に、破傷風収縮半弛緩は、ピークまでの時間で上記と同じ理由で最大トルクではなく、刺激の終わりに開始されるべきである。 図3B の時間バーは、刺激の終了から50%の緩和に達するまでの時間を表す。半緩和の補完的な分析は、緩和の平均率です。トルクトレースの下降肢の破線のバーは、上り肢と同じ30%〜70%の最大トルク範囲を表します。平均緩和率は、刺激の終了時に開始し、30%〜70%の最大トルク間の平均変化率をキャプチャする必要があります。繰り返しますが、これらは推奨される範囲です。1つの重要な注意点:収縮/緩和の平均速度を収縮/緩和の最大速度と混同しないでください。最大レートは、隣接する 2 つのデータ ポイント間の最も顕著な 1 つのレート変化を表し、大きく変動する可能性があります。
いくつかの痙攣および収縮特性を分析して、骨格筋の繊維タイプおよび興奮収縮結合属性についての洞察を得ることができる10、32。けいれんおよび収縮特性の過剰解釈は注意される。それらは、さらなる細胞レベルの尋問のための提案および理論的根拠を表し、必ずしも示唆的ではない。一般に、収縮性の速度は、筋小胞体カルシウム放出およびミオシン重鎖アイソフォーム酵素速度を反映することができる。対照的に、緩和率は、サルコ(小)小胞体カルシウムATPase酵素率およびアイソフォームを反映することができる。これらの特性は、疲労、筋肉損傷、運動トレーニング、および多数の病状(例えば、廃用萎縮)によって影響され得る。
図4は、損傷していない四肢のトルク周波数およびトルク関節角度関係の代表値を示しています。これらのデータは、幅広いブタサイズを代表しています。
表面筋電図の代表的な実験的分析を 、インビボ 筋分析(図5)中に実施し、速度コードおよび総筋活性の実験的制御を実証した。接着EMG電極は、三分儀の腓骨の中腹部に配置した。刺激アーチファクトを最小限に抑えるために膝の上に接地電極を配置し、筋肉位置の近位にある腓骨神経の周りに刺激電極針を配置した。トルクとEMGを同時に記録し、20、60、および100Hzの刺激周波数で行った。刺激器パルスの数( 図5の赤いバー)は、刺激持続時間とパルス間の時間の商を反映しています。たとえば、20 Hz の刺激周波数は、50 ミリ秒ごとのパルスを意味します。したがって、400 msの刺激持続時間をパルス間の50 msで割ると、8つのパルスが供給されます(図5A)。刺激器パルスは、経皮的針電極配置 を介して 神経軸索に送達され、同数の電気筋肉パルスを生成し(すなわち、20Hzは8回のEMG記録に等しい)、関心のある筋肉群の活動電位周波数の実験的制御を実証する。生のEMG記録は、二乗平均平方根分析(EMG RMS) を介して 変換して、刺激頻度の増加に伴う総筋肉活動を視覚化することができます。曲線下面積(AUC)分析は、筋電図RMSを定量化して全筋活動の変化を決定する1つの方法です。RMS刺激周波数ごとに代表的なAUCsが提供される(図5A−C)。
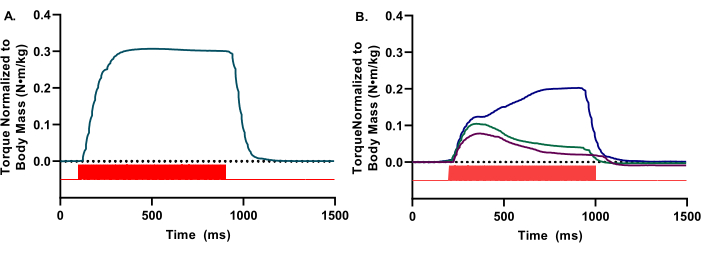
図2:代表的な高品質波形と低品質波形。 (A)アイソメトリック波形は、矩形波の外観で存在し、顕著な流体プラトーを有する。(B)低品質の波形は、不適切な刺激または不適切な電極配置が原因である可能性があります。このような場合、電極の再配置が必要です。 A と Bの両方について、刺激器パルス(赤いバー)が示されます。 この図の拡大版を表示するには、ここをクリックしてください。
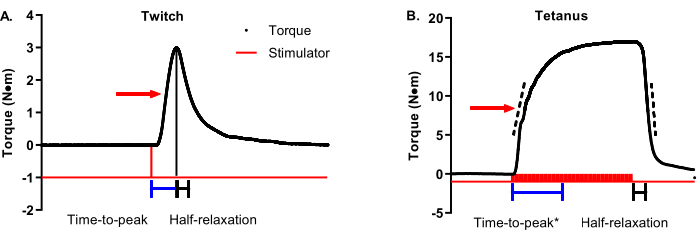
図3:Twitchと破傷風の収縮特性分析 (A)代表的なけいれん(1Hz)および(B)破傷風(100Hz)トルクタイムトレースは、収縮特性を詳述するように修正されています。各グラフの赤い矢印は、最大トルクの50%を示しています。トレースの下にある青と黒のバーは、それぞれピークまでの時間と半分の緩和時間を示します。破傷風トルクタイムトレースの上端と下降肢の破線バーは、収縮または緩和の平均速度を決定するために使用できる30%〜70%の最大トルクの範囲を表します。 この図の拡大版を表示するには、ここをクリックしてください。
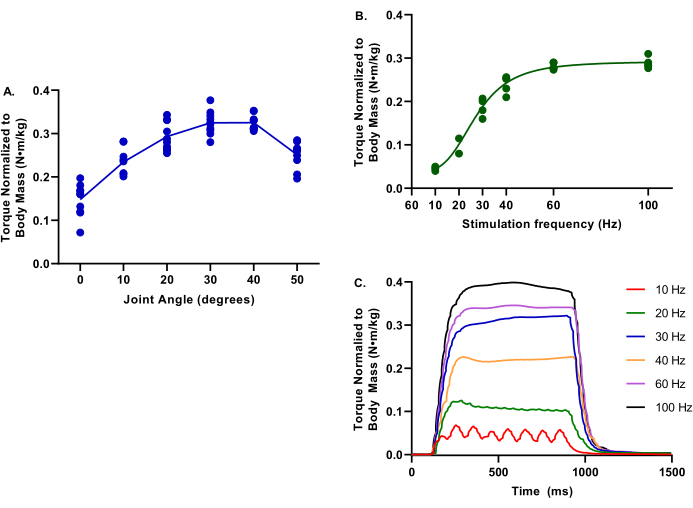
図4:トルクジョイント角度とトルク周波数のデータ例 提供されたデータは、2.9〜6.3ヶ月の雌ヨークシャークロスブタの範囲からのものです。39.4-75.4キロ体重;すべて評価時に健全な制御とみなされた。すべての試験の間、深部体温は37°Cに維持された(A)体重に正規化されたトルクは、0〜50°の足底屈曲の足首関節で評価される。ピークトルクは30°で決定されることに注意してください。(B)体重に正規化されたトルクは、10〜100Hzの様々な刺激周波数で評価される。これらの評価は、足底屈曲の30°で足首関節で実施されたことに注意してください。(c)各刺激周波数の個々のトルクトレースを評価した。 この図の拡大版を表示するには、ここをクリックしてください。
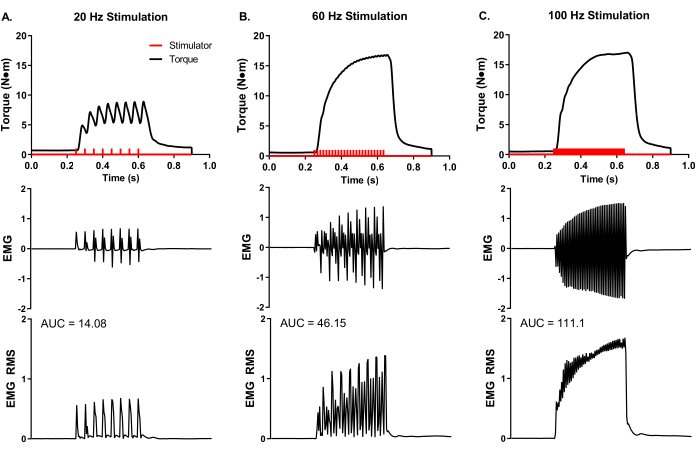
図5: インビボア イソメトリックトルクとEMGの同時測定。 (A)20、(B)60、および(C)100Hzの代表的な刺激周波数でのEMGおよびトルクの同時記録を、雌ヨークシャーブタ(〜90kg体重)から収集した。刺激器パルス(赤いバー)は、設定された刺激周波数に従って送達された。生のEMG記録を二乗平均平方根(EMG RMS)に変換し、刺激頻度の増加とともに総筋肉活動を視覚化した。代表的なEMG RMS曲線を曲線下面積(AUC)について分析し、AUCを刺激周波数ごとに提供する。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
重要な手順、変更、トラブルシューティング
データの変動性を最小限に抑え、アプローチの成功を最大化するために、次の重要な手順が強調表示されます。
最適な神経刺激
この実験的アプローチは、神経軸索脱分極から始まり、正しい電極配置と最適化された電気刺激に依存しています。骨のランドマークに関連する神経解剖学の死後分析は、テスト中の適切な電極配置を視覚化するのに役立ちます。最大けいれんトルクを獲得することは、神経軸索に送達される適切な電流(ミリアンペア単位、mA)を決定するのに役立ちます。検査開始時に神経刺激を最適化する際に留意すべき2つの値があります:(1)けいれん対破傷風比は〜1:5であり、例えば、〜2N·mのけいれんトルクは10N·m破傷風トルクに対応する(図3)。(2)体重に対する典型的なトルクは、体重1kgあたり約0.3N·mである(図4)。ピーク時のけいれんトルクが低い場合は、電極を取り外して別の配置を試みます。刺激器の設定、BNC接続、電極接続を必ず確認してください。上記のように、関節角度間の四肢の位置決め中に動きが多すぎる場合、収縮の間に電極の再配置が必要になることがあります(図2)。実験的および介入的なアプローチは、これらの値に影響を与える可能性があることに注意してください。
適切な生体力学的アライメント
開始筋肉の長さは筋肉の収縮力(長さと張力の関係)に影響し、筋肉の長さは股関節、膝関節、足首関節の整列に基づいて変化する可能性があります。関節の角度は、手足間およびブタ間で標準化されなければならない。90°の足首関節角度は、股関節と膝に強く推奨されます。わずかに足底屈曲した足首の位置(中立の0°の足首関節角度から約30°)は、ピーク強度に最適です。これは、立っている間の豚と犬の両方の足首関節の自然な解剖学的位置を反映しています。また、すべてのジョイントはフットペダルおよびトルクトランスデューサと平行にして、垂直トルクベクトルの寄与による測定可能なトルクの損失を回避する必要があります。股関節 - 膝 - 足首関節の角度と足 - ペダル - 関節の位置合わせを検査することは、足をフットペダルに固定し、膝関節を四肢クランプバーで固定した後に強くお勧めします(図1)。ずれがある場合は、バーのロックを解除して取り外し、手術台に豚の位置を変えます。研究間で関節角度を標準化することは、データの分散を最小限に抑えるために重要ですが、以下で説明する注目すべき生体力学的アライメントには限界があります。
既存または代替方法に関する意義
ブタモデルに使用できる筋肉機能の臨床的関連性および非侵襲的評価の代替例には、トレッドミル歩行距離、EMG、および活動的な筋肉横波電気測定が含まれる。ヒトにおける6分間歩行試験として、トレッドミル歩行試験は、大型動物における疾患進行および介入成功を評価することができる33、34、35。典型的には、馴化期間の後、動物は、異なるトレッドミル速度および/または傾斜レベルでコンプライアンスの終わりまで歩行される。食物報酬は、多くの場合、最大のモチベーションを達成するために必要です。しかし、トレッドミル歩行転帰は、被験者の動機付け、非最大運動単位の募集、および心臓血管系、骨格系、呼吸器系などの他の身体系への固有の共依存などの制限のために、筋肉収縮機能の間接的な解釈のみを提供する。
一方、EMG電極は、関心のある筋肉群に直接配置されるので、筋電図系のわずかに良好な直接評価を提供する36、37、38。EMG電極は、集団的な筋活動(脱分極筋線維)を測定する。この筋活動は、運動単位の募集と速度符号化(募集された運動単位に送られる活動電位の頻度)に基づいている。しかし、モータユニットの募集とレートコーディングの相対的な寄与を分離することは、表面EMGでは不可能です。さらに、EMGは被験者が最大の収縮を生成する意欲に依存しており、このレベルの協力は大型動物モデルではありそうにない。歩行サイクル中の筋電図の変化を評価することは有益であり得るが、これらのデータは、関心のある骨格筋群の最大の機能的能力を表すものではない。Bモードおよび横波エラストグラフィーを利用した超音波ベースのイメージングは、筋肉機能を評価するために使用される別の非侵襲的モダリティである。エラストグラフィーによって測定されたヤング率と筋肉負荷の増加との間には良好な相関関係がある39,40。剪断波エラストグラフィーは、ブタ体積測定筋損失損傷モデル23において含む受動的組織剛性41、42、43、44、45の定量的尺度として検証および使用される。また、活動的な筋力産生39の間接的な測定として用いてもよい。しかし、被験者が収縮を行う意欲と協力に対するEMGに似た制限は依然として存在する。
ここに記載される in vivo プロトコルは、トレッドミル歩行距離およびEMGとは対照的に、筋肉機能の信頼性が高く、再現性があり、かつ最大評価を提供する。このプロトコルは、モチベーションとは無関係に、制御された定量化可能な方法で筋肉の収縮を呼び起こします。具体的には、経皮電極は、中枢神経系を迂回する軸索の神経を刺激するために使用される。神経軸索の脱分極は、すべての運動単位に関与し、運動単位の動員に関連する変動を排除する。さらに、研究者は、速度コーディング(刺激頻度)を制御する。このアプローチに適用される結果として生じる神経筋生理学は、ランヴィエの節における電位依存性ナトリウムチャネル活性化から始まる。その後のすべての(または下流の)生理学は、励起収縮結合およびクロスブリッジサイクリングを含む、関与する。 in vivo 非侵襲的筋肉分析の重要な利点は、収縮性筋機能を繰り返し、例えば毎週、傷害、介入、または疾患進行後の筋力を監視することができることである。
方法の制限事項
このプロトコルに記載された in vivo 機器は、関節角度および刺激周波数の関数として受動的および能動的アイソメトリックトルクを可能にする。使用される試験装置は、動的収縮(例えば、等動論的偏心または同心円収縮)の測定をサポートしていない。この装置は、トルク-ジョイント角度の関係を特徴付けるために105°の可動域を可能にし、最大トルク範囲が〜50N·mのロードセルを使用する。特定の実験的な質問には、これらの仕様外の性能特性が必要な場合があります。注目すべきことに、この記載された装置上のロードセルは、必要に応じてより大きなトルク範囲に交換され得る。
インビボで最大神経筋強度を測定するための本明細書に記載のプロトコールには、顕著な限界がある。第1に、この方法は麻酔を必要とし、これは動物施設のプロトコルおよび資源ごとに異なる方法で実施され得る。麻酔薬は神経筋機能に様々な効果を有することが知られており、麻酔薬型および用量依存的にマウスの生体内背筋トルク産生を変化させることが示されている29。大型動物の生体内トルクに対する麻酔薬の差異効果は不明である。したがって、対照群および実験群は、この変動性を制御するために同じ麻酔剤(例えば、ケタミンを投与されるすべての群)を有していなければならない。第二に、in vivo拡散パターンへの依存は、収縮機能障害および急性薬物毒性の細胞機構の探索を制限する。例えば、カフェインは、単離された筋肉のインビトロ器官浴試験中に、筋小胞体カルシウム放出を刺激し、興奮収縮結合46を直接バイパスするために使用することができる。この効果を誘導するカフェインの量(mM)は、in vivo設定では致命的である。このアプローチが急性筋力に対する薬物スクリーニングに使用される場合、全身に対する薬物の影響(例えば、腎臓/肝臓ストレス)および循環に分泌されるその後の要因を考慮する必要がある23。第三に、最大電気神経刺激の使用は、上で論じたように、自発的な募集戦略から逸脱しており、したがって、神経筋動員適応に起因する可能性のある強度の変化を反映していない。
インビボトルク測定は、実験観察のための特定のメカニズムを確立することに関しても制限され得る。例えば、足首関節に関するトルクは、筋力産生だけでなく、腱および関節および結合組織特性にも依存する。さらに、力は筋肉のグループ、特にブタの足底屈筋(腓腹筋、ヒラメ筋、足底筋)および背屈筋(腓骨三分節、脛骨筋、およびジジトルム筋)によって生成される。したがって、最大in vivoトルクデータの解釈は、潜在的な筋内膜および解剖学的変化を考慮する必要があり、個々の筋肉ではなく筋肉群に限定される。関連して、筋肉群は、足底屈筋の腓腹筋およびヒラメ筋などの主に速い筋線維および遅い筋線維の混合物からなることが多い。収縮および弛緩の速度(またはピークまでの時間収縮および半弛緩時間)などの収縮特性は、in vitroまたはin situ試験プロトコル47などの単離された筋肉調製物に対するin vivoを用いた繊維型生理学の信頼できる指標ではない。単離された筋肉製剤は、筋肉の長さなどの特性を正確に制御することができるため、筋肉機能に対する生体力学的パラメータの影響を理解するのにも優れている。腱(例えば、弛み)、筋肉(例えば、ペネーション角、筋節の重なり)、および関節(例えば、モーメントアーム)のトルク産生に寄与する特性は関節角度に依存するため、関節角度 - トルク関係は筋肉の長さ - 力関係と直接等価ではないことを強調することが重要である。そのために、大型動物のin situ機能試験48は、in situ試験が最終実験であることを念頭に置いて、in vivo試験への貴重な追加となり得る。実験的知見の機構的洞察を改善するために将来探求され得る現在のプロトコルへの他の進歩には、筋肉および腱の構造的特性を測定するための超音波Bモード画像化の使用、および随意および電気的に刺激された収縮中の筋力を測定するための腱力トランスデューサの移植49が含まれる。
この方法の重要性と潜在的な用途
このプロトコールは、ブタ背筋群の インビボ トルク産生能力を評価し、生理学的設定における筋機能の増減を評価する非侵襲的方法を実証する。この方法論はブタにとって非終末的であるため、疾患の進行中、または治療戦略の前、最中、および後に、同じ被験者の筋肉機能を縦方向に評価するためにも使用することができる。そのため、反復測定実験計画は、独立した測定と比較して、より大きな検出力とより少ない動物との堅牢な統計的比較を可能にする可能性がある。さらに、骨格筋機能障害は、慢性疾患関連筋消耗(例えば、心不全、腎不全、AIDS、癌など)、筋ジストロフィー、神経変性疾患(例えば、SMAまたは筋萎縮性側索硬化症;ALS)、老化(すなわち、サルコペニア)、および薬物毒性。骨格筋機能能力は、運動、栄養、薬物および再生医療療法などの介入のための重要な主要転帰尺度である。したがって、本明細書に記載のプロトコールは、 インビボでの ブタトルク生成能力を確実に評価するために、多数の研究用途にわたって使用され得る。これは、開発中の治療法の翻訳のための広範な動物データを取得するのに役立つかもしれません。
開示事項
ここに含まれる意見や主張は、著者の個人的な見解です。これらは、公式として、または陸軍省、国防総省、または米国政府の見解を反映していると解釈されるべきではありません。
ビデオ記事の制作とオープンアクセスの可用性は、Aurora Scientific, Inc.が後援し、Matthew BorkowskiはAurora Scientific Inc.に雇用されています。この会社は、調査結果から潜在的に利益を得る可能性があります。
謝辞
提示された作業とデータは、BTCとSMG(#MR140099;#C_003_2015_USAISR;#C_001_2018_USAISR)への米国陸軍医学研究および材料司令部によって広く支援されました。退役軍人省、退役軍人保健局、研究開発局(I21 RX003188)は、JACとルーク・ブリュースター博士に。著者らは、USAISR獣医サービスおよび比較病理学部門とUMN先進前臨床イメージングセンターがこれらの研究を完了するための技術支援を高く評価している。
資料
| Name | Company | Catalog Number | Comments |
| 615A Dynamic Muscle Control LabBook and Analysis Software Suite | Aurora Scientific Inc. | 615A | Compatible Win Vista/7/10 |
| 892A Swine Isometric Footplate Test Apparatus | Aurora Scientific Inc. | 892A | Includes Isometric Load Cell, Pig Footplate, Goniometer stage and positioners |
| Calibration Weights | Ohaus or similar | 80850116 | |
| Computer | Aurora Scientific or any vendor | 601A | Computer must include data acquisition card and interface for software |
| Gauze pad | Various vendors | 4 by 4 squares or similar | |
| Monopolar Needle Electrodes | Chalgren, Electrode Store, or similar vendor | 242-550-24TP, or DTM-2.00SAF | |
| Non-adhesive Flexiable Tape | 3M, Coflex, or similar | 4 inch by 5 yard role | |
| Stimulator | Aurora Scientific or comparable | 701C | Must include constant current stimulation mode |
参考文献
- Verlaan, S., et al. Nutritional status, body composition, and quality of life in community-dwelling sarcopenic and non-sarcopenic older adults: A case-control study. Clinical Nutrition. 36 (1), 267-274 (2017).
- Wang, D. X. M., Yao, J., Zirek, Y., Reijnierse, E. M., Maier, A. B. Muscle mass, strength, and physical performance predicting activities of daily living: a meta-analysis. Journal of Cachexia, Sarcopenia and Muscle. 11 (1), 3-25 (2020).
- Ishikawa, Y., et al. Duchenne muscular dystrophy: survival by cardio-respiratory interventions. Neuromuscular Disorders. 21 (1), 47-51 (2011).
- Khirani, S., et al. Respiratory muscle decline in Duchenne muscular dystrophy. Pediatric Pulmonology. 49 (5), 473-481 (2014).
- Ziter, F. A., Allsop, K. G., Tyler, F. H. Assessment of muscle strength in Duchenne muscular dystrophy. Neurology. 27 (10), 981-984 (1977).
- Garg, K., et al. Volumetric muscle loss: persistent functional deficits beyond frank loss of tissue. Journal of Orthopaedic Research. 33 (1), 40-46 (2015).
- Lovering, R. M., Roche, J. A., Goodall, M. H., Clark, B. B., McMillan, A. An in vivo rodent model of contraction-induced injury and non-invasive monitoring of recovery. Journal of Visualized Experiments: JoVE. (51), e2782 (2011).
- Mintz, E. L., Passipieri, J. A., Lovell, D. Y., Christ, G. J. Applications of in vivo functional testing of the rat tibialis anterior for evaluating tissue engineered skeletal muscle repair. Journal of Visualized Experiments: JoVE. (116), e54487 (2016).
- Call, J. A., Warren, G. L., Verma, M., Lowe, D. A. Acute failure of action potential conduction in mdx muscle reveals new mechanism of contraction-induced force loss. The Journal of Physiology. 591, 3765-3776 (2013).
- Call, J. A., Eckhoff, M. D., Baltgalvis, K. A., Warren, G. L., Lowe, D. A. Adaptive strength gains in dystrophic muscle exposed to repeated bouts of eccentric contraction. The Journal of Physiology. 111 (6), 1768-1777 (2011).
- Ingalls, C. P., Wenke, J. C., Nofal, T., Armstrong, R. B. Adaptation to lengthening contraction-induced injury in mouse muscle. The Journal of Physiology. 97 (3), 1067-1076 (2004).
- Hyman, S. A., et al. In vivo supraspinatus muscle contractility and architecture in rabbit. The Journal of Physiology. 129 (6), 1405-1412 (2020).
- Childers, M. K., Grange, R. W., Kornegay, J. N. In vivo canine muscle function assay. Journal of Visualized Experiments: JoVE. (50), e2623 (2011).
- Grange, R. W., et al. Muscle function in a canine model of X-linked myotubular myopathy. Muscle & Nerve. 46 (4), 588-591 (2012).
- Novakova, S. S., et al. Repairing volumetric muscle loss in the ovine peroneus tertius following a 3-month recovery. Tissue Engineering Part A. , (2020).
- Maeng, G., et al. Humanized skeletal muscle in MYF5/MYOD/MYF6-null pig embryos. Nature Biomedical Engineering. , (2021).
- Ward, C. L., et al. Autologous minced muscle grafts improve muscle strength in a porcine model of volumetric muscle loss injury. Journal of Orthopaedic Trauma. 30 (12), 396-402 (2016).
- Prather, R. S., Lorson, M., Ross, J. W., Whyte, J. J., Walters, E. Genetically engineered pig models for human diseases. Annual Review of Animal Biosciences. 1, 203-219 (2013).
- Lowe, D. A., Warren, G. L., Ingalls, C. P., Boorstein, D. B., Armstrong, R. B. Muscle function and protein metabolism after initiation of eccentric contraction-induced injury. Journal of Applied Physiology. 79 (4), 1260-1270 (1995).
- Ashton-Miller, J. A., He, Y., Kadhiresan, V. A., McCubbrey, D. A., Faulkner, J. A. An apparatus to measure in vivo biomechanical behavior of dorsi- and plantarflexors of mouse ankle. Journal of Applied Physiology. 72 (3), 1205-1211 (1992).
- Chao, T., Burmeister, D. M., Corona, B. T., Greising, S. M. Oxidative pathophysiology following volumetric muscle loss injury in a porcine model. Journal of Applied Physiology. 126 (6), 1541-1549 (2019).
- Corona, B. T., Greising, S. M. Challenges to acellular biological scaffold mediated skeletal muscle tissue regeneration. Biomaterials. 104, 238-246 (2016).
- Corona, B. T., Rivera, J. C., Dalske, K. A., Wenke, J. C., Greising, S. M. Pharmacological Mitigation of Fibrosis in a Porcine Model of Volumetric Muscle Loss Injury. Tissue Engineering Part A. , (2020).
- Corona, B. T., Rivera, J. C., Greising, S. M. Inflammatory and physiological consequences of debridement of fibrous tissue after volumetric muscle loss injury. Clinical and Translational Science. 11 (2), 208-217 (2018).
- Corona, B. T., Rivera, J. C., Wenke, J. C., Greising, S. M. Tacrolimus as an adjunct to autologus minced muscle grafts for the repair of a volumetric muscle loss injury. Journal of Experimental Orthopaedics. 4 (1), 36 (2017).
- Greising, S. M., et al. Unwavering pathobiology of volumetric muscle loss injury. Scientific Reports. 7 (1), 13179 (2017).
- Pollot, B. E., Corona, B. T. Volumetric muscle loss. Methods in Molecular Biology. 1460, 19-31 (2016).
- Kheirabadi, B. S., et al. Long-term effects of Combat Ready Clamp application to control junctional hemorrhage in swine. The Journal of Trauma and Acute Care Surgery. 77 (3), 101-108 (2014).
- Ingalls, C. P., Warren, G. L., Lowe, D. A., Boorstein, D. B., Armstrong, R. B. Differential effects of anesthetics on in vivo skeletal muscle contractile function in the mouse. Journal of Applied Physiology. 80 (1), 332-340 (1996).
- Forbes, S. C., Paganini, A. T., Slade, J. M., Towse, T. F., Meyer, R. A. Phosphocreatine recovery kinetics following low- and high-intensity exercise in human triceps surae and rat posterior hindlimb muscles. American Journal of Physiology. Regulatory, Integrative and Comparative Physiology. 296 (1), 161-170 (2009).
- Meyer, R. A., Sweeney, H. L., Kushmerick, M. J. A simple analysis of the "phosphocreatine shuttle.". American Journal of Physiology. 246 (5), 365-377 (1984).
- McKeehen, J. N., et al. Adaptations of mouse skeletal muscle to low-intensity vibration training. Medicine & Science in Sports & Exercise. 45 (6), 1051-1059 (2013).
- Boakye, M., et al. Treadmill-based gait kinematics in the yucatan mini pig. Journal of Neurotrauma. 37 (21), 2277-2291 (2020).
- Woodman, C. R., Muller, J. M., Laughlin, M. H., Price, E. M. Induction of nitric oxide synthase mRNA in coronary resistance arteries isolated from exercise-trained pigs. American Journal of Physiology. 273 (6), 2575-2579 (1997).
- Boddy, K. N., Roche, B. M., Schwartz, D. S., Nakayama, T., Hamlin, R. L. Evaluation of the six-minute walk test in dogs. American Journal of Veterinary Research. 65 (3), 311-313 (2004).
- Valentin, S., Zsoldos, R. R. Surface electromyography in animal biomechanics: A systematic review. Journal of Electromyography & Kinesiology. 28, 167-183 (2016).
- Stegeman, D. F., Blok, J. H., Hermens, H. J., Roeleveld, K. Surface EMG models: properties and applications. Journal of Electromyography & Kinesiology. 10 (5), 313-326 (2000).
- Zwarts, M. J., Stegeman, D. F. Multichannel surface EMG: basic aspects and clinical utility. Muscle Nerve. 28 (1), 1-17 (2003).
- Liu, J., et al. Non-invasive quantitative assessment of muscle force based on ultrasonic shear wave elastography. Ultrasound in Medicine and Biology. 45 (2), 440-451 (2019).
- Wang, A. B., Perreault, E. J., Royston, T. J., Lee, S. S. M. Changes in shear wave propagation within skeletal muscle during active and passive force generation. Journal of Applied Biomechanics. 94, 115-122 (2019).
- Brandenburg, J. E., et al. Quantifying passive muscle stiffness in children with and without cerebral palsy using ultrasound shear wave elastography. Developmental Medicine & Child Neurology. 58 (12), 1288-1294 (2016).
- Brandenburg, J. E., et al. Ultrasound elastography: the new frontier in direct measurement of muscle stiffness. Archives of Physical Medicine and Rehabilitation. 95 (11), 2207-2219 (2014).
- Brandenburg, J. E., et al. Feasibility and reliability of quantifying passive muscle stiffness in young children by using shear wave ultrasound elastography. Journal of Ultrasound in Medicine. 34 (4), 663-670 (2015).
- Eby, S. F., et al. Shear wave elastography of passive skeletal muscle stiffness: influences of sex and age throughout adulthood. Clinical Biomechanics. 30 (1), 22-27 (2015).
- Eby, S. F., et al. Validation of shear wave elastography in skeletal muscle. Journal of Biomechanics. 46 (14), 2381-2387 (2013).
- Ingalls, C. P., Warren, G. L., Williams, J. H., Ward, C. W., Armstrong, R. B. E-C coupling failure in mouse EDL muscle after in vivo eccentric contractions. Journal of Applied Physiology. 85 (1), 58-67 (1998).
- Warren, G. L., Lowe, D. A., Armstrong, R. B. Measurement tools used in the study of eccentric contraction-induced injury. Sports Medicine. 27 (1), 43-59 (1999).
- Dobson, J. L., Gladden, L. B. Effect of rhythmic tetanic skeletal muscle contractions on peak muscle perfusion. Journal of Applied Physiology. 94 (1), 11-19 (2003).
- Fleming, B. C., Beynnon, B. D. In vivo measurement of ligament/tendon strains and forces: a review. Annals of Biomedical Engineering. 32 (3), 318-328 (2004).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved