A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
مقايسات نقل طاقة الرنين Förster التي تم حلها بمرور الوقت لقياس بروتينات STAT المفسفرة الداخلية في الخلايا البشرية
In This Article
Summary
يتم وصف بروتوكولات الفحص الخلوي القائم على خلايا نقل طاقة Förster التي تم حلها عبر الزمن من أجل التحديد الكمي البسيط والمحدد والحساس والقوي لمحول الإشارة المفسفرة الداخلي ومنشط النسخ (STAT) 1/3/4/5/6 البروتينات في محللات الخلايا بتنسيق 384 بئرا.
Abstract
يلعب محول الإشارة Janus kinase (JAK) / منشط مسار إشارات النسخ (STAT) دورا حاسما في التوسط في الاستجابات الخلوية للسيتوكينات وعوامل النمو. يتم تنشيط بروتينات STAT عن طريق فسفرة التيروزين بوساطة JAKs بشكل رئيسي. التنشيط غير الطبيعي لمسارات إشارات STAT متورط في العديد من الأمراض البشرية ، وخاصة السرطان والحالات المرتبطة بالمناعة. لذلك ، فإن القدرة على مراقبة فسفرة بروتين STAT داخل بيئة إشارات الخلايا الأصلية مهمة لكل من الأبحاث الأكاديمية واكتشاف الأدوية. تشمل تنسيقات الفحص التقليدية المتاحة لقياس بروتينات STAT المفسفرة النشاف الغربي ومقايسة الممتز المناعي المرتبط بالإنزيم (ELISA). هذه الطرق غير المتجانسة كثيفة العمالة ، ومنخفضة الإنتاجية ، وغالبا ما تكون غير موثوقة (محددة) في حالة النشاف الغربي. تتوفر طرق متجانسة (بدون غسل) ولكنها تظل باهظة الثمن.
هنا ، يتم توفير بروتوكولات مفصلة للقياس الحساس والقوي والفعال من حيث التكلفة في تنسيق 384 بئرا للمستويات الداخلية من STAT1 المفسفرة (Y701) و STAT3 (Y705) و STAT4 (Y693) و STAT5 (Y694 / Y699) و STAT6 (Y641) في محللات الخلايا من الخلايا الملتصقة أو المعلقة باستخدام منصة نقل طاقة الرنين Förster الجديدة التي تم حلها بمرور الوقت (TR-FRET). سير العمل للفحص الخلوي بسيط وسريع ومصمم للفحص عالي الإنتاجية (HTS). بروتوكول الفحص مرن ، ويستخدم عينة منخفضة الحجم (15 ميكرولتر) ، ويتطلب خطوة واحدة فقط لإضافة الكاشف ، ويمكن تكييفه مع التطبيقات منخفضة الإنتاجية وعالية الإنتاجية. يتم التحقق من صحة كل اختبار مناعي لساندويتش فوسفو-ستات في ظل ظروف محسنة مع ناهضات ومثبطات معروفة ويولد قيم علم الأدوية وعامل Z المتوقعة. نظرا لأن اختبارات TR-FRET هي نسبة قياسية ولا تتطلب خطوات غسيل ، فإنها توفر قابلية تكرار أفضل بكثير من الأساليب التقليدية. توفر هذه المجموعة من الفحوصات معا أدوات جديدة فعالة من حيث التكلفة لإجراء تحليل أكثر شمولا لبروتينات STAT المفسفرة المحددة بعد معالجة الخلايا وفحص وتوصيف المعدلات المحددة والانتقائية لمسار إشارات JAK / STAT.
Introduction
يلعب مسار إشارات JAK/STAT دورا رئيسيا في التوسط في الاستجابات الخلوية للسيتوكينات المتنوعة والإنترفيرون وعوامل النمو والجزيئات ذات الصلة1,2. يؤدي ربط هذه الروابط بمستقبلات سطح الخلية المحددة إلى تنشيط JAKs ، والتي بدورها تنشط بروتينات STAT عن طريق الفسفرة لبقايا التيروزين المحددة. ينتج عن الفسفرة STAT تعريضها ونقلها إلى النواة ، حيث تمارس تأثيرها على نسخ الجينات المستهدفة المنظمة. تتكون عائلة STAT من سبعة أعضاء: STAT1 و STAT2 و STAT3 و STAT4 و STAT5a و STAT5b و STAT6. يلعب الأعضاء دورا معقدا وأساسيا في تنظيم عمليات الخلايا الفسيولوجية ، بما في ذلك الانتشار والتمايز وموت الخلايا المبرمج وتكوين الأوعية الدموية وتنظيم الجهاز المناعي. التنشيط غير الطبيعي لمسارات إشارات STAT متورط في العديد من الأمراض البشرية ، وخاصة السرطان والحالات المتعلقة بالمناعة3,4. لذلك ، فإن القدرة على تقييم فسفرة بروتين STAT داخل بيئة إشارات الخلايا الأصلية مهمة لكل من الأبحاث الأكاديمية واكتشاف الأدوية.
حتى الآن ، فإن الطرق التقليدية المستخدمة لقياس مستويات البروتين المفسفرة داخل الخلايا ، بما في ذلك STATs ، تعتمد على الأجسام المضادة وتشمل النشاف الغربي ، ELISA ، وقياس التدفق الخلوي الفوسفولي. هذه الطرق غير المتجانسة كثيفة العمالة ، وتستغرق وقتا طويلا ، وعرضة للخطأ ، وإنتاجية منخفضة ، وغالبا ما تكون غير موثوقة (على سبيل المثال ، قضايا الخصوصية) في حالة النشاف الغربي5. وعلى النقيض من ذلك، تتطلب الفحوصات المتجانسة خطوات تجريبية أقل، وتستخدم كميات عينات أصغر، وتكون قابلة لهيئة تحرير الشام. هناك خمس منصات متجانسة للمقايسة المناعية القائمة على الخلايا متاحة تجاريا يمكن استخدامها لمراقبة الفسفرة المعتمدة على JAK من STATs في الليزات الخلوية: SureFire و HTRF و LANCE و LanthaScreen و Lumit. كل من هذه المنصات لها مزاياها وعيوبها.
يعتمد SureFire على تقنية توجيه الأكسجين المضيئة ، والتي تستخدم الخرز المانح والمتقبل المطلي لالتقاط زوج من الأجسام المضادة على وجه التحديد ، أحدها بيوتينيل. في وجود البروتين المفسفر، يجلب الجسمان المضادان حبات المتبرع والمتقبل إلى مكان قريب، مما يتيح توليد إشارة كيميائية مضيئة6. على الرغم من أن هذه التكنولوجيا متعددة الاستخدامات وحساسة ، إلا أنها باهظة الثمن ، وتتأثر بالبيوتين في وسط الثقافة ، وهي حساسة للغاية لدرجة الحرارة المحيطة والضوء ، وتتطلب قارئا خاصا للكشف. يعتمد كل من HTRF و LANCE على تقنية TR-FRET التي تستخدم مجمعات أيون اللانثانيد المضيئة طويلة العمر (مخلبات اليوروبيوم أو التربيوم ، أو تشفير اليوروبيوم) كجزيئات مانحة والفلوروفورات الحمراء البعيدة كجزيئات متقبلة 7. عندما يتم جلب اثنين من الأجسام المضادة الخاصة بالبروتين الموسومة إما بجزيئات مانحة أو متقبلة إلى مكان قريب ، يحدث FRET ، مما يتسبب في زيادة في تألق المتقبل وانخفاض في تألق المانحين. يمكن قياس إشارات الفلورسنت طويلة العمر هذه بطريقة يتم حلها زمنيا ونسبة مئوية لتقليل تداخل الفحص وزيادة جودة البيانات. المزايا الأخرى ل TR-FRET هي أنها ليست حساسة للضوء ، وتسمح بالقراءات المتكررة ، وتظهر ثبات إشارة طويل. في حين يتم تنفيذ TR-FRET على نطاق واسع في هيئة تحرير الشام بسبب تنوعها وحساسيتها ومتانتها العالية ، فإن جميع منصات الفحص التجارية القائمة على TR-FRET باهظة الثمن ، مما يحول دون اعتمادها على نطاق واسع في المختبرات الأكاديمية والصناعية الصغيرة. يستخدم فحص LanthaScreen أيضا قراءة قائمة على TR-FRET ولكنه يعتمد على خط خلية U2OS هندسي يعبر بثبات عن بروتين الفلورسنت الأخضر (GFP)-STAT1 الاندماجي جنبا إلى جنب مع الجسم المضاد STAT1 الخاص بالفوسفو المسمى بالتربيوم8. بالإضافة إلى كونها محدودة من حيث اختيار بروتينات الإشارة ، تتطلب هذه الطريقة شراء خطوط الخلايا المنقولة باهظة الثمن ، مما يقلل من قابليتها للتطبيق ويزيد من إمكانية القطع الأثرية التجريبية. Lumit عبارة عن منصة مقايسة مناعية عامة للإضاءة الحيوية تستخدم الأجسام المضادة الثانوية (المضادة للفأر والمضادة للأرانب) المصنفة كيميائيا مع الوحدات الفرعية NanoBit الصغيرة والكبيرة من NanoLuc Luciferase9. إن ربط اثنين من الأجسام المضادة الأولية بالبروتين المستهدف يجعل الأجسام المضادة الثانوية قريبة لتشكيل إنزيم نشط يولد إشارة تلألؤ. في حين أن التلألؤ هو عموما قراءة حساسة وقوية ، فإن متطلبات الأجسام المضادة الأولية التي يتم تربيتها في نوعين مختلفين تحد من خيارات تصميم الفحص. بالإضافة إلى ذلك ، قد يكون استخدام الأجسام المضادة الثانوية في مصفوفات العينات المعقدة عرضة لتداخل المقايسة.
وبالتالي ، لا تزال هناك حاجة إلى منصة فحص موثوقة وسريعة وبأسعار معقولة تعتمد على الخلايا لقياس البروتينات الفردية المفسفرة والكلية STAT بطريقة متوافقة مع HTS. ولتلبية هذه الحاجة، تم تطوير منصة جديدة للمقايسة المناعية القائمة على الخلايا عالية الإنتاجية استنادا إلى تقنية TR-FRET المحسنة (THUNDER) والمصممة لتمكين قياس بسيط وحساس وقوي وفعال من حيث التكلفة للبروتينات داخل الخلايا المعبر عنها داخليا (المفسفرة أو الكلية) في الليزات الخلوية. تنبع مزايا هذه التقنية من الجمع بين زوج FRET المانح / المتقبل الذي يظهر توافقا طيفيا استثنائيا وإشارة TR-FRET ، والأجسام المضادة التي تم التحقق منها بدقة ، والمخازن المؤقتة المحسنة للتحليل. يتم تنسيق هذه الفحوصات كمقايسات مناعية للساندويتش وتستخدم سير عمل مباشر من ثلاث خطوات (الشكل 1). يتم التعامل مع الخلايا أولا لتعديل فسفرة البروتين ثم يتم تحليلها باستخدام مخزن التحلل العازل المحدد المقدم في المجموعة. يتم الكشف عن البروتين المستهدف المفسفرة أو بروتين STAT الكلي في الخلية المحللة في خطوة واحدة لإضافة كاشف وحضانة مع زوج من الأجسام المضادة التي تحمل علامة الفلوروفور التي تتعرف على ظواهر مميزة على البروتين المستهدف (الشكل 2). يتم تصنيف أحد الأجسام المضادة مع متبرع مخلب اليوروبيوم (Eu-Ab1) ، في حين يتم تصنيف الجسم المضاد الثاني مع فلوروفور متقبل أحمر بعيد (FR-Ab2). يرتبط الجسمان المضادان الموسومان بالبروتين الموجود في المحلول ، مما يجعل الملصقين قريبين من بعضهما البعض. يؤدي إثارة مخلب اليوروبيوم المتبرع عند 320 أو 340 نانومتر إلى تشغيل FRET إلى المتقبل ، والذي ينبعث منه إشارة TR-FRET طويلة العمر عند 665 نانومتر تتناسب مع تركيز البروتين المستهدف (المفسفرة أو الإجمالية) في محللات الخلية.
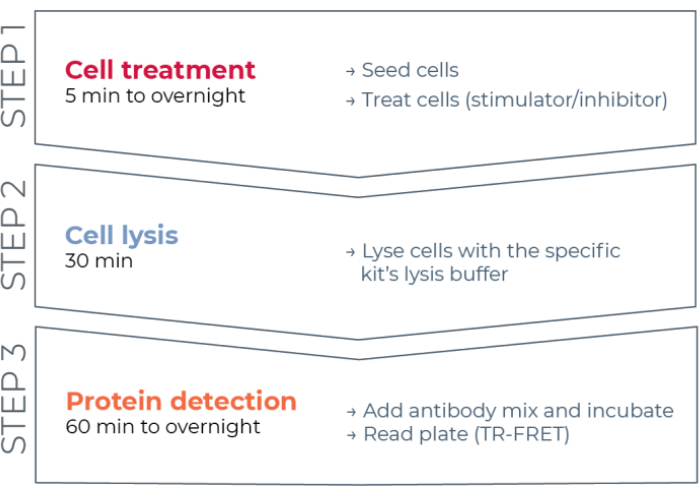
الشكل 1: سير عمل فحص TR-FRET. يتكون سير العمل من ثلاث خطوات: معالجة الخلايا ، وتحلل الخلايا ، واكتشاف البروتين باستخدام TR-FRET. في بروتوكول الفحص المكون من صفيحتين ، يتم نقل الليزات إلى لوحة كشف بيضاء من 384 بئرا ، بينما في بروتوكول اللوحة الواحدة ، يتم إجراء جميع الخطوات في نفس لوحة الكشف البيضاء 384 بئرا (بروتوكول الكل في البئر الواحد). بغض النظر عن بروتوكول الفحص المستخدم ، يتم إجراء الكشف عن البروتين بنفس الحجم الكلي (20 ميكرولتر لكل بئر). اختصار: TR-FRET = نقل طاقة الرنين Förster الذي تم حله بمرور الوقت. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: مبدأ المقايسة المناعية لساندويتش TR-FRET. يتم تسمية أحد الأجسام المضادة بمتبرع مخلب اليوروبيوم (Eu-Ab1) والثاني مع متقبل الفلوروفور الصغير الأحمر (FR-Ab2). يرتبط الجسمان المضادان المصنفان على وجه التحديد بظواهر مميزة على البروتين المستهدف (المفسفرة أو الكلية) في محللات الخلية ، مما يجعل اثنين من الفلوروفورات في مكان قريب. إثارة مخلب يوروبيوم المتبرع عند 320 أو 340 نانومتر يؤدي إلى FRET من المتبرع إلى جزيئات المستقبل ، والتي بدورها تنبعث منها إشارة عند 665 نانومتر. هذه الإشارة تتناسب مع تركيز البروتين في الخلية lysate. في حالة عدم وجود البروتين المستهدف المحدد ، تكون الفلوروفورات المانحة والمتقبلة بعيدة جدا عن بعضها البعض بحيث لا يمكن أن تحدث FRET. الاختصارات: FRET = نقل طاقة الرنين Förster; TR-FRET = FRET الذي تم حله بمرور الوقت ؛ Ab = الأجسام المضادة; FR = أحمر بعيد; Eu - مخلب اليوروبيوم. P = الفسفرة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
هنا ، يتم توفير بروتوكولات مفصلة لقياس ، بتنسيق 384 بئرا ، المستويات داخل الخلايا من STAT1 (Y701) ، STAT3 (Y705) ، STAT4 (Y693) ، STAT5 (Y694 / Y699) ، و STAT6 (Y641) ، جنبا إلى جنب مع إجمالي STAT1 و STAT3 و STAT5 و STAT6 ، في محللات الخلايا من الخلايا الملتصقة أو المعلقة باستخدام منصة THUNDER TR-FRET. تحدد هذه البروتوكولات خطوات لمعالجة الخلايا والتحلل والكشف عن البروتين المستهدف القائم على TR-FRET باستخدام بروتوكول نقل من صفيحتين أو بروتوكول بئر الكل في واحد من صفيحة واحدة. يتم تطبيق هذه الفحوصات القائمة على الخلايا لتحديد الملف الدوائي للمنشطات والمثبطات المعروفة لمسار JAK / STAT. يتم إثبات متانة وملاءمة الفحوصات المختارة لهيئة تحرير الشام. أخيرا ، تتم مناقشة التجارب الرئيسية لتحسين المقايسة ، إلى جانب توصيات لاستكشاف أخطاء الفحص وإصلاحها.
Protocol
1. زراعة الخلايا
- حافظ على الخلايا في حاضنة رطبة 37 درجة مئوية / 5٪ CO2 وثقافة مع إما DMEM مكملة مع 10٪ مصل البقر الجنيني (FBS) (خلايا HeLa و A431) أو RPMI مكملة مع 15٪ FBS (خلايا U266B1). قم بزراعة الخلايا حتى تصل إلى التقاء 70-80٪ ، ثم قم بتربسينها ومرورها أو استخدامها في المقاييس.
ملاحظة: احتوت وسائل الإعلام الثقافية على الفينول الأحمر. لم يتم إجراء تجويع المصل لأي خط خلوي قبل إجراء الفحوصات.
2. معايرة المحفز أو المثبط باستخدام بروتوكول الفحص المكون من صفيحتين مع الخلايا الملتصقة
ملاحظة: يصف هذا الإجراء كيفية تحديد قدرات المحفز أو المثبط عن طريق توليد منحنى استجابة التركيز من سلسلة تخفيف مركب الاختبار.
- بذر الخلايا
- قم بتوزيع 50 ميكرولتر من الخلايا بالكثافة المحسنة مسبقا (40000 خلية HeLa / بئر لكل من STAT3 و STAT6 ؛ 75000 خلية A431 / بئر ل STAT5) في لوحة معالجة بزراعة الأنسجة من 96 بئرا في وسط الثقافة المناسب. احتضان بين عشية وضحاها في 37 درجة مئوية / 5 ٪ CO2.
ملاحظة: يجب تحديد كثافة الخلايا المثلى ووقت حضانة الثقافة.
- قم بتوزيع 50 ميكرولتر من الخلايا بالكثافة المحسنة مسبقا (40000 خلية HeLa / بئر لكل من STAT3 و STAT6 ؛ 75000 خلية A431 / بئر ل STAT5) في لوحة معالجة بزراعة الأنسجة من 96 بئرا في وسط الثقافة المناسب. احتضان بين عشية وضحاها في 37 درجة مئوية / 5 ٪ CO2.
- تخفيفات مركبات الاختبار
- قم بإعداد سلسلة تخفيف متوسطة 2x من مركب (مركبات) الاختبار عن طريق تخفيف مركب (مركبات) متسلسل (تخفيفات الفاصل الزمني نصف السجل) عبر 12 بئرا من صفيحة البولي بروبيلين 96 بئرا إلى وسط خال من المصل.
ملاحظة: يوصى بإجراء منحنى استجابة تركيز الفاصل الزمني نصف الفاصل الزمني المكون من 12 نقطة في نسختين على الأقل للحصول على تقدير دقيق ل EC50 أو IC50. - بدلا من ذلك ، بالنسبة لمركبات الاختبار القابلة للذوبان في ثنائي ميثيل سلفوكسيد (DMSO) الكارهة للماء ، قم بإجراء التخفيفات الأولية في 100٪ DMSO ، ثم قم بتخفيف سلسلة تخفيف المركب إلى وسط خال من المصل.
ملاحظة: يجب تحديد مدى تحمل الفحص ل DMSO قبل إجراء معايرة مركبة اختبار في مركبة DMSO. من المهم الحفاظ على تركيزات متساوية من المذيبات بين الخلايا المعالجة وغير المعالجة. بالإضافة إلى ذلك ، عند اختبار التخفيفات التسلسلية للمركبات ، يجب أن تظل تركيزات المذيبات ثابتة دائما عبر سلسلة التخفيف.
- قم بإعداد سلسلة تخفيف متوسطة 2x من مركب (مركبات) الاختبار عن طريق تخفيف مركب (مركبات) متسلسل (تخفيفات الفاصل الزمني نصف السجل) عبر 12 بئرا من صفيحة البولي بروبيلين 96 بئرا إلى وسط خال من المصل.
- علاج الخلايا
- لتحفيز الخلايا ، أضف 50 ميكرولتر من الوسط الخالي من المصل وحده (الخلايا غير المعالجة) أو التي تحتوي على المحفز (2x).
- احتضان الوقت الأمثل مسبقا إما في درجة حرارة الغرفة (RT) أو 37 درجة مئوية (الإنترفيرون (IFN) α2b / 20 دقيقة في RT ل STAT3 ؛ عامل نمو البشرة (EGF) / 10 دقائق في RT ل STAT5 ؛ الإنترلوكين (IL) -4/20 دقيقة في RT ل STAT6). انتقل بعد ذلك إلى القسم 2.4.
ملاحظة: يجب تحديد درجة حرارة الحضانة المثلى. - لتثبيط الخلايا ، أضف 25 ميكرولتر من الوسط الخالي من المصل وحده (الخلايا غير المعالجة) أو التي تحتوي على المثبط (4x).
- احتضان الوقت الأمثل مسبقا إما في RT أو 37 درجة مئوية (مثبط JAK 1/30 دقيقة في RT ل STAT3 و STAT6 ؛ Erlotinib / 15 دقيقة في RT ل STAT5).
- أضف 25 ميكرولتر من الوسط الخالي من المصل وحده (الخلايا غير المعالجة) أو التي تحتوي على المحفز (4x) في EC80.
- احتضان للوقت الأمثل مسبقا إما عند RT أو 37 درجة مئوية (نفس الظروف كما هو الحال بالنسبة للخطوة 2.3.2).
- تحلل الخلايا
- قم بإعداد مخزن التحلل التكميلي الخاص بالمجموعة 1x كما هو موضح من قبل الشركة المصنعة.
ملاحظة: من الضروري استكمال 1x Lysis Buffer مع كوكتيل مثبط الفوسفاتيز 100x المخفف إلى تركيز نهائي من 1x. يحتوي مخزن التحلل التكميلي 1x على فلوريد الصوديوم 1 mM ، و 2 mM orthovanadate الصوديوم ، و 2 mM beta-glycerophosphate. مثبطات الفوسفاتيز الأخرى ليست مطلوبة ويجب تجنبها. لا ينصح باستخدام مخازن التحلل ومثبطات الفوسفاتيز بخلاف تلك المضمنة في المجموعة لأنها قد تحتوي على مكونات يمكن أن تتداخل مع القياس. - قم بإزالة وتجاهل وسط زراعة الخلايا بعناية عن طريق شفط السوبرناتانت.
- أضف على الفور 50 ميكرولتر من 1x المخزن المؤقت للتحلل المكمل.
ملاحظة: قد يتم تحسين حجم المخزن المؤقت للتحلل (25-50 ميكرولتر). - احتضن لمدة 30 دقيقة في RT تحت الاهتزاز (شاكر اللوحة المدارية المحدد عند 400 دورة في الدقيقة ؛ إثارة معتدلة).
ملاحظة: يمكن تحسين وقت حضانة التحلل (30-60 دقيقة). يمكن استخدام Lysates على الفور للكشف عن البروتين المستهدف أو تجميده عند -80 درجة مئوية.
- قم بإعداد مخزن التحلل التكميلي الخاص بالمجموعة 1x كما هو موضح من قبل الشركة المصنعة.
- الكشف عن TR-FRET
- قم بإعداد مزيج الكشف عن الأجسام المضادة 4x في مخزن مؤقت للكشف 1x كما هو موضح من قبل الشركة المصنعة.
- في خطوة النقل هذه ، قم بماصة 15 ميكرولتر من تحلل الخلايا بعناية من لوحة الاستزراع المكونة من 96 بئرا إلى بئر من صفيحة صغيرة بيضاء منخفضة الحجم بحجم 384 بئرا.
- أضف 15 ميكرولتر من محللة التحكم الإيجابي و 15 ميكرولتر من 1x Lysis Buffer (التحكم السلبي) لفصل آبار المقايسة.
- أضف 5 ميكرولتر من مزيج الكشف عن الأجسام المضادة 4x (إما Eu-Ab1 / FR-Ab2 للكشف عن بروتين الفوسفو أو Eu-Ab3 / FR-Ab4 للكشف عن البروتين الكلي) إلى كل بئر من آبار الفحص.
- قم بتغطية اللوحة بسدادة لوحة واحتضنها لمدة 1 ساعة حتى الليل في RT ، اعتمادا على الفحص (انظر ورقة البيانات الفنية المقابلة).
ملاحظة: يجب تحسين وقت القراءة الأمثل لكل فحص وسطر خلية. يمكن قراءة اللوحة عدة مرات دون تأثير سلبي على أداء الفحص. - قم بإزالة مانع تسرب اللوحة اللاصقة واقرأ اللوحة على قارئ لوحة دقيقة متوافق مع TR-FRET.
ملاحظة: يوصى باستخدام مقاييس الفلورومتر القائمة على الفلتر، على الرغم من أنه يمكن استخدام بعض الأدوات أحادية اللون. تحقق من تثبيت الوحدة البصرية المناسبة (المرشحات والمرآة) ل TR-FRET. استخدم الطول الموجي للإثارة 320 أو 340 نانومتر لإثارة مخلب اليوروبيوم. اقرأ الفحوصات عند كل من 615 نانومتر (أو 620 نانومتر) و 665 نانومتر للكشف عن كل من الانبعاثات من اليوروبيوم المتبرع والفلوروفور المتقبل ، على التوالي. تعتمد إعدادات الأداة على القارئ المعين. تم الحصول على البيانات المعروضة هنا باستخدام الإثارة القائمة على المصباح ، وتأخير 90 ميكروثانية ، ووقت تكامل 300 ميكروثانية ، و 100 ومضة لكل بئر. ومع ذلك ، تمت قراءة فحص phospho-STAT4 باستخدام إثارة الليزر لتوليد نسب أعلى من الإشارة إلى الخلفية (S / B).
3. معايرة المحفز أو المثبط باستخدام بروتوكول الفحص المكون من صفيحتين مع خلايا التعليق
- تخفيف مركبات الاختبار
- قم بإعداد سلسلة تخفيف متوسطة 2x من مركب (مركبات) الاختبار كما هو موضح في الخطوتين 2.2.1 و 2.2.2.
- بذر الخلايا وعلاجها
- قم بتوزيع 20 ميكرولتر من الخلايا بكثافة محسنة مسبقا (200,000 خلية U266B1 / بئر ل STAT1 ؛ 400,000 خلية U266B1 / بئر ل STAT4) في لوحة معالجة بزراعة الأنسجة من 96 بئرا في وسط الثقافة المناسب. انتقل مباشرة إلى علاج الخلايا أو احتضان 2-4 ساعات عند 37 درجة مئوية ، 5 ٪ CO2.
ملاحظة: يجب تحسين هذه الخطوة لأنواع الخلايا المختلفة. - لتحفيز الخلايا ، أضف 20 ميكرولتر من الوسط الخالي من المصل وحده (الخلايا غير المعالجة) أو التي تحتوي على المحفز (2x).
- احتضان الوقت الأمثل مسبقا إما في RT أو 37 درجة مئوية (IFNα2b / 15 دقيقة في RT ل STAT1 ؛ IFNα2b/25 دقيقة عند 37 درجة مئوية ل STAT4). انتقل بعد ذلك إلى القسم 3.3.
ملاحظة: يجب تحديد درجة حرارة الحضانة المثلى. - لتثبيط الخلايا ، أضف 10 ميكرولتر من الوسط الخالي من المصل وحده (الخلايا غير المعالجة) أو التي تحتوي على المثبط (4x).
- احتضان الوقت الأمثل مسبقا إما في RT أو 37 درجة مئوية (مثبط JAK 1/30 دقيقة في RT ل STAT1 و STAT4).
- أضف 10 ميكرولتر من الوسط الخالي من المصل وحده (الخلايا غير المعالجة) أو التي تحتوي على المحفز (4x) في EC80.
- احتضان للوقت الأمثل مسبقا إما عند RT أو 37 درجة مئوية (نفس الظروف كما هو الحال بالنسبة للخطوة 3.2.3).
- قم بتوزيع 20 ميكرولتر من الخلايا بكثافة محسنة مسبقا (200,000 خلية U266B1 / بئر ل STAT1 ؛ 400,000 خلية U266B1 / بئر ل STAT4) في لوحة معالجة بزراعة الأنسجة من 96 بئرا في وسط الثقافة المناسب. انتقل مباشرة إلى علاج الخلايا أو احتضان 2-4 ساعات عند 37 درجة مئوية ، 5 ٪ CO2.
- تحلل الخلايا
- قم بإعداد مخزن التحلل التكميلي الخاص بالمجموعة 5x كما هو موضح من قبل الشركة المصنعة.
ملاحظة: من الضروري استكمال المخزن المؤقت 5x Lysis Buffer مع كوكتيل مثبط الفوسفاتيز 100x المخفف إلى تركيز نهائي قدره 5x. يحتوي مخزن التحلل التكميلي 5x على 5 ملليمتر من فلوريد الصوديوم ، و 10 ملليمتر من أورثوفانادات الصوديوم ، و 10 ملليمتر من بيتا جليسيروفوسفات. مثبطات الفوسفاتيز الأخرى ليست مطلوبة ويجب تجنبها. - أضف 10 ميكرولتر من 5x المخزن المؤقت للتحلل المكمل.
- احتضن لمدة 30 دقيقة في RT تحت الاهتزاز (شاكر اللوحة المدارية المحدد عند 400 دورة في الدقيقة ؛ إثارة معتدلة).
ملاحظة: يمكن تحسين وقت حضانة التحلل (30-60 دقيقة). يمكن استخدام Lysates على الفور للكشف عن البروتين المستهدف أو تجميده عند -80 درجة مئوية.
- قم بإعداد مخزن التحلل التكميلي الخاص بالمجموعة 5x كما هو موضح من قبل الشركة المصنعة.
- الكشف عن TR-FRET
- بعد تحلل الخلايا ، قم بإجراء خطوة الكشف عن TR-FRET كما هو موضح في القسم 2.5 لبروتوكول الفحص المكون من صفيحتين للخلايا الملتصقة.
4. معايرة المحفز باستخدام بروتوكول الفحص أحادي الصفيحة مع الخلايا الملتصقة أو المعلقة
- تخفيف مركبات الاختبار
- تحضير سلسلة تخفيف وسيطة من مركب (مركبات) الاختبار عند 3x عن طريق تخفيف مركب (مركبات) متسلسل (تخفيفات الفاصل الزمني نصف السجل) عبر 12 بئرا من صفيحة البولي بروبيلين 96 بئرا في وسط خال من المصل.
- بذر الخلايا وعلاجها
- قم بتوزيع 8 ميكرولتر من الخلايا بكثافة محسنة مسبقا (160,000 خلية U266B1 / بئر ل STAT4 ؛ 80,000 خلية HeLa / بئر ل STAT6) ، في وسط الاستزراع المناسب الخالي من المصل ، في لوحة فحص 384well بيضاء منخفضة الحجم. انتقل مباشرة إلى علاج الخلايا أو احتضان 2-4 ساعات عند 37 درجة مئوية ، 5 ٪ CO2.
ملاحظة: يجب تحديد متطلبات فترة حضانة زراعة الخلايا قبل العلاج لأنواع الخلايا المختلفة. - لتحفيز الخلايا ، أضف 4 ميكرولتر من الوسط الخالي من المصل وحده (الخلايا غير المعالجة) أو التي تحتوي على المحفز (3x).
- احتضان الوقت الأمثل مسبقا إما في درجة حرارة الغرفة أو 37 درجة مئوية (IFNα2b / 25 دقيقة عند 37 درجة مئوية ل STAT4 ؛ IL-4/20 دقيقة عند 37 درجة مئوية ل STAT6). انتقل بعد ذلك إلى القسم 4.3.
- قم بتوزيع 8 ميكرولتر من الخلايا بكثافة محسنة مسبقا (160,000 خلية U266B1 / بئر ل STAT4 ؛ 80,000 خلية HeLa / بئر ل STAT6) ، في وسط الاستزراع المناسب الخالي من المصل ، في لوحة فحص 384well بيضاء منخفضة الحجم. انتقل مباشرة إلى علاج الخلايا أو احتضان 2-4 ساعات عند 37 درجة مئوية ، 5 ٪ CO2.
- تحلل الخلايا
- قم بإعداد مخزن التحلل التكميلي الخاص بالمجموعة 5x كما هو موضح من قبل الشركة المصنعة.
ملاحظة: من الضروري استكمال المخزن المؤقت 5x Lysis Buffer مع كوكتيل مثبط الفوسفاتيز 100x المخفف إلى تركيز نهائي قدره 5x. - أضف 3 ميكرولتر من 5x المخزن المؤقت للتحلل المكمل.
- احتضن لمدة 30 دقيقة في RT تحت الاهتزاز (اهتزاز اللوحة المدارية عند 400 دورة في الدقيقة).
ملاحظة: يمكن تحسين وقت حضانة التحلل (30-60 دقيقة). يمكن استخدام Lysates على الفور أو تجميدها عند 80 درجة مئوية.
- قم بإعداد مخزن التحلل التكميلي الخاص بالمجموعة 5x كما هو موضح من قبل الشركة المصنعة.
- الكشف عن TR-FRET
- أضف 15 ميكرولتر من محلل التحكم الإيجابي (غير المخفف) و 15 ميكرولتر من 1x المخزن المؤقت للتحلل المكمل (التحكم السلبي) لفصل آبار الفحص.
- أضف 5 ميكرولتر من مزيج الكشف عن الأجسام المضادة 4x (إما Eu-Ab1 / FR-Ab2 لبروتين الفوسفو أو Eu-Ab3-/FR-Ab4 للبروتين الكلي) المحضر في مخزن مؤقت للكشف عن 1x إلى كل بئر من آبار الفحص.
- قم بتغطية اللوحة بسدادة لوحة واحتضنها لمدة 1 ساعة حتى الليل في RT ، اعتمادا على الفحص.
ملاحظة: يجب تحسين وقت القراءة الأمثل لكل فحص وسطر خلية. يمكن قراءة اللوحة عدة مرات دون تأثير سلبي على أداء الفحص. - قم بإزالة مانع التسرب الخاص باللوحة اللاصقة. اقرأ اللوحة على قارئ microplate متوافق مع TR-FRET.
5. تحليل البيانات
- احسب نسبة TR-FRET لكل بئر باستخدام الصيغة التالية (1):
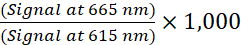 (1)
(1)
ملاحظة: نظرا لأن إشارة TR-FRET تتم قراءتها في وضع تم حلها بمرور الوقت، فإن طرح الخلفية عادة ما يكون غير ضروري. إذا تم إجراء طرح الخلفية ، فاستخدم الآبار الخالية من الخلايا التي تحتوي على 1x Supplemented Lysis Buffer (التحكم السلبي) لطرح الخلفية. أوجد متوسط نسبة TR-FRET من الآبار الخالية من الخلايا ثم اطرح هذه القيمة من نسبة TR-FRET لكل بئر. - بالنسبة لمنحنيات التركيز والاستجابة ، قم بتحليل البيانات وفقا لانحدار غير خطي باستخدام المعادلة اللوجستية المكونة من 4 معلمات (منحنى الاستجابة للجرعة السينية مع ميل متغير) وترجيح بيانات 1 / Y2 لإنشاء قيم EC50 أو IC50.
- بالنسبة لتجربة عامل Z، قم بتحليل البيانات وفقا للصيغة التالية (2)10
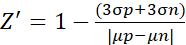 (2)
(2)
حيث μ و σ هي القيم المتوسطة والانحرافات المعيارية للتحكم الإيجابي (p ؛ الخلايا المحفزة) والتحكم السلبي (n ؛ الخلايا غير المعالجة) ، على التوالي.
النتائج
تم التحقق من صحة كل اختبار THUNDER TR-FRET دوائيا عن طريق علاج الخلايا الملتصقة (HeLa أو A431) أو الخلايا المعلقة (U266B1) باستخدام منشطات أو مثبطات خاصة بمسار JAK / STAT ثم قياس مستويات الإحصائيات المفسفرة والكلية المحددة ، عند الاقتضاء. تم إجراء الفحوصات بتنسيق 384 بئرا باستخدام بروتوكول النقل المكون من لوح?...
Discussion
بالمقارنة مع الطرق التقليدية لتحليل البروتين الفوسفوبروتيني مثل النشاف الغربي والطرق القائمة على ELISA ، فإن سير العمل الخاص بالفحص الخلوي THUNDER TR-FRET بسيط وسريع ، ويستخدم عينة منخفضة الحجم (15 ميكرولتر) ، وهو مصمم ل HTS بتنسيق 384 بئر ، وهو قابل للغاية للأتمتة. بروتوكول الفحص مرن ويمكن تكييفه بسهو...
Disclosures
المصالح المتنافسة: خايمي بادروس وميراي كارون وجينيفيف شاتيل هم موظفون في BioAuxilium Research ، التي تصنع مجموعات فحص THUNDER TR-FRET المستخدمة في هذه الدراسة. بالإضافة إلى ذلك ، خايمي بادروس وميراي كارون مساهمان في BioAuxilium Research. هذا لا يغير من التزام المؤلفين بجميع سياسات JoVE بشأن مشاركة البيانات والمواد.
Acknowledgements
اي.
Materials
| Name | Company | Catalog Number | Comments |
| 96-well microplate, clear, flat bottom, polystyrene, tissue culture-treated, sterile | Corning | 3595 | This is the plate for culturing cells when using the two-plate assay protocol. Other cell culture 96-well plates can be used |
| 384-well microplate, white, low-volume | PerkinElmer | 6007290 | This is the plate for TR-FRET detection when using the two- or one-plate assay protocols. Other low-volume, white 384-well plates can be used |
| A431 cell line | ATCC | CRL-1555 | |
| Adhesive microplate seal | PerkinElmer | 6050185 | |
| DMSO | Fisher | D159-4 | |
| Dulbecco’s modified Eagle medium (DMEM) | Wisent | 319-005-CL | THUNDER TR-FRET is compatible with culture medium containing phenol red |
| EnVision Xcite Multilabel plate reader | PerkinElmer | 2104-0020A | The assays can be performed on a variety of plate readers equipped with the TR-FRET option |
| Erlotinib hydrochloride | Sigma | CDS022564 | |
| Falcon tissue culture treated flasks | Fisher | 13-680-65 | |
| Fetal bovine serum (FBS) | Wisent | 098-150 | |
| HeLa cell line | ATCC | CCL-2 | |
| JAK Inhibitor 1 | Cayman Chemical | 15146 | |
| Orbital plate shaker | Many options available | Not applicable | |
| Recombinant human EGF | PeproTech | AF-100-15 | |
| Recombinant human IFNα2b | ProSpec | CYT-460 | |
| Recombinant human IL-4 | R&D Systems | 204-IL | |
| Roswell Park Memorial Institute 1640 medium (RPMI) | Wisent | 350-007-CL | THUNDER TR-FRET is compatible with culture medium containing phenol red |
| THUNDER Phospho-STAT1 (Y701) + Total STAT1 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT1PT-500 | |
| THUNDER Phospho-STAT3 (Y705) + Total STAT3 Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT3PT-500 | |
| THUNDER Phospho-STAT4 (Y693) TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT4P-500 | |
| THUNDER Phospho-STAT5 (Y694/Y699) + Total STAT5 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT5PT-500 | |
| THUNDER Phospho-STAT6 (Y641) + Total STAT6 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT6PT-500 | |
| Trypsin/EDTA 0.05% | Wisent | 325-542-CL | |
| U266B1 cell line | ATCC | TIB-196 | |
| Ultrapure water | NA | NA | Use Milli-Q grade water (18 MΩ.cm) to dilute Lysis Buffer and Detection Buffer |
References
- Villarino, A., Kanno, Y., O'Shea, J. Mechanisms and consequences of Jak-STAT signaling in the immune system. Nature Immunology. 18 (4), 374-384 (2017).
- Hammarén, H. M., Virtanen, A. T., Raivola, J., Silvennoinen, O. The regulation of JAKs in cytokine signaling and its breakdown in disease. Cytokine. 118, 48-63 (2019).
- O'Shea, J. J., et al. The JAK-STAT pathway: impact on human disease and therapeutic intervention. Annual Review of Medicine. 66, 311-328 (2015).
- Verhoeven, Y., et al. et al. potential and controversy of targeting STAT family members in cancer. Seminars in Cancer Biology. 60 (2), 41-56 (2020).
- Gilda, J. E., et al. et al. blotting inaccuracies with unverified antibodies: need for a Western blotting minimal reporting standard (WBMRS). PLoS One. 10 (8), 0135392 (2015).
- Binder, C., et al. et al. and utilization of the SureFire phospho-STAT5 assay for a cell-based screening campaign. Assay and Drug Development Technologies. 6 (1), 27-37 (2008).
- Ayoub, M. A., et al. Homogeneous time-resolved fluorescence-based assay to monitor extracellular signal-regulated kinase signaling in a high-throughput format. Frontiers in Endocrinology. 5, 94 (2014).
- Robers, M. B., Machleidt, T., Carlson, C. B., Bi, K. Cellular LanthaScreen and beta-lactamase reporter assays for high-throughput screening of JAK2 inhibitors. Assay and Drug Development Technologies. 6 (4), 519-529 (2008).
- Hwang, B., Engel, L., Goueli, S. A., Zegzouti, H. A. Homogeneous bioluminescent immunoassay to probe cellular signaling pathway regulation. Communications Biology. 3 (8), 1-12 (2020).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high-throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Osmond, R. I. W., Das, S., Crouch, M. F. Development of cell-based assays for cytokine receptor signaling, using an AlphaScreen SureFire assay format. Analytical Biochemistry. 403 (1-2), 94-101 (2010).
- Haan, C., et al. Jak1 has a dominant role over Jak3 in signal transduction through γc-containing cytokine receptors. Chemistry & Biology. 18 (3), 314-323 (2011).
- Kim, Y., Apetri, M., Luo, B., Settleman, J. E., Anderson, K. S. Differential effects of tyrosine kinase inhibitors on normal and oncogenic EGFR signaling and downstream effectors. Molecular Cancer Research. 13 (4), 765-774 (2015).
- Qian, J., et al. Comparison of two homogeneous cell-based kinase assays for JAK2 V617F: SureFire pSTAT5 and GeneBLAzer fluorescence resonance energy transfer assays. ASSAY and Drug Development Technologies. 10 (2), 212-217 (2012).
- Iversen, P. W., et al., Markossian, S., et al. HTS assay validation. Assay Guidance Manual. , (2012).
- Muelas, M. W., Ortega, F., Breitling, R., Bendtsen, C., Westerhoff, H. V. Rational cell culture optimization enhances experimental reproducibility in cancer cells. Scientific Reports. 8, 3029 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved