JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
인간 세포에서 내인성 인산화 STAT 단백질의 측정을 위한 시간 분해된 Förster 공명 에너지 전달 분석
요약
시간-분해된 Förster 공명 에너지 전달 세포 기반 분석 프로토콜은 384-웰 포맷의 세포 용해물에서 내인성 인산화 신호 변환기 및 전사 활성화제(STAT) 1/3/4/5/6 단백질의 단순하고, 특이적이며, 민감하고, 강력한 정량화를 위해 기술된다.
초록
야누스 키나제 (JAK) / 신호 변환기 및 전사 활성화제 (STAT) 신호 전달 경로는 사이토 카인 및 성장 인자에 대한 세포 반응을 매개하는 데 중요한 역할을합니다. STAT 단백질은 주로 JAKs에 의해 매개되는 티로신 인산화에 의해 활성화된다. STAT 신호전달 경로의 비정상적인 활성화는 많은 인간 질환, 특히 암 및 면역 관련 병태에 연루되어 있다. 따라서, 천연 세포 신호전달 환경 내에서 STAT 단백질 인산화를 모니터링하는 능력은 학술 및 약물 발견 연구 모두에 중요하다. 인산화된 STAT 단백질을 정량화하는 데 사용할 수 있는 전통적인 분석 형식에는 웨스턴 블롯팅 및 효소 결합 면역흡착 분석법(ELISA)이 포함됩니다. 이러한 이질적인 방법은 노동 집약적이고 처리량이 낮으며 웨스턴 블롯팅의 경우 종종 신뢰할 수 없습니다 (특이적). 균질 (세척 없음) 방법을 사용할 수 있지만 비싸지 만 여전히 비쌉니다.
여기서, 상세한 프로토콜은 신규한 천둥 시간 분해된 뫼르스터 공명 에너지 전달(TR-FRET) 플랫폼을 사용하여 부착성 또는 현탁 세포로부터의 세포 용해물에서 인산화된 STAT1(Y701), STAT3(Y705), STAT4(Y693), STAT5(Y694/Y699), 및 STAT6(Y641)의 내인성 수준의 384-웰 포맷으로 민감하고, 견고하며, 비용 효율적인 측정을 위해 제공된다. 세포 분석의 워크플로우는 간단하고 빠르며 고처리량 스크리닝(HTS)을 위해 설계되었습니다. 분석 프로토콜은 유연하고, 저용량 샘플(15μL)을 사용하며, 단 하나의 시약 첨가 단계만 필요로 하며, 저처리량 및 고처리량 응용 분야에 적합할 수 있습니다. 각각의 포스포-STAT 샌드위치 면역검정은 공지된 작용제 및 억제제와 함께 최적화된 조건 하에서 검증되고 예상되는 약리학 및 Z'-인자 값을 생성한다. TR-FRET 분석은 비율계량이며 세척 단계가 필요하지 않으므로 기존 접근 방식보다 훨씬 더 나은 재현성을 제공합니다. 함께, 이 분석 제품군은 세포 처리 후 특정 인산화된 STAT 단백질의 보다 포괄적인 분석과 JAK/STAT 신호전달 경로의 특이적이고 선택적인 조절제의 스크리닝 및 특성화를 위한 새로운 비용 효율적인 도구를 제공합니다.
서문
JAK/STAT 신호전달 경로는 다양한 사이토카인, 인터페론, 성장 인자 및 관련 분자1,2에 대한 세포 반응을 매개하는 데 중요한 역할을 합니다. 특정 세포-표면 수용체에 대한 이들 리간드의 결합은 JAKs의 활성화를 초래하고, 이는 차례로 특정 티로신 잔기의 인산화에 의해 STAT 단백질을 활성화시킨다. STAT 인산화는 그들의 이량체화 및 핵 내로의 전좌를 초래하며, 여기서 이들은 조절된 표적 유전자의 전사에 그들의 효과를 발휘한다. STAT 제품군은 STAT1, STAT2, STAT3, STAT4, STAT5a, STAT5b 및 STAT6의 일곱 멤버로 구성됩니다. 구성원은 증식, 분화, 아폽토시스, 혈관 신생 및 면역 체계 조절을 포함한 생리 세포 과정의 조절에 복잡하고 필수적인 역할을합니다. STAT 신호전달 경로의 비정상적 활성화는 많은 인간 질환, 특히 암 및 면역 관련 병태3,4에 연루되어 있다. 따라서, 천연 세포 신호전달 환경 내에서 STAT 단백질 인산화를 평가하는 능력은 학술 및 약물 발견 연구 모두에 중요하다.
현재까지, STATs를 포함하는 세포내 인산화된 단백질 수준을 측정하기 위해 사용된 통상적인 방법은 항체-기반 웨스턴 블롯팅, ELISA, 및 포스포플로우 세포측정법을 포함한다. 이러한 이질적인 방법은 노동 집약적이고, 시간이 많이 걸리고, 오류가 발생하기 쉽고, 처리량이 낮으며, 웨스턴 블롯팅의 경우 종종 신뢰할 수 없는(예를 들어, 특이성 문제) 이다5. 대조적으로, 동종 검정은 더 적은 실험 단계를 필요로 하고, 더 작은 샘플 부피를 사용하며, HTS에 순응할 수 있다. 세포 용해물에서 STAT의 JAK 의존성 인산화를 정량적으로 모니터링하는 데 사용할 수 있는 상업적으로 이용 가능한 다섯 개의 동종 세포 기반 면역분석 플랫폼이 있습니다: SureFire, HTRF, LANCE, LanthaScreen 및 Lumit. 이러한 각 플랫폼에는 장점과 단점이 있습니다.
SureFire는 발광 산소 채널링 기술을 기반으로하며, 공여체 및 수용체 비드를 사용하여 한 쌍의 항체를 특이적으로 포착하며, 그 중 하나는 비오티닐화됩니다. 인산화된 단백질의 존재 하에서, 두 항체는 공여체 및 수용체 비드를 가까운 근접성으로 가져와 화학발광 신호의 생성을 가능하게 한다6. 다재다능하고 민감하지만, 이 기술은 비용이 많이 들고, 배양 배지의 비오틴에 의해 영향을 받으며, 주변 온도와 빛에 매우 민감하며, 검출을 위해 특별한 판독기가 필요합니다. HTRF 및 LANX는 모두 장기 수명 발광 란타나이드 이온 착물 (유로퓸 또는 테르븀 킬레이트, 또는 유로퓸 크립테이트)을 공여체 분자로 사용하고 수용체 분자로서 원간 적색 형광단을 사용하는 TR-FRET 기술을 기반으로합니다7. 공여체 또는 수용체 분자로 표지된 두 단백질 특이적 항체가 근접하게 되면 FRET가 발생하여 수용체 형광이 증가하고 공여체 형광이 감소합니다. 이러한 수명이 긴 형광 신호는 시간 분해능 및 비율계량 방식으로 측정하여 분석 간섭을 줄이고 데이터 품질을 높일 수 있습니다. TR-FRET의 다른 장점은 빛에 민감하지 않고 반복적 인 판독을 허용하며 긴 신호 안정성을 나타낸다는 것입니다. TR-FRET는 다목적성, 감도 및 높은 견고성으로 인해 HTS에서 널리 구현되지만 모든 상용 TR-FRET 기반 분석 플랫폼은 비용이 많이 들기 때문에 학술 및 소규모 산업 실험실에서의 광범위한 채택을 배제합니다. LanthaScreen 분석은 또한 TR-FRET 기반-판독을 사용하지만, 테르븀 표지된 포스포-특이적 STAT1 항체8과 결합된 녹색 형광 단백질(GFP)-STAT1 융합 단백질을 안정적으로 발현하는 조작된 U2OS 세포주에 의존한다. 신호전달 단백질의 선택의 측면에서 제한될 뿐만 아니라, 이 방법은 고가의 형질감염된 세포주를 구입하여 그 적용가능성을 감소시키고 실험 아티팩트의 가능성을 증가시켜야 한다. 루미트는 NanoLuc Luciferase9의 작고 큰 NanoBit 서브유닛으로 화학적으로 표지된 이차 항체(항마우스 및 항토끼)를 이용하는 일반적인 생체발광 면역분석 플랫폼이다. 표적 단백질에 대한 두 개의 일차 항체의 결합은 이차 항체를 근접하게 가져와 발광 신호를 생성하는 활성 효소를 형성한다. 발광은 일반적으로 민감하고 강력한 판독이지만, 두 가지 다른 종에서 제기 된 일차 항체에 대한 요구 사항은 분석 설계에 대한 선택을 제한합니다. 또한, 복잡한 샘플 매트릭스에서 이차 항체의 사용은 분석 간섭을 일으키는 경향이 있을 수 있다.
따라서, HTS와 상용성인 방식으로 개별 인산화 및 총 STAT 단백질을 측정하기 위한 안정적이고 신속하면서도 저렴한 세포 기반 분석 플랫폼에 대한 필요성이 여전히 존재한다. 이러한 요구를 해결하기 위해 새로운 고처리량 세포 기반 면역 분석 플랫폼은 향상된 TR-FRET 기술 (THUNDER)을 기반으로 개발되었으며 세포 용해물에서 내인성으로 발현 된 세포 내 단백질 (인산화 또는 전체)의 간단하고 민감하며 견고하며 비용 효율적인 측정을 가능하게하도록 설계되었습니다. 이 기술의 장점은 탁월한 스펙트럼 호환성과 TR-FRET 신호, 엄격하게 검증된 항체 및 최적화된 용해 버퍼를 나타내는 공여체/수용체 FRET 쌍의 조합에서 비롯됩니다. 이러한 분석은 샌드위치 면역 분석법으로 포맷되며 간단한 세 단계 워크플로우를 사용합니다(그림 1). 세포는 먼저 단백질 인산화를 조절하기 위해 처리되고, 이어서 키트에 제공된 특이적 용해 완충액으로 용해된다. 세포 용해물 내의 표적 인산화 또는 총 STAT 단백질은 단일 시약 첨가 및 인큐베이션 단계에서 표적 단백질 상의 별개의 에피토프를 인식하는 형광단 표지된 항체 쌍과 함께 검출된다(도 2). 하나의 항체는 유로퓸 킬레이트 공여체 (Eu-Ab1)로 표지되고, 두 번째 항체는 원거리 적색 수용체 형광단 (FR-Ab2)으로 표지된다. 표지 된 두 항체는 용액 중 단백질에 결합하여 두 라벨을 가까운 거리로 가져옵니다. 320 또는 340 nm에서 공여체 유로퓸 킬레이트의 여기는 수용체에 FRET를 트리거하고, 이는 세포 용해물 내의 표적 단백질 (인산화 또는 전체)의 농도에 비례하여 665 nm에서 수명이 긴 TR-FRET 신호를 방출한다.
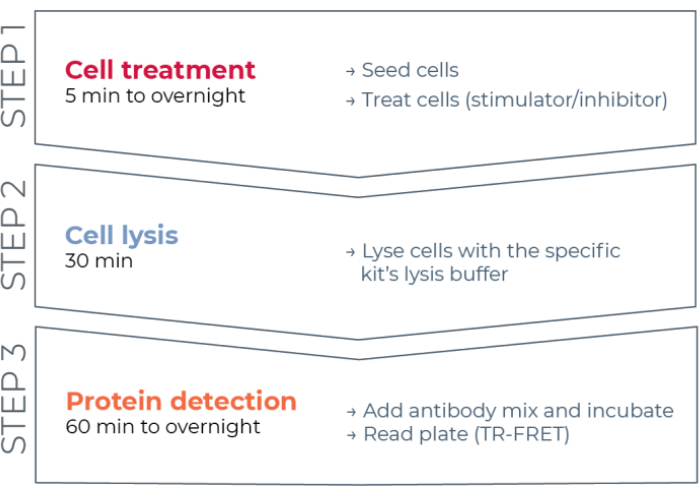
그림 1: TR-FRET 분석 워크플로우. 워크플로우는 세포 치료, 세포 용해 및 TR-FRET를 사용한 단백질 검출의 세 단계로 구성됩니다. 두 플레이트 분석 프로토콜에서, 용해물은 백색 384-웰 검출 플레이트로 이송되는 반면, 원플레이트 프로토콜에서, 모든 단계는 동일한 백색 384-웰 검출 플레이트(올인원-웰 프로토콜)에서 수행된다. 사용된 분석 프로토콜에 관계없이, 단백질 검출은 동일한 총 부피 (웰 당 20 μL)에서 수행된다. 약어: TR-FRET = 시간 분해된 Förster 공명 에너지 전달. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 2: TR-FRET 샌드위치 면역분석 원리. 하나의 항체는 유로퓸 킬레이트 공여체 (Eu-Ab1)로 표지되고 두 번째 항체는 원적색 작은 형광단 수용체 (FR-Ab2)로 표지된다. 두 개의 표지된 항체는 세포 용해물에서 표적 단백질 (인산화 또는 전체) 상의 별개의 에피토프에 특이적으로 결합하여, 두 형광단을 근접하게 만든다. 320 또는 340 nm에서 공여체 유로퓸 킬레이트의 여기는 공여체로부터 수용체 분자로의 FRET를 촉발시키고, 이는 차례로 665 nm에서 신호를 방출한다. 이 신호는 세포 용해물 내의 단백질의 농도에 비례한다. 특정 표적 단백질의 부재 하에서, 공여체 및 수용체 형광단은 FRET가 발생하기에 너무 멀리 떨어져 있다. 약어: FRET = Förster 공명 에너지 전달; TR-FRET = 시간 분해능 FRET; Ab = 항체; FR = 원-적색; Eu - 유로퓸 킬레이트; P = 인산화. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
여기서, 상세한 프로토콜은 384-웰 포맷으로, 인산화된 STAT1 (Y701), STAT3 (Y705), STAT4 (Y693), STAT5 (Y694/Y699), 및 STAT6 (Y641)의 세포내 수준을 측정하기 위해, 총 STAT1, STAT3, STAT5 및 STAT6과 함께, 썬더 TR-FRET 플랫폼을 사용하는 부착성 또는 현탁액으로부터의 세포 용해물에서 제공된다. 이들 프로토콜은 세포 치료, 용해 및 TR-FRET-기반 표적 단백질 검출을 위한 단계를 두 플레이트 전달 프로토콜 또는 원플레이트 올인원-웰 프로토콜 중 하나를 사용하여 정의한다. 이러한 세포 기반 분석은 JAK/STAT 경로의 알려진 활성화제 및 억제제의 약리학적 프로파일을 결정하기 위해 적용됩니다. HTS에 대한 선택된 분석의 견고성 및 적합성이 입증된다. 마지막으로, 분석 최적화를 위한 주요 실험과 분석 문제 해결을 위한 권장 사항에 대해 논의합니다.
프로토콜
1. 세포 배양
- 가습된 37°C/5% CO2 배양기에서 세포를 유지하고 10% 소 태아 혈청(FBS)이 보충된 DMEM(HeLa 및 A431 세포) 또는 15% FBS(U266B1 세포)가 보충된 RPMI로 배양합니다. 70-80 % 합류에 도달 할 때까지 세포를 배양 한 다음 트립신화하고 계대 또는 분석에 사용하십시오.
참고 : 배양 배지에는 페놀 레드가 포함되어 있습니다. 분석을 수행하기 전에 임의의 세포주에 대해 혈청 기아가 수행되지 않았다.
2. 부착성 세포와 함께 2-플레이트 분석 프로토콜을 이용한 자극기 또는 억제제 적정
참고: 이 절차는 시험 화합물의 희석 시리즈로부터 농도-반응 곡선을 생성함으로써 자극제 또는 억제제 효능을 결정하는 방법을 설명한다.
- 세포 시딩
- 사전 최적화된 밀도(STAT3 및 STAT6의 경우 40,000 HeLa 세포/웰, STAT5의 경우 75,000 A431 세포/웰)로 50μL의 세포를 적절한 배양 배지의 96웰 조직 배양 처리 플레이트에 분주하십시오. 37°C/5% CO2에서 하룻밤 동안 배양한다.
참고: 최적의 세포 밀도 및 배양 배양 시간을 결정해야 합니다.
- 사전 최적화된 밀도(STAT3 및 STAT6의 경우 40,000 HeLa 세포/웰, STAT5의 경우 75,000 A431 세포/웰)로 50μL의 세포를 적절한 배양 배지의 96웰 조직 배양 처리 플레이트에 분주하십시오. 37°C/5% CO2에서 하룻밤 동안 배양한다.
- 시험 화합물의 희석
- 폴리프로필렌 96-웰 플레이트의 12 웰에 걸쳐 화합물(들)을 연속 희석(하프 로그 간격 희석)하여 시험 화합물의 중간체 2x 희석 시리즈를 무혈청 매질로 준비한다.
참고: EC50 또는 IC50의 정확한 추정을 위해 최소한 중복된 12점, 하프 로그 간격 농도-응답 곡선을 수행하는 것이 좋습니다. - 대안적으로, 소수성, 디메틸술폭시드 (DMSO)-가용성 시험 화합물의 경우, 100% DMSO에서 초기 희석을 수행하고, 이어서 화합물 희석 계열을 무혈청 매질로 희석한다.
참고: DMSO 비히클에서 시험 화합물 적정을 수행하기 전에 DMSO에 대한 분석 내성을 확립해야 합니다. 처리된 세포와 처리되지 않은 세포 사이에 동일한 용매 농도를 유지하는 것이 중요하다. 또한, 화합물의 연속 희석을 시험할 때, 용매 농도는 희석 계열 전반에 걸쳐 항상 일정하게 유지되어야 한다.
- 폴리프로필렌 96-웰 플레이트의 12 웰에 걸쳐 화합물(들)을 연속 희석(하프 로그 간격 희석)하여 시험 화합물의 중간체 2x 희석 시리즈를 무혈청 매질로 준비한다.
- 세포 치료
- 세포 자극을 위해, 50 μL의 무혈청 배지를 단독으로(처리되지 않은 세포) 또는 자극기(2x)를 함유하는 첨가한다.
- 실온 (RT) 또는 37°C (인터페론 (IFN) α2b/20 분 동안 RT3에서 20 분; 표피 성장 인자 (EGF)/STAT5에 대한 RT에서 10 분; 인터루킨 (IL)-4/20 분 동안 RT6)에서 사전 최적화된 시간 동안 인큐베이션한다. 그런 다음 섹션 2.4로 진행하십시오.
참고: 최적의 배양 온도를 결정해야 합니다. - 세포 억제를 위해, 25 μL의 무혈청 배지를 단독으로(처리되지 않은 세포) 또는 억제제(4x)를 함유한다.
- RT 또는 37°C에서 사전 최적화된 시간 동안 인큐베이션한다 (JAK 억제제는 STAT3 및 STAT6에 대해 RT에서 1/30분; Erlotinib / STAT5의 경우 RT에서 15 분).
- 25 μL의 무혈청 배지를 단독으로 첨가하거나(처리되지 않은 세포) 또는 EC80에 자극기(4x)를 함유한다.
- RT 또는 37°C에서 사전 최적화된 시간 동안 인큐베이션한다(단계 2.3.2와 동일한 조건).
- 세포 용해
- 제조업체가 지시한대로 키트의 특정 1x 보충 용해 버퍼를 준비하십시오.
참고 : 1x 용해 버퍼에 1x의 최종 농도로 희석 된 100x 포스파타제 억제제 칵테일을 보충해야합니다. 1x 보충 용해 버퍼에는 1 mM 불화나트륨, 2 mM 오르토바나데이트 나트륨 및 2 mM 베타 글리세로포스페이트가 포함되어 있습니다. 다른 포스파타제 억제제는 필요하지 않으며 피해야합니다. 키트에 포함된 것 이외의 용해 완충액 및 포스파타제 억제제는 측정을 방해할 수 있는 성분을 함유할 수 있으므로 권장하지 않습니다. - 상층액을 흡인하여 세포 배양액을 조심스럽게 제거하고 버린다.
- 즉시 50 μL의 1x 보충 용해 완충액을 첨가하십시오.
참고: 용해 버퍼 부피(25-50 μL)가 최적화될 수 있습니다. - 진탕 하에 RT에서 30분 동안 인큐베이션한다(400 rpm으로 설정된 궤도 플레이트 진탕기; 적당한 교반).
참고: 용해 배양 시간(30-60분)이 최적화될 수 있습니다. 용해물은 표적 단백질 검출을 위해 즉시 사용되거나 -80°C에서 동결될 수 있다.
- 제조업체가 지시한대로 키트의 특정 1x 보충 용해 버퍼를 준비하십시오.
- TR-FRET 감지
- 제조업체의 지시에 따라 4x 항체 검출 믹스를 1x 검출 버퍼에 준비합니다.
- 이 이송 단계에서, 96-웰 배양 플레이트로부터 15 μL의 세포 용해물을 백색의 저용량 384-웰 마이크로플레이트의 웰로 조심스럽게 피펫한다.
- 15 μL의 양성 대조군 용해물과 15 μL의 1x 용해 완충액 (음성 대조군)을 첨가하여 분석 웰을 분리하십시오.
- 5μL의 4x 항체 검출 믹스(포스포 단백질 검출을 위한 Eu-Ab1/FR-Ab2 또는 총 단백질의 검출을 위한 Eu-Ab3/FR-Ab4)를 각각의 분석 웰에 첨가한다.
- 플레이트를 플레이트 실러로 덮고 분석법에 따라 RT에서 하룻밤 동안 1시간 동안 인큐베이션한다(상응하는 기술 데이터 시트 참조).
참고: 최적의 판독 시간은 각 분석 및 세포주에 대해 최적화되어야 합니다. 플레이트는 분석 성능에 부정적인 영향 없이 여러 번 판독될 수 있다. - 접착 플레이트 실러를 분리하고 TR-FRET 호환 마이크로플레이트 리더 상에서 플레이트를 판독한다.
참고: 필터 기반 형광계가 권장되지만 일부 단색화 기기를 사용할 수 있습니다. TR-FRET에 적합한 광학 모듈(필터 및 미러)이 설치되어 있는지 확인합니다. 320 또는 340 nm의 여기 파장을 사용하여 유로퓸 킬레이트를 여기시킨다. 615 nm (또는 620 nm) 및 665 nm 모두에서 검정을 판독하여 공여체 유로퓸 및 수용체 형광단으로부터의 방출을 각각 검출한다. 계측기 설정은 특정 리더에 따라 다릅니다. 여기에 제시된 데이터는 램프 기반 여기, 90μs 지연, 300μs 통합 시간 및 웰당 100회 플래시를 사용하여 얻어졌다. 그러나 포스포-STAT4 분석은 레이저 여기를 사용하여 판독되어 더 높은 신호 대 배경 (S/B) 비율을 생성했습니다.
3. 현탁액 세포와 함께 두 플레이트 분석 프로토콜을 이용한 자극기 또는 억제제 적정
- 시험 화합물의 희석
- 단계 2.2.1 및 2.2.2에 기재된 바와 같이 시험 화합물의 중간체 2x 희석 시리즈를 제조한다.
- 세포 시딩 및 처리
- 20 μL의 세포를 사전 최적화된 밀도(STAT1의 경우 200,000 U266B1 세포/웰, STAT4의 경우 400,000 U266B1 세포/웰)로 적절한 배양 배지의 96웰 조직 배양 처리 플레이트에 분주합니다. 직접 세포 처리를 진행하거나 37°C, 5% CO2에서 2-4시간 배양한다.
참고: 이 단계는 다른 셀 유형에 맞게 최적화되어야 합니다. - 세포 자극을 위해, 20 μL의 무혈청 배지를 단독으로(처리되지 않은 세포) 또는 자극기(2x)를 함유한다.
- RT 또는 37°C에서 사전 최적화된 시간 동안 인큐베이션한다 (STAT1에 대한 RT에서 IFNα2b/15분; IFNα2b/STAT4에 대해 37°C에서 25분). 그런 다음 섹션 3.3으로 진행하십시오.
참고: 최적의 배양 온도를 결정해야 합니다. - 세포 억제를 위해, 10 μL의 무혈청 배지를 단독으로 첨가하거나(처리되지 않은 세포) 또는 억제제(4x)를 함유한다.
- RT 또는 37°C에서 사전 최적화된 시간 동안 인큐베이션한다(JAK 억제제는 STAT1 및 STAT4에 대해 RT에서 1/30분).
- 10 μL의 무혈청 배지를 단독으로 첨가하거나(처리되지 않은 세포) 또는 EC80에 자극기(4x)를 함유한다.
- RT 또는 37°C에서 사전 최적화된 시간 동안 인큐베이션한다(단계 3.2.3과 동일한 조건).
- 20 μL의 세포를 사전 최적화된 밀도(STAT1의 경우 200,000 U266B1 세포/웰, STAT4의 경우 400,000 U266B1 세포/웰)로 적절한 배양 배지의 96웰 조직 배양 처리 플레이트에 분주합니다. 직접 세포 처리를 진행하거나 37°C, 5% CO2에서 2-4시간 배양한다.
- 세포 용해
- 제조업체가 지시한대로 키트의 특정 5x 보충 용해 버퍼를 준비하십시오.
참고 : 5x 용해 버퍼에 5x의 최종 농도로 희석 된 100x 포스파타제 억제제 칵테일을 보충해야합니다. 5x 보충 용해 버퍼에는 5mM 불화나트륨, 10mM 오르토바나데이트나트륨 및 10mM 베타글리세로포스페이트가 들어 있습니다. 다른 포스파타제 억제제는 필요하지 않으며 피해야합니다. - 10 μL의 5x 보충된 용해 완충액을 첨가하십시오.
- 진탕 하에 RT에서 30분 동안 인큐베이션한다(400 rpm으로 설정된 궤도 플레이트 진탕기; 적당한 교반).
참고: 용해 배양 시간(30-60분)이 최적화될 수 있습니다. 용해물은 표적 단백질 검출을 위해 즉시 사용되거나 -80°C에서 동결될 수 있다.
- 제조업체가 지시한대로 키트의 특정 5x 보충 용해 버퍼를 준비하십시오.
- TR-FRET 감지
- 세포 용해 후, 부착성 세포에 대한 2-플레이트 분석 프로토콜에 대해 섹션 2.5에 기재된 바와 같이 TR-FRET 검출 단계를 수행한다.
4. 부착성 또는 현탁액 세포를 사용한 원플레이트 분석 프로토콜을 이용한 자극기 적정
- 시험 화합물의 희석
- 폴리프로필렌 96-웰 플레이트의 12웰에 걸쳐 화합물(들)을 연속 희석(하프 로그 간격 희석)하여 3x에서 시험 화합물의 중간 희석 시리즈를 무혈청 매질로 준비한다.
- 세포 시딩 및 처리
- 8 μL의 세포를 미리 최적화된 밀도(STAT4의 경우 160,000 U266B1 세포/웰, STAT6의 경우 80,000 HeLa 세포/웰)로 적절한 무혈청 배지에 분배하여 흰색의 저용량 384웰 분석 플레이트에 분주한다. 직접 세포 처리를 진행하거나 37°C, 5% CO2에서 2-4시간 배양한다.
참고: 치료 전 세포 배양 배양 기간에 대한 요구 사항은 다른 세포 유형에 대해 결정될 필요가 있습니다. - 세포 자극을 위해, 4 μL의 무혈청 배지를 단독으로(처리되지 않은 세포) 또는 자극기(3x)를 함유하는 첨가한다.
- 실온 또는 37°C에서 사전 최적화된 시간 동안 인큐베이션한다(STAT4에 대해 37°C에서 IFNα2b/25분; IL-4/STAT6의 경우 37°C에서 20분). 그런 다음 섹션 4.3으로 진행하십시오.
- 8 μL의 세포를 미리 최적화된 밀도(STAT4의 경우 160,000 U266B1 세포/웰, STAT6의 경우 80,000 HeLa 세포/웰)로 적절한 무혈청 배지에 분배하여 흰색의 저용량 384웰 분석 플레이트에 분주한다. 직접 세포 처리를 진행하거나 37°C, 5% CO2에서 2-4시간 배양한다.
- 세포 용해
- 제조업체가 지시한대로 키트의 특정 5x 보충 용해 버퍼를 준비하십시오.
참고 : 5x 용해 버퍼에 5x의 최종 농도로 희석 된 100x 포스파타제 억제제 칵테일을 보충해야합니다. - 3 μL의 5x 보충된 용해 완충액을 첨가하십시오.
- 진탕 하에 RT에서 30분 동안 인큐베이션한다(400 rpm에서 궤도 플레이트 진탕기).
참고: 용해 배양 시간(30-60분)이 최적화될 수 있습니다. 용해물은 즉시 사용되거나 80°C에서 동결될 수 있다.
- 제조업체가 지시한대로 키트의 특정 5x 보충 용해 버퍼를 준비하십시오.
- TR-FRET 감지
- 15 μL의 양성 대조군 용해물 (희석되지 않은) 및 15 μL의 1x 보충 용해 완충액 (음성 대조군)을 분석 웰을 분리하십시오.
- 1x 검출 버퍼에서 준비한 5μL의 4x 항체 검출 믹스(포스포 단백질의 경우 Eu-Ab1/FR-Ab2 또는 총 단백질의 경우 Eu-Ab3-/FR-Ab4)를 각 분석 웰에 추가합니다.
- 플레이트를 플레이트 실러로 덮고 검정에 따라 RT에서 밤새도록 1시간 동안 인큐베이션한다.
참고: 최적의 판독 시간은 각 분석 및 세포주에 대해 최적화되어야 합니다. 플레이트는 분석 성능에 부정적인 영향 없이 여러 번 판독될 수 있다. - 접착판 실러를 분리합니다. TR-FRET 호환 마이크로플레이트 리더에서 플레이트를 판독하십시오.
5. 데이터 분석
- 다음 식 (1)을 사용하여 각 웰에 대한 TR-FRET 비율을 계산하십시오.
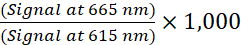 (1)
(1)
참고: TR-FRET 신호는 시간 해결 모드에서 읽히기 때문에 일반적으로 배경 빼기가 필요하지 않습니다. 배경 뺄셈이 수행되는 경우 배경 뺄셈을 위해 1x 보충 용해 버퍼 (음성 대조군)가 포함 된 세포가없는 웰을 사용하십시오. 무세포 웰에서 평균 TR-FRET 비를 결정한 다음 각 웰의 TR-FRET 비에서 이 값을 뺍니다. - 농도-반응 곡선의 경우, 4개의 파라미터 로지스틱 방정식(가변 기울기를 갖는 시그모이드 용량-반응 곡선)과 1/Y2 데이터 가중치를 사용하여 비선형 회귀에 따라 데이터를 분석하여 EC50 또는 IC50 값을 생성합니다.
- Z' 요인 실험의 경우 다음 식 (2)10에 따라 데이터를 분석합니다.
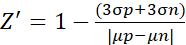 (2)
(2)
여기서 μ 및 σ는 각각 양성 대조군 (p; 자극된 세포) 및 음성 대조군 (n; 처리되지 않은 세포)에 대한 평균 값 및 표준 편차이다.
결과
각 THUNDER TR-FRET 분석은 JAK/STAT 경로 특이적 활성화제 또는 억제제로 부착제(HeLa 또는 A431) 또는 현탁액 세포(U266B1)를 처리한 다음, 적용 가능한 경우 특정 인산화 및 총 STAT의 수준을 측정함으로써 약리학적으로 검증되었습니다. 분석은 두 플레이트 전사 프로토콜 및 사전 최적화된 분석 조건을 사용하여 384-웰 포맷으로 수행되었다. 도 3, 도 4, 도 5, 도 6, 및
토론
웨스턴 블롯팅 및 ELISA 기반 방법과 같은 포스포단백질 분석을 위한 기존의 방법과 비교할 때, THUNDER TR-FRET 세포 분석을 위한 워크플로우는 간단하고 빠르며, 저용량 샘플(15μL)을 사용하며, 384-웰 포맷의 HTS용으로 설계되었으며, 자동화에 매우 적합합니다. 분석 프로토콜은 유연하며 중간 및 고처리량 응용 분야 모두에 쉽게 적응할 수 있습니다. 분석은 두 개의 플레이트 전송 프로토콜 또는 one-384-w...
공개
경쟁 관심사: Jaime Padros, Mireille Caron 및 Geneviève Chatel은 이 연구에 사용된 THUNDER TR-FRET 분석 키트를 제조하는 BioAuxilium Research의 직원입니다. 또한 Jaime Padros와 Mireille Caron은 BioAuxilium Research의 주주입니다. 그렇다고 해서 데이터 및 자료 공유에 대한 모든 JoVE 정책에 대한 저자의 준수가 변경되는 것은 아닙니다.
감사의 말
없음.
자료
| Name | Company | Catalog Number | Comments |
| 96-well microplate, clear, flat bottom, polystyrene, tissue culture-treated, sterile | Corning | 3595 | This is the plate for culturing cells when using the two-plate assay protocol. Other cell culture 96-well plates can be used |
| 384-well microplate, white, low-volume | PerkinElmer | 6007290 | This is the plate for TR-FRET detection when using the two- or one-plate assay protocols. Other low-volume, white 384-well plates can be used |
| A431 cell line | ATCC | CRL-1555 | |
| Adhesive microplate seal | PerkinElmer | 6050185 | |
| DMSO | Fisher | D159-4 | |
| Dulbecco’s modified Eagle medium (DMEM) | Wisent | 319-005-CL | THUNDER TR-FRET is compatible with culture medium containing phenol red |
| EnVision Xcite Multilabel plate reader | PerkinElmer | 2104-0020A | The assays can be performed on a variety of plate readers equipped with the TR-FRET option |
| Erlotinib hydrochloride | Sigma | CDS022564 | |
| Falcon tissue culture treated flasks | Fisher | 13-680-65 | |
| Fetal bovine serum (FBS) | Wisent | 098-150 | |
| HeLa cell line | ATCC | CCL-2 | |
| JAK Inhibitor 1 | Cayman Chemical | 15146 | |
| Orbital plate shaker | Many options available | Not applicable | |
| Recombinant human EGF | PeproTech | AF-100-15 | |
| Recombinant human IFNα2b | ProSpec | CYT-460 | |
| Recombinant human IL-4 | R&D Systems | 204-IL | |
| Roswell Park Memorial Institute 1640 medium (RPMI) | Wisent | 350-007-CL | THUNDER TR-FRET is compatible with culture medium containing phenol red |
| THUNDER Phospho-STAT1 (Y701) + Total STAT1 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT1PT-500 | |
| THUNDER Phospho-STAT3 (Y705) + Total STAT3 Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT3PT-500 | |
| THUNDER Phospho-STAT4 (Y693) TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT4P-500 | |
| THUNDER Phospho-STAT5 (Y694/Y699) + Total STAT5 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT5PT-500 | |
| THUNDER Phospho-STAT6 (Y641) + Total STAT6 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT6PT-500 | |
| Trypsin/EDTA 0.05% | Wisent | 325-542-CL | |
| U266B1 cell line | ATCC | TIB-196 | |
| Ultrapure water | NA | NA | Use Milli-Q grade water (18 MΩ.cm) to dilute Lysis Buffer and Detection Buffer |
참고문헌
- Villarino, A., Kanno, Y., O'Shea, J. Mechanisms and consequences of Jak-STAT signaling in the immune system. Nature Immunology. 18 (4), 374-384 (2017).
- Hammarén, H. M., Virtanen, A. T., Raivola, J., Silvennoinen, O. The regulation of JAKs in cytokine signaling and its breakdown in disease. Cytokine. 118, 48-63 (2019).
- O'Shea, J. J., et al. The JAK-STAT pathway: impact on human disease and therapeutic intervention. Annual Review of Medicine. 66, 311-328 (2015).
- Verhoeven, Y., et al. et al. potential and controversy of targeting STAT family members in cancer. Seminars in Cancer Biology. 60 (2), 41-56 (2020).
- Gilda, J. E., et al. et al. blotting inaccuracies with unverified antibodies: need for a Western blotting minimal reporting standard (WBMRS). PLoS One. 10 (8), 0135392 (2015).
- Binder, C., et al. et al. and utilization of the SureFire phospho-STAT5 assay for a cell-based screening campaign. Assay and Drug Development Technologies. 6 (1), 27-37 (2008).
- Ayoub, M. A., et al. Homogeneous time-resolved fluorescence-based assay to monitor extracellular signal-regulated kinase signaling in a high-throughput format. Frontiers in Endocrinology. 5, 94 (2014).
- Robers, M. B., Machleidt, T., Carlson, C. B., Bi, K. Cellular LanthaScreen and beta-lactamase reporter assays for high-throughput screening of JAK2 inhibitors. Assay and Drug Development Technologies. 6 (4), 519-529 (2008).
- Hwang, B., Engel, L., Goueli, S. A., Zegzouti, H. A. Homogeneous bioluminescent immunoassay to probe cellular signaling pathway regulation. Communications Biology. 3 (8), 1-12 (2020).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high-throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Osmond, R. I. W., Das, S., Crouch, M. F. Development of cell-based assays for cytokine receptor signaling, using an AlphaScreen SureFire assay format. Analytical Biochemistry. 403 (1-2), 94-101 (2010).
- Haan, C., et al. Jak1 has a dominant role over Jak3 in signal transduction through γc-containing cytokine receptors. Chemistry & Biology. 18 (3), 314-323 (2011).
- Kim, Y., Apetri, M., Luo, B., Settleman, J. E., Anderson, K. S. Differential effects of tyrosine kinase inhibitors on normal and oncogenic EGFR signaling and downstream effectors. Molecular Cancer Research. 13 (4), 765-774 (2015).
- Qian, J., et al. Comparison of two homogeneous cell-based kinase assays for JAK2 V617F: SureFire pSTAT5 and GeneBLAzer fluorescence resonance energy transfer assays. ASSAY and Drug Development Technologies. 10 (2), 212-217 (2012).
- Iversen, P. W., et al., Markossian, S., et al. HTS assay validation. Assay Guidance Manual. , (2012).
- Muelas, M. W., Ortega, F., Breitling, R., Bendtsen, C., Westerhoff, H. V. Rational cell culture optimization enhances experimental reproducibility in cancer cells. Scientific Reports. 8, 3029 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유