Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
İnsan Hücrelerinde Endojen Fosforile STAT Proteinlerinin Ölçümü için Zaman Çözülmüş Förster Rezonans Enerji Transfer Testleri
Bu Makalede
Özet
Zaman çözümlü Förster rezonans enerji transfer hücresi tabanlı tahlil protokolleri, endojen fosforile sinyal dönüştürücüsünün ve transkripsiyon aktivatörü (STAT) 1/3/4/5/6 proteinlerinin 384 kuyucuklu bir formatta basit, spesifik, hassas ve sağlam bir şekilde ölçülmesi için tanımlanmıştır.
Özet
Janus kinaz (JAK) / sinyal dönüştürücü ve transkripsiyon aktivatörü (STAT) sinyal yolu, sitokinlere ve büyüme faktörlerine hücresel yanıtlara aracılık etmede çok önemli bir rol oynar. STAT proteinleri, esas olarak JAK'ların aracılık ettiği tirozin fosforilasyonu ile aktive edilir. STAT sinyal yolaklarının anormal aktivasyonu, birçok insan hastalığında, özellikle kanser ve bağışıklık ile ilgili koşullarda rol oynar. Bu nedenle, doğal hücre sinyal ortamında STAT protein fosforilasyonunu izleme yeteneği hem akademik hem de ilaç keşif araştırmaları için önemlidir. Fosforile STAT proteinlerini ölçmek için mevcut geleneksel tahlil formatları arasında batı lekelenmesi ve enzime bağlı immünosorbent testi (ELISA) bulunur. Bu heterojen yöntemler emek yoğun, düşük verimlidir ve batı lekelenmesi durumunda genellikle güvenilir (spesifik) değildir. Homojen (yıkamasız) yöntemler mevcuttur ancak pahalı olmaya devam etmektedir.
Burada, fosforile edilmiş STAT1 (Y701), STAT3 (Y705), STAT4 (Y693), STAT5 (Y694/Y699) ve STAT6'nın (Y641) endojen seviyelerinin 384 kuyucuklu bir formatında, yeni THUNDER zaman çözümlü Förster rezonans enerji transferi (TR-FRET) platformu kullanılarak yapışkan veya süspansiyon hücrelerinden hücre lizatlarında hassas, sağlam ve uygun maliyetli ölçüm için ayrıntılı protokoller sağlanmaktadır. Hücresel tahlil için iş akışı basit, hızlı ve yüksek verimli tarama (HTS) için tasarlanmıştır. Tahlil protokolü esnektir, düşük hacimli bir numune (15 μL) kullanır, yalnızca bir reaktif ekleme adımı gerektirir ve düşük verimli ve yüksek verimli uygulamalara uyarlanabilir. Her fosfo-STAT sandviç immünoassay, bilinen agonistler ve inhibitörler ile optimize edilmiş koşullar altında doğrulanır ve beklenen farmakoloji ve Z'-faktör değerlerini üretir. TR-FRET testleri orantılı olduğundan ve yıkama adımı gerektirmediğinden, geleneksel yaklaşımlardan çok daha iyi tekrarlanabilirlik sağlarlar. Birlikte, bu tahlil paketi, hücre tedavisini takiben spesifik fosforile STAT proteinlerinin daha kapsamlı bir analizi ve JAK / STAT sinyal yolunun spesifik ve seçici modülatörlerinin taranması ve karakterizasyonu için yeni uygun maliyetli araçlar sunmaktadır.
Giriş
JAK/STAT sinyal yolu, çeşitli sitokinlere, interferonlara, büyüme faktörlerine ve ilgili moleküllere hücresel yanıtlara aracılık etmede önemli bir rol oynar1,2. Bu ligandların spesifik hücre yüzeyi reseptörlerine bağlanması, JAK'ların aktivasyonu ile sonuçlanır ve bu da spesifik tirozin kalıntılarının fosforilasyonu ile STAT proteinlerini aktive eder. STAT fosforilasyonu, dimerizasyonları ve çekirdeğe translokasyonları ile sonuçlanır, burada düzenlenmiş hedef genlerin transkripsiyonu üzerindeki etkilerini gösterirler. STAT ailesi yedi üyeden oluşur: STAT1, STAT2, STAT3, STAT4, STAT5a, STAT5b ve STAT6. Üyeler, proliferasyon, farklılaşma, apoptoz, anjiyogenez ve bağışıklık sistemi regülasyonu dahil olmak üzere fizyolojik hücre süreçlerinin düzenlenmesinde karmaşık ve önemli bir rol oynamaktadır. STAT sinyal yolaklarının anormal aktivasyonu, başta kanser ve bağışıklıkla ilgili durumlar olmak üzere birçok insan hastalığında rol oynar3,4. Bu nedenle, doğal hücre sinyal ortamında STAT protein fosforilasyonunu değerlendirme yeteneği hem akademik hem de ilaç keşif araştırmaları için önemlidir.
Bugüne kadar, STAT'lar da dahil olmak üzere hücre içi fosforile protein seviyelerini ölçmek için kullanılan geleneksel yöntemler antikor bazlıdır ve batı lekelenmesi, ELISA ve fosfoflow sitometrisini içerir. Bu heterojen yöntemler, batı lekelenmesi durumunda emek yoğun, zaman alıcı, hataya eğilimli, düşük verimli ve genellikle güvenilmezdir (örneğin, özgüllük sorunları)5. Buna karşılık, homojen analizler daha az deneysel adım gerektirir, daha küçük numune hacimleri kullanır ve HTS'ye uygundur. Hücre lizatlarındaki STAT'ların JAK'a bağımlı fosforilasyonunu nicel olarak izlemek için kullanılabilecek beş homojen hücre bazlı immünoassay platformu vardır: SureFire, HTRF, LANCE, LanthaScreen ve Lumit. Bu platformların her birinin avantajları ve dezavantajları vardır.
SureFire, biri biyotinillenmiş bir çift antikoru özel olarak yakalamak için kaplanmış donör ve alıcı boncukları kullanan ışıldayan oksijen kanal teknolojisine dayanmaktadır. Fosforile protein varlığında, iki antikor donör ve alıcı boncukları birbirine yaklaştırarak kemilüminesan sinyalin üretilmesini sağlar6. Çok yönlü ve hassas olsa da, bu teknoloji pahalıdır, kültür ortamındaki biyotin'den etkilenir, ortam sıcaklığına ve ışığa karşı çok hassastır ve algılama için özel bir okuyucu gerektirir. HTRF ve LANCE, donör moleküller olarak uzun ömürlü ışıldayan lantanid iyon komplekslerini (Europium veya Terbiyum şelatları veya Europium kriptolatları) ve alıcı moleküller olarak çok kırmızı floroforları kullanan TR-FRET teknolojisine dayanmaktadır7. Donör veya alıcı moleküllerle etiketlenmiş iki proteine özgü antikor yakın bir yakınlığa getirildiğinde, FRET gerçekleşir ve alıcı floresansında bir artışa ve donör floresansında bir azalmaya neden olur. Bu uzun ömürlü floresan sinyalleri, tahlil parazitini azaltmak ve veri kalitesini artırmak için zamana bağlı ve oranmetrik bir şekilde ölçülebilir. TR-FRET'in diğer avantajları, ışığa duyarlı olmaması, tekrarlanan okumalara izin vermesi ve uzun sinyal kararlılığı sergilemesidir. TR-FRET çok yönlülüğü, hassasiyeti ve yüksek sağlamlığı nedeniyle HTS'de yaygın olarak uygulanmakla birlikte, tüm ticari TR-FRET tabanlı tahlil platformları pahalıdır ve bu nedenle akademik ve küçük endüstriyel laboratuvarlarda geniş çapta benimsenmesini engellemektedir. LanthaScreen testi ayrıca TR-FRET tabanlı bir okuma kullanır, ancak terbiyum etiketli fosfo-spesifik STAT1 antikoru ile birleştirilmiş yeşil floresan protein (GFP)-STAT1 füzyon proteinini istikrarlı bir şekilde ifade eden tasarlanmış bir U2OS hücre hattına dayanır8. Sinyal proteinlerinin seçimi açısından sınırlı olmasının yanı sıra, bu yöntem pahalı transfekte hücre hatları satın almayı, uygulanabilirliğini azaltmayı ve deneysel eserlerin olasılığını arttırmayı gerektirir. Lumit, NanoLuc Luciferase9'un küçük ve büyük NanoBit alt birimleri ile kimyasal olarak etiketlenmiş ikincil antikorları (fare ve tavşan karşıtı) kullanan jenerik bir biyolüminesan immünoassay platformudur. İki birincil antikorun hedef proteine bağlanması, ikincil antikorları, bir lüminesans sinyali üreten aktif bir enzim oluşturmak için yakınlaştırır. Lüminesans genellikle hassas ve sağlam bir okuma olsa da, iki farklı türde yetiştirilen birincil antikorlara duyulan gereksinim, tahlil tasarımı için seçenekleri sınırlar. Ek olarak, karmaşık numune matrislerinde ikincil antikorların kullanımı tahlil girişimine eğilimli olabilir.
Bu nedenle, bireysel fosforile ve toplam STAT proteinlerini HTS ile uyumlu bir şekilde ölçmek için güvenilir, hızlı, ancak uygun fiyatlı bir hücre bazlı tahlil platformuna hala ihtiyaç duyulmaktadır. Bu ihtiyacı karşılamak için, gelişmiş bir TR-FRET teknolojisine (THUNDER) dayanan yeni bir yüksek verimli hücre bazlı immünoassay platformu geliştirildi ve hücre lisatlarında endojen olarak eksprese edilen hücre içi proteinlerin (fosforile veya toplam) basit, hassas, sağlam ve uygun maliyetli ölçümünü sağlamak için tasarlandı. Bu teknolojinin avantajları, olağanüstü spektral uyumluluk ve TR-FRET sinyali, titizlikle doğrulanmış antikorlar ve optimize edilmiş lizis tamponları sergileyen bir donör / alıcı FRET çiftinin kombinasyonundan kaynaklanmaktadır. Bu testler sandviç immünotahlilleri olarak biçimlendirilir ve basit, üç adımlı bir iş akışı kullanır (Şekil 1). Hücreler önce protein fosforilasyonunu modüle etmek için muamele edilir ve daha sonra kit içinde sağlanan spesifik lizis tamponu ile lize edilir. Hücre lizatındaki hedef fosforile veya toplam STAT proteini, hedef protein üzerindeki farklı epitopları tanıyan bir çift florofor etiketli antikor ile tek bir reaktif ilavesi ve inkübasyon adımında tespit edilir (Şekil 2). Bir antikor bir Europium şelat donörü (Eu-Ab1) ile etiketlenirken, ikinci antikor çok kırmızı bir alıcı florofor (FR-Ab2) ile etiketlenir. İki etiketli antikor, çözeltideki proteine bağlanır ve iki etiketi birbirine yaklaştırır. Donör Europium şelatının 320 veya 340 nm'de uyarılması, alıcı için bir FRET'yi tetikler ve bu da hücre lizatındaki hedef protein (fosforile veya toplam) konsantrasyonuyla orantılı olarak 665 nm'de uzun ömürlü bir TR-FRET sinyali yayar.
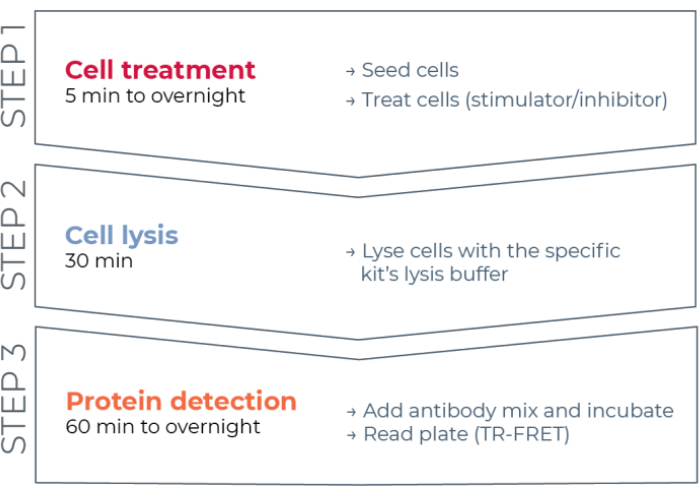
Şekil 1: TR-FRET tahlil iş akışı. İş akışı üç adımdan oluşur: hücre tedavisi, hücre lizisi ve TR-FRET kullanarak protein tespiti. İki plakalı tahlil protokolünde, lizatlar beyaz bir 384 kuyucuklu algılama plakasına aktarılırken, tek plakalı protokolde, tüm adımlar aynı beyaz 384 kuyucuklu algılama plakasında (hepsi bir arada kuyu protokolü) gerçekleştirilir. Kullanılan tahlil protokolünden bağımsız olarak, protein tespiti aynı toplam hacimde (kuyu başına 20 μL) gerçekleştirilir. Kısaltma: TR-FRET = zaman çözümlü Förster rezonans enerji transferi. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 2: TR-FRET sandviç immünoassay prensibi. Bir antikor, Europium şelat donörü (Eu-Ab1) ve ikincisi çok kırmızı küçük florofor alıcısı (FR-Ab2) ile etiketlenir. İki etiketli antikor, hücre lizatındaki hedef protein (fosforile veya toplam) üzerindeki farklı epitoplara spesifik olarak bağlanır ve iki floroforu birbirine yaklaştırır. Donör Europium şelatının 320 veya 340 nm'de uyarılması, donörden alıcı moleküllere bir FRET tetikler ve bu da 665 nm'de bir sinyal yayar. Bu sinyal, hücre lizatındaki protein konsantrasyonu ile orantılıdır. Spesifik hedef proteinin yokluğunda, donör ve alıcı floroforlar FRET'nin gerçekleşmesi için birbirinden çok uzaktır. Kısaltmalar: FRET = Förster rezonans enerji transferi; TR-FRET = zaman çözümlü FRET; Ab = antikor; FR = uzak kırmızı; AB - Europium şelat; P = fosforilasyon. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Burada, THUNDER TR-FRET platformunu kullanarak yapışkan veya süspansiyon hücrelerinden gelen hücre lizatlarında fosforile STAT1 (Y701), STAT3 (Y705), STAT4 (Y693), STAT5 (Y694 / Y699) ve STAT6 (Y641) hücre içi seviyelerinin 384 kuyucuklu bir formatta ölçülmesi için ayrıntılı protokoller sağlanmaktadır. Bu protokoller, iki plakalı bir transfer protokolü veya bir plakalı hepsi bir arada kuyu protokolü kullanarak hücre tedavisi, lizis ve TR-FRET tabanlı hedef protein tespiti için adımları tanımlar. Bu hücre bazlı testler, bilinen aktivatörlerin ve JAK/STAT yolunun inhibitörlerinin farmakolojik profilini belirlemek için uygulanır. HTS için seçilen tahlillerin sağlamlığı ve uygunluğu gösterilmiştir. Son olarak, tahlil optimizasyonu için temel deneyler ve tahlil sorun giderme önerileri tartışılmaktadır.
Protokol
1. Hücre kültürü
- Hücreleri nemlendirilmiş 37 °C / % 5 CO2 inkübatöründe ve kültüründe,% 10 fetal sığır serumu (FBS) (HeLa ve A431 hücreleri) ile desteklenmiş DMEM veya% 15 FBS (U266B1 hücreleri) ile desteklenmiş RPMI ile koruyun. Hücreleri% 70-80 birleşime ulaşana kadar kültürleyin, daha sonra onları tripsinize edin ve tahliller için geçirin veya kullanın.
NOT: Kültür ortamı fenol kırmızısı içeriyordu. Tahliller yapılmadan önce herhangi bir hücre hattı için serum açlığı yapılmadı.
2. Yapışkan hücrelerle iki plakalı tahlil protokolünü kullanarak uyarıcı veya inhibitör titrasyonu
NOT: Bu prosedür, test bileşiğinin seyreltme serisinden bir konsantrasyon-yanıt eğrisi oluşturarak uyarıcı veya inhibitör potansiyellerinin nasıl belirleneceğini açıklamaktadır.
- Hücre tohumlama
- Önceden optimize edilmiş yoğunlukta (hem STAT3 hem de STAT6 için 40.000 HeLa hücresi / kuyusu; STAT5 için 75.000 A431 hücresi / kuyusu) 50 μL hücreyi, uygun kültür ortamında 96 delikli doku kültürü ile muamele edilmiş bir plakaya dağıtın. Gece boyunca 37 °C / % 5 CO2'de inkübe edin.
NOT: Optimal hücre yoğunluğu ve kültür inkübasyon süresinin belirlenmesi gerekir.
- Önceden optimize edilmiş yoğunlukta (hem STAT3 hem de STAT6 için 40.000 HeLa hücresi / kuyusu; STAT5 için 75.000 A431 hücresi / kuyusu) 50 μL hücreyi, uygun kültür ortamında 96 delikli doku kültürü ile muamele edilmiş bir plakaya dağıtın. Gece boyunca 37 °C / % 5 CO2'de inkübe edin.
- Test bileşiklerinin seyreltilmeleri
- Bir polipropilen 96 delikli plakanın 12 kuyucuğu boyunca serumsuz ortama seri olarak seyreltilerek test bileşiğinin (yarım kütük aralıklı seyreltmeler) ara 2x seyreltme serisi test bileşiğini hazırlayın.
NOT: EC50 veya IC50'nin doğru bir şekilde tahmin edilmesi için 12 noktalı, yarım günlük aralıklı bir konsantrasyon-yanıt eğrisinin en az kopya halinde yapılması önerilir. - Alternatif olarak, hidrofobik, dimetilsülfoksit (DMSO) ile çözünür test bileşikleri için, ilk seyreltmeleri% 100 DMSO'da gerçekleştirin ve daha sonra bileşik seyreltme serisini serumsuz ortama seyreltin.
NOT: DMSO'ya karşı tahlil toleransı, DMSO aracında bir test bileşiği titrasyonu yapılmadan önce belirlenmelidir. Tedavi edilen ve edilmeyen hücreler arasında eşit çözücü konsantrasyonlarının tutulması önemlidir. Ek olarak, bileşiklerin seri seyreltmelerini test ederken, çözücü konsantrasyonları seyreltme serisi boyunca daima sabit kalmalıdır.
- Bir polipropilen 96 delikli plakanın 12 kuyucuğu boyunca serumsuz ortama seri olarak seyreltilerek test bileşiğinin (yarım kütük aralıklı seyreltmeler) ara 2x seyreltme serisi test bileşiğini hazırlayın.
- Hücre tedavisi
- Hücre stimülasyonu için, tek başına 50 μL serumsuz ortam (tedavi edilmemiş hücreler) veya uyarıcıyı (2x) içeren bir ortam ekleyin.
- Oda sıcaklığında (RT) veya 37 °C'de önceden optimize edilmiş süre için inkübe edin (STAT3 için RT'de interferon (IFN) α2b / 20 dakika; STAT5 için RT'de epidermal büyüme faktörü (EGF) / 10 dakika; STAT6 için RT'de interlökin (IL) -4/20 dakika). Ardından bölüm 2.4'e geçin.
NOT: Optimum inkübasyon sıcaklığının belirlenmesi gerekir. - Hücre inhibisyonu için, tek başına 25 μL serumsuz ortam (tedavi edilmemiş hücreler) veya inhibitörü (4x) içeren bir ortam ekleyin.
- RT veya 37 °C'de önceden optimize edilmiş süre için inkübe edin (STAT3 ve STAT6 için RT'de JAK İnhibitörü 1/30 dakika; Erlotinib / STAT5 için RT'de 15 dakika).
- Tek başına 25 μL serumsuz ortam (işlenmemiş hücreler) veya EC80'inde uyarıcı (4x) içeren ortam ekleyin.
- RT veya 37 °C'de önceden optimize edilmiş süre için inkübe edin (adım 2.3.2 ile aynı koşullar).
- Hücre lizisi
- Kitin özel 1x Takviyeli Lizis Arabelleğini üretici tarafından belirtildiği gibi hazırlayın.
NOT: 1x Lizis Tamponunun, 1x'lik son konsantrasyona seyreltilmiş 100x Fosfataz İnhibitörü Kokteyli ile desteklenmesi zorunludur. 1x Takviyeli Lizis Tamponu 1 mM sodyum florür, 2 mM sodyum ortovanadat ve 2 mM beta-gliserofosfat içerir. Diğer fosfataz inhibitörleri gerekli değildir ve kaçınılmalıdır. Kitte bulunanlar dışındaki lizis tamponları ve fosfataz inhibitörleri, ölçümü engelleyebilecek bileşenler içerebileceğinden önerilmez. - Süper natantı aspire ederek hücre kültürü ortamını dikkatlice çıkarın ve atın.
- Hemen 50 μL 1x Takviyeli Lizis Tamponu ekleyin.
NOT: Lysis Buffer hacmi (25-50 μL) optimize edilebilir. - Sallanma altında RT'de 30 dakika boyunca inkübe edin (yörüngesel plaka çalkalayıcı 400 rpm'ye ayarlanmış; orta derecede ajitasyon).
NOT: Lizis inkübasyon süresi (30-60 dakika) optimize edilebilir. Lisatlar, hedef protein tespiti için hemen kullanılabilir veya -80 ° C'de dondurulabilir.
- Kitin özel 1x Takviyeli Lizis Arabelleğini üretici tarafından belirtildiği gibi hazırlayın.
- TR-FRET algılama
- 4x Antikor Algılama Karışımını üretici tarafından belirtildiği gibi 1x Algılama Arabelleğinde hazırlayın.
- Bu transfer adımında, 96 delikli kültür plakasından beyaz, düşük hacimli 384 delikli bir mikro plaka kuyucuğuna 15 μL hücre lizatını dikkatlice pipetleyin.
- Tahlil kuyularını ayırmak için 15 μL Pozitif Kontrol Lisat ve 15 μL 1x Lizis Tamponu (negatif kontrol) ekleyin.
- Tahlil kuyularının her birine 5 μL 4x Antikor Tespit Karışımı (fosfo-proteinin tespiti için Eu-Ab1 / FR-Ab2 veya toplam proteinin tespiti için Eu-Ab3 / FR-Ab4) ekleyin.
- Plakayı bir plaka kapatıcı ile örtün ve tahlil işlemine bağlı olarak RT'de gece boyunca 1 saat boyunca inkübe edin (ilgili Teknik Veri Sayfasına bakın).
NOT: Her tahlil ve hücre çizgisi için optimum okuma süresinin optimize edilmesi gerekir. Plaka, tahlil performansı üzerinde olumsuz bir etkisi olmadan birkaç kez okunabilir. - Yapışkan plaka sızdırmazlık elemanını çıkarın ve plakayı TR-FRET uyumlu bir mikro plaka okuyucuda okuyun.
NOT: Filtre bazlı florometreler önerilir, ancak bazı monokromatör cihazları kullanılabilir. TR-FRET için uygun optik modülün (filtreler ve ayna) takılı olduğunu doğrulayın. Europium şelatını uyarmak için 320 veya 340 nm'lik bir uyarma dalga boyu kullanın. Hem donör Europium'dan hem de alıcı florofordan gelen emisyonu tespit etmek için hem 615 nm (veya 620 nm) hem de 665 nm'de tahlilleri okuyun. Cihaz ayarları belirli bir okuyucuya bağlı olacaktır. Burada sunulan veriler lamba bazlı uyarma, 90 μs gecikme, 300 μs entegrasyon süresi ve kuyu başına 100 flaş kullanılarak elde edilmiştir. Bununla birlikte, fosfo-STAT4 testi, daha yüksek sinyal-arka plan (S / B) oranları üretmek için lazer uyarımı kullanılarak okundu.
3. Süspansiyon hücreleri ile iki plakalı tahlil protokolünü kullanarak uyarıcı veya inhibitör titrasyonu
- Test bileşiklerinin seyreltilmesi
- Test bileşiklerinin ara 2x seyreltme serisini adım 2.2.1 ve 2.2.2'de açıklandığı gibi hazırlayın.
- Hücre tohumlama ve tedavisi
- Önceden optimize edilmiş yoğunlukta (200.000 U266B1 hücresi / STAT1 için kuyu; STAT4 için 400.000 U266B1 hücresi / kuyusu) 20 μL hücreyi, uygun kültür ortamında 96 kuyucuklu doku kültürü ile muamele edilmiş bir plakaya dağıtın. Doğrudan hücre tedavisine devam edin veya 37 ° C'de,% 5 CO2'de 2-4 saat inkübe edin.
NOT: Bu adımın farklı hücre türleri için optimize edilmesi gerekir. - Hücre stimülasyonu için, tek başına 20 μL serumsuz ortam (tedavi edilmemiş hücreler) veya uyarıcı içeren (2x) ekleyin.
- RT veya 37 °C'de önceden optimize edilmiş süre için inkübe edin (STAT1 için RT'de IFN�2b/15 dakika; STAT4 için 37 °C'de IFN�2b/25 dakika). Ardından bölüm 3.3'e geçin.
NOT: Optimum inkübasyon sıcaklığının belirlenmesi gerekir. - Hücre inhibisyonu için, tek başına 10 μL serumsuz ortam (tedavi edilmemiş hücreler) veya inhibitörü (4x) içeren bir ortam ekleyin.
- RT veya 37 °C'de önceden optimize edilmiş süre için inkübe edin (STAT1 ve STAT4 için RT'de JAK İnhibitörü 1/30 dakika).
- Tek başına 10 μL serumsuz ortam (işlenmemiş hücreler) veya EC80'inde uyarıcı (4x) içeren bir ortam ekleyin.
- RT veya 37 °C'de önceden optimize edilmiş süre için inkübe edin (adım 3.2.3 ile aynı koşullar).
- Önceden optimize edilmiş yoğunlukta (200.000 U266B1 hücresi / STAT1 için kuyu; STAT4 için 400.000 U266B1 hücresi / kuyusu) 20 μL hücreyi, uygun kültür ortamında 96 kuyucuklu doku kültürü ile muamele edilmiş bir plakaya dağıtın. Doğrudan hücre tedavisine devam edin veya 37 ° C'de,% 5 CO2'de 2-4 saat inkübe edin.
- Hücre lizisi
- Kitin özel 5x Takviyeli Lizis Arabelleğini üretici tarafından belirtildiği gibi hazırlayın.
NOT: 5x Lizis Tamponunun, 5x'lik son konsantrasyona seyreltilmiş 100x Fosfataz İnhibitörü Kokteyli ile desteklenmesi zorunludur. 5x Takviyeli Lizis Tamponu 5 mM sodyum florür, 10 mM sodyum ortovanadat ve 10 mM beta-gliserofosfat içerir. Diğer fosfataz inhibitörleri gerekli değildir ve kaçınılmalıdır. - 10 μL 5x Takviyeli Lizis Tamponu ekleyin.
- Sallanma altında RT'de 30 dakika boyunca inkübe edin (yörüngesel plaka çalkalayıcı 400 rpm'ye ayarlanmış; orta derecede ajitasyon).
NOT: Lizis inkübasyon süresi (30-60 dakika) optimize edilebilir. Lisatlar, hedef protein tespiti için hemen kullanılabilir veya -80 ° C'de dondurulabilir.
- Kitin özel 5x Takviyeli Lizis Arabelleğini üretici tarafından belirtildiği gibi hazırlayın.
- TR-FRET algılama
- Hücre lizisini takiben, TR-FRET tespit adımını, yapışkan hücreler için 2 plakalı tahlil protokolü için bölüm 2.5'te açıklandığı gibi uygulayın.
4. Yapışkan veya süspansiyon hücreleri ile tek plakalı tahlil protokolünü kullanarak uyarıcı titrasyonu
- Test bileşiklerinin seyreltilmesi
- Bir polipropilen 96 delikli plakanın 12 kuyucuğu boyunca seri olarak seyreltilerek 3x'te test bileşiğinin ara seyreltme serisini hazırlayın (yarım kütük aralıklı seyreltmeler) serumsuz ortama dönüştürün.
- Hücre tohumlama ve tedavisi
- Önceden optimize edilmiş yoğunlukta (STAT4 için 160.000 U266B1 hücresi / kuyusu; STAT6 için 80.000 HeLa hücresi / kuyusu), uygun serumsuz kültür ortamında, beyaz, düşük hacimli bir 384iyi tahlil plakasına 8 μL hücre dağıtın. Doğrudan hücre tedavisine devam edin veya 37 ° C'de,% 5 CO2'de 2-4 saat inkübe edin.
NOT: Tedaviden önce hücre kültürü inkübasyon süresi gereksinimi, farklı hücre tipleri için belirlenmelidir. - Hücre stimülasyonu için, tek başına 4 μL serumsuz ortam (tedavi edilmemiş hücreler) veya uyarıcı içeren (3x) ekleyin.
- Oda sıcaklığında veya 37 °C'de önceden optimize edilmiş süre için inkübe edin (STAT4 için 37°C'de IFN�2b/25 dk; STAT6 için 37 ° C'de IL-4/20 dakika). Ardından bölüm 4.3'e geçin.
- Önceden optimize edilmiş yoğunlukta (STAT4 için 160.000 U266B1 hücresi / kuyusu; STAT6 için 80.000 HeLa hücresi / kuyusu), uygun serumsuz kültür ortamında, beyaz, düşük hacimli bir 384iyi tahlil plakasına 8 μL hücre dağıtın. Doğrudan hücre tedavisine devam edin veya 37 ° C'de,% 5 CO2'de 2-4 saat inkübe edin.
- Hücre lizisi
- Kitin özel 5x Takviyeli Lizis Arabelleğini üretici tarafından belirtildiği gibi hazırlayın.
NOT: 5x Lizis Tamponunun, 5x'lik son konsantrasyona seyreltilmiş 100x Fosfataz İnhibitörü Kokteyli ile desteklenmesi zorunludur. - 3 μL 5x Takviyeli Lizis Tamponu ekleyin.
- Sallanma sırasında RT'de 30 dakika boyunca inkübe edin (400 rpm'de yörüngesel plaka çalkalayıcı).
NOT: Lizis inkübasyon süresi (30-60 dakika) optimize edilebilir. Lisatlar hemen kullanılabilir veya 80 °C'de dondurulabilir.
- Kitin özel 5x Takviyeli Lizis Arabelleğini üretici tarafından belirtildiği gibi hazırlayın.
- TR-FRET algılama
- Tahlil kuyularını ayırmak için 15 μL Pozitif Kontrol Lisat (seyreltilmemiş) ve 15 μL 1x Takviyeli Lizis Tamponu (negatif kontrol) ekleyin.
- Tahlil kuyularının her birine 1x Algılama Tamponunda hazırlanan 5 μL 4x Antikor Tespit Karışımı (fosfo-protein için Eu-Ab1 / FR-Ab2 veya toplam protein için Eu-Ab3-/FR-Ab4) ekleyin.
- Plakayı bir plaka kapatıcı ile örtün ve tahlil işlemine bağlı olarak RT'de gece boyunca 1 saate kadar inkübe edin.
NOT: Her tahlil ve hücre çizgisi için optimum okuma süresinin optimize edilmesi gerekir. Plaka, tahlil performansı üzerinde olumsuz bir etkisi olmadan birkaç kez okunabilir. - Yapışkan plaka sızdırmazlık elemanını çıkarın. Plakayı TR-FRET uyumlu bir mikro plaka okuyucuda okuyun.
5. Veri analizi
- Aşağıdaki formülü kullanarak her kuyu için TR-FRET oranını hesaplayın (1):
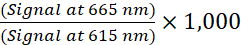 (1)
(1)
NOT: TR-FRET sinyali zaman çözümlü modda okunduğundan, arka plan çıkarma işlemi genellikle gerekli değildir. Arka plan çıkarma işlemi yapılırsa, arka plan çıkarma işlemi için 1x Takviyeli Lizis Arabelleği (negatif kontrol) içeren hücresiz kuyucukları kullanın. Hücresiz kuyulardan ortalama TR-FRET oranını belirleyin ve ardından bu değeri her bir kuyucuğun TR-FRET oranından çıkarın. - Konsantrasyon-yanıt eğrileri için, EC50 veya IC50 değerlerini oluşturmak üzere 4 parametreli lojistik denklemi (değişken eğimli sigmoidal doz-yanıt eğrisi) ve 1/Y2 veri ağırlıklandırmasını kullanarak verileri doğrusal olmayan bir regresyona göre analiz edin.
- Z' faktörü deneyi için, verileri aşağıdaki formüle göre analiz edin (2)10
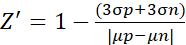 (2)
(2)
Burada μ ve σ sırasıyla pozitif kontrol (p; uyarılmış hücreler) ve negatif kontrol (n; tedavi edilmemiş hücreler) için ortalama değerler ve standart sapmalardır.
Sonuçlar
Her THUNDER TR-FRET testi, yapışkan (HeLa veya A431) veya süspansiyon hücrelerinin (U266B1) JAK / STAT yoluna özgü aktivatörler veya inhibitörlerle muamele edilmesi ve daha sonra uygulanabilir olduğunda spesifik fosforile ve toplam STAT'ların seviyelerinin ölçülmesiyle farmakolojik olarak doğrulanmıştır. Tahliller, iki plakalı transfer protokolü ve önceden optimize edilmiş tahlil koşulları kullanılarak 384 kuyucuklu formatta gerçekleştirildi. Şekil 3, Şekil 4, Şe...
Tartışmalar
Batı lekelenmesi ve ELISA tabanlı yöntemler gibi fosfoprotein analizi için geleneksel yöntemlerle karşılaştırıldığında, THUNDER TR-FRET hücresel tahlili için iş akışı basit ve hızlıdır, düşük hacimli bir numune (15 μL) kullanır, HTS için 384 kuyucuklu bir formatta tasarlanmıştır ve otomasyona oldukça uygundur. Tahlil protokolü esnektir ve hem orta hem de yüksek verimli uygulamalara kolayca uyarlanabilir. Tahliller, iki plakalı bir aktarım protokolü veya bir adet 384 kuyucuklu plaka pr...
Açıklamalar
Rakip İlgi Alanları: Jaime Padros, Mireille Caron ve Geneviève Chatel, bu çalışmada kullanılan THUNDER TR-FRET test kitlerini üreten BioAuxilium Research'ün çalışanlarıdır. Buna ek olarak, Jaime Padros ve Mireille Caron, BioAuxilium Research'ün hissedarlarıdır. Bu, yazarların veri ve materyal paylaşımına ilişkin tüm JoVE politikalarına bağlılığını değiştirmez.
Teşekkürler
Hiç kimse.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 96-well microplate, clear, flat bottom, polystyrene, tissue culture-treated, sterile | Corning | 3595 | This is the plate for culturing cells when using the two-plate assay protocol. Other cell culture 96-well plates can be used |
| 384-well microplate, white, low-volume | PerkinElmer | 6007290 | This is the plate for TR-FRET detection when using the two- or one-plate assay protocols. Other low-volume, white 384-well plates can be used |
| A431 cell line | ATCC | CRL-1555 | |
| Adhesive microplate seal | PerkinElmer | 6050185 | |
| DMSO | Fisher | D159-4 | |
| Dulbecco’s modified Eagle medium (DMEM) | Wisent | 319-005-CL | THUNDER TR-FRET is compatible with culture medium containing phenol red |
| EnVision Xcite Multilabel plate reader | PerkinElmer | 2104-0020A | The assays can be performed on a variety of plate readers equipped with the TR-FRET option |
| Erlotinib hydrochloride | Sigma | CDS022564 | |
| Falcon tissue culture treated flasks | Fisher | 13-680-65 | |
| Fetal bovine serum (FBS) | Wisent | 098-150 | |
| HeLa cell line | ATCC | CCL-2 | |
| JAK Inhibitor 1 | Cayman Chemical | 15146 | |
| Orbital plate shaker | Many options available | Not applicable | |
| Recombinant human EGF | PeproTech | AF-100-15 | |
| Recombinant human IFNα2b | ProSpec | CYT-460 | |
| Recombinant human IL-4 | R&D Systems | 204-IL | |
| Roswell Park Memorial Institute 1640 medium (RPMI) | Wisent | 350-007-CL | THUNDER TR-FRET is compatible with culture medium containing phenol red |
| THUNDER Phospho-STAT1 (Y701) + Total STAT1 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT1PT-500 | |
| THUNDER Phospho-STAT3 (Y705) + Total STAT3 Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT3PT-500 | |
| THUNDER Phospho-STAT4 (Y693) TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT4P-500 | |
| THUNDER Phospho-STAT5 (Y694/Y699) + Total STAT5 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT5PT-500 | |
| THUNDER Phospho-STAT6 (Y641) + Total STAT6 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT6PT-500 | |
| Trypsin/EDTA 0.05% | Wisent | 325-542-CL | |
| U266B1 cell line | ATCC | TIB-196 | |
| Ultrapure water | NA | NA | Use Milli-Q grade water (18 MΩ.cm) to dilute Lysis Buffer and Detection Buffer |
Referanslar
- Villarino, A., Kanno, Y., O'Shea, J. Mechanisms and consequences of Jak-STAT signaling in the immune system. Nature Immunology. 18 (4), 374-384 (2017).
- Hammarén, H. M., Virtanen, A. T., Raivola, J., Silvennoinen, O. The regulation of JAKs in cytokine signaling and its breakdown in disease. Cytokine. 118, 48-63 (2019).
- O'Shea, J. J., et al. The JAK-STAT pathway: impact on human disease and therapeutic intervention. Annual Review of Medicine. 66, 311-328 (2015).
- Verhoeven, Y., et al. et al. potential and controversy of targeting STAT family members in cancer. Seminars in Cancer Biology. 60 (2), 41-56 (2020).
- Gilda, J. E., et al. et al. blotting inaccuracies with unverified antibodies: need for a Western blotting minimal reporting standard (WBMRS). PLoS One. 10 (8), 0135392 (2015).
- Binder, C., et al. et al. and utilization of the SureFire phospho-STAT5 assay for a cell-based screening campaign. Assay and Drug Development Technologies. 6 (1), 27-37 (2008).
- Ayoub, M. A., et al. Homogeneous time-resolved fluorescence-based assay to monitor extracellular signal-regulated kinase signaling in a high-throughput format. Frontiers in Endocrinology. 5, 94 (2014).
- Robers, M. B., Machleidt, T., Carlson, C. B., Bi, K. Cellular LanthaScreen and beta-lactamase reporter assays for high-throughput screening of JAK2 inhibitors. Assay and Drug Development Technologies. 6 (4), 519-529 (2008).
- Hwang, B., Engel, L., Goueli, S. A., Zegzouti, H. A. Homogeneous bioluminescent immunoassay to probe cellular signaling pathway regulation. Communications Biology. 3 (8), 1-12 (2020).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high-throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Osmond, R. I. W., Das, S., Crouch, M. F. Development of cell-based assays for cytokine receptor signaling, using an AlphaScreen SureFire assay format. Analytical Biochemistry. 403 (1-2), 94-101 (2010).
- Haan, C., et al. Jak1 has a dominant role over Jak3 in signal transduction through γc-containing cytokine receptors. Chemistry & Biology. 18 (3), 314-323 (2011).
- Kim, Y., Apetri, M., Luo, B., Settleman, J. E., Anderson, K. S. Differential effects of tyrosine kinase inhibitors on normal and oncogenic EGFR signaling and downstream effectors. Molecular Cancer Research. 13 (4), 765-774 (2015).
- Qian, J., et al. Comparison of two homogeneous cell-based kinase assays for JAK2 V617F: SureFire pSTAT5 and GeneBLAzer fluorescence resonance energy transfer assays. ASSAY and Drug Development Technologies. 10 (2), 212-217 (2012).
- Iversen, P. W., et al., Markossian, S., et al. HTS assay validation. Assay Guidance Manual. , (2012).
- Muelas, M. W., Ortega, F., Breitling, R., Bendtsen, C., Westerhoff, H. V. Rational cell culture optimization enhances experimental reproducibility in cancer cells. Scientific Reports. 8, 3029 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır