Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Tests de transfert d’énergie par résonance de Förster à résolution temporelle pour la mesure des protéines STAT phosphorylées endogènes dans les cellules humaines
Dans cet article
Résumé
Les protocoles de dosage basés sur les cellules de transfert d’énergie de résonance de Förster résolues dans le temps sont décrits pour la quantification simple, spécifique, sensible et robuste du transducteur de signal phosphorylé endogène et de l’activateur de la transcription (STAT) 1/3/4/5/6 dans les lysats cellulaires dans un format de 384 puits.
Résumé
La voie de signalisation Janus kinase (JAK)/transducteur de signal et activateur de transcription (STAT) joue un rôle crucial dans la médiation des réponses cellulaires aux cytokines et aux facteurs de croissance. Les protéines STAT sont activées par la phosphorylation de la tyrosine médiée principalement par les JAG. L’activation anormale des voies de signalisation STAT est impliquée dans de nombreuses maladies humaines, en particulier le cancer et les affections liées au système immunitaire. Par conséquent, la capacité de surveiller la phosphorylation des protéines STAT dans l’environnement de signalisation des cellules natives est importante pour la recherche universitaire et la découverte de médicaments. Les formats de dosage traditionnels disponibles pour quantifier les protéines STAT phosphorylées comprennent le transfert western et le test immuno-enzymatique (ELISA). Ces méthodes hétérogènes sont exigeantes en main-d’œuvre, à faible débit et souvent peu fiables (spécifiques) dans le cas du Western Blotting. Des méthodes homogènes (sans lavage) sont disponibles mais restent coûteuses.
Ici, des protocoles détaillés sont fournis pour la mesure sensible, robuste et rentable dans un format de 384 puits des niveaux endogènes de STAT1 phosphorylés (Y701), STAT3 (Y705), STAT4 (Y693), STAT5 (Y694 / Y699) et STAT6 (Y641) phosphorylés dans les lysats cellulaires de cellules adhérentes ou en suspension à l’aide de la nouvelle plate-forme de transfert d’énergie de résonance Förster à résolution temporelle THUNDER (TR-FRET). Le flux de travail pour le test cellulaire est simple, rapide et conçu pour le criblage à haut débit (HTS). Le protocole d’essai est flexible, utilise un échantillon à faible volume (15 μL), ne nécessite qu’une seule étape d’ajout de réactif et peut être adapté aux applications à faible débit et à haut débit. Chaque immunodosage sandwich phospho-STAT est validé dans des conditions optimisées avec des agonistes et des inhibiteurs connus et génère les valeurs attendues de pharmacologie et de facteur Z. Comme les tests TR-FRET sont ratiométriques et ne nécessitent aucune étape de lavage, ils offrent une bien meilleure reproductibilité que les approches traditionnelles. Ensemble, cette série de tests fournit de nouveaux outils rentables pour une analyse plus complète de protéines STAT phosphorylées spécifiques après un traitement cellulaire et le criblage et la caractérisation de modulateurs spécifiques et sélectifs de la voie de signalisation JAK/STAT.
Introduction
La voie de signalisation JAK/STAT joue un rôle clé dans la médiation des réponses cellulaires à diverses cytokines, interférons, facteurs de croissance et molécules apparentées1,2. La liaison de ces ligands à des récepteurs spécifiques de la surface cellulaire entraîne l’activation des JAG, qui à leur tour activent les protéines STAT par phosphorylation de résidus de tyrosine spécifiques. La phosphorylation STAT entraîne leur dimérisation et leur translocation dans le noyau, où ils exercent leur effet sur la transcription des gènes cibles régulés. La famille STAT se compose de sept membres : STAT1, STAT2, STAT3, STAT4, STAT5a, STAT5b et STAT6. Les membres jouent un rôle complexe et essentiel dans la régulation des processus cellulaires physiologiques, y compris la prolifération, la différenciation, l’apoptose, l’angiogenèse et la régulation du système immunitaire. L’activation anormale des voies de signalisation STAT est impliquée dans de nombreuses maladies humaines, en particulier le cancer et les affections liées au système immunitaire3,4. Par conséquent, la capacité d’évaluer la phosphorylation des protéines STAT dans l’environnement de signalisation des cellules natives est importante pour la recherche universitaire et la découverte de médicaments.
À ce jour, les méthodes conventionnelles utilisées pour mesurer les niveaux de protéines phosphorylées intracellulaires, y compris les STAT, sont à base d’anticorps et comprennent le western blotting, l’ELISA et la cytométrie phosphoflow. Ces méthodes hétérogènes sont exigeantes en main-d’œuvre, chronophages, sujettes aux erreurs, à faible débit et souvent peu fiables (par exemple, des problèmes de spécificité) dans le cas du transfert Western5. En revanche, les essais homogènes nécessitent moins d’étapes expérimentales, utilisent des volumes d’échantillons plus petits et se prêtent à HTS. Il existe cinq plates-formes d’immunodosage cellulaires homogènes disponibles dans le commerce qui peuvent être utilisées pour surveiller quantitativement la phosphorylation dépendante de JAK des STAT dans les lysats cellulaires : SureFire, HTRF, LANCE, LanthaScreen et Lumit. Chacune de ces plateformes a ses avantages et ses inconvénients.
SureFire est basé sur la technologie de canalisation de l’oxygène luminescent, qui utilise des billes de donneur et d’accepteur enduites pour capturer spécifiquement une paire d’anticorps, dont l’un est biotinylé. En présence de protéines phosphorylées, les deux anticorps rapprochent les perles donneuses et acceptatrices, permettant la génération d’un signal chimiluminescent6. Bien que polyvalente et sensible, cette technologie est coûteuse, est affectée par la biotine dans le milieu de culture, est très sensible à la température ambiante et à la lumière, et nécessite un lecteur spécial pour la détection. HTRF et LANCE sont tous deux basés sur la technologie TR-FRET qui utilise des complexes d’ions lanthanides luminescents à longue durée de vie (chélates d’europium ou de terbium, ou cryptate d’europium) comme molécules donneuses et des fluorophores rouge lointain comme molécules acceptrices7. Lorsque deux anticorps spécifiques à une protéine marqués avec des molécules donneuses ou acceptrices sont rapprochés, fret a lieu, provoquant une augmentation de la fluorescence de l’accepteur et une diminution de la fluorescence du donneur. Ces signaux fluorescents à longue durée de vie peuvent être mesurés de manière à résolution temporelle et ratiométrique afin de réduire les interférences de dosage et d’augmenter la qualité des données. D’autres avantages du TR-FRET sont qu’il n’est pas sensible à la lumière, permet des lectures répétées et présente une longue stabilité du signal. Alors que TR-FRET est largement mis en œuvre dans HTS en raison de sa polyvalence, de sa sensibilité et de sa grande robustesse, toutes les plates-formes de dosage commerciales basées sur TR-FRET sont coûteuses, empêchant ainsi son large adoption dans les laboratoires universitaires et les petits laboratoires industriels. Le test LanthaScreen utilise également une lecture basée sur TR-FRET, mais repose sur une lignée cellulaire U2OS conçue qui exprime de manière stable la protéine fluorescente verte (GFP)-STAT1 combinée à un anticorps STAT1 spécifique au phospho marqué au terbium8. En plus d’être limitée en termes de choix de protéines de signalisation, cette méthode nécessite l’achat de lignées cellulaires transfectées coûteuses, réduisant son applicabilité et augmentant la possibilité d’artefacts expérimentaux. Lumit est une plateforme générique d’immunodosage bioluminescent qui utilise des anticorps secondaires (anti-souris et anti-lapin) marqués chimiquement avec les petites et grandes sous-unités NanoBit de NanoLuc Luciferase9. La liaison de deux anticorps primaires à la protéine cible rapproche les anticorps secondaires pour former une enzyme active qui génère un signal de luminescence. Bien que la luminescence soit généralement une lecture sensible et robuste, l’exigence d’anticorps primaires soulevés chez deux espèces différentes limite les choix pour la conception du test. En outre, l’utilisation d’anticorps secondaires dans des matrices d’échantillons complexes peut être sujette à des interférences de dosage.
Ainsi, il existe toujours un besoin d’une plate-forme de dosage cellulaire fiable, rapide mais abordable pour mesurer les protéines STAT phosphorylées et totales individuelles d’une manière compatible avec HTS. Pour répondre à ce besoin, une nouvelle plateforme d’immunoessais cellulaires à haut débit a été développée sur la base d’une technologie TR-FRET améliorée (THUNDER) et conçue pour permettre une mesure simple, sensible, robuste et rentable des protéines intracellulaires exprimées de manière endogène (phosphorylées ou totales) dans les lysats cellulaires. Les avantages de cette technologie découlent de la combinaison d’une paire FRET donneur/accepteur présentant une compatibilité spectrale exceptionnelle et un signal TR-FRET, d’anticorps rigoureusement validés et de tampons de lyse optimisés. Ces tests sont formatés en tests immunologiques sandwich et utilisent un flux de travail simple en trois étapes (Figure 1). Les cellules sont d’abord traitées pour moduler la phosphorylation des protéines, puis lysées avec le tampon de lyse spécifique fourni dans le kit. La protéine STAT phosphorylée ou totale cible dans le lysat cellulaire est détectée en une seule étape d’ajout et d’incubation de réactif avec une paire d’anticorps marqués au fluorophore qui reconnaissent des épitopes distincts sur la protéine cible (Figure 2). Un anticorps est marqué avec un donneur de chélate d’europium (Eu-Ab1), tandis que le second anticorps est marqué avec un fluorophore accepteur rouge lointain (FR-Ab2). Les deux anticorps marqués se lient à la protéine en solution, ce qui rapproche les deux étiquettes. L’excitation du chélate d’europium donneur à 320 ou 340 nm déclenche un FRET vers l’accepteur, qui émet un signal TR-FRET à longue durée de vie à 665 nm proportionnel à la concentration de protéine cible (phosphorylée ou totale) dans le lysat cellulaire.
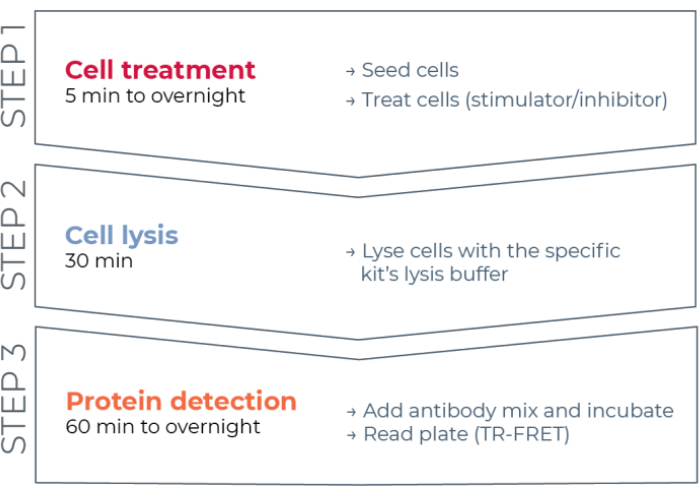
Figure 1 : Flux de travail du test TR-FRET. Le flux de travail se compose de trois étapes : le traitement cellulaire, la lyse cellulaire et la détection des protéines à l’aide de TR-FRET. Dans le protocole d’essai à deux plaques, les lysats sont transférés sur une plaque de détection blanche de 384 puits, tandis que dans le protocole à une plaque, toutes les étapes sont effectuées dans la même plaque de détection blanche de 384 puits (protocole tout-en-un). Quel que soit le protocole de dosage utilisé, la détection des protéines est effectuée dans le même volume total (20 μL par puits). Abréviation : TR-FRET = transfert d’énergie de résonance de Förster résolu dans le temps. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Principe du test immunologique en sandwich TR-FRET. Un anticorps est marqué avec le donneur de chélate d’Europium (Eu-Ab1) et le second avec le petit accepteur de fluorophore rouge lointain (FR-Ab2). Les deux anticorps marqués se lient spécifiquement à des épitopes distincts sur la protéine cible (phosphorylée ou totale) dans le lysat cellulaire, amenant les deux fluorophores à proximité. L’excitation du chélate d’europium donneur à 320 ou 340 nm déclenche une FRET du donneur vers les molécules acceptrices, qui à leur tour émettent un signal à 665 nm. Ce signal est proportionnel à la concentration de protéines dans le lysat cellulaire. En l’absence de la protéine cible spécifique, les fluorophores donneurs et accepteurs sont trop éloignés l’un de l’autre pour que fret se produise. Abréviations : FRET = transfert d’énergie de résonance de Förster ; TR-FRET = FRET à résolution temporelle; Ab = anticorps; FR = rouge lointain; Eu - chélate d’europium; P = phosphorylation. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Ici, des protocoles détaillés sont fournis pour mesurer, dans un format de puits 384, les niveaux intracellulaires de STAT1 phosphorylé (Y701), STAT3 (Y705), STAT4 (Y693), STAT5 (Y694/Y699) et STAT6 (Y641), ainsi que les totals STAT1, STAT3, STAT5 et STAT6, dans les lysats cellulaires des cellules adhérentes ou en suspension à l’aide de la plate-forme THUNDER TR-FRET. Ces protocoles définissent les étapes du traitement cellulaire, de la lyse et de la détection des protéines cibles basée sur TR-FRET à l’aide d’un protocole de transfert à deux plaques ou d’un protocole tout-en-un à une plaque. Ces tests cellulaires sont appliqués pour déterminer le profil pharmacologique des activateurs et inhibiteurs connus de la voie JAK/STAT. La robustesse et la pertinence de certains tests pour HTS sont démontrées. Enfin, des expériences clés pour l’optimisation des tests sont discutées, ainsi que des recommandations pour le dépannage des tests.
Protocole
1. Culture cellulaire
- Maintenir les cellules dans un incubateur et une culture de CO2 humidifié à 37 °C/5 % avec du DMEM complété par 10 % de sérum fœtal bovin (FBS) (cellules HeLa et A431) ou rpmI complété par 15 % de FBS (cellules U266B1). Cultivez les cellules jusqu’à ce qu’elles atteignent 70 à 80% de confluence, puis essayez-les et passez-les ou utilisez-les pour les essais.
REMARQUE: Les milieux de culture contenaient du rouge phénolique. Aucune famine sérique n’a été effectuée pour aucune lignée cellulaire avant d’effectuer les essais.
2. Titrage du stimulateur ou de l’inhibiteur à l’aide du protocole de dosage à deux plaques avec des cellules adhérentes
REMARQUE: Cette procédure décrit comment déterminer les puissances du stimulateur ou de l’inhibiteur en générant une courbe concentration-réponse à partir d’une série de dilution du composé d’essai.
- Ensemencement cellulaire
- Distribuer 50 μL de cellules à la densité pré-optimisée (40 000 cellules HeLa/puits pour STAT3 et STAT6 ; 75 000 cellules A431/puits pour STAT5) dans une plaque de culture tissulaire de 96 puits dans le milieu de culture approprié. Incuber toute la nuit à 37 °C/5 % de CO2.
REMARQUE: La densité cellulaire optimale et le temps d’incubation de la culture doivent être déterminés.
- Distribuer 50 μL de cellules à la densité pré-optimisée (40 000 cellules HeLa/puits pour STAT3 et STAT6 ; 75 000 cellules A431/puits pour STAT5) dans une plaque de culture tissulaire de 96 puits dans le milieu de culture approprié. Incuber toute la nuit à 37 °C/5 % de CO2.
- Dilutions des composés d’essai
- Préparer une série intermédiaire de 2x dilutions de composé(s) d’essai en diluant en série le(s) composé(s) (dilutions d’intervalle demi-logarithmiques) à travers 12 puits d’une plaque de polypropylène à 96 puits dans un milieu sans sérum.
REMARQUE : Il est recommandé d’effectuer une courbe concentration-réponse d’intervalle d’un demi-logarithme de 12 points au moins en double pour une estimation précise de la CE50 ou de la CI50. - Alternativement, pour les composés d’essai hydrophobes solubles dans le diméthylsulfoxyde (DMSO), effectuez les dilutions initiales dans du DMSO à 100%, puis diluez la série de dilution composée dans un milieu sans sérum.
REMARQUE: La tolérance d’essai au DMSO doit être établie avant d’effectuer un titrage du composé d’essai dans un véhicule DMSO. Il est important de maintenir des concentrations égales de solvant entre les cellules traitées et non traitées. En outre, lors de l’essai de dilutions en série de composés, les concentrations de solvants doivent toujours rester constantes dans toute la série de dilutions.
- Préparer une série intermédiaire de 2x dilutions de composé(s) d’essai en diluant en série le(s) composé(s) (dilutions d’intervalle demi-logarithmiques) à travers 12 puits d’une plaque de polypropylène à 96 puits dans un milieu sans sérum.
- Traitement cellulaire
- Pour la stimulation cellulaire, ajouter 50 μL de milieu sans sérum seul (cellules non traitées) ou contenant le stimulateur (2x).
- Incuber pendant le temps pré-optimisé à température ambiante (RT) ou à 37 °C (interféron (IFN) α2b/20 min à RT pour STAT3 ; facteur de croissance épidermique (EGF)/10 min à RT pour STAT5 ; interleukine (IL)-4/20 min à RT pour STAT6). Passez ensuite à la section 2.4.
REMARQUE: La température d’incubation optimale doit être déterminée. - Pour l’inhibition cellulaire, ajouter 25 μL de milieu sans sérum seul (cellules non traitées) ou contenant l’inhibiteur (4x).
- Incuber pendant le temps pré-optimisé à RT ou 37 °C (inhibiteur de JAK 1/30 min à RT pour STAT3 et STAT6; Erlotinib/15 min à RT pour STAT5).
- Ajouter 25 μL de milieu sans sérum seul (cellules non traitées) ou contenant le stimulateur (4x) à son EC80.
- Incuber pendant le temps pré-optimisé à RT ou 37 °C (mêmes conditions que pour l’étape 2.3.2).
- Lyse cellulaire
- Préparez le tampon de lyse supplémenté 1x spécifique du kit comme indiqué par le fabricant.
REMARQUE: Il est obligatoire de compléter le tampon de lyse 1x avec le cocktail d’inhibiteurs de phosphatase 100x dilué à une concentration finale de 1x. Le tampon de lyse supplémenté 1x contient 1 mM de fluorure de sodium, 2 mM d’orthovanadate de sodium et 2 mM de bêta-glycérophosphate. D’autres inhibiteurs de la phosphatase ne sont pas nécessaires et doivent être évités. Les tampons de lyse et les inhibiteurs de phosphatase autres que ceux inclus dans le kit ne sont pas recommandés car ils peuvent contenir des ingrédients qui pourraient interférer avec la mesure. - Retirez et jetez soigneusement le milieu de culture cellulaire en aspirant le surnageant.
- Ajouter immédiatement 50 μL de 1x tampon de lyse supplémenté.
REMARQUE: Le volume du tampon de lyse (25-50 μL) peut être optimisé. - Incuber pendant 30 min à RT sous agitation (agitateur à plaque orbitale réglé à 400 tr/min; agitation modérée).
REMARQUE: Le temps d’incubation de la lyse (30-60 min) peut être optimisé. Les lysats peuvent être utilisés immédiatement pour la détection des protéines cibles ou congelés à -80 °C.
- Préparez le tampon de lyse supplémenté 1x spécifique du kit comme indiqué par le fabricant.
- Détection TR-FRET
- Préparez le mélange de détection d’anticorps 4x dans 1x tampon de détection comme indiqué par le fabricant.
- Dans cette étape de transfert, pipetez soigneusement 15 μL de lysat cellulaire de la plaque de culture de 96 puits vers un puits d’une microplaque blanche de 384 puits à faible volume.
- Ajouter 15 μL de lysat témoin positif et 15 μL de 1x tampon de lyse (témoin négatif) pour séparer les puits d’essai.
- Ajouter 5 μL de 4x Antibody Detection Mix (soit Eu-Ab1/FR-Ab2 pour la détection de la phospho-protéine ou Eu-Ab3/FR-Ab4 pour la détection de la protéine totale) à chacun des puits d’essai.
- Couvrir la plaque avec un scellant à plaques et incuber pendant 1 h jusqu’à la nuit à RT, selon le test (voir la fiche technique correspondante).
REMARQUE: Le temps de lecture optimal doit être optimisé pour chaque test et lignée cellulaire. La plaque peut être lue plusieurs fois sans effet négatif sur les performances du test. - Retirez le scellant de plaque adhésive et lisez la plaque sur un lecteur de microplaques compatible TR-FRET.
REMARQUE: Les fluoromètres à filtre sont recommandés, bien que certains instruments monochromateurs puissent être utilisés. Vérifiez que le module optique approprié (filtres et miroir) pour TR-FRET est installé. Utilisez une longueur d’onde d’excitation de 320 ou 340 nm pour exciter le chélate d’europium. Lire les essais à 615 nm (ou 620 nm) et 665 nm pour détecter à la fois l’émission de l’europium donneur et du fluorophore accepteur, respectivement. Les réglages de l’instrument dépendront du lecteur particulier. Les données présentées ici ont été obtenues en utilisant une excitation à base de lampe, un délai de 90 μs, un temps d’intégration de 300 μs et 100 flashs par puits. Le test phospho-STAT4, cependant, a été lu en utilisant l’excitation laser pour générer des rapports signal/fond (S / B) plus élevés.
3. Titrage du stimulateur ou de l’inhibiteur à l’aide du protocole de dosage à deux plaques avec des cellules en suspension
- Dilution des composés d’essai
- Préparer une série intermédiaire de dilution 2x de composé(s) d’essai comme décrit aux étapes 2.2.1 et 2.2.2.
- Ensemencement et traitement des cellules
- Distribuer 20 μL de cellules à la densité pré-optimisée (200 000 cellules U266B1/puits pour STAT1 ; 400 000 cellules U266B1/puits pour STAT4) dans une plaque de culture tissulaire de 96 puits dans le milieu de culture approprié. Procéder directement au traitement cellulaire ou incuber 2-4 h à 37 °C, 5% de CO2.
REMARQUE : cette étape doit être optimisée pour différents types de cellules. - Pour la stimulation cellulaire, ajouter 20 μL de milieu sans sérum seul (cellules non traitées) ou contenant le stimulateur (2x).
- Incuber pendant le temps pré-optimisé à RT ou 37 °C (IFNα2b/15 min à RT pour STAT1; IFNα2b/25 min à 37 °C pour STAT4). Passez ensuite à la section 3.3.
REMARQUE: La température d’incubation optimale doit être déterminée. - Pour l’inhibition cellulaire, ajouter 10 μL de milieu sans sérum seul (cellules non traitées) ou contenant l’inhibiteur (4x).
- Incuber pendant le temps pré-optimisé à RT ou 37 °C (inhibiteur de JAK 1/30 min à RT pour STAT1 et STAT4).
- Ajouter 10 μL de milieu sans sérum seul (cellules non traitées) ou contenant le stimulateur (4x) à son EC80.
- Incuber pendant le temps pré-optimisé à RT ou 37 °C (mêmes conditions que pour l’étape 3.2.3).
- Distribuer 20 μL de cellules à la densité pré-optimisée (200 000 cellules U266B1/puits pour STAT1 ; 400 000 cellules U266B1/puits pour STAT4) dans une plaque de culture tissulaire de 96 puits dans le milieu de culture approprié. Procéder directement au traitement cellulaire ou incuber 2-4 h à 37 °C, 5% de CO2.
- Lyse cellulaire
- Préparez le tampon de lyse supplémenté 5x spécifique du kit comme indiqué par le fabricant.
REMARQUE: Il est obligatoire de compléter le tampon de lyse 5x avec le cocktail d’inhibiteurs de phosphatase 100x dilué à une concentration finale de 5x. Le tampon de lyse supplémenté 5x contient 5 mM de fluorure de sodium, 10 mM d’orthovanadate de sodium et 10 mM de bêta-glycérophosphate. D’autres inhibiteurs de la phosphatase ne sont pas nécessaires et doivent être évités. - Ajouter 10 μL de 5x tampon de lyse complété.
- Incuber pendant 30 min à RT sous agitation (agitateur à plaque orbitale réglé à 400 tr/min; agitation modérée).
REMARQUE: Le temps d’incubation de la lyse (30-60 min) peut être optimisé. Les lysats peuvent être utilisés immédiatement pour la détection des protéines cibles ou congelés à -80 °C.
- Préparez le tampon de lyse supplémenté 5x spécifique du kit comme indiqué par le fabricant.
- Détection TR-FRET
- Après la lyse cellulaire, effectuer l’étape de détection TR-FRET comme décrit à la rubrique 2.5 pour le protocole de dosage à 2 plaques pour les cellules adhérentes.
4. Titrage du stimulateur à l’aide du protocole de dosage à une plaque avec des cellules adhérentes ou en suspension
- Dilution des composés d’essai
- Préparer une série de dilution intermédiaire de composé(s) d’essai à 3x en diluant en série le(s) composé(s) (dilutions par intervalle demi-logarithmique) à travers 12 puits d’une plaque de polypropylène à 96 puits dans un milieu sans sérum.
- Ensemencement et traitement des cellules
- Distribuer 8 μL de cellules à la densité pré-optimisée (160 000 cellules U266B1/puits pour STAT4 ; 80 000 cellules HeLa/puits pour STAT6), dans le milieu de culture sans sérum approprié, dans une plaque de dosage blanche de faible volume 384well. Procéder directement au traitement cellulaire ou incuber 2-4 h à 37 °C, 5% de CO2.
REMARQUE: L’exigence d’une période d’incubation en culture cellulaire avant le traitement doit être déterminée pour différents types de cellules. - Pour la stimulation cellulaire, ajouter 4 μL de milieu sans sérum seul (cellules non traitées) ou contenant le stimulateur (3x).
- Incuber pour le temps pré-optimisé à température ambiante ou à 37 °C (IFNα2b/25 min à 37 °C pour STAT4; IL-4/20 min à 37°C pour STAT6). Passez ensuite à la section 4.3.
- Distribuer 8 μL de cellules à la densité pré-optimisée (160 000 cellules U266B1/puits pour STAT4 ; 80 000 cellules HeLa/puits pour STAT6), dans le milieu de culture sans sérum approprié, dans une plaque de dosage blanche de faible volume 384well. Procéder directement au traitement cellulaire ou incuber 2-4 h à 37 °C, 5% de CO2.
- Lyse cellulaire
- Préparez le tampon de lyse supplémenté 5x spécifique du kit comme indiqué par le fabricant.
REMARQUE: Il est obligatoire de compléter le tampon de lyse 5x avec le cocktail d’inhibiteurs de phosphatase 100x dilué à une concentration finale de 5x. - Ajouter 3 μL de 5x tampon de lyse supplémenté.
- Incuber pendant 30 min à RT sous agitation (agitateur à plaque orbitale à 400 tr/min).
REMARQUE: Le temps d’incubation de la lyse (30-60 min) peut être optimisé. Les lysats peuvent être utilisés immédiatement ou congelés à 80 °C.
- Préparez le tampon de lyse supplémenté 5x spécifique du kit comme indiqué par le fabricant.
- Détection TR-FRET
- Ajouter 15 μL de lysat témoin positif (non dilué) et 15 μL de 1x tampon de lyse supplémenté (témoin négatif) pour séparer les puits d’essai.
- Ajouter 5 μL de 4x mélange de détection d’anticorps (soit Eu-Ab1/FR-Ab2 pour la protéine phospho ou Eu-Ab3-/FR-Ab4 pour la protéine totale) préparé dans 1x tampon de détection à chacun des puits d’essai.
- Couvrir la plaque avec un scellant à plaques et incuber pendant 1 h jusqu’à la nuit à RT, selon le test.
REMARQUE: Le temps de lecture optimal doit être optimisé pour chaque test et lignée cellulaire. La plaque peut être lue plusieurs fois sans effet négatif sur les performances du test. - Retirez le scellant de plaque adhésive. Lisez la plaque sur un lecteur de microplaques compatible TR-FRET.
5. Analyse des données
- Calculer le rapport TR-FRET pour chaque puits à l’aide de la formule suivante (1) :
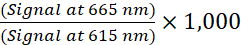 (1)
(1)
REMARQUE: Étant donné que le signal TR-FRET est lu en mode à résolution temporelle, la soustraction d’arrière-plan n’est généralement pas nécessaire. Si une soustraction de fond est effectuée, utilisez les puits sans cellule contenant le tampon de lyse supplémenté 1x (contrôle négatif) pour la soustraction de fond. Déterminez le rapport TR-FRET moyen des puits sans cellules, puis soustrayez cette valeur du rapport TR-FRET de chaque puits. - Pour les courbes concentration-réponse, analysez les données selon une régression non linéaire en utilisant l’équation logistique à 4 paramètres (courbe dose-réponse sigmoïdale avec pente variable) et une pondération des données 1/Y2 pour générer des valeurs EC50 ou IC50 .
- Pour l’expérience du facteur Z', analysez les données selon la formule suivante (2)10
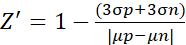 (2)
(2)
Lorsque μ et σ sont les valeurs moyennes et les écarts-types pour le témoin positif (p; cellules stimulées) et le contrôle négatif (n; cellules non traitées), respectivement.
Résultats
Chaque test THUNDER TR-FRET a été validé pharmacologiquement en traitant des cellules adhérentes (HeLa ou A431) ou en suspension (U266B1) avec des activateurs ou des inhibiteurs spécifiques à la voie JAK/STAT, puis en mesurant les niveaux de TAG phosphorylés et totaux spécifiques, le cas échéant. Les essais ont été effectués en format 384 puits en utilisant le protocole de transfert à deux plaques et des conditions de dosage pré-optimisées. La figure 3, l...
Discussion
Comparé aux méthodes conventionnelles d’analyse des phosphoprotéines telles que le western blotting et les méthodes BASÉES SUR ELISA, le flux de travail pour un test cellulaire THUNDER TR-FRET est simple et rapide, utilise un échantillon à faible volume (15 μL), est conçu pour HTS dans un format 384 puits et se prête parfaitement à l’automatisation. Le protocole d’essai est flexible et peut facilement être adapté aux applications à débit moyen et élevé. Les tests peuvent être exécutés à l’aid...
Déclarations de divulgation
Intérêts concurrents : Jaime Padros, Mireille Caron et Geneviève Chatel sont des employés de BioAuxilium Research, qui fabrique les kits de dosage THUNDER TR-FRET utilisés dans cette étude. De plus, Jaime Padros et Mireille Caron sont actionnaires de BioAuxilium Research. Cela ne modifie pas l’adhésion des auteurs à toutes les politiques de JoVE sur le partage de données et de documents.
Remerciements
Aucun.
matériels
| Name | Company | Catalog Number | Comments |
| 96-well microplate, clear, flat bottom, polystyrene, tissue culture-treated, sterile | Corning | 3595 | This is the plate for culturing cells when using the two-plate assay protocol. Other cell culture 96-well plates can be used |
| 384-well microplate, white, low-volume | PerkinElmer | 6007290 | This is the plate for TR-FRET detection when using the two- or one-plate assay protocols. Other low-volume, white 384-well plates can be used |
| A431 cell line | ATCC | CRL-1555 | |
| Adhesive microplate seal | PerkinElmer | 6050185 | |
| DMSO | Fisher | D159-4 | |
| Dulbecco’s modified Eagle medium (DMEM) | Wisent | 319-005-CL | THUNDER TR-FRET is compatible with culture medium containing phenol red |
| EnVision Xcite Multilabel plate reader | PerkinElmer | 2104-0020A | The assays can be performed on a variety of plate readers equipped with the TR-FRET option |
| Erlotinib hydrochloride | Sigma | CDS022564 | |
| Falcon tissue culture treated flasks | Fisher | 13-680-65 | |
| Fetal bovine serum (FBS) | Wisent | 098-150 | |
| HeLa cell line | ATCC | CCL-2 | |
| JAK Inhibitor 1 | Cayman Chemical | 15146 | |
| Orbital plate shaker | Many options available | Not applicable | |
| Recombinant human EGF | PeproTech | AF-100-15 | |
| Recombinant human IFNα2b | ProSpec | CYT-460 | |
| Recombinant human IL-4 | R&D Systems | 204-IL | |
| Roswell Park Memorial Institute 1640 medium (RPMI) | Wisent | 350-007-CL | THUNDER TR-FRET is compatible with culture medium containing phenol red |
| THUNDER Phospho-STAT1 (Y701) + Total STAT1 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT1PT-500 | |
| THUNDER Phospho-STAT3 (Y705) + Total STAT3 Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT3PT-500 | |
| THUNDER Phospho-STAT4 (Y693) TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT4P-500 | |
| THUNDER Phospho-STAT5 (Y694/Y699) + Total STAT5 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT5PT-500 | |
| THUNDER Phospho-STAT6 (Y641) + Total STAT6 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT6PT-500 | |
| Trypsin/EDTA 0.05% | Wisent | 325-542-CL | |
| U266B1 cell line | ATCC | TIB-196 | |
| Ultrapure water | NA | NA | Use Milli-Q grade water (18 MΩ.cm) to dilute Lysis Buffer and Detection Buffer |
Références
- Villarino, A., Kanno, Y., O'Shea, J. Mechanisms and consequences of Jak-STAT signaling in the immune system. Nature Immunology. 18 (4), 374-384 (2017).
- Hammarén, H. M., Virtanen, A. T., Raivola, J., Silvennoinen, O. The regulation of JAKs in cytokine signaling and its breakdown in disease. Cytokine. 118, 48-63 (2019).
- O'Shea, J. J., et al. The JAK-STAT pathway: impact on human disease and therapeutic intervention. Annual Review of Medicine. 66, 311-328 (2015).
- Verhoeven, Y., et al. et al. potential and controversy of targeting STAT family members in cancer. Seminars in Cancer Biology. 60 (2), 41-56 (2020).
- Gilda, J. E., et al. et al. blotting inaccuracies with unverified antibodies: need for a Western blotting minimal reporting standard (WBMRS). PLoS One. 10 (8), 0135392 (2015).
- Binder, C., et al. et al. and utilization of the SureFire phospho-STAT5 assay for a cell-based screening campaign. Assay and Drug Development Technologies. 6 (1), 27-37 (2008).
- Ayoub, M. A., et al. Homogeneous time-resolved fluorescence-based assay to monitor extracellular signal-regulated kinase signaling in a high-throughput format. Frontiers in Endocrinology. 5, 94 (2014).
- Robers, M. B., Machleidt, T., Carlson, C. B., Bi, K. Cellular LanthaScreen and beta-lactamase reporter assays for high-throughput screening of JAK2 inhibitors. Assay and Drug Development Technologies. 6 (4), 519-529 (2008).
- Hwang, B., Engel, L., Goueli, S. A., Zegzouti, H. A. Homogeneous bioluminescent immunoassay to probe cellular signaling pathway regulation. Communications Biology. 3 (8), 1-12 (2020).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high-throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Osmond, R. I. W., Das, S., Crouch, M. F. Development of cell-based assays for cytokine receptor signaling, using an AlphaScreen SureFire assay format. Analytical Biochemistry. 403 (1-2), 94-101 (2010).
- Haan, C., et al. Jak1 has a dominant role over Jak3 in signal transduction through γc-containing cytokine receptors. Chemistry & Biology. 18 (3), 314-323 (2011).
- Kim, Y., Apetri, M., Luo, B., Settleman, J. E., Anderson, K. S. Differential effects of tyrosine kinase inhibitors on normal and oncogenic EGFR signaling and downstream effectors. Molecular Cancer Research. 13 (4), 765-774 (2015).
- Qian, J., et al. Comparison of two homogeneous cell-based kinase assays for JAK2 V617F: SureFire pSTAT5 and GeneBLAzer fluorescence resonance energy transfer assays. ASSAY and Drug Development Technologies. 10 (2), 212-217 (2012).
- Iversen, P. W., et al., Markossian, S., et al. HTS assay validation. Assay Guidance Manual. , (2012).
- Muelas, M. W., Ortega, F., Breitling, R., Bendtsen, C., Westerhoff, H. V. Rational cell culture optimization enhances experimental reproducibility in cancer cells. Scientific Reports. 8, 3029 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon