A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
توصيف تصوير الانعكاس التداخل أحادي الجسيم للحويصلات الفردية خارج الخلية وديناميكيات السكان
In This Article
Summary
يقدم هذا البروتوكول تصوير انعكاس التداخل أحادي الجسيم المصمم للقياسات متعددة المستويات والشاملة لحجم الحويصلات خارج الخلية (EV) ، وعدد EV ، والنمط الظاهري EV ، وتحديد الموقع الحيوي للعلامة الحيوية EV.
Abstract
الحويصلات خارج الخلية (EVs) عبارة عن حويصلات بحجم نانومتر مع طبقة ثنائية دهنية تفرزها معظم الخلايا. تحمل المركبات الكهربائية العديد من الجزيئات البيولوجية المختلفة ، بما في ذلك البروتين والدهون والحمض النووي والحمض النووي الريبي ، ويتم افتراضها لتسهيل التواصل من خلية إلى خلية في الأنسجة والأعضاء المتنوعة. في الآونة الأخيرة ، جذبت المركبات الكهربائية اهتماما كبيرا كمؤشرات حيوية للتشخيص والعوامل العلاجية لمختلف الأمراض. تم تطوير العديد من الطرق لتوصيف المركبات الكهربائية. ومع ذلك ، فإن الطرق الحالية لتحليل المركبات الكهربائية لها قيود مختلفة. وبالتالي ، فإن تطوير طرق فعالة وفعالة لعزل المركبات الكهربائية وتوصيفها يظل أحد الخطوات الحاسمة لهذا المجال البحثي المتطور مع نضوجه. هنا ، نقدم بروتوكولا مفصلا يحدد مستشعر تصوير الانعكاس التداخل أحادي الجسيم (SP-IRIS) ، كطريقة قادرة على اكتشاف وتوصيف المركبات الكهربائية من مصادر بيولوجية غير منقاة ومركبات كهربائية منقاة بمنهجيات أخرى. يمكن استخدام هذه التقنية المتقدمة لقياسات متعددة المستويات وشاملة لتحليل حجم المركبات الكهربائية ، وعدد المركبات الكهربائية ، والنمط الظاهري للمركبات الكهربائية ، وتحديد الموضع المشترك للمؤشرات الحيوية.
Introduction
الحويصلات خارج الخلية (EVs) عبارة عن حويصلات غشائية بحجم نانومتر من أصل خلوي يمكن عزلها عن العديد من السوائل البيولوجية ، بما في ذلك الدم وحليب الثدي واللعاب والبول والصفراء وعصير البنكرياس والسوائل الدماغية النخاعية والصفاقية. يحدث اشتقاق المركبات الكهربائية عبر ثلاث آليات رئيسية: موت الخلايا المبرمج ، والإطلاق عن طريق اندماج الأجسام متعددة الحويصلات مع غشاء البلازما ، وفقاع غشاءالبلازما 1. تشير الأدلة على نقل مكونات الخلايا المانحة إلى الخلايا والأنسجة المجاورة أو البعيدة إلى أن هذه العبوات المغلقة بالغشاء قد تلعب أدوارا مهمة في الباراكرين وكذلك شلالات إشارات المسافات الطويلة أو الغدد الصماء1،2،3. نظرا لأن المركبات الكهربائية يمكن أن توفر لمحة سريعة عن النمط الظاهري للخلية ، فإن إمكانية استخدامها كأدوات تشخيصية وعلاجية لعلاج الأمراض المختلفة أصبحت مجالا نشطا للبحث4،5،6،7،8.
تم تطوير العديد من الطرق التي تهدف إلى توصيف المركبات الكهربائية9،10،11،12،13. توفر معظم هذه الطرق معلومات فريدة وقيمة حول مجموعات المركبات الكهربائية بكميات كبيرة في المقام الأول. في حين أن مجموعة فرعية من هذه التقنيات يمكن أن توفر تفاصيل تتعلق بالمواد داخل أو على المركبات الكهربائية الفردية ، يمكن أن تكون هناك قيود على توصيف المركبات الكهربائية على مستوى المركبات الكهربائية الواحدة. على سبيل المثال ، يمكن استخدام المجهر الإلكتروني المناعي لفهم المركبات الكهربائية الفردية وتكوينها ، ولكن هذه التقنية منخفضة الإنتاجية ، ومحدودة للغاية في قدرتها على استخدامها لوصف ديناميكيات السكان ، وتتطلب تطوير طرق مهمة14.
في الآونة الأخيرة ، أدى تطوير وتسويق تقنية مستشعر التصوير الانعكاسي للتداخل أحادي الجسيم (SP-IRIS) ، عبر منصة ExoView ، إلى فتح توصيف EV الفردي باستخدام طريقة روتينية وبسيطة لجمع البيانات. جوهر هذه التقنية هو الشريحة ، وهي طبقة مزدوجة Si / SiO2 مقاس 1 سم × 1 سم ، والتي تتيح قياس التداخل للجسيمات النانوية البيولوجية المفردة. يتم حرث الشريحة بمصفوفة دقيقة من بقع الأجسام المضادة الوظيفية الفردية ، مما يسمح بالكشف المتعدد لما يصل إلى ستة أنواع مختلفة من الالتقاط. تشتمل الرقائق القياسية على علامات tetraspanin الشائعة (CD81 و CD63 و CD9) للالتقاط أثناء خطوة الحضانة ، ويمكن للمستخدم إضافة نقاط التقاط مخصصة إضافية لعزل مجموعات مميزة من المركبات الكهربائية المنفصلة عن tetraspanins. بعد خطوة الحضانة ، ربطت كل بقعة التقاط العديد من المركبات الكهربائية التي تعبر عن العلامة المقابلة. يمكن بعد ذلك غسل هذه المركبات الكهربائية الملتقطة وتجفيفها ومسحها ضوئيا في القارئ لتحديد حجم الحويصلات المرتبطة ببقعة الالتقاط بين 50-200 نانومتر لإعطاء توزيع حجم رقمي مرجح عبر SP-IRIS15. يوفر النظام أيضا ثلاث قنوات للكشف عن الفلورسنت لوضع العلامات المناعية على المركبات الكهربائية الملتقطة ، ويوفر كلا من متوسط شدة الفلورسنت ، والذي لا يقتصر على الحجم مثل قياسات SP-IRIS ، وجوانب التحديد لكل بقعة فلورية. يتيح ذلك للمستخدم تحديد مجموعات المركبات الكهربائية الفردية بناء على عرض أربعة مؤشرات حيوية مختلفة لكل EV (التقاط بالإضافة إلى ثلاثة ملصقات فلورية مناعية). يمكن للنظام أن يتجاوز قياس البروتينات السطحية باستخدام التألق المناعي ، حيث يسمح بروتوكول الشحن الاختياري للمستخدم بالتحقيق في البروتينات الداخلية للمركبات الكهربائية الملتقطة والحلقات اللمعية لعلامات السطح الممتدة للغشاء ، بالإضافة إلى السماح للمستخدم بالتحقق من سلامة غشاء EV. في هذه المقالة ، نقدم بروتوكولا مفصلا يحدد الخطوات اللازمة للحصول على بيانات متسقة فيما يتعلق بحجم المركبات الكهربائية وعددها ، مع ما يصل إلى أربعة مؤشرات حيوية مختلفة على مستوى EV واحد على مجموعات كبيرة من المركبات الكهربائية. يمكن استخدام هذه التقنية على كل من السوائل البيولوجية غير المعالجة والمركبات الكهربائية المعزولة باستخدام أي عدد من التقنيات ، مثل الطرد المركزي الفائق ، والترشيح الفائق ، وعوامل الترسيب ، والتقاط التقارب المناعي ، والموائع الدقيقة ، والكروماتوغرافيا لاستبعاد الحجم.
يستخدم البروتوكول الموضح أدناه حويصلات خارج الخلية (EV) مشتقة من وسائط زراعة الخلايا HEK 293 ومن مصل الفأر باستخدام طريقة عزل راسخة16. تم تطبيق البروتوكول على العديد من السوائل البيولوجية الأخرى ، ووسط زراعة الخلايا ، والحويصلات خارج الخلية المنقاة المعزولة عن السوائل البيولوجية. ينقسم هذا البروتوكول إلى إجراء مدته يومان مع سير العمل لتجربة نموذجية موضحة في الشكل 1.
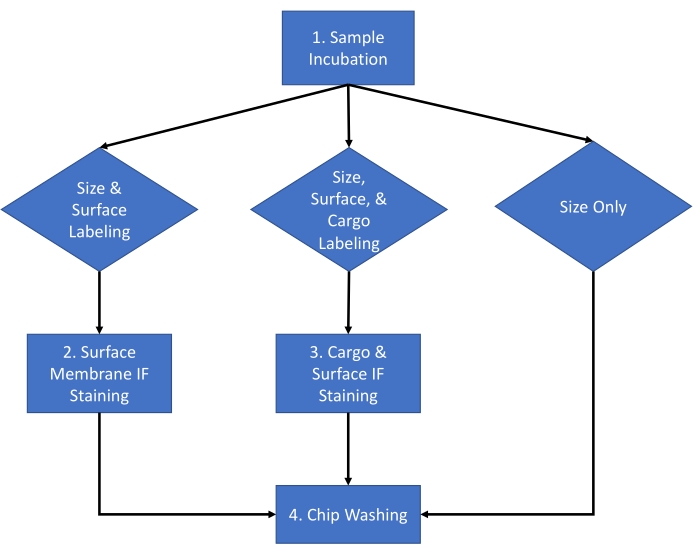
الشكل 1: سير عمل الفحص. سير عمل الفحص لاختيار نوع التحليل المراد إكماله للعينة بين الحجم والعدد ، وعدد الحجم وتلوين السطح ، وعدد الحجم وتلوين البضائع. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Access restricted. Please log in or start a trial to view this content.
Protocol
تم جمع عينات المصل من الفئران وفقا لبروتوكول لجان رعاية واستخدام المؤسسية المعتمدة (IACUC) في المركز الطبي بجامعة كانساس (KUMC). كما تمت الموافقة على استخدام هذه العينات البيولوجية في هذه التجارب من قبل KUMC.
1. تحضير العينة (اليوم 1)
- تحديد تركيز EV باستخدام تتبع الجسيمات النانوية أو تقنية مكافئة.
- تمييع العينة بمحلول الحضانة إلى تركيز 5 × 107-5 × 108 EVs / مل ؛ هناك حاجة إلى 50 ميكرولتر كحد أدنى.
ملاحظة: بالنسبة للعينات التي يكون فيها تركيز EV غير معروف ، يمكن استخدام البروتين الكلي عند 1 ميكروغرام / مل كمقياس بديل. إذا كان من المتوقع أن تكون العينة منخفضة التركيز ، فقم بإجراء تخفيف 1: 1 على الأقل في محلول الحضانة قبل التحميل. - ضع لوحا من 24 بئرا على سطح مستو وخالي من الاهتزازات والحركات الفظة.
ملاحظة: لتعزيز التباين ، يمكن وضع ورقة بيضاء أسفل اللوحة. - أضف الماء إلى المناطق المحيطة بالآبار (الشكل 2).
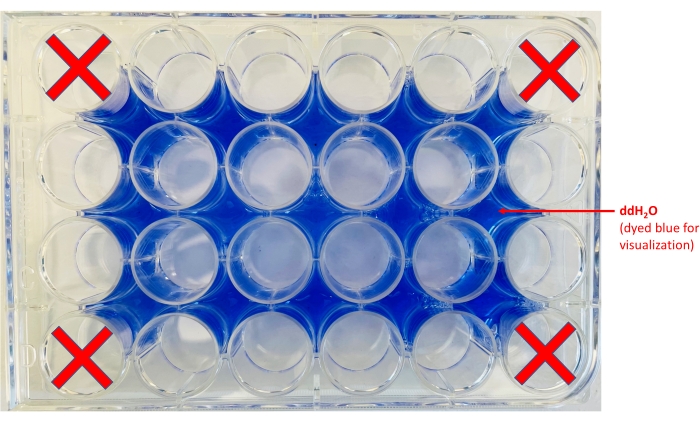
الشكل 2: تخطيط لوحة 24 بئر. يتم عرض مواقع مكان aliquot ddH2O (تمت إضافة الصبغة الزرقاء لأغراض التصور فقط) والآبار التي سيتم الاحتفاظ بها بالرقائق. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. تحضير الرقائق ومسحها مسبقا
- قم بإزالة اللوحة المختومة المكونة من 48 بئرا التي تحتوي على رقائق من الثلاجة 4-8 درجات مئوية واتركها تصل إلى درجة حرارة الغرفة (~ 15 دقيقة) قبل فتح الختم.
ملاحظة: هذا ضروري لتجنب التكثيف على الرقائق التي يمكن أن تلحق الضرر بالبقع. إذا لوحظ تكاثف على السطح عند إزالة الرقاقة من العبوة ، فانتظر لفترة أطول قبل إزالة الآخرين. - انتقل إلى الخطوة 8 لاسترداد تشاك للتحضير لتشغيل الفحص المسبق (الشكل 3).
ملاحظة: سيتم استخدام بيانات المسح المسبق لتحديد أي جسيمات يمكن اكتشافها على نقاط الالتقاط قبل الحضانة مع العينة بحيث يمكن إزالتها أثناء خطوة التحليل.

الشكل 3: صورة تشاك المستخدم لتحميل الشريحة في الماكينة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
- باستخدام الملقط ، قم بإزالة العدد المطلوب من الرقائق (شريحة واحدة لكل عينة) من اللوحة المكونة من 48 بئرا وقم بتحميل الرقائق مباشرة في ظرف الظرف لتشغيل المسح المسبق عندما يتم تحميل جميع الرقائق المزمع استخدامها في التجربة ومسحها ضوئيا مسبقا كما هو موضح في الخطوة 8، انتقل إلى الخطوة 2.4.
ملاحظة: عند التعامل مع الرقائق ، تأكد من عدم لمس المربعات الموجودة في المنتصف ، حيث أن بقع التقاط الأجسام المضادة موجودة في هذه المنطقة وستتلف إذا لمسها الملقط (الشكل 4).

الشكل 4: الرقاقة والتعامل المناسب مع الرقاقة. (أ) يشير الخط الأصفر المنقط إلى موقع الأجسام المضادة المرقطة ، أو الجانب الوظيفي للشريحة. يوجد معرف الشريحة أسفل السطر ("58"). يوضح الشكل أيضا التعامل السليم. (ب) يوضح التعامل غير المناسب مع الشريحة. (ج) الجانب غير الوظيفي للشريحة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
- ضع كل شريحة ممسوحة ضوئيا مسبقا بحيث يكون السطح الوظيفي متجها لأعلى في اللوحة المعدة مسبقا المكونة من 24 بئرا. يمكن التعرف بسهولة على السطح الوظيفي من خلال الترقيم المميز وشبكات المحاذاة والصناديق السوداء الثلاثة في المنتصف. الجانب غير الوظيفي هو سطح موحد فضي مسطح.
- استخدم ملاقط دقيقة للتأكد من أن كل شريحة متمركزة داخل البئر (الشكل 5).
ملاحظة: يعد توسيط الرقاقة داخل البئر أمرا بالغ الأهمية لأنه إذا لامست الشريحة جدار البئر ، فيمكن أن تتلاشى العينة بعد التحميل.

الشكل 5: عرض توضيحي لوضع الرقائق بشكل صحيح في البئر. (أ) يجب وضع الرقائق في منتصف البئر ، مع عدم وجود زوايا تلامس جوانب البئر. (ب) تصوير الوضع غير الصحيح للرقاقة ، حيث تلامس الزوايا جوانب البئر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. تحميل وحضانة الرقاقة والعينة
- الماصة 35 ميكرولتر من العينة المحضرة (من الخطوة 1) على الشريحة.
ملاحظة: احرص على عدم إضافة فقاعات أو لمس الشريحة بطرف الماصة، حيث يمكن أن تمنع التوزيع المتساوي للعينة على الرقاقة أو تتلف بقع الجسم المضاد على الشريحة. يجب أن تنتشر العينة على سطح الرقاقة بالكامل. في حالة امتصاص العينة من الرقاقة أثناء التحميل ، قم إما بإضافة عينة إضافية إلى البئر يصل حجمها إلى 250 ميكرولتر أو إضافة محلول حضانة يصل إلى 250 ميكرولتر ولاحظ عامل التخفيف المتغير لتلك العينة. - أغلق اللوحة باستخدام فيلم اللوحة المضمن في المجموعة لمنع تبخر العينة.
- احتضان العينة / الرقاقة طوال الليل (~ 16 ساعة) في اللوحة المختومة في درجة حرارة الغرفة في منطقة خالية من الاهتزازات أو الحركة.
ملاحظة: بعد الحضانة الليلية ، سيختار المستخدم خيار اليوم 2 المناسب لسؤال البحث الخاص به. إذا كان حجم المركبات الكهربائية وعددها فقط مطلوبا ، فتابع الخطوة 4 (اليوم 2). إذا كان تحليل علامات السطح المتعددة مطلوبا ، فانتقل إلى الخطوة 5 (اليوم 2).
4. تحديد حجم المركبات الكهربائية وعددها (اليوم 2)
- أضف 1 مل من المحلول A على جانب كل بئر يحتوي على شريحة ، مع الحرص على عدم إضافة المحلول مباشرة على الشريحة أو خدش الرقاقة بطرف الماصة.
- ضع اللوحة على شاكر مداري يدور عند ~ 500 دورة في الدقيقة لمدة 3 دقائق في درجة حرارة الغرفة.
ملاحظة: إذا كانت الرقائق تهتز على اللوحة ، فقم على الفور بتقليل السرعة بحيث يدور السائل ولكن لا يوجد خشخشة. - قم بإزالة 750 ميكرولتر من السائل. تجنب إمالة اللوحة أثناء إزالة السائل لمنع الجفاف العرضي للرقاقة.
- أضف 750 ميكرولتر من المحلول B باستخدام التقنية الموضحة في الخطوة 4.1 ورجها عند ~ 500 دورة في الدقيقة لمدة 3 دقائق في درجة حرارة الغرفة.
- كرر الخطوات 4.3-4.4 مرتين أخريين ليصبح المجموع ثلاث غسلات باستخدام المحلول B.
- في نهاية الغسيل الأخير ، قم بإزالة 750 ميكرولتر من المحلول ، مع ترك 250 ميكرولتر من المحلول B في البئر.
- أضف 750 ميكرولتر من الماء المقطر المزدوج (ddH2O) ورجه عند ~ 500 دورة في الدقيقة لمدة 3 دقائق في درجة حرارة الغرفة.
- املأ طبق بتري مقاس 10 سم ب 50 مل من ddH2O وانقل شريحة واحدة في كل مرة من البئر إلى الطبق باستخدام ملقط.
ملاحظة: احرص على نقل الشريحة أفقيا والتأكد من عدم جفافها. يمكن غسل ما يصل إلى ثماني رقائق قبل استبدال ddH2O. - في ddH2O ، أمسك الشريحة من الحواف باستخدام ملقط ، وقم بتحريكها في الطبق لمدة ثلاث دورات لإزالة الحطام.
- قم بإزالة الشريحة بزاوية 45 درجة خارج الماء وضع الشريحة على ورق ماص بحيث يكون معرف الرقاقة متجها لأعلى (الشكل 6).
ملاحظة: الرقائق جاهزة الآن للقراءة. انتقل إلى الخطوة 8 للمسح الضوئي على قارئ SP-IRIS.

الشكل 6: الطريقة الصحيحة لإزالة الرقاقة من ماء ddH2O بزاوية 45 درجة. (أ) عرض من الأعلى و (ب) عرض من الجانب يوضح الزاوية التي يتم بها إزالة الشريحة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
5. تحضير محلول الأجسام المضادة (اليوم 2)
- أضف 300 ميكرولتر من محلول الحجب لكل شريحة في أنبوب بحجم مناسب (0.5 إلى 3 مل).
- أضف 0.6 ميكرولتر من الجسم المضاد لكل 300 ميكرولتر من محلول الحبس. تخلط برفق عن طريق النقر على الأنبوب والدوران السريع.
ملاحظة: يتم تضمين الأجسام المضادة ل CD9 و CD81 و CD63 البشرية أو الفئران CD9 و CD81 و CD63 في المجموعات المناسبة. إذا كانت الأجسام المضادة المترافقة بالفلورسنت أخرى مطلوبة، فحدد تركيز التلوين الأمثل باستخدام معايرة نموذجية على نطاق 0.1 إلى 10 ميكروغرام/مل مع تحميل عينة ثابت كما تفعل مع قياس التدفق الخلوي.
6. تحديد حجم EV وعددها وتنميطها الظاهري مع تلطيخ الفلورسنت المناعي
- أضف 1 مل من المحلول A على جانب كل بئر يحتوي على شريحة ، مع الحرص على عدم إضافة المحلول مباشرة على الشريحة أو خدش الرقاقة بطرف الماصة.
- ضع اللوحة على شاكر مداري يدور عند ~ 500 دورة في الدقيقة لمدة 3 دقائق في درجة حرارة الغرفة.
ملاحظة: إذا كانت الرقائق تهتز على اللوحة ، فقم على الفور بتقليل السرعة بحيث يدور السائل ولكن لا يوجد خشخشة. - قم بإزالة 750 ميكرولتر من السائل. تجنب إمالة اللوحة أثناء إزالة السائل لمنع الجفاف العرضي للرقاقة.
- أضف 750 ميكرولتر من المحلول A باستخدام التقنية الموضحة في الخطوة 6.1 ورجه عند ~ 500 دورة في الدقيقة لمدة 3 دقائق في درجة حرارة الغرفة.
- كرر الخطوتين 6.3 و 6.4 مرتين ليصبح المجموع ثلاث غسلات باستخدام المحلول أ.
- في نهاية الغسيل الأخير ، قم بإزالة 750 ميكرولتر من المحلول ، مع ترك 250 ميكرولتر من المحلول A في البئر.
ملاحظة: إذا رغب المستخدم في تلطيخ البضائع ، فانتقل إلى الخطوة 7 في هذه المرحلة. إذا لم يكن الأمر كذلك، فانتقل إلى الخطوة 6.7 - أضف 250 ميكرولتر من محلول الأجسام المضادة (الخطوة 5) إلى كل شريحة في البئر. قم بتغطية اللوحة بورق الألمنيوم للحماية من الضوء ورجه لمدة 1 ساعة على شاكر المداري في درجة حرارة الغرفة.
- أضف 500 ميكرولتر من المحلول أ ، وبالتالي فإن الحجم الكلي لكل بئر هو ~ 1,000 ميكرولتر.
- قم بإزالة 750 ميكرولتر على الفور وأضف 750 ميكرولتر من المحلول A ورجه عند ~ 500 دورة في الدقيقة على شاكر المداري لمدة 3 دقائق في درجة حرارة الغرفة.
- قم بإزالة 750 ميكرولتر من المحلول وأضف 750 ميكرولتر من المحلول B ورجه عند ~ 500 دورة في الدقيقة لمدة 3 دقائق في درجة حرارة الغرفة.
- كرر الخطوة 6.10 مرتين أخريين ليصبح المجموع ثلاث غسلات.
- أضف 750 ميكرولتر من الماء المقطر المزدوج (ddH2O) ورجه عند ~ 500 دورة في الدقيقة لمدة 3 دقائق في درجة حرارة الغرفة.
- املأ طبق بتري مقاس 10 سم ب 50 مل من ddH2O وانقل شريحة واحدة من البئر إلى الطبق باستخدام ملقط.
ملاحظة: احرص على نقل الشريحة أفقيا والتأكد من عدم جفافها. يمكن غسل ما يصل إلى ثماني رقائق قبل استبدالها ب ddH2O الطازج. - في ddH2O ، أمسك الشريحة من الحواف باستخدام ملفق ، وقم بالتدوير في الطبق لمدة ثلاث دورات لإزالة الحطام.
- قم بإزالة الشريحة بزاوية 45 درجة خارج الماء وضع الشريحة على ورق ماص بحيث يكون معرف الشريحة متجها لأعلى (الشكل 6).
ملاحظة: الرقائق جاهزة الآن للقراءة. انتقل إلى الخطوة 8 (جمع البيانات) للحصول على إرشادات حول كيفية إعداد الرقائق للمسح الضوئي على القارئ.
7. تلطيخ البضائع الاختياري
ملاحظة: يسمح هذا البروتوكول بوضع العلامات المتزامنة للعلامات الداخلية والسطحية.
- مع بقاء 250 ميكرولتر من المحلول A في كل بئر ، أضف 250 ميكرولتر من المحلول C في كل بئر.
- ضعه على الفور على شاكر المداري واضبطه على ~ 200 دورة في الدقيقة لمدة 10 دقائق بالضبط.
ملاحظة: في هذه الخطوة والخطوة 7.8 أدناه ، يعد كل من التوقيت وسرعة الاهتزاز البطيئة أمرا بالغ الأهمية. تأكد من أن السرعة تعطي دواما بطيئا فقط في الآبار واستخدم مؤقتا. - بعد 10 دقائق من الحضانة بالمحلول C ، أضف 500 ميكرولتر من المحلول A إلى كل بئر.
- قم بإزالة 750 ميكرولتر على الفور وأضف 750 ميكرولتر من المحلول A ورجها عند ~ 500 دورة في الدقيقة على شاكر المداري لمدة 3 دقائق في درجة حرارة الغرفة.
- كرر الخطوة 7.4 مرتين أخريين ليصبح المجموع ثلاث غسلات.
- في نهاية الغسيل الأخير ، قم بإزالة 750 ميكرولتر من المحلول ، مع ترك ~ 250 ميكرولتر من المحلول في البئر مع الشريحة.
- أضف 250 ميكرولتر من المحلول D إلى كل بئر.
- ضعه على الفور على شاكر المداري المضبوطة على ~ 200 دورة في الدقيقة لمدة 10 دقائق بالضبط.
- بعد 10 دقائق من الحضانة بالمحلول C ، أضف 500 ميكرولتر من المحلول A إلى كل بئر.
- قم بإزالة 750 ميكرولتر على الفور وأضف 750 ميكرولتر من المحلول A ورجه عند ~ 500 دورة في الدقيقة على شاكر المداري لمدة 3 دقائق في درجة حرارة الغرفة.
- كرر الخطوة 7.10 مرتين ليصبح المجموع ثلاث غسلات.
- قم بإزالة 750 ميكرولتر من المحلول بعد الغسيل الأخير والعودة إلى الخطوة 6.7 أعلاه للتلطيخ واستكمال بروتوكول الفحص.
8. جمع البيانات
ملاحظة: يتم إجراء جمع البيانات من الرقائق باستخدام ExoView R100 تلقائيا ولا يتطلب أي مدخلات من المستخدم. يمكن العثور على التعليمات التفصيلية في دليل المستخدم والفيديو المقابل لتحميل حامل الرقاقة ، أو "تشاك" ، والحصول على البيانات17.
- قم بتشغيل منصة توصيف EV باستخدام مفتاحي الطاقة الموجودين في الجزء الخلفي من الجهاز ، ثم ابدأ تشغيل برنامج الماسح الضوئي بالنقر المزدوج على أيقونة سطح المكتب.
ملاحظة: عند بدء تشغيل برنامج الماسح الضوئي، سيتم ضبط القارئ تلقائيا على الشاشة الرئيسية، ثم يطالب المستخدم ب "فتح الباب لتحميل الرقائق". - افتح الباب الموجود في مقدمة القارئ عن طريق رفع المقبض الفضي. سيؤدي هذا إلى إخراج المرحلة ، مما يسمح للمستخدم بالوصول إلى ظرف وإعداد فحص جديد في البرنامج.
- حدد الموقع الذي يرغب المستخدم في حفظ البيانات فيه بالنقر فوق مجلد الحفظ وتحديد الموقع المطلوب لحفظ البيانات.
ملاحظة: غالبا ما يكون من المفيد تسمية موقع الحفظ بشيء ثاقب مثل اسم التجربة، ثم إنشاء مجلدين فرعيين، أحدهما للفحص المسبق والآخر للفحص اللاحق. هذا يجعل العثور على البيانات ومطابقتها أثناء التحليل أسهل. - لفحص الرقائق ضوئيا ، حدد موقع ملفات الشرائح على كمبيوتر التحكم.
ملاحظة: ملفات الشرائح عبارة عن خرائط لتخطيط بقعة الجسم المضاد على الشريحة المستخدمة وتسمح للماسح الضوئي بمعرفة مكان المسح الضوئي على كل شريحة. في كل مجموعة ، يوجد مفتاح USB مع ملفات الشرائح للرقائق بالداخل. يجب حفظها في موقع على كمبيوتر التحكم عند استلام المجموعة حيث يمكن للمستخدمين العثور عليها بشكل موثوق. - قم بتحميل الرقائق على الظرف مع الرقم الموجود على الرقائق المواجه للمقبض الموجود على الظرف ، ثم من القائمة المنسدلة Chip على الكمبيوتر ، حدد كل شريحة من قائمة ملفات الشرائح وضعها في موقع المطابقة المناسب في ظرف الظاهري في برنامج الماسح الضوئي. بمجرد الانتهاء ، ستظهر مطالبة على الشاشة تطلب من المستخدم وضع الظرف على المسرح.
- ضع ظرف الظرف المحمل على المسرح. ستقوم المحاذاة المغناطيسية على الظرف بنقله تلقائيا إلى الموقع الصحيح على المسرح ، ثم النقر فوق "موافق " بجوار وضع الظرف على المسرح. سيبدأ الماسح الضوئي بعد ذلك في روتين جمع البيانات الآلي.
ملاحظة: تكون البيانات جاهزة للتحليل بمجرد أن يبلغ البرنامج عن حالة الفحص لكل شريحة على أنها ناجحة.
9. تحليل البيانات
- انقر نقرا مزدوجا فوق ExoView Analyzer على سطح مكتب جهاز التحكم. بعد تمهيد البرنامج ، انقر فوق الزر Prescan Data وحدد موقع المجلد لمجموعة بيانات المسح المسبق في القسم 8.3.
- انقر فوق الزر Postscan Data وحدد موقع المجلد لمجموعة بيانات postscan في القسم 8.3.
ملاحظة: إذا تم اكتشاف البيانات بشكل صحيح في كلا المجلدين ، فبالنسبة لبعض الشرائح على الأقل ، سيعرض البرنامج عددا "X" من الرقائق المكتشفة بجوار زر موقع ملف الشريطة. عند حفظها بشكل صحيح ، يجب أن تتطابق الرقائق المكتشفة مع عدد الرقائق التي تم مسحها ضوئيا. - انقر فوق التالي في أسفل منطقة تحميل البيانات.
- في القائمة المنسدلة للجدول التعريفي ، سيكون لكل شريحة خلية. أدخل أسماء العينات وعوامل التخفيف والعلامات التي يتم تلطيخها في كل قناة كشف عن طريق النقر في المربع المقابل وكتابة المعلومات ؛ عند الانتهاء ، انقر فوق التالي مرة أخرى.
ملاحظة: سيتم حفظ بيانات التعريف هذه مع البيانات. - مراقبة الجودة مسبقا (QC) بالنقر فوق علامة التبويب تعطيل أسفل زر مراقبة الجودة في الجزء العلوي الأيسر.
ملاحظة: تسمح هذه الميزة بإيقاف تشغيل مجسات ورقائق معينة للتحليل. سيوفر البرنامج تحذيرين مختلفين فيما يتعلق بالبيانات ، أحدهما للأعداد العالية التي يمكن أن تشير إلى أن التقاط معين مشبع ، ومعامل تباين مرتفع (CV) يحدد متى تختلف إحدى النسخ المتماثلة لنوع الالتقاط عن الآخرين.- انقر فوق بقعة تحذير للحصول على سيرة ذاتية عالية ، وافحص البقع التي يتم استدعاؤها بواسطة البرنامج ، ومعرفة ما إذا كان هناك ضرر مادي واضح ؛ عند تحديد الضرر ، انقر فوق الرقم الفوري لإيقاف تشغيل هذه البقعة في التحليل.
- كرر حتى يتم تقييم جميع التحذيرات ، ثم انقر فوق التالي.
- قم بإجراء تحليل القطع من خلال النقر على علامة التبويب "قطع" الموجودة بجوار علامة التبويب "تعطيل " أسفل زر مراقبة الجودة في الجزء العلوي الأيسر.
ملاحظة: سيقدم هذا استجابة الفلورسنت الموضعية للتحكم في مخطط ، ويوفر للمستخدم إعدادين ، الحد الأدنى والحد الأقصى لكل قناة ألوان (أحمر / أخضر / أزرق). يعد تحديد قيمة القطع لكل قناة للكشف عن الفلورسنت هو تعديل البيانات الوحيد الذي يجب إجراؤه وهو بسيط نسبيا. الأهم من ذلك ، يجب أن يكون القطع النهائي الذي يتم اختياره متسقا عبر التجربة ، وكما لوحظ يجب أن يندرج ضمن القواعد الأساسية ل 300-400 a.u. باللونين الأحمر والأخضر ، و 400-700 a.u. للأزرق في التجارب النموذجية. يحتوي البرنامج على أدلة مرمزة بالألوان للمستخدم لهذه النطاقات أيضا.- انقر فوق علامة التبويب اللون الأخضر لتحميل البيانات لتلك القناة وعرض القطع الحالية. عند فحص بقعة التحكم السلبية للنمط المتماثل ، قد يرى المرء أحداث الكشف ذات الشدة المضان المنخفضة جدا. في هذه الحالة ، يجب أن يتوقع المستخدمون عادة تعيين اللون الأخضر بين 300-400 وحدة أسترالية.
- قم بزيادة الحد الأدنى لكل قناة من قنوات الكشف حتى لا تحتوي "النسبة المئوية المتوسطة" (متوسط النسبة المئوية للجسيمات المكتشفة في بقعة التحكم المضمنة فوق القطع) تحت عرض البيانات على تحذيرات كما هو موضح بالتمييز الأحمر أو الأصفر في تلك الخلية.
ملاحظة: لا يلزم تعديل القيمة القصوى بشكل عام من القيمة الافتراضية ولكن يمكن خفضها لتصفية الجسيمات الساطعة أو الحد من اكتشاف الفلورسنت إلى نطاق أضيق. - انقر فوق الزر التالي .
- قم بزيادة الحد الأدنى لكل قناة من قنوات الكشف حتى لا تحتوي "النسبة المئوية المتوسطة" (متوسط النسبة المئوية للجسيمات المكتشفة في بقعة التحكم المضمنة فوق القطع) تحت عرض البيانات على تحذيرات كما هو موضح بالتمييز الأحمر أو الأصفر في تلك الخلية.
- انقر فوق علامة التبويب اللون الأحمر لتحميل البيانات لتلك القناة وعرض القطع الحالية. مرة أخرى ، عند فحص بقعة التحكم السلبية للنمط المتماثل ، قد يرى المرء أحداث الكشف ذات شدة مضان منخفضة جدا. في هذه الحالة ، يجب أن يتوقع المستخدمون عادة تعيين اللون الأحمر بين 300-400 A.U. اتبع نفس الإجراءات المشار إليها في الخطوات 9.6.1.1-9.6.1.3.
- انقر فوق علامة التبويب اللون الأزرق لتحميل البيانات لتلك القناة وعرض القطع الحالية. ومرة أخرى، عند فحص بقعة التحكم السلبية للنمط المتماثل، اتبع نفس الإجراءات المشار إليها في الخطوات 9-6-1-1-9-6-1-3.
ملاحظة: القناة الزرقاء فريدة من نوعها من حيث أن الجسم المضاد في البقعة هو فلوري تلقائي عند مستويات كافية لتتطلب قطعا أعلى قليلا من 400-700 سنويا حتى بالنسبة للرقائق الفارغة.
- انقر فوق علامة التبويب اللون الأخضر لتحميل البيانات لتلك القناة وعرض القطع الحالية. عند فحص بقعة التحكم السلبية للنمط المتماثل ، قد يرى المرء أحداث الكشف ذات الشدة المضان المنخفضة جدا. في هذه الحالة ، يجب أن يتوقع المستخدمون عادة تعيين اللون الأخضر بين 300-400 وحدة أسترالية.
- بعد الانتهاء من تحليل القطع ، انقر فوق التالي وستظهر مخطط خريطة التمثيل اللوني ، والتي ستعطي نظرة عامة على ارتباط الجسيمات عبر التجربة. هناك العديد من أدوات التصور التي يمكن للمستخدم استخدامها لرسم البيانات. يمكن إضافة هذه المخططات والبيانات الأولية المرتبطة بها إلى تقرير بالنقر فوق الزر إضافة تقرير مؤامرة .
ملاحظة: خريطة التمثيل اللوني هي عرض البيانات الافتراضي الذي يعرض جميع العينات وعرض الالتقاط بالكامل لاكتشاف معين. العرض الافتراضي هو الإجمالي الذي يحدد المركبات الكهربائية الفريدة المرتبطة بكل بقعة التقاط. - انقر فوق الزر تصدير التقرير وحدد موقع حفظ للتقرير.
ملاحظة: سيتم فتح التقرير في متصفح. ابحث عن ملف جدول بيانات قائمة الجسيمات التي تمت تصفيتها المرفق بالتقرير؛ هذه هي المعلومات التي يجب تقديمها إلى EVTRACK. - استمر في إضافة التقارير باستخدام التحديدات المختلفة لأنواع العينات والالتقاط في القوائم المنسدلة أعلى الشاشة. يتم التحكم في البيانات المعروضة من خلال تحديد أزرار اكتشاف القنوات في أعلى اليسار. قم بتعيين نمط ظاهري / نموذج محدد / قناة التقاط بالنقر فوق كل زر لون لإيقاف تشغيل قناة الكشف هذه (باللون الرمادي) أو التشغيل (ملون).
- انقر فوق الزر "إضافة مخطط إلى تقرير " لتجميع المخططات المطلوبة في تقرير.
- انقر فوق تصدير التقرير وحدد موقع الحفظ للتقرير النهائي.
Access restricted. Please log in or start a trial to view this content.
النتائج
يوضح الشكل 7 (اللوحة اليسرى) صورة مركبة ثلاثية الألوان للمركبات الكهربائية مشتقة من الوسائط المكيفة HEK293 المرتبطة ببقعة CD63 على الشريحة وملطخة ب CD81 و CD63 و CD9 في القنوات التالية باللون الأخضر والأحمر والأزرق على التوالي. الشكل 7 (اللوحة العلو?...
Access restricted. Please log in or start a trial to view this content.
Discussion
تعتمد طرق توصيف المركبات الكهربائية الحالية إلى حد كبير على المركبات الكهربائية المنقاة ، والتي تقتصر عليها القيود التجريبية الحالية لطرق تنقية المركباتالكهربائية 9،10،11،12،13. يعد...
Access restricted. Please log in or start a trial to view this content.
Disclosures
كلايتون ديغان وجورج دعبول موظفان ومساهمان في شركة NanoView Biosciences Inc.
Acknowledgements
تمت رعاية هذا العمل جزئيا من قبل برنامج جائزة معدات البحث وشراء الموارد بكلية الطب بجامعة كانساس. تم دعم PCG و LKC و FD و AR بأموال من NIA R21 AG066488-01.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 10-cm sterile Petri dish | Fisher | FB0875712 | |
| 15mL sterile tube | n/a | various | |
| 24-well cell culture plate, flat bottom | Fisher | 08-772-1 | |
| Blocking Solution | NanoView Biosciences | EV-TETRA-C | Can be found in ExoView Human Tetraspanin Kit. |
| Chipfiles | NanoView Biosciences | EV-TETRA-C | Can be found in ExoView Human Tetraspanin Kit. |
| Chips | NanoView Biosciences | EV-TETRA-C | Can be found in ExoView Human Tetraspanin Kit. |
| Chuck | NanoView Biosciences | EV-TETRA-C | Can be found in ExoView Human Tetraspanin Kit. |
| Corning Easy Grip Disposable Polystyrene Sterile Bottles 250 ml | Fisher | 09-761-4 | |
| Corning Easy Grip Disposable Polystyrene Sterile Bottles 500 ml | Fisher | 09-761-10 | |
| Deionized (DI) water | Fisher | LC267404 | |
| EMS style tweezers with Carbon Fiber tips | Fisher | 50-193-0842 | |
| ExoView Human Tetraspanin Kit | NanoView Biosciences | EV-TETRA-C | Capture for hCD81, hCD9, hCD63, IgG Control + stains for hEV-A (hEV-CD63-647, hEV-CD81-555, hEV-CD9-488) 16 Chips per kit |
| ExoView R100 Imager | NanoView Biosciences | EV-R100 | Interferometric microscope including high specification camera including 3 color fluorescence and label free sizing and counting extracellular vesicles |
| Fluorescently labled huma CD9 IgG antibody | NanoView Biosciences | EV-TETRA-C | Can be found in ExoView Human Tetraspanin Kit. |
| Fluorescently labled human CD63 IgG antibody | NanoView Biosciences | EV-TETRA-C | Can be found in ExoView Human Tetraspanin Kit. |
| Fluorescently labled human CD81 IgG antibody | NanoView Biosciences | EV-TETRA-C | Can be found in ExoView Human Tetraspanin Kit. |
| Incubation Solution | NanoView Biosciences | EV-TETRA-C | Can be found in ExoView Human Tetraspanin Kit. |
| Orbital shaker or microplate shaker with digital settings capable of shaking at 500 rpm | n/a | various | |
| Plate Seal | NanoView Biosciences | EV-TETRA-C | Can be found in ExoView Human Tetraspanin Kit. |
| Solution A | NanoView Biosciences | EV-TETRA-C | Can be found in ExoView Human Tetraspanin Kit. |
| Solution B | NanoView Biosciences | EV-TETRA-C | Can be found in ExoView Human Tetraspanin Kit. |
| Solution C | NanoView Biosciences | EV-TETRA-C | Can be found in ExoView Human Tetraspanin Kit. |
| Solution D | NanoView Biosciences | EV-TETRA-C | Can be found in ExoView Human Tetraspanin Kit. |
| Square/flat tip tweezer | Fisher | 50-239-62 | |
| Straight strong point Boley style tweezers | Fisher | 16-100-124 | |
| Thermo Scientific Adhesive PCR Plate Seals | Fisher | AB-0558 |
References
- Maas, S. L. N., Breakefield, X. O., Weaver, A. M. Extracellular vesicles: Unique intercellular delivery vehicles. Trends in Cell Biology. 27 (3), 172-188 (2017).
- Shah, R., Patel, T., Freedman, J. E. Circulating extracellular vesicles in human disease. The New England Journal of Medicine. 379 (10), 958-966 (2018).
- Deng, F., Miller, J. A review on protein markers of exosome from different bio-resources and the antibodies used for characterization. Journal of Histotechnology. 42 (4), 226-239 (2019).
- Cohen, O., et al. ’Golden’ exosomes as delivery vehicles to target tumors and overcome intratumoral barriers: in vivo tracking in a model for head and neck cancer. Biomaterials Science. 9 (6), 2103-2114 (2021).
- Han, Y., et al. Overview and update on methods for cargo loading into extracellular vesicles. Processes (Basel). 9 (2), 356(2021).
- Lee, M., Im, W., Kim, M. Exosomes as a potential messenger unit during heterochronic parabiosis for amelioration of Huntington's disease. Neurobiology of Disease. 155, 105374(2021).
- Sun, B., et al. Characterization and biomarker analyses of post-COVID-19 complications and neurological manifestations. Cells. 10 (2), 386(2021).
- Jiang, L., Gu, Y., Du, Y., Liu, J. Exosomes: Diagnostic biomarkers and therapeutic delivery vehicles for cancer. Molecular Pharmaceutics. 16 (8), 3333-3349 (2019).
- Bachurski, D., et al. Extracellular vesicle measurements with nanoparticle tracking analysis - An accuracy and repeatability comparison between NanoSight NS300 and ZetaView. Journal of Extracellular Vesicles. 8 (1), 1596016(2019).
- Carmicheal, J., et al. Label-free characterization of exosome via surface enhanced Raman spectroscopy for the early detection of pancreatic cancer. Nanomedicine. 16, 88-96 (2019).
- Greening, D. W., Xu, R., Ji, H., Tauro, B. J., Simpson, R. J. A protocol for exosome isolation and characterization: evaluation of ultracentrifugation, density-gradient separation, and immunoaffinity capture methods. Methods in Molecular Biology. 1295, 179-209 (2015).
- Wu, Y., Deng, W., Klinke, D. J. Exosomes: improved methods to characterize their morphology, RNA content, and surface protein biomarkers. The Analyst. 140 (19), 6631-6642 (2015).
- van de Vlekkert, D., Qiu, X., Annunziata, I., d'Azzo, A. Isolation and characterization of exosomes from skeletal muscle fibroblasts. Journal of Visualized Experiments: JoVE. (159), (2020).
- Ayala-Mar, S., Donoso-Quezada, J., Gallo-Villanueva, R. C., Perez-Gonzalez, V. H., Gonzalez-Valdez, J. Recent advances and challenges in the recovery and purification of cellular exosomes. Electrophoresis. 40 (23-24), 3036-3049 (2019).
- Daaboul, G. G., et al. Digital detection of exosomes by interferometric imaging. Scientific Reports. 6, 37246(2016).
- Pohler, K. G., et al. Circulating microRNA as candidates for early embryonic viability in cattle. NMolecular Reproduction and Development. 84 (8), 731-743 (2017).
- NanoView Biosciences. ExoView R100 User Guide. v240.4. NanoView Biosciences. , 202(2021).
- Daaboul, G. G., et al. Enhanced light microscopy visualization of virus particles from Zika virus to filamentous ebolaviruses. PLoS One. 12, 0179728(2017).
- ET Consortium. EV-TRACK: transparent reporting and centralizing knowledge in extracellular vesicle research. Nature Methods. 14, 228-232 (2017).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved