Method Article
زرع داخل المخ وتتبع التلألؤ الحيوي في الجسم الحي للخلايا السلفية العصبية البشرية في دماغ الفأر
* These authors contributed equally
In This Article
Summary
نحن نصف عملية زرع البطانة اللبنية للخلايا السلفية العصبية البشرية التي تم نقلها باستخدام ناقل مراسل مزدوج يعبر عن بروتين الفلورسنت الأخضر luciferase (GFP) في دماغ الفأر. بعد الزرع ، يتم قياس إشارة luciferase بشكل متكرر باستخدام التلألؤ الحيوي في الجسم الحي والخلايا المطعمة المعبرة عن GFP المحددة في أقسام الدماغ باستخدام المجهر الفلوري.
Abstract
لطالما كان العلاج الخلوي نموذجا علاجيا ناشئا في البيولوجيا العصبية التجريبية. ومع ذلك ، غالبا ما تعتمد دراسات زرع الخلايا على قياسات نقطة النهاية ، وبالتالي يمكنها فقط تقييم التغيرات الطولية لهجرة الخلايا وبقائها على قيد الحياة إلى حد محدود. توفر هذه الورقة بروتوكولا موثوقا به وطفيف التوغل لزرع الخلايا السلفية العصبية (NPCs) وتتبعها طوليا في دماغ الفأر البالغ. قبل الزرع ، يتم نقل الخلايا باستخدام ناقل فيروسي عدسي يتكون من مراسل حيوي (اليراع - لوسيفيراز) والفلورسنت (البروتين الفلوري الأخضر [GFP]). يتم زرع NPCs في نصف الكرة القشرية اليمنى باستخدام الحقن المجسمة في القشرة الحسية الحركية. بعد الزرع ، تم اكتشاف الخلايا المطعمة من خلال الجمجمة السليمة لمدة تصل إلى خمسة أسابيع (في الأيام 0 و 3 و 14 و 21 و 35) مع حد دقة 6000 خلية تستخدم تصوير التلألؤ الحيوي في الجسم الحي . في وقت لاحق ، يتم تحديد الخلايا المزروعة في أقسام الدماغ النسيجية وتتميز كذلك بالتألق المناعي. وبالتالي ، يوفر هذا البروتوكول أداة قيمة لزرع الخلايا في دماغ الفأر وتتبعها وتحديدها كميا وتوصيفها.
Introduction
يتمتع دماغ الثدييات بقدرات تجديدية محدودة بعد الإصابة أو المرض ، مما يتطلب استراتيجيات مبتكرة لتعزيز الأنسجة والإصلاح الوظيفي. تركز الاستراتيجيات قبل السريرية على جوانب مختلفة من تجديد الدماغ ، بما في ذلك الحماية العصبية ، أو تكوين الخلايا العصبية ، أو تكوين الأوعية الدموية1،2 ، أو إصلاح حاجز الدم الدماغي3،4 ، أو العلاج الخلوي5،6. يتميز العلاج الخلوي بقدرته على تعزيز العديد من هذه العمليات المؤيدة للإصلاح في وقت واحد. في تجارب زرع الخلايا ، حدث إصلاح الأنسجة من خلال (1) استبدال الخلايا المباشر و (2) إنتاج السيتوكينات مما يؤدي إلى تكوين الأوعية الدموية وتكوين الخلايا العصبية7. وقد سهلت التطورات الأخيرة في تكنولوجيا الخلايا الجذعية تطوير مصادر الخلايا العصبية القابلة للتطوير والمميزة بشكل جيد والتي هي الآن في طور الإعداد للتجارب السريرية (تمت مراجعتها في 7،8،9). على الرغم من أن العلاجات الخلوية قد وصلت إلى المرحلة السريرية لعدد قليل من الأمراض العصبية (على سبيل المثال ، مرض باركنسون10 ، والسكتة الدماغية11 ، وإصابة الحبل الشوكي12) ، إلا أن فعاليتها كانت متغيرة ، وهناك حاجة إلى مزيد من الأبحاث قبل السريرية لفهم آليات التفاعلات بين الطعم والمضيف.
أحد القيود الرئيسية للعديد من الدراسات قبل السريرية هو التتبع المستمر للخلايا المزروعة داخل المضيف. في كثير من الأحيان يتم إجراء قياسات نقطة النهاية فقط ، مع حذف عمليات الهجرة والبقاء الديناميكية في المضيف 6,13. تؤدي هذه القيود إلى سوء توصيف الخلايا المطعمة وتتطلب أعدادا كبيرة من الحيوانات لفهم التغيرات الطولية. للتغلب على هذه القيود ، في هذه الدراسة ، نقوم بتحويل الخلايا السلفية العصبية المستحثة متعددة القدرات (iPSC) المستمدة من الخلايا العصبية مع ناقل lentiviral مزدوج المراسل متاح تجاريا يتكون من luciferase اليراع الأحمر والبروتين الفلوري الأخضر المحسن (rFluc-eGFP). يتم زرع هذه الخلايا عن طريق الحقن المجسمة intraparenchymal في دماغ الفأر ويتم تتبعها طوليا باستخدام التصوير الحيوي في الجسم الحي على مدى 5 أسابيع. بعد جمع أنسجة المخ ، يتم تحديد الخلايا المطعمة التي تعبر عن GFP وتوصيفها بشكل أكبر في أقسام الدماغ النسيجية. يمكن تكييف هذه الطريقة بسلاسة مع مصادر الخلايا البديلة القابلة للتحويل وطرق الزرع للتطبيقات في الجسم الحي في دماغ القوارض. بشكل عام ، يعد الإجراء ذا قيمة للحصول على معلومات طولية عن بقاء الكسب غير المشروع والهجرة في دماغ الفأر ويسهل التوصيف النسيجي اللاحق.
Protocol
ملاحظة: أجريت جميع التجارب التي شملت الفئران وفقا للمبادئ التوجيهية الحكومية والمؤسسية وإرشادات REACH وتمت الموافقة عليها من قبل المكتب البيطري الكانتوني في زيورخ. تم استخدام الفئران البالغة من الذكور والإناث غير البدينين المصابين بسكري SCID gamma (NSG) (10-14 أسبوعا ، 25-35 جم). تم وضع الفئران في أقفاص عادية من النوع الثاني / الثالث في مجموعات من حيوانين على الأقل لكل قفص في غرفة يتم التحكم فيها بالرطوبة ودرجة الحرارة مع دورة ضوء / ظلام ثابتة 12/12 ساعة. .).
1. زراعة الخلايا والنقل الفيروسي
- تمييز الخلايا السلفية العصبية (NPCs) عن iPSCs باستخدام مثبطات الجزيئات الصغيرة كما هو موضح سابقا14.
- NPCs15 من الممر 2 فصاعدا في وسط صيانة الخلايا الجذعية العصبية (NSMM; الجدول 1) تستكمل بجزيئات صغيرة (الجدول 1) في ألواح من 6 آبار (2 مل من الوسط لكل بئر) مغلفة ببولي أورنيثين / لامينين 521 (pLO / L521). تغيير الوسط يوميا.
ملاحظة: لتمرير NPCs ، أضف 1 مل من كاشف تفكك الخلايا لكل بئر (انظر جدول المواد) واحتضن عند 37 درجة مئوية لمدة 1 دقيقة حتى تنفصل معظم الخلايا.- بالنسبة للطلاء ، احتضن 150 ميكرولتر من pLO في 1 مل من محلول ملحي مخزن بالفوسفات (PBS) بمقدار 0.1 مليون لكل بئر لمدة 2 ساعة في درجة حرارة الغرفة (RT). بعد ثلاث غسلات باستخدام PBS ، احتضن 10 ميكروغرام من L521 في 1 مل من PBS لكل بئر لمدة 2 ساعة في RT.
- بالنسبة للنقل الفيروسي ، قم بصفيحة 50000 خلية لكل بئر في صفيحة من 24 بئرا مغلفة ب pLO / L521 وأضف ناقلات فيروسية معبأة مسبقا (pLL-EF1a-rFLuc-T2A-GFP-mPGK-Puro ، LL410PA-1) إلى كل بئر.
ملاحظة: إجمالي الوحدات المعدية (IFU) المقدمة هي >2 × 106 IFU وهي كافية لإصابة 100000 خلية بتعدد العدوى (MOI) من 20. تم إجراء عد الخلايا باستخدام عداد خلايا آلي. تعتمد كفاءة النقل بشدة على خط الخلية المستخدم. يتطلب العمل مع فيروس lentivirus الامتثال للمبادئ التوجيهية المحلية لمنتجات المستوى 2 للسلامة الأحيائية (BSL-2). - احتضن الخلايا عند 37 درجة مئوية لمدة 72 ساعة ، مع الاستمرار في التغييرات المتوسطة اليومية.
- تأكد من نجاح النقل عن طريق فحص الخلايا بحثا عن تعبير GFP في المجهر الفلوري. اضبط تكبير المجهر على 10x أو 20x واستخدم الإثارة المناسبة (460-480 نانومتر) ونطاق الانبعاثات (490-520 نانومتر) للكشف عن الخلايا المعبرة عن GFP المحولة.
- تحديد نسبة GFP المحولة إلى الخلايا الكلية لتقدير فعالية النقل العامة.
ملاحظة: تم تحقيق معدلات نقل 65-95٪ باستخدام هذا البروتوكول. يوصى باستخدام فعالية نقل >50٪ كمعيار ذهاب / عدم الذهاب قبل الزرع. إذا تعذر تحقيق فعالية نقل 50٪ ، فقم بإجراء اختيار البيروميسين أو فرز الخلايا باستخدام قياس التدفق الخلوي لزيادة إنتاجية الخلايا المحولة. - اختياري: تجميد الخلايا
- قم بتدوير الخلايا لأسفل (300 × جم ، 5 دقائق) وتخلص من supernatant. أعد تعليق الكريات في 1 مل من وسط التجميد (انظر جدول المواد) ونقل التعليق إلى قوارير للحصول على 106 خلايا / قارورة. انقل الخلايا إلى صناديق التجميد لمدة 24 ساعة عند -80 درجة مئوية ثم إلى -150 درجة مئوية للتخزين على المدى الطويل.
2. إعداد الخلايا للزرع
- جمع قارورة من الخلايا من تخزين -150 درجة مئوية ونقلها إلى المختبر. عد الخلايا باستخدام عداد خلايا تلقائي.
ملاحظة: تحتوي القارورة على 1.5-2 × 106 خلايا. - انقل القارورة بسرعة إلى حمام مائي 37 درجة مئوية حتى لا تبقى بلورات ثلج (2-3 دقائق).
ملاحظة: من المهم الذوبان بسرعة لتقليل أي ضرر يلحق بأغشية الخلايا. لا تغمر القارورة تماما في الحمام المائي لأنها يمكن أن تزيد من خطر التلوث. - انقل القارورة إلى خزانة السلامة الأحيائية وقم بماصة المحتوى بأكمله (~ 1 مل) في أنبوب مخروطي معقم بسعة 15 مل.
ملاحظة: يتطلب العمل مع الخلايا المحولة عديا BSL-2. ومع ذلك ، فإن غسل الخلايا وتمريرها يزيل الجسيمات الفيروسية من الوسط. يجب الحصول على معلومات حول متى يسمح بالنقل من BSL-2 إلى BSL-1 من السلطات المحلية. - أضف 9 مل من 1x PBS المعقمة وأجهزة الطرد المركزي لمدة 5 دقائق عند 300 × جم ، RT.
- إزالة supernatant عن طريق الشفط باستخدام ماصة (1-10 مل) ؛ قم بإمالة التعليق بلطف نحو طرف الماصة وابدأ في الشفط. احرص على عدم إزعاج الكريات.
- اغسل الخلايا عن طريق التعليق في 10 مل من 1x PBS المعقمة.
ملاحظة: ضع علامة تبويب الأنبوب برفق لإعادة تعليق الخلايا في وحدة التخزين المتبقية. قم بتثلث تعليق الخلية ببطء باستخدام ماصة 1 مل حتى لا تحتوي على كتل أو مجاميع. - عد الخلايا قبل الدوران النهائي باستخدام عداد خلايا آلي.
- جهاز طرد مركزي لمدة 5 دقائق عند 300 × جم ، RT.
- قم بإزالة supernatant (الخطوة 2.5) وأعد تعليق حبيبات الخلية في الحجم المطلوب من PBS المعقم إلى تركيز 8 × 104 خلايا / ميكرولتر.
ملاحظة: تم استخدام حجم 1.6 × 105 خلايا/2 ميكرولتر من PBS في هذا البروتوكول.
3. إجراء الزرع
- التحضير للجراحة
- تنظيف وتعقيم معدات الجراحة.
- قم بإعداد جهاز التجسيم ونظام مضخة الحقن المجهري.
ملاحظة: من الأهمية بمكان اختبار حقنة هاميلتون وإبرة 30 جم و 2 بوصة قبل البدء. أدخل الإبرة في أنبوب يحتوي على 0.9٪ كلوريد الصوديوم المعقم واسحب المحلول ببطء إلى الداخل والخارج. - قم بإعداد جهاز التخدير. اختبر الجهاز قبل إشراك أي. نظف غرفة الحث بالإيثانول بنسبة 70٪.
- إعداد الحيوانات
- احتفظ بالفئران لمدة 7 أيام على الأقل قبل التجارب في ظروف قياسية للتأقلم معها.
ملاحظة: تم استخدام الحيوانات التالية لهذا البروتوكول: أنثى NOD/SCID/IL2rγnull (30-35 جم، والمعروفة أيضا باسم NSG) وأنثى C57BL/6J (20-25 جم، والمعروفة أيضا باسم B6). يمكن أيضا تنفيذ الإجراء مع الفئران الذكور. - قياس وزن جسم الفأر وضبط جرعة مسكن الألم المراد حقنه. إدارة كاربروفين (5 مغ / كغ من وزن الجسم) داخل الصفاق لتقليل الألم و / أو منع الاستجابة الالتهابية.
- تخدير الحيوانات باستخدام الأيزوفلوران (3 ٪ في مرحلة الحث و 1.5-2 ٪ في مرحلة الصيانة أثناء الجراحة) تبخير في الأكسجين.
ملاحظة: يفضل التخدير الغازي بسبب الاستيقاظ السريع بعد العملية الجراحية ولأن مستويات غاز التخدير يمكن تعديلها بسهولة. - استخدم ردود الفعل المسببة للألم لضمان تخدير الحيوان بعمق (على سبيل المثال ، قرصات أصابع القدم). عندما يتم الوصول إلى التخدير العميق ، انقل الحيوان من غرفة الحث إلى الإطار المجسم. الحفاظ على التخدير باستخدام قناع الوجه.
ملاحظة: يجب مراقبة معدل التنفس بصريا طوال العملية (40-60 نفسا في الدقيقة). استخدم وسادة الاحترار لتجنب انخفاض حرارة الجسم أثناء الإجراء. - ضع مواد التشحيم العينية لمنع العينين من الجفاف.
- حلق فروة رأس الفأر باستخدام ماكينة حلاقة كهربائية وقم بتطهير الجلد بمحلول بيتادين بنسبة 5٪ باستخدام مسحات القطن.
- قم بتأمين رأس الماوس وأدخل قضبان الأذن في الصماخ الخارجي.
ملاحظة: احرص على عدم إتلاف طبلة الأذن. ضع مرهم يدوكائين على كل من قنوات الأذن قبل إدخال قضبان الأذن. للتحقق مما إذا كان رأس الحيوان في وضع مستقر ، ادفع بعناية لأسفل على الرأس لمعرفة ما إذا كانت هناك حركة. إذا لوحظت الحركة ، فإما أن يكون شريط الأذن أو وضع قطعة الأنف أو كلاهما غير صحيح ويحتاج إلى إعادة ضبط.
- احتفظ بالفئران لمدة 7 أيام على الأقل قبل التجارب في ظروف قياسية للتأقلم معها.
- بضع القحف
- استخدم شفرة جراحية لعمل قطع على طول خط الوسط كبير بما يكفي للكشف عن معالم لامدا وبريجرا.
ملاحظة: يمكن تطبيق متراجعات الجلد للحفاظ على الجمجمة مكشوفة. - اسحب السمحاق واللفافة باستخدام مشرط واستخدم مسحات قطنية معقمة لتجفيف سطح الجمجمة.
- اضبط قضبان الأذن والفم لتوحيد وضع الرأس.
ملاحظة: يجب أن تكون الإحداثيات الرأسية للبريجما ولامدا متطابقة لتحديد المواقع الأمامية الخلفية. - ضع الإبرة في البريجما واحسب إحداثيات نقاط الحقن المطلوبة (إحداثيات الاهتمام المختارة لهذا البروتوكول: الأمامي الخلفي (AP): + 0.5 مم ، الإنسي الجانبي (ML): + 1.5 مم). حرك الإبرة إلى تلك النقطة وقم بوضع علامة عليها بالحبر.
ملاحظة: تم اختيار الإحداثيات استنادا إلى أطلس دماغ فرانكلين وباكسينوس ماوس 16. المسافات مم من bregma. - ضع كلوريد الصوديوم المعقم بنسبة 0.9٪ على الجمجمة وحفر حفرة قطرها 2-3 مم من خلال الجمجمة باستخدام مثقاب جراحي للأسنان.
- حرك الإبرة إلى سطح الجافية واحسب إحداثيات العمق.
- استخدم شفرة جراحية لعمل قطع على طول خط الوسط كبير بما يكفي للكشف عن معالم لامدا وبريجرا.
- إجراء الزرع
- أعد تعليق الخلايا الموجودة في الأنبوب (الخطوة 2.9) واسحب 2 ميكرولتر من تعليق الخلايا إلى حقنة (5 ميكرولتر أو 10 ميكرولتر).
ملاحظة: تأكد من عدم وجود فقاعات هواء في تعليق الخلية. يجب أن تبقى المحقنة في وضع أفقي حتى يتم تركيبها في الجهاز التجسيمي لتجنب ترسيب الخلايا. - ضع المحقنة فوق الموقع المستهدف (الإحداثيات المحسوبة: AP: + 0.5 مم ، ML: + 1.5 مم) وحرك الإبرة ببطء إلى سطح الجافية.
ملاحظة: إذا لم تكن متأكدا من الإحداثيات الصحيحة ، فقم بإجراء الحقن باستخدام صبغة وتقييم نسيجي لموقع الحقن قبل زرع الخلايا (لمزيد من التفاصيل ، انظر 17). - قم بتوجيه الإبرة بمعدل 0.02 مم / ثانية إلى الدماغ حتى العمق المناسب (الإحداثيات المختارة لهذا البروتوكول هي الظهرية البطنية (DV) - 0.8 مم). تجاوز العمق بمقدار 0.1 مم واسحب الإبرة على نفس المسافة لإنشاء جيب للخلايا المحقونة.
- ضع لاصق الأنسجة حول الإبرة باستخدام ملقط لمنع تسرب الخلايا.
- حقن 2 ميكرولتر من تعليق الخلية المحضر بمعدل ثابت من 3-5 نانولتر / ثانية.
ملاحظة: سيستمر إجراء الحقن بين 7 و 12 دقيقة. - بعد الحقن ، اترك الإبرة في مكانها لمدة 5 دقائق على الأقل قبل سحبها ببطء. ضع لاصقا للأنسجة لإغلاق الثقب في الجمجمة وانتظر لمدة 2 دقيقة أخرى.
- أعد تعليق الخلايا الموجودة في الأنبوب (الخطوة 2.9) واسحب 2 ميكرولتر من تعليق الخلايا إلى حقنة (5 ميكرولتر أو 10 ميكرولتر).
- الغرز وما بعد الرعاية
- ضع محلول كلوريد الصوديوم المعقم بنسبة 0.9٪ على الجمجمة المكشوفة لتجنب الجفاف.
- قم بإغلاق الجرح بخيط خياطة حريري 5/0.
- ترطيب الحيوان مع 0.5 مل من محلول لاكتات الرنين حقن تحت الجلد في أسفل الظهر.
- قاطع توصيل التخدير وأزل الماوس بعناية من جهاز التاكسيك المجسمة وضعه مرة أخرى في قفص محفوظ على وسادة تدفئة.
- مراقبة الحيوانات خلال المرحلة الحادة بعد الإصابة. تحقق من الخياطة ووزن الحيوان والصحة العامة مرتين على الأقل في اليوم.
4. التصوير في الجسم الحي
- إعداد لوسيفيرين
- قم بإذابة ملح البوتاسيوم D-luciferin في RT وقم بإعداد محلول مخزون طازج من D-luciferin عند 30 مجم / مل في PBS.
- تعقيم محلول المخزون من خلال مرشح حقنة 0.22 ميكرومتر.
ملاحظة: يوصى بالاستخدام الفوري لحل العمل. إذا لزم الأمر ، يمكن تخزين لوسيفيرين المذاب في -20 درجة مئوية. ومع ذلك ، قد يؤدي التخزين المطول إلى تدهور الإشارة. Luciferin هو كاشف حساس للضوء. احفظه بعيدا عن الضوء المباشر كلما أمكن ذلك. ويمكن أيضا النظر في ركائز بديلة، مثل السيكلوك، لتحسين حد الاستبانة18.
- التصوير
- الإعداد الأولي
ملاحظة: تم إجراء التصوير بتقنية التلألؤ الحيوي باستخدام نظام تصوير في الجسم الحي (انظر جدول المواد) يتكون من غرفة مظلمة وكاميرا جهاز مبرد مقترن بالشحن (CCD).- انقر نقرا مزدوجا فوق رمز برنامج Living Image وحدد معرف مستخدم من القائمة المنسدلة.
- انقر فوق تهيئة في لوحة التحكم التي تظهر. بمجرد اكتمال عملية التهيئة ، سيتحول مربع درجة الحرارة في لوحة التحكم إلى اللون الأخضر.
- في لوحة التحكم، حدد مربعي Luminescent و Photo (التعريض الضوئي التلقائي) (~ 60 ثانية). حدد مجال رؤية (تم اختيار D/12.5cm لهذا البروتوكول). أدخل ارتفاع الهدف (1.5 سم) وحدد خيار استخدام التركيز البؤري لارتفاع الهدف. قم بتعيين المعلمات التالية يدويا: الربط الكبير ، f / 2 ، مرشح الإثارة المحظور ، ومرشح الانبعاثات المفتوح.
- تحديد كمية الحقن من D-luciferin في 300 ملغم / كغم من وزن الجسم. ملاحظة: الجرعة القياسية الموصى بها هي 150 ملغم / كغم من D-luciferin. تم تعديل هذا الإجراء وفقا لبروتوكول يبلغ عن حساسية أعلى باستخدام 300 مغ / كغ18.
- حقن لوسيفيرين داخل الصفاق (i.p.).
ملاحظة: إذا كان الحيوان بحاجة إلى التخدير قبل الحقن ، فاعلم أنه قد يطيل وقت تعبير لوسيفيراز الذروة. - انتظر لمدة 5 دقائق ، ثم قم بتخدير الحيوانات مع إمدادات مستمرة من الأيزوفلوران (4.5 ٪ في مرحلة الحث و 1.5-2 ٪ في مرحلة الصيانة أثناء إجراء التصوير).
- ضع مواد تشحيم العيون على العينين ، ثم حلق الحيوانات المخدرة على منطقة الرأس باستخدام ماكينة حلاقة الشعر التقليدية. ضع الحيوانات في غرفة التصوير وابدأ التصوير بعد 15 دقيقة من حقن لوسيفيرين بالنقر فوق اكتساب في لوحة التحكم .
- الإعداد الأولي
5. التروية
- تخدير الحيوانات عن طريق حقن i.p. من بنتوباربيتال الصوديوم (150 ملغم / كغم من وزن الجسم). انتظر حتى يتوقف الماوس عن الاستجابة للمحفزات المؤلمة، مثل قرصات أصابع القدم.
- ضع الماوس على ظهره واستخدم الملقط والمقص لفتح تجويف الصدر.
- استخدم المقص القياسي لفتح الحجاب الحاجز.
- كشف القلب وأدخل إبرة (من الأنابيب مع رنين / 4٪ محلول بارافورمالديهايد (PFA)) في قمة البطين الأيسر.
ملاحظة: احرص على إبقاء طرف الإبرة في تجويف البطين. - قطع البطين الأيمن باستخدام المقص.
- Perfuse مع حل الرنين (يمكن الاحتفاظ بها في RT) لمدة 3-4 دقائق (معدل التدفق: 17 مل / دقيقة). استمر حتى يصبح القلب نظيفا.
- قم بتبديل السدادة للسماح بتدفق PFA (يخزن عند 4 درجات مئوية ؛ احتفظ به على الجليد أثناء الإجراء) وقم بتشغيله لمدة 5 دقائق أخرى (~ 100 مل).
- أوقف المضخة وأزل الإبرة من البطين الأيسر.
ملاحظة: يحافظ التروية مع PFA على سلامة الأنسجة بشكل موحد. كما أنه يسهل الحفاظ على إشارة GFP في عمليات الزرع التي قد تفقد بسبب الانتشار.
6. المعالجة
- جمع الأنسجة
- قم بإزالة الرأس باستخدام مقص قياسي وقم بعمل شق في خط الوسط في الجلد.
- اقلب الجلد فوق العينين لفضح الجمجمة.
- ابدأ من الجزء الذيلي عند نقطة العظم الجداري وقم بعمل شق صغير باستخدام مقص زنبركي. تقدم المقص بشكل كبير على طول خياطة منتصف السهمي حتى نقطة بين العينين. ابدأ مرة أخرى من الجزء الذيلي وقم بإجراء قطعتين متوازيتين و ~ 4 مم متباعدتين في المستوى السهمي.
ملاحظة: احرص على عدم إتلاف الدماغ عن طريق الضغط على المقص على السطح الداخلي للجمجمة. - استخدم الملقط لإمالة جانب واحد من العظم الجداري بعناية وكسره. افعل الشيء نفسه مع الجانب الآخر.
ملاحظة: استخدم ملعقة صغيرة لتحرير العظام من السحايا. خلاف ذلك ، فإنها قد تلحق الضرر بالدماغ أثناء كسر الجمجمة. إذا بقيت أجزاء من العظم الجبهي ، فقم بعمل قطع صغير لإمالة وكسر صفيحة العظام. - لتحرير الدماغ ، حرك الملعقات الدقيقة بعناية تحت الدماغ (المصابيح الشمية) وقم بإمالتها بلطف لأعلى.
- بعد الجمع ، حافظ على الدماغ في محلول PFA بنسبة 4٪ لمدة 4-6 ساعات عند 4 درجات مئوية. نقله إلى 1x PBS معقمة بعد ذلك.
- الكيمياء النسيجية المناعية
- انقل الدماغ إلى محلول السكروز بنسبة 30٪ لمدة 48 ساعة على الأقل عند 4 درجات مئوية لمنع تكوين البلورات أثناء التجميد.
- استخدم ميكروتوم منزلق لقطع المقاطع الإكليلية بسماكة 40 ميكرومتر. جمع وتخزين الأقسام كأقسام عائمة حرة (في لوحة 24 بئر) في محلول مبرد (الجدول 1) عند -20 درجة مئوية حتى مزيد من المعالجة.
- شطف الأقسام مع 450 ميكرولتر من 1x PBS لكل بئر (3 مرات ، 5 دقائق لكل منها ، RT).
- حجب المواقع غير المحددة باستخدام 450 ميكرولتر من محلول الحجب لكل بئر (الجدول 1) لمدة 1 ساعة في RT.
- احتضان كل بئر مع 450 ميكرولتر من الأجسام المضادة الأولية عند 4 درجات مئوية بين عشية وضحاها. تمييع الأجسام المضادة 1:200 في مصل الحمير 3 ٪. 0.1٪ تريتون-X-100 في PBS. لتحديد المواد المانحة في البيئة المضيفة ، استخدم جسما مضادا للنوى الخاصة بالإنسان (الأجسام المضادة للنوى المضادة للإنسان ، استنساخ 235-1).
- اغسل الأقسام ب 450 ميكرولتر من 1x PBS لكل بئر (3 مرات ، 5 دقائق لكل منها ، RT).
- احتضان كل بئر مع 450 ميكرولتر من الأجسام المضادة الثانوية الفلورسنت المقابلة لمدة 2-3 ساعات (RT). تمييع الأجسام المضادة في مصل الحمير 3 ٪. 0.1٪ تريتون-X-100 في 1x PBS.
- اغسل الأقسام ب 450 ميكرولتر من 1x PBS لكل بئر (3 مرات ، 5 دقائق لكل منها ، RT).
- وصمة عار النوى مع 450 ميكرولتر من 0.1 ميكروغرام / مل 4'،6-دياميدينو-2-فينيليندول (DAPI).
النتائج
نحن نهدف إلى تتبع الخلايا السلفية العصبية المزروعة طوليا في دماغ الفأر باستخدام تصوير التلألؤ الحيوي في الجسم الحي وتحديد الخلايا المزروعة في التحليل النسيجي اللاحق (الشكل 1A). لذلك ، يتم نقل الخلايا السلفية العصبية مع ناقل فيروسي عدسي يتكون من EF1α-rFluc-eGFP. قبل الزرع ، تم اختبار الخلايا للنقل الناجح عن طريق التعبير عن eGFP في المختبر (الشكل 1B). تم زرع الخلايا المحولة بنجاح بشكل مجسمي في دماغ الفأر عند الإحداثيات المطلوبة (على سبيل المثال ، في القشرة الحسية الحركية). بعد الزرع ، تم حقن الفئران بشكل منهجي باستخدام D-luciferin ، الركيزة ل rFluc ، وتم قياس كثافة الإشارة للخلايا المزروعة لتأكيد نجاح عملية الزرع (الشكل 1C).
لتقييم حد الكشف عن تصوير التلألؤ الحيوي في الجسم الحي ، تم زرع مجموعة من 6000-180000 خلية في القشرة الحسية الحركية اليمنى للفأر (الشكل 2A). اكتشفنا <6000 خلية وإشارة تلألؤ حيوي تتناسب مع عدد الخلايا المزروعة مباشرة بعد الزرع (الشكل 2B). نظرا لأن مصادر الخلايا البشرية مناعية للفئران ذات الكفاءة المناعية ، فقد تم استخدام الفئران التي تعاني من نقص المناعة في NOD scid gamma (NSG) لمراقبة بقاء الطعوم الخلوية على المدى الطويل. تم تأكيد البقاء على قيد الحياة على المدى الطويل والكشف عن إشارة التلألؤ الحيوي لمدة تصل إلى 5 أسابيع بعد زرع الخلايا (الشكل 2C ، D). تم الكشف عن الخلايا المزروعة بنجاح خارج الجسم الحي في تحليل نسيجي لاحق من خلال مراسل eGFP والتلطيخ المناعي بالنوى المضادة للإنسان والأجسام المضادة للميتوكوندريا المضادة للإنسان (الشكل 2E).
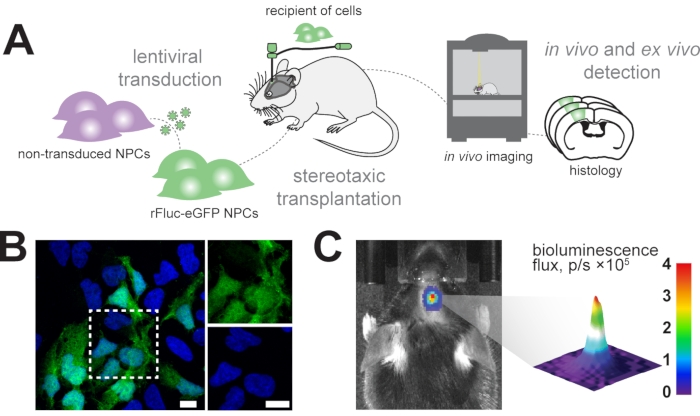
الشكل 1: زرع الخلايا السلفية العصبية . (أ) نظرة عامة تخطيطية لتوليد وزرع NPCs rFluc-eGFP. (B) صورة التألق المناعي التمثيلي ل NPCs المحولة (مراسل GFP ، أخضر) ملطخة ب DAPI (أزرق) ؛ أشرطة المقياس = 5 ميكرومتر (C) الكشف في الجسم الحي عن إشارة التلألؤ الحيوي في الخلايا المزروعة ؛ شريط اللون = أزرق (0 ، دقيقة ، بدون إشارة) ، أحمر (4 تدفق ، p / s × 105 ، إشارة كحد أقصى) الاختصارات: NPCs = الخلايا السلفية العصبية ؛ GFP = بروتين الفلورسنت الأخضر; rFluc-eGFP = لوسيفيراز اليراع الأحمر وبروتين الفلورسنت الأخضر المعزز ؛ DAPI = 4',6-دياميدينو-2-فينيليندول; p/s = فوتونات/فوتونات. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
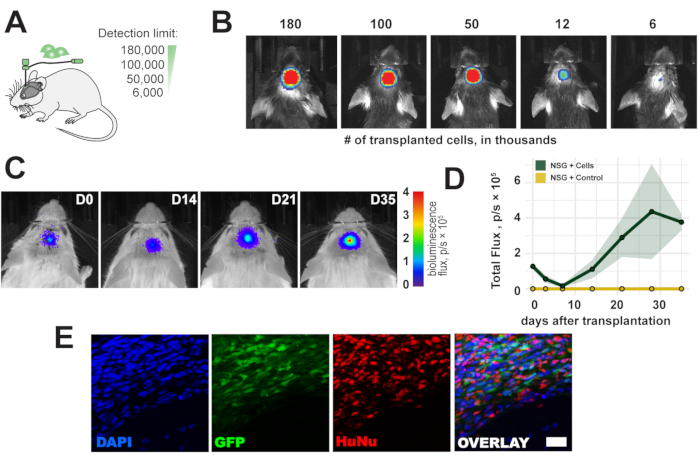
الشكل 2: المسار الزمني للخلايا المزروعة. (أ) عرض تخطيطي لأعداد الخلايا للزرع. (ب) حد الكشف عن الخلايا المزروعة 1 ساعة بعد الزرع. (ج، دال) الدورة الزمنية للزرع (180000 خلية) لمدة تصل إلى 35 يوما في فئران NSG ؛ شريط اللون = أزرق (0 ، دقيقة ، بدون إشارة) ، أحمر (4 تدفق ، p / s × 105 ، أقصى إشارة) البيانات هي متوسط ± SEM (n = 3). (ه) صور التألق التمثيلية للأقسام النسيجية والخلايا المزروعة بعد 5 أسابيع من الزرع. شريط المقياس = 10 ميكرومتر. الاختصارات: D = يوم بعد الزرع. NSG = نقص المناعة NOD scid gamma; DAPI = 4',6-دياميدينو-2-فينيليندول; GFP = بروتين الفلورسنت الأخضر; HuNu = الأجسام المضادة للنوى البشرية ، استنساخ 235-1 ؛ p/s = فوتونات/فوتونات. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
Discussion
لا يزال تجديد الدماغ المصاب للسماح بالشفاء الوظيفي يمثل تحديا لم تتم مواجهته. وقد تطورت العديد من الأساليب المبتكرة قبل السريرية التي تستهدف ، على سبيل المثال ، التعديل المناعي19،20 ، وتكوين الأوعية الدموية1،21،22،23 ، وسلامة حاجز الدم الدماغي2،3،24،25 ، واستبدال الخلايا 5،26 . خاصة في السنوات الأخيرة ، ظهرت العلاجات القائمة على الخلايا كاستراتيجية علاج واعدة للدماغ بسبب التقدم الكبير في تكنولوجيا الخلايا الجذعية وبروتوكولات التمايز الفعالة15,28. توفر هذه الورقة بروتوكولا قيما لزرع وتتبع الخلايا العصبية في دماغ الفأر. هذه الطريقة قابلة للتطبيق على جميع خطوط الخلايا القابلة للتحويل للتطبيقات في الجسم الحي في دماغ الماوس.
يستخدم الإعداد المقدم عمليات زرع من أصل بشري في فأر. عمليات الزرع هذه غير قابلة للحياة على المدى الطويل في الفئران البرية ذات الكفاءة المناعية بسبب المناعة. وبالتالي ، تم استخدام الفئران NSG التي تعاني من نقص المناعة للتغلب على هذا القيد. بدلا من ذلك ، قد يفضل استخدام عمليات زرع الفئران للتغلب على الجوانب المناعية. إذا كانت هناك حاجة إلى زرع الخلايا البشرية ، فإن نماذج الفئران البشرية تمثل بديلا ناشئا لتقليل احتمال رفض الكسب غير المشروع29.
تم استخدام ناقل فيروسي تجاري مزدوج المراسل يتكون من لوسيفيراز اليراع و eGFP تحت محرك EF1α لتصور عمليات الزرع. تم اختيار هذا المحرك الأولي لتحقيق كثافة إشارة عالية15. ومع ذلك ، وبصرف النظر عن NPCs ، فقد ثبت أن أنواع الخلايا الأخرى تعزز وظائف الدماغ بعد الإصابة ، بما في ذلك pericytes30 و astrocytes31 ؛ وبالتالي ، اعتمادا على خط الخلية المستخدم ، قد تكون promotors الأخرى أكثر ملاءمة لتحقيق مستويات تعبير عالية. بالإضافة إلى ذلك ، قد يؤدي استخدام مروجي الجينات المحورة ، مثل CMV ، إلى انخفاض التنظيم ، خاصة في التجارب طويلة الأجل32. تعتمد كفاءة نقل ناقل الفيروسات الوعائية بشدة على خط الخلية المستخدم وقد تختلف بين التجارب الفردية. لذلك ، يجب تقييم كفاءة النقل قبل البدء في التجارب في الجسم الحي وتصحيح الاختلافات في فعالية النقل بين التجارب. تؤثر منطقة الزرع في الدماغ أيضا على قوة الإشارة. على الرغم من تحقيق حد اكتشاف يبلغ <6000 خلية لعمليات زرع القشرة، إلا أنه قد يتطلب المزيد من الخلايا للكشف عن إشارة في مناطق أعمق من الدماغ، على سبيل المثال، المخطط أو الحصين.
تقتصر أحجام الزرع في دماغ الفأر على 1-2 ميكرولتر. لذلك ، من المهم تحديد رقم خلية مناسب للتجارب. وقد لوحظ سابقا أن زيادة أعداد الخلايا يؤدي إلى انخفاض معدل البقاء على قيد الحياة ، على الأرجح بسبب محدودية توافر العناصر الغذائية والأكسجين في منطقة الزرع33. يوفر التصوير بتقنية التلألؤ الحيوي في الجسم الحي دقة مكانية منخفضة نسبيا مقارنة بطرق التصوير الأخرى في الجسم الحي مثل التصوير بالرنين المغناطيسي أو التصوير المقطعي المحوسب. لذلك ، لا يمكن تقييم مسارات الهجرة القصيرة للخلايا المطعمة بشكل موثوق به إلا في التحليل اللاحق بعد التخصيص .
تتناسب قوة الإشارة المطلقة للتلألؤ الحيوي بشكل عام مع عدد الخلايا المزروعة. ومع ذلك ، قد يتم تقليل قوة الإشارة إذا تم زرع الطعوم في هياكل أعمق للدماغ أو إذا كانت قوة الإشارة خارج طيف الكشف الخطي لنظام التصوير في الجسم الحي . حاليا ، يتم تطوير ركائز جديدة لضمان اختراق أكثر كفاءة عبر حاجز الدم في الدماغ من D-luciferin ، بما في ذلك cycluc1. قد تزيد هذه الركائز من تحسين حد الكشف عن الخلايا المطعمة في المستقبل18. بشكل عام ، يسمح هذا البروتوكول بإجراء مباشر وطفيف التوغل لزرع ومراقبة الطعوم في دماغ الفأر.
Disclosures
ليس لدى المؤلفين أي تضارب محتمل في المصالح للإعلان.
Acknowledgements
يعترف المؤلفان RR و CT بالدعم المقدم من مؤسسة Mäxi ومركز الكفاءة 3R.
Materials
| Name | Company | Catalog Number | Comments |
| Viral Transduction | |||
| pLL-EF1a-rFLuc-T2A-GFP-mPGK-Puro (Lenti-Labeler virus) | Systembio | LL410VA-1 | |
| Consumables | |||
| Eppendorf microtubes; 1.5 mL | Sigma Aldrich | Z606340 | |
| Falcon Tubes; 15 mL | TPP | 91015 | |
| Microscope cover slips | Product of choice | ||
| Microscope slides | Product of choice | ||
| Sterlie cotton swabs | Product of choice | ||
| Sutures; 5/0 silk with curved needle | B. Braun | G0762482 | |
| Syringe filter; 0.22 µm | TPP | 99722 | |
| Syringe; 1 mL and 0.5 mL | B. Braun | 9166017V | |
| Tissue culture plate (24-well) | TPP | 92024 | |
| Equipment | |||
| Automated cell counter (Vi-CELL XR) | Beckmann Coulter Life Science | 383721 | |
| Forceps | Fine Science Tools | 11064-07 | |
| Forceps, fine | Fine Science Tools | 11412-11 | |
| Heating pad | Product of choice | ||
| High Speed Brushless Micromotor Kit | Foredom | K.1060-22. | |
| Ideal Micro Drill Burr Set Of 5 | Cell Point Specific | 60-1000 | |
| In-Vivo imaging system (IVIS Lumina III with Living Imaging 4.2 software package) | Perkin Elmer | CLS136334 | |
| Isoflurane vaporizer | Provet AG | 330724 | |
| Microinjection Syringe Pump system | World Precision Instruments | UMP3T-1 | |
| Microliter syringe; 700-Series; Volume: 5-10 µL | Hamilton | 7635-01 | |
| Microtome | Leica | HM430 | |
| NanoFill-33 G-Needle (removable and reusable) | World Precision Instruments | NF33BV-2 | |
| Needle Holder | Fine Science Tools | 12001-13 | |
| Perfusion pump and tubing | Masterflex | HV-77120-42 | |
| Scalpel | Fine Science Tools | 10003-12 | |
| Small bonn scissors, straight | Fine Science Tools | 14184-09 | |
| Small spring scissors, straight | Fine Science Tools | 15000-03 | |
| Spatula | Merck | Z243213-2EA | |
| Stereotaxic frame for rodents; motorized | World Precision Instruments | 99401 | |
| Pharmaceuticals and Reagents | |||
| Accutase | Invitrogen | A11105-01 | Proteolytic and collagenolytic; cell dissociation reagent |
| Anti-Human Nuclei Antibody, clone 235-1, Biotin Conjugate | Merck | MAB1281B | |
| B27 – Supplement (50x) | Gibco | 17504-001 | |
| Betadine (11 mg Iod als Povidon-Iod pro 1 ml Lösung) | Mundipharma Medical Company | All pharmaceuticals were provided by the cantonal pharmacy, Zurich, Switzerland | |
| Blocking solution (3% donkey serum; 0.1% Triton-X-100 in PBS) | Product of choice; can be homemade | ||
| CHIR99021 (10 mM – 2,500x) | StemMACS | 130-103-926 | |
| Cryoprotectant solution | Product of choice; can be homemade | ||
| DAPI solution (1 mg/mL) | Thermo Fisher Scientific | 62248 | |
| D-Luciferin Potassium Salt | Perkin Elmer | 122799 | |
| DMEM/F12 | Gibco | 11320-074 | |
| Donkey anti-Mouse IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 555 | Invitrogen | A-31570 | |
| Donkey serum | Product of choice | ||
| Esconarcon (Pentobarbitalum natricum 300 mg) | Streuli Pharma AG | All pharmaceuticals were provided by the cantonal pharmacy, Zurich, Switzerland | |
| Ethanol; 70% | Product of choice | ||
| FGF Basic recombinant human protein, Animal-origin free | Thermo Fisher Scientific | PHG6015 | |
| Glutamax (100x) | Gibco | A12860-01 | |
| hLif (10 µg/mL – 1,000x) | PeproTech | AF-300-05-25UG | |
| Isoflurane (Isofluran (1-Chlor-2,2,2-trifluorethyl-difluoromethylether) 99.9%) | Provet AG | All pharmaceuticals were provided by the cantonal pharmacy, Zurich, Switzerland | |
| Laminin-L521 (L-521) | Biolaminin LN | LN521 | |
| Lidocaine ointment (Lidocain: 25 mg , Prilocain: 25 mg) | Aspen Pharma Schweiz GmbH | All pharmaceuticals were provided by the cantonal pharmacy, Zurich, Switzerland | |
| Mounting Medium | Product of choice; can be homemade | ||
| N2- Supplement (100x) | Gibco | 75202-001 | |
| Neurobasal | Gibco | 21103-049 | |
| Ophtalmic lubricant (Retinol palmitat: 15,000 UI) | Bausch & Lomb Swiss AG | All pharmaceuticals were provided by the cantonal pharmacy, Zurich, Switzerland | |
| Paraformaldehyde solution | Product of choice | ||
| PBS | Thermo Fisher Scientific | 10010023 | Can also be homemade |
| Poly-L-ornithine Solution (pLO) | Sigma-Aldrich | P4957 | |
| Rimadyl (Carprofen 50 mg) | Zoetis Schweiz GmbH | All pharmaceuticals were provided by the cantonal pharmacy, Zurich, Switzerland | |
| Ringer lactate | B. Braun | 3570500 | |
| Ringer solution | B. Braun | 3570030 | |
| Saline (0.9% NaCl) | B. Braun | 3570160 | |
| SB431542 (10 mM – 3,333.3x) | StemMACS | 130-106-543 | |
| Tissue Adhesive (Histoacryl) | B. Braun | 1050060 |
References
- Rust, R., et al. Nogo-A targeted therapy promotes vascular repair and functional recovery following stroke. Proceedings of the National Academy of Sciences of the United States of America. 116 (28), 14270-14279 (2019).
- Rust, R., et al. Anti-Nogo-A antibodies prevent vascular leakage and act as pro-angiogenic factors following stroke. Scientific Reports. 9 (1), 20040 (2019).
- Weber, R. Z., et al. Characterization of the blood brain barrier disruption in the photothrombotic stroke model. Frontiers in Physiology. 11, 58226 (2020).
- Sweeney, M. D., Sagare, A. P., Zlokovic, B. V. Blood-brain barrier breakdown in Alzheimer's disease and other neurodegenerative disorders. Nature Reviews. Neurology. 14 (3), 133-150 (2018).
- Wang, Y., et al. 3K3A-APC stimulates post-ischemic neuronal repair by human neural stem cells in mice. Nature Medicine. 22 (9), 1050-1055 (2016).
- Llorente, I. L., et al. Patient-derived glial enriched progenitors repair functional deficits due to white matter stroke and vascular dementia in rodents. Science Translational Medicine. 13 (590), (2021).
- Kokaia, Z., Llorente, I. L., Carmichael, S. T. Customized brain cells for stroke patients using pluripotent stem cells. Stroke. 49 (5), 1091-1098 (2018).
- Parmar, M., Grealish, S., Henchcliffe, C. The future of stem cell therapies for Parkinson disease. Nature Reviews Neuroscience. 21 (2), 103-115 (2020).
- Galgano, M., et al. Traumatic brain injury: current treatment strategies and future endeavors. Cell Transplantation. 26 (7), 1118-1130 (2017).
- Schweitzer, J. S., et al. Personalized iPSC-derived dopamine progenitor cells for Parkinson's disease. The New England Journal of Medicine. 382 (20), 1926-1932 (2020).
- Muir, K. W., et al. Intracerebral implantation of human neural stem cells and motor recovery after stroke: multicentre prospective single-arm study (PISCES-2). Journal of Neurology, Neurosurgery & Psychiatry. 91 (4), 396-401 (2020).
- Kawabori, M., et al. Cell therapy for chronic TBI: interim analysis of the randomized controlled STEMTRA trial. Neurology. 96 (8), 1202-1214 (2021).
- George, P. M., et al. Engineered stem cell mimics to enhance stroke recovery. Biomaterials. 178, 63-72 (2018).
- Sancho-Martinez, I., et al. Establishment of human iPSC-based models for the study and targeting of glioma initiating cells. Nature Communications. 7 (1), 1-14 (2016).
- Rust, R., et al. Xeno-free induced pluripotent stem cell-derived neural progenitor cells for in vivo applications. bioRxiv. , (2022).
- Franklin, K., Paxinos, G. . Paxinos and Franklin's the Mouse brain in stereotaxic coordinates, compact: The coronal plates and diagrams. , (2019).
- Baker, S., Götz, J. A local insult of okadaic acid in wild-type mice induces tau phosphorylation and protein aggregation in anatomically distinct brain regions. Acta Neuropathologica Communications. 4, 32 (2016).
- Cao, J., et al. In vivo optical imaging of myelination events in a myelin basic protein promoter-driven luciferase transgenic mouse model. ASN Neuro. 10, (2018).
- Aswendt, M., Adamczak, J., Couillard-Despres, S., Hoehn, M. Boosting bioluminescence neuroimaging: an optimized protocol for brain studies. PLoS One. 8 (2), 55662 (2013).
- Roth, S., et al. Brain-released alarmins and stress response synergize in accelerating atherosclerosis progression after stroke. Science Translational Medicine. 10 (432), (2018).
- Rust, R., Hofer, A. -. S., Schwab, M. E. Stroke promotes systemic endothelial inflammation and atherosclerosis. Trends in Molecular Medicine. 24 (7), 593-595 (2018).
- Rust, R., Gantner, C., Schwab, M. E. Pro- and antiangiogenic therapies: current status and clinical implications. FASEB Journal. 33 (1), 34-48 (2018).
- Rust, R., Grönnert, L., Weber, R. Z., Mulders, G., Schwab, M. E. Refueling the ischemic CNS: guidance molecules for vascular repair. Trends in Neurosciences. 42 (9), 644-656 (2019).
- Nih, L. R., Gojgini, S., Carmichael, S. T., Segura, T. Dual-function injectable angiogenic biomaterial for the repair of brain tissue following stroke. Nature Materials. 17 (7), 642 (2018).
- Montagne, A., et al. Pericyte degeneration causes white matter dysfunction in the mouse central nervous system. Nature Medicine. 24 (3), 326-337 (2018).
- Montagne, A., et al. APOE4 leads to blood-brain barrier dysfunction predicting cognitive decline. Nature. 581 (7806), 71-76 (2020).
- George, P. M., Steinberg, G. K. Novel stroke therapeutics: unraveling stroke pathophysiology and its impact on clinical treatments. Neuron. 87 (2), 297-309 (2015).
- Weber, R. Z., et al. Deep learning based behavioral profiling of rodent stroke recovery. bioRxiv. , (2021).
- Nair, R. R., et al. Uses for humanised mouse models in precision medicine for neurodegenerative disease. Mammalian Genome. 30 (7), 173-191 (2019).
- Kirabali, T., Rust, R. iPS-derived pericytes for neurovascular regeneration. European Journal of Clinical Investigation. 51 (9), 13601 (2021).
- Weber, R. Z., Perron, P., Rust, R. Astrocytes for brain repair: More than just a neuron's sidekick. Brain Pathology. 31 (5), 12999 (2021).
- Johansen, J., et al. Evaluation of Tet-on system to avoid transgene down-regulation in ex vivo gene transfer to the CNS. Gene Therapy. 9 (19), 1291-1301 (2002).
- Vogel, S., et al. Initial graft size and not the innate immune response limit survival of engrafted neural stem cells. Journal of Tissue Engineering and Regenerative Medicine. 12 (3), 784-793 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved