Method Article
השתלה תוך-מוחית ומעקב ביולומינסנציה In Vivo של תאי אב עצביים אנושיים במוח העכבר
* These authors contributed equally
In This Article
Summary
אנו מתארים את ההשתלה התוך-פרנכימלית של תאי אב עצביים אנושיים שעברו התמרות עם וקטור מדווח כפול המבטא חלבון פלואורסצנטי ירוק-לוציפראז (GFP) במוח העכבר. לאחר ההשתלה, אות הלוציפראז נמדד שוב ושוב באמצעות תאים מושתלים in vivo bioluminescence ותאים מושתלים המבטאים GFP שזוהו בחתכי מוח באמצעות מיקרוסקופיה פלואורסצנטית.
Abstract
טיפול בתאים הוא כבר מזמן פרדיגמה טיפולית מתפתחת בנויירוביולוגיה ניסויית. עם זאת, מחקרי השתלת תאים מסתמכים לעתים קרובות על מדידות של נקודות קצה ולכן יכולים להעריך רק שינויים אורכיים של נדידת תאים והישרדותם במידה מוגבלת. מאמר זה מספק פרוטוקול אמין, זעיר פולשני להשתלה ומעקב אורכי אחר תאי אב עצביים (NPCs) במוח העכבר הבוגר. לפני ההשתלה, התאים מתמרים עם וקטור לנטי-ויראלי המורכב מדיווח ביולומינסנטי (firefly-luciferase) ופלורסנט (חלבון פלואורסצנטי ירוק [GFP]). NPCs מושתלים בהמיספרה קליפת המוח הימנית באמצעות זריקות סטריאוטקסיות בקליפת המוח הסנסו-מוטורית. לאחר ההשתלה, תאים מושתלים זוהו דרך הגולגולת השלמה במשך עד חמישה שבועות (בימים 0, 3, 14, 21, 35) עם מגבלת רזולוציה של 6,000 תאים באמצעות הדמיית in vivo bioluminescence. לאחר מכן, התאים המושתלים מזוהים בקטעי מוח היסטולוגיים ומאופיינים עוד יותר באימונופלואורסצנציה. לפיכך, פרוטוקול זה מספק כלי רב ערך להשתלה, מעקב, כימות ואפיון תאים במוח העכבר.
Introduction
למוח היונקים יש יכולות התחדשות מוגבלות בעקבות פציעה או מחלה, הדורשות אסטרטגיות חדשניות לקידום רקמות ותיקון תפקודי. אסטרטגיות פרה-קליניות מתמקדות בהיבטים שונים של התחדשות המוח, כולל הגנה עצבית, נוירוגנזה, אנגיוגנזה 1,2, תיקון מחסום דם-מוח 3,4, או טיפול בתאים 5,6. לטיפול בתאים יש יתרון בכך שהוא מסוגל לקדם רבים מתהליכי התיקון הללו בו זמנית. בניסויים עם השתלת תאים, תיקון רקמות התרחש באמצעות (1) החלפת תאים ישירה ו-(2) ייצור ציטוקינים שהובילו לאנגיוגנזה ונוירוגנזה7. ההתקדמות האחרונה בטכנולוגיית תאי הגזע הקלה עוד יותר על פיתוחם של מקורות תאי עצב מדרגיים ומאופינים היטב שנמצאים כעת בצנרת לניסויים קליניים (שנסקרו ב-7,8,9). אף על פי שטיפולים תאיים הגיעו לשלב הקליני של כמה מחלות נוירולוגיות (למשל, מחלת פרקינסון10, שבץ11 ופגיעה בחוט השדרה12), יעילותם הייתה משתנה, ויש צורך במחקר פרה-קליני יותר כדי להבין את המנגנונים של אינטראקציות בין השתל לפונדקאי.
מגבלה מרכזית אחת של מחקרים פרה-קליניים רבים היא מעקב רציף אחר התאים המושתלים בתוך הפונדקאי. לעתים קרובות מבוצעות רק מדידות של נקודות קצה, תוך השמטת תהליכי הנדידה וההישרדות הדינמיים במארח 6,13. מגבלות אלה גורמות לאפיון לקוי של התאים המושתלים ודורשות מספר גבוה של בעלי חיים כדי להבין את השינויים האורכיים. כדי להתגבר על מגבלות אלה, במחקר זה, אנו מתמרים תאי גזע עצביים מושרים (iPSC) שמקורם בתאי אב עצביים עם וקטור לנטי-ויראלי בעל דיווח כפול הזמין מסחרית, המורכב מלוציפראז גחלילי אדום וחלבון פלואורסצנטי ירוק משופר (rFluc-eGFP). תאים אלה מושתלים באמצעות הזרקה תוך-פרנכימלית סטריאוטקסית למוח העכבר ונמצאים במעקב אורכי באמצעות הדמיית in vivo bioluminescence במשך 5 שבועות. לאחר איסוף רקמות המוח, התאים המושתלים המבטאים GFP מזוהים ומאופיינים עוד יותר בקטעי מוח היסטולוגיים. ניתן להתאים שיטה זו בצורה חלקה למקורות תאים חלופיים הניתנים להמרה ולנתיבים של השתלה עבור יישומי in vivo במוח המכרסמים. באופן כללי, ההליך הוא בעל ערך כדי לקבל מידע אורכי על הישרדות השתל והגירה במוח העכבר ומאפשר אפיון היסטולוגי לאחר מכן.
Protocol
הערה: כל הניסויים שבהם היו מעורבים עכברים נערכו בהתאם להנחיות ממשלתיות, מוסדיות ו-ARRIVE ואושרו על ידי המשרד הווטרינרי הקנטונלי של ציריך. נעשה שימוש בעכברי SCID SCID (NSG) זכרים ונקבות בוגרים שאינם שמנים (10-14 שבועות, 25-35 גרם). עכברים שוכנו בכלובים רגילים מסוג II/III בקבוצות של לפחות שני בעלי חיים לכל כלוב בחדר מבוקר לחות וטמפרטורה עם מחזור אור/חושך קבוע של 12/12 שעות. .).
1. תרבית תאים והתמרה ויראלית
- להבדיל בין תאי אב עצביים (NPCs) לבין תאי iPSCs באמצעות מעכבי מולקולות קטנות כפי שתואר קודם לכן14.
- NPCs תרבית15 ממעבר 2 ואילך במדיום תחזוקת תאי גזע עצביים (NSMM; טבלה 1) בתוספת מולקולות קטנות (טבלה 1) בלוחות של 6 בארות (2 מ"ל של בינוני לכל באר) מצופות בפולי-אורניתין/למינין521 (pLO/L521). שנה את המדיום מדי יום.
הערה: כדי להעביר NPCs, הוסף 1 מ"ל של מגיב דיסוציאציה של תאים לכל באר (ראה טבלת החומרים) ודגירה ב 37 °C (37 °C) למשך דקה אחת עד שרוב התאים מתנתקים.- לציפוי, יש לדגום 150 μL של pLO ב-1 מ"ל של 0.1 M תמיסת מלח עם תמיסת פוספט (PBS) לבאר למשך שעתיים בטמפרטורת החדר (RT). לאחר שלוש שטיפות עם PBS, דגירה של 10 מיקרוגרם של L521 ב 1 מ"ל של PBS לכל באר במשך 2 שעות ב- RT.
- עבור התמרה נגיפית, צלחת 50,000 תאים לכל באר בצלחת של 24 בארות המצופה ב-pLO/L521 ומוסיפה וקטורים נגיפיים ארוזים מראש (pLL-EF1a-rFLuc-T2A-GFP-mPGK-Puro, LL410PA-1) לכל באר.
הערה: סך היחידות הזיהומיות (IFU) המסופקות הן >2 × 106 IFU והן מספיקות כדי להדביק 100,000 תאים בריבוי של זיהום (MOI) של 20. ספירת תאים בוצעה באמצעות מונה תאים אוטומטי. יעילות ההעתקה תלויה מאוד בקו התאים המשומש. עבודה עם lentivirus דורשת עמידה בהנחיות המקומיות עבור מוצרי בטיחות ביולוגית ברמה 2 (BSL-2). - דגירה של התאים בטמפרטורה של 37 מעלות צלזיוס למשך 72 שעות, תוך המשך שינויים יומיים בינוניים.
- אשרו התמרה מוצלחת על ידי בדיקת התאים לביטוי GFP במיקרוסקופ פלואורסצנטי. הגדר את הגדלה של המיקרוסקופ ל- 10x או 20x והשתמש בעירור המתאים (460-480 ננומטר) ובטווח הפליטה (490-520 ננומטר) כדי לזהות תאים המבטאים GFP מומרים.
- לכמת את היחס בין התאים המתומרים ב-GFP לסך התאים כדי להעריך את יעילות ההתמרה הכללית.
הערה: שיעורי התמרה של 65-95% הושגו באמצעות פרוטוקול זה. יעילות טרנסדוקציה של >50% מומלצת כקריטריון של go/no-go לפני ההשתלה. אם לא ניתן להשיג יעילות התמרה של 50%, בצע בחירת פורומיצין או מיין את התאים באמצעות ציטומטריה של זרימה כדי להגדיל את התשואה של תאים מותמרים. - אופציונלי: הקפאת תאים
- סובבו את התאים כלפי מטה (300 × גרם, 5 דקות) והשליכו את ה-supernatant. בצעו החייאה של הכדור ב-1 מ"ל של מדיום הקפאה (ראו טבלת החומרים) והעבירו את התרחיף לבקבוקונים כדי לקבל 106 תאים/בקבוקון. העבר את התאים לקופסאות הקפאה למשך 24 שעות בטמפרטורה של -80 מעלות צלזיוס ולאחר מכן ל-150 מעלות צלזיוס לאחסון לטווח ארוך.
2. הכנת תאים להשתלה
- לאסוף בקבוקון של תאים מאחסון של -150 מעלות צלזיוס ולהעביר אותו למעבדה. ספרו את התאים באמצעות מונה תאים אוטומטי.
הערה: הבקבוקון מכיל 1.5-2 × 106 תאים. - העבירו במהירות את הבקבוקון לאמבט מים של 37 מעלות צלזיוס עד שלא יישארו גבישי קרח (2-3 דקות).
הערה: חשוב להפשיר במהירות כדי למזער כל נזק לקרומי התאים. אין לטבול את הבקבוקון לחלוטין באמבט המים מכיוון שהוא עלול להגביר את הסיכון לזיהום. - מעבירים את הבקבוקון לארון הבטיחות הביולוגית ומעבירים את כל התוכן (כ-1 מ"ל) לצינור חרוטי סטרילי של 15 מ"ל.
הערה: עבודה עם תאים שעברו התמרה לנטיווירלית דורשת BSL-2. עם זאת, תאי שטיפה ומעבר מסירים חלקיקים נגיפיים מהמדיום. מידע על המועד שבו מותרת העברה מ- BSL-2 ל- BSL-1 יש לקבל מהרשויות המקומיות. - הוסף 9 מ"ל של PBS סטרילי 1x וצנטריפוגה למשך 5 דקות ב 300 × גרם, RT.
- הסר את הסופרנאטנט על ידי שאיפה באמצעות פיפטה (1-10 מ"ל); הטה בעדינות את המתלים לכיוון קצה הפיפטה והתחל לשאוף. היזהרו לא להפריע לכדור.
- לשטוף את התאים על ידי resuspending ב 10 מ"ל של 1x PBS סטרילי.
הערה: טבל בעדינות את הצינור כדי לבצע החייאה של תאים בנפח השיורי. לאט לאט תקצצו את תרחיף התא באמצעות פיפטה של 1 מ"ל עד שהיא לא מכילה גושים או אגרגטים. - ספרו את התאים לפני הסיבוב הסופי באמצעות מונה תאים אוטומטי.
- צנטריפוגה במשך 5 דקות ב 300 × g, RT.
- הסר את הסופרנאטנט (שלב 2.5) והחזיר את גלולת התא בנפח הנדרש של PBS סטרילי לריכוז של 8 × 104 4 תאים /μL. הניחו את התאים על הקרח והשתמשו בהם להשתלה תוך 5 שעות.
הערה: נעשה שימוש בנפח של 1.6 × 105 תאים/2 μL של PBS בפרוטוקול זה.
3. הליך השתלה
- הכנה לניתוח
- לנקות ולעקר את ציוד הניתוח.
- הכן את המכשיר הסטריאוטקסי ואת מערכת משאבת המיקרו-איניג'קציה.
הערה: זה קריטי לבדוק את מזרק המילטון ואת מחט 30 G, 2 אינץ 'לפני תחילת. מכניסים את המחט לצינור המכיל 0.9% NaCl סטרילי ולאט לאט מושכים את התמיסה פנימה והחוצה. - הגדר את מכונת ההרדמה. בדוק את המכונה לפני שמערבים בעלי חיים כלשהם. נקו את תא האינדוקציה עם 70% אתנול.
- הכנת בעלי חיים
- שמור את העכברים לפחות 7 ימים לפני הניסויים בתנאים סטנדרטיים כדי לאקלם אותם.
הערה: החיות הבאות שימשו לפרוטוקול זה: נקבת NOD/SCID/IL2rγnull (30-35 גרם, הידועה גם בשם NSG) ונקבת C57BL/6J (20-25 גרם, הידועה גם בשם B6). ההליך יכול להתבצע גם עם עכברים זכרים. - מדוד את משקל הגוף של העכבר והתאם את המינון של משכך הכאבים להזרקה. יש לתת קרפרופן (5 מ"ג/ק"ג משקל גוף) באופן תוך-צפקי כדי להפחית את הכאב ו/או למנוע תגובה דלקתית.
- מרדימים את בעלי החיים באמצעות איזופלורן (3% בשלב האינדוקציה ו-1.5-2% בשלב התחזוקה במהלך הניתוח) המאדים בחמצן.
הערה: הרדמה גזית עדיפה בשל השכמה מהירה לאחר ההליך הכירורגי ומכיוון שניתן לכוונן בקלות את רמות גז ההרדמה. - השתמשו ברפלקסים נוסיספטיים כדי להבטיח שהחיה מורדמת עמוקות (למשל, צביטות בבוהן). כאשר מגיעים להרדמה עמוקה, העבירו את החיה מתא האינדוקציה למסגרת הסטריאוטקסית. יש לשמור על הרדמה באמצעות מסכת פנים.
הערה: יש לעקוב אחר קצב הנשימה באופן חזותי לאורך כל ההליך (40-60 נשימות בדקה). השתמש כרית חימום כדי למנוע היפותרמיה במהלך ההליך. - יש למרוח חומר סיכה אופתלמי כדי למנוע מהעיניים להתייבש.
- לגלח את קרקפת העכבר באמצעות סכין גילוח חשמלי ולחטא את העור בתמיסת בטאדין 5% באמצעות צמר גפן.
- אבטחו את ראש העכבר והכניסו את מוטות האוזן לתוך הבשר החיצוני.
הערה: היזהרו שלא לפגוע בעור התוף. יש למרוח משחת לידוקאין על שתי תעלות האוזן לפני החדרת חטיפי האוזניים. כדי לבדוק אם ראש החיה נמצא במצב יציב, דחפו בזהירות כלפי מטה את הראש כדי לראות אם יש תנועה. אם מציינים את התנועה, או שמוט האוזן, מיקום האף או שניהם שגויים ויש להתאים אותם מחדש.
- שמור את העכברים לפחות 7 ימים לפני הניסויים בתנאים סטנדרטיים כדי לאקלם אותם.
- קרניוטומיה
- השתמשו בלהב כירורגי כדי ליצור חתך לאורך קו האמצע גדול מספיק כדי לחשוף את ציוני הדרך של למבדה וברגמה.
הערה: ניתן למרוח מעכבי עור כדי לשמור על הגולגולת חשופה. - יש לסגת מהפריוסטאום והפאשיה באמצעות אזמל ולהשתמש במטושים מכותנה סטרילית כדי לייבש את משטח הגולגולת.
- התאם את מוטות האוזן והפה כדי לתקנן את תנוחת הראש.
הערה: הקואורדינטות האנכיות עבור bregma ו- lambda צריכות להיות זהות עבור מיקום anteroposterior. - מקם את המחט ב- bregma וחשב את הקואורדינטות של נקודות ההזרקה הרצויות (קואורדינטות העניין שנבחרו לפרוטוקול זה: קדמי-אחורי (AP): + 0.5 מ"מ, מדיאלי-לרוחב (ML): + 1.5 מ"מ). הזז את המחט לנקודה זו וסמן אותה בדיו.
הערה: הקואורדינטות נבחרו על סמך אטלס המוח של פרנקלין ופקסינוס עכבר 16. המרחקים הם מ"מ מהברגמה. - יש למרוח 0.9% NaCl סטרילי על הגולגולת ולקדוח חור בקוטר של 2-3 מ"מ דרך הגולגולת באמצעות מקדחה כירורגית דנטלית.
- הזז את המחט אל פני השטח של הדורה וחשב את קואורדינטות העומק.
- השתמשו בלהב כירורגי כדי ליצור חתך לאורך קו האמצע גדול מספיק כדי לחשוף את ציוני הדרך של למבדה וברגמה.
- הליך השתלה
- בצעו החייאה של התאים בצינור (שלב 2.9) ומשכו 2 μL של תרחיף התא לתוך מזרק (5 μL או 10 μL).
הערה: ודא שאין בועות אוויר בהשעיית התא. המזרק צריך להישמר במצב אופקי עד להתקנה לתוך המכשיר הסטריאוטקטי כדי למנוע משקעים בתאים. - מקם את המזרק מעל אתר היעד (קואורדינטות מחושבות: AP: + 0.5 מ"מ, ML: + 1.5 מ"מ) והעביר באיטיות את המחט אל פני השטח של הדורה.
הערה: אם אינך בטוח לגבי הקואורדינטות הנכונות, בצע זריקות עם צבע והערכה היסטולוגית של אתר ההזרקה לפני השתלת התאים (לפרטים נוספים, ראה 17). - הנחה את המחט בקצב של 0.02 מ"מ לשנייה לתוך המוח עד לעומק המתאים (הקואורדינטות שנבחרו לפרוטוקול זה הן גחון-גב (DV) - 0.8 מ"מ). נצלו את העומק ב-0.1 מ"מ ומשכו את המחט באותו מרחק כדי ליצור כיס לתאים המוזרקים.
- יש למרוח דבק רקמה סביב המחט באמצעות מלקחיים כדי למנוע דליפה של תאים.
- הזריקו 2 μL של תרחיף התא המוכן בקצב קבוע של 3-5 nL/s.
הערה: הליך ההזרקה יימשך בין 7 ל -12 דקות. - לאחר ההזרקה, השאירו את המחט במקומה למשך 5 דקות לפחות לפני שתמשכו אותה באיטיות. יש למרוח דבק רקמה כדי לאטום את החור בגולגולת ולהמתין עוד 2 דקות.
- בצעו החייאה של התאים בצינור (שלב 2.9) ומשכו 2 μL של תרחיף התא לתוך מזרק (5 μL או 10 μL).
- תפרים ולאחר טיפול
- יש למרוח תמיסת NaCl סטרילית של 0.9% על הגולגולת החשופה כדי למנוע התייבשות.
- סגור את הפצע עם חוט תפר משי 5/0.
- הוסיפו לחות לבעל החיים עם 0.5 מ"ל של תמיסת לקטט מצלצלת המוזרקת באופן תת עורי בגב התחתון.
- הפסיקו את מסירת ההרדמה והסירו בזהירות את העכבר מהמנגנון הסטריאוטקסי והחזירו אותו לכלוב שנשמר על משטח חימום.
- עקוב אחר בעלי החיים במהלך השלב החריף שלאחר הלידה. בדקו את התפר, את משקל בעלי החיים ואת הבריאות הכללית לפחות פעמיים ביום.
4. הדמיית In vivo
- הכנת לוציפרין
- להפשיר מלח אשלגן D-לוציפרין ב-RT ולהכין תמיסת מלאי טרייה של D-לוציפרין ב-30 מ"ג/מ"ל ב-PBS.
- לעקר את תמיסת המלאי באמצעות מסנן מזרק 0.22 מיקרומטר.
הערה: מומלץ להשתמש באופן מיידי בפתרון העבודה. במידת הצורך, ניתן לאחסן לוציפרין מומס בטמפרטורה של -20 מעלות צלזיוס. עם זאת, אחסון ממושך עלול לגרום לפגיעה באות. לוציפרין הוא מגיב רגיש לאור; לשמור אותו מחוץ לאור ישיר במידת האפשר. ניתן לשקול גם מצעים חלופיים, למשל, ציקלוק, כדי לשפר את מגבלת הרזולוציה18.
- דימות
- הגדרה ראשונית
הערה: הדמיית Bioluminescence בוצעה באמצעות מערכת הדמיה in vivo (ראה טבלת החומרים) המורכבת מתא כהה ומצלמת התקן מצומד מטען מקורר (CCD).- לחץ פעמיים על סמל התוכנה Living Image ובחר מזהה משתמש מהרשימה הנפתחת.
- לחץ על אתחול בלוח הבקרה שמופיע. לאחר השלמת תהליך האתחול, תיבת הטמפרטורה בלוח הבקרה תהפוך לירוקה.
- בלוח הבקרה, סמן את התיבות 'זוהר' ו'צילום' ובחר 'חשיפה אוטומטית' (כ-60 שניות). בחר שדה ראייה (D/12.5 ס"מ נבחר עבור פרוטוקול זה). הזן את גובה הנושא (1.5 ס"מ) ובחר באפשרות שימוש במיקוד גובה הנושא. הגדר באופן ידני את הפרמטרים הבאים: binning גדול, f/2, מסנן עירור חסום ומסנן פליטה פתוח.
- קבעו את כמות ההזרקה של D-לוציפרין במשקל גוף של 300 מ"ג/ק"ג. הערה: המינון המומלץ הסטנדרטי הוא 150 מ"ג/ק"ג של D-לוציפרין. הליך זה הותאם על פי פרוטוקול המדווח על רגישות גבוהה יותר באמצעות 300 מ"ג/ק"ג18.
- להזריק את הלוציפרין באופן תוך-צפקי (i.p.).
הערה: אם החיה צריכה להיות מסוממת לפני ההזרקה, שים לב שהיא עשויה להאריך את זמן הביטוי של לוציפראז שיא. - המתן במשך 5 דקות, ולאחר מכן הרדם בעלי חיים עם אספקה רציפה של איזופלורן (4.5% בשלב האינדוקציה ו-1.5-2% בשלב התחזוקה במהלך הליך ההדמיה).
- יש למרוח חומר סיכה אופתלמי על העיניים, ולאחר מכן לגלח את בעלי החיים המסוממים באזור הראש באמצעות מכונת גילוח שיער קונבנציונלית. הניחו את בעלי החיים בתא ההדמיה והתחילו לדמיין 15 דקות לאחר הזרקת הלוציפרין על ידי לחיצה על Purchase בלוח הבקרה .
- הגדרה ראשונית
5. פרפוזיה
- מרדימים את בעלי החיים על ידי הזרקת i.p. של נתרן פנטוברביטל (150 מ"ג/ק"ג משקל גוף). המתן עד שהעכבר כבר לא יגיב לגירויים כואבים, כגון צביטות בבוהן.
- הניחו את העכבר על גבו והשתמשו בפינצטה ומספריים כדי לפתוח את חלל החזה.
- השתמש במספריים סטנדרטיים כדי לפתוח את הסרעפת.
- חשפו את הלב והכניסו מחט (מהצינור עם תמיסת צלצול/4% פרפורמלדהיד (PFA)) לתוך פסגת החדר השמאלי.
הערה: היזהרו לשמור את קצה המחט בלומן של החדר. - חותכים את החדר הימני באמצעות מספריים.
- החדרה עם תמיסת צלצול (ניתן לשמור ב- RT) למשך 3-4 דקות (קצב זרימה: 17 מ"ל לדקה). ממשיכים עד שהלב נקי.
- החלף את ה-stopcock כדי לאפשר זרימה של PFA (אחסן ב-4 °C (שמור על קרח; שמור על קרח במהלך ההליך) ונקב במשך 5 דקות נוספות (~ 100 מ"ל).
- עצרו את המשאבה והסירו את המחט מהחדר השמאלי.
הערה: הזלוף עם PFA שומר על שלמות הרקמות באופן אחיד. זה גם מקל על שימור של אות GFP בהשתלות כי אחרת עלול ללכת לאיבוד עקב דיפוזיה.
6. עיבוד
- איסוף רקמות
- הסר את הראש באמצעות מספריים סטנדרטיים ובצע חתך בקו האמצע בעור.
- הפוך את העור מעל העיניים כדי לחשוף את הגולגולת.
- התחילו מהחלק הקאודלי בנקודת העצם הקודקודית ועשו חתך קטן באמצעות מספריים קפיץ. מקדמים את המספריים באופן רוסטרלי לאורך התפר האמצעי עד לנקודה בין העיניים. התחילו שוב מהחלק הקאודלי ועשו שני חתכים מקבילים ו-4 מ"מ זה מזה במישור הסגיטלי.
הערה: היזהר שלא לפגוע במוח על ידי לחיצה על המספריים על המשטח הפנימי של הגולגולת. - השתמשו במלקחיים כדי להטות בזהירות צד אחד של העצם הקודקודית ולנתק אותה. לעשות את אותו הדבר עם הצד השני.
הערה: השתמש במיקרו-ספטולה כדי לשחרר את העצם מקום המוח; אחרת, הם עלולים לפגוע במוח תוך שבירת הגולגולת. אם חלקים מהעצם המצחית נשארים, בצעו חתך קטן כדי להטות ולנתק את צלחת העצם. - כדי לשחרר את המוח, החליקו בזהירות את המיקרוספטולה מתחת למוח (נורות חוש הריח) והטו אותה בעדינות כלפי מעלה.
- לאחר האיסוף, שמור את המוח בתמיסת PFA של 4% למשך 4-6 שעות בטמפרטורה של 4 מעלות צלזיוס. מעבירים אותו ל-PBS סטרילי 1x לאחר מכן.
- אימונוהיסטוכימיה
- העבר את המוח לתמיסה של 30% סוכרוז למשך 48 שעות לפחות בטמפרטורה של 4 מעלות צלזיוס כדי למנוע היווצרות גבישים במהלך הקפאה.
- השתמשו במיקרוטום הזזה כדי לחתוך חלקים קורונליים בעובי של 40 מיקרומטר. אסוף ואחסן את החלקים כמקטעים צפים חופשיים (בצלחת של 24 בארות) בתמיסת הגנה מפני ההקפאה (טבלה 1) בטמפרטורה של -20 מעלות צלזיוס עד לעיבוד נוסף.
- שטפו את החלקים עם 450 μL של 1x PBS עבור כל באר (3 פעמים, 5 דקות כל אחד, RT).
- חסום אתרים לא ספציפיים עם 450 μL של פתרון חסימה עבור כל באר (טבלה 1) למשך שעה אחת ב- RT.
- דגירה כל באר עם 450 μL של נוגדנים ראשוניים ב 4 °C בלילה. לדלל את הנוגדנים 1:200 בסרום חמור 3%; 0.1% טריטון-X-100 ב-PBS. כדי לזהות חומר תורם בסביבה המארחת, השתמש בנוגדן לגרעינים ספציפיים לבני אדם (נוגדן גרעינים אנטי-אנושיים, שיבוט 235-1).
- לשטוף את החלקים עם 450 μL של 1x PBS עבור כל באר (3 פעמים, 5 דקות כל אחד, RT).
- דגירה של כל באר עם 450 μL של נוגדנים משניים פלואורסצנטיים מתאימים למשך 2-3 שעות (RT). לדלל את הנוגדנים בסרום חמור 3%; 0.1% טריטון-X-100 ב-1x PBS.
- לשטוף את החלקים עם 450 μL של 1x PBS עבור כל באר (3 פעמים, 5 דקות כל אחד, RT).
- הכתימו את הגרעינים ב-450 μL של 0.1 מיקרוגרם/מ"ל 4',6-דיאמידינו-2-פנילינדול (DAPI).
תוצאות
אנו שואפים לעקוב באופן אורכי אחר תאי אב עצביים מושתלים במוח העכבר באמצעות הדמיית in vivo bioluminescence ולזהות את התאים המושתלים בניתוח היסטולוגי מאוחר יותר (איור 1A). לכן, תאי אב עצביים מומרים עם וקטור lentiviral המורכב מ- EF1α-rFluc-eGFP. לפני ההשתלה, התאים נבדקו להתמרה מוצלחת על ידי ביטוי של eGFP במבחנה (איור 1B). התאים שעברו התמרה מוצלחת הושתלו באופן סטריאוטקטי במוח העכבר בקואורדינטות הרצויות (למשל, בקליפת המוח הסנסו-מוטורית). לאחר ההשתלה, העכברים הוזרקו באופן שיטתי עם D-לוציפרין, המצע של rFluc, ועוצמות האותות של התאים המושתלים נמדדו כדי לאשר השתלה מוצלחת (איור 1C).
כדי להעריך את מגבלת הגילוי של הדמיית in vivo bioluminescence, הושתל טווח של 6,000-180,000 תאים בקליפת המוח הסנסו-מוטורית הימנית של העכבר (איור 2A). זיהינו <6,000 תאים ואות ביולומינסנציה פרופורציונליים לספירת התאים המושתלים מיד לאחר ההשתלה (איור 2B). מכיוון שמקורות התאים האנושיים הם אימונוגניים לעכברים מדוכאי חיסון, נעשה שימוש בעכברים אימונו-יעילים של NOD scid (NSG) כדי לצפות בהישרדות ארוכת הטווח של השתלות התאים. הישרדות ארוכת טווח וזיהוי של אות ביולומינסנציה למשך עד 5 שבועות אושרו לאחר השתלת תאים (איור 2C,D). התאים המושתלים זוהו בהצלחה ex vivo בניתוח היסטולוגי מאוחר יותר באמצעות כתב eGFP וחיסון עם גרעינים אנטי-אנושיים ונוגדנים מיטוכונדריאליים אנטי-אנושיים (איור 2E).
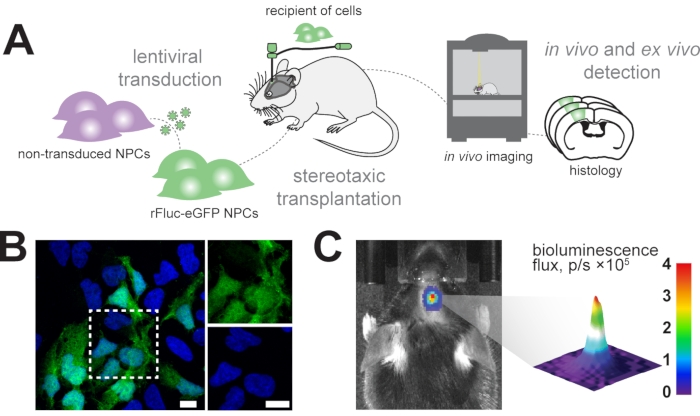
איור 1: השתלה של תאי אב עצביים. (A) סקירה סכמטית של ייצור והשתלה של NPCs rFluc-eGFP. (B) תמונת אימונופלואורסצנציה מייצגת של NPCs מותמרים (מדווח GFP, ירוק) נגד DAPI (כחול); סרגלי קנה מידה = 5 μm. (C) זיהוי In vivo של אות ביולומינסנציה בתאים מושתלים; סרגל צבע = כחול (0, דקה, ללא אות), אדום (4 שטף, p/s × 105, אות מקסימלי) קיצורים: NPCs = תאי אב עצביים; GFP = חלבון פלואורסצנטי ירוק; rFluc-eGFP = גחלילית אדומה לוציפראז וחלבון פלואורסצנטי ירוק משופר; DAPI = 4',6-diamidino-2-פנילינדול; p/s = פוטונים/ים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
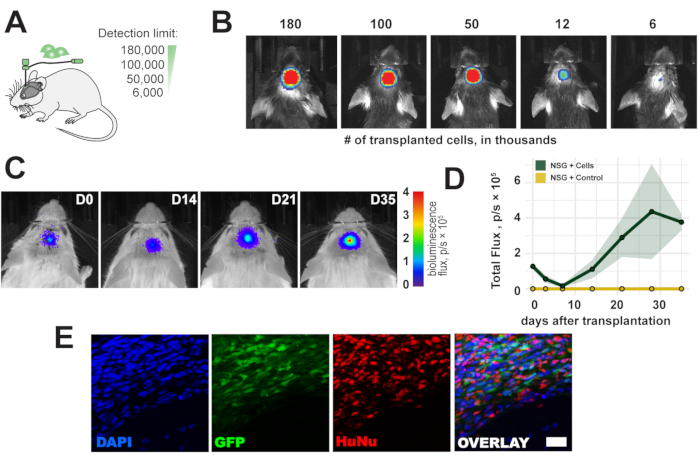
איור 2: מהלך הזמן של תאים מושתלים. (A) תצוגה סכמטית של מספרי התאים להשתלה. (B) מגבלת זיהוי של תאים מושתלים 1 שעה לאחר ההשתלה. (ג, ד) השתלת זמן (180,000 תאים) עד 35 יום בעכברי NSG ; סרגל צבע = כחול (0, דקה, ללא אות), אדום (4 שטף, p /s × 105, אות מקסימלי) הנתונים הם ממוצעים ± SEM (n = 3). (E) תמונות פלואורסצנטיות מייצגות של חלקים היסטולוגיים ותאים מושתלים 5 שבועות לאחר ההשתלה. סרגל קנה מידה = 10 μm. קיצורים: D = יום לאחר ההשתלה; NSG = גמא NOD scid scid scid של NOD; DAPI = 4',6-diamidino-2-פנילינדול; GFP = חלבון פלואורסצנטי ירוק; HuNu = נוגדן גרעינים אנטי-אנושיים, שיבוט 235-1; p/s = פוטונים/ים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
התחדשות המוח הפגוע כדי לאפשר התאוששות תפקודית נותרה אתגר שלא קיבל מענה. גישות פרה-קליניות חדשניות רבות פיתחו מיקוד, לדוגמה, אפנון חיסוני 19,20, אנגיוגנזה 1,21,22,23, שלמות מחסום דם-מוח 2,3,24,25, והחלפת תאים 5,26 . במיוחד בשנים האחרונות, טיפולים מבוססי תאים התגלו כאסטרטגיית טיפול מבטיחה למוח בשל ההתקדמות הגדולה בטכנולוגיית תאי הגזע ופרוטוקולי התמיינות יעילים15,28. מאמר זה מספק פרוטוקול רב ערך להשתלה ומעקב אחר תאים עצביים במוח העכבר. השיטה ישימה עבור כל קווי התאים הניתנים להמרה עבור יישומי in vivo במוח העכבר.
המערך המוצג משתמש בהשתלות ממקור אנושי בעכבר. השתלות אלה אינן בנות קיימא בטווח הארוך בעכברים מסוג בר בעלי יכולת חיסונית בשל אימונוגניות. לפיכך, עכברי NSG אימונו-יעילים שימשו כדי להתגבר על מגבלה זו. לחלופין, ניתן להעדיף את השימוש בהשתלות עכברים כדי להתגבר על ההיבטים האימונוגניים. אם נדרשת השתלה של תאים אנושיים, מודלים אנושיים של עכברים מייצגים חלופה מתפתחת להפחתת ההסתברות לדחיית השתל29.
וקטור נגיפי מסחרי בעל כתב כפול המורכב מלוציפראז גחלילית ו- eGFP תחת מקדם EF1α שימש כדי לדמיין את ההשתלות. מקדם זה נבחר כדי להשיג עוצמת אות גבוהה15. עם זאת, מלבד NPCs, סוגי תאים אחרים הוכחו כמעודדים תפקוד מוחי לאחר פגיעה, כולל פריסיטים30 ואסטרוציטים31; לפיכך, בהתאם לקו התאים שבו נעשה שימוש, מקדמים אחרים עשויים להיות מתאימים יותר להשגת רמות ביטוי גבוהות. בנוסף, השימוש במקדמי טרנסג'נדרים, כגון CMV, עלול להוביל להפחתת הרגולציה, במיוחד בניסויים ארוכי טווח32. יעילות ההעתקה של וקטור הלנטי-ויראלי תלויה מאוד בקו התאים המשומש ועשויה להשתנות בין ניסויים בודדים. לכן, יש להעריך את יעילות ההעתקה לפני תחילת ניסויי ה-in vivo ולתקן את השינויים ביעילות ההתמרה בין הניסויים. אזור המוח של ההשתלה משפיע גם על עוצמת האות. אף על פי שהושגה מגבלת זיהוי של <6,000 תאים להשתלות קליפת המוח, ייתכן שיהיה צורך בתאים רבים יותר כדי לזהות אות באזורים עמוקים יותר במוח, לדוגמה, סטריאטום או היפוקמפוס.
נפחי ההשתלה במוח העכבר מוגבלים ל-1-2 μL. לכן, חשוב לזהות מספר תא מתאים לניסויים. זה כבר ציין בעבר כי הגדלת מספר התאים מוביל לירידה בשיעור ההישרדות, ככל הנראה בשל זמינות מוגבלת של חומרים מזינים וחמצן באזור ההשתלה33. הדמיית in vivo bioluminescence מספקת רזולוציה מרחבית נמוכה יחסית בהשוואה לשיטות הדמיה in vivo אחרות כגון MRI או CT. לכן, נתיבי נדידה קצרים של תאים מושתלים יכולים להיות מוערכים באופן מהימן רק בניתוח שלאחר ההוק הבא.
עוצמת האות המוחלטת של הביולומינסנציה פרופורציונלית בדרך כלל למספר התא המושתל. עם זאת, עוצמת האות עשויה להיות מופחתת אם שתלים מושתלים במבנים מוחיים עמוקים יותר או אם עוצמת האות נמצאת מחוץ לספקטרום הגילוי הליניארי של מערכת ההדמיה in vivo . נכון לעכשיו, מצעים חדשניים מפותחים כדי להבטיח חדירה יעילה יותר על פני מחסום הדם-מוח מאשר D-לוציפרין, כולל cycluc1. מצעים אלה עשויים לשפר עוד יותר את מגבלת הגילוי של התאים המושתלים בעתיד18. באופן כללי, פרוטוקול זה מאפשר הליך פשוט, זעיר פולשני להשתלה ולהתבוננות בשתלים במוח העכבר.
Disclosures
למחברים אין ניגודי עניינים פוטנציאליים להצהיר עליהם.
Acknowledgements
המחברים RR ו- CT מכירים בתמיכה של קרן Mäxi ומרכז הכשירות 3R.
Materials
| Name | Company | Catalog Number | Comments |
| Viral Transduction | |||
| pLL-EF1a-rFLuc-T2A-GFP-mPGK-Puro (Lenti-Labeler virus) | Systembio | LL410VA-1 | |
| Consumables | |||
| Eppendorf microtubes; 1.5 mL | Sigma Aldrich | Z606340 | |
| Falcon Tubes; 15 mL | TPP | 91015 | |
| Microscope cover slips | Product of choice | ||
| Microscope slides | Product of choice | ||
| Sterlie cotton swabs | Product of choice | ||
| Sutures; 5/0 silk with curved needle | B. Braun | G0762482 | |
| Syringe filter; 0.22 µm | TPP | 99722 | |
| Syringe; 1 mL and 0.5 mL | B. Braun | 9166017V | |
| Tissue culture plate (24-well) | TPP | 92024 | |
| Equipment | |||
| Automated cell counter (Vi-CELL XR) | Beckmann Coulter Life Science | 383721 | |
| Forceps | Fine Science Tools | 11064-07 | |
| Forceps, fine | Fine Science Tools | 11412-11 | |
| Heating pad | Product of choice | ||
| High Speed Brushless Micromotor Kit | Foredom | K.1060-22. | |
| Ideal Micro Drill Burr Set Of 5 | Cell Point Specific | 60-1000 | |
| In-Vivo imaging system (IVIS Lumina III with Living Imaging 4.2 software package) | Perkin Elmer | CLS136334 | |
| Isoflurane vaporizer | Provet AG | 330724 | |
| Microinjection Syringe Pump system | World Precision Instruments | UMP3T-1 | |
| Microliter syringe; 700-Series; Volume: 5-10 µL | Hamilton | 7635-01 | |
| Microtome | Leica | HM430 | |
| NanoFill-33 G-Needle (removable and reusable) | World Precision Instruments | NF33BV-2 | |
| Needle Holder | Fine Science Tools | 12001-13 | |
| Perfusion pump and tubing | Masterflex | HV-77120-42 | |
| Scalpel | Fine Science Tools | 10003-12 | |
| Small bonn scissors, straight | Fine Science Tools | 14184-09 | |
| Small spring scissors, straight | Fine Science Tools | 15000-03 | |
| Spatula | Merck | Z243213-2EA | |
| Stereotaxic frame for rodents; motorized | World Precision Instruments | 99401 | |
| Pharmaceuticals and Reagents | |||
| Accutase | Invitrogen | A11105-01 | Proteolytic and collagenolytic; cell dissociation reagent |
| Anti-Human Nuclei Antibody, clone 235-1, Biotin Conjugate | Merck | MAB1281B | |
| B27 – Supplement (50x) | Gibco | 17504-001 | |
| Betadine (11 mg Iod als Povidon-Iod pro 1 ml Lösung) | Mundipharma Medical Company | All pharmaceuticals were provided by the cantonal pharmacy, Zurich, Switzerland | |
| Blocking solution (3% donkey serum; 0.1% Triton-X-100 in PBS) | Product of choice; can be homemade | ||
| CHIR99021 (10 mM – 2,500x) | StemMACS | 130-103-926 | |
| Cryoprotectant solution | Product of choice; can be homemade | ||
| DAPI solution (1 mg/mL) | Thermo Fisher Scientific | 62248 | |
| D-Luciferin Potassium Salt | Perkin Elmer | 122799 | |
| DMEM/F12 | Gibco | 11320-074 | |
| Donkey anti-Mouse IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 555 | Invitrogen | A-31570 | |
| Donkey serum | Product of choice | ||
| Esconarcon (Pentobarbitalum natricum 300 mg) | Streuli Pharma AG | All pharmaceuticals were provided by the cantonal pharmacy, Zurich, Switzerland | |
| Ethanol; 70% | Product of choice | ||
| FGF Basic recombinant human protein, Animal-origin free | Thermo Fisher Scientific | PHG6015 | |
| Glutamax (100x) | Gibco | A12860-01 | |
| hLif (10 µg/mL – 1,000x) | PeproTech | AF-300-05-25UG | |
| Isoflurane (Isofluran (1-Chlor-2,2,2-trifluorethyl-difluoromethylether) 99.9%) | Provet AG | All pharmaceuticals were provided by the cantonal pharmacy, Zurich, Switzerland | |
| Laminin-L521 (L-521) | Biolaminin LN | LN521 | |
| Lidocaine ointment (Lidocain: 25 mg , Prilocain: 25 mg) | Aspen Pharma Schweiz GmbH | All pharmaceuticals were provided by the cantonal pharmacy, Zurich, Switzerland | |
| Mounting Medium | Product of choice; can be homemade | ||
| N2- Supplement (100x) | Gibco | 75202-001 | |
| Neurobasal | Gibco | 21103-049 | |
| Ophtalmic lubricant (Retinol palmitat: 15,000 UI) | Bausch & Lomb Swiss AG | All pharmaceuticals were provided by the cantonal pharmacy, Zurich, Switzerland | |
| Paraformaldehyde solution | Product of choice | ||
| PBS | Thermo Fisher Scientific | 10010023 | Can also be homemade |
| Poly-L-ornithine Solution (pLO) | Sigma-Aldrich | P4957 | |
| Rimadyl (Carprofen 50 mg) | Zoetis Schweiz GmbH | All pharmaceuticals were provided by the cantonal pharmacy, Zurich, Switzerland | |
| Ringer lactate | B. Braun | 3570500 | |
| Ringer solution | B. Braun | 3570030 | |
| Saline (0.9% NaCl) | B. Braun | 3570160 | |
| SB431542 (10 mM – 3,333.3x) | StemMACS | 130-106-543 | |
| Tissue Adhesive (Histoacryl) | B. Braun | 1050060 |
References
- Rust, R., et al. Nogo-A targeted therapy promotes vascular repair and functional recovery following stroke. Proceedings of the National Academy of Sciences of the United States of America. 116 (28), 14270-14279 (2019).
- Rust, R., et al. Anti-Nogo-A antibodies prevent vascular leakage and act as pro-angiogenic factors following stroke. Scientific Reports. 9 (1), 20040 (2019).
- Weber, R. Z., et al. Characterization of the blood brain barrier disruption in the photothrombotic stroke model. Frontiers in Physiology. 11, 58226 (2020).
- Sweeney, M. D., Sagare, A. P., Zlokovic, B. V. Blood-brain barrier breakdown in Alzheimer's disease and other neurodegenerative disorders. Nature Reviews. Neurology. 14 (3), 133-150 (2018).
- Wang, Y., et al. 3K3A-APC stimulates post-ischemic neuronal repair by human neural stem cells in mice. Nature Medicine. 22 (9), 1050-1055 (2016).
- Llorente, I. L., et al. Patient-derived glial enriched progenitors repair functional deficits due to white matter stroke and vascular dementia in rodents. Science Translational Medicine. 13 (590), (2021).
- Kokaia, Z., Llorente, I. L., Carmichael, S. T. Customized brain cells for stroke patients using pluripotent stem cells. Stroke. 49 (5), 1091-1098 (2018).
- Parmar, M., Grealish, S., Henchcliffe, C. The future of stem cell therapies for Parkinson disease. Nature Reviews Neuroscience. 21 (2), 103-115 (2020).
- Galgano, M., et al. Traumatic brain injury: current treatment strategies and future endeavors. Cell Transplantation. 26 (7), 1118-1130 (2017).
- Schweitzer, J. S., et al. Personalized iPSC-derived dopamine progenitor cells for Parkinson's disease. The New England Journal of Medicine. 382 (20), 1926-1932 (2020).
- Muir, K. W., et al. Intracerebral implantation of human neural stem cells and motor recovery after stroke: multicentre prospective single-arm study (PISCES-2). Journal of Neurology, Neurosurgery & Psychiatry. 91 (4), 396-401 (2020).
- Kawabori, M., et al. Cell therapy for chronic TBI: interim analysis of the randomized controlled STEMTRA trial. Neurology. 96 (8), 1202-1214 (2021).
- George, P. M., et al. Engineered stem cell mimics to enhance stroke recovery. Biomaterials. 178, 63-72 (2018).
- Sancho-Martinez, I., et al. Establishment of human iPSC-based models for the study and targeting of glioma initiating cells. Nature Communications. 7 (1), 1-14 (2016).
- Rust, R., et al. Xeno-free induced pluripotent stem cell-derived neural progenitor cells for in vivo applications. bioRxiv. , (2022).
- Franklin, K., Paxinos, G. . Paxinos and Franklin's the Mouse brain in stereotaxic coordinates, compact: The coronal plates and diagrams. , (2019).
- Baker, S., Götz, J. A local insult of okadaic acid in wild-type mice induces tau phosphorylation and protein aggregation in anatomically distinct brain regions. Acta Neuropathologica Communications. 4, 32 (2016).
- Cao, J., et al. In vivo optical imaging of myelination events in a myelin basic protein promoter-driven luciferase transgenic mouse model. ASN Neuro. 10, (2018).
- Aswendt, M., Adamczak, J., Couillard-Despres, S., Hoehn, M. Boosting bioluminescence neuroimaging: an optimized protocol for brain studies. PLoS One. 8 (2), 55662 (2013).
- Roth, S., et al. Brain-released alarmins and stress response synergize in accelerating atherosclerosis progression after stroke. Science Translational Medicine. 10 (432), (2018).
- Rust, R., Hofer, A. -. S., Schwab, M. E. Stroke promotes systemic endothelial inflammation and atherosclerosis. Trends in Molecular Medicine. 24 (7), 593-595 (2018).
- Rust, R., Gantner, C., Schwab, M. E. Pro- and antiangiogenic therapies: current status and clinical implications. FASEB Journal. 33 (1), 34-48 (2018).
- Rust, R., Grönnert, L., Weber, R. Z., Mulders, G., Schwab, M. E. Refueling the ischemic CNS: guidance molecules for vascular repair. Trends in Neurosciences. 42 (9), 644-656 (2019).
- Nih, L. R., Gojgini, S., Carmichael, S. T., Segura, T. Dual-function injectable angiogenic biomaterial for the repair of brain tissue following stroke. Nature Materials. 17 (7), 642 (2018).
- Montagne, A., et al. Pericyte degeneration causes white matter dysfunction in the mouse central nervous system. Nature Medicine. 24 (3), 326-337 (2018).
- Montagne, A., et al. APOE4 leads to blood-brain barrier dysfunction predicting cognitive decline. Nature. 581 (7806), 71-76 (2020).
- George, P. M., Steinberg, G. K. Novel stroke therapeutics: unraveling stroke pathophysiology and its impact on clinical treatments. Neuron. 87 (2), 297-309 (2015).
- Weber, R. Z., et al. Deep learning based behavioral profiling of rodent stroke recovery. bioRxiv. , (2021).
- Nair, R. R., et al. Uses for humanised mouse models in precision medicine for neurodegenerative disease. Mammalian Genome. 30 (7), 173-191 (2019).
- Kirabali, T., Rust, R. iPS-derived pericytes for neurovascular regeneration. European Journal of Clinical Investigation. 51 (9), 13601 (2021).
- Weber, R. Z., Perron, P., Rust, R. Astrocytes for brain repair: More than just a neuron's sidekick. Brain Pathology. 31 (5), 12999 (2021).
- Johansen, J., et al. Evaluation of Tet-on system to avoid transgene down-regulation in ex vivo gene transfer to the CNS. Gene Therapy. 9 (19), 1291-1301 (2002).
- Vogel, S., et al. Initial graft size and not the innate immune response limit survival of engrafted neural stem cells. Journal of Tissue Engineering and Regenerative Medicine. 12 (3), 784-793 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved