Method Article
Intracerebrale Transplantation und In Vivo Biolumineszenz-Tracking von menschlichen neuralen Vorläuferzellen im Gehirn der Maus
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Wir beschreiben die intraparenchymale Transplantation von humanen neuralen Vorläuferzellen, die mit einem dualen Reportervektor transduziert werden, der Luciferase-grün fluoreszierendes Protein (GFP) im Gehirn der Maus exprimiert. Nach der Transplantation wird das Luciferase-Signal wiederholt mit In-vivo-Biolumineszenz und GFP-exprimierenden transplantierten Zellen gemessen, die in Hirnschnitten mittels Fluoreszenzmikroskopie identifiziert wurden.
Zusammenfassung
Die Zelltherapie ist seit langem ein aufstrebendes Behandlungsparadigma in der experimentellen Neurobiologie. Zelltransplantationsstudien stützen sich jedoch häufig auf Endpunktmessungen und können daher longitudinale Veränderungen der Zellmigration und des Überlebens nur in begrenztem Umfang bewerten. Dieses Papier bietet ein zuverlässiges, minimal-invasives Protokoll zur Transplantation und Längsverfolgung neuronaler Vorläuferzellen (NPCs) im erwachsenen Mäusegehirn. Vor der Transplantation werden die Zellen mit einem lentiviralen Vektor transduziert, der einen biolumineszenten (Firefly-Luciferase) und fluoreszierenden (grün fluoreszierendes Protein [GFP]) Reporter umfasst. Die NPCs werden mit Hilfe stereotaxischer Injektionen in den sensomotorischen Kortex in die richtige kortikale Hemisphäre transplantiert. Nach der Transplantation wurden gepfropfte Zellen bis zu fünf Wochen (an den Tagen 0, 3, 14, 21, 35) mit einer Auflösungsgrenze von 6.000 Zellen mittels In-vivo-Biolumineszenz-Bildgebung durch den intakten Schädel nachgewiesen. Anschließend werden die transplantierten Zellen in histologischen Hirnschnitten identifiziert und weiter mit Immunfluoreszenz charakterisiert. Somit bietet dieses Protokoll ein wertvolles Werkzeug, um Zellen im Gehirn der Maus zu transplantieren, zu verfolgen, zu quantifizieren und zu charakterisieren.
Einleitung
Das Gehirn von Säugetieren hat nach Verletzungen oder Krankheiten begrenzte Regenerationsfähigkeiten, was innovative Strategien zur Förderung der Gewebe- und Funktionsreparatur erfordert. Präklinische Strategien konzentrieren sich auf verschiedene Aspekte der Gehirnregeneration, einschließlich Neuroprotektion, Neurogenese, Angiogenese 1,2, Blut-Hirn-Schranken-Reparatur 3,4 oder Zelltherapie 5,6. Die Zelltherapie hat den Vorteil, dass sie viele dieser Pro-Reparatur-Prozesse gleichzeitig fördern kann. In Experimenten mit der Transplantation von Zellen erfolgte die Gewebereparatur durch (1) direkten Zellersatz und (2) Produktion von Zytokinen, was zu Angiogenese und Neurogenese führte7. Jüngste Fortschritte in der Stammzelltechnologie haben die Entwicklung skalierbarer, gut charakterisierter neuronaler Zellquellen, die jetzt für klinische Studien in der Pipeline sind (überprüft in 7,8,9), weiter erleichtert. Obwohl Zelltherapien für einige neurologische Erkrankungen (z. B. Parkinson-Krankheit10, Schlaganfall 11 und Rückenmarksverletzung12) das klinische Stadium erreicht haben, war ihre Wirksamkeit variabel, und es ist mehr präklinische Forschung erforderlich, um die Mechanismen der Transplantat-Wirt-Interaktionen zu verstehen.
Eine wesentliche Einschränkung vieler präklinischer Studien ist die kontinuierliche Verfolgung der transplantierten Zellen im Wirt. Oft werden nur Endpunktmessungen durchgeführt, wobei die dynamischen Migrations- und Überlebensprozesse im Wirt ausgelassenwerden 6,13. Diese Einschränkungen führen zu einer schlechten Charakterisierung der transplantierten Zellen und erfordern hohe Tierzahlen, um Längsschnittveränderungen zu verstehen. Um diese Einschränkungen zu überwinden, transduzieren wir in dieser Studie induzierte pluripotente Stammzellen (iPSC)-abgeleitete neuronale Vorläuferzellen mit einem kommerziell erhältlichen lentiviralen Dual-Reporter-Vektor, der aus roter Glühwürmchen-Luciferase und verbessertem grün fluoreszierendem Protein (rFluc-eGFP) besteht. Diese Zellen werden über eine stereotaktische intraparenchymale Injektion in das Gehirn der Maus transplantiert und mit Hilfe der in vivo Biolumineszenzbildgebung über 5 Wochen longitudinal verfolgt. Nach der Hirngewebeentnahme werden die GFP-exprimierenden transplantierten Zellen identifiziert und in histologischen Hirnschnitten weiter charakterisiert. Diese Methode kann nahtlos an alternative transduzierbare Zellquellen und Transplantationswege für In-vivo-Anwendungen im Nagetiergehirn angepasst werden. Insgesamt ist das Verfahren wertvoll, um Längsschnittinformationen über das Überleben und die Migration von Transplantaten im Gehirn der Maus zu erhalten und die anschließende histologische Charakterisierung zu erleichtern.
Protokoll
HINWEIS: Alle Experimente mit Mäusen wurden in Übereinstimmung mit den staatlichen, institutionellen und ARRIVE-Richtlinien durchgeführt und vom kantonalen Veterinäramt Zürich genehmigt. Erwachsene männliche und weibliche nicht-fettleibige diabetische SCID gamma (NSG) Mäuse (10-14 Wochen, 25-35 g) wurden verwendet. Die Mäuse wurden in regulären Käfigen des Typs II/III in Gruppen von mindestens zwei Tieren pro Käfig in einem feuchtigkeits- und temperaturkontrollierten Raum mit einem konstanten Hell/Dunkel-Zyklus von 12/12 h untergebracht. .).
1. Zellkultur und Virustransduktion
- Differenzieren Sie neuronale Vorläuferzellen (NPCs) von iPS-Zellen unter Verwendung von niedermolekularen Inhibitoren, wie zuvor beschrieben14.
- Kultur-NPCs15 ab Passage 2 in Neural Stem cell Maintenance Medium (NSMM; Tabelle 1) ergänzt mit kleinen Molekülen (Tabelle 1) in 6-Well-Platten (2 ml Medium pro Well), die mit Poly-Ornithin/Laminin521 (pLO/L521) beschichtet sind. Wechseln Sie das Medium täglich.
HINWEIS: Um NPCs zu passieren, fügen Sie 1 ml Zelldissoziationsreagenz pro Vertiefung hinzu (siehe Materialtabelle) und inkubieren Sie bei 37 ° C für 1 Minute, bis sich die meisten Zellen lösen.- Für die Beschichtung 150 μL pLO in 1 ml 0,1 M phosphatgepufferter Kochsalzlösung (PBS) pro Vertiefung für 2 Stunden bei Raumtemperatur (RT) inkubieren. Nach drei Wäschen mit PBS 10 μg L521 in 1 ml PBS pro Bohrung für 2 h bei RT inkubieren.
- Für die virale Transduktion werden 50.000 Zellen pro Vertiefung in einer mit pLO/L521 beschichteten 24-Well-Platte plattiert und vorverpackte virale Vektoren (pLL-EF1a-rFLuc-T2A-GFP-mPGK-Puro, LL410PA-1) zu jeder Vertiefung hinzugefügt.
HINWEIS: Die Gesamtzahl der bereitgestellten infektiösen Einheiten (IFU) beträgt >2 × 106 IFU und reicht aus, um 100.000 Zellen bei einer Multiplizität von Infektionen (MOI) von 20 zu infizieren. Die Zellzählung wurde mit einem automatisierten Zellzähler durchgeführt. Die Transduktionseffizienz hängt stark von der verwendeten Zelllinie ab. Die Arbeit mit dem Lentivirus erfordert die Einhaltung der lokalen Richtlinien für Produkte der Biosicherheitsstufe 2 (BSL-2). - Inkubieren Sie die Zellen bei 37 °C für 72 h, während Sie die täglichen Mediumswechsel fortsetzen.
- Bestätigen Sie die erfolgreiche Transduktion, indem Sie die Zellen in einem Fluoreszenzmikroskop auf GFP-Expression überprüfen. Stellen Sie die Vergrößerung des Mikroskops auf 10x oder 20x ein und verwenden Sie den entsprechenden Anregungs- (460-480 nm) und Emissionsbereich (490-520 nm), um transduzierte GFP-exprimierende Zellen zu erkennen.
- Quantifizieren Sie das Verhältnis von GFP-transduzierten zu Gesamtzellen, um die allgemeine Transduktionswirksamkeit abzuschätzen.
HINWEIS: Mit diesem Protokoll wurden Transduktionsraten von 65-95% erreicht. Eine Transduktionswirksamkeit von >50% wird als Go/No-Go-Kriterium vor der Transplantation empfohlen. Wenn eine Transduktionseffizienz von 50% nicht erreicht werden kann, führen Sie eine Puromycin-Selektion durch oder sortieren Sie die Zellen mittels Durchflusszytometrie, um die Ausbeute der transduzierten Zellen zu erhöhen. - Optional: Einfrieren von Zellen
- Drehen Sie die Zellen nach unten (300 × g, 5 min) und verwerfen Sie den Überstand. Resuspendiert das Pellet in 1 ml Gefriermedium (siehe Materialtabelle) und überträgt die Suspension in Durchstechflaschen, um 106 Zellen/Durchstechflasche zu erhalten. Die Zellen für 24 h bei -80 °C in Gefrierboxen und dann zur Langzeitlagerung auf -150 °C überführen.
2. Zellvorbereitung für die Transplantation
- Sammeln Sie eine Durchstechflasche mit Zellen aus der Lagerung von -150 °C und bringen Sie sie ins Labor. Zählen Sie die Zellen mithilfe eines automatisierten Zellzählers.
HINWEIS: Die Durchstechflasche enthält 1,5-2 × 106 Zellen. - Überführen Sie das Fläschchen schnell in ein 37 ° C warmes Wasserbad, bis keine Eiskristalle mehr vorhanden sind (2-3 min).
HINWEIS: Es ist wichtig, schnell aufzutauen, um Schäden an Zellmembranen zu minimieren. Tauchen Sie die Durchstechflasche nicht vollständig in das Wasserbad, da dies das Risiko einer Kontamination erhöhen kann. - Die Durchstechflasche in die Biosicherheitskabine geben und den gesamten Inhalt (~1 ml) in ein steriles 15 mL konisches Röhrchen pipettieren.
HINWEIS: Die Arbeit mit lentiviral transduzierten Zellen erfordert BSL-2. Wasch- und Passierzellen entfernen jedoch virale Partikel aus dem Medium. Informationen darüber, wann ein Transfer von BSL-2 zu BSL-1 zulässig ist, sollten von den lokalen Behörden eingeholt werden. - Fügen Sie 9 ml steriles 1x PBS hinzu und zentrifugieren Sie für 5 min bei 300 × g, RT.
- Entfernen Sie den Überstand durch Aspiration mit einer Pipette (1-10 ml); Neigen Sie die Aufhängung vorsichtig zur Pipettenspitze und beginnen Sie mit dem Absaugen. Achten Sie darauf, das Pellet nicht zu stören.
- Waschen Sie die Zellen, indem Sie in 10 ml sterilem 1x PBS resuspendieren.
HINWEIS: Halten Sie die Röhre vorsichtig fest, um die Zellen im Restvolumen zu resuspendieren. Triturate die Zellsuspension langsam mit einer 1 ml Pipette, bis sie keine Klumpen oder Aggregate mehr enthält. - Zählen Sie die Zellen vor dem letzten Spin mit einem automatisierten Zellzähler.
- Zentrifuge für 5 min bei 300 × g, RT.
- Entfernen Sie den Überstand (Schritt 2.5) und suspendieren Sie das Zellpellet im erforderlichen Volumen sterilen PBS auf eine Konzentration von 8 × 104 Zellen/μL. Legen Sie die Zellen auf Eis und verwenden Sie sie für die Transplantation innerhalb der nächsten 5h.
HINWEIS: In diesem Protokoll wurde ein Volumen von 1,6 × 105 Zellen/2 μL PBS verwendet.
3. Transplantationsverfahren
- Vorbereitung auf die Operation
- Reinigen und sterilisieren Sie die chirurgischen Geräte.
- Bereiten Sie das stereotaktische Gerät und das Mikroinjektionspumpensystem vor.
HINWEIS: Es ist wichtig, die Hamilton-Spritze und die 30 G, 2-Zoll-Nadel vor dem Start zu testen. Führen Sie die Nadel in ein Röhrchen mit sterilem 0,9% NaCl ein und ziehen Sie die Lösung langsam ein und aus. - Richten Sie das Anästhesiegerät ein. Testen Sie die Maschine, bevor Sie Tiere einbeziehen. Reinigen Sie die Induktionskammer mit 70% Ethanol.
- Vorbereitung von Tieren
- Halten Sie die Mäuse mindestens 7 Tage vor den Experimenten unter Standardbedingungen, um sie zu akklimatisieren.
HINWEIS: Die folgenden Tiere wurden für dieses Protokoll verwendet: weibliches NOD/SCID/IL2rγnull (30-35 g, auch bekannt als NSG) und weibliches C57BL/6J (20-25 g, auch bekannt als B6). Das Verfahren kann auch mit männlichen Mäusen durchgeführt werden. - Messen Sie das Körpergewicht der Maus und passen Sie die Dosis des zu injizierenden Schmerzmittels an. Carprofen (5 mg/kg Körpergewicht) intraperitoneal verabreichen, um Schmerzen zu lindern und/oder eine Entzündungsreaktion zu verhindern.
- Anästhesieren Sie die Tiere mit Isofluran (3% in der Induktionsphase und 1,5-2% in der Erhaltungsphase während der Operation), das in Sauerstoff verdampft ist.
HINWEIS: Die Gasanästhesie wird aufgrund eines schnellen Aufwachens nach dem chirurgischen Eingriff und der einfachen Einstellung des Anästhesiegasgehalts bevorzugt. - Verwenden Sie nozizeptive Reflexe, um sicherzustellen, dass das Tier tief betäubt ist (z. B. Zehenkneifen). Wenn die Tiefenanästhesie erreicht ist, transportieren Sie das Tier von der Induktionskammer in den stereotaktischen Rahmen. Halten Sie die Anästhesie mit einer Gesichtsmaske aufrecht.
HINWEIS: Die Atemfrequenz muss während des gesamten Eingriffs visuell überwacht werden (40-60 Atemzüge pro Minute). Verwenden Sie ein Wärmekissen, um Unterkühlung während des Eingriffs zu vermeiden. - Tragen Sie ophthalmisches Gleitmittel auf, um ein Austrocknen der Augen zu verhindern.
- Rasieren Sie die Kopfhaut der Maus mit einem elektrischen Rasierer und desinfizieren Sie die Haut mit 5% iger Betadinlösung mit Wattestäbchen.
- Befestigen Sie den Mauskopf und setzen Sie die Ohrstangen in den äußeren Meatus ein.
HINWEIS: Achten Sie darauf, das Trommelfell nicht zu beschädigen. Tragen Sie Lidocain-Salbe auf beide Gehörgänge auf, bevor Sie die Ohrstangen einsetzen. Um zu überprüfen, ob sich der Kopf des Tieres in einer stabilen Position befindet, drücken Sie vorsichtig auf den Kopf, um zu sehen, ob sich Bewegung befindet. Wenn Bewegung bemerkt wird, sind entweder die Ohrstange, die Platzierung des Nasenstücks oder beides falsch und müssen neu eingestellt werden.
- Halten Sie die Mäuse mindestens 7 Tage vor den Experimenten unter Standardbedingungen, um sie zu akklimatisieren.
- Kraniotomie
- Verwenden Sie eine chirurgische Klinge, um einen Schnitt entlang der Mittellinie zu machen, der groß genug ist, um die Lambda- und Bregma-Wahrzeichen zu enthüllen.
HINWEIS: Hautretraktoren können angewendet werden, um den Schädel freizulegen. - Ziehen Sie das Periost und die Faszie mit einem Skalpell zurück und verwenden Sie sterile Wattestäbchen, um die Schädeloberfläche zu trocknen.
- Passen Sie die Ohr- und Mundstangen an, um die Kopfposition zu standardisieren.
HINWEIS: Die vertikalen Koordinaten für Bregma und Lambda müssen für die anteroposteriore Positionierung identisch sein. - Legen Sie die Nadel an die Bregma und berechnen Sie die Koordinaten der gewünschten Injektionspunkte (die für dieses Protokoll ausgewählten Koordinaten: anterior-posterior (AP): + 0,5 mm, medial-lateral (ML): + 1,5 mm). Bewegen Sie die Nadel an diesen Punkt und markieren Sie sie mit Tinte.
HINWEIS: Die Koordinaten wurden basierend auf dem Franklin und Paxinos Mouse Brain Atlas 16 ausgewählt. Die Abstände vom Bregma betragen mm. - Tragen Sie sterile 0,9% NaCl auf den Schädel auf und bohren Sie mit einem chirurgischen Zahnbohrer ein Loch mit einem Durchmesser von 2-3 mm durch den Schädel.
- Bewegen Sie die Nadel an die Oberfläche der Dura und berechnen Sie die Tiefenkoordinaten.
- Verwenden Sie eine chirurgische Klinge, um einen Schnitt entlang der Mittellinie zu machen, der groß genug ist, um die Lambda- und Bregma-Wahrzeichen zu enthüllen.
- Transplantationsverfahren
- Resuspendieren Sie die Zellen im Röhrchen (Schritt 2.9) und ziehen Sie 2 μL Zellsuspension in eine Spritze (5 μL oder 10 μL).
HINWEIS: Stellen Sie sicher, dass keine Luftblasen in der Zellsuspension vorhanden sind. Die Spritze muss in einer horizontalen Position gehalten werden, bis sie in der stereotaktischen Vorrichtung montiert ist, um eine Zellsedimentation zu vermeiden. - Platzieren Sie die Spritze über der Zielstelle (berechnete Koordinaten: AP: + 0,5 mm, ML: + 1,5 mm) und bewegen Sie die Nadel langsam an die Oberfläche der Dura.
HINWEIS: Wenn Sie sich über die richtigen Koordinaten nicht sicher sind, führen Sie vor der Transplantation der Zellen Injektionen mit einem Farbstoff und einer histologischen Bewertung der Injektionsstelle durch (weitere Einzelheiten siehe 17). - Führen Sie die Nadel mit einer Geschwindigkeit von 0,02 mm/s bis zur richtigen Tiefe in das Gehirn (die für dieses Protokoll gewählte Koordinate ist dorsal-ventral (DV) - 0,8 mm). Überschreiten Sie die Tiefe um 0,1 mm und ziehen Sie die Nadel über die gleiche Entfernung zurück, um eine Tasche für die injizierten Zellen zu schaffen.
- Tragen Sie Gewebekleber mit einer Pinzette um die Nadel auf, um ein Auslaufen von Zellen zu verhindern.
- Injizieren Sie 2 μL der vorbereiteten Zellsuspension mit einer konstanten Rate von 3-5 nL/s.
HINWEIS: Der Injektionsvorgang dauert zwischen 7 und 12 Minuten. - Lassen Sie die Nadel nach der Injektion mindestens 5 Minuten an Ort und Stelle, bevor Sie sie langsam zurückziehen. Tragen Sie Gewebekleber auf, um das Loch im Schädel zu versiegeln, und warten Sie weitere 2 Minuten.
- Resuspendieren Sie die Zellen im Röhrchen (Schritt 2.9) und ziehen Sie 2 μL Zellsuspension in eine Spritze (5 μL oder 10 μL).
- Nähte und Nachsorge
- Tragen Sie sterile 0,9% ige NaCl-Lösung auf den exponierten Schädel auf, um Austrocknung zu vermeiden.
- Schließen Sie die Wunde mit einem 5/0 Seidennahtfaden.
- Hydratisieren Sie das Tier mit 0,5 ml Ringerlaktatlösung, die subkutan in den unteren Rücken injiziert wird.
- Unterbrechen Sie die Anästhesieabgabe und entfernen Sie die Maus vorsichtig aus dem stereotaktischen Gerät und legen Sie sie wieder in einen Käfig, der auf einem Heizkissen gehalten wird.
- Überwachen Sie die Tiere während der akuten Phase nach der Verletzung. Überprüfen Sie die Naht, das Tiergewicht und die allgemeine Gesundheit mindestens zweimal täglich.
4. In-vivo-Bildgebung
- Herstellung von Luciferin
- Auftauen Sie D-Luciferin-Kaliumsalz bei RT auf und bereiten Sie eine frische Stammlösung von D-Luciferin bei 30 mg/ml in PBS vor.
- Sterilisieren Sie die Stammlösung durch einen 0,22 μm Spritzenfilter.
HINWEIS: Die sofortige Verwendung der Arbeitslösung wird empfohlen. Bei Bedarf kann gelöstes Luciferin bei -20 °C gelagert werden. Eine längere Lagerung kann jedoch zu einer Verschlechterung des Signals führen. Luciferin ist ein lichtempfindliches Reagenz; Halten Sie es nach Möglichkeit aus direktem Licht heraus. Alternative Substrate, z. B. Cycluc, können ebenfalls in Betracht gezogen werden, um die Auflösungsgrenze18 zu verbessern.
- Bildgebung
- Ersteinrichtung
HINWEIS: Die Biolumineszenzbildgebung wurde mit einem In-vivo-Bildgebungssystem (siehe Materialtabelle) durchgeführt, das aus einer dunklen Kammer und einer gekühlten CCD-Kamera (Charge-Coupled Device) bestand.- Doppelklicken Sie auf das Symbol Living Image-Software und wählen Sie eine Benutzer-ID aus der Dropdown-Liste aus.
- Klicken Sie im angezeigten Bedienfeld auf Initialisieren. Sobald der Initialisierungsprozess abgeschlossen ist, wird die Temperaturbox im Bedienfeld grün.
- Aktivieren Sie im Bedienfeld die Kontrollkästchen Lumineszierend und Fotografieren und wählen Sie Automatische Belichtung (~60 s). Wählen Sie ein Sichtfeld aus (D/12,5cm wurde für dieses Protokoll ausgewählt). Geben Sie die Betreffhöhe (1,5 cm) ein und wählen Sie die Option Motivhöhe verwenden Fokusoption aus. Stellen Sie die folgenden Parameter manuell ein: großes Binning, f/2, blockierter Anregungsfilter und offener Emissionsfilter.
- Bestimmen Sie die Injektionsmenge von D-Luciferin bei 300 mg/kg Körpergewicht. HINWEIS: Die empfohlene Standarddosis beträgt 150 mg/kg D-Luciferin. Dieses Verfahren wurde gemäß einem Protokoll angepasst, das eine höhere Empfindlichkeit mit 300 mg/kg18 meldet.
- Injizieren Sie das Luciferin intraperitoneal (i.p.).
HINWEIS: Wenn das Tier vor der Injektion sediert werden muss, beachten Sie, dass es die maximale Luciferase-Expressionszeit verlängern kann. - Warten Sie 5 min, dann betäuben Sie die Tiere mit einer kontinuierlichen Zufuhr von Isofluran (4,5% in der Induktionsphase und 1,5-2% in der Erhaltungsphase während des bildgebenden Verfahrens).
- Tragen Sie Augenleitmittel auf die Augen auf und rasieren Sie dann die sedierten Tiere mit einem herkömmlichen Haarrasierer auf der Kopfregion. Legen Sie die Tiere in die Bildgebungskammer und beginnen Sie 15 Minuten nach der Luciferin-Injektion mit der Bildgebung, indem Sie im Bedienfeld auf Erfassen klicken.
- Ersteinrichtung
5. Perfusion
- Betäuben Sie die Tiere durch eine i.p. Injektion von Natriumpentobarbital (150 mg/kg Körpergewicht). Warten Sie, bis die Maus nicht mehr auf schmerzhafte Reize wie Zehenkneifen reagiert.
- Legen Sie die Maus auf den Rücken und öffnen Sie mit einer Pinzette und einer Schere die Brusthöhle.
- Verwenden Sie eine Standardschere, um die Membran zu öffnen.
- Legen Sie das Herz frei und führen Sie eine Nadel (aus dem Schlauch mit Ringer/4% Paraformaldehydlösung (PFA)) in die Spitze des linken Ventrikels ein.
HINWEIS: Achten Sie darauf, die Nadelspitze im Lumen des Ventrikels zu halten. - Schneiden Sie den rechten Ventrikel mit einer Schere ab.
- Perfuse mit Ringerlösung (kann bei RT gehalten werden) für 3-4 min (Durchflussrate: 17 ml/min). Fahren Sie fort, bis das Herz rein ist.
- Schalten Sie den Absperrhahn um, um den PFA-Fluss zu ermöglichen (bei 4 ° C lagern; während des Eingriffs auf Eis halten) und für weitere 5 Minuten (~ 100 ml) perfundieren.
- Stoppen Sie die Pumpe und entfernen Sie die Nadel aus dem linken Ventrikel.
HINWEIS: Die Perfusion mit PFA bewahrt die Gewebeintegrität gleichmäßig. Es erleichtert auch die Erhaltung des GFP-Signals in den Transplantaten, die sonst aufgrund der Diffusion verloren gehen könnten.
6. Verarbeitung
- Gewebeentnahme
- Entfernen Sie den Kopf mit einer Standardschere und machen Sie einen Mittellinienschnitt in der Haut.
- Drehen Sie die Haut über die Augen, um den Schädel freizulegen.
- Beginnen Sie mit dem Schwanzteil an der Spitze des Parietalknochens und machen Sie einen kleinen Schnitt mit einer Federschere. Bewegen Sie die Schere rostral entlang der mittelsagittalen Naht bis zu einem Punkt zwischen den Augen. Beginnen Sie erneut mit dem Schwanzteil und machen Sie zwei Schnitte parallel und ~4 mm voneinander entfernt in der Sagittalebene.
HINWEIS: Achten Sie darauf, das Gehirn nicht zu schädigen, indem Sie die Schere gegen die innere Oberfläche des Schädels drücken. - Verwenden Sie eine Pinzette, um vorsichtig eine Seite des Parietalknochens zu neigen und abzubrechen. Machen Sie dasselbe mit der anderen Seite.
HINWEIS: Verwenden Sie einen Mikrospatel, um den Knochen von den Hirnhäuten zu befreien. Andernfalls können sie das Gehirn schädigen, während sie den Schädel abbrechen. Wenn Teile des Frontalknochens verbleiben, machen Sie einen kleinen Schnitt, um die Knochenplatte zu kippen und abzubrechen. - Um das Gehirn freizusetzen, schieben Sie den Mikrospatel vorsichtig unter das Gehirn (Riechkolben) und neigen Sie ihn sanft nach oben.
- Nach dem Sammeln das Gehirn in 4% iger PFA-Lösung für 4-6 h bei 4 ° C aufbewahren. Anschließend auf steriles 1x PBS übertragen.
- Immunhistochemie
- Übertragen Sie das Gehirn für mindestens 48 h bei 4 ° C auf eine 30% ige Saccharoselösung, um die Bildung von Kristallen während des Einfrierens zu verhindern.
- Verwenden Sie ein Gleitmikrotom, um koronale Abschnitte mit einer Dicke von 40 μm zu schneiden. Die Abschnitte werden als frei schwebende Abschnitte (in einer 24-Well-Platte) in einer kryoprotektiven Lösung (Tabelle 1) bei -20 °C bis zur Weiterverarbeitung gesammelt und gelagert.
- Spülen Sie die Abschnitte mit 450 μL von 1x PBS für jede Vertiefung (3 mal, jeweils 5 min, RT).
- Blockieren Sie unspezifische Stellen mit 450 μL Blockierlösung für jede Vertiefung (Tabelle 1) für 1 h bei RT.
- Inkubieren Sie jede Vertiefung mit 450 μL primärer Antikörper bei 4 °C über Nacht. Verdünnen Sie die Antikörper 1:200 in 3% Eselserum; 0,1 % Triton-X-100 in PBS. Um Spendermaterial in der Wirtsumgebung zu identifizieren, verwenden Sie einen Antikörper gegen humanspezifische Kerne (Anti-Human Nuclei Antibody, Klon 235-1).
- Waschen Sie die Abschnitte mit 450 μL 1x PBS für jede Vertiefung (3 mal, jeweils 5 min, RT).
- Inkubieren Sie jede Vertiefung mit 450 μL entsprechender fluoreszierender sekundärer Antikörper für 2-3 h (RT). Verdünnen Sie die Antikörper in 3% Eselserum; 0,1% Triton-X-100 in 1x PBS.
- Waschen Sie die Abschnitte mit 450 μL 1x PBS für jede Vertiefung (3 mal, jeweils 5 min, RT).
- Die Kerne werden mit 450 μL 0,1 μg/ml 4',6-diamidino-2-phenylindol (DAPI) gefärbt.
Ergebnisse
Unser Ziel ist es, transplantierte neurale Vorläuferzellen im Gehirn der Maus mit Hilfe der In-vivo-Biolumineszenzbildgebung längsschnittlich zu verfolgen und die transplantierten Zellen in der anschließenden histologischen Analyse zu identifizieren (Abbildung 1A). Daher werden neurale Vorläuferzellen mit einem lentiviralen Vektor transduziert, der aus EF1α-rFluc-eGFP besteht. Vor der Transplantation wurden die Zellen auf eine erfolgreiche Transduktion durch Expression von eGFP in vitro getestet (Abbildung 1B). Die erfolgreich transduzierten Zellen wurden im Gehirn der Maus an den gewünschten Koordinaten (z.B. im sensomotorischen Kortex) stereotaktisch transplantiert. Nach der Transplantation wurde den Mäusen systemisch D-Luciferin, das Substrat für rFluc, injiziert und die Signalintensitäten der transplantierten Zellen wurden gemessen, um eine erfolgreiche Transplantation zu bestätigen (Abbildung 1C).
Um die Nachweisgrenze der in vivo Biolumineszenzbildgebung zu bewerten, wurde ein Bereich von 6.000-180.000 Zellen in den rechten sensomotorischen Kortex der Maus transplantiert (Abbildung 2A). Wir detektierten <6.000 Zellen und ein Biolumineszenzsignal proportional zur transplantierten Zellzahl direkt nach der Transplantation (Abbildung 2B). Da menschliche Zellquellen immunogen zu immunkompetenten Mäusen sind, wurden immunodefiziente NOD scid gamma (NSG) Mäuse verwendet, um das langfristige Überleben der Zelltransplantate zu beobachten. Das Langzeitüberleben und der Nachweis eines Biolumineszenzsignals für bis zu 5 Wochen wurden nach der Zelltransplantation bestätigt (Abbildung 2C,D). Die transplantierten Zellen wurden in einer anschließenden histologischen Analyse durch den eGFP-Reporter und die Immunfärbung mit antimenschlichen Kernen und antihumanen mitochondrialen Antikörpern erfolgreich ex vivo nachgewiesen (Abbildung 2E).
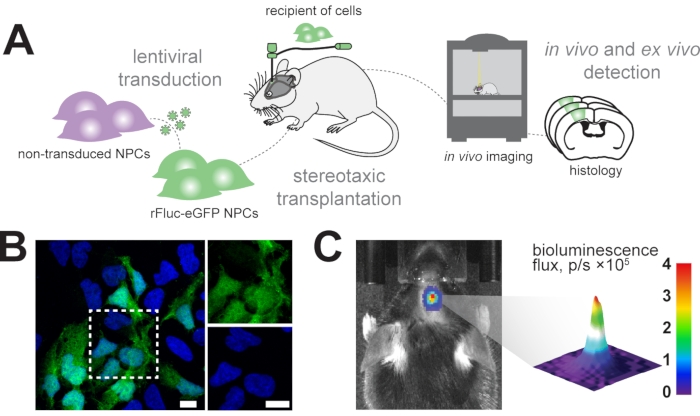
Abbildung 1: Transplantation von neuralen Vorläuferzellen . (A) Schematische Übersicht über die Erzeugung und Transplantation von rFluc-eGFP-NPCs. (B) Repräsentatives Immunfluoreszenzbild von transduzierten NPCs (GFP-Reporter, grün), die mit DAPI (blau) konterfärbt sind; Skalenbalken = 5 μm. (C) In-vivo-Nachweis des Biolumineszenzsignals in transplantierten Zellen; Farbbalken = blau (0, min, kein Signal), rot (4 Fluss, p/s × 105, max. Signal) Abkürzungen: NPCs = neurale Vorläuferzellen; GFP = grün fluoreszierendes Protein; rFluc-eGFP = rotes Glühwürmchen-Luciferase und verbessertes grün fluoreszierendes Protein; DAPI = 4',6-Diamidino-2-phenylindol; p/s = Photonen/s. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
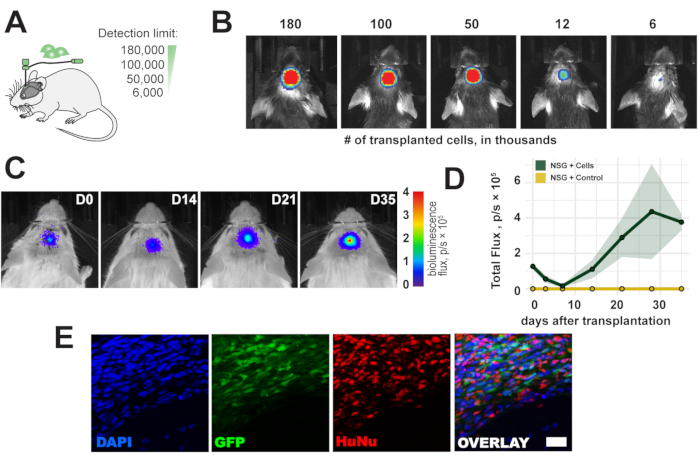
Abbildung 2: Zeitlicher Verlauf der transplantierten Zellen. (A) Schematische Darstellung der Zellnummern für die Transplantation. (B) Nachweisgrenze der transplantierten Zellen 1 h nach der Transplantation. (C, D) Zeitlicher Verlauf der Transplantation (180.000 Zellen) für bis zu 35 Tage bei NSG-Mäusen ; Farbbalken = blau (0, min, kein Signal), rot (4 Fluss, p/s × 105, max Signal) Die Daten sind Mittelwert ± SEM (n = 3). (E) Repräsentative Fluoreszenzbilder von histologischen Schnitten und transplantierten Zellen 5 Wochen nach der Transplantation. Maßstabsleiste = 10 μm. Abkürzungen: D = Tag nach der Transplantation; NSG = immundefizientes NOD scid gamma; DAPI = 4',6-Diamidino-2-phenylindol; GFP = grün fluoreszierendes Protein; HuNu = Anti-Human Nuclei Antikörper, Klon 235-1; p/s = Photonen/s. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diskussion
Die Regeneration des verletzten Gehirns, um eine funktionelle Genesung zu ermöglichen, bleibt eine ungelöste Herausforderung. Viele innovative präklinische Ansätze haben sich entwickelt, die beispielsweise auf Immunmodulation19,20, Angiogenese 1,21,22,23, Blut-Hirn-Schrank-Integrität 2,3,24,25 und Zellersatz 5,26 abzielen. . Gerade in den letzten Jahren haben sich zellbasierte Therapien aufgrund großer Fortschritte in der Stammzelltechnologie und effizienter Differenzierungsprotokolle zu einer vielversprechenden Behandlungsstrategie für das Gehirn entwickelt15,28. Dieses Papier bietet ein wertvolles Protokoll für die Transplantation und Verfolgung von Nervenzellen im Gehirn der Maus. Die Methode ist für alle transduzierbaren Zelllinien für In-vivo-Anwendungen im Gehirn der Maus anwendbar.
Das vorgestellte Setup verwendet Transplantate menschlichen Ursprungs in einer Maus. Diese Transplantate sind bei immunkompetenten Wildtypmäusen aufgrund der Immunogenität langfristig nicht lebensfähig. Daher wurden immundefiziente NSG-Mäuse verwendet, um diese Einschränkung zu überwinden. Alternativ kann die Verwendung von Maustransplantaten bevorzugt werden, um die immunogenen Aspekte zu überwinden. Wenn eine Transplantation menschlicher Zellen erforderlich ist, stellen humanisierte Mausmodelle eine aufkommende Alternative dar, um die Wahrscheinlichkeit einer Transplantatabstoßung zu verringern29.
Ein kommerzieller viraler Vektor mit zwei Reportern, bestehend aus Glühwürmchen-Luciferase und eGFP unter dem EF1α-Promotor, wurde verwendet, um die Transplantate zu visualisieren. Dieser Promotor wurde ausgewählt, um eine hohe Signalintensität15 zu erreichen. Abgesehen von NPCs wurde jedoch gezeigt, dass andere Zelltypen die Gehirnfunktion nach Verletzungen fördern, einschließlich der Perizyten30 und Astrozyten31; Daher könnten je nach verwendeter Zelllinie andere Promotoren besser geeignet sein, hohe Expressionsniveaus zu erreichen. Darüber hinaus kann die Verwendung von Transgenpromotoren wie CMV zu einer Herunterregulierung führen, insbesondere in Langzeitexperimenten32. Die Transduktionseffizienz des lentiviralen Vektors hängt stark von der verwendeten Zelllinie ab und kann zwischen einzelnen Experimenten variieren. Daher muss die Transduktionseffizienz vor Beginn der In-vivo-Experimente und zur Korrektur von Variationen der Transduktionseffizienz zwischen den Experimenten bewertet werden. Auch die Hirnregion der Transplantation beeinflusst die Signalstärke. Obwohl für kortikale Transplantationen eine Nachweisgrenze von <6.000 Zellen erreicht wurde, kann es erforderlich sein, dass mehr Zellen ein Signal in tieferen Hirnregionen, zum Beispiel Striatum- oder Hippocampus, erkennen.
Die Transplantationsvolumina im Gehirn der Maus sind auf 1-2 μL begrenzt. Daher ist es wichtig, eine geeignete Zellzahl für die Experimente zu identifizieren. Es wurde bereits beobachtet, dass steigende Zellzahlen zu einer verminderten Überlebensrate führen, höchstwahrscheinlich aufgrund der begrenzten Verfügbarkeit von Nährstoffen und Sauerstoff im Bereich derTransplantation 33. Die In-vivo-Biolumineszenzbildgebung bietet im Vergleich zu anderen In-vivo-Bildgebungsverfahren wie MRT oder CT eine relativ geringe räumliche Auflösung. Kurze Migrationswege von transplantierten Zellen können daher nur in der anschließenden Post-hoc-Analyse zuverlässig beurteilt werden.
Die absolute Signalstärke der Biolumineszenz ist im Allgemeinen proportional zur transplantierten Zellzahl. Die Signalstärke könnte jedoch reduziert werden, wenn Transplantate in tiefere Hirnstrukturen transplantiert werden oder wenn die Signalstärke außerhalb des linearen Detektionsspektrums des In-vivo-Bildgebungssystems liegt. Derzeit werden neuartige Substrate entwickelt, um eine effizientere Penetration über die Blut-Hirn-Dämpfung zu gewährleisten als D-Luciferin, einschließlich cycluc1. Diese Substrate könnten die Nachweisgrenze der transplantierten Zellen in Zukunft weiter verbessern18. Insgesamt ermöglicht dieses Protokoll ein einfaches, minimal-invasives Verfahren zur Transplantation und Beobachtung von Transplantaten im Mäusegehirn.
Offenlegungen
Die Autoren haben keine potenziellen Interessenkonflikte zu erklären.
Danksagungen
Die Autoren RR und CT bedanken sich für die Unterstützung durch die Mäxi Foundation und das 3R Competence Center.
Materialien
| Name | Company | Catalog Number | Comments |
| Viral Transduction | |||
| pLL-EF1a-rFLuc-T2A-GFP-mPGK-Puro (Lenti-Labeler virus) | Systembio | LL410VA-1 | |
| Consumables | |||
| Eppendorf microtubes; 1.5 mL | Sigma Aldrich | Z606340 | |
| Falcon Tubes; 15 mL | TPP | 91015 | |
| Microscope cover slips | Product of choice | ||
| Microscope slides | Product of choice | ||
| Sterlie cotton swabs | Product of choice | ||
| Sutures; 5/0 silk with curved needle | B. Braun | G0762482 | |
| Syringe filter; 0.22 µm | TPP | 99722 | |
| Syringe; 1 mL and 0.5 mL | B. Braun | 9166017V | |
| Tissue culture plate (24-well) | TPP | 92024 | |
| Equipment | |||
| Automated cell counter (Vi-CELL XR) | Beckmann Coulter Life Science | 383721 | |
| Forceps | Fine Science Tools | 11064-07 | |
| Forceps, fine | Fine Science Tools | 11412-11 | |
| Heating pad | Product of choice | ||
| High Speed Brushless Micromotor Kit | Foredom | K.1060-22. | |
| Ideal Micro Drill Burr Set Of 5 | Cell Point Specific | 60-1000 | |
| In-Vivo imaging system (IVIS Lumina III with Living Imaging 4.2 software package) | Perkin Elmer | CLS136334 | |
| Isoflurane vaporizer | Provet AG | 330724 | |
| Microinjection Syringe Pump system | World Precision Instruments | UMP3T-1 | |
| Microliter syringe; 700-Series; Volume: 5-10 µL | Hamilton | 7635-01 | |
| Microtome | Leica | HM430 | |
| NanoFill-33 G-Needle (removable and reusable) | World Precision Instruments | NF33BV-2 | |
| Needle Holder | Fine Science Tools | 12001-13 | |
| Perfusion pump and tubing | Masterflex | HV-77120-42 | |
| Scalpel | Fine Science Tools | 10003-12 | |
| Small bonn scissors, straight | Fine Science Tools | 14184-09 | |
| Small spring scissors, straight | Fine Science Tools | 15000-03 | |
| Spatula | Merck | Z243213-2EA | |
| Stereotaxic frame for rodents; motorized | World Precision Instruments | 99401 | |
| Pharmaceuticals and Reagents | |||
| Accutase | Invitrogen | A11105-01 | Proteolytic and collagenolytic; cell dissociation reagent |
| Anti-Human Nuclei Antibody, clone 235-1, Biotin Conjugate | Merck | MAB1281B | |
| B27 – Supplement (50x) | Gibco | 17504-001 | |
| Betadine (11 mg Iod als Povidon-Iod pro 1 ml Lösung) | Mundipharma Medical Company | All pharmaceuticals were provided by the cantonal pharmacy, Zurich, Switzerland | |
| Blocking solution (3% donkey serum; 0.1% Triton-X-100 in PBS) | Product of choice; can be homemade | ||
| CHIR99021 (10 mM – 2,500x) | StemMACS | 130-103-926 | |
| Cryoprotectant solution | Product of choice; can be homemade | ||
| DAPI solution (1 mg/mL) | Thermo Fisher Scientific | 62248 | |
| D-Luciferin Potassium Salt | Perkin Elmer | 122799 | |
| DMEM/F12 | Gibco | 11320-074 | |
| Donkey anti-Mouse IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 555 | Invitrogen | A-31570 | |
| Donkey serum | Product of choice | ||
| Esconarcon (Pentobarbitalum natricum 300 mg) | Streuli Pharma AG | All pharmaceuticals were provided by the cantonal pharmacy, Zurich, Switzerland | |
| Ethanol; 70% | Product of choice | ||
| FGF Basic recombinant human protein, Animal-origin free | Thermo Fisher Scientific | PHG6015 | |
| Glutamax (100x) | Gibco | A12860-01 | |
| hLif (10 µg/mL – 1,000x) | PeproTech | AF-300-05-25UG | |
| Isoflurane (Isofluran (1-Chlor-2,2,2-trifluorethyl-difluoromethylether) 99.9%) | Provet AG | All pharmaceuticals were provided by the cantonal pharmacy, Zurich, Switzerland | |
| Laminin-L521 (L-521) | Biolaminin LN | LN521 | |
| Lidocaine ointment (Lidocain: 25 mg , Prilocain: 25 mg) | Aspen Pharma Schweiz GmbH | All pharmaceuticals were provided by the cantonal pharmacy, Zurich, Switzerland | |
| Mounting Medium | Product of choice; can be homemade | ||
| N2- Supplement (100x) | Gibco | 75202-001 | |
| Neurobasal | Gibco | 21103-049 | |
| Ophtalmic lubricant (Retinol palmitat: 15,000 UI) | Bausch & Lomb Swiss AG | All pharmaceuticals were provided by the cantonal pharmacy, Zurich, Switzerland | |
| Paraformaldehyde solution | Product of choice | ||
| PBS | Thermo Fisher Scientific | 10010023 | Can also be homemade |
| Poly-L-ornithine Solution (pLO) | Sigma-Aldrich | P4957 | |
| Rimadyl (Carprofen 50 mg) | Zoetis Schweiz GmbH | All pharmaceuticals were provided by the cantonal pharmacy, Zurich, Switzerland | |
| Ringer lactate | B. Braun | 3570500 | |
| Ringer solution | B. Braun | 3570030 | |
| Saline (0.9% NaCl) | B. Braun | 3570160 | |
| SB431542 (10 mM – 3,333.3x) | StemMACS | 130-106-543 | |
| Tissue Adhesive (Histoacryl) | B. Braun | 1050060 |
Referenzen
- Rust, R., et al. Nogo-A targeted therapy promotes vascular repair and functional recovery following stroke. Proceedings of the National Academy of Sciences of the United States of America. 116 (28), 14270-14279 (2019).
- Rust, R., et al. Anti-Nogo-A antibodies prevent vascular leakage and act as pro-angiogenic factors following stroke. Scientific Reports. 9 (1), 20040 (2019).
- Weber, R. Z., et al. Characterization of the blood brain barrier disruption in the photothrombotic stroke model. Frontiers in Physiology. 11, 58226 (2020).
- Sweeney, M. D., Sagare, A. P., Zlokovic, B. V. Blood-brain barrier breakdown in Alzheimer's disease and other neurodegenerative disorders. Nature Reviews. Neurology. 14 (3), 133-150 (2018).
- Wang, Y., et al. 3K3A-APC stimulates post-ischemic neuronal repair by human neural stem cells in mice. Nature Medicine. 22 (9), 1050-1055 (2016).
- Llorente, I. L., et al. Patient-derived glial enriched progenitors repair functional deficits due to white matter stroke and vascular dementia in rodents. Science Translational Medicine. 13 (590), (2021).
- Kokaia, Z., Llorente, I. L., Carmichael, S. T. Customized brain cells for stroke patients using pluripotent stem cells. Stroke. 49 (5), 1091-1098 (2018).
- Parmar, M., Grealish, S., Henchcliffe, C. The future of stem cell therapies for Parkinson disease. Nature Reviews Neuroscience. 21 (2), 103-115 (2020).
- Galgano, M., et al. Traumatic brain injury: current treatment strategies and future endeavors. Cell Transplantation. 26 (7), 1118-1130 (2017).
- Schweitzer, J. S., et al. Personalized iPSC-derived dopamine progenitor cells for Parkinson's disease. The New England Journal of Medicine. 382 (20), 1926-1932 (2020).
- Muir, K. W., et al. Intracerebral implantation of human neural stem cells and motor recovery after stroke: multicentre prospective single-arm study (PISCES-2). Journal of Neurology, Neurosurgery & Psychiatry. 91 (4), 396-401 (2020).
- Kawabori, M., et al. Cell therapy for chronic TBI: interim analysis of the randomized controlled STEMTRA trial. Neurology. 96 (8), 1202-1214 (2021).
- George, P. M., et al. Engineered stem cell mimics to enhance stroke recovery. Biomaterials. 178, 63-72 (2018).
- Sancho-Martinez, I., et al. Establishment of human iPSC-based models for the study and targeting of glioma initiating cells. Nature Communications. 7 (1), 1-14 (2016).
- Rust, R., et al. Xeno-free induced pluripotent stem cell-derived neural progenitor cells for in vivo applications. bioRxiv. , (2022).
- Franklin, K., Paxinos, G. . Paxinos and Franklin's the Mouse brain in stereotaxic coordinates, compact: The coronal plates and diagrams. , (2019).
- Baker, S., Götz, J. A local insult of okadaic acid in wild-type mice induces tau phosphorylation and protein aggregation in anatomically distinct brain regions. Acta Neuropathologica Communications. 4, 32 (2016).
- Cao, J., et al. In vivo optical imaging of myelination events in a myelin basic protein promoter-driven luciferase transgenic mouse model. ASN Neuro. 10, (2018).
- Aswendt, M., Adamczak, J., Couillard-Despres, S., Hoehn, M. Boosting bioluminescence neuroimaging: an optimized protocol for brain studies. PLoS One. 8 (2), 55662 (2013).
- Roth, S., et al. Brain-released alarmins and stress response synergize in accelerating atherosclerosis progression after stroke. Science Translational Medicine. 10 (432), (2018).
- Rust, R., Hofer, A. -. S., Schwab, M. E. Stroke promotes systemic endothelial inflammation and atherosclerosis. Trends in Molecular Medicine. 24 (7), 593-595 (2018).
- Rust, R., Gantner, C., Schwab, M. E. Pro- and antiangiogenic therapies: current status and clinical implications. FASEB Journal. 33 (1), 34-48 (2018).
- Rust, R., Grönnert, L., Weber, R. Z., Mulders, G., Schwab, M. E. Refueling the ischemic CNS: guidance molecules for vascular repair. Trends in Neurosciences. 42 (9), 644-656 (2019).
- Nih, L. R., Gojgini, S., Carmichael, S. T., Segura, T. Dual-function injectable angiogenic biomaterial for the repair of brain tissue following stroke. Nature Materials. 17 (7), 642 (2018).
- Montagne, A., et al. Pericyte degeneration causes white matter dysfunction in the mouse central nervous system. Nature Medicine. 24 (3), 326-337 (2018).
- Montagne, A., et al. APOE4 leads to blood-brain barrier dysfunction predicting cognitive decline. Nature. 581 (7806), 71-76 (2020).
- George, P. M., Steinberg, G. K. Novel stroke therapeutics: unraveling stroke pathophysiology and its impact on clinical treatments. Neuron. 87 (2), 297-309 (2015).
- Weber, R. Z., et al. Deep learning based behavioral profiling of rodent stroke recovery. bioRxiv. , (2021).
- Nair, R. R., et al. Uses for humanised mouse models in precision medicine for neurodegenerative disease. Mammalian Genome. 30 (7), 173-191 (2019).
- Kirabali, T., Rust, R. iPS-derived pericytes for neurovascular regeneration. European Journal of Clinical Investigation. 51 (9), 13601 (2021).
- Weber, R. Z., Perron, P., Rust, R. Astrocytes for brain repair: More than just a neuron's sidekick. Brain Pathology. 31 (5), 12999 (2021).
- Johansen, J., et al. Evaluation of Tet-on system to avoid transgene down-regulation in ex vivo gene transfer to the CNS. Gene Therapy. 9 (19), 1291-1301 (2002).
- Vogel, S., et al. Initial graft size and not the innate immune response limit survival of engrafted neural stem cells. Journal of Tissue Engineering and Regenerative Medicine. 12 (3), 784-793 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten