Method Article
Trasplante intracerebral y seguimiento de bioluminiscencia in vivo de células progenitoras neurales humanas en el cerebro de ratón
* Estos autores han contribuido por igual
En este artículo
Resumen
Describimos el trasplante intraparenquimatoso de células progenitoras neurales humanas transducidas con un vector informador dual que expresa la proteína fluorescente verde luciferasa (GFP) en el cerebro del ratón. Después del trasplante, la señal de luciferasa se mide repetidamente utilizando bioluminiscencia in vivo y células injertadas que expresan GFP identificadas en secciones cerebrales mediante microscopía de fluorescencia.
Resumen
La terapia celular ha sido durante mucho tiempo un paradigma de tratamiento emergente en neurobiología experimental. Sin embargo, los estudios de trasplante celular a menudo se basan en mediciones de punto final y, por lo tanto, solo pueden evaluar los cambios longitudinales de la migración celular y la supervivencia en una medida limitada. Este documento proporciona un protocolo confiable y mínimamente invasivo para trasplantar y rastrear longitudinalmente las células progenitoras neurales (NPC) en el cerebro de ratón adulto. Antes del trasplante, las células se transducen con un vector lentiviral que comprende un reportero bioluminiscente (luciérnaga-luciferasa) y fluorescente (proteína fluorescente verde [GFP]). Los NPC se trasplantan al hemisferio cortical derecho mediante inyecciones estereotáxicas en la corteza sensoriomotora. Después del trasplante, se detectaron células injertadas a través del cráneo intacto durante un máximo de cinco semanas (en los días 0, 3, 14, 21, 35) con un límite de resolución de 6.000 células utilizando imágenes de bioluminiscencia in vivo . Posteriormente, las células trasplantadas se identifican en secciones histológicas del cerebro y se caracterizan con inmunofluorescencia. Por lo tanto, este protocolo proporciona una herramienta valiosa para trasplantar, rastrear, cuantificar y caracterizar células en el cerebro del ratón.
Introducción
El cerebro de los mamíferos tiene capacidades regenerativas limitadas después de una lesión o enfermedad, lo que requiere estrategias innovadoras para promover la reparación funcional y de tejidos. Las estrategias preclínicas se centran en diferentes aspectos de la regeneración cerebral, incluyendo la neuroprotección, la neurogénesis, la angiogénesis 1,2, la reparación de la barrera hematoencefálica 3,4 o la terapia celular 5,6. La terapia celular tiene la ventaja de poder promover muchos de estos procesos pro-reparación simultáneamente. En experimentos con trasplante de células, la reparación de tejidos se ha producido a través de (1) el reemplazo celular directo y (2) la producción de citoquinas que conducen a la angiogénesis y la neurogénesis7. Los recientes avances en la tecnología de células madre han facilitado aún más el desarrollo de fuentes de células neuronales escalables y bien caracterizadas que ahora están en preparación para ensayos clínicos (revisados en 7,8,9). Aunque las terapias celulares han alcanzado la etapa clínica para algunas enfermedades neurológicas (por ejemplo, enfermedad de Parkinson10, accidente cerebrovascular11 y lesión de la médula espinal12), su eficacia ha sido variable, y se necesita más investigación preclínica para comprender los mecanismos de las interacciones injerto-huésped.
Una limitación importante de muchos estudios preclínicos es el seguimiento continuo de las células trasplantadas dentro del huésped. A menudo solo se realizan mediciones de punto final, omitiendo los procesos migratorios y de supervivencia dinámicos en el huésped 6,13. Estas limitaciones resultan en la caracterización deficiente de las células injertadas y requieren un alto número de animales para comprender los cambios longitudinales. Para superar estas limitaciones, en este estudio, transducimos células progenitoras neurales derivadas de células madre pluripotentes inducidas (iPSC) con un vector lentiviral de doble reportero disponible comercialmente que consiste en luciferasa de luciérnaga roja y proteína fluorescente verde mejorada (rFluc-eGFP). Estas células se trasplantan a través de una inyección estereotáxica intraparenquimatosa en el cerebro del ratón y se rastrean longitudinalmente utilizando imágenes de bioluminiscencia in vivo durante 5 semanas. Después de la recolección de tejido cerebral, las células injertadas que expresan GFP se identifican y se caracterizan aún más en las secciones histológicas del cerebro. Este método se puede adaptar sin problemas a fuentes celulares transducibles alternativas y rutas de trasplante para aplicaciones in vivo en el cerebro de roedores. En general, el procedimiento es valioso para obtener información longitudinal de la supervivencia y migración del injerto en el cerebro del ratón y facilita la posterior caracterización histológica.
Protocolo
NOTA: Todos los experimentos con ratones se llevaron a cabo de acuerdo con las pautas gubernamentales, institucionales y de ARRIVE y fueron aprobados por la Oficina Veterinaria Cantonal de Zurich. Se utilizaron ratones adultos machos y hembras diabéticos no obesos SCID gamma (NSG) (10-14 semanas, 25-35 g). Los ratones fueron alojados en jaulas regulares de tipo II / III en grupos de al menos dos animales por jaula en una habitación con humedad y temperatura controlada con un ciclo constante de luz / oscuridad de 12/12 h. .).
1. Cultivo celular y transducción viral
- Diferenciar las células progenitoras neurales (NPC) de las iPSCs utilizando inhibidores de moléculas pequeñas como se describió anteriormente14.
- NPCsde cultivo 15 a partir del pasaje 2 en adelante en Neural Stem cell Maintenance Medium (NSMM; Tabla 1) suplementado con moléculas pequeñas (Tabla 1) en placas de 6 pocillos (2 mL de medio por pozo) recubiertas con poli-ornitina/laminina521 (pLO/L521). Cambia el medio diariamente.
NOTA: Para pasar NPCs, agregue 1 mL de reactivo de disociación celular por pozo (ver la Tabla de Materiales) e incube a 37 °C durante 1 min hasta que la mayoría de las células se separen.- Para el recubrimiento, incube 150 μL de pLO en 1 ml de solución salina tamponada con fosfato (PBS) de 0,1 M por pozo durante 2 h a temperatura ambiente (RT). Después de tres lavados con PBS, incubar 10 μg de L521 en 1 ml de PBS por pozo durante 2 h en RT.
- Para la transducción viral, coloque 50,000 células por pozo en una placa de 24 pocillos recubierta con pLO / L521 y agregue vectores virales preempaquetados (pLL-EF1a-rFLuc-T2A-GFP-mPGK-Puro, LL410PA-1) a cada pozo.
NOTA: El total de unidades infecciosas (IFU) proporcionadas es de >2 × 106 IFU y son suficientes para infectar 100,000 células a una multiplicidad de infección (MOI) de 20. El conteo de células se ha realizado con un contador de células automatizado. La eficiencia de transducción depende en gran medida de la línea celular utilizada. El trabajo con lentivirus requiere el cumplimiento de las directrices locales para productos de nivel 2 de bioseguridad (BSL-2). - Incubar las células a 37 °C durante 72 h, mientras se continúan los cambios diarios del medio.
- Confirme la transducción exitosa comprobando las células para la expresión de GFP en un microscopio de fluorescencia. Ajuste el aumento del microscopio a 10x o 20x y use la excitación adecuada (460-480 nm) y el rango de emisión (490-520 nm) para detectar células transducidas que expresan GFP.
- Cuantificar la relación entre la GFP transducida y las células totales para estimar la eficacia general de la transducción.
NOTA: Con este protocolo se alcanzaron tasas de transducción del 65-95%. Se recomienda una eficacia de transducción de >50% como criterio de ir/no ir antes del trasplante. Si no se puede lograr una eficacia de transducción del 50%, realice la selección de puromicina o clasifique las células utilizando citometría de flujo para aumentar el rendimiento de las células transducidas. - Opcional: Congelación de celdas
- Gire las células hacia abajo (300 × g, 5 min) y deseche el sobrenadante. Resuspender el pellet en 1 mL de medio de congelación (ver la Tabla de Materiales) y transferir la suspensión a viales para obtener 106 células/vial. Transfiera las celdas a cajas de congelación durante 24 h a -80 °C y luego a -150 °C para su almacenamiento a largo plazo.
2. Preparación celular para trasplante
- Recoger un vial de células de -150 °C de almacenamiento y transferirlo al laboratorio. Cuente las celdas mediante un contador de celdas automatizado.
NOTA: El vial contiene 1.5-2 × 106 células. - Transfiera rápidamente el vial a un baño de agua a 37 °C hasta que no queden cristales de hielo (2-3 min).
NOTA: Es importante descongelar rápidamente para minimizar cualquier daño a las membranas celulares. No sumerja el vial completamente en el baño de agua, ya que puede aumentar el riesgo de contaminación. - Transfiera el vial al gabinete de bioseguridad y pipetee todo el contenido (~ 1 ml) en un tubo cónico estéril de 15 ml.
NOTA: El trabajo con células transducidas lentiviralmente requiere BSL-2. Sin embargo, las células de lavado y paso eliminan las partículas virales del medio. La información sobre cuándo se permite una transferencia de BSL-2 a BSL-1 debe obtenerse de las autoridades locales. - Agregue 9 ml de PBS estéril 1x y centrífuga durante 5 min a 300 × g, RT.
- Retire el sobrenadante por aspiración con una pipeta (1-10 ml); Incline suavemente la suspensión hacia la punta de la pipeta y comience a aspirar. Tenga cuidado de no molestar el pellet.
- Lave las células resuspensando en 10 ml de 1x PBS estéril.
NOTA: Aplique suavemente el tubo para resuspendir las células en el volumen residual. Triture lentamente la suspensión celular con una pipeta de 1 ml hasta que no contenga grumos o agregados. - Cuente las celdas antes del giro final utilizando un contador de celdas automatizado.
- Centrifugadora durante 5 min a 300 × g, RT.
- Retire el sobrenadante (paso 2.5) y vuelva a suspender el gránulo celular en el volumen requerido de PBS estéril a una concentración de 8 × 104 células/μL. Coloque las células en hielo y utilícelas para el trasplante dentro de las próximas 5 horas.
NOTA: En este protocolo se utilizó un volumen de 1,6 × 105 células/2 μL de PBS.
3. Procedimiento de trasplante
- Preparación para la cirugía
- Limpie y esterilice el equipo de cirugía.
- Prepare el dispositivo estereotáxico y el sistema de bomba de microinyección.
NOTA: Es fundamental probar la jeringa Hamilton y la aguja de 30 G, 2 pulgadas antes de comenzar. Inserte la aguja en un tubo que contenga NaCl estéril al 0,9% y extraiga lentamente la solución hacia adentro y hacia afuera. - Configure la máquina de anestesia. Pruebe la máquina antes de involucrar a cualquier animal. Limpie la cámara de inducción con etanol al 70%.
- Preparación de animales
- Mantenga a los ratones durante al menos 7 días antes de los experimentos en condiciones estándar para aclimatarlos.
NOTA: Para este protocolo se utilizaron los siguientes animales: hembra NOD/SCID/IL2rγnull (30-35 g, también conocido como NSG) y hembra C57BL/6J (20-25 g, también conocido como B6). El procedimiento también se puede realizar con ratones machos. - Mida el peso corporal del ratón y ajuste la dosis del analgésico que se va a inyectar. Administrar carprofeno (5 mg/kg de peso corporal) por vía intraperitoneal para reducir el dolor y/o prevenir una respuesta inflamatoria.
- Anestesiar a los animales utilizando isoflurano (3% en la fase de inducción y 1,5-2% en la fase de mantenimiento durante la cirugía) vaporizado en oxígeno.
NOTA: Se prefiere la anestesia gaseosa debido a un despertar rápido después del procedimiento quirúrgico y porque los niveles de gas anestésico se pueden ajustar fácilmente. - Use reflejos nociceptivos para asegurarse de que el animal esté profundamente anestesiado (por ejemplo, pellizcos en los dedos de los pies). Cuando se alcanza la anestesia profunda, transporte al animal desde la cámara de inducción hasta el marco estereotáxico. Mantenga la anestesia con una máscara facial.
NOTA: La frecuencia respiratoria debe controlarse visualmente durante todo el procedimiento (40-60 respiraciones por minuto). Use una almohadilla de calentamiento para evitar la hipotermia durante el procedimiento. - Aplique lubricante oftálmico para evitar que los ojos se sequen.
- Afeitar el cuero cabelludo del ratón con una maquinilla de afeitar eléctrica y desinfectar la piel con una solución de betadina al 5% con hisopos de algodón.
- Asegure la cabeza del ratón e inserte las barras para los oídos en el meato externo.
NOTA: Tenga cuidado de no dañar los tímpanos. Aplique ungüento de lidocaína en ambos canales auditivos antes de insertar las barras para los oídos. Para verificar si la cabeza del animal está en una posición estable, empuje cuidadosamente hacia abajo la cabeza para ver si hay movimiento. Si se observa movimiento, la barra de la oreja, la colocación de la pieza nasal o ambas son incorrectas y deben reajustarse.
- Mantenga a los ratones durante al menos 7 días antes de los experimentos en condiciones estándar para aclimatarlos.
- Craneotomía
- Use una cuchilla quirúrgica para hacer un corte a lo largo de la línea media lo suficientemente grande como para revelar los puntos de referencia lambda y bregma.
NOTA: Se pueden aplicar retractores de piel para mantener el cráneo expuesto. - Retraiga el periostio y la fascia con un bisturí y use hisopos de algodón estériles para secar la superficie del cráneo.
- Ajuste las barras de la oreja y la boca para estandarizar la posición de la cabeza.
NOTA: Las coordenadas verticales para bregma y lambda deben ser idénticas para el posicionamiento anteroposterior. - Coloque la aguja en el bregma y calcule las coordenadas de los puntos de inyección deseados (las coordenadas de interés elegidas para este protocolo: anterior-posterior (AP): + 0,5 mm, medial-lateral (ML): + 1,5 mm). Mueva la aguja a ese punto y márquela con tinta.
NOTA: Las coordenadas se eligieron en base al Atlas 16 del Cerebro del Ratón de Franklin y Paxinos. Las distancias son mm desde el bregma. - Aplique NaCl estéril al 0,9% en el cráneo y perfore un orificio con un diámetro de 2-3 mm a través del cráneo con un taladro dental quirúrgico.
- Mueva la aguja a la superficie de la duramadre y calcule las coordenadas de profundidad.
- Use una cuchilla quirúrgica para hacer un corte a lo largo de la línea media lo suficientemente grande como para revelar los puntos de referencia lambda y bregma.
- Procedimiento de trasplante
- Resuspend las células en el tubo (paso 2.9) y extraiga 2 μL de suspensión celular en una jeringa (5 μL o 10 μL).
NOTA: Asegúrese de que no haya burbujas de aire presentes en la suspensión celular. La jeringa debe mantenerse en posición horizontal hasta que se monte en el dispositivo estereotáctico para evitar la sedimentación celular. - Coloque la jeringa sobre el sitio objetivo (coordenadas calculadas: AP: + 0,5 mm, ML: + 1,5 mm) y mueva lentamente la aguja a la superficie de la duramadre.
NOTA: Si no está seguro de las coordenadas correctas, realice inyecciones con un tinte y una evaluación histológica del sitio de inyección antes de trasplantar células (para obtener más detalles, consulte 17). - Guíe la aguja a una velocidad de 0,02 mm / s en el cerebro hasta la profundidad adecuada (la coordenada elegida para este protocolo es dorsal-ventral (DV) - 0,8 mm). Sobredimensione la profundidad en 0,1 mm y retire la aguja a la misma distancia para crear un bolsillo para las células inyectadas.
- Aplique adhesivo tisular alrededor de la aguja usando fórceps para evitar fugas de células.
- Inyectar 2 μL de la suspensión celular preparada a una velocidad constante de 3-5 nL/s.
NOTA: El procedimiento de inyección durará entre 7 y 12 min. - Después de la inyección, deje la aguja en su lugar durante al menos 5 minutos antes de retirarla lentamente. Aplique adhesivo tisular para sellar el orificio en el cráneo y espere otros 2 minutos.
- Resuspend las células en el tubo (paso 2.9) y extraiga 2 μL de suspensión celular en una jeringa (5 μL o 10 μL).
- Suturas y post-cuidado
- Aplique una solución estéril de NaCl al 0,9% en el cráneo expuesto para evitar la deshidratación.
- Cierra la herida con un hilo de sutura de seda 5/0.
- Hidratar al animal con 0,5 ml de solución de lactato ringer inyectada por vía subcutánea en la parte baja de la espalda.
- Interrumpa la administración de anestesia y retire cuidadosamente el ratón del aparato estereotáxico y colóquelo de nuevo en una jaula que se mantiene en una almohadilla térmica.
- Monitorear a los animales durante la fase aguda post-lesión. Verifique la sutura, el peso del animal y la salud general al menos dos veces al día.
4. Imágenes in vivo
- Preparación de luciferina
- Descongele la sal potásica de D-luciferina en RT y prepare una solución madre fresca de D-luciferina a 30 mg / ml en PBS.
- Esterilizar la solución madre a través de un filtro de jeringa de 0,22 μm.
NOTA: Se recomienda el uso inmediato de la solución de trabajo. Si es necesario, la luciferina disuelta se puede almacenar a -20 °C. Sin embargo, el almacenamiento prolongado puede dar lugar a la degradación de la señal. La luciferina es un reactivo sensible a la luz; manténgalo fuera de la luz directa siempre que sea posible. También se pueden considerar sustratos alternativos, por ejemplo, ciclcuc, para mejorar el límite de resolución18.
- Imagenológico
- Configuración inicial
NOTA: Las imágenes de bioluminiscencia se realizaron utilizando un sistema de imágenes in vivo (consulte la Tabla de materiales) que consiste en una cámara oscura y una cámara de dispositivo de carga acoplada refrigerada (CCD).- Haga doble clic en el icono del software Living Image y seleccione un ID de usuario de la lista desplegable.
- Haga clic en Inicializar en el panel de control que aparece. Una vez que se completa el proceso de inicialización, el cuadro de temperatura en el panel de control se volverá verde.
- En el panel de control, marque las casillas Luminiscente y Fotografía y seleccione Exposición automática (~60 s). Seleccione un campo de visión (se eligió D/12.5cm para este protocolo). Introduzca la altura del sujeto (1,5 cm) y seleccione la opción usar enfoque de altura del sujeto. Establezca manualmente los siguientes parámetros: binning grande, f/2, filtro de excitación bloqueado y filtro de emisión abierto.
- Determine la cantidad de inyección de D-luciferina a 300 mg/kg de peso corporal. NOTA: La dosis estándar recomendada es de 150 mg/kg de D-luciferina. Este procedimiento se ajustó de acuerdo con un protocolo que reportaba una mayor sensibilidad utilizando 300 mg/kg18.
- Inyecte la luciferina por vía intraperitoneal (p.i.).
NOTA: Si el animal necesita ser sedado antes de la inyección, tenga en cuenta que puede extender el tiempo máximo de expresión de luciferasa. - Espere 5 minutos, luego anestesia a los animales con un suministro continuo de isoflurano (4.5% en la fase de inducción y 1.5-2% en la fase de mantenimiento durante el procedimiento de imagen).
- Aplique lubricante oftálmico en los ojos, luego afeite a los animales sedados en la región de la cabeza con una afeitadora de pelo convencional. Coloque a los animales en la cámara de imágenes y comience a tomar imágenes 15 minutos después de la inyección de luciferina haciendo clic en Adquirir en el panel de control .
- Configuración inicial
5. Perfusión
- Anestesiar a los animales mediante una inyección i.p. de pentobarbital sódico (150 mg/kg de peso corporal). Espere hasta que el ratón ya no responda a estímulos dolorosos, como pellizcos en los dedos de los pies.
- Coloque el ratón sobre su espalda y use pinzas y tijeras para abrir la cavidad torácica.
- Use tijeras estándar para abrir el diafragma.
- Exponga el corazón e inserte una aguja (desde el tubo con anillo/solución de paraformaldehído al 4% (PFA)) en el ápice del ventrículo izquierdo.
NOTA: Tenga cuidado de mantener la punta de la aguja en la luz del ventrículo. - Corte el ventrículo derecho con tijeras.
- Perfuse con solución de timbre (se puede mantener en RT) durante 3-4 min (caudal: 17 mL/min). Continúe hasta que el corazón esté limpio.
- Cambie la llave de paso para permitir el flujo de PFA (almacenar a 4 ° C; mantener en hielo durante el procedimiento) y perfundir durante otros 5 minutos (~ 100 ml).
- Detenga la bomba y retire la aguja del ventrículo izquierdo.
NOTA: La perfusión con PFA preserva la integridad del tejido de manera uniforme. También facilita la preservación de la señal de GFP en los trasplantes que de otro modo podrían perderse debido a la difusión.
6. Procesamiento
- Recolección de tejidos
- Retire la cabeza con tijeras estándar y haga una incisión en la línea media de la piel.
- Gire la piel sobre los ojos para exponer el cráneo.
- Comience desde la parte caudal en el punto del hueso parietal y haga una pequeña incisión con tijeras de resorte. Avance las tijeras rostralmente a lo largo de la sutura midsagittal hasta un punto entre los ojos. Comience de nuevo desde la parte caudal y haga dos cortes paralelos y ~ 4 mm de separación en el plano sagital.
NOTA: Tenga cuidado de no dañar el cerebro presionando las tijeras contra la superficie interior del cráneo. - Use fórceps para inclinar cuidadosamente un lado del hueso parietal y romperlo. Haz lo mismo con el otro lado.
NOTA: Use una microespatula para liberar el hueso de las meninges; de lo contrario, pueden dañar el cerebro al romper el cráneo. Si quedan partes del hueso frontal, haga un pequeño corte para inclinar y romper la placa ósea. - Para liberar el cerebro, deslice cuidadosamente la microespatula debajo del cerebro (bulbos olfativos) e inclínela suavemente hacia arriba.
- Después de la recolección, mantenga el cerebro en solución de PFA al 4% durante 4-6 h a 4 ° C. Transfiéralo a 1x PBS estéril después.
- Inmunohistoquímica
- Transfiera el cerebro a una solución de sacarosa al 30% durante al menos 48 h a 4 ° C para evitar la formación de cristales durante la congelación.
- Utilice un microtomo deslizante para cortar secciones coronales con un grosor de 40 μm. Recoger y almacenar las secciones como secciones de flotación libre (en una placa de 24 pocillos) en una solución crioprotectora (Tabla 1) a -20 °C hasta su posterior procesamiento.
- Enjuague las secciones con 450 μL de 1x PBS para cada pozo (3 veces, 5 min cada una, RT).
- Bloquear sitios no específicos con 450 μL de solución de bloqueo para cada pocillo (Tabla 1) durante 1 h en RT.
- Incubar cada pozo con 450 μL de anticuerpos primarios a 4 °C durante la noche. Diluir los anticuerpos 1:200 en suero de burro al 3%; 0.1% Triton-X-100 en PBS. Para identificar el material del donante en el entorno del huésped, use un anticuerpo contra núcleos específicos humanos (anticuerpo anti-núcleos humanos, clon 235-1).
- Lavar las secciones con 450 μL de 1x PBS para cada pocillo (3 veces, 5 min cada una, RT).
- Incubar cada pozo con 450 μL de anticuerpos secundarios fluorescentes correspondientes durante 2-3 h (RT). Diluir los anticuerpos en suero de burro al 3%; 0.1% Triton-X-100 en 1x PBS.
- Lavar las secciones con 450 μL de 1x PBS para cada pocillo (3 veces, 5 min cada una, RT).
- Tinción de los núcleos con 450 μL de 0,1 μg/mL 4',6-diamidino-2-fenilindol (DAPI).
Resultados
Nuestro objetivo es rastrear longitudinalmente las células progenitoras neurales trasplantadas en el cerebro de ratón utilizando imágenes de bioluminiscencia in vivo e identificar las células trasplantadas en análisis histológicos posteriores (Figura 1A). Por lo tanto, las células progenitoras neurales se transducen con un vector lentiviral que consiste en EF1α-rFluc-eGFP. Antes del trasplante, las células se analizaron para una transducción exitosa mediante la expresión de eGFP in vitro (Figura 1B). Las células transducidas con éxito se trasplantaron estereotácticamente en el cerebro del ratón en las coordenadas deseadas (por ejemplo, en la corteza sensoriomotora). Después del trasplante, los ratones fueron inyectados sistémicamente con D-luciferina, el sustrato para rFluc, y se midieron las intensidades de señal de las células trasplantadas para confirmar el éxito del trasplante (Figura 1C).
Para evaluar el límite de detección de la imagen de bioluminiscencia in vivo , se trasplantó un rango de 6.000-180.000 células en la corteza sensoriomotora derecha del ratón (Figura 2A). Se detectaron <6.000 células y una señal de bioluminiscencia proporcional al recuento de células trasplantadas directamente después del trasplante (Figura 2B). Como las fuentes de células humanas son inmunogénicas para ratones inmunocompetentes, se utilizaron ratones inmunodeficientes NOD scid gamma (NSG) para observar la supervivencia a largo plazo de los injertos celulares. La supervivencia a largo plazo y la detección de una señal de bioluminiscencia durante un máximo de 5 semanas se confirmaron después del trasplante celular (Figura 2C, D). Las células trasplantadas fueron detectadas con éxito ex vivo en un análisis histológico posterior a través del informador eGFP e inmunotinción con núcleos anti-humanos y anticuerpos mitocondriales anti-humanos (Figura 2E).
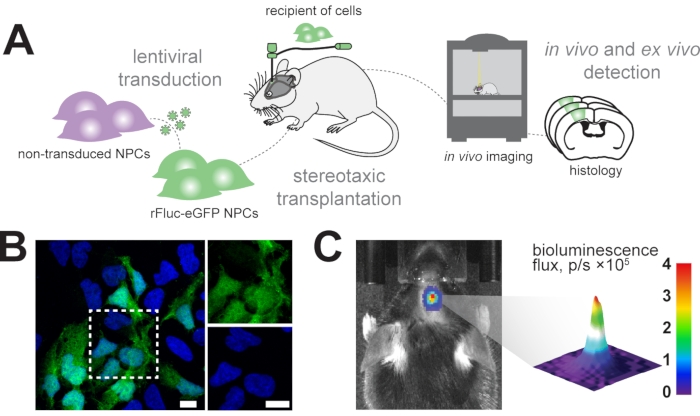
Figura 1: Trasplante de células progenitoras neurales. (A) Visión general esquemática de la generación y el trasplante de NPC rFluc-eGFP. (B) Imagen de inmunofluorescencia representativa de NPC transducidas (GFP reporter, verde) contrateñida con DAPI (azul); barras de escamas = 5 μm. (C) Detección in vivo de la señal de bioluminiscencia en células trasplantadas; barra de color = azul (0, min, sin señal), rojo (4 flujo, p/s × 105, señal máxima) Abreviaturas: NPCs = células progenitoras neurales; GFP = proteína fluorescente verde; rFluc-eGFP = luciferasa de luciérnaga roja y proteína fluorescente verde mejorada; DAPI = 4',6-diamidino-2-fenilindol; p/s = fotones/s. Haga clic aquí para ver una versión más grande de esta figura.
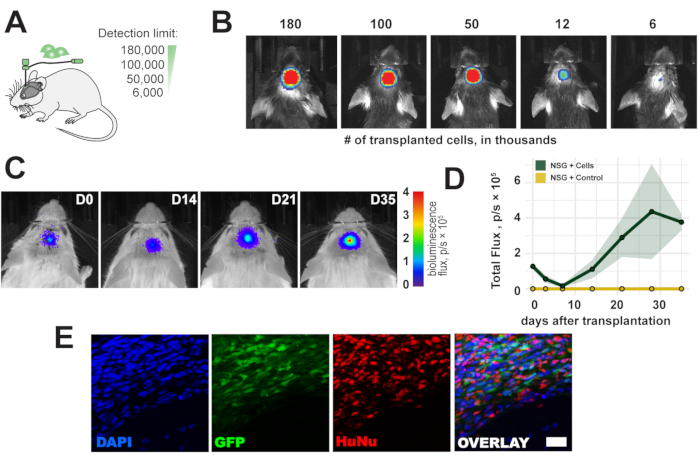
Figura 2: Curso temporal de las células trasplantadas. (A) Vista esquemática de los números de células para trasplante. (B) Límite de detección de células trasplantadas 1 h después del trasplante. (C, D) Curso temporal del trasplante (180.000 células) durante un máximo de 35 días en ratones NSG; barra de color = azul (0, min, sin señal), rojo (4 flujo, p/s × 105, señal máxima) Los datos son medios ± SEM (n = 3). (E) Imágenes representativas de fluorescencia de secciones histológicas y células trasplantadas 5 semanas después del trasplante. Barra de escala = 10 μm. Abreviaturas: D = día después del trasplante; NSG = NOD scid gamma inmunodeficiente; DAPI = 4',6-diamidino-2-fenilindol; GFP = proteína fluorescente verde; HuNu = Anticuerpo anti-núcleos humanos, clon 235-1; p/s = fotones/s. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Regenerar el cerebro lesionado para permitir la recuperación funcional sigue siendo un desafío insatisfecho. Muchos enfoques preclínicos innovadores han evolucionado dirigiéndose, por ejemplo, la modulación inmune 19,20, la angiogénesis 1,21,22,23, la integridad de la barrera hematoencefálica 2,3,24,25 y el reemplazo celular 5,26 . Especialmente en los últimos años, las terapias basadas en células han surgido como una estrategia de tratamiento prometedora para el cerebro debido a los importantes avances en la tecnología de células madre y los protocolos de diferenciación eficientes15,28. Este documento proporciona un protocolo valioso para el trasplante y seguimiento de células neuronales en el cerebro de ratón. El método es aplicable a todas las líneas celulares transducibles para aplicaciones in vivo en el cerebro del ratón.
La configuración presentada utiliza trasplantes de origen humano en un ratón. Estos trasplantes no son viables a largo plazo en ratones inmunocompetentes de tipo salvaje debido a la inmunogenicidad. Por lo tanto, se utilizaron ratones NSG inmunodeficientes para superar esta limitación. Alternativamente, se puede preferir el uso de trasplantes de ratón para superar los aspectos inmunogénicos. Si se requiere el trasplante de células humanas, los modelos de ratón humanizados representan una alternativa emergente para reducir la probabilidad de rechazo del injerto29.
Se utilizó un vector viral comercial de doble reportero que consiste en luciferasa luciérnaga y eGFP bajo el promotor EF1α para visualizar los trasplantes. Este promotor fue seleccionado para lograr una alta intensidad de señal15. Sin embargo, aparte de los NPC, se ha demostrado que otros tipos de células promueven la función cerebral después de una lesión, incluidos los pericitos30 y los astrocitos31; por lo tanto, dependiendo de la línea celular utilizada, otros promotores podrían ser más adecuados para lograr altos niveles de expresión. Además, el uso de promotores de transgenes, como el CMV, puede conducir a una regulación a la baja, especialmente en experimentos a largo plazo32. La eficiencia de transducción del vector lentiviral depende en gran medida de la línea celular utilizada y puede variar entre experimentos individuales. Por lo tanto, la eficiencia de la transducción debe evaluarse antes de comenzar los experimentos in vivo y para corregir las variaciones en la eficacia de la transducción entre experimentos. La región cerebral del trasplante también influye en la intensidad de la señal. Aunque se alcanzó un límite de detección de <6.000 células para los trasplantes corticales, puede requerir más células para detectar una señal en regiones cerebrales más profundas, por ejemplo, el cuerpo estriado o el hipocampo.
Los volúmenes de trasplante en el cerebro del ratón están limitados a 1-2 μL. Por lo tanto, es importante identificar un número de célula adecuado para los experimentos. Se ha observado previamente que el aumento del número de células conduce a una disminución de la tasa de supervivencia, muy probablemente debido a la disponibilidad limitada de nutrientes y oxígeno en la región del trasplante33. Las imágenes de bioluminiscencia in vivo proporcionan una resolución espacial relativamente baja en comparación con otros métodos de imágenes in vivo , como la resonancia magnética o la tomografía computarizada. Por lo tanto, las rutas migratorias cortas de las células injertadas solo pueden evaluarse de manera confiable en el análisis post-hoc posterior.
La intensidad absoluta de la señal de la bioluminiscencia es generalmente proporcional al número de células trasplantadas. Sin embargo, la intensidad de la señal podría reducirse si los injertos se trasplantan en estructuras cerebrales más profundas o si la intensidad de la señal está fuera del espectro de detección lineal del sistema de imágenes in vivo . Actualmente, se desarrollan nuevos sustratos para garantizar una penetración más eficiente a través de la barrera hematoencefálica que la D-luciferina, incluido el ciclcuc1. Estos sustratos pueden mejorar aún más el límite de detección de las células injertadas en el futuro18. En general, este protocolo permite un procedimiento sencillo y mínimamente invasivo para trasplantar y observar injertos en el cerebro del ratón.
Divulgaciones
Los autores no tienen conflictos de intereses potenciales que declarar.
Agradecimientos
Los autores RR y CT reconocen el apoyo de la Fundación Mäxi y el Centro de Competencia 3R.
Materiales
| Name | Company | Catalog Number | Comments |
| Viral Transduction | |||
| pLL-EF1a-rFLuc-T2A-GFP-mPGK-Puro (Lenti-Labeler virus) | Systembio | LL410VA-1 | |
| Consumables | |||
| Eppendorf microtubes; 1.5 mL | Sigma Aldrich | Z606340 | |
| Falcon Tubes; 15 mL | TPP | 91015 | |
| Microscope cover slips | Product of choice | ||
| Microscope slides | Product of choice | ||
| Sterlie cotton swabs | Product of choice | ||
| Sutures; 5/0 silk with curved needle | B. Braun | G0762482 | |
| Syringe filter; 0.22 µm | TPP | 99722 | |
| Syringe; 1 mL and 0.5 mL | B. Braun | 9166017V | |
| Tissue culture plate (24-well) | TPP | 92024 | |
| Equipment | |||
| Automated cell counter (Vi-CELL XR) | Beckmann Coulter Life Science | 383721 | |
| Forceps | Fine Science Tools | 11064-07 | |
| Forceps, fine | Fine Science Tools | 11412-11 | |
| Heating pad | Product of choice | ||
| High Speed Brushless Micromotor Kit | Foredom | K.1060-22. | |
| Ideal Micro Drill Burr Set Of 5 | Cell Point Specific | 60-1000 | |
| In-Vivo imaging system (IVIS Lumina III with Living Imaging 4.2 software package) | Perkin Elmer | CLS136334 | |
| Isoflurane vaporizer | Provet AG | 330724 | |
| Microinjection Syringe Pump system | World Precision Instruments | UMP3T-1 | |
| Microliter syringe; 700-Series; Volume: 5-10 µL | Hamilton | 7635-01 | |
| Microtome | Leica | HM430 | |
| NanoFill-33 G-Needle (removable and reusable) | World Precision Instruments | NF33BV-2 | |
| Needle Holder | Fine Science Tools | 12001-13 | |
| Perfusion pump and tubing | Masterflex | HV-77120-42 | |
| Scalpel | Fine Science Tools | 10003-12 | |
| Small bonn scissors, straight | Fine Science Tools | 14184-09 | |
| Small spring scissors, straight | Fine Science Tools | 15000-03 | |
| Spatula | Merck | Z243213-2EA | |
| Stereotaxic frame for rodents; motorized | World Precision Instruments | 99401 | |
| Pharmaceuticals and Reagents | |||
| Accutase | Invitrogen | A11105-01 | Proteolytic and collagenolytic; cell dissociation reagent |
| Anti-Human Nuclei Antibody, clone 235-1, Biotin Conjugate | Merck | MAB1281B | |
| B27 – Supplement (50x) | Gibco | 17504-001 | |
| Betadine (11 mg Iod als Povidon-Iod pro 1 ml Lösung) | Mundipharma Medical Company | All pharmaceuticals were provided by the cantonal pharmacy, Zurich, Switzerland | |
| Blocking solution (3% donkey serum; 0.1% Triton-X-100 in PBS) | Product of choice; can be homemade | ||
| CHIR99021 (10 mM – 2,500x) | StemMACS | 130-103-926 | |
| Cryoprotectant solution | Product of choice; can be homemade | ||
| DAPI solution (1 mg/mL) | Thermo Fisher Scientific | 62248 | |
| D-Luciferin Potassium Salt | Perkin Elmer | 122799 | |
| DMEM/F12 | Gibco | 11320-074 | |
| Donkey anti-Mouse IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 555 | Invitrogen | A-31570 | |
| Donkey serum | Product of choice | ||
| Esconarcon (Pentobarbitalum natricum 300 mg) | Streuli Pharma AG | All pharmaceuticals were provided by the cantonal pharmacy, Zurich, Switzerland | |
| Ethanol; 70% | Product of choice | ||
| FGF Basic recombinant human protein, Animal-origin free | Thermo Fisher Scientific | PHG6015 | |
| Glutamax (100x) | Gibco | A12860-01 | |
| hLif (10 µg/mL – 1,000x) | PeproTech | AF-300-05-25UG | |
| Isoflurane (Isofluran (1-Chlor-2,2,2-trifluorethyl-difluoromethylether) 99.9%) | Provet AG | All pharmaceuticals were provided by the cantonal pharmacy, Zurich, Switzerland | |
| Laminin-L521 (L-521) | Biolaminin LN | LN521 | |
| Lidocaine ointment (Lidocain: 25 mg , Prilocain: 25 mg) | Aspen Pharma Schweiz GmbH | All pharmaceuticals were provided by the cantonal pharmacy, Zurich, Switzerland | |
| Mounting Medium | Product of choice; can be homemade | ||
| N2- Supplement (100x) | Gibco | 75202-001 | |
| Neurobasal | Gibco | 21103-049 | |
| Ophtalmic lubricant (Retinol palmitat: 15,000 UI) | Bausch & Lomb Swiss AG | All pharmaceuticals were provided by the cantonal pharmacy, Zurich, Switzerland | |
| Paraformaldehyde solution | Product of choice | ||
| PBS | Thermo Fisher Scientific | 10010023 | Can also be homemade |
| Poly-L-ornithine Solution (pLO) | Sigma-Aldrich | P4957 | |
| Rimadyl (Carprofen 50 mg) | Zoetis Schweiz GmbH | All pharmaceuticals were provided by the cantonal pharmacy, Zurich, Switzerland | |
| Ringer lactate | B. Braun | 3570500 | |
| Ringer solution | B. Braun | 3570030 | |
| Saline (0.9% NaCl) | B. Braun | 3570160 | |
| SB431542 (10 mM – 3,333.3x) | StemMACS | 130-106-543 | |
| Tissue Adhesive (Histoacryl) | B. Braun | 1050060 |
Referencias
- Rust, R., et al. Nogo-A targeted therapy promotes vascular repair and functional recovery following stroke. Proceedings of the National Academy of Sciences of the United States of America. 116 (28), 14270-14279 (2019).
- Rust, R., et al. Anti-Nogo-A antibodies prevent vascular leakage and act as pro-angiogenic factors following stroke. Scientific Reports. 9 (1), 20040 (2019).
- Weber, R. Z., et al. Characterization of the blood brain barrier disruption in the photothrombotic stroke model. Frontiers in Physiology. 11, 58226 (2020).
- Sweeney, M. D., Sagare, A. P., Zlokovic, B. V. Blood-brain barrier breakdown in Alzheimer's disease and other neurodegenerative disorders. Nature Reviews. Neurology. 14 (3), 133-150 (2018).
- Wang, Y., et al. 3K3A-APC stimulates post-ischemic neuronal repair by human neural stem cells in mice. Nature Medicine. 22 (9), 1050-1055 (2016).
- Llorente, I. L., et al. Patient-derived glial enriched progenitors repair functional deficits due to white matter stroke and vascular dementia in rodents. Science Translational Medicine. 13 (590), (2021).
- Kokaia, Z., Llorente, I. L., Carmichael, S. T. Customized brain cells for stroke patients using pluripotent stem cells. Stroke. 49 (5), 1091-1098 (2018).
- Parmar, M., Grealish, S., Henchcliffe, C. The future of stem cell therapies for Parkinson disease. Nature Reviews Neuroscience. 21 (2), 103-115 (2020).
- Galgano, M., et al. Traumatic brain injury: current treatment strategies and future endeavors. Cell Transplantation. 26 (7), 1118-1130 (2017).
- Schweitzer, J. S., et al. Personalized iPSC-derived dopamine progenitor cells for Parkinson's disease. The New England Journal of Medicine. 382 (20), 1926-1932 (2020).
- Muir, K. W., et al. Intracerebral implantation of human neural stem cells and motor recovery after stroke: multicentre prospective single-arm study (PISCES-2). Journal of Neurology, Neurosurgery & Psychiatry. 91 (4), 396-401 (2020).
- Kawabori, M., et al. Cell therapy for chronic TBI: interim analysis of the randomized controlled STEMTRA trial. Neurology. 96 (8), 1202-1214 (2021).
- George, P. M., et al. Engineered stem cell mimics to enhance stroke recovery. Biomaterials. 178, 63-72 (2018).
- Sancho-Martinez, I., et al. Establishment of human iPSC-based models for the study and targeting of glioma initiating cells. Nature Communications. 7 (1), 1-14 (2016).
- Rust, R., et al. Xeno-free induced pluripotent stem cell-derived neural progenitor cells for in vivo applications. bioRxiv. , (2022).
- Franklin, K., Paxinos, G. . Paxinos and Franklin's the Mouse brain in stereotaxic coordinates, compact: The coronal plates and diagrams. , (2019).
- Baker, S., Götz, J. A local insult of okadaic acid in wild-type mice induces tau phosphorylation and protein aggregation in anatomically distinct brain regions. Acta Neuropathologica Communications. 4, 32 (2016).
- Cao, J., et al. In vivo optical imaging of myelination events in a myelin basic protein promoter-driven luciferase transgenic mouse model. ASN Neuro. 10, (2018).
- Aswendt, M., Adamczak, J., Couillard-Despres, S., Hoehn, M. Boosting bioluminescence neuroimaging: an optimized protocol for brain studies. PLoS One. 8 (2), 55662 (2013).
- Roth, S., et al. Brain-released alarmins and stress response synergize in accelerating atherosclerosis progression after stroke. Science Translational Medicine. 10 (432), (2018).
- Rust, R., Hofer, A. -. S., Schwab, M. E. Stroke promotes systemic endothelial inflammation and atherosclerosis. Trends in Molecular Medicine. 24 (7), 593-595 (2018).
- Rust, R., Gantner, C., Schwab, M. E. Pro- and antiangiogenic therapies: current status and clinical implications. FASEB Journal. 33 (1), 34-48 (2018).
- Rust, R., Grönnert, L., Weber, R. Z., Mulders, G., Schwab, M. E. Refueling the ischemic CNS: guidance molecules for vascular repair. Trends in Neurosciences. 42 (9), 644-656 (2019).
- Nih, L. R., Gojgini, S., Carmichael, S. T., Segura, T. Dual-function injectable angiogenic biomaterial for the repair of brain tissue following stroke. Nature Materials. 17 (7), 642 (2018).
- Montagne, A., et al. Pericyte degeneration causes white matter dysfunction in the mouse central nervous system. Nature Medicine. 24 (3), 326-337 (2018).
- Montagne, A., et al. APOE4 leads to blood-brain barrier dysfunction predicting cognitive decline. Nature. 581 (7806), 71-76 (2020).
- George, P. M., Steinberg, G. K. Novel stroke therapeutics: unraveling stroke pathophysiology and its impact on clinical treatments. Neuron. 87 (2), 297-309 (2015).
- Weber, R. Z., et al. Deep learning based behavioral profiling of rodent stroke recovery. bioRxiv. , (2021).
- Nair, R. R., et al. Uses for humanised mouse models in precision medicine for neurodegenerative disease. Mammalian Genome. 30 (7), 173-191 (2019).
- Kirabali, T., Rust, R. iPS-derived pericytes for neurovascular regeneration. European Journal of Clinical Investigation. 51 (9), 13601 (2021).
- Weber, R. Z., Perron, P., Rust, R. Astrocytes for brain repair: More than just a neuron's sidekick. Brain Pathology. 31 (5), 12999 (2021).
- Johansen, J., et al. Evaluation of Tet-on system to avoid transgene down-regulation in ex vivo gene transfer to the CNS. Gene Therapy. 9 (19), 1291-1301 (2002).
- Vogel, S., et al. Initial graft size and not the innate immune response limit survival of engrafted neural stem cells. Journal of Tissue Engineering and Regenerative Medicine. 12 (3), 784-793 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados