Method Article
Intracerebral 이식 및 마우스 뇌에서 인간 신경 전구 세포의 생체 내 생체 발광 추적
* 이 저자들은 동등하게 기여했습니다
요약
우리는 마우스 뇌에서 루시페라아제-녹색 형광 단백질 (GFP)을 발현하는 이중 리포터 벡터로 형질도입된 인간 신경 전구 세포의 사다리꼴 이식을 기술한다. 이식 후, 루시퍼라아제 신호는 형광 현미경을 사용하여 뇌 절편에서 확인된 생체 내 생체 발광 및 GFP 발현 이식된 세포를 사용하여 반복적으로 측정된다.
초록
세포 치료는 오랫동안 실험 신경 생물학에서 새로운 치료 패러다임이었습니다. 그러나 세포 이식 연구는 종종 종말점 측정에 의존하므로 제한된 범위 내에서 세포 이동 및 생존의 종단 변화 만 평가할 수 있습니다. 이 논문은 성인 마우스 뇌에서 신경 전구 세포 (NPC)를 이식하고 종으로 추적하기위한 신뢰할 수있는 최소 침습적 프로토콜을 제공합니다. 이식 전에, 세포는 생체발광 (반딧불이-루시페라제) 및 형광 (녹색 형광 단백질 [GFP]) 리포터를 포함하는 렌티바이러스 벡터로 형질도입된다. NPC는 감각 운동 피질에 입체 택시 주사를 사용하여 오른쪽 피질 반구에 이식됩니다. 이식 후, 이식된 세포를 생체 내 생체 발광 영상화를 사용하여 6,000개의 세포의 분해능 한계로 최대 5주간(0, 3, 14, 21, 35일) 동안 무손상 두개골을 통해 검출하였다. 이어서, 이식된 세포는 조직학적 뇌 절편에서 확인되고 면역형광으로 더 특성화된다. 따라서, 이 프로토콜은 마우스 뇌에서 세포를 이식, 추적, 정량화 및 특성화하는 데 유용한 도구를 제공한다.
서문
포유류의 뇌는 부상이나 질병에 따른 재생 능력이 제한되어 있어 조직 및 기능 복구를 촉진하기 위한 혁신적인 전략이 필요합니다. 전임상 전략은 신경 보호, 신경 발생, 혈관 신생 1,2, 혈액 뇌 장벽 복구 3,4 또는 세포 치료 5,6을 포함한 뇌 재생의 다양한 측면에 중점을 둡니다. 세포 치료는 이러한 많은 프로 복구 과정을 동시에 촉진 할 수 있다는 장점이 있습니다. 세포의 이식을 통한 실험에서, 조직 복구는 (1) 직접적인 세포 대체 및 (2) 혈관형성 및 신경발생을 유도하는 사이토카인의 생산7을 통해 발생하였다. 줄기 세포 기술의 최근 발전은 현재 임상 시험을위한 파이프 라인에있는 확장 가능하고 잘 특성화 된 신경 세포 소스의 개발을 더욱 촉진했습니다 (7,8,9에서 검토). 비록 세포 요법이 몇몇 신경학적 질환(예를 들어, 파킨슨병10, 뇌졸중(11), 및 척수 손상(12))에 대한 임상 단계에 도달했음에도 불구하고, 그들의 효능은 가변적이었으며, 이식편-숙주 상호작용의 메카니즘을 이해하기 위해서는 더 많은 전임상 연구가 필요하다.
많은 전임상 연구의 주요 한계 중 하나는 숙주 내부에 이식 된 세포의 지속적인 추적입니다. 종점 측정만 수행되는 경우가 많으며, 숙주(6,13)에서 동적 철새 및 생존 과정을 생략한다. 이러한 한계는 이식 된 세포의 특성화가 불량하고 종방향 변화를 이해하기 위해 높은 동물 수를 필요로합니다. 이러한 한계를 극복하기 위해, 본 연구에서는 유도만능줄기세포(iPSC) 유래 신경전구세포를 적색 반딧불이 루시퍼라아제와 강화된 녹색 형광 단백질(rFluc-eGFP)로 구성된 시판되는 이중 리포터 렌티바이러스 벡터로 형질도입하였다. 이 세포는 마우스 뇌에 입체 택시 사지꼴 인트라 인펜치 주사를 통해 이식되며 5 주에 걸쳐 생체 내 생체 발광 이미징을 사용하여 종방향 추적됩니다. 뇌 조직 수집 후, GFP 발현 이식된 세포가 확인되고 조직학적 뇌 절편을 추가로 특징으로 한다. 이 방법은 설치류 뇌에서의 생체내 응용을 위한 대안적인 형질도입가능한 세포 공급원 및 이식 경로에 매끄럽게 적응될 수 있다. 전반적으로이 절차는 마우스 뇌에서 이식편 생존 및 이동에 대한 종방향 정보를 얻고 후속 조직 학적 특성화를 용이하게하는 데 유용합니다.
프로토콜
참고 : 생쥐와 관련된 모든 실험은 정부, 기관 및 ARRIVE 지침에 따라 수행되었으며 취리히의 광저우 수의학 사무소의 승인을 받았습니다. 성인 남성 및 여성 비비만 당뇨병성 SCID 감마(NSG) 마우스(10-14주, 25-35 g)를 사용하였다. 마우스는 일정한 12/12 h 빛/어둠 주기를 갖는 습도 및 온도 조절된 방의 케이지 당 적어도 두 마리의 동물 그룹으로 규칙적인 Type II/III 케이지에 수용되었다. .).
1. 세포 배양 및 바이러스 전달
- 앞서 기술한 바와 같이 소분자 억제제를 사용하여 iPSCs로부터 신경 전구 세포 (NPCs)를 분화시킨다14.
- NPCs15를 계대 2 이후부터 신경줄기세포 유지배지(NSMM; 표 1) 폴리오르니틴/라미닌521(pLO/L521)로 코팅된 6웰 플레이트(웰당 배지 2mL)에 소분자(표 1)를 보충하였다. 매일 매체를 교체하십시오.
참고: NPC를 통과시키기 위해, 웰당 세포 해리 시약 1mL를 첨가하고( 물질 표 참조) 대부분의 세포가 분리될 때까지 37°C에서 1분 동안 인큐베이션한다.- 코팅을 위해, 150 μL의 pLO를 웰 당 0.1 M 인산완충 식염수(PBS) 1 mL에 넣고 실온에서 2시간 동안 인큐베이션한다(RT). PBS로 3회 세척한 후, 10 μg의 L521을 RT에서 2시간 동안 웰 당 PBS 1 mL에 인큐베이션한다.
- 바이러스 형질도입을 위해, pLO/L521로 코팅된 24-웰 플레이트에서 웰당 50,000개의 세포를 플레이트화하고, 사전 패키징된 바이러스 벡터(pLL-EF1a-rFLuc-T2A-GFP-mPGK-Puro, LL410PA-1)를 각 웰에 첨가한다.
참고: 제공된 총 감염 단위(IFU)는 >2 ×10,6 IFU이며 20의 감염 다수도(MOI)에서 100,000개의 세포를 감염시키기에 충분합니다. 셀 카운팅은 자동화된 셀 카운터로 수행되었습니다. 형질도입 효율은 사용된 세포주에 강하게 의존한다. 렌티바이러스에 대한 작업은 생물 안전 레벨 2(BSL-2) 제품에 대한 현지 지침을 준수해야 합니다. - 세포를 37°C에서 72시간 동안 인큐베이션하고, 매일 배지 변화를 계속한다.
- GFP 발현에 대한 세포를 형광 현미경으로 확인함으로써 성공적인 형질도입을 확인하였다. 현미경 배율을 10x 또는 20x로 설정하고 적절한 여기 (460-480 nm) 및 방출 범위 (490-520 nm)를 사용하여 형질 도입 GFP 발현 세포를 검출하십시오.
- 전체 세포에 대한 GFP 형질도입의 비율을 정량화하여 일반적인 형질도입 효능을 추정한다.
참고: 이 프로토콜로 65-95%의 형질도입률을 달성하였다. >50 %의 형질 도입 효능은 이식 전에 이동 / 이동 금지 기준으로 권장됩니다. 50% 형질도입 효능을 달성할 수 없는 경우, 퓨로마이신 선택을 수행하거나 유세포 분석기를 사용하여 세포를 분류하여 형질도입된 세포의 수율을 증가시킨다. - 선택 사항: 세포의 동결
- 세포를 아래로 회전시키고(300 × g, 5분) 상청액을 버린다. 펠렛을 1 mL의 동결 배지 ( 물질 표 참조)에 재현탁시키고 현탁액을 바이알로 옮겨 106 세포 / 바이알을 얻습니다. 세포를 -80°C에서 24시간 동안 냉동 박스로 옮긴 다음, 장기간 보관을 위해 -150°C로 옮긴다.
2. 이식을 위한 세포 준비
- -150°C에서 세포 바이알을 수집하여 보관하고 실험실로 옮긴다. 자동화된 셀 카운터를 사용하여 셀 수를 계산합니다.
참고: 바이알에는 1.5-2 × 10,6 세포가 들어 있습니다. - 얼음 결정이 남지 않을 때까지 바이알을 37°C 수조로 신속하게 옮깁니다(2-3분).
참고: 세포막의 손상을 최소화하기 위해 신속하게 해동하는 것이 중요합니다. 바이알을 수조에 완전히 담그면 오염의 위험이 높아질 수 있으므로 침지하지 마십시오. - 바이알을 생물안전 캐비닛으로 옮기고 전체 내용물(~1 mL)을 멸균된 15 mL 코니컬 튜브에 피펫한다.
참고: 렌티바이러스로 형질도입된 세포에 대한 작업에는 BSL-2가 필요합니다. 그러나, 세척 및 계대배양 세포는 배지로부터 바이러스 입자를 제거한다. BSL-2에서 BSL-1로의 전송이 허용되는 시기에 대한 정보는 지방 당국으로부터 얻어야 합니다. - 멸균된 1x PBS 9 mL를 첨가하고 300 × g, RT에서 5분 동안 원심분리한다.
- 피펫(1-10 mL)을 사용하여 흡인에 의해 상층액을 제거하고; 서스펜션을 피펫 팁 쪽으로 부드럽게 기울이고 흡인을 시작하십시오. 펠렛을 방해하지 않도록주의하십시오.
- 세포를 멸균된 1x PBS의 10 mL에 재현탁시켜 세척한다.
주: 튜브를 부드럽게 탭하여 잔류 부피의 셀을 재현탁시킵니다. 덩어리 또는 응집체가 포함되지 않을 때까지 1 mL 피펫을 사용하여 세포 현탁액을 천천히 트리투레이트한다. - 자동화된 셀 카운터를 사용하여 최종 스핀 전에 셀을 계산합니다.
- 300 × g, RT에서 5분 동안 원심분리한다.
- 상청액을 제거하고(단계 2.5) 멸균 PBS의 필요한 부피에 세포 펠릿을 8 × 104 cells /μL의 농도로 재현탁시킨다. 세포를 얼음 위에 놓고 다음 5h 이내에 이식에 사용한다.
참고: 이 프로토콜에는 1.6 × 105 세포/2 μL의 PBS의 부피가 사용되었다.
3. 이식 절차
- 수술 준비
- 수술 장비를 청소하고 살균하십시오.
- 입체 택시 장치와 미세 주입 펌프 시스템을 준비하십시오.
참고: 시작하기 전에 해밀턴 주사기와 30G, 2인치 바늘을 테스트하는 것이 중요합니다. 바늘을 멸균 0.9 % NaCl이 들어있는 튜브에 넣고 천천히 용액을 안팎으로 그립니다. - 마취 기계를 설치하십시오. 동물을 참여시키기 전에 기계를 테스트하십시오. 유도 챔버를 70% 에탄올로 청소하십시오.
- 동물의 제조
- 실험하기 최소 7일 전에 마우스를 표준 조건에서 보관하여 적응시킨다.
참고: 이 프로토콜에는 여성 NOD/SCID/IL2rγnull(30-35g, NSG라고도 함) 및 여성 C57BL/6J(20-25g, B6라고도 함)의 동물이 사용되었습니다. 절차는 또한 수컷 마우스와 함께 수행 할 수 있습니다. - 마우스 체중을 측정하고 주사 할 진통제의 복용량을 조정하십시오. 카프로펜 (5 mg / kg 체중)을 복강 내로 투여하여 통증을 줄이거 나 염증 반응을 예방하십시오.
- 산소에서 기화 된 이소 플루란 (유도 단계에서 3 %, 수술 중 유지 단계에서 1.5-2 %)을 사용하여 동물을 마취하십시오.
참고: 기체 마취는 수술 후 빠른 웨이크업과 마취 가스의 수준을 쉽게 조절할 수 있기 때문에 선호됩니다. - 동물이 깊이 마취되도록 nociceptive 반사 신경을 사용하십시오 (예 : 발가락 핀치). 깊은 마취에 도달하면 유도 챔버에서 입체 택시 프레임으로 동물을 운반하십시오. 얼굴 마스크를 사용하여 마취를 유지하십시오.
참고 : 호흡 속도는 절차 전반에 걸쳐 시각적으로 모니터링해야합니다 (분당 40-60 회 호흡). 절차 중에 저체온증을 피하기 위해 온난화 패드를 사용하십시오. - 눈이 마르지 않도록 안과 윤활제를 바르십시오.
- 전기 면도기로 마우스 두피를 면도하고 면봉을 사용하여 5 % 베타 딘 용액으로 피부를 소독하십시오.
- 마우스 머리를 고정하고 이어 바를 외부 고기에 삽입하십시오.
참고: 고막이 손상되지 않도록 주의하십시오. 이어 바를 삽입하기 전에 양쪽 외이도에 리도카인 연고를 바르십시오. 동물의 머리가 안정된 위치에 있는지 확인하려면 조심스럽게 머리를 아래로 밀어 움직임이 있는지 확인하십시오. 움직임이 나타나면 이어 바, 노즈피스 배치 또는 둘 다 잘못되어 다시 조정해야 합니다.
- 실험하기 최소 7일 전에 마우스를 표준 조건에서 보관하여 적응시킨다.
- 두개골 절제술
- 외과 용 블레이드를 사용하여 람다와 브레그마 랜드 마크를 드러내기에 충분히 큰 미드 라인을 따라 자르십시오.
참고 : 피부 수축기는 두개골이 노출 된 상태로 유지하기 위해 적용될 수 있습니다. - 메스로 골막과 근막을 후퇴시키고 멸균 된 면봉을 사용하여 두개골 표면을 건조시킵니다.
- 귀와 입 막대를 조정하여 머리 위치를 표준화하십시오.
참고: 브레그마와 람다의 수직 좌표는 전후 위치 지정에 대해 동일해야 합니다. - 바늘을 브레그마에 놓고 원하는 주사 지점의 좌표 (이 프로토콜에 대해 선택한 관심 좌표 : 전후 (AP) : + 0.5mm, 내측 (ML) : + 1.5mm)을 계산하십시오. 바늘을 그 지점으로 옮기고 잉크로 표시하십시오.
참고: 좌표는 Franklin과 Paxinos Mouse Brain Atlas 16을 기반으로 선택되었습니다. 거리는 브레그마에서 mm입니다. - 두개골에 멸균 된 0.9 % NaCl을 바르고 외과 용 치과 드릴로 두개골을 통해 직경 2-3mm의 구멍을 뚫습니다.
- 바늘을 경막 표면으로 이동시키고 깊이 좌표를 계산하십시오.
- 외과 용 블레이드를 사용하여 람다와 브레그마 랜드 마크를 드러내기에 충분히 큰 미드 라인을 따라 자르십시오.
- 이식 절차
- 세포를 튜브에 재현탁시키고(단계 2.9) 2 μL의 세포 현탁액을 주사기 (5 μL 또는 10 μL)에 끌어당긴다.
참고: 셀 서스펜션에 기포가 없는지 확인하십시오. 주사기는 세포 침강을 피하기 위해 입체 장치에 장착 될 때까지 수평 위치에 보관해야합니다. - 주사기를 표적 부위 위에 놓고 (계산 좌표: AP: + 0.5 mm, ML: + 1.5 mm) 바늘을 두라의 표면으로 천천히 이동시킨다.
참고: 정확한 좌표에 대해 확실하지 않은 경우, 세포를 이식하기 전에 주사 부위의 염료 및 조직학적 평가를 수행하십시오(자세한 내용은 17 참조). - 바늘을 0.02 mm / s의 속도로 뇌에 적절한 깊이까지 안내하십시오 (이 프로토콜에 대해 선택된 좌표는 등쪽 - 복부 (DV) - 0.8mm입니다). 깊이를 0.1mm로 오버슛하고 바늘을 같은 거리로 인출하여 주입 된 세포를위한 포켓을 만듭니다.
- 포셉을 사용하여 바늘 주위에 조직 접착제를 바르면 세포 누출을 방지합니다.
- 준비된 세포 현탁액 2 μL를 3-5 nL/s의 일정한 속도로 주입하십시오.
참고 : 주입 절차는 7 분에서 12 분 사이에 지속됩니다. - 주사 후 바늘을 천천히 꺼내기 전에 적어도 5 분 동안 제자리에 두십시오. 조직 접착제를 적용하여 두개골의 구멍을 봉인하고 2 분 더 기다리십시오.
- 세포를 튜브에 재현탁시키고(단계 2.9) 2 μL의 세포 현탁액을 주사기 (5 μL 또는 10 μL)에 끌어당긴다.
- 봉합사 및 사후 관리
- 탈수를 피하기 위해 노출 된 두개골에 멸균 된 0.9 % NaCl 용액을 바르십시오.
- 5/0 실크 봉합사 실로 상처를 닫으십시오.
- 동물을 0.5 mL의 링거 락테이트 용액으로 피하 주사하여 허리에 수화시킨다.
- 마취 전달을 중단하고 입체 택시 장치에서 마우스를 조심스럽게 제거하고 가열 패드에 보관 된 케이지에 다시 놓습니다.
- 급성기 부상 후 동물을 모니터링하십시오. 봉합사, 동물의 체중 및 전반적인 건강을 적어도 하루에 두 번 확인하십시오.
4. 생체 내 이미징
- 루시페린의 제조
- RT에서 D-루시페린 칼륨 염을 해동하고 PBS 중 30 mg/mL의 D-루시페린의 신선한 원액을 제조하였다.
- 0.22 μm 시린지 필터를 통해 원액을 멸균한다.
참고: 작업 솔루션을 즉시 사용하는 것이 좋습니다. 필요한 경우, 용해된 루시페린은 -20°C에서 저장될 수 있다. 그러나, 장시간 저장은 신호의 저하를 초래할 수 있다. 루시페린은 빛에 민감한 시약이고; 가능할 때마다 직사광선을 피하십시오. 대안적인 기판들은 또한 분해능 한계(18)를 개선하기 위해, 예를 들어, 사이클루크(cycluc)로 고려될 수 있다.
- 이미징
- 초기 설정
참고: 생체 발광 이미징은 어두운 챔버와 냉각 전하 결합 장치(CCD) 카메라로 구성된 생체 내 이미징 시스템( 재료 표 참조)을 사용하여 수행되었습니다.- Living Image 소프트웨어 아이콘을 두 번 클릭하고 드롭다운 목록에서 사용자 ID를 선택합니다.
- 나타나는 제어판에서 초기화를 클릭합니다. 초기화 프로세스가 완료되면 제어판의 온도 상자가 녹색으로 바뀝니다.
- 제어판에서 발광 및 사진 상자를 선택하고 자동 노출(~ 60초)을 선택합니다. 시야각을 선택합니다(이 프로토콜에 대해 D/12.5cm가 선택됨). 피사체 높이(1.5cm)를 입력하고 피사체 높이 초점 사용 옵션을 선택합니다. 대형 비닝, f/2, 차단된 여기 필터 및 개방 방출 필터와 같은 매개 변수를 수동으로 설정합니다.
- 300 mg / kg 체중에서 D- 루시페린의 주사량을 결정하십시오. 참고 : 표준 권장 용량은 D- 루시페린 150 mg / kg입니다. 이 절차는 300 mg / kg18을 사용하여 더 높은 감도를보고하는 프로토콜에 따라 조정되었습니다.
- 루시페린을 복강내 주사하십시오 (즉).
참고: 주사 전에 동물을 진정시켜야 하는 경우, 피크 루시퍼라제 발현 시간이 연장될 수 있다는 점에 유의하십시오. - 5 분 동안 기다린 다음 이소플루란의 연속 공급으로 동물을 마취하십시오 (이미징 절차 중 유도 단계에서 4.5 %, 유지 단계에서 1.5-2 %).
- 눈에 안과 윤활제를 바르고 기존의 모발 면도기를 사용하여 머리 부위에 진정 된 동물을 면도하십시오. 동물을 이미징 챔버에 놓고 루시페린 주사 후 15분 후에 대조군 패널에서 획득을 클릭하여 이미징을 시작한다.
- 초기 설정
5. 관류
- 펜토바르비탈 나트륨 (체중 150 mg / kg 체중)의 i.p. 주사로 동물을 마취하십시오. 마우스가 발가락 꼬집음과 같은 고통스러운 자극에 더 이상 반응하지 않을 때까지 기다리십시오.
- 마우스를 등에 대고 핀셋과 가위를 사용하여 흉강을 엽니 다.
- 표준 가위를 사용하여 다이어프램을 엽니다.
- 심장을 노출시키고 바늘 (링거 / 4 % 파라 포름 알데히드 용액 (PFA)이있는 튜브에서)을 좌심실의 정점에 삽입하십시오.
참고 : 바늘 끝을 심실의 내강에 보관하십시오. - 가위를 사용하여 우심실을 자릅니다.
- 링거 용액 (RT에서 보관할 수 있음)을 3-4 분 동안 관류하십시오 (유속 : 17 mL / 분). 마음이 깨끗해질 때까지 계속하십시오.
- PFA의 흐름을 허용하고 (4 °C에서 보관; 절차 중에 얼음 위에 보관하십시오) 또 다른 5 분 (~ 100 mL) 동안 관류하도록 스톱콕을 전환하십시오.
- 펌프를 멈추고 좌심실에서 바늘을 제거하십시오.
참고: PFA를 사용한 관류는 조직 완전성을 균일하게 보존합니다. 또한 확산으로 인해 손실될 수 있는 이식에서 GFP 신호의 보존을 용이하게 한다.
6. 처리
- 조직 수집
- 표준 가위를 사용하여 머리를 제거하고 피부에 중간 선을 절개하십시오.
- 두개골을 노출시키기 위해 눈 위로 피부를 돌립니다.
- 정수리 뼈의 지점에서 꼬리 부분에서 시작하여 봄 가위를 사용하여 작은 절개를하십시오. 중간 시상 봉합사를 따라 눈 사이의 지점까지 가위를 로스트랄하게 전진시킵니다. 꼬리 부분에서 다시 시작하여 시상면에서 평행하고 ~ 4mm 떨어진 두 개의 컷을 만듭니다.
참고: 두개골의 내부 표면에 가위를 눌러 뇌를 손상시키지 않도록 주의하십시오. - 포셉을 사용하여 정수리 뼈의 한쪽을 조심스럽게 기울여 부러 뜨립니다. 다른 쪽에서도 똑같이하십시오.
참고 : 미세 주걱을 사용하여 수막에서 뼈를 풀어주십시오. 그렇지 않으면 두개골을 부러 뜨리는 동안 뇌를 손상시킬 수 있습니다. 전두엽 뼈의 일부가 남아 있으면 뼈 판을 기울이고 부러 뜨리기 위해 작은 절단을하십시오. - 뇌를 풀어 주걱을 조심스럽게 뇌 (후각 전구) 아래로 밀어 넣고 부드럽게 위쪽으로 기울이십시오.
- 수집 후, 뇌를 4°C에서 4-6시간 동안 4% PFA 용액에 보관한다. 이후 멸균된 1x PBS로 옮긴다.
- 면역조직화학
- 동결 동안 결정의 형성을 방지하기 위해 4°C에서 적어도 48시간 동안 뇌를 30% 수크로오스 용액으로 옮긴다.
- 슬라이딩 마이크로톰을 사용하여 40μm 두께의 코로나 절편을 절단합니다. 섹션을 수집하고, 추가 처리될 때까지 -20°C에서 냉동 보호제 용액(표 1)에 자유 부유 섹션(24-웰 플레이트 내)으로서 저장한다.
- 절편을 각 웰에 대해 450 μL의 1x PBS로 헹구십시오 (각각 3회, 5분, RT).
- RT에서 1시간 동안 각 웰에 대해 450 μL의 블로킹 용액(표 1)으로 비특이적 부위를 차단한다.
- 각 웰을 450 μL의 일차 항체와 함께 4°C에서 밤새 인큐베이션한다. 항체를 3% 당나귀 혈청에 1:200으로 희석하고; PBS 중의 0.1% 트리톤-X-100. 숙주 환경에서 공여체 물질을 확인하려면, 인간 특이적 핵에 대한 항체를 사용한다 (항-인간 핵 항체, 클론 235-1).
- 절편을 각 웰에 대해 450 μL의 1x PBS로 세척한다(각각 3회, 5분, RT).
- 각 웰을 450 μL의 상응하는 형광 보조 항체와 함께 2-3 h (RT) 동안 인큐베이션한다. 항체를 3% 당나귀 혈청에 희석; 1x PBS에서 0.1% 트리톤-X-100.
- 절편을 각 웰에 대해 450 μL의 1x PBS로 세척한다(각각 3회, 5분, RT).
- 0.1 μg/mL 4',6-디아미디노-2-페닐인돌(DAPI)의 450 μL로 핵을 착색시킨다.
결과
우리는 생체 내 생체 발광 이미징을 사용하여 마우스 뇌에 이식 된 신경 전구 세포를 종방향으로 추적하고 후속 조직 학적 분석에서 이식 된 세포를 확인하는 것을 목표로합니다 (그림 1A). 따라서, 신경 전구 세포는 EF1α-rFluc-eGFP로 구성된 렌티바이러스 벡터로 형질도입된다. 이식 전에, 세포를 시험관내에서 eGFP의 발현에 의한 성공적인 형질도입에 대해 시험하였다 (도 1B). 성공적으로 형질도입된 세포를 원하는 좌표로(예를 들어, 감각운동 피질에서) 마우스 뇌에 입체적으로 이식하였다. 이식 후, 마우스에 rFluc용 기질인 D-루시페린을 전신적으로 주입하였고, 이식된 세포의 신호 강도를 측정하여 성공적인 이식을 확인하였다(도 1C).
생체내 생체발광 영상화의 검출 한계를 평가하기 위해, 6,000-180,000개의 범위의 세포를 마우스의 우측 감각운동 피질에 이식하였다(도 2A). 우리는 <6,000 개의 세포와 이식 직후 이식 된 세포 수에 비례하는 생체 발광 신호를 검출했습니다 (그림 2B). 인간 세포 공급원이 면역적격 마우스에 면역원성인 것으로서, NOD scid gamma (NSG) 면역결핍 마우스는 세포 이식편의 장기 생존을 관찰하기 위해 사용되었다. 장기 생존 및 최대 5주 동안 생체발광 신호의 검출은 세포 이식 후 확인되었다(도 2C, D). 이식된 세포는 eGFP 리포터 및 항-인간 핵 및 항-인간 미토콘드리아 항체로 면역염색을 통해 후속 조직학적 분석을 통해 생체외에서 성공적으로 검출되었다(도 2E).
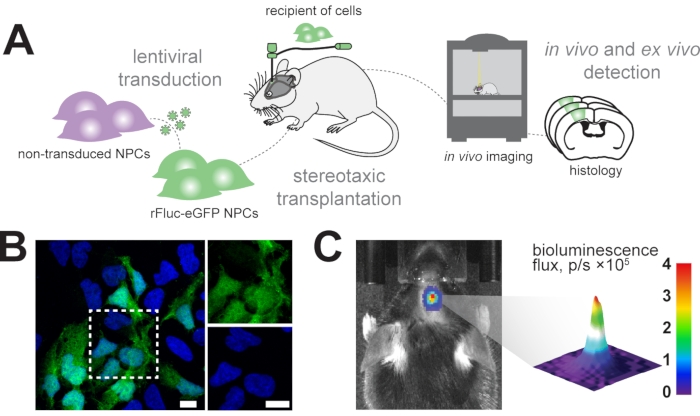
도 1: 신경 전구 세포의 이식. (A) rFluc-eGFP NPC의 생성 및 이식에 대한 개략적인 개요. (B) DAPI(파란색)로 역염색된 형질도입된 NPCs(GFP 리포터, 녹색)의 대표적인 면역형광 이미지; 스케일 바 = 5 μm. (C) 이식된 세포에서 생체발광 신호의 생체내 검출; 색상 막대 = 파란색 (0, 분, 신호 없음), 빨간색 (4 플럭스, p / s × 105, 최대 신호) 약어 : NPC = 신경 전구 세포; GFP = 녹색 형광 단백질; rFluc-eGFP = 적색 반딧불이 루시퍼라제 및 강화된 녹색 형광 단백질; DAPI = 4',6-디아미디노-2-페닐인돌; p/s = 광자/s. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
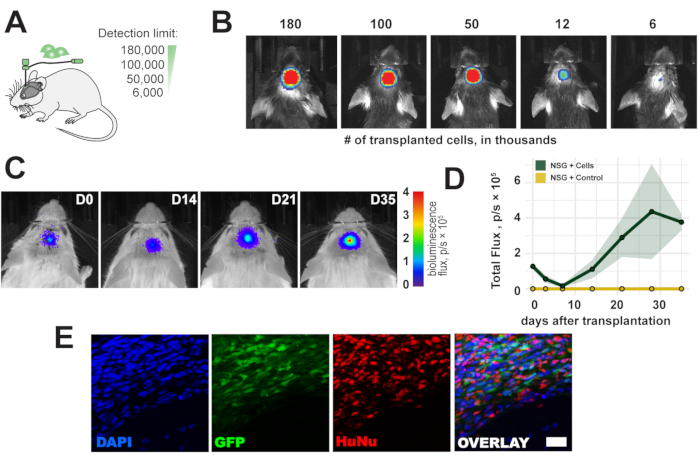
그림 2 : 이식 된 세포의 시간 과정. (A) 이식을 위한 세포 번호의 모식도. (B) 이식 후 1 h 이식 세포의 검출 한계. (C, D) NSG 마우스에서 최대 35 일 동안 이식 (180,000 세포)의 시간 과정; 색상 막대 = 파란색(0, min, 신호 없음), 빨간색(4 플럭스, p/s × 105, 최대 신호) 데이터는 SEM (n = 3)± 평균입니다. (e) 이식 후 5주 후 조직학적 절편 및 이식된 세포의 대표적인 형광 이미지. 스케일 바 = 10 μm. 약어: D = 이식 후 하루; NSG = 면역결핍 NOD scid 감마; DAPI = 4',6-디아미디노-2-페닐인돌; GFP = 녹색 형광 단백질; HuNu = 항-인간 핵 항체, 클론 235-1; p/s = 광자/s. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
기능적 회복을 허용하기 위해 부상당한 뇌를 재생하는 것은 충족되지 않은 과제로 남아 있습니다. 많은 혁신적인 전임상 접근법은 예를 들어 면역 조절19,20, 혈관 신생 1,21,22,23, 혈액-뇌 장벽 완전 성 2,3,24,25 및 세포 대체 5,26과 같은 표적화를 진화시켰다. . 특히 최근 몇 년 동안, 세포 기반 치료법은 줄기 세포 기술 및 효율적인 분화 프로토콜15,28의 주요 발전으로 인해 뇌에 대한 유망한 치료 전략으로 부상하고 있습니다. 이 논문은 마우스 뇌에서 신경 세포를 이식하고 추적하기위한 귀중한 프로토콜을 제공합니다. 상기 방법은 마우스 뇌에서의 생체내 적용을 위한 모든 형질도입가능한 세포주에 적용가능하다.
제시된 설정은 마우스에서 인간 기원의 이식을 사용합니다. 이들 이식은 면역원성으로 인해 면역적격 야생형 마우스에서 장기간 생존할 수 없다. 따라서, 면역결핍 NSG 마우스가 이러한 한계를 극복하기 위해 사용되었다. 대안적으로, 마우스 이식의 사용은 면역원성 측면을 극복하기 위해 바람직할 수 있다. 인간 세포의 이식이 필요한 경우, 인간화 마우스 모델은 이식편 거부 확률을 감소시키기 위한 새로운 대안을 나타낸다(29).
EF1α 프로모터 하에서 반딧불이 루시퍼라아제 및 eGFP로 구성된 상용 이중 리포터 바이러스 벡터를 사용하여 이식을 시각화하였다. 이 프로모터는 높은 신호 강도(15)를 달성하기 위해 선택되었다. 그러나, NPCs 이외에도, 다른 세포 유형은 혈관주위세포(30) 및 성상세포(31)를 포함하여 손상 후 뇌 기능을 증진시키는 것으로 나타났다; 따라서, 사용된 세포주에 따라, 다른 프로모터는 높은 발현 수준을 달성하는데 더 적합할 수 있다. 추가적으로, CMV와 같은 전이유전자 프로모터의 사용은 특히 장기 실험(32)에서 하향조절을 야기할 수 있다. 렌티바이러스 벡터의 형질도입 효율은 사용된 세포주에 크게 의존하며, 단일 실험마다 달라질 수 있다. 따라서, 형질도입 효율은 생체내 실험을 시작하기 전에 평가되어야 하고, 실험 사이의 형질도입 효능의 변화를 교정해야 한다. 이식의 뇌 영역은 또한 신호 강도에 영향을 미칩니다. 피질 이식을 위해 <6,000 세포의 검출 한계가 달성되었지만, 더 깊은 뇌 영역, 예를 들어 선조체 또는 해마에서 신호를 검출하기 위해서는 더 많은 세포가 필요할 수 있습니다.
마우스 뇌에서의 이식 부피는 1-2 μL로 제한된다. 따라서, 실험에 적합한 세포 번호를 확인하는 것이 중요하다. 세포 수의 증가는 생존율 감소로 이어진다는 것이 이전에 관찰되었으며, 이식 부위(33)에서 영양분과 산소의 제한된 이용가능성 때문일 가능성이 높다. 생체 내 생체발광 영상은 MRI 또는 CT와 같은 다른 생체내 영상 방법에 비해 상대적으로 낮은 공간 분해능을 제공한다. 따라서, 이식된 세포의 짧은 철새 경로는 후속 사후 분석에서만 신뢰성 있게 평가될 수 있다.
생체발광의 절대 신호 강도는 일반적으로 이식된 세포 수에 비례한다. 그러나 이식편이 더 깊은 뇌 구조에 이식되거나 신호 강도가 생체 내 이미징 시스템의 선형 검출 스펙트럼을 벗어나는 경우 신호 강도가 감소 될 수 있습니다. 현재, cycleuc1을 포함한 D-루시페린보다 혈액-뇌 장벽을 가로지르는 더 효율적인 침투를 보장하기 위해 새로운 기질이 개발되고 있다. 이들 기질은 장래(18)에 그래프팅된 세포의 검출 한계를 더욱 향상시킬 수 있다. 전반적으로,이 프로토콜은 마우스 뇌에서 이식편을 이식하고 관찰하는 간단하고 최소 침습적 인 절차를 허용합니다.
공개
저자는 선언 할 잠재적 인 이해 상충이 없습니다.
감사의 말
저자 RR과 CT는 Mäxi Foundation과 3R Competence Center의 지원을 인정합니다.
자료
| Name | Company | Catalog Number | Comments |
| Viral Transduction | |||
| pLL-EF1a-rFLuc-T2A-GFP-mPGK-Puro (Lenti-Labeler virus) | Systembio | LL410VA-1 | |
| Consumables | |||
| Eppendorf microtubes; 1.5 mL | Sigma Aldrich | Z606340 | |
| Falcon Tubes; 15 mL | TPP | 91015 | |
| Microscope cover slips | Product of choice | ||
| Microscope slides | Product of choice | ||
| Sterlie cotton swabs | Product of choice | ||
| Sutures; 5/0 silk with curved needle | B. Braun | G0762482 | |
| Syringe filter; 0.22 µm | TPP | 99722 | |
| Syringe; 1 mL and 0.5 mL | B. Braun | 9166017V | |
| Tissue culture plate (24-well) | TPP | 92024 | |
| Equipment | |||
| Automated cell counter (Vi-CELL XR) | Beckmann Coulter Life Science | 383721 | |
| Forceps | Fine Science Tools | 11064-07 | |
| Forceps, fine | Fine Science Tools | 11412-11 | |
| Heating pad | Product of choice | ||
| High Speed Brushless Micromotor Kit | Foredom | K.1060-22. | |
| Ideal Micro Drill Burr Set Of 5 | Cell Point Specific | 60-1000 | |
| In-Vivo imaging system (IVIS Lumina III with Living Imaging 4.2 software package) | Perkin Elmer | CLS136334 | |
| Isoflurane vaporizer | Provet AG | 330724 | |
| Microinjection Syringe Pump system | World Precision Instruments | UMP3T-1 | |
| Microliter syringe; 700-Series; Volume: 5-10 µL | Hamilton | 7635-01 | |
| Microtome | Leica | HM430 | |
| NanoFill-33 G-Needle (removable and reusable) | World Precision Instruments | NF33BV-2 | |
| Needle Holder | Fine Science Tools | 12001-13 | |
| Perfusion pump and tubing | Masterflex | HV-77120-42 | |
| Scalpel | Fine Science Tools | 10003-12 | |
| Small bonn scissors, straight | Fine Science Tools | 14184-09 | |
| Small spring scissors, straight | Fine Science Tools | 15000-03 | |
| Spatula | Merck | Z243213-2EA | |
| Stereotaxic frame for rodents; motorized | World Precision Instruments | 99401 | |
| Pharmaceuticals and Reagents | |||
| Accutase | Invitrogen | A11105-01 | Proteolytic and collagenolytic; cell dissociation reagent |
| Anti-Human Nuclei Antibody, clone 235-1, Biotin Conjugate | Merck | MAB1281B | |
| B27 – Supplement (50x) | Gibco | 17504-001 | |
| Betadine (11 mg Iod als Povidon-Iod pro 1 ml Lösung) | Mundipharma Medical Company | All pharmaceuticals were provided by the cantonal pharmacy, Zurich, Switzerland | |
| Blocking solution (3% donkey serum; 0.1% Triton-X-100 in PBS) | Product of choice; can be homemade | ||
| CHIR99021 (10 mM – 2,500x) | StemMACS | 130-103-926 | |
| Cryoprotectant solution | Product of choice; can be homemade | ||
| DAPI solution (1 mg/mL) | Thermo Fisher Scientific | 62248 | |
| D-Luciferin Potassium Salt | Perkin Elmer | 122799 | |
| DMEM/F12 | Gibco | 11320-074 | |
| Donkey anti-Mouse IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 555 | Invitrogen | A-31570 | |
| Donkey serum | Product of choice | ||
| Esconarcon (Pentobarbitalum natricum 300 mg) | Streuli Pharma AG | All pharmaceuticals were provided by the cantonal pharmacy, Zurich, Switzerland | |
| Ethanol; 70% | Product of choice | ||
| FGF Basic recombinant human protein, Animal-origin free | Thermo Fisher Scientific | PHG6015 | |
| Glutamax (100x) | Gibco | A12860-01 | |
| hLif (10 µg/mL – 1,000x) | PeproTech | AF-300-05-25UG | |
| Isoflurane (Isofluran (1-Chlor-2,2,2-trifluorethyl-difluoromethylether) 99.9%) | Provet AG | All pharmaceuticals were provided by the cantonal pharmacy, Zurich, Switzerland | |
| Laminin-L521 (L-521) | Biolaminin LN | LN521 | |
| Lidocaine ointment (Lidocain: 25 mg , Prilocain: 25 mg) | Aspen Pharma Schweiz GmbH | All pharmaceuticals were provided by the cantonal pharmacy, Zurich, Switzerland | |
| Mounting Medium | Product of choice; can be homemade | ||
| N2- Supplement (100x) | Gibco | 75202-001 | |
| Neurobasal | Gibco | 21103-049 | |
| Ophtalmic lubricant (Retinol palmitat: 15,000 UI) | Bausch & Lomb Swiss AG | All pharmaceuticals were provided by the cantonal pharmacy, Zurich, Switzerland | |
| Paraformaldehyde solution | Product of choice | ||
| PBS | Thermo Fisher Scientific | 10010023 | Can also be homemade |
| Poly-L-ornithine Solution (pLO) | Sigma-Aldrich | P4957 | |
| Rimadyl (Carprofen 50 mg) | Zoetis Schweiz GmbH | All pharmaceuticals were provided by the cantonal pharmacy, Zurich, Switzerland | |
| Ringer lactate | B. Braun | 3570500 | |
| Ringer solution | B. Braun | 3570030 | |
| Saline (0.9% NaCl) | B. Braun | 3570160 | |
| SB431542 (10 mM – 3,333.3x) | StemMACS | 130-106-543 | |
| Tissue Adhesive (Histoacryl) | B. Braun | 1050060 |
참고문헌
- Rust, R., et al. Nogo-A targeted therapy promotes vascular repair and functional recovery following stroke. Proceedings of the National Academy of Sciences of the United States of America. 116 (28), 14270-14279 (2019).
- Rust, R., et al. Anti-Nogo-A antibodies prevent vascular leakage and act as pro-angiogenic factors following stroke. Scientific Reports. 9 (1), 20040 (2019).
- Weber, R. Z., et al. Characterization of the blood brain barrier disruption in the photothrombotic stroke model. Frontiers in Physiology. 11, 58226 (2020).
- Sweeney, M. D., Sagare, A. P., Zlokovic, B. V. Blood-brain barrier breakdown in Alzheimer's disease and other neurodegenerative disorders. Nature Reviews. Neurology. 14 (3), 133-150 (2018).
- Wang, Y., et al. 3K3A-APC stimulates post-ischemic neuronal repair by human neural stem cells in mice. Nature Medicine. 22 (9), 1050-1055 (2016).
- Llorente, I. L., et al. Patient-derived glial enriched progenitors repair functional deficits due to white matter stroke and vascular dementia in rodents. Science Translational Medicine. 13 (590), (2021).
- Kokaia, Z., Llorente, I. L., Carmichael, S. T. Customized brain cells for stroke patients using pluripotent stem cells. Stroke. 49 (5), 1091-1098 (2018).
- Parmar, M., Grealish, S., Henchcliffe, C. The future of stem cell therapies for Parkinson disease. Nature Reviews Neuroscience. 21 (2), 103-115 (2020).
- Galgano, M., et al. Traumatic brain injury: current treatment strategies and future endeavors. Cell Transplantation. 26 (7), 1118-1130 (2017).
- Schweitzer, J. S., et al. Personalized iPSC-derived dopamine progenitor cells for Parkinson's disease. The New England Journal of Medicine. 382 (20), 1926-1932 (2020).
- Muir, K. W., et al. Intracerebral implantation of human neural stem cells and motor recovery after stroke: multicentre prospective single-arm study (PISCES-2). Journal of Neurology, Neurosurgery & Psychiatry. 91 (4), 396-401 (2020).
- Kawabori, M., et al. Cell therapy for chronic TBI: interim analysis of the randomized controlled STEMTRA trial. Neurology. 96 (8), 1202-1214 (2021).
- George, P. M., et al. Engineered stem cell mimics to enhance stroke recovery. Biomaterials. 178, 63-72 (2018).
- Sancho-Martinez, I., et al. Establishment of human iPSC-based models for the study and targeting of glioma initiating cells. Nature Communications. 7 (1), 1-14 (2016).
- Rust, R., et al. Xeno-free induced pluripotent stem cell-derived neural progenitor cells for in vivo applications. bioRxiv. , (2022).
- Franklin, K., Paxinos, G. . Paxinos and Franklin's the Mouse brain in stereotaxic coordinates, compact: The coronal plates and diagrams. , (2019).
- Baker, S., Götz, J. A local insult of okadaic acid in wild-type mice induces tau phosphorylation and protein aggregation in anatomically distinct brain regions. Acta Neuropathologica Communications. 4, 32 (2016).
- Cao, J., et al. In vivo optical imaging of myelination events in a myelin basic protein promoter-driven luciferase transgenic mouse model. ASN Neuro. 10, (2018).
- Aswendt, M., Adamczak, J., Couillard-Despres, S., Hoehn, M. Boosting bioluminescence neuroimaging: an optimized protocol for brain studies. PLoS One. 8 (2), 55662 (2013).
- Roth, S., et al. Brain-released alarmins and stress response synergize in accelerating atherosclerosis progression after stroke. Science Translational Medicine. 10 (432), (2018).
- Rust, R., Hofer, A. -. S., Schwab, M. E. Stroke promotes systemic endothelial inflammation and atherosclerosis. Trends in Molecular Medicine. 24 (7), 593-595 (2018).
- Rust, R., Gantner, C., Schwab, M. E. Pro- and antiangiogenic therapies: current status and clinical implications. FASEB Journal. 33 (1), 34-48 (2018).
- Rust, R., Grönnert, L., Weber, R. Z., Mulders, G., Schwab, M. E. Refueling the ischemic CNS: guidance molecules for vascular repair. Trends in Neurosciences. 42 (9), 644-656 (2019).
- Nih, L. R., Gojgini, S., Carmichael, S. T., Segura, T. Dual-function injectable angiogenic biomaterial for the repair of brain tissue following stroke. Nature Materials. 17 (7), 642 (2018).
- Montagne, A., et al. Pericyte degeneration causes white matter dysfunction in the mouse central nervous system. Nature Medicine. 24 (3), 326-337 (2018).
- Montagne, A., et al. APOE4 leads to blood-brain barrier dysfunction predicting cognitive decline. Nature. 581 (7806), 71-76 (2020).
- George, P. M., Steinberg, G. K. Novel stroke therapeutics: unraveling stroke pathophysiology and its impact on clinical treatments. Neuron. 87 (2), 297-309 (2015).
- Weber, R. Z., et al. Deep learning based behavioral profiling of rodent stroke recovery. bioRxiv. , (2021).
- Nair, R. R., et al. Uses for humanised mouse models in precision medicine for neurodegenerative disease. Mammalian Genome. 30 (7), 173-191 (2019).
- Kirabali, T., Rust, R. iPS-derived pericytes for neurovascular regeneration. European Journal of Clinical Investigation. 51 (9), 13601 (2021).
- Weber, R. Z., Perron, P., Rust, R. Astrocytes for brain repair: More than just a neuron's sidekick. Brain Pathology. 31 (5), 12999 (2021).
- Johansen, J., et al. Evaluation of Tet-on system to avoid transgene down-regulation in ex vivo gene transfer to the CNS. Gene Therapy. 9 (19), 1291-1301 (2002).
- Vogel, S., et al. Initial graft size and not the innate immune response limit survival of engrafted neural stem cells. Journal of Tissue Engineering and Regenerative Medicine. 12 (3), 784-793 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유