Method Article
İntraserebral Transplantasyon ve Fare Beynindeki İnsan Nöral Progenitör Hücrelerinin İnVivo Biyolüminesans İzlenmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Fare beyninde lusiferaz-yeşil floresan proteini (GFP) eksprese eden ikili muhabir bir vektör ile transdüke edilen insan nöral progenitör hücrelerinin intraparankimal transplantasyonunu tanımladık. Transplantasyondan sonra, lusiferaz sinyali, floresan mikroskobu kullanılarak beyin bölümlerinde tanımlanan in vivo biyolüminesans ve GFP eksprese eden aşılanmış hücreler kullanılarak tekrar tekrar ölçülür.
Özet
Hücre tedavisi uzun zamandır deneysel nörobiyolojide ortaya çıkan bir tedavi paradigması olmuştur. Bununla birlikte, hücre nakli çalışmaları genellikle son nokta ölçümlerine dayanır ve bu nedenle hücre göçü ve sağkalımının uzunlamasına değişikliklerini yalnızca sınırlı bir ölçüde değerlendirebilir. Bu makale, yetişkin fare beynindeki nöral progenitör hücrelerin (NPC'ler) nakli ve uzunlamasına izlenmesi için güvenilir, minimal invaziv bir protokol sunmaktadır. Transplantasyondan önce, hücreler bir biyolüminesan (ateşböceği-lusiferaz) ve floresan (yeşil floresan protein [GFP]) muhabirinden oluşan bir lentiviral vektör ile dönüştürülür. NPC'ler, sensorimotor kortekste stereotaksik enjeksiyonlar kullanılarak sağ kortikal yarımküreye nakledilir. Transplantasyonu takiben, aşılanmış hücreler bozulmamış kafatası yoluyla beş haftaya kadar (0, 3, 14, 21, 35. günlerde) in vivo biyolüminesans görüntüleme kullanılarak 6.000 hücrelik bir çözünürlük sınırı ile tespit edildi. Daha sonra, nakledilen hücreler histolojik beyin kesitlerinde tanımlanır ve ayrıca immünofloresan ile karakterize edilir. Bu nedenle, bu protokol fare beynindeki hücreleri nakletmek, izlemek, ölçmek ve karakterize etmek için değerli bir araç sağlar.
Giriş
Memeli beyni, yaralanma veya hastalıktan sonra sınırlı rejeneratif kapasiteye sahiptir ve doku ve fonksiyonel onarımı teşvik etmek için yenilikçi stratejiler gerektirir. Preklinik stratejiler, nöroproteksiyon, nörogenez, anjiyogenez1,2, kan-beyin-bariyer onarımı3,4 veya hücre tedavisi 5,6 dahil olmak üzere beyin rejenerasyonunun farklı yönlerine odaklanır. Hücre tedavisi, bu onarım öncesi süreçlerin çoğunu aynı anda teşvik edebilme avantajına sahiptir. Hücre nakli ile yapılan deneylerde, doku onarımı (1) doğrudan hücre replasmanı ve (2) anjiyogenez ve nörogeneze yol açan sitokinlerin üretimi yoluyla gerçekleşmiştir7. Kök hücre teknolojisindeki son gelişmeler, şu anda klinik çalışmalar için boru hattında olan ölçeklenebilir, iyi karakterize edilmiş sinir hücresi kaynaklarının geliştirilmesini daha da kolaylaştırmıştır (7,8,9'da gözden geçirilmiştir). Hücre tedavileri birkaç nörolojik hastalık için klinik aşamaya ulaşmış olsa da (örneğin, Parkinson hastalığı10, inme11 ve omurilik yaralanması12), etkinlikleri değişkendir ve greft-konakçı etkileşimlerinin mekanizmalarını anlamak için daha fazla klinik öncesi araştırmaya ihtiyaç vardır.
Birçok preklinik çalışmanın önemli bir sınırlaması, konakçı içindeki nakledilen hücrelerin sürekli izlenmesidir. Genellikle konakçı 6,13'teki dinamik göç ve hayatta kalma süreçleri göz ardı edilerek sadece son nokta ölçümleri yapılır. Bu sınırlamalar, aşılanmış hücrelerin zayıf karakterizasyonuna neden olur ve uzunlamasına değişiklikleri anlamak için yüksek hayvan sayıları gerektirir. Bu sınırlamaların üstesinden gelmek için, bu çalışmada, indüklenmiş pluripotent kök hücre (iPSC) kaynaklı nöral progenitör hücreleri, kırmızı ateşböceği lusiferaz ve gelişmiş yeşil floresan proteininden (rFluc-eGFP) oluşan ticari olarak temin edilebilen çift muhabirli lentiviral vektörle dönüştürüyoruz. Bu hücreler stereotaksik intraparankimal enjeksiyon yoluyla fare beynine nakledilir ve 5 hafta boyunca in vivo biyolüminesans görüntüleme kullanılarak uzunlamasına izlenir. Beyin dokusu toplandıktan sonra, GFP eksprese eden greftlenmiş hücreler tanımlanır ve histolojik beyin bölümlerinde daha da karakterize edilir. Bu yöntem, kemirgen beynindeki in vivo uygulamalar için alternatif dönüştürülebilir hücre kaynaklarına ve nakil yollarına sorunsuz bir şekilde uyarlanabilir. Genel olarak, prosedür fare beyninde greft sağkalımı ve göçü hakkında uzunlamasına bilgi edinmek için değerlidir ve sonraki histolojik karakterizasyonu kolaylaştırır.
Protokol
NOT: Fareleri içeren tüm deneyler devlet, kurumsal ve ARRIVE yönergelerine uygun olarak yürütülmüş ve Zürih Kanton Veterinerlik Ofisi tarafından onaylanmıştır. Erişkin erkek ve dişi obez olmayan diyabetik SCID gama (NSG) fareler (10-14 hafta, 25-35 g) kullanıldı. Fareler, normal Tip II / III kafeslerde, sabit bir 12/12 saat aydınlık / karanlık döngüsüne sahip nem ve sıcaklık kontrollü bir odada kafes başına en az iki hayvandan oluşan gruplar halinde barındırıldı. .).
1. Hücre kültürü ve viral transdüksiyon
- Nöral progenitör hücreleri (NPC'ler) daha önce tarif edildiği gibi küçük molekül inhibitörleri kullanarak iPSC'lerden ayırt edin14.
- Kültür NPC'leri15, Nöral Kök Hücre Bakım Ortamında (NSMM; Tablo 1) poli-ornitin/laminin521 (pLO/L521) ile kaplanmış 6 delikli plakalarda (kuyu başına 2 mL ortam) küçük moleküllerle (Tablo 1) desteklenmiştir. Ortamı günlük olarak değiştirin.
NOT: NPC'leri geçmek için, kuyucuk başına 1 mL hücre ayrışma reaktifi ekleyin ( Malzeme Tablosuna bakınız) ve çoğu hücre ayrılana kadar 1 dakika boyunca 37 ° C'de inkübe edin.- Kaplama için, oda sıcaklığında (RT) 2 saat boyunca kuyucuk başına 1 mL'lik 0,1 M fosfat tamponlu salin (PBS) içinde 150 μL pLO inkübe edin. PBS ile üç yıkamadan sonra, RT'de 2 saat boyunca kuyu başına 1 mL PBS'de 10 μg L521 inkübe edin.
- Viral transdüksiyon için, pLO / L521 ile kaplanmış 24 delikli bir plakada kuyu başına 50.000 hücre plakalayın ve her bir kuyucuğa önceden paketlenmiş viral vektörler (pLL-EF1a-rFLuc-T2A-GFP-mPGK-Puro, LL410PA-1) ekleyin.
NOT: Sağlanan toplam bulaşıcı birimler (IFU) >2 × 106 IFU'dur ve 20 enfeksiyon çokluğunda (MOI) 100.000 hücreyi enfekte etmek için yeterlidir. Hücre sayımı otomatik bir hücre sayacı ile gerçekleştirilmiştir. Transdüksiyon verimliliği büyük ölçüde kullanılan hücre hattına bağlıdır. Lentivirüs ile çalışmak, biyogüvenlik seviye 2 (BSL-2) ürünleri için yerel yönergelere uyulmasını gerektirir. - Günlük orta değişimlere devam ederken hücreleri 72 saat boyunca 37 ° C'de inkübe edin.
- Floresan mikroskobunda hücreleri GFP ekspresyonu açısından kontrol ederek başarılı transdüksiyonu onaylayın. Mikroskop büyütmeyi 10x veya 20x'e ayarlayın ve dönüştürülmüş GFP eksprese eden hücreleri tespit etmek için uygun uyarma (460-480 nm) ve emisyon aralığını (490-520 nm) kullanın.
- Genel transdüksiyon etkinliğini tahmin etmek için GFP-transdüktörünün toplam hücrelere oranını ölçün.
NOT: Bu protokol ile %65-95 iletim hızlarına ulaşılmıştır. Transplantasyondan önce go/no-go kriteri olarak %>50 transdüksiyon etkinliği önerilmektedir. % 50 transdüksiyon etkinliği elde edilemezse, püromisin seçimi yapın veya transdüke hücrelerin verimini artırmak için akış sitometrisini kullanarak hücreleri sıralayın. - İsteğe bağlı: Hücrelerin dondurulması
- Hücreleri aşağı doğru döndürün (300 × g, 5 dakika) ve süpernatanı atın. Peleti 1 mL donma ortamında yeniden askıya alın ( Malzeme Tablosuna bakınız) ve 106 hücre / şişe elde etmek için süspansiyonu şişelere aktarın. Hücreleri -80 °C'de 24 saat boyunca dondurma kutularına ve daha sonra uzun süreli depolama için -150 °C'ye aktarın.
2. Transplantasyon için hücre hazırlığı
- -150 °C depodan bir şişe hücre toplayın ve laboratuvara aktarın. Otomatik bir hücre sayacı kullanarak hücreleri sayın.
NOT: Flakon 1.5-2 × 106 hücre içerir. - Şişeyi, buz kristalleri kalmayana kadar (2-3 dakika) hızlı bir şekilde 37 ° C'lik bir su banyosuna aktarın.
NOT: Hücre zarlarına verilen zararı en aza indirmek için hızlı bir şekilde çözülmesi önemlidir. Şişeyi tamamen su banyosuna batırmayın, çünkü kontaminasyon riskini artırabilir. - Şişeyi biyogüvenlik kabinine aktarın ve tüm içeriği (~ 1 mL) steril 15 mL konik bir tüpe pipetleyin.
NOT: Lentivüral olarak dönüştürülmüş hücrelerle çalışmak BSL-2 gerektirir. Bununla birlikte, yıkama ve pasaj hücreleri viral parçacıkları ortamdan uzaklaştırır. BSL-2'den BSL-1'e transfere ne zaman izin verildiği hakkında yerel makamlardan bilgi alınmalıdır. - 9 mL steril 1x PBS ekleyin ve 300 × g, RT'de 5 dakika boyunca santrifüj yapın.
- Süpernatantı bir pipet (1-10 mL) kullanarak aspirasyonla çıkarın; Süspansiyonu yavaşça pipet ucuna doğru eğin ve aspirasyona başlayın. Pelet'i rahatsız etmemeye dikkat edin.
- Hücreleri 10 mL steril 1x PBS'de yeniden askıya alarak yıkayın.
NOT: Artık hacimdeki hücreleri yeniden askıya almak için tüpü yavaşça sekme tuşuna basın. Hücre süspansiyonunu 1 mL'lik bir pipet kullanarak küme veya agrega içermeyene kadar yavaşça tritüre edin. - Otomatik bir hücre sayacı kullanarak son dönüşten önce hücreleri sayın.
- 300 × g, RT'de 5 dakika santrifüj.
- Süpernatantı çıkarın (adım 2.5) ve hücre peletini gerekli steril PBS hacminde 8 × 104 hücre / μL konsantrasyonuna kadar yeniden askıya alın.
NOT: Bu protokolde 105 hücre/2 μL PBS'den 1,6 × bir hacim kullanılmıştır.
3. Transplantasyon prosedürü
- Ameliyat için hazırlık
- Ameliyat ekipmanını temizleyin ve sterilize edin.
- Stereotaksik cihazı ve mikroenjeksiyon pompa sistemini hazırlayın.
NOT: Başlamadan önce Hamilton şırıngasını ve 30 G, 2 inç iğneyi test etmek çok önemlidir. İğneyi steril% 0.9 NaCl içeren bir tüpe yerleştirin ve çözeltiyi yavaşça içeri ve dışarı çekin. - Anestezi makinesini kurun. Herhangi bir hayvanı dahil etmeden önce makineyi test edin. İndüksiyon odasını% 70 etanol ile temizleyin.
- Hayvanların hazırlanması
- Fareleri, onları alıştırmak için deneylerden önce standart koşullarda en az 7 gün boyunca saklayın.
NOT: Bu protokol için aşağıdaki hayvanlar kullanılmıştır: dişi NOD / SCID / IL2rγnull (NSG olarak da bilinen 30-35 g) ve dişi C57BL / 6J (20-25 g, B6 olarak da bilinir). Prosedür erkek farelerle de yapılabilir. - Fare vücut ağırlığını ölçün ve enjekte edilecek ağrı kesicinin dozunu ayarlayın. Ağrıyı azaltmak ve / veya enflamatuar bir yanıtı önlemek için karprofen (5 mg / kg vücut ağırlığı) intraperitoneal olarak uygulayın.
- Oksijende buharlaştırılan izofluran (indüksiyon fazında %3 ve ameliyat sırasında bakım fazında %1.5-2) kullanarak hayvanları uyuşturun.
NOT: Gazlı anestezi, cerrahi işlemden sonra hızlı uyanma ve anestezik gaz seviyelerinin kolayca ayarlanabilmesi nedeniyle tercih edilir. - Hayvanın derinlemesine uyuşturulduğundan emin olmak için nosiseptif refleksler kullanın (örneğin, ayak parmağı sıkışmaları). Derin anesteziye ulaşıldığında, hayvanı indüksiyon odasından stereotaksik çerçeveye taşıyın. Bir yüz maskesi kullanarak anesteziyi sürdürün.
NOT: Nefes hızının prosedür boyunca görsel olarak izlenmesi gerekir (dakikada 40-60 nefes). İşlem sırasında hipotermiyi önlemek için bir ısıtma yastığı kullanın. - Gözlerin kurumasını önlemek için oftalmik yağlayıcı uygulayın.
- Fare kafa derisini elektrikli tıraş bıçağı ile tıraş edin ve pamuklu çubuklar kullanarak cildi% 5 betadin çözeltisi ile dezenfekte edin.
- Fare kafasını sabitleyin ve kulak çubuklarını dış meatusa yerleştirin.
NOT: Kulak zarlarına zarar vermemeye dikkat edin. Kulak çubuklarını yerleştirmeden önce her iki kulak kanalına da lidokain merhem uygulayın. Hayvanın başının sabit bir konumda olup olmadığını kontrol etmek için, hareket olup olmadığını görmek için kafayı dikkatlice aşağı doğru itin. Hareket not edilirse, kulak çubuğu, burun parçası yerleşimi veya her ikisi de yanlıştır ve yeniden ayarlanması gerekir.
- Fareleri, onları alıştırmak için deneylerden önce standart koşullarda en az 7 gün boyunca saklayın.
- Kraniotomi
- Orta hat boyunca lambda ve bregma simgelerini ortaya çıkaracak kadar büyük bir kesim yapmak için cerrahi bir bıçak kullanın.
NOT: Kafatasını açıkta tutmak için cilt retraktörleri uygulanabilir. - Periosteum ve fasyayı bir neşterle geri çekin ve kafatası yüzeyini kurutmak için steril pamuklu çubuklar kullanın.
- Kafa pozisyonunu standartlaştırmak için kulak ve ağız çubuklarını ayarlayın.
NOT: Bregma ve lambda için dikey koordinatların anteroposterior konumlandırma için aynı olması gerekir. - İğneyi bregmaya yerleştirin ve istenen enjeksiyon noktalarının koordinatlarını hesaplayın (bu protokol için seçilen ilgili koordinatlar: ön-arka (AP): + 0,5 mm, medial-lateral (ML): + 1,5 mm). İğneyi o noktaya taşıyın ve mürekkeple işaretleyin.
NOT: Koordinatlar Franklin ve Paxinos Fare Beyin Atlası 16'ya göre seçilmiştir. Mesafeler bregma'dan mm'dir. - Kafatasına steril% 0.9 NaCl uygulayın ve cerrahi, diş matkabı ile kafatasından 2-3 mm çapında bir delik açın.
- İğneyi dura yüzeyine taşıyın ve derinlik koordinatlarını hesaplayın.
- Orta hat boyunca lambda ve bregma simgelerini ortaya çıkaracak kadar büyük bir kesim yapmak için cerrahi bir bıçak kullanın.
- Transplantasyon prosedürü
- Tüpteki hücreleri yeniden askıya alın (adım 2.9) ve 2 μL hücre süspansiyonunu bir şırıngaya (5 μL veya 10 μL) çekin.
NOT: Hücre süspansiyonunda hava kabarcığı bulunmadığından emin olun. Şırınga, hücre çökelmesini önlemek için stereotaktik cihaza monte edilene kadar yatay konumda tutulmalıdır. - Şırıngayı hedef bölgenin üzerine yerleştirin (hesaplanan koordinatlar: AP: + 0,5 mm, ML: + 1,5 mm) ve iğneyi yavaşça dura yüzeyine hareket ettirin.
NOT: Doğru koordinatlardan emin değilseniz, hücreleri nakletmeden önce bir boya ile enjeksiyon yapın ve enjeksiyon bölgesinin histolojik değerlendirmesini yapın (daha fazla ayrıntı için bkz. 17). - İğneyi 0.02 mm / s hızında beyne uygun derinliğe kadar yönlendirin (bu protokol için seçilen koordinat dorsal-ventral (DV) - 0.8 mm'dir). Derinliği 0,1 mm aşın ve enjekte edilen hücreler için bir cep oluşturmak için iğneyi aynı mesafeden çekin.
- Hücrelerin sızmasını önlemek için forseps kullanarak iğnenin etrafına doku yapıştırıcısı uygulayın.
- Hazırlanan hücre süspansiyonunun 2 μL'sini 3-5 nL / s sabit bir oranda enjekte edin.
NOT: Enjeksiyon prosedürü 7 ila 12 dakika arasında sürecektir. - Enjeksiyonu takiben, yavaşça geri çekmeden önce iğneyi en az 5 dakika yerinde bırakın. Kafatasındaki deliği kapatmak için doku yapıştırıcısı uygulayın ve 2 dakika daha bekleyin.
- Tüpteki hücreleri yeniden askıya alın (adım 2.9) ve 2 μL hücre süspansiyonunu bir şırıngaya (5 μL veya 10 μL) çekin.
- Dikişler ve bakım sonrası
- Dehidrasyondan kaçınmak için maruz kalan kafatasına steril% 0.9 NaCl çözeltisi uygulayın.
- Yarayı 5/0 ipek dikiş ipliği ile kapatın.
- Hayvanı, alt sırta deri altından enjekte edilen 0.5 mL zil laktat çözeltisi ile nemlendirin.
- Anestezi dağıtımını kesin ve fareyi stereotaksik aparattan dikkatlice çıkarın ve bir ısıtma yastığı üzerinde tutulan bir kafese geri yerleştirin.
- Yaralanma sonrası akut faz sırasında hayvanları izleyin. Dikişi, hayvan ağırlığını ve genel sağlığı günde en az iki kez kontrol edin.
4. İn vivo görüntüleme
- Lusiferin hazırlanması
- RT'de D-lusiferin potasyum tuzunu çözün ve PBS'de 30 mg / mL'de taze bir D-lusiferin stok çözeltisi hazırlayın.
- Stok çözeltisini 0,22 μm şırınga filtresinden sterilize edin.
NOT: Çalışma çözümünün hemen kullanılması önerilir. Gerekirse, çözünmüş lusiferin -20 ° C'de saklanabilir. Bununla birlikte, uzun süreli depolama, sinyalin bozulmasına neden olabilir. Luciferin ışığa duyarlı bir reaktiftir; mümkün olduğunca doğrudan ışıktan uzak tutun. Çözünürlük sınırı18'i iyileştirmek için alternatif substratlar, örneğin siklükler de düşünülebilir.
- Görüntüleme
- İlk kurulum
NOT: Biyolüminesans görüntüleme, karanlık bir oda ve soğutulmuş bir şarj bağlantılı cihaz (CCD) kameradan oluşan bir in vivo görüntüleme sistemi ( Malzeme Tablosuna bakınız) kullanılarak gerçekleştirilmiştir.- Living Image yazılım simgesini çift tıklatın ve açılır listeden bir kullanıcı kimliği seçin.
- Görüntülenen kontrol panelinde Başlat'ı tıklatın. Başlatma işlemi tamamlandığında, kontrol panelindeki sıcaklık kutusu yeşile dönecektir.
- Kontrol panelinde, Işıksaçan ve Fotoğraf kutularını işaretleyin ve Otomatik pozlama (~60 sn) seçeneğini belirleyin. Bir görüş alanı seçin (bu protokol için D/12,5 cm seçilmiştir). Konu yüksekliğini (1,5 cm) girin ve konu yüksekliği odağını kullan seçeneğini belirleyin. Aşağıdaki parametreleri manuel olarak ayarlayın: büyük bölme, f/2, bloke edilmiş uyarma filtresi ve açık emisyon filtresi.
- 300 mg / kg vücut ağırlığında D-lusiferin enjeksiyon miktarını belirleyin. NOT: Önerilen standart doz 150 mg / kg D-luciferin'dir. Bu prosedür, 300 mg / kg18 kullanılarak daha yüksek duyarlılık bildiren bir protokole göre ayarlandı.
- Lusiferini intraperitoneal olarak enjekte edin (i.p.).
NOT: Hayvanın enjeksiyondan önce sakinleştirilmesi gerekiyorsa, pik lusiferaz ekspresyon süresini uzatabileceğini unutmayın. - 5 dakika bekleyin, ardından hayvanları sürekli izofluran kaynağı ile uyuşturun (görüntüleme prosedürü sırasında indüksiyon fazında% 4.5 ve bakım aşamasında% 1.5-2).
- Gözlere oftalmik kayganlaştırıcı uygulayın, ardından geleneksel bir saç tıraş makinesi kullanarak baş bölgesindeki yatıştırılmış hayvanları tıraş edin. Hayvanları görüntüleme odasına yerleştirin ve lusiferin enjeksiyonundan 15 dakika sonra kontrol panelinde Edin'e tıklayarak görüntülemeye başlayın.
- İlk kurulum
5. Perfüzyon
- Hayvanları i.p. sodyum pentobarbital enjeksiyonu (150 mg / kg vücut ağırlığı) ile anestezi yapın. Fare, ayak parmağı sıkışmaları gibi ağrılı uyaranlara artık yanıt vermeyene kadar bekleyin.
- Fareyi sırt üstü koyun ve göğüs boşluğunu açmak için cımbız ve makas kullanın.
- Diyaframı açmak için standart makas kullanın.
- Kalbi açığa çıkarın ve sol ventrikülün tepesine bir iğne (zil / % 4 paraformaldehit çözeltisi (PFA) içeren borudan) yerleştirin.
NOT: İğnenin ucunu ventrikülün lümeninde tutmaya dikkat edin. - Makas kullanarak sağ ventrikülü kesin.
- Zil çözeltisi ile perfüze (RT'de tutulabilir) 3-4 dakika (akış hızı: 17 mL/dak). Kalp temizlenene kadar devam edin.
- PFA akışına izin vermek için durdurmayı değiştirin (4 ° C'de saklayın; prosedür sırasında buz üzerinde tutun) ve 5 dakika daha (~ 100 mL) perfüze edin.
- Pompayı durdurun ve iğneyi sol ventrikülden çıkarın.
NOT: PFA ile perfüzyon doku bütünlüğünü eşit şekilde korur. Ayrıca, aksi takdirde difüzyon nedeniyle kaybedilebilecek nakillerde GFP sinyalinin korunmasını kolaylaştırır.
6. İşleme
- Doku toplama
- Standart makas kullanarak kafayı çıkarın ve ciltte orta hat kesisi yapın.
- Kafatasını ortaya çıkarmak için cildi gözlerin üzerine çevirin.
- Parietal kemiğin noktasındaki kaudal kısımdan başlayın ve yay makası kullanarak küçük bir kesi yapın. Makası midsagital sütür boyunca rostral olarak gözler arasındaki bir noktaya kadar ilerletin. Kaudal kısımdan tekrar başlayın ve sagital düzlemde paralel ve ~ 4 mm aralıklarla iki kesim yapın.
NOT: Makası kafatasının iç yüzeyine bastırarak beyne zarar vermemeye dikkat edin. - Parietal kemiğin bir tarafını dikkatlice eğmek ve kırmak için forseps kullanın. Aynı şeyi diğer tarafla da yapın.
NOT: Kemiği meninkslerden kurtarmak için bir mikrospatula kullanın; aksi takdirde, kafatasını kırarken beyne zarar verebilirler. Ön kemiğin parçaları kalırsa, kemik plakasını eğmek ve kırmak için küçük bir kesim yapın. - Beyni serbest bırakmak için, mikrospatulayı beynin altına dikkatlice kaydırın (koku alma ampulleri) ve yavaşça yukarı doğru eğin.
- Topladıktan sonra, beyni 4 ° C'de 4-6 saat boyunca% 4 PFA çözeltisinde tutun. Daha sonra steril 1x PBS'ye aktarın.
- İmmünohistokimya
- Donma sırasında kristal oluşumunu önlemek için beyni 4 ° C'de en az 48 saat boyunca% 30'luk bir sakkaroz çözeltisine aktarın.
- 40 μm kalınlığındaki koronal bölümleri kesmek için sürgülü bir mikrotom kullanın. Bölümleri serbest yüzen bölümler olarak (24 kuyucuklu bir plakada) toplayın ve bir sonraki işleme kadar -20 ° C'de bir kriyoprotektan çözeltisinde (Tablo 1) saklayın.
- Bölümleri her bir kuyucuk için 450 μL 1x PBS ile durulayın (3 kez, her biri 5 dakika, RT).
- RT'de 1 saat boyunca her bir kuyucuk için 450 μL blokaj çözeltisi (Tablo 1) ile spesifik olmayan alanları bloke edin.
- Her bir kuyucuğu gece boyunca 4 ° C'de 450 μL birincil antikorlarla inkübe edin. Antikorları% 3 eşek serumunda 1:200 seyreltin; PBS'de% 0.1 Triton-X-100. Konakçı ortamdaki donör materyali tanımlamak için, insana özgü çekirdeklere karşı bir antikor kullanın (Anti-İnsan Çekirdeği Antikoru, klon 235-1).
- Bölümleri her bir kuyucuk için 450 μL 1x PBS ile yıkayın (3 kez, her biri 5 dakika, RT).
- Her bir kuyuyu, 2-3 saat (RT) için 450 μL karşılık gelen floresan ikincil antikorlarla inkübe edin. Antikorları% 3 eşek serumunda seyreltin; 1x PBS'de %0,1 Triton-X-100.
- Bölümleri her bir kuyucuk için 450 μL 1x PBS ile yıkayın (3 kez, her biri 5 dakika, RT).
- Çekirdekleri 450 μL 0.1 μg / mL 4',6-diamidino-2-fenilindol (DAPI) ile sabitleyin.
Sonuçlar
İn vivo biyolüminesans görüntüleme kullanarak fare beynindeki nakledilen nöral progenitör hücreleri uzunlamasına izlemeyi ve sonraki histolojik analizlerde nakledilen hücreleri tanımlamayı amaçlıyoruz (Şekil 1A). Bu nedenle, nöral progenitör hücreler EF1α-rFluc-eGFP'den oluşan bir lentiviral vektör ile dönüştürülür. Transplantasyondan önce, hücreler in vitro eGFP ekspresyonu ile başarılı transdüksiyon için test edildi (Şekil 1B). Başarılı bir şekilde dönüştürülen hücreler, fare beyninde istenen koordinatlarda (örneğin, sensorimotor kortekste) stereotaktik olarak nakledildi. Transplantasyonu takiben, farelere sistemik olarak rFluc substratı olan D-luciferin enjekte edildi ve başarılı transplantasyonu doğrulamak için nakledilen hücrelerin sinyal yoğunlukları ölçüldü (Şekil 1C).
İn vivo biyolüminesans görüntülemenin tespit sınırını değerlendirmek için, farenin sağ sensorimotor korteksine 6.000-180.000 hücre aralığı nakledildi (Şekil 2A). Transplantasyondan hemen sonra <6.000 hücre ve nakledilen hücre sayısıyla orantılı bir biyolüminesans sinyali tespit ettik (Şekil 2B). İnsan hücre kaynakları immünkompetan farelere immünojenik olduğundan, hücre greftlerinin uzun süreli sağkalımını gözlemlemek için NOD scid gama (NSG) immün yetmezlikli fareler kullanılmıştır. Hücre naklinden sonra uzun süreli sağkalım ve 5 haftaya kadar biyolüminesans sinyalinin saptanması doğrulanmıştır (Şekil 2C,D). Nakledilen hücreler, eGFP muhabiri aracılığıyla yapılan sonraki histolojik analizlerde ve anti-insan çekirdekleri ve anti-insan mitokondriyal antikorları ile immün boyama ile ex vivo olarak başarıyla tespit edildi (Şekil 2E).
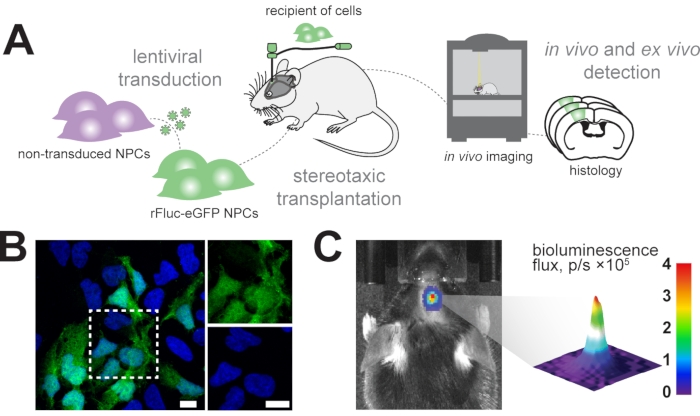
Şekil 1: Nöral progenitör hücrelerin transplantasyonu . (A) rFluc-eGFP NPC'lerin üretimi ve transplantasyonuna şematik genel bakış. (B) DAPI (mavi) ile karşı boyanmış transdüktif NPC'lerin (GFP reporter, yeşil) temsili immünofloresan görüntüsü; ölçek çubukları = 5 μm. (C) Nakledilen hücrelerde biyolüminesans sinyalinin in vivo tespiti; renk çubuğu = mavi (0, dk, sinyal yok), kırmızı (4 akı, p / s × 105, maksimum sinyal) Kısaltmalar: NPC'ler = nöral progenitör hücreler; GFP = yeşil floresan protein; rFluc-eGFP = kırmızı ateşböceği lusiferaz ve gelişmiş yeşil floresan proteini; DAPI = 4',6-diamidino-2-fenilindol; p/s = foton/s. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
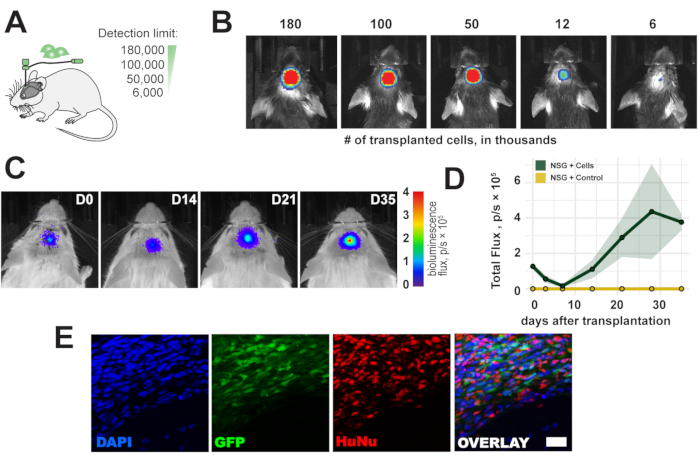
Şekil 2: Nakledilen hücrelerin zaman seyri. (A) Transplantasyon için hücre numaralarının şematik görünümü. (B) Transplantasyondan 1 saat sonra nakledilen hücrelerin tespit sınırı. (C, D) NSG farelerde 35 güne kadar transplantasyon süresi (180.000 hücre); renk çubuğu = mavi (0, dk, sinyal yok), kırmızı (4 akı, p/s × 105, maksimum sinyal) Veriler ortalama ± SEM'dir (n = 3). (E) Transplantasyondan 5 hafta sonra histolojik kesitlerin ve nakledilen hücrelerin temsili floresan görüntüleri. Ölçek çubuğu = 10 μm. Kısaltmalar: D = transplantasyondan sonraki gün; NSG = immün yetmezlikli NOD scid gama; DAPI = 4',6-diamidino-2-fenilindol; GFP = yeşil floresan protein; HuNu = Anti-İnsan Çekirdeği Antikoru, klon 235-1; p/s = foton/s. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tartışmalar
İşlevsel iyileşmeye izin vermek için yaralı beynin yenilenmesi karşılanmamış bir zorluk olmaya devam etmektedir. Birçok yenilikçi preklinik yaklaşım, örneğin immün modülasyon19,20, anjiyogenez 1,21,22,23, kan-beyin-bariyer bütünlüğü 2,3,24,25 ve hücre replasmanı 5,26 gibi hedeflemeyi geliştirmiştir. . Özellikle son yıllarda kök hücre teknolojisindeki büyük gelişmeler ve etkin farklılaşma protokolleri nedeniyle hücre bazlı tedaviler beyin için umut verici bir tedavi stratejisi olarak ortaya çıkmıştır15,28. Bu makale, fare beynindeki sinir hücrelerinin nakli ve izlenmesi için değerli bir protokol sunmaktadır. Yöntem, fare beynindeki in vivo uygulamalar için tüm dönüştürülebilir hücre hatları için geçerlidir.
Sunulan kurulum, bir farede insan kökenli nakiller kullanır. Bu nakiller, immünojenite nedeniyle immünkompetan vahşi tip farelerde uzun vadede uygulanabilir değildir. Bu nedenle, bu sınırlamanın üstesinden gelmek için immün yetmezlikli NSG fareleri kullanılmıştır. Alternatif olarak, immünojenik yönlerin üstesinden gelmek için fare nakillerinin kullanılması tercih edilebilir. İnsan hücrelerinin nakli gerekiyorsa, insanlaştırılmış fare modelleri, greft reddi olasılığını azaltmak için ortaya çıkan bir alternatifi temsil eder29.
EF1α promotor altında ateşböceği lusiferaz ve eGFP'den oluşan ticari bir çift muhabirli viral vektör, nakli görselleştirmek için kullanıldı. Bu promotor, yüksek sinyal yoğunluğu15 elde etmek için seçildi. Bununla birlikte, NPC'lerin yanı sıra, diğer hücre tiplerinin, perisitler30 ve astrositler31 dahil olmak üzere yaralanmadan sonra beyin fonksiyonunu desteklediği gösterilmiştir; Bu nedenle, kullanılan hücre hattına bağlı olarak, diğer promotorlar yüksek ekspresyon seviyelerine ulaşmak için daha uygun olabilir. Ek olarak, CMV gibi transgen promotörlerinin kullanımı, özellikle uzun süreli deneylerde aşağı regülasyona yol açabilir32. Lentiviral vektörün transdüksiyon verimliliği, kullanılan hücre hattına büyük ölçüde bağlıdır ve tek deneyler arasında değişebilir. Bu nedenle, in vivo deneylere başlamadan önce transdüksiyon verimliliği değerlendirilmeli ve deneyler arasındaki transdüksiyon etkinliğindeki varyasyonları düzeltmelidir. Transplantasyonun beyin bölgesi de sinyal gücünü etkiler. Kortikal transplantasyonlar için 6.000 < hücrelik bir tespit sınırına ulaşılmış olsa da, daha derin beyin bölgelerinde, örneğin striatum veya hipokampusta bir sinyal tespit etmek için daha fazla hücre gerekebilir.
Fare beynindeki transplantasyon hacimleri 1-2 μL ile sınırlıdır. Bu nedenle, deneyler için uygun bir hücre numarası belirlemek önemlidir. Daha önce, artan hücre sayılarının, büyük olasılıkla transplantasyon bölgesinde besin ve oksijenin sınırlı mevcudiyeti nedeniyle hayatta kalma oranının azalmasına yol açtığı gözlenmiştir33. İn vivo biyolüminesans görüntüleme, MRG veya BT gibi diğer in vivo görüntüleme yöntemlerine kıyasla nispeten düşük bir uzamsal çözünürlük sağlar. Bu nedenle, aşılanmış hücrelerin kısa göç yolları, sonraki post-hoc analizde yalnızca güvenilir bir şekilde değerlendirilebilir.
Biyolüminesansın mutlak sinyal gücü genellikle nakledilen hücre sayısı ile orantılıdır. Bununla birlikte, greftler daha derin beyin yapılarına nakledilirse veya sinyal gücü in vivo görüntüleme sisteminin doğrusal algılama spektrumunun dışındaysa sinyal gücü azaltılabilir. Şu anda, kan-beyin bariyeri boyunca siklüzyon1 de dahil olmak üzere D-lusiferinden daha verimli penetrasyon sağlamak için yeni substratlar geliştirilmiştir. Bu substratlar, gelecekte aşılanmış hücrelerin tespit sınırını daha da artırabilir18. Genel olarak, bu protokol fare beynindeki greftleri nakletmek ve gözlemlemek için basit, minimal invaziv bir prosedüre izin verir.
Açıklamalar
Yazarların beyan etmek için potansiyel bir çıkar çatışması yoktur.
Teşekkürler
Yazarlar RR ve CT, Mäxi Vakfı ve 3R Yetkinlik Merkezi'nin desteğini kabul ediyor.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Viral Transduction | |||
| pLL-EF1a-rFLuc-T2A-GFP-mPGK-Puro (Lenti-Labeler virus) | Systembio | LL410VA-1 | |
| Consumables | |||
| Eppendorf microtubes; 1.5 mL | Sigma Aldrich | Z606340 | |
| Falcon Tubes; 15 mL | TPP | 91015 | |
| Microscope cover slips | Product of choice | ||
| Microscope slides | Product of choice | ||
| Sterlie cotton swabs | Product of choice | ||
| Sutures; 5/0 silk with curved needle | B. Braun | G0762482 | |
| Syringe filter; 0.22 µm | TPP | 99722 | |
| Syringe; 1 mL and 0.5 mL | B. Braun | 9166017V | |
| Tissue culture plate (24-well) | TPP | 92024 | |
| Equipment | |||
| Automated cell counter (Vi-CELL XR) | Beckmann Coulter Life Science | 383721 | |
| Forceps | Fine Science Tools | 11064-07 | |
| Forceps, fine | Fine Science Tools | 11412-11 | |
| Heating pad | Product of choice | ||
| High Speed Brushless Micromotor Kit | Foredom | K.1060-22. | |
| Ideal Micro Drill Burr Set Of 5 | Cell Point Specific | 60-1000 | |
| In-Vivo imaging system (IVIS Lumina III with Living Imaging 4.2 software package) | Perkin Elmer | CLS136334 | |
| Isoflurane vaporizer | Provet AG | 330724 | |
| Microinjection Syringe Pump system | World Precision Instruments | UMP3T-1 | |
| Microliter syringe; 700-Series; Volume: 5-10 µL | Hamilton | 7635-01 | |
| Microtome | Leica | HM430 | |
| NanoFill-33 G-Needle (removable and reusable) | World Precision Instruments | NF33BV-2 | |
| Needle Holder | Fine Science Tools | 12001-13 | |
| Perfusion pump and tubing | Masterflex | HV-77120-42 | |
| Scalpel | Fine Science Tools | 10003-12 | |
| Small bonn scissors, straight | Fine Science Tools | 14184-09 | |
| Small spring scissors, straight | Fine Science Tools | 15000-03 | |
| Spatula | Merck | Z243213-2EA | |
| Stereotaxic frame for rodents; motorized | World Precision Instruments | 99401 | |
| Pharmaceuticals and Reagents | |||
| Accutase | Invitrogen | A11105-01 | Proteolytic and collagenolytic; cell dissociation reagent |
| Anti-Human Nuclei Antibody, clone 235-1, Biotin Conjugate | Merck | MAB1281B | |
| B27 – Supplement (50x) | Gibco | 17504-001 | |
| Betadine (11 mg Iod als Povidon-Iod pro 1 ml Lösung) | Mundipharma Medical Company | All pharmaceuticals were provided by the cantonal pharmacy, Zurich, Switzerland | |
| Blocking solution (3% donkey serum; 0.1% Triton-X-100 in PBS) | Product of choice; can be homemade | ||
| CHIR99021 (10 mM – 2,500x) | StemMACS | 130-103-926 | |
| Cryoprotectant solution | Product of choice; can be homemade | ||
| DAPI solution (1 mg/mL) | Thermo Fisher Scientific | 62248 | |
| D-Luciferin Potassium Salt | Perkin Elmer | 122799 | |
| DMEM/F12 | Gibco | 11320-074 | |
| Donkey anti-Mouse IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 555 | Invitrogen | A-31570 | |
| Donkey serum | Product of choice | ||
| Esconarcon (Pentobarbitalum natricum 300 mg) | Streuli Pharma AG | All pharmaceuticals were provided by the cantonal pharmacy, Zurich, Switzerland | |
| Ethanol; 70% | Product of choice | ||
| FGF Basic recombinant human protein, Animal-origin free | Thermo Fisher Scientific | PHG6015 | |
| Glutamax (100x) | Gibco | A12860-01 | |
| hLif (10 µg/mL – 1,000x) | PeproTech | AF-300-05-25UG | |
| Isoflurane (Isofluran (1-Chlor-2,2,2-trifluorethyl-difluoromethylether) 99.9%) | Provet AG | All pharmaceuticals were provided by the cantonal pharmacy, Zurich, Switzerland | |
| Laminin-L521 (L-521) | Biolaminin LN | LN521 | |
| Lidocaine ointment (Lidocain: 25 mg , Prilocain: 25 mg) | Aspen Pharma Schweiz GmbH | All pharmaceuticals were provided by the cantonal pharmacy, Zurich, Switzerland | |
| Mounting Medium | Product of choice; can be homemade | ||
| N2- Supplement (100x) | Gibco | 75202-001 | |
| Neurobasal | Gibco | 21103-049 | |
| Ophtalmic lubricant (Retinol palmitat: 15,000 UI) | Bausch & Lomb Swiss AG | All pharmaceuticals were provided by the cantonal pharmacy, Zurich, Switzerland | |
| Paraformaldehyde solution | Product of choice | ||
| PBS | Thermo Fisher Scientific | 10010023 | Can also be homemade |
| Poly-L-ornithine Solution (pLO) | Sigma-Aldrich | P4957 | |
| Rimadyl (Carprofen 50 mg) | Zoetis Schweiz GmbH | All pharmaceuticals were provided by the cantonal pharmacy, Zurich, Switzerland | |
| Ringer lactate | B. Braun | 3570500 | |
| Ringer solution | B. Braun | 3570030 | |
| Saline (0.9% NaCl) | B. Braun | 3570160 | |
| SB431542 (10 mM – 3,333.3x) | StemMACS | 130-106-543 | |
| Tissue Adhesive (Histoacryl) | B. Braun | 1050060 |
Referanslar
- Rust, R., et al. Nogo-A targeted therapy promotes vascular repair and functional recovery following stroke. Proceedings of the National Academy of Sciences of the United States of America. 116 (28), 14270-14279 (2019).
- Rust, R., et al. Anti-Nogo-A antibodies prevent vascular leakage and act as pro-angiogenic factors following stroke. Scientific Reports. 9 (1), 20040 (2019).
- Weber, R. Z., et al. Characterization of the blood brain barrier disruption in the photothrombotic stroke model. Frontiers in Physiology. 11, 58226 (2020).
- Sweeney, M. D., Sagare, A. P., Zlokovic, B. V. Blood-brain barrier breakdown in Alzheimer's disease and other neurodegenerative disorders. Nature Reviews. Neurology. 14 (3), 133-150 (2018).
- Wang, Y., et al. 3K3A-APC stimulates post-ischemic neuronal repair by human neural stem cells in mice. Nature Medicine. 22 (9), 1050-1055 (2016).
- Llorente, I. L., et al. Patient-derived glial enriched progenitors repair functional deficits due to white matter stroke and vascular dementia in rodents. Science Translational Medicine. 13 (590), (2021).
- Kokaia, Z., Llorente, I. L., Carmichael, S. T. Customized brain cells for stroke patients using pluripotent stem cells. Stroke. 49 (5), 1091-1098 (2018).
- Parmar, M., Grealish, S., Henchcliffe, C. The future of stem cell therapies for Parkinson disease. Nature Reviews Neuroscience. 21 (2), 103-115 (2020).
- Galgano, M., et al. Traumatic brain injury: current treatment strategies and future endeavors. Cell Transplantation. 26 (7), 1118-1130 (2017).
- Schweitzer, J. S., et al. Personalized iPSC-derived dopamine progenitor cells for Parkinson's disease. The New England Journal of Medicine. 382 (20), 1926-1932 (2020).
- Muir, K. W., et al. Intracerebral implantation of human neural stem cells and motor recovery after stroke: multicentre prospective single-arm study (PISCES-2). Journal of Neurology, Neurosurgery & Psychiatry. 91 (4), 396-401 (2020).
- Kawabori, M., et al. Cell therapy for chronic TBI: interim analysis of the randomized controlled STEMTRA trial. Neurology. 96 (8), 1202-1214 (2021).
- George, P. M., et al. Engineered stem cell mimics to enhance stroke recovery. Biomaterials. 178, 63-72 (2018).
- Sancho-Martinez, I., et al. Establishment of human iPSC-based models for the study and targeting of glioma initiating cells. Nature Communications. 7 (1), 1-14 (2016).
- Rust, R., et al. Xeno-free induced pluripotent stem cell-derived neural progenitor cells for in vivo applications. bioRxiv. , (2022).
- Franklin, K., Paxinos, G. . Paxinos and Franklin's the Mouse brain in stereotaxic coordinates, compact: The coronal plates and diagrams. , (2019).
- Baker, S., Götz, J. A local insult of okadaic acid in wild-type mice induces tau phosphorylation and protein aggregation in anatomically distinct brain regions. Acta Neuropathologica Communications. 4, 32 (2016).
- Cao, J., et al. In vivo optical imaging of myelination events in a myelin basic protein promoter-driven luciferase transgenic mouse model. ASN Neuro. 10, (2018).
- Aswendt, M., Adamczak, J., Couillard-Despres, S., Hoehn, M. Boosting bioluminescence neuroimaging: an optimized protocol for brain studies. PLoS One. 8 (2), 55662 (2013).
- Roth, S., et al. Brain-released alarmins and stress response synergize in accelerating atherosclerosis progression after stroke. Science Translational Medicine. 10 (432), (2018).
- Rust, R., Hofer, A. -. S., Schwab, M. E. Stroke promotes systemic endothelial inflammation and atherosclerosis. Trends in Molecular Medicine. 24 (7), 593-595 (2018).
- Rust, R., Gantner, C., Schwab, M. E. Pro- and antiangiogenic therapies: current status and clinical implications. FASEB Journal. 33 (1), 34-48 (2018).
- Rust, R., Grönnert, L., Weber, R. Z., Mulders, G., Schwab, M. E. Refueling the ischemic CNS: guidance molecules for vascular repair. Trends in Neurosciences. 42 (9), 644-656 (2019).
- Nih, L. R., Gojgini, S., Carmichael, S. T., Segura, T. Dual-function injectable angiogenic biomaterial for the repair of brain tissue following stroke. Nature Materials. 17 (7), 642 (2018).
- Montagne, A., et al. Pericyte degeneration causes white matter dysfunction in the mouse central nervous system. Nature Medicine. 24 (3), 326-337 (2018).
- Montagne, A., et al. APOE4 leads to blood-brain barrier dysfunction predicting cognitive decline. Nature. 581 (7806), 71-76 (2020).
- George, P. M., Steinberg, G. K. Novel stroke therapeutics: unraveling stroke pathophysiology and its impact on clinical treatments. Neuron. 87 (2), 297-309 (2015).
- Weber, R. Z., et al. Deep learning based behavioral profiling of rodent stroke recovery. bioRxiv. , (2021).
- Nair, R. R., et al. Uses for humanised mouse models in precision medicine for neurodegenerative disease. Mammalian Genome. 30 (7), 173-191 (2019).
- Kirabali, T., Rust, R. iPS-derived pericytes for neurovascular regeneration. European Journal of Clinical Investigation. 51 (9), 13601 (2021).
- Weber, R. Z., Perron, P., Rust, R. Astrocytes for brain repair: More than just a neuron's sidekick. Brain Pathology. 31 (5), 12999 (2021).
- Johansen, J., et al. Evaluation of Tet-on system to avoid transgene down-regulation in ex vivo gene transfer to the CNS. Gene Therapy. 9 (19), 1291-1301 (2002).
- Vogel, S., et al. Initial graft size and not the innate immune response limit survival of engrafted neural stem cells. Journal of Tissue Engineering and Regenerative Medicine. 12 (3), 784-793 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır